Геоэкология. Инженерная геология, гидрогеология, геокриология, 2021, № 6, стр. 55-67
ХИМИЧЕСКИЙ СОСТАВ И ФОРМЫ НАХОЖДЕНИЯ МЕТАЛЛОВ В ВОДАХ РАЙОНА ШАХТЫ “ЛЮПИККО-I” (ПИТКЯРАНТСКИЙ РУДНЫЙ РАЙОН, КАРЕЛИЯ)
А. А. Конышев 1, *, Е. С. Сидкина 1, **, Е. А. Солдатова 1, Е. В. Черкасова 1, И. А. Бугаев 1, А. С. Торопов 2, Д. Н. Догадкин 1, И. Н. Громяк 1, И. Ю. Николаева 2
1 Институт геохимии и аналитической химии имени В.И. Вернадского РАН
119991 Москва, ул. Косыгина, д. 19, Россия
2 Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, д. 1, Россия
* E-mail: icelopa@gmail.com
** E-mail: sidkinaes@yandex.ru
Поступила в редакцию 16.06.2021
После доработки 16.07.2021
Принята к публикации 26.08.2021
Аннотация
Цель исследования природных вод района рудного поля Люпикко – изучение поведения химических элементов, в частности рудной специализации, форм их нахождения и осаждения. Предпринята попытка проследить влияние горных выработок на состояние природных водных объектов, поскольку локальный сток играет важную роль в формировании речного стока. Для этого были отобраны пробы воды из шахты “Люпикко-I” с разных глубин, закопушки в пределах шахтных отвалов, подотвального пруда и р. Ристиоя, а также две пробы отложений из закопушки и подотвального пруда. Результаты показывают повышенные содержания Fe, Zn, Ni, Co, Sr, Cd, U в водах района шахты “Люпикко-I” относительно значений геохимического фона. Пик концентраций этих металлов приходится на пробы воды, отобранные из закопушки, в то время как наиболее высокие их содержания определены в донных отложениях подотвального пруда. В речных водах концентрация металлов значительно ниже. Исследования показывают, что после активного растворения атмосферными осадками минералов отвалов в присутствии кислорода воздуха происходит сток в пруд с застойной водой, где происходит осаждение металлов в виде собственных минералов или вследствие сорбционных процессов. Можно сделать вывод, что пруд в данной системе выполняет роль приемника не только физического стока подотвальных вод, но и места протекания химических процессов самоочищения воды. Установлено, что органическое вещество гуминовой природы является доминирующим фактором накопления железа в изученных водах. Меньшая степень сродства с гумусовыми веществами отмечена для Ca, Mg, а также большинства рассмотренных микрокомпонентов.
1. ВВЕДЕНИЕ
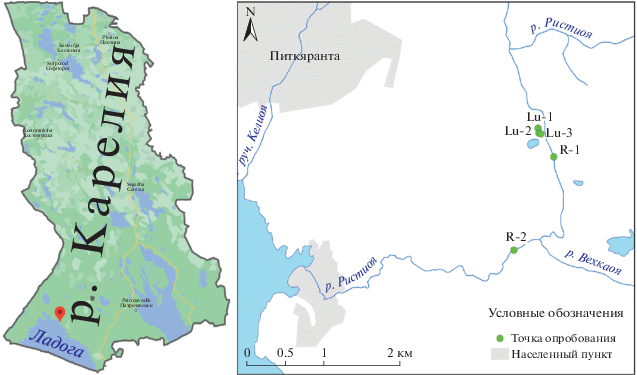
Изучаемые объекты – шахты Люпикко, расположены в Питкярантском рудном районе на северо-восточной оконечности Ладожского озера и относятся к одноименному административному району Республики Карелия (рис. 1). Толчком к открытию железорудного месторождения Люпикко послужило обнаружение халькопирита крестьянином Я. Павловым в 1856 г. Помимо упомянутого, в Питкярантском рудном районе находятся и другие скарновые и апоскарновые грейзеновые месторождения и рудопроявления с комплексным железо-полиметаллическим-оловянным и редкометальным оруденением. Район исследований характеризуется развитой гидрографической сетью, представленной преимущественно небольшими реками и протоками, которые соединяют небольшие озера, образуя озерно-речные системы. Основную долю в поверхностном стоке составляет местный сток, формирующийся непосредственно на территории Карелии. В связи с особенностями водного режима, реки района представляют ценность для рыбного хозяйства [8, 9]. Также поверхностные воды здесь широко используются для целей питьевого водоснабжения [8]. Эти факторы определяют важность исследования поведения химических элементов в поверхностных водных объектах, в особенности форм их миграции и осаждения, а также взаимосвязи природных водных объектов с горными выработками, широко распространенными на территории района, для оценки их геоэкологического статуса и прогноза состояния гидроэкосистем.
Рис. 1.
Расположение района исследований и точек опробования: Lu-1 – шахта “Люпикко-I”, Lu-2 – закопушка, Lu-3 – пруд, R-1 – р. Ристиоя у отвалов, в 400 м от шахты, R-2 – р. Ристиоя в 1.8 км ниже по течению от R-1, после впадения р. Вехкаоя.
Следует отметить, что добыча медных руд месторождения Люпикко не оправдала ожиданий, но при геологоразведочных работах было открыто месторождение магнетита. Под этот объект в 1866 г. была построена доменная печь. Однако уже с 1867 г. на предприятии стали плавить в основном руды, добытые на других объектах района, поскольку руды месторождения Люпикко оказались проблемными для плавки из-за значительного содержания сфалерита. C 1873 г. рудники заброшены по причине нецелесообразности производств [24].
В настоящее время шахты Люпикко затоплены. Породы отвалов доступны для воздействия атмосферного воздуха и осадков. Отвалы частично затоплены и выстилают дно пруда, который вероятно служил резервуаром для стока атмосферных осадков с отвалов. Для пород отвалов установлено широкое минеральное разнообразие, в том числе три десятка собственных минералов редких элементов и благородных металлов. Породы содержат в себе широкий спектр химических элементов, которые могут поступать и накапливаться в водах при их длительном взаимодействии. С целью детального изучения химического состава и оценки форм нахождения металлов в природных водах в 2020 г. на объекте был проведен пробоотбор природных вод из шахты, пруда и протекающей по району исследования р. Ристиоя (см. рис. 1).
1.1. Геологический очерк
Рудные объекты Питкярантского района приурочены к метакарбонатным горизонтам сортавальской серии, опоясывающих гнейсогранитные купола (AR2–PR2). Рудообразование связывается, главным образом, с внедрением гранитов Салминского батолита в мезопротерозое [7], которые залегают под рудными объектами, как правило, на глубине до первых сотен метров [5]. На восточной оконечности рудного поля Хопунваара расположены и прямые контакты метакарбонатов сортавальской серии с гранитными породами.
Рассматриваемый в данной работе объект приурочен к рудному полю Люпикко, развитому в юго-западном обрамлении одноименного гнейсогранитного купола (рис. 2). Через территорию рудного поля протекает р. Ристиоя так, что 4 шахты оказываются с западной стороны от реки, а одна к востоку. Рудное поле Люпикко имеет магнетитовую специфику. Так, в 1894 г. при помощи магниторазведки были обнаружены две параллельные магнитные аномалии аналогичные таковым на рудном поле Хопунваара. Аномалии связаны с наличием двух метакарбонатных горизонтов в обрамлении гнейсогранитных куполов – “верхним” и “нижним”, и развивающимися магнетитсодержащими скарнами по ним. В состав пород сортавальской серии, кроме метакарбонатов также входят амфиболитовые сланцы. Из силикатных пород, обрамляющих гнейсогранитные купола, в рассматриваемом районе также развиты пегматитовые тела, образованные до внедрения кислых пород Салминского батолита. Силикатные породы, приуроченные к Салминскому батолиту и вскрываемые горными выработками на рудном поле Люпикко, представлены дайковой серией высокодифференцированных Li-сидерофиллитовых гранитов.
Рис. 2.
Геологическая схема части Питкярантского рудного района (а) и шахта “Люпикко-I” в разрезе (б) по [19, 24] с упрощениями и дополнениями. Условные обозначения: 1 – гранитные породы Салминского батолита; 2 – Свекофеннские керамические пегматиты; 3 – богатые алюминием слюдистые сланцы Ладожской серии; 4 – Сортавальская серия: амфиболиты и амфиболовые сланцы с карбонатными горизонтами; 5 – гранито-гнейсы куполов; 6 – метакарбонатные горизонты сортавальской серии; 7 – контур рудного тела; 8 – ствол шахты и штреки; 9 – р. Ристиоя и направление ее течения.
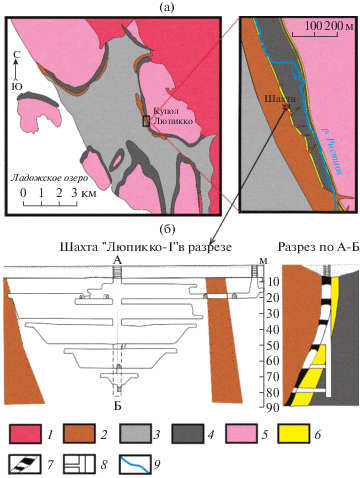
Общее падение рудных тел Люпикко составляет около 75° к западу. При этом у поверхности падение более крутое и доходит до 85°, с глубиной выполаживается и на глубине более 45 м падает до 45° [24]. В породах Сортавальской серии вблизи границы с куполом гнейсогранитов проявлены сдвиговые деформации, к которым приурочены тела пегматитов. Вероятно, по имеющимся ослабленным зонам происходила также и фильтрация флюида, что привело к более масштабным образованиям рудной минерализации в висячем блоке. Рудные магнетитовые тела не выдержаны по мощности и простиранию.
Основной рудный минерал на рудном поле Люпикко – магнетит. Вместе с магнетитом в руде в значимых количествах развиты сфалерит, флюорит, халькопирит, пирит, касситерит и галенит, встречаются реликты скарнированных мраморов. В рудах также встречаются пирротин, кубанит, As-содержащие минералы (арсенопирит, леллингит), молибденит, повеллит, шеелит, Bi-содержащие минералы (хедлейит, самородный Bi), стокезит, Be-содержащая минерализация (хризоберилл, берборит, бертрандит, бромеллит, даналит), флюоборит, апатит, кальцит. Развиты силикаты: минералы группы серпентина и гумита, клинопироксен, хлорит, тальк, флогопит, эпидот (пьемонтит), гельвин, типичные для скарнов – везувиан, гранат (андратит-гроссулярового ряда). Минеральный состав представлен по материалам [2, 4, 11], а также на основе наблюдений авторов.
2. МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Пробоотбор и аналитические методы исследования проб воды
В ходе полевых работ в районе шахты “Люпикко-I” было отобрано 6 проб воды: Lu-1a и Lu-1b – из шахты с поверхности и с глубины 2 м, соответственно; Lu-2 – из закопушки; Lu-3 – из подотвального пруда; R-1 – вода протекающей по скарнированным породам р. Ристиоя, в 400 м от шахты Люпикко; R-2 – вода р. Ристиоя, в 1.8 км ниже по течению от R-1, после впадения р. Вехкаоя.
При пробоотборе анализировались показатели pH (PH200, HM Digital, Южная Корея) и Eh (ЭКОТЕСТ 2000, ЭКОНИКС, Россия). Пробы для элементного анализа на точке опробования фильтровали через ацетат-целлюлозные мембраны с размером пор 0.45 мкм в стерильные пробирки объемом 15 мл с добавлением 0.45 мл HNO3 ос.ч. Для анализа компонентов карбонатной системы, хлорид-иона и Сорг пробы отобраны в бутылки объемом 300 мл, предварительно трижды промытые исследуемой водой.
Элементный анализ воды был выполнен в ГЕОХИ РАН. Содержания Ca, Mg, Na, K, Fe, Al, S определяли методом ICP-AES с помощью плазменного спектрометра iCAP 6500 DUO (Thermo Scientific), содержания Mn, Co, Ni, Cu, Zn, Sr, Pb, Cd, U и других микроэлементов определены методом ICP-MS на квадрупольном масс-спектрометре X-series 2 (Thermo Scientific).
Компоненты карбонатного равновесия (СО2, ${\text{HCO}}_{3}^{ - }$, ${\text{CO}}_{3}^{{2 - }}$) определялись методом потенциометрического титрования с использованием высокоточного анализатора Эксперт-001 (ООО Эконикс-Эксперт). Количество Cl– и ${\text{SO}}_{4}^{{2 - }}$ определено методом ионной хроматографии на приборах ICS-3000 и ICS-2000 (Thermo Scientific); содержание Сорг – методом высокотемпературного каталитического окисления (Vario TOC cube, Elementar). Соотношение содержаний фульво- и гуминовых кислот проанализировано оксидиметрически с K2Cr2O7 на приборе Shimadzu UV-1800 с преконцентрированием на смоле XAD-8 и разделением элюата при рН 2. Исследования выполнены в МГУ им. М.В. Ломоносова.
Также в ходе полевых работ были отобраны 2 пробы породы: в точке Lu-2 – отложения со дна закопушки; в точке Lu-3 – донные отложения подотвального пруда с глубины 80 см. Отбор проб отложений был произведен в герметичные полиэтиленовые пакеты. В лаборатории пробы высушены, истерты и просеяны через сито с размером ячеек 1 мм. Зольность отложений в течение 2 ч при температуре 800°С определялась в двух параллельных пробах. После этого пробы охлаждали на воздухе в течение 5 мин, а затем в эксикаторе до комнатной температуры и взвешивали. Для контроля тигли с зольным остатком прокаливали в течение 30 мин при температуре 800°С, охлаждали, взвешивали и определяли изменение массы. Изменение массы не должно было превышать 0.001 г. Также в пробах отложений были проанализированы содержания микрокомпонентов (Mn, Co, Ni, Cu, Zn, Sr, Pb, Cd, U и др.) методом ICP-MS. Образцы для анализа готовили спеканием с карбонатом натрия [3]. Для этого 0.1 г образца смешивали с 0.3 г безводного карбоната натрия (Merck, Suprapur) в агатовой ступке и переносили в корундовый тигель. Спекание проводили при 800°С в течение часа в муфельной печи. Полученные таблетки из спеченного материала обрабатывали 5 мл смеси HNO3:HCl:HF в пропорции 10:2:1 и после растворения разбавляли до 50 мл деионизированной водой (EasyPure). Для измерения раствор разбавляли 3% азотной кислотой. Измерения проводились на масс-спектрометре Element-2 (Thermo Scientific) в лаборатории экспериментальной геохимии МГУ им. М.В. Ломоносова.
В качестве геохимического фона приняты средние геометрические значения содержания элементов в поверхностных водах по данным [12], полученные для северо-западных территорий России, сходных с районом исследований по ландшафтно-климатическим условиям.
2.2 Методика термодинамических расчетов
Термодинамические расчеты проведены с помощью программного комплекса HydroGeo [1]. Система состояла из 20 химических элементов (O, H, C, S, Cl, Ca, Mg, Na, K, Fe, Al, Mn, Zn, Cu, Ni, Co, Sr, Cd, Pb, U), а также Fu (фульвокислота) и Hu (гуминовая кислота).
Для расчета свободных энергий образования комплексов с фульвовыми и гуминовыми кислотами были использованы эффективные константы устойчивости, приведенные в [18, 23]. Фульвокислота (Fu) и гуминовая кислота (Hu) введены в базу данных как новые независимые элементы. Свободные энергии Fu2– и Hu– приняты равными нулю. Содержания фульво- и гуминовых кислот были рассчитаны из концентрации Cорг согласно [10]. В расчете использовано соотношение фульво- и гуминовых кислот, экспериментально определенное по методу, описанному в п. 2.1. Более подробно о подходе к расчету содержания фульво- и гуминовых кислот изложено в [10].
В качестве потенциально возможных твердых фаз были приняты: магнезит, кальцит, сидерит, Fe(OH)3, (аморфный) гетит, тенорит, смитсонит, цинкит, ангидрит, гипс, родохрозит, пирит, сфалерит, брусит, гиббсит. Список компонентов водного раствора, рассматриваемый в модели, приведен в табл. 1.
Таблица 1.
Ионы и комплексные частицы, добавленные в модель
| H+ | Mg2+ | ${\text{MnHCO}}_{3}^{ + }$ | CuCl+ | ${\text{CoSO}}_{4}^{0}$ | ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{HCO}}_{3}^{ + }$ |
| OH– | ${\text{MgHCO}}_{3}^{ + }$ | ${\text{MnSO}}_{4}^{0}$ | Cu+ | Co2+ | ${\text{U}}{{{\text{O}}}_{2}}({\text{HC}}{{{\text{O}}}_{3}})_{2}^{0}$ |
| H2O | ${\text{MgSO}}_{4}^{0}$ | Mn2+ | CuFu0 | CoFu0 | ${\text{U}}{{{\text{O}}}_{2}}{\text{CO}}_{3}^{0}$ |
| ${\text{HCO}}_{3}^{ - }$ | MgFu0 | MnFu0 | Cu(OH)2Fu2– | ${\text{CoHu}}_{2}^{0}$ | ${\text{U}}{{{\text{O}}}_{2}}({\text{C}}{{{\text{O}}}_{3}})_{2}^{{2 - }}$ |
| ${\text{CO}}_{3}^{{2 - }}$ | MgHu+ | MnHu+ | ${\text{CuHu}}_{2}^{0}$ | Sr2+ | ${\text{U}}{{{\text{O}}}_{2}}({\text{C}}{{{\text{O}}}_{3}})_{3}^{{4 - }}$ |
| ${\text{CO}}_{2}^{0}$ | Ca2+ | Al3+ | CuHu+ | ${\text{SrHCO}}_{3}^{ + }$ | ${\text{U}}{{{\text{O}}}_{2}}({\text{C}}{{{\text{O}}}_{3}})_{3}^{{5 - }}$ |
| ${\text{SO}}_{4}^{{2 - }}$ | ${\text{CaHCO}}_{3}^{ + }$ | ${\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}_{3}^{0}$ | Zn2+ | ${\text{SrSO}}_{4}^{0}$ | ${\text{U}}{{{\text{O}}}_{2}}{\text{SO}}_{4}^{0}$ |
| Fu2– | ${\text{CaCO}}_{3}^{0}$ | ${\text{AlSO}}_{4}^{ + }$ | ${\text{ZnHCO}}_{3}^{ + }$ | SrFu0 | ${\text{UO}}_{3}^{0}$ |
| HFu– | ${\text{CaSO}}_{4}^{0}$ | AlFu+ | $Z{\text{nSO}}_{4}^{0}$ | ${\text{SrHu}}_{2}^{0}$ | UO2OH+ |
| H2Fu0 | CaFu0 | ${\text{Al(OH)}}_{3}^{0}$ | ZnFu0 | SrHu+ | ${\text{U}}{{{\text{O}}}_{2}}({\text{OH}})_{2}^{0}$ |
| Hu– | CaHu+ | ${\text{Al}}({\text{OH}})_{2}^{ + }$ | ZnHu+ | Pb2+ | UO2Fu0 |
| HHu0 | Fe3+ | Ni2+ | Cd2+ | ${\text{PbHCO}}_{3}^{ + }$ | ${\text{U}}{{{\text{O}}}_{2}}{\text{Fu}}_{2}^{{2 - }}$ |
| Cl– | (FeHCO3)+ | ${\text{NiHCO}}_{3}^{ + }$ | ${\text{CdHCO}}_{3}^{ + }$ | ${\text{PbCO}}_{3}^{0}$ | UO2Hu+ |
| Na+ | (Fe(OH)2Fu)– | NiFu0 | ${\text{CdSO}}_{4}^{0}$ | ${\text{PbSO}}_{4}^{0}$ | ${\text{U}}{{{\text{O}}}_{2}}{\text{Hu}}_{2}^{0}$ |
| ${\text{NaHCO}}_{3}^{0}$ | FeOHFu0 | NiOH+ | CdFu0 | PbOH+ | ${\text{UO}}_{2}^{ + }$ |
| ${\text{NaSO}}_{4}^{ - }$ | ${\text{FeHu}}_{3}^{0}$ | ${\text{Ni}}({\text{OH}})_{2}^{0}$ | CdHu+ | PbFu0 | ${\text{UO}}_{2}^{0}$ |
| K+ | ${\text{Fe}}({\text{OH}})_{3}^{0}$ | Cu2+ | ${\text{CdHu}}_{2}^{0}$ | PbHu+ | ${\text{U}}({\text{OH}})_{3}^{ + }$ |
| ${\text{KHCO}}_{3}^{0}$ | Fe2+ | ${\text{CuHCO}}_{3}^{ + }$ | Co3+ | ${\text{PbHu}}_{2}^{0}$ | |
| ${\text{KSO}}_{4}^{ - }$ | Mn3+ | ${\text{CuSO}}_{4}^{0}$ | ${\text{CoHCO}}_{3}^{ + }$ | ${\text{UO}}_{2}^{{2 + }}$ |
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Химический состав изучаемых природных вод
Изучаемые природные воды являются весьма пресными (табл. 2) по классификации ОСТ 41-05-263-8611.
Таблица 2.
Химический состав изучаемых природных вод
| Компоненты и показатели | Единица измерения | Фоновые значения [12] | Точка пробоотбора | |||||
|---|---|---|---|---|---|---|---|---|
| Lu-1a | Lu-1b | Lu-2 | Lu-3 | R-1 | R-2 | |||
| pH | ед. pH | н/д | 7.95 | 7.59 | 6.04 | 7.04 | 5.38 | 7.05 |
| Eh | мВ | н/д | 122.8 | 80.2 | 190.6 | 194.2 | 202.03 | 175.5 |
| M | мг/л | н/д | 305 | 301 | 163 | 158 | 18.5 | 42.2 |
| Cорг | н/д | 14.5 | 8.8 | 17.4 | 9.8 | 25.3 | 19.6 | |
| CO2 | н/д | 7.04 | 11.62 | 10.56 | 14.08 | 21.12 | 8.80 | |
| ${\text{HCO}}_{3}^{ - }$ | н/д | 220 | 215 | 102 | 83.0 | 5.4 | 19.5 | |
| ${\text{SO}}_{4}^{{2 - }}$ | 2.23 | 1.6 | 1.2 | 17.4 | 33.4 | 3.1 | 8.5 | |
| Cl– | 0.857 | 9.7 | 10.6 | 3.0 | 2.5 | 4.0 | 1.8 | |
| Ca | 2.32 | 32.4 | 32.6 | 28.2 | 28.9 | 3.34 | 6.78 | |
| Mg | 0.766 | 15.3 | 15.2 | 7.08 | 6.89 | 0.76 | 1.81 | |
| Na | 1.04 | 24.1 | 24.2 | 3.78 | 1.82 | 1.77 | 3.10 | |
| K | 0.344 | 2.32 | 2.81 | 1.02 | 1.27 | 0.12 | 0.66 | |
| Fe | 0.072 | 0.23 | 0.85 | 1.61 | 0.63 | 1.34 | 1.48 | |
| Al | 0.034 | <0.008 | <0.008 | 0.12 | 0.03 | 0.33 | 0.27 | |
| Mn | н/д | 0.588 | 0.640 | 1.430 | 0.221 | 0.055 | 0.074 | |
| Zn | мкг/л | 0.964 | 15.8 | 8.6 | 2977 | 553 | 10.8 | 9.96 |
| Cu | 0.525 | <0.5 | 0.10 | 46.6 | 9.88 | <0.5 | 0.20 | |
| Ni | 0.278 | 0.74 | 0.50 | 3.78 | 2.21 | 0.69 | 1.08 | |
| Co | 0.025 | 0.13 | 0.10 | 6.77 | 0.86 | 0.40 | 0.31 | |
| Sr | 14.7 | 146.7 | 146.9 | 34.02 | 42.39 | 14.80 | 25.12 | |
| Cd | 0.011 | 0.42 | <0.01 | 5.65 | 0.35 | 0.01 | 0.01 | |
| Pb | 0.079 | <0.12 | <0.12 | 2.66 | 2.65 | 0.46 | 0.50 | |
| U | 0.01 | 6.47 | 6.16 | 0.73 | 0.26 | 0.23 | 0.60 | |
Величина общей минерализации изменяется от 18.5 мг/л (р. Ристиоя) до 305 мг/л (шахта “Люпикко-I”). По величине pH все воды нейтральные (6.04–7.95) за исключением точки R-1, где вода умеренно кислая (pH 5.38). При пробоотборе была измерена температура воды. Вода во всех точках холодная: от 11°С в шахте до 15.6°С в р. Ристиоя.
Химический состав воды разнообразный. Вода из шахты (пробы Lu-1a и Lu-1b) – гидрокарбонатная кальциево-магниево-натриевая. Сравнение аналитически определенных концентраций в этой точке со значениями геохимического фона показало превышения по макрокомпонентам и целому ряду микрокомпонентов: Fe, Zn, Ni, Co, Sr, Cd и U. При этом содержание Sr и U в воде затопленной шахты наибольшее среди изученных проб.
Вода, отобранная из закопушки (точка Lu-2), гидрокарбонатная кальциево-магниевая со значительным содержанием ${\text{SO}}_{4}^{{2 - }}$ (17.4 мг/л). В этой пробе определены наивысшее содержание Fe, Zn, Cu, Ni, Co, Cd. Концентрации Al, Sr, U превышают значения геохимического фона.
Проба Lu-3 отобрана из подотвального пруда, частично покрывающего и сами отвалы. Вода в этой точке сульфатно-гидрокарбонатная кальциево-магниевая. Превышения геохимического фона в этой точке наблюдаются по тому же перечню химических элементов, что и в пробе Lu-2, но концентрации этих элементов несколько ниже.
В пробах, отобранных из р. Ристиоя, также отмечены превышения фоновых значений по Fe, Al, Zn, Ni, Co, Sr, U, но их концентрации значительно (иногда на порядки) ниже, чем в воде затопленной шахты и прилегающих объектов.
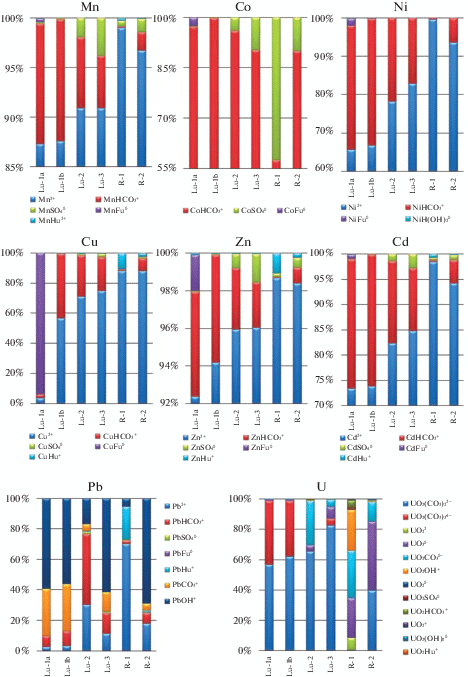
3.2. Формы миграции и осаждения химических элементов
Основные катионогенные элементы в изученных водах находятся преимущественно в ионной форме. Характер распределения кальция и магния почти идентичен. Кроме ионной формы эти элементы мигрируют в форме гидрокарбонатного комплекса (не более 2.8 mol %). В пробах, отобранных из закопушки и пруда, наблюдаются максимальные значения сульфатных форм кальция и магния (1.2–3.0 mol %). Фульватные комплексы кальция и магния имеют резко подчиненное значение. Максимальные содержания фульватных комплексов рассчитаны для пробы Lu-1a (0.13 и 0.17 mol % для кальция и магния соответственно). Кальцит выпадает во всех изученных пробах кроме речных (табл. 3). Результаты моделирования также показали возможность осаждения магнезита из воды в пробах Lu-1b и Lu-2. Натрий и калий преимущественно находятся в ионной форме (более 99 mol %). Распределение Sr по формам весьма похоже на распределение основных катионов. В речных водах резко доминирует ионная форма (более 99 mol %), в остальных пробах содержание стронция в ионной форме варьирует в пределах 96.0–97.7 mol %. Доля гидрокарбонатных комплексов Sr наиболее велика в пробах, отобранных из шахты (3.8–3.9 mol %). Доля фульватного комплекса SrFu0 незначительна, максимальное значение 0.10 mol % наблюдается в пробе Lu-1a.
Таблица 3.
Рассчитанные массы минералов, осаждающихся из изучаемых вод (мг/л)
| Минерал | Формула | Lu-1a | Lu-1b | Lu-2 | Lu-3 | R-1 | R-2 |
|---|---|---|---|---|---|---|---|
| Гётит | FeOOH | 0 | 1.20 × 10–5 | 8.50 × 10–7 | 8.30 × 10–7 | 8.50 × 10–7 | 8.60 × 10–7 |
| Гиббсит | Al(OH)3 | 0.023 | 0.023 | 0.35 | 0.085 | 0.94 | 0.79 |
| Кальцит | CaCO3 | 8.1 | 6.2 | 9.80 × 10–7 | 9.10 × 10–7 | 0 | 0 |
| Магнезит | MgCO3 | 0 | 1.40 × 10–6 | 7.80 × 10–7 | 0 | 0 | 0 |
| Родохрозит | MnCO3 | 1.1 | 1.2 | 1.10 × 10–6 | 1.10 × 10–6 | 0 | 1.20 × 10–6 |
| Смитсонит | ZnCO3 | 0 | 0 | 1.20 × 10–6 | 0 | 0 | 0 |
| Тенорит | CuO | 0 | 0 | 7.30 × 10–7 | 7.70 × 10–7 | 0 | 0 |
| Уранинит | UO2 | 2.80 × 10–6 | 2.70 × 10–6 | 0 | 0 | 0 | 0 |
Все железо связывается в комплекс Fe(OH)2Fu–. При исчерпании заданной в баланс фульвокислоты Fe выпадает в виде гётита (см. табл. 3). Такое поведение Fe было выявлено в водах других объектов Питкярантского рудного района [6, 18], а также в поверхностных и подземных водах других регионов [15, 20, 21]. Железо в виде гётита выпадает в пробах Lu-1b, Lu-2, Lu-3 и R-2.
Схожие характеры распределения имеют Mn, Ni, Zn и Cd (рис. 3). Они также преимущественно находятся в ионной форме, доля которой особенно значительна в речных водах. Второй по распространенности формой нахождения является гидрокарбонатная, доля которой наиболее высока в пробах, отобранных из шахты. Для Mn доля гидрокарбонатных комплексов составляет до 12.3 mol %, для Ni – до 33.0 mol %, для Zn – 5.7 mol %, для Cd – 26.0 mol %. В пробах, отобранных из шахты, отмечена высокая по сравнению с другими пробами доля фульватных комплексов (MnFu0 0.4 mol %, NiFu0 1.9 mol %, ZnFu0 1.9 mol %, CdFu0 0.9 mol %).
В речных водах в небольшом количестве присутствуют гуминовые комплексы вышеперечисленных металлов. Максимальное содержание рассчитано для Zn (1.1 mol %). Наибольшее относительное содержание гуминового комплекса Mn (0.26 mol %) рассчитано в пробе речной воды R-1. Термодинамический расчет показал выпадение смитсонита в пробе Lu-2, в которой была зафиксирована максимальная концентрация Zn (2977 мкг/л). Mn выпадает в виде родохрозита во всех пробах, кроме R-1. Возможность выпадения этих минералов в природных условиях подтверждают высокие концентрации Zn и Mn в пробах донных отложений, что особенно характерно для подотвального пруда, куда направлен поток поверхностных вод, промывающих отвалы (табл. 4).
Таблица 4.
Содержание некоторых химических элементов в изучаемых отложениях (мг/кг) и зольность
| Проба | Cd | Pb | U | Mn | Co | Ni | Cu | Zn | Sr | Зольность, % |
|---|---|---|---|---|---|---|---|---|---|---|
| Lu-2 | 48.25 | 285 | 8.27 | 1903 | 18.93 | 10.73 | 1669 | 10 225 | 19 | 98.14 |
| Lu-3 | 325.7 | 978 | 35.27 | 214 | 63.37 | 31.88 | 1555 | 42 297 | 31 | 92.86 |
Содержание Ni и Cd в донных отложениях также достаточно высокое. Можно предположить, что для Zn и Mn основными процессом вывода из раствора является выпадение собственных минералов, а для Ni и Cd, вероятно, значительную роль будет играть сорбция. Однако мы не можем исключить механический снос частиц рудных минералов в пруд, который может быть причиной высоких концентраций, поэтому верифицировать результаты моделирования с необходимой надежностью по содержанию металлов в отложениях не представляется возможным. Зольность, определенная для проб донных отложений, говорит о невысоком содержании в них органического вещества, особенно для точки Lu-2. Вероятно, в представленных концентрациях органическое вещество не будет играть значительной роли в осаждении металлов в виде твердой фазы. Хотя возможность такого механизма иммобилизации металлов и обсуждается в [16, 22].
Поведение меди во многом схоже с рассмотренными выше металлами. Значительным отличием является более тесное сродство с органическими веществом. В пробе Lu-1a 94.0 mol % Cu находится в виде фульватного комплекса (см. рис. 3). В речных водах значительно содержание гуминового комплекса меди – 2.6–10.8 mol %. В пробе Lu-2 и Lu-3 согласно данным моделирования возможно выпадение тенорита, что также хорошо согласуется с высоким содержанием Cu в пробах донных отложений.
Формы нахождения свинца довольно разнообразны (см. рис. 3). Наибольшая доля формы Pb2+ рассчитана для речных вод в пробе R-1 (70.0 mol %). В этой же пробе отмечено наибольшее содержание формы PbHu+ (21.5 mol %). Высокая степень сродства Pb с гуминовой кислотой показана в работе [17]. В других пробах значительное место занимает комплекс PbOH+ (5.0–69.0 mol %). Также присутствуют гидрокарбонатная и карбонатная формы.
Преобладающая форма урана в пробах Lu-1a, Lu-1b, Lu-2, Lu-3 – (UO2(CO3)2)2– (57.0–83.0 mol %). Доля комплекса (UO2(CO3)3)4– значительно выше в пробах воды, отобранных из шахты (37.0–42.0 mol %). В остальных пробах доля этого комплекса составляет не более 4.5 mol %. В речных водах, где содержание гидрокарбонат-иона ниже, увеличивается доля комплексов ${\text{U}}{{{\text{O}}}_{2}}{\text{CO}}_{3}^{0}$ (13.0–31.5 mol %) и ${\text{UO}}_{3}^{0}$ (26.0–45.0 mol %). Для вод, отобранных из шахты, рассчитано насыщение уранинитом. Это значительно отличается от распределения форм урана в водах, связанных с карьером бутового камня (Питкярантский рудный район), которые были ранее рассмотрены авторами [6], где большую долю в миграции урана играют ${\text{UO}}_{2}^{0}$ и ${\text{U}}{{{\text{O}}}_{2}}{\text{CO}}_{3}^{0}$ в связи с пониженными значениями Eh, а также гидроксокомплексы (при практически полном отсутствии в водах гидрокарбонат-иона). Известно, что формы миграции урана подвержены значительному влиянию геохимических условий среды [13].
Термодинамические расчеты показали возможность осаждения гиббсита во всех рассмотренных пробах (см. табл. 3). Формы миграции Al находятся в тесной связи с величиной pH [14]. При pH выше 7 (пробы Lu-1a, Lu-1a, Lu-3 R-2) преобладает комплекс ${\text{Al(OH)}}_{3}^{0}$ (89.0–98.0 mol %). В пробе с наименьшей величиной pH основными формами нахождения являются Al3+ (58.0 mol %) и ${\text{Al(OH)}}_{2}^{ + }$ (37.0 mol %).
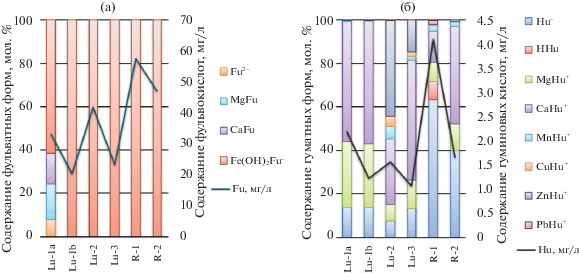
Роль органического вещества в комплексообразовании металлов хорошо демонстрируют сводные диаграммы, представленные на рис. 4. Расчеты показали, что практически вся фульвокислота, заданная в баланс системы, связывается с железом в комплекс Fe(OH)2Fu–. При израсходовании фульвокислоты железо выпадает в виде гётита. В пробе Lu-1a содержание железа недостаточное, чтобы связать всю фульвокислоту, и она находится в виде Fu2– и связывает часть кальция и магния в комплексы CaFu0 и MgFu0. Другие металлы также образуют фульватные комплексы (например, медь (см. рис. 3)), но их количество незначительно в общем балансе фульвокислоты. В речных же водах, где наблюдаются повышенные концентрации Fe, этот элемент полностью связывается фульвокислотой, содержание которой также велико относительно других проб (см. рис. 4). Вероятно, накопление Fe в речных водах связано именно с повышенным содержанием органического вещества.
Картина распределения форм нахождения металлов с гуминовыми кислотами более разнообразная. В речных водах, содержащих низкие концентрации металлов и высокие концентрации органического вещества гумусовой природы, преобладающей формой нахождения является Hu–. В пробах, отобранных из шахты, доминируют гуминовые формы кальция и магния. В пробе с высоким содержанием цинка (Lu-2) ZnHu+ является преобладающей формой для гуминовой кислоты. В пробах с наиболее высокими концентрациями меди (Lu-2, Lu-3) и марганца (Lu-2) отмечается увеличение доли форм CuHu+ и MnHu+. Следует также заметить, что гуминовые кислоты играют значительную роль в миграции Pb, однако в силу достаточно низких концентраций Pb в воде, комплекс PbHu+ имеет подчиненное значение в общем балансе гуматных форм.
4. ВЫВОДЫ
Приведенные в работе результаты показывают повышенные содержания Fe, Zn, Ni, Co, Sr, Cd, U в водах района шахты “Люпикко-I” относительно значений геохимического фона. Наибольшие концентрации для U и Sr определены в водах затопленной шахты Люпикко. Максимальные содержания большинства рассмотренных химических элементов рудной специализации (Fe, Zn, Cu, Ni, Co, Cd, Pb) определены в пробах воды, отобранных из закопушки и подотвального пруда. При этом пик концентраций этих металлов в воде приходится на точку Lu-2 (закопушка), в то время как наиболее высокие их содержания в донных отложениях определены в точке Lu-3 (подотвальный пруд). Вероятно, это связано с активным растворением атмосферными осадками минералов отвалов в присутствии кислорода воздуха. Результат этих процессов демонстрирует химический состав проб воды и донных отложений, отобранных в точке Lu-2. Затем происходит сток в пруд (застойная вода), где более активно происходит иммобилизация металлов путем их осаждения в виде собственных минералов или в следствие сорбционных процессов.
Можно сделать вывод, что пруд в данной системе выполняет роль приемника не только физического стока подотвальных вод, но и места протекания химических процессов самоочищения воды.
В речных водах района концентрация металлов значительно ниже. Здесь наблюдается второй пик содержания железа, накопление которого в данном случае вероятно объясняется связыванием с органическим веществом. Кроме железа органическое вещество очевидно влияет и на накопление Ca, Mg, а также большинства рассмотренных микрокомпонентов (Mn, Zn, Cu, Cd, Ni, Pb).
Работа выполнена в рамках государственного задания № 0137-2019-0016 лаборатории моделирования гидрогеохимических и гидротермальных процессов ГЕОХИ РАН. Определение анионного состава и органического вещества в пробах воды и расчет форм нахождения урана выполнены при финансовой поддержке РФФИ в рамках научного проекта № 19-33-60030.
Список литературы
Букаты М.Б. Разработка программного обеспечения для решения гидрогеологических задач // Известия Томского политехнического университета. 2002. Т. 305. Вып. 6: Геология, поиски и разведка полезных ископаемых Сибири. С. 348–365.
Булах А.Г., Франк-Каменецкий В.А. Геологическая экскурсия в окрестности Питкяранты. Петрозаводск: Госкарелиздат, 1961. 105 с.
Бычкова Я.В., Стародымова Д.П., Шайхутдинова К.В., Дягилева Д.Р. и др. Особенности химической подготовки проб донных отложений для мультиэлементного анализа методом ИСП-МС // Вестник Московского университета. Серия 4. Геология. 2020. № 4. С. 45–54.
Волошин А.В., Пахомовский Я.А. О стокезите из гранитных пегматитов Кольского п-ова и скарноидов Карелии (Питкяранта) // Тр. Минералогического музея. Вып. 35. Новые Данные о Минералах СССР. М.: Наука, 1988. С. 36–39.
Духовский А.А., Артамонова Н.А., Иванова Э.И., Никифоров И.О. Объемная модель Салминского массива гранитов рапакиви и закономерности размещения оруденения // Отечественная геология. 1994. № 4. С. 24–32.
Конышев А.А., Сидкина Е.С., Солдатова Е.А., Догадкин Д.Н., Громяк И.Н. Особенности поведения химических элементов в системе вода-порода района разрабатываемого карьера бутового камня в Питкярантском рудном районе (Карелия) // Известия Томского политехнического университета. Инжиниринг георесурсов. 2021. № 332. С. 7–19. https://doi.org/10.18799/24131830/2021/3/3098
Ларин А.М. Граниты рапакиви и ассоциирующие породы. СПб.: Наука, 2011. 402 с.
Литвиненко А.В., Богданова М.С., Карпечко В.А., Литвинова И.А., Филатов Н.Н. Водные ресурсы Карелии: основные проблемы рационального использования и охраны // Тр. Карельского НЦ РАН. 2011. № 4. С. 12–20.
Литвиненко А.В., Филатов Н.Н., Лозовик П.А., Карпечко В.А. Региональная экология: эколого-экономические основы рационального использования водных ресурсов Карелии // Инженерная экология. 1998. № 6. С. 3–13.
Методы геохимического моделирования и прогнозирования в гидрогеологии / [С.Р. Крайнов, Ю.В. Шваров, Д.В. Гричук и др.]; Под ред. С.Р. Край-нова. М.: Недра, 1988. 252 с.
Нефедов Е.И. Берборит, новый минерал // Доклады АН СССР. Серия геологическая. 1967. № 174. С. 189–192.
Томилина О.В., Паламарчук С.Ф., Яхнин Э.Я., Егоров А.И. Комплект карт геохимической основы государственной геологической карты Российской Федерации // Геохимическое картирование севера европейской территории России в рамках международной программы “Экогеохимия Баренцева региона” и проведение опережающего этапа составления геохимических основ Госгеолкарты-1000 третьего поколения на листы Р-35, 36. Т. 2: Отчет о научно-исследовательской работе / отв. исп. В. А. Чекушин. СПб., 2004. 146 с.
Торопов А.С., Солдатова Е.А., Рихванов Л.П. Формы миграции радионуклидов (U и Th) в природных водах в различных геохимических условиях на основе расчетных и экспериментальных данных // Известия Томского политехнического университета. Инжиниринг георесурсов. 2020. № 331. С. 7–21. https://doi.org/10.18799/24131830/2020/12/2935
Courtijn E., Vandecasteele C., Dams R. Speciation of aluminium in surface water // Sci. Total Environ. 1990. V. 90. P. 191–202. https://doi.org/10.1016/0048-9697(90)90193-X
Dinu M.I., Shkinev V.M. Complexation of metal ions with organic substances of humus nature: methods of study and structural features of ligands, and distribution of elements between species // Geochemistry Int. 2020. V. 58. P. 200–211. https://doi.org/10.1134/S0016702920020032
Ephraim J.H., Allard B. Metal ion binding by humic substances / Grenthe I., Puigdomenech I. (eds.) // Modelling in Aquatic Chemistry. Paris, OECD, Nuclear Energy Agency, 1997. P. 207–244.
Jordan R.N., Yonge D.R., Hathhorn W.E. Enhanced mobility of Pb in the presence of dissolved natural organic matter // J. Contam. Hydrol. 1997. V. 29. P. 59–80. https://doi.org/10.1016/S0169-7722(96)00087-3
Konyshev A.A., Sidkina E.S., Cherkasova E.V., Mironenko M.V., Gridasov A.G., Zhilkina A.V., Bugaev I.A. Migration forms of heavy metals and chemical composition of surface waters in the “Arsenic” shaft area (Pitkäranta Ore District, South Karelia) // Geochemistry Int. 2020. V. 58. P. 1068–1074. https://doi.org/10.1134/S0016702920090050
Larin A.M. Ore mineralisation / Haapala I., Ramo O.T., Salonsaari P.T. (eds.) // Salmi Batholith and Pitkaranta Ore Field in Soviet Karelia. Espoo, Finland, University of Helsinki, 1991. P. 19–34.
Lepokurova O.E., Ivanova I.S. Geochemistry of iron in organogenic water of Western Siberia, Russia // Proc. Earth Planet. Sci. 2014. V. 10. P. 297–302. https://doi.org/10.1016/j.proeps.2014.08.068
Rose A.L., Waite T.D. Kinetics of iron complexation by dissolved natural organic matter in coastal waters // Mar. Chem. 2003. V. 84. P. 85–103. https://doi.org/10.1016/S0304-4203(03)00113-0
Savichev O., Soldatova E., Rudmin M., Mazurov A. Geochemical barriers in oligotrophic peat bog (Western Siberia) // Appl. Geochemistry. 2020. V. 113. 104519. https://doi.org/10.1016/j.apgeochem.2019.104519
Soldatova E., Sidkina E., Sun Z. Thermodynamic modeling of aqueous migration of chemical elements in irrigation water // E3S Web Conf. 2020. V. 222. 05022. https://doi.org/10.1051/e3sconf/202022205022
Trüstedt O. Die Erzlagerstätten von Pitkäranta am Ladoga-See // Bull. la Comm. Géologique Finlande 1907. V. 19. P. 243–244. (in German)
Дополнительные материалы отсутствуют.
Инструменты
Геоэкология. Инженерная геология, гидрогеология, геокриология