Геоэкология. Инженерная геология, гидрогеология, геокриология, 2021, № 6, стр. 3-16
РОЛЬ МИКРОБИОЛОГИЧЕСКИХ ПРОЦЕССОВ В ФОРМИРОВАНИИ ГЕОХИМИЧЕСКИХ БАРЬЕРОВ И ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ЗОН ПРИ ЗАГРЯЗНЕНИИ МЕТАЛЛАМИ ПОЧВ И ВОДОНОСНЫХ ГОРИЗОНТОВ ВБЛИЗИ ПОЛИГОНОВ ТКО
В. С. Путилина 1, *, Т. И. Юганова 1, **
1 Институт геоэкологии им. Е.М. Сергеева РАН
101000 Москва, Уланский пер., 13, стр.2, Россия
* E-mail: vputilina@yandex.ru
** E-mail: tigryu@gmail.com
Поступила в редакцию 03.09.2021
После доработки 03.09.2021
Принята к публикации 10.09.2021
Аннотация
В статье проанализирована роль микробиологических процессов в формировании геохимических барьеров и окислительно-восстановительных зон при загрязнении почв и водоносных горизонтов металлами. Значительный вклад в загрязнение окружающей среды вносят тяжелые металлы в местах захоронения отходов, их миграция с формирующимся фильтратом в зону аэрации и подземные воды. Особое внимание уделено характеристике поведения тяжелых металлов в сменяющихся окислительно-восстановительных условиях, их трансформации и поступлению в водоносные горизонты. Рассмотрены механизмы биологического преобразования металлов и снижения их токсического воздействия на окружающую среду. Отмечено, что биологическая детоксикация природной среды представляет собой совокупность процессов метаболизма и биоконцентрирования за счет комплексообразования, сорбции и биодеградации вещества, зависящую от биологической активности окружающей среды и природы загрязняющих веществ. Биоремедиация загрязненных территорий и водоносных горизонтов – одна из наиболее безопасных, экономически эффективных, экологически чистых технологий для обезвреживания загрязненных участков территорий и водоносных горизонтов.
ВВЕДЕНИЕ
Преобладающей формой обращения с твердыми коммунальными отходами (ТКО) во многих странах являются полигоны их захоронения, поскольку они экономичны и могут вместить различные типы, а также большие количества отходов. Однако полигон создает серьезные проблемы для населения из-за неблагоприятных воздействий на окружающую среду. Основное потенциальное воздействие на окружающую среду полигона – это загрязнение грунтовых и поверхностных вод, связанное с миграцией фильтрата, который содержит различные типы опасных органических и неорганических загрязнителей [17]. В этой связи складирование ТКО вызывает множество экологических проблем. Тяжелые металлы (ТМ), содержащиеся в ТКО, относятся к наиболее опасным потенциальным поллютантам поверхностных и подземных вод.
Загрязнение окружающей среды ТМ вызывает большую озабоченность из-за значительного превышения их допустимого содержания в различных природных средах и, как следствие, обогащения металлами пищевых цепей живых организмов.
Многие металлы и металлоиды удерживаются в свалочном теле, почвах и горных породах посредством ряда механизмов: сорбции, осаждения, ионного обмена, комплексообразования и окислительно-восстановительных преобразований [10, 33]. Все эти процессы могут участвовать в формировании геохимических барьеров – определенных зон, в которых происходит резкое изменение подвижности и, следовательно, интенсивности миграции химических элементов. Существует несколько видов таких барьеров, однако в природных условиях геохимические процессы часто происходят не в пределах одного барьера, а в совокупности барьеров, избирательно действующих на преобразование элементов разных групп [4].
Сорбционные барьеры возникают на контакте воды с сорбентами и подразделяются на сорбционные с процессом катионного обмена (глинистый тип) и сорбционные гидроксидные или карбонатные, где сорбентами являются твердые фазы гидроксидов или карбонатов. Изменение кислотно-щелочных условий среды (pH) формирует щелочной гидролитический барьер, где происходят процессы гидролитического осаждения элементов со слабой устойчивостью комплексных соединений. Сульфидный барьер связан с образованием труднорастворимых сульфидов и формируется в зонах сульфатредукции и высокого содержания сульфидных вод. Снижение pH среды приводит к образованию труднорастворимых сульфидов.
Для свалочных отложений и зон аэрации характерны окислительно-восстановительные процессы, и во многих системах они приобретают ведущее значение, формируя окислительные и восстановительные барьеры. Окислительные преобразования приводят к осаждению окисленных форм ранее растворенных восстановленных соединений. Восстановительный процесс, напротив, ведет к преобразованию хорошо растворимых форм (например, сульфатных) в труднорастворимые восстановленные соединения (например, сульфидные, карбонатные). В этом случае при изменении окислительно-восстановительных условий восстановленные металлы могут вновь перейти в подвижное состояние [10].
Геохимические процессы с участием окислительно-восстановительных реакций, ведущие к формированию или растворению геохимических барьеров, могут быть в значительной степени обусловлены или усилены микробной активностью [3, 7, 30]. Окислительно-восстановительные процессы, связанные с микробиальным восстановлением металлов, относятся к аэробным процессам, происходящим в присутствии кислорода. Микроорганизмы получают энергию и растут за счет трансформации окисляемых органических соединений или других способных к восстановлению соединений с кислородом. Однако многие реакции с участием металлов происходят и в бескислородной среде. Такие среды благоприятны для жизнедеятельности анаэробных (диссимиляторных) микроорганизмов, которые изменяют окислительное состояние металлов, получая энергию по механизму, аналогичному аэробному дыханию. При диссимиляторном восстановлении металлов электроны от органических соединений, водорода или элементной серы переносятся к окисленной форме металла, например, железа, марганца, урана, селена, хрома и др.
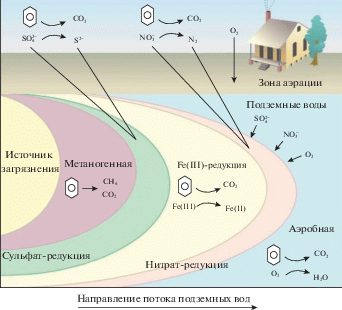
Понимание природы и условий существования геохимических барьеров необходимо для правильной оценки и прогноза развития геоэкологической ситуации и защиты подземных вод. В настоящее время особое внимание уделяется защите ресурсов подземных вод от загрязнения металлами, поступающими из мест складирования ТКО. По мере того, как осадки инфильтруются через отходы, образуется фильтрат, который мигрирует вниз в виде шлейфа. В фильтрате содержатся растворимые органические вещества, обеспечивающие восстановительные условия в загрязненной почве и грунтовых водах. Восстановительная среда определяет биогеохимические процессы на полигонах отходов с участием аммония, железа, марганца, бикарбоната, сульфида, метана. Основные процессы в загрязненном потоке: биологическая деградация органического вещества и различные биологические и абиотические процессы [37]. В водоносном горизонте под свалкой формируется естественный окислительно-восстановительный градиент от верхней кислородной зоны к более низкой бескислородной зоне. Растворенное органическое вещество (РОВ), фильтрующееся из свалки, разлагается в последовательности окислительно-восстановительных реакций, которые определяются микробиологическим разложением органического вещества (ОВ). Особое внимание обращается на роль в биоразложении конечных электроноакцепторных процессов (КЭАП): аэробного дыхания, денитрификации, восстановления Mn(IV), Fe(III) и ${\text{SO}}_{4}^{{2 - }}$, а также метаногенеза.
Настоящая статья посвящена исследованию роли микроорганизмов в формировании геохимических барьеров и окислительно-восстановительных зон, изменяющих подвижность металлов при загрязнении зон аэрации и водоносных горизонтов.
МИКРОБИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
До недавнего времени большинство исследований окислительно-восстановительных процессов с микробиальным восстановлением металлов было связано с микроорганизмами, живущими в присутствии кислорода. Эти аэробные бактерии получают энергию и растут за счет ассоциации окисляемых органических соединений или других способных к восстановлению соединений с кислородом. Аэробные микроорганизмы обладают высокой способностью усваивать металлы из окружающей среды для синтеза металл-содержащих энзимов и кофакторов и тем самым уменьшать загрязнение металлами. Некоторые аэробные микроорганизмы играют важную роль в круговороте металлов в окружающей среде за счет окисления восстановленных форм железа и марганца до оксидов [30].
Однако большое количество реакций с металлами происходит в бескислородной среде, в водоносных горизонтах и подземных водах. Диссимиляторное восстановление металлов дает энергию для поддержания роста массы микроорганизмов, как и при переносе электронов к кислороду для аэробных микроорганизмов.
Железо – один из наиболее распространенных металлов в земной коре. В присутствии кислорода железо в почвах, водоносных горизонтах и донных отложениях находится в форме окси/гидроксида Fe(III). Значительная часть железа, доступного для микробного метаболизма, находится в форме слабо окристаллизованных оксидов, которые обычно существуют как покрытия на глинистых и других частицах. В бескислородной среде Fe(III) может быть восстановлено до двухвалентного железа Fe(II), и это одна из наиболее важных геохимических реакций, которая обеспечивает формирование железо-восстановительного барьера [25, 29].
К микроорганизмам, способным участвовать в восстановлении железа, относятся Pseudomonas sp., Shewanella putrefaciens и штамм BrY, которые растут за счет энергии окисления органических соединений или водорода с восстановлением Fe(III) по реакции [24, 29]:
Другие организмы, такие как Geobacter metallireducens и Desulfuromonas acetoxidans, растут за счет полного окисления ОВ до двуокиси углерода в присутствии Fe(III) как акцептора электронов. Характерные реакции [24, 29]:
В результате совместной активности различных типов железовосстанавливающих микроорганизмов большой набор ОВ может окисляться с образованием мономерных соединений типа сахаров, аминокислот, ароматических и длинноцепочечных жирных кислот, которые представляют РОВ. Бактерии трансформируют сахара и аминокислоты в короткоцепочечные жирные кислоты: (преимущественно ацетат-ион), водород H2, двуокись углерода и др. [24].
Большинство бактерий, которые могут окислять органические соединения, способны также использовать в качестве акцепторов электронов оксиды марганца [22, 30]. Однако Mn(IV) может легко восстанавливаться и соединениями Fe(II) до Mn(II) – железо-марганец восстановительный барьер. Поэтому в ряде случаев трудно установить последовательность окислительно-восстановительных процессов.
Микробиальное восстановление сульфата до сульфида также может обеспечить абиотическое восстановление железа, так как сульфид-ион может восстанавливать Fe(III). Однако в присутствии Fe(III) восстановление сульфата тормозится из-за предпочтительности микробиального [24].
Сульфатвосстанавливающие бактерии (СВБ) влияют на подвижность металла либо непосредственно путем восстановительного преобразования ионов металла в его нерастворимые формы, либо косвенно путем формирования сульфидов металла – сульфат-восстановительный барьер. Диссимиляторные СВБ играют важную роль в цикле серы и минерализации ОВ в анаэробных средах. Кроме того, восстановление сульфата может происходить в окисленных средах обитания микроорганизмов, где анаэробные ниши и активность супероксидной редуктазы (ферментов) обеспечивают защиту СВБ от токсичности кислорода [34].
Образующийся сульфид как конечный продукт микробиального восстановления сульфата может вносить вклад в связывание металла путем восстановления его оксикатионов и оксианионов (например, ионов урана и хрома) или путем осаждения катионов металлов в виде сульфидов. Кроме того, СВБ способны увеличивать удерживание металла за счет внеклеточного связывания, клеточного поглощения и накопления металлов, процессов окисления/восстановления и осаждения на поверхностях минералов [33].
Значимыми акцепторами электронов в анаэробном метаболизме, помимо сульфатов, Mn(IV) и Fe(III), являются нитраты и двуокись углерода. В свалочных отложениях, почвах, донных осадках и горных породах, находящихся в анаэробных условиях, конкурирующие конечные акцепторы электронов, например, нитрат и трехвалентное железо (последнее в форме Fe(III)-окси/гидроксида) могут уменьшать скорость и степень микробиального восстановления [35]. Ферригидрит имеет самый высокий окислительно-восстановительный потенциал из соединений окси/гидроксидов Fe(III) и следовательно – наибольшую способность конкурировать как акцептор электронов в микробном дыхании. Например, в работе [35] отмечалось 52%-е уменьшение восстановления уранила посредством Shewanella alga в присутствии ферригидрита, тогда как ни гётит, ни гематит не влияли на восстановление уранила. Наблюдаемые различия между Fe-окси/гидроксидами обусловлены площадью их поверхности и выделением свободной энергии. Например, железо (по крайней мере первоначально) более доступно для биовосстановления в форме ферригидрита, чем гётита или гематита [15, 35].
Микроорганизмы Geobacter metallireducens и Shewanella alga могут использовать гумусовые соединения (ГС) в качестве акцепторов электронов для поддержания анаэробного окисления органических соединений и водорода. Если такой метаболизм распространен среди микроорганизмов, то он может иметь существенное значение для микробного сообщества в анаэробных средах, например, в затопленных почвах, водоносных горизонтах и донных отложениях [26].
Микробиальный перенос электронов к ГС может быть значительным для сред с низким содержанием гумуса, если в них также содержится Fe(III). При этом электроны могут затем быть вновь перемещены от ГС к железу. Такой перенос электронов может проходить в абиотических процессах в отсутствие микроорганизмов. Окисленное железом ГС может снова акцептировать электроны от гумус-восстанавливающих микроорганизмов. Таким образом, в Fe(III)-содержащей среде даже при небольшом количестве гумуса возможен перенос электронов, и этот цикл может повторяться несколько раз [26].
Микробиальное восстановление Fe(III) – важный процесс в анаэробных условиях. Восстановление Fe(III) обычно не оказывает значительного влияния на качество воды в незагрязненных неглубоких водоносных горизонтах, которые, как правило, являются аэробными. Однако, когда неглубокие водоносные горизонты загрязнены растворимыми органическими соединениями, например, из фильтратов свалок или протекающих подземных резервуаров для хранения топлива, создаются анаэробные условия, и Fe(III) становится наиболее распространенным потенциальным акцептором электронов для окисления ОВ [27]. Поэтому загрязненные органическими соединениями водоносные горизонты обычно содержат обширные зоны, в которых восстановление Fe(III) является преобладающим КЭАП. Как правило, зона, в которой преобладает восстановление Fe(III), находится ниже по потоку от зон образования метана и сульфатредукции и выше по потоку от зон восстановления нитрата и Mn(IV). Причина такого распределения заключается в том, что метаногенез и сульфатредукция могут стать важными КЭАП только тогда, когда микробиальное восстановление Fe(III) становится ограниченным из-за доступности Fe(III).
Поступление ОВ со свалочным фильтратом в водоносные горизонты на участках расположения полигонов ТКО оказывает существенное влияние на окислительно-восстановительные условия подземных вод. В результате формируются окислительно-восстановительные зоны, расположенные в определенной последовательности по мере удаления от источника загрязнения: метаногенная, восстановления сульфата, восстановления железа, марганца, нитрата и аэробная (рис. 1). Однако, окислительно-восстановительные зоны не имеют строго определенных границ и часто перекрываются, так что нельзя исключить возможность одновременного присутствия того или иного вида растворенного соединения (${\text{SO}}_{4}^{{2 - }}{\text{/S}}_{{}}^{{2 - }}$, Fe3+/Fe2+, Mn4+/Mn2+, ${\text{NO}}_{3}^{ - }{\text{/NH}}_{4}^{ + }$) [2, 28, 37].
Кислород подавляет рост и активность анаэробов, но обычно доступен только на краю шлейфа загрязнения. В бескислородных условиях анаэробы используют акцепторы электронов, такие как нитрат, Fe(III) или сульфат, для окисления загрязняющих веществ. Когда эти акцепторы электронов истощаются, анаэробный метаболизм продолжается путем преобразования ОВ в метан и диоксид углерода [28].
ФОРМЫ ТЯЖЕЛЫХ МЕТАЛЛОВ В СМЕНЯЮЩИХСЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ УСЛОВИЯХ
В свалочном теле распределение геохимических барьеров происходит локально в зависимости от типа присутствующих отходов. На первом этапе депонирования формируется, как уже упоминалось, аэробная зона до тех пор, пока в пустотах свалочного тела присутствует кислород. Аэробные условия определяются концентрациями свободного кислорода (O2), превышающими 1.0 мг л–1, и очень низкими концентрациями всех восстановленных видов [31].
Изменение окислительно-восстановительных условий в свалочном теле связано с процессами разложения отходов, где важным компонентом является ОВ, скорость и условия трансформации которого определяют тип окислительно-восстановительных реакций. В начальной стадии захоронения отходов металлы находятся в связанной форме. В открытых свалках неглубокого залегания со свободным доступом кислорода и кислородсодержащих атмосферных осадков происходит быстрое аэробное окисление ОВ, которое сопровождается образованием карбоновых кислот и снижением pH примерно до 6–5. В этих условиях часть связанных металлов переходит в растворенное состояние. Когда кислород полностью израсходован, начинаются анаэробные процессы, и уже другие соединения, такие как нитраты, сульфаты, оксиды марганца и железа, действуют как окислители, при этом изменяются окислительно-воcстановительные условия. Анаэробное разложение ОВ сопровождается дополнительным образованием спиртов, карбоновых кислот и других органических соединений. При этом значение pH снижается примерно до 4–3, и происходит растворение многих все еще связанных соединений металлов. Эта фаза характеризуется максимальным количеством растворенных металлов в фильтрате. В ходе последующих стадий выделенные металлы будут в различной степени переадсорбироваться или переосаждаться. Если бескислородные отложения подвергаются воздействию атмосферного воздуха, то окислительно-восстановительные условия будут изменяться, при этом будет происходить окисление растворенных металлов и образование новых форм связанных металлов. Особенно часто такие процессы происходят, когда система подвергается периодическим изменениям.
Все этапы переработки свалочных отходов связаны с трансформацией ОВ и его взаимодействиями с металлами, которые на протяжении своей “жизни” в свалке с изменением окислительно-восстановительных условий могут несколько раз переходить из подвижного состояния в неподвижное, перемещаясь в теле свалке и покидая его, и, в конечном итоге, мигрировать в подземные воды [1, 7].
Особенно важной задачей является определение периода наиболее активного выхода металлов из связанного состояния в свалочном теле и возможности их поступления в водоносные горизонты. Этот период определяется аэробной фазой и анаэробной фазой ацетогенеза – образованием карбоновых кислот и снижением рН, когда происходит активное растворение металлов и образование комплексных соединений с ОВ.
Изменение форм связывания тяжелых металлов – Zn, Cd, Pb и Cu – в циклах окисления–восстановления показано на примере слабо буферированных донных отложений [11]. Для эксперимента были выбраны образцы анаэробных отложений из устья р. Эльба (гавань г. Гамбург) с pH 6.43 и низким окислительно-восстановительным потенциалом –289 мВ.
Трансформация форм ТМ в отложениях происходила в результате следующих процессов:
• сорбция и десорбция,
• формирование и растворение карбонатных форм металлов,
• формирование и разложение растворимых и нерастворимых металлоорганических комплексных соединений,
• формирование и растворение оксидов и окси/гидроксидов,
• сорбция и соосаждение металлов с Fe/Mn-оксидами, особенно в окислительной среде с нейтральным значением pH,
• осаждение сульфидов металлов в сильно восстановительной среде и растворение в форме сульфатов в окислительных условиях.
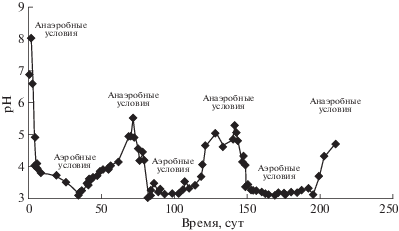
Благодаря этим процессам изменяются химические свойства соединений. На рис. 2 показана эволюция pH в трех сменяющихся окислительно-восстановительных циклах в течение 210 сут.
Рис. 2.
Изменения pH в ходе последовательных циклов окисления–восстановления в донных отложениях р. Эльба [11].
В исходных отложениях около 40% цинка были связаны во фракции сульфидов и органических соединений. После каждой стадии окисления доля этой фракции снижалась. По окончании 3-го окислительно-восстановительного цикла (в восстановительных условиях) в этой фракции осталось только 30% Zn. Наибольшие изменения были связаны с концентрацией растворенного Zn, которая постоянно возрастала. После восстановления в первом цикле цинк в растворе не был обнаружен. После двух последующих циклов около 20% цинка, первоначально связанного в твердой фазе, растворилось. Снижались доли легко восстанавливаемого цинка, возрастали доли обменного цинка и связанного с карбонатом. В целом, трансформация происходила в менее устойчивых формах.
Аналогичные изменения были отмечены для кадмия. В исходных отложениях около 65% Cd были связаны в сульфид органической фракции. Эта доля постепенно снижалась. Одновременно происходило четко выраженное увеличение подвижности кадмия, особенно после стадий окисления.
Доля свинца в сульфид органической фракции была даже выше, чем для Cd и Zn. После 2-й и 3-й стадий окисления отмечалось небольшое увеличение его подвижности, которое, однако, было существенно менее значимым, чем для Cd и Zn.
Доля меди в сульфид органической фракции в исходном осадке была наивысшей по сравнению с другими металлами и никогда не была ниже 40%. Оставшаяся часть меди находилась в умеренно восстанавливаемой фракции. В течение стадий окисления содержание меди в этой фракции постоянно росло. Доля сульфид органической меди снижалась, но никогда не была ниже 40%. Только небольшая часть меди была растворена.
Таким образом, в исходных отложениях высокие доли ТМ находились в сульфид органических фракциях, которые возрастали в порядке Zn < < Cd < Pb < Cu, что соответствует последовательности значений констант устойчивости сульфидных соединений металлов. При контакте с атмосферным воздухом или растворенным кислородом отложения окисляются и сульфидные соединения растворяются. В результате часть ТМ становится подвижной. В зависимости от химического состояния среды ТМ могут оставаться в растворе или переадсорбироваться на свежеосажденных оксидах железа, которые формируются при окислении [11].
МЕХАНИЗМЫ БИОРЕМЕДИАЦИИ МЕТАЛЛОВ
Фильтрат свалочных отложений содержит значительное количество ТМ, которые могут поступать в грунтовые воды и зону аэрации. Загрязнение ТМ опасно из-за токсических последствий их влияния на все формы жизни в окружающей среде. Эти металлы чрезвычайно чувствительны при низких концентрациях и могут храниться в пищевых цепях, создавая серьезную угрозу для здоровья населения. Различные органические загрязнители и металлы не поддаются разложению и остаются в окружающей среде в течение длительного времени. Микроорганизмы обладают различными механизмами связывания металлов и способностью к биосорбции [36].
Биологическое преобразование металлов – сложный процесс, который может происходить во многих средах обитания и реализовываться широким спектром микроорганизмов, в основном, бактериями и грибами. Металлы не разрушаются, но могут в результате биологической активности изменять валентность и/или преобразовываться в менее токсичные металлоорганические соединения. Оба процесса можно рассматривать как механизмы детоксикации, поскольку в результате можно ожидать связывание металла.
Тяжелые металлы участвуют в процессе биоремедиации и могут высвобождаться из связанных форм при восстановлении оксидов железа и марганца, на которых они адсорбированы или с которыми они образуют смешанные соединения. Но при переходе в свободное состояние металлы при соответствующих условиях могут вновь образовывать труднорастворимые или нерастворимые соединения.
Многие важные загрязнители-металлы и металлоиды часто являются слаборастворимыми или более летучими в восстановленном состоянии, чем в окисленном (табл. 1) [21, 25].
Таблица 1.
Реакции диссимиляторного восстановления токсичных металлов и органических соединений [25]
| № реакции | Реагенты | Продукты |
|---|---|---|
| Окисление органического загрязнителя совместно с восстановлением Fe(III) | ||
| 1 | Толуол + 36Fe(III) + 21H2O | 7${\text{HCO}}_{3}^{ - }$ + 36Fe(II) + 43H+ |
| Восстановление растворимого металла до нерастворимой формы | ||
| 2 | U(VI) + H2* | U(IV) + 2H+ |
| 3 | Cr(VI) + 3/2H2 | Cr(III) + 3H+ |
| 4 | Se(VI) + [3H2]** | Se(0) + 6H+ |
| 5 | Pb(II) + [H2] | Pb(0) + 2H+ |
| 6 | Tc(VII) + [3/2H2] | Tc(IV) + 3H+ |
| Восстановление растворимого металла до летучей формы | ||
| 7 | Hg(II) + [H2] | Hg(0) + 2H+ |
Преобразования, включающие окислительно-восстановительные процессы, изучались для элементов с переменной валентностью, например, ртути, хрома, урана, кобальта и др. [21, 22]. Было обнаружено несколько типов бактерий и дрожжей, восстанавливающих катионы ртути (Hg2+) до элементного состояния (Hg). Это обычно приводит к испарению ртути из среды. Окисление элементной ртути до ее катионной формы может также происходить посредством микроорганизмов. Такой способностью обладают E. coli, Pseudomonas fluorescens, P. aeruginosa, Geobacter, Citrobacter sp., Bacillus subtilis и B. megatherium [22]. Хром, восстановленный теми же бактериями, нерастворим в восстановительных условиях и в среде нейтральной и слабо щелочной присутствует как Cr(OH)3 [13, 22]. Изменение окислительного состояния радиоактивного Co3+, связанного в устойчивые, хорошо растворимые комплексы с ОВ, до Co2+ осуществляется при участии Geobacter metallireducens и Shewanella putrefaciens. Образуются неустойчивые комплексы Co2+ с ОВ, которые в 25 раз слабее, чем комплексы с Co3+, и хорошо адсорбируются почвами. В восстановлении Co3+ большую роль играют оксиды марганца Mn(IV), которые регулируют распределение электронов между бактериальной клеткой и оксидом Fe(III) [22].
В восстановительных условиях ТМ могут удаляться из раствора в виде сульфидных минералов, если доступно достаточное количество серы. Это характерно для меди, свинца, цинка, железа [34].
Бактерии могут повышать подвижность ТМ или радионуклидов путем их растворения и десорбции, благодаря выделению протонов и формированию различных лигандов. Обычно в присутствии активной микробной популяции pH почв, донных осадков или осадочных пород снижается, а количество растворенного органического углерода увеличивается. Таким образом, больше металлов может быть переведено в подвижные формы комплексных соединений [18]. С другой стороны, бактерии могут адсорбировать, удерживать и связывать в комплексные соединения металлы и радионуклиды путем поверхностных взаимодействий и формирования хелатирующих агентов, в результате чего металлы переходят в более устойчивые формы. Известно о высокой сорбционной способности живой биомассы грибов для Cd и о ее низкой способности к выделению удержанного Cd [18]. Эти исследования показали, что наиболее подвижная фракция Cd в отложениях была удержана биомассой Trichoderma koningii. Это было связано с переходом Cd в самую устойчивую осадочную фракцию.
Металлы могут повышать микробную активность в результате метаболических взаимодействий. Например, никель использовался Alcaligenes sp. для увеличения активности гидрогеназы и фактически накапливался в клеточной стенке. Возможно внутриклеточное поглощение урана бактериями P. aeruginosa, оно могло занимать до 15% сух. вес. клеток [18].
Известны некоторые бактерии (Alcaligenes, Acinetobacter, Arthrobacter, Azospirillum, Bacillus, Pseudomonas, Rhizobium и др.), способные растворять минералы фосфата. Образующийся фосфат-ион реагирует со многими переходными и тяжелыми металлами, металлоидами и радионуклидами, быстро формируя вторичные осадки фосфата, устойчивые в широком диапазоне геологических условий. Использование твердых фаз соединений фосфата, как изолирующего агента для преобразования многих металлов в загрязненных отложениях, создает значительный потенциал для долговременной экологической реабилитации. Например, биодобавки P. putida и A. piechaudii в комбинации с добавками фосфата показали возможность реабилитации почв, загрязненных свинцом и ураном [18]. Таким образом, микроорганизмы способны усиливать или подавлять процессы реабилитации окружающей среды от загрязнения in situ.
Преобразование некоторых металлов в металлоорганические соединения путем метилирования – еще один механизм их детоксикации. Способность к метилированию была установлена для ртути, свинца, кадмия и олова. На этот процесс могут влиять различные факторы окружающей среды, а также количество и разновидности микробов, присутствующих в данной среде обитания. Метилирование может катализироваться широким спектром микроорганизмов: аэробными и анаэробными бактериями, дрожжами и грибами. Но продукты метилирования могут быть более токсичными, чем свободный металл, они часто оказываются летучими и выделяются в атмосферу. Так обстоит дело с ртутью и ее метилированными производными: метил- и диметилртутью. Металлоорганические соединения могут также подвергаться микробиологическому и химическому разложению, что приводит к повторному высвобождению металла, обычно вновь в летучей форме. Такое разложение реализуется многими видами микробов [14].
Преобразования металлов происходят в широком спектре сред обитания, например, в озерах и речных отложениях, почвах, речных водах и активированных осадках, и в каждом случае действующий микробный состав различен. Как уже отмечалось, в преобразование металлов может быть вовлечено широкое разнообразие микроорганизмов. Тот факт, что специализированной преобразующей микрофлоры не существует, означает, что процесс трансформации – широко распространенное явление, характерное для разнородных организмов всех видов сред обитания. Способность микроорганизмов преобразовывать некоторые металлы и таким образом снижать их токсичность объясняется устойчивостью микробов к металлам.
БИОВЫЩЕЛАЧИВАНИЕ МЕТАЛЛОВ ИЗ ЗОН ЗАГРЯЗНЕНИЯ
Биоремедиация загрязненных территорий и водоносных горизонтов рассматривается как одна из наиболее безопасных, экономически эффективных и экологически чистых технологий для обезвреживания участков, загрязненных широким спектром загрязняющих веществ. Исследования по микробиологии водоносных горизонтов, подвергшихся воздействию свалок [8, 20], позволили получить представление о микробных профилях водоносных горизонтов, подверженных воздействию фильтрата.
Термин “биоремедиация” был введен для описания процесса использования биологического агента для удаления токсичных отходов из окружающей среды. В процессе биоремедиации используются различные агенты, такие как бактерии, грибы, водоросли и высшие растения, в качестве основных инструментов для обработки ТМ, присутствующих в окружающей среде. Биоремедиация, как in situ, так и ex situ, привлекла значительный научный интерес благодаря возможности естественной очистки сред вследствие биологического разложения в природных условиях [19].
В основе методов биоремедиации лежит возможность удаления металлов, накопленных в почвах, донных отложениях, горных породах, а также загрязненных водоносных горизонтах, при изменении окислительно-восстановительных условий [21, 22, 25]. Если металл полностью или частично удаляется, результатом может быть уменьшение или полное исчезновение токсических воздействий. Существует несколько стратегий рекультивации загрязненных водоносных горизонтов. Они в широком смысле подразделяются на искусственные и естественные. Первые, которые включают в себя обычную откачку и очистку, работают быстрее, но требуют значительных экономических затрат на эксплуатацию и техническое обслуживание [8, 16]. С другой стороны, природное истощение, такое как биоремедиация in situ, предлагает недорогие, экологически безопасные, но эффективные средства [8, 23]. Кроме того, в отличие от откачки и очистки, биоремедиация на месте не приводит к образованию вторичных отходов. Поэтому это наиболее предпочтительный вариант восстановления подземных вод in situ [32]. Однако рекультивация in situ, особенно внутренняя биоремедиация, происходит медленно, и подземные воды остаются загрязненными в течение длительного времени, хотя восстановление может быть ускорено путем внесения добавок [23].
Анаэробное окисление органических соединений с восстановлением железа Fe(III) – очень важный процесс биоремедиации загрязненных подземных вод и стимуляции диссимиляторного восстановления металлов как метода связывания токсичных металлов в подземной среде [9, 30]. Но этот процесс часто сдерживается доступностью углерода, и процесс окисления in situ заметно тормозится. Добавление источников углерода стимулирует восстановление нитрата или Fe(III), что влияет на подвижность металлов [12].
В России изучались процессы биовыщелачивания металлов из почв с использованием микроорганизмов и синтетических сред для их развития [5, 6]. В работе [5] показана возможность выщелачивания ТМ и урана из загрязненных почв металлорезистентной культурой Bacillus cereus (МРК). Эта культура оказалась устойчивой к концентрации меди, кобальта 2–3 ммоль л–1 и урана(VI) 1 ммоль л–1. Для обеспечения развития МРК использовалась синтетическая среда, содержащая (NH4)2SO4, K2HPO4, KH2PO4, MgSO4 и источники углерода (легко усваиваемые глюкоза или ацетат натрия – наиболее распространенные субстраты биологического круговорота ОВ в природе). В качестве сорбента была выбрана легкосуглинистая темно серая оподзоленная почва лесостепной зоны. Сорбционные эксперименты проводились на суспензии с отношением “твердая : жидкая” фаза 1 :10. Изучаемые металлы адсорбировались в последовательности U(VI) > > Cu > Co > Sr. Такой порядок сохранялся при сорбции как из индивидуальных растворов, так и из растворов, содержащих смеси металлов в эквимолярных концентрациях. Как показали результаты экспериментов, существуют две области pH, благоприятные для микробиальной экстракции U(VI) из почвы: при pH 4–5, когда уран переходит в жидкую фазу в виде цитратного бинуклеарного комплекса (UO2)2(C6O7H5)2, и при pH 8–9 – с выносом урана в виде карбонатного комплекса UO2CO3. Эти комплексы являются водорастворимыми. В результате бактериального процесса степень выщелачивания U(VI) в слабокислой области pH достигала 99%, в слабощелочной не превышала 85%.
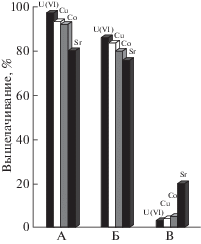
Проведено сравнительное выщелачивание металлов из образцов почвы, загрязненной смесью металлов, под действием металлорезистентных бактерий, развивающихся на глюкозе или ацетате, а также при обработке минеральной средой без источника углерода (контроль) [5]. Полученные данные представлены на рис. 3. При отсутствии бактерий выщелачивание металлов практически не происходит (см. рис. 3 В). Уран, кобальт и медь были более прочно связаны с почвой, чем стронций. В контрольном эксперименте эти металлы оставались практически полностью в неподвижном состоянии, в отличие от стронция, который выщелачивался на 20%. Одновременное выщелачивание металлов Co, Cu, U было более эффективным c глюкозой, чем в среде с ацетат-ионом. Результаты проведенного исследования показали возможность эффективного биовыщелачивания ТМ из загрязненной почвы в суспендированном варианте. Оно может быть положено в основу технологии обезвреживания сильно загрязненных участков почвы [5].
Рис. 3.
Биовыщелачивание ТМ из почвы, загрязненной их смесью. Развитие Bacillus cereus ВКМ 4368 в течение 18 ч на среде с: А – глюкозой до рН 4.0–4.2; Б – ацетатом до рН 9.0–9.2; В – контроль (выщелачивание под действием минеральной среды с рН 6.8 без источника углерода) [5].
Другой пример с применением биовыщелачивания приведен в работе [6], где изучена возможность обогащения бокситов путем их обезкремнивания и обезжелезивания с использованием микроорганизмов. В этих исследованиях показано, что некоторые гетеротрофные бактерии, Bacillus mucilaginosus и B. circulans, способны повышать кремниевый модуль (отношение Al2O3/SiO2) некоторых типов бокситов.
Изучена способность 63 штаммов микроорганизмов, относящихся к 15 родам, извлекать кремний, железо и алюминий из каолинит-гематит-бемитового боксита. Показано, что большинство изученных микроорганизмов способно с разной степенью активности и селективности извлекать указанные элементы в раствор. Суммарный вынос элементов под воздействием наиболее активных мицелиальных микромицетов превышал контрольный эксперимент в 137–165 раз, а у остальных штаммов мицелиальных микромицетов – в 9.7–45 раз. Под действием дрожжевых культур извлечение элементов в раствор возрастало в 3–11 раз. В случае бактерий родов Pseudomonas и Bacillus – в 3–10 раз. Селективность процесса выноса элементов из боксита зависит от природы метаболитов, выделяемых микроорганизмами, и их активности в растворении минералов, входящих в состав боксита. Так, в условиях развития микроорганизмов T. thiooxidans при pH 1.95 в раствор переходит в основном Al; Fe и Si в этих условиях в раствор не выносятся. В случае мицелиальных микромицетов при pH 2.5–3.5 выщелачивались в основном кремний и железо.
Деятельность, связанная с добычей и переработкой урановой руды, привела к появлению обширных областей загрязненных почв и водоносных горизонтов. Радионуклиды не могут быть разрушены, но токсичность этих неорганических загрязнителей можно снизить путем изменения их химической формы. Использование фосфата, изолирующего агента для преобразования радионуклидов при низких концентрациях в загрязненных почвах и отложениях, открывает значительный потенциал для долговременной экологической реабилитации. Известны некоторые бактерии (Alcaligenes, Acinetobacter, Arthrobacter, Azospirillum, Bacillus, Pseudomonas, Rhizobium и др.), способные растворять минералы фосфата и таким путем усиливать или ингибировать процессы реабилитации окружающей среды in situ относительно загрязнения ураном при использовании добавок фосфата. Эти разновидности бактерий обычны в почвах и донных осадках. Биодобавки P. putida и A. piechaudii в комбинации с добавками фосфата продемонстрировали потенциал для реабилитации почв стрельбища, загрязненных свинцом, и возможно, эти бактерии также удастся использовать для реабилитации почв и погребенных осадочных пород, загрязненных ураном [18].
ЗАКЛЮЧЕНИЕ
Загрязнение окружающей среды тяжелыми металлами (ТМ) вызывает большую озабоченность из-за значительного превышения их допустимого содержания в различных природных средах и, как следствие, обогащения металлами пищевых цепей живых организмов. Значительный вклад в загрязнение окружающей среды ТМ вносят места складирования отходов и миграция ТМ с формирующимся фильтратом в зону аэрации и подземные воды. Многие металлы удерживаются в свалочном теле, почвах и горных породах посредством ряда механизмов: сорбции, осаждения, ионного обмена, комплексообразования и окислительно-восстановительных преобразований. Геохимические процессы с участием окислительно-восстановительных реакций, ведущие к формированию или растворению геохимических барьеров, могут быть в значительной степени обусловлены или усилены микробной активностью.
Микробиологическое преобразование с участием металлов – важный процесс, который может происходить во многих средах обитания и реализовываться широким спектром микроорганизмов, в основном, бактериями и грибами. Металлы не могут разрушаться, но могут в результате биологического воздействия менять валентности и/или преобразовываться в металлоорганические соединения. Оба процесса можно рассматривать как механизмы детоксикации.
Множество процессов с участием микроорганизмов происходит в бескислородной среде водоносных горизонтов и подземных вод. Эти среды благоприятны для жизнедеятельности анаэробных (диссимиляторных) микроорганизмов, которые трансформируют металлы, получая энергию по механизму, аналогичному аэробному дыханию с использованием кислорода.
В анаэробных условиях Fe(III) – наиболее распространенный потенциальный акцептор электронов для окисления органического вещества (ОВ). Поэтому водоносные горизонты, загрязненные органическими соединениями, обычно содержат обширные окислительно-восстановительные зоны, в которых восстановление Fe(III) является преобладающим конечным электроноакцепторным процессом. Зона, в которой преобладает процесс восстановления Fe(III), находится ниже по потоку от окислительно-восстановительных зон образования метана и сульфатредукции и выше по потоку от зон восстановления нитрата и Mn(IV).
В ходе восстановительного растворения оксидов железа и марганца анаэробными микроорганизмами адсорбированные металлы могут выделяться в раствор, при этом железо и марганец изменяют свое валентное состояние с понижением и также переходят в растворимые формы. Обычно в присутствии активной микробной популяции pH отложений снижается, а количество растворенного органического вещества (РОВ) увеличивается. Таким образом, больше металлов могут быть преобразованы в более подвижные формы – комплексные соединения с РОВ.
При изменении окислительно-восстановительных условий восстановленные железо и марганец окисляются и формируют устойчивые твердые фазы окси/гидроксидных соединений, которые являются важными поглотителями растворенных и комплексных соединений остальных металлов. Поглотителями также могут быть карбонатные и смешанные карбонат-фосфатные осадки металлов.
Микроорганизмы могут адсорбировать, удерживать и связывать в комплексные соединения металлы и радионуклиды путем поверхностных взаимодействий и выделения хелатирующих агентов, переводя металлы в более устойчивые формы. В результате формируются геохимические барьеры с измененными условиями миграции элементов, которая может быть усилена деятельностью микробов. Развитие процессов микробиальной трансформации металлов из связанных форм в подвижные, доступные для экстракции, является одним из наиболее перспективных направлений в реабилитации окружающей среды. Природная ремедиация почв, загрязненных ТМ, протекает очень медленно. Актуальной становится задача активизации процессов удаления ТМ из почв и горных пород, в том числе для предотвращения загрязнения подземных вод. Микроорганизмы могут повышать подвижность ТМ или радионуклидов, благодаря выделению протонов и образованию различных лигандов при трансформации ОВ. Таким образом, больше металлов может перейти в более подвижные формы за счет связывания в комплексные соединения с РОВ.
Биологическая детоксикация природной среды представляет собой совокупность процессов метаболизма и биоконцентрирования за счет комплексообразования, сорбции и биодеградации вещества, зависящую от биологической активности окружающей среды и природы загрязняющих веществ.
Статья подготовлена в рамках выполнения государственного задания и плана НИР по теме № г.р. АААА-А19-119101890052-5 и при финансовой поддержке гранта РФФИ № 20-05-00574.
Список литературы
Галицкая И.В., Путилина В.С., Юганова Т.И. Роль органического вещества в миграции тяжелых металлов на участках складирования твердых бытовых отходов // Геоэкология. 2005. № 5. С. 411–422.
Галицкая И.В., Путилина В.С., Юганова Т.И. Формирование зональности окислительно-восстановительных состояний в водоносных горизонтах под влиянием полигонов и свалок ТБО // Геоэкология. 2008. № 5. С. 401–410.
Галицкая И.В., Путилина В.С., Юганова Т.И. Роль микроорганизмов в поведении урана в системе вода–порода // Геоэкология. 2016. № 4. С. 320–334.
Крайнов С.Р., Рыженко Б.Н., Швец В.М. Геохимия подземных вод. Теоретические, прикладные и экологические аспекты. М.: Наука, 2004. 677 с.
Никовская Г.Н., Ульберг З.Р., Коваль Л.А. Коллоидно-химические процессы в биотехнологии извлечения тяжелых металлов из почвы // Коллоидный журнал. 2001. Т. 63. № 6. С. 820–824.
Огурцова Л.В., Каравайко Г.И., Авакян З.А., Корнеевский А.А. Активность различных микроорганизмов в выносе элементов из боксита // Микробиология. 1989. Т. 58. № 6. С. 956–962.
Путилина В.С., Галицкая И.В., Юганова Т.И. Влияние органического вещества на миграцию тяжелых металлов на участках складирования твердых бытовых отходов: Аналит. обзор. Сер. Экология; Вып. 76. Новосибирск: ГПНТБ СО РАН; ИГЭ РАН, 2005. 100 с.
Abiriga D., Jenkins A., Alfsnes K., Vestgarden L.S., Klempe H. Characterisation of the bacterial microbiota of a landfill-contaminated confined aquifer undergoing intrinsic remediation // Science of the Total Environment. 2021. V. 785. Paper 147349. 12 p.
Anderson R.T., Vrionis H.A., Ortiz-Bernad I., Resch C.T., Long P.E., Dayvault R., Karp K., Marutzky S., Metzler D.R., Peacock A., White D.C., Lowe M., Lovley D.R. Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer // Applied & Environmental Microbiology. 2003. V. 69. № 10. P. 5884–5891.
Burkhardt E.-M., Meißner S., Merten D., Büchel G., Küsel K. Heavy metal retention and microbial activities in geochemical barriers formed in glacial sediments subjacent to a former uranium mining leaching heap // Chemie der Erde – Geochemistry. 2009. V. 69, Suppl. 2. P. 21–34.
Calmano W., Hong J., Förstner U. Binding and mobilization of heavy metals in contaminated sediments affected by pH and redox potential // Water Science & Technology. 1993. V. 28. № 8–9. P. 223–235.
Edwards L., Kusel K., Drake H., Kostka J.E. Electron flow in acidic subsurface sediments contaminated with nitrate and uranium // Geochimica et Cosmochimica Acta. 2007. V. 71. № 3. P. 643–654.
Flyhammar P. Estimation of heavy metal transformations in municipal solid waste // The Science of the Total Environment. 1997. V. 198. № 2. P. 123–133.
Gadd G.M., Griffiths A.J. Microorganisms and heavy metal toxicity // Microbial Ecology. 1978. V. 4. № 4. P. 303–317.
Hansel C.M., Benner S.G., Neiss J., Dohnalkova A., Kukkadapu R.K., Fendorf S. Secondary mineralization pathways induced by dissimilatory iron reduction of ferrihydrite under advective flow // Geochimica et Cosmochimica Acta. 2003. V. 67. № 16. P. 2977–2992.
Hyldegaard B.H., Jakobsen R., Weeth E.B., Overheu N.D., Gent D.B., Ottosen L.M. Challenges in electrochemical remediation of chlorinated solvents in natural groundwater aquifer settings // Journal of Hazardous Materials. 2019. V. 368. P. 680–688.
Kjeldsen P., Barlaz M.A., Rooker A.P., Baun A., Ledin A., Christensen T.H. Present and long-term composition of MSW landfill leachate: A Review // Critical Reviews in Environmental Science & Technology. 2002. V. 32. № 4. P. 297–336.
Knox A.S., Brigmon R.L., Kaplan D.I., Paller M.H. Interactions among phosphate amendments, microbes and uranium mobility in contaminated sediments // The Science of the Total Environment. 2008. V. 395. № 2–3. P. 63–71.
Kulshreshtha A., Agrawal R., Barar M., Saxena S. A review on bioremediation of heavy metals in contaminated water // IOSR Journal of Environmental Science, Toxicology & Food Technology. 2014. V. 8. № 7. P. 44–50.
Lin B., Braster M., Röling W.F., van Breukelen B.M. Iron-reducing microorganisms in a landfill leachate-polluted aquifer: complementing culture-independent information with enrichments and isolations // Geomicrobiology Journal. 2007. V. 24. № 3–4. P. 283–294.
Lloyd J.R., Lovley D.R. Microbial detoxification of metals and radionuclides // Current Opinion in Biotechnology. 2001. V. 12. № 3. P. 248–253.
Lloyd J.R., Lovley D.R., Macaskie L.E. Biotechnological application of metal-reducing microorganisms // Advances in Applied Microbiology. 2003. V. 53. P. 85–128.
Logeshwaran P., Megharaj M., Chadalavada S., Bowman M., Naidu R. Petroleum hydrocarbons (PH) in groundwater aquifers: an overview of environmental fate, toxicity, microbial degradation and risk-based remediation approaches // Environmental Technology & Innovation. 2018. V. 10. P. 175–193.
Lovley D.R. Anaerobes into heavy metal: Dissimilatory metal reduction in anoxic environments // Trends in Ecology & Evolution. 1993. V. 8. № 6. P. 213–217.
Lovley D.R. Bioremediation of organic and metal contaminants with dissimilatory metal reduction // Journal of Industrial Microbiology. 1995. V. 14. P. 85–93.
Lovley D.R., Fraga J.L., Blunt-Harris E.L., Hayes L.A., Phillips E.J.P., Coates J.D. Humic substances as a mediator for microbially catalysed metal reduction // Acta Hydrochimica et Hydrobiologica. 1998. V. 26. № 3. P. 152–157.
Lovley D.R., Anderson R.T. Influence of dissimilatory metal reduction on fate of organic and metal contaminants in the subsurface // Hydrogeology Journal. 2000. V. 8. № 1. P. 77–88.
Lovley D.R. Anaerobes to the rescue // Science. 2001. V. 293. № 5534. P. 1444–1446.
Lovley D.R. Dissimilatory metal reduction: From early life to bioremediation // ASM News. 2002. V. 68. P. 231–237.
Lovley D.R. Extracellular electron transfer: wires, capacitors, iron lungs, and more // Geobiology. 2008. V. 6. № 3. P. 225–231.
Lyngkilde J., Christensen T.H. Redox zones of a landfill leachate pollution plume (Vejen, Denmark) // Journal of Contaminant Hydrology. 1992. V. 10. P. 273–289.
O’Connor D., Hou D., Ok Y.S., Song Y., Sarmah A.K., Li X., Tack F.M. Sustainable in situ remediation of recalcitrant organic pollutants in groundwater with controlled release materials: a review // Journal of Controlled Release. 2018. V. 283. P. 200–213.
Picardal F., Cooper D.G. Microbially mediated changes in the mobility of contaminant metals in soils and sediments // Ahmad I., Hayat S., Pichtel J. (Eds.), Heavy Metal Contamination of Soil: Problems and Remedies. Enfield, NH: Science Publishers, Inc., 2005. P. 43–88.
Sitte J., Akob D.M., Kaufmann C., Finster K., Banerjee D., et al. Microbial links between sulfate reduction and metal retention in uranium- and heavy metal-contaminated soil // Applied & Environmental Microbiology. 2010. V. 76. № 10. P. 3143–3152.
Stewart B.D., Neiss J., Fendorf S. Quantifying constraints imposed by calcium and iron on bacterial reduction of Uranium(VI) // Journal of Environmental Quality. 2007. V. 36. № 2. P. 363–372.
Tarekegn M.M., Salilih F.Z., Ishetu A.I. Microbes used as a tool for bioremediation of heavy metal from the environment // Cogent Food & Agriculture. 2020. V. 6. № 1. Paper 1783174. 19 p.
Vodyanitskii Yu.N. Biochemical processes in soil and groundwater contaminated by leachates from municipal landfills (Mini review) // Annals of Agrarian Science. 2016. V. 14. № 3. P. 249–256.
Дополнительные материалы отсутствуют.
Инструменты
Геоэкология. Инженерная геология, гидрогеология, геокриология