Геохимия, 2020, T. 65, № 10, стр. 955-968
Формирование биогеохимических аномалий в бассейне р. Баксан
В. В. Ермаков a, *, С. Ф. Тютиков a, А. П. Дегтярев a, В. Н. Данилова a, У. А. Гуляева a, Д. Н. Догадкин a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: vad-ermak@yandex.ru
Поступила в редакцию 01.04.2020
После доработки 08.04.2020
Принята к публикации 08.04.2020
Аннотация
В процессе биогеохимических исследований W-Mo рудных ландшафтов Северного Кавказа и фоновых территорий установлено повышенное аккумулирование Mo, W, Cu и Re почвами и организмами в бассейне р. Баксан в результате техногенного загрязнения бывшим Тырныаузским W-Mo комбинатом и миграции металлов с природными водами. Техногенно преобразованные почвы долины р. Баксан и природные воды обогащены умеренно подвижными соединениями Mo и других металлов. При оценке биогенной миграции металлов выявлены конкурентные взаимосвязи не только между Mо и Cu, но также между Mo и W. Повышенное содержание Mo и W обнаружено в волосяном покрове, крови и молоке сельскохозяйственных животных, что сопровождается изменением активности некоторых ферментов.
ВВЕДЕНИЕ
Молибден незаменимый микроэлемент практически для всех форм жизни. Он действует как кофактор ряда ферментов, катализирующих важные химические превращения в биогеохимических циклах азота, углерода и серы (Anke et al., 2010; Ермаков и др., 2018). Биологическое значение молибдена известно давно. В 1930 г. Бортельс (Bortels) опубликовал первые работы о роли молибдена в каталитических процессах биологической фиксации азота микроорганизмами Azotobacter chroococcum и Clostridium pasteurianum. В сороковых годах прошлого столетия Х.Г. Виноградова представила данные о содержании молибдена в растениях семейства Leguminosae (Vinogradova, 1943). Последующие интенсивные исследования роли молибдена в питании растений, как в России, так и за рубежом раскрыли физиологическую функцию молибдена (Anke et al., 2100). Ряд штаммов микроорганизмов, выделенных из обогащенных молибденом почв, используется в биотехнологиии для получения биологически активных кормовых добавок, содержащих микроэлементы (Ермаков и др., 2012; Gradova et al., 2013).
Молибден относится к жизненно важным микроэлементам. Особенно большую роль этот микроэлемент играет в азотном обмене растений, животных и человека. Необходимость и специфичность молибдена доказана для ряда окислительно-восстановительных ферментных систем, участвующих в процессах восстановления нитратов и биологической азотфиксации у растений и микроорганизмов, а также в реакциях пуринового обмена в животном организме. Ферменты, содержащие молибден, подразделяются на два основных класса – нитрогеназы и молибдоптериновые ферменты, синтез которых в организмах регулируется генетически (Boll et al., 2005; Brondino et al., 2006; Риш, 2003). Из взаимодействий молибдена с другими химическими элементами наиболее известна сложная конкуренция с медью и сульфатами, а также с вольфрамом (Telfer et al., 2003; Wayne et al., 2007; Ermakov et al., 2011).
Одним из ферментов, где молибден включается в активный птериновый центр является ксантиноксидаза (Сумбаев и др., 2001; Бедина и др., 2019). На молекулярном уровне молибден и медь конкурируют за активный центр в ксантиноксидазе (КСО) – EC 1.1.3.22 (Ball et al., 2005). Существуют данные об антагонизме молибдена и вольфрама при действии их на активность КСО (Brondino et al., 2006; Ermakov et al., 2011). Полагают, что в период дефицита кислорода в начальной биосфере вольфрам широко использовался микроорганизмами, но в последующем в кислородной атмосфере многие организмы утратили использование вольфрама в каталитических процессах (Федонкин, 2003). Тем не менее, существует группа термофильных бактерий, где вольфрам-содержащие ферменты играют важную роль в их жизнедеятельности (Boll et al., 2005). Оказалось, что изоферментный спектр энзима в различных биогеохимических провинциях меняется, а в условиях избытка меди появлялась КСО, содержащая медь. При этом степень замещения молибдена медью зависела от концентрации металлов в рационе животных и среде (Kovalsky et al., 1974).
Максимально допустимый уровень молибдена в пастбищных растениях и кормах животных составляет 5 мг/кг сухого вещества. Разработаны биогеохимические критерии оценки экологического состояния территорий по молибдену. Критическими концентрациями молибдена в растениях являются (в мг/кг) 1–3 (относительно удовлетворительное состояние); <0.5–1.0 и >3–10 (риск) (Критерии, 1992). При этом существенное влияние на метаболизм молибдена в организме жвачных животных оказывает конкурентное взаимодействие меди и серы (Anke et al., 2010; Дженбаев, 2009). Выявлены биогеохимические провинции с избытком молибдена в среде, где среди населения распространена особая форма эндемической подагры, а у животных диагностирован “молибденозис” – хронический молибденовый токсикоз (Kovalsky et al., 1974).
Принимая во внимание сложный характер взаимодействия микроэлементов в биогеохимических циклах и организмах, представляло интерес изучение биогенной миграции молибдена и других микроэлементов в экстремальных геохимических условиях. Цель данной работы состояла в выявлении особенностей биогенной миграции молибдена в бассейне р. Баксан и связи уровней содержания металлов с активностью Mo-содержащих ферментов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Район работ
Биогеохимические исследования проводились в бассейне р. Баксан (Кабардино-Балкарская республика РФ) в июле 2003, 2009 и 2919 гг. Географические координаты района работ: 43°16′23″ N. 42°26′41″ E (гора Эльбрус) – 43°43′52″ N. 44°03′43″ E (устье реки, впадение в р. Малка).
Основная часть исследуемой территории находится на высоте от 200 до 2000 м над уровнем моря. По ландшафтно-геохимическим особенностям бассейн р. Баксан протяженностью 169 км подразделяется на четыре участка: 1 – степная зона (г. Прохладный), 2 – предгорная зона (г. Баксан), горнорудная зона с техногенным загрязнением (г. Тырныауз) и высокогорная (п. Верхний Баксан (Ашабоков и др., 2005).
Основные объекты исследований – г. Тырныауз и прилегающие к нему территории с различной степенью техногенного загрязнения в результате миграции складированных отходов бывшего Тырныаузского W-Mo комбината (ТВМК). Тырныа́узское месторожде́ние W-Mo руд, оценивалось как крупнейшее в РФ по запасам W. Оно открыто в 1934 г., разрабатывалось с 1940 г. (до 1968 г. подземным, затем комбинированным способом), добыча остановлена по экономич. причинам. Месторождение приурочено к Пшекиш-Tырныаузской шовной зоне в пределах складчато-покровной системы Большого Кавказа, сложенной вулканогенными, терригенными и карбонатными сильно метаморфизованными породами среднего палеозоя и нижней юры, смятыми в сложную складчатую структуру и прорванными в мезокайнозойское время интрузиями гранитоидов. Промышленный тип месторождения пластообразный (скарновый). Минеральный тип руд – шеелит-молибденитовый с содержанием Mo (0.03–0.2%), W (до 0.8%), Cu (до 0.3%). Сопутствующие компоненты – Bi, Se, Tl, Au, Ag (Молибденовые руды, 2007). Главные рудные минералы: шеелит, молибденит, молибдошеелит; второстепенные – магнетит, пирротин, халькопирит, сфалерит, висмутин.
Оставшиеся запасы WO3 568.91 тыс. т (36.3% балансовых запасов РФ), среднее содержание в руде WO3 0.16%; запасы Mo 143.7 тыс. т (6.9% балансовых запасов РФ), ср. содержание Mo в руде 0.041%; руды содержат также медь и висмут. В результате полувековой активности ТВМК складировано около 106 млн. т отходов в двух хвостохранилищах. В гипергенных условиях происходит трансформация отходов и формы миграции рудных и сопутствующих химических элементов, а ТВМК с его отходами рассматривается как одно из техногенных месторождений (Винокуров и др., 2018). Основными источниками загрязнения бассейна р. Баксан являются выветриваемые складированные твердые отходы ТВМК, миграция металлов с водами ручьев Малый и Большой Мукулан с основного карьера, поступление металлов с притоками р. Баксан (Камыксу, Герхожансу, Гижгит). При этом среднемноголетний объём стока р. Баксан равен 1.073 км3/год, максимальный расход воды – 275 м3/с, а ее средняя мутность достигает 2–3 кг/м3. Кроме того, миграция терригенного вещества резко усиливается в результате селей, лавин, оползней и землетрясений (Винокуров, 2018).
Отбор материала
Отбор проб воды и биогеохимического материала осуществлялся на 32 точках наблюдений, включая фоновые территории (Эльбрус, Верхний Баксан, г. Прохладный, с. Солдатское, с. Чегем) и загрязненные техногенные участки (Тырныауз – Былым), область разгрузки (г. Баксан) (рис. 1). Образцы талых вод отбирали на подъемных станциях 1–3 и у подножия вершин Эльбруса.
Отбор проб воды и речного аллювия проводился по общепринятой гидрогеохимической методологии. Измерение pH, Eh и общей минерализации проводили непосредственно в полевых условиях, используя аттестованные приборы (pH-метр MP 230, кондуктометр MC 126). Во всех пробах после фильтрования измеряли взвешенную часть (осадок на фильтре). При биогеохимическом опробовании ландшафтов применяли метод сопряженных тестовых участков (площадок) с отбором горных пород, почв и растений, а в пределах населенного пункта – проб волосяного покрова, крови и молока крупного рогатого скота. Метод включал в себя выбор типичного ландшафта – участка площадью 100 м2. При взятии проб почвы используя технику диагонального опробования. В центре все травянистые (луговые) растения были скошены с участка площадью 1 м2. Затем отбирали почву с верхнего гумусового горизонта А (0–15 см) или из отдельных горизонтов почвенного разреза. Образцы почв и растений высушивали при комнатной температуре, почвы просеивали через сито с отверстиями <1 мм, а растения измельчали с помощью титановых ножниц. Для аналитических целей почву растирали до размера зерна в 200 меш. Кроме того, проводили описание ландшафтов по всей протяженности р. Баксан и качественно оценивали вклад техногенных и природных факторов в возможное изменение минеральной компоненты вод реки. Молоко и пахта были предоставлены жителями п. Заюково, с. Былым, г. Тырныауз, г. Баксан и г. Прохладный.
Методы анализа
После фильтрования проводили общий гидрохимический анализ проб воды, а микроэлементы определяли на атомно-абсорбционном спектрометре “КВАНТ-Z.ЭТА” с зееменовской коррекцией фона без предварительного концентрирования. Почвы минерализовали смесью фтористоводородной, азотной и хлорной кислотами в стеклоуглеродных тиглях, а растения – смесью азотной и хлорной кислот. При определении селена использовали спектрофлуориметрический метод (Ермаков и др., 2010). При одновременном количественном измерении концентраций W, Mo, Cu и Re применяли ИСП-масс-спектральный метод. В этом случае использовали квадрупольный масс-спектрометр с индуктивно связанной плазмой (МС-ИСП) X Series II (Thermo Scientific, Германия), снабженным концентрическим распылителем и кварцевой циклонной распылительной камерой, охлаждаемой элементом Пельтье (2°С). В качестве плазмообразующего газа использовали аргон высокой чистоты 99.998%. Мощность плазмы составляла 1400 Вт, cкорость плазмообразующего потока аргона – 13 л/мин, скорость вспомогательного потока аргона – 1.15 л/мин, скорость распылительного потока аргона – 0.88 л/мин, глубина плазмоотбора – 105 отн. ед., скорость подачи раствора в плазму 1 мл/мин, температура в распылительной камере – 2°C, уровень CeO+/Ce+ < 2%, уровень Ba2+/Ba+ < 3%. Для контроля дрейфа сигнала и учета погрешности анализа в ходе обработки результатов в качестве внутреннего стандарта использовали индий, который добавляли в исследуемые растворы из расчета концентрации 10 мкг/л. Градуировочные зависимости элементов определяли, используя стандартные растворы, изготовленные High-Purity Standards (США): Trace Elements in Drinking Water Standard CRM-TMDW (26 элементов), Trace Elements in Drinking Water Standard-B CRM-TMDW-B (29 элементов), 68 Element Standards ICP-MS-68A (Solution A и Solution B). Расчет содержаний элементов в анализируемых растворах проводили с использованием программного обеспечения спектрометра PlasmaLab и программы Microsoft Access. Стандартными образцами служили также почвы: СДПС-1, ССК-3, СЧТ-3, растения: травозлаковая смесь ГСО СОРМ1Б, а также стандарты волос CRM NCS DS 73347 и CRM 397.
Выделение и определение активности КСО молока проводили по методу (Gilbert, Berge, 1964; Цой, 1974). Использовали фермент, выделенный из сливок (пахта). Ряд фракций фермента был очищен посредством жидкостной хроматографии на сорбенте TSKGEL HW–65F и проанализирован на содержание белка, активность фермента КСО и содержание металлов. Определение активности КСО молока проводили по известному спектрофотометрическому методу – окислению ксантина в гипоксантин (увеличение абсорбции при 295 нм) (Gilbert, Bergel, 1964; Цой, 1974) на спектрофотометре СФ-320 (Хитачи) в кюветах с длиной светового пути 1 см в течение 10 мин после добавления раствора ксантина. Объем среды – 3 мл. Определение флавинадениндинуклеотида (ФАД) проводили посредством ВЭЖХ, используя колонку Jupiter (0.45 × 15 см) и хроматограф со спектрофлуориметрическим детектором RF-530 (Shimadzu). Возбуждающий свет с максимумом при длине волны 450 нм; максимум флуоресцентного света при 525 нм. Использовали кислый элюент, содержащий уксусную кислоту, ацетонитрил (pH 3.0) c добавкой органического основания, расход – 0.75 мл/мин. В качестве стандарта использовали рибофлавин и его производные. Экстракт или раствор КСО обрабатывали 11%‑ной трихлоруксусной кислотой и после центрифугирования 20 мкл надосадочной жидкости инъецировали непосредственно в камеру ввода образца. Активность ксантин-дегидрогеназы в свежем молоке коров измеряли по методу (Шидловская, 2006).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химический состав талых вод Эльбруса и реки Баксан
Талые снеговые и ледниковые воды в пределах подъемных станций Эльбруса являются слабо кислыми с pH от 5.4 до 6.05, умеренно минерализованы (12–30 мг/л) Содержание сульфатов и хлоридов изменяется от 2.8 до 15.2 мг/л $\left( {{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}} \right)$ и от 3.5 до 14.2 мг/л (Cl–). Общая жесткость не превышает 1.2 мг-экв/л. Содержание кальция м магния составляет 1–6 мг/л (Ca2+) и 1–10.9 мг/л (Mg2+) (табл. 1). Как правило, концентрации Mg меньше содержания Ca, но в пробе снеговой воды с высоким содержанием взвешенных веществ концентрация Ca оказалась ниже концентрации Mg (6.0 и 10.9 мг/л, соответственно), что связано с взаимодействием тающего льда с вулканическими породами и возможным сходом рыхлого выветренного материала. Этот образец ледовой воды отличается повышенной минерализацией и концентрацией хлорид-иона. Уровень содержания Na и K варьирует от 1.5 до 5.0 мг/л (Na) и от 1.6 до 2.2 мг/л (K). В водах от таяния снега и льда обнаружен йод – от 0.4 до 1.2 мкг/л, что согласуется с данными других авторов (Anke, 2004). При этом обращает внимание высокий уровень содержания селена. Так, в снеговой воде, отобранной на высоте 3600 м под вершинами Эльбруса обнаружено селена 1166 нг/л. Это в 5–6 раз выше по сравнению с речной водой. По-видимому, селен, как и йод, привносятся с атмосферными аэрозолями. Однако нельзя исключать поступление селена с вулканическими флюидами. Начиная с 3-ей станции (высота 2285 м), значение всех химических компонентов возрастает и еще более увеличивается в истоке р. Баксан (п. Эльбрус, высота 1738 м).
Таблица 1.
Химический состав воды р. Баксан и талых вод Эльбруса
| Место отбора пробы, высота (м) |
M, мг/л |
pH | HC${\text{O}}_{3}^{ - }$, мг/л |
CO2, мг/л |
S${\text{O}}_{4}^{{2 - }}$, мг/л |
Cl–, мг/л |
F–, мг/л |
Na+, мг/л |
K+, мг/л |
О.Ж., мг-э/л |
Ca2+, мг/л |
Mg2+, мг/л |
Sr, мкг/л |
Se, нг/л |
I, мкг/л |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Эльбрус, верх, свежий снег; 3600 | 14 | 5.35 | 14 | 28.0 | 4.0 | 3.5 | 0.23 | 2.0 | 2.5 | 0.1 | 1.0 | 0.6 | 17 | 1166 | 0.4 |
| Эльбрус, верх, талые воды; 3031 | 21 | 5.33 | 12 | 2.3 | 15.2 | 3.5 | 0.30 | 1.5 | 1.9 | 0.2 | 1.4 | 1.0 | 30 | 133 | 0.5 |
| Эльбрус, верх, снег “грязный”; 2837 | 30 | 5.41 | 20 | 7.5 | 6.8 | 14.2 | 0.19 | 2.0 | 2.0 | 0.4 | 4.0 | 2.4 | 20 | 3673 | 1.2 |
| Эльбрус 2 станция, талая мутная вода; 2340 | 12 | 5.24 | 12 | 26.0 | 2.8 | 2.1 | 0.32 | 1.6 | 1.6 | 0.2 | 2.0 | 1.2 | 20 | 233 | 0.8 |
| Эльбрус 1 станция, горная ледн. Вода; 2285 | 32 | 6.05 | 24 | 12.1 | 6.0 | 3.5 | 0.50 | 3.0 | 2.0 | 1.2 | 6.0 | 10.9 | 30 | 53 | 0.8 |
| П. Эдьбрус, р. Баксан; 1728 | 46 | 6.37 | 45 | 44.1 | 15.6 | 3.5 | 0.19 | 4.0 | 2.2 | 1.0 | 14.0 | 4.1 | 180 | 160 | 5.1 |
| П. Верхний Баксан, р. Баксан; 1590 | 45 | 7.36 | 45 | 46.2 | 22.7 | 3.6 | 0.40 | 4.0 | 2.6 | 1.1 | 11.7 | 4.9 | 210 | 113 | 6.2 |
| Ручей Большой Мукулан; 1356 | 518 | 6,94 | 118 | 27.3 | 29.2 | 14.8 | 1.00 | 10.0 | 9.0 | 10.8 | 188.4 | 17.0 | 540 | 3900 | 5.7 |
| г. Тырныауз, 500 м вверх по течению р. Баксан; 1278 | 49 | 7.14 | 49 | 31.5 | 15.2 | 3.8 | 0.55 | 4.0 | 2.4 | 1.2 | 14.0 | 6.1 | 160 | 160 | 6.0 |
| Центр г. Тырныауза, р. Баксан; 1244 | 48 | 7.27 | 49 | 35.4 | 17.2 | 8.9 | 0.50 | 4.0 | 1.9 | 1.1 | 12.0 | 6.1 | 170 | 140 | 6.0 |
| С. Былым, р. Баксан; 1021 | 60 | 7.58 | 67 | 43.0 | 15.2 | 11.6 | 0.30 | 4.0 | 2.6 | 1.6 | 17.0 | 9.9 | 180 | 330 | 6.4 |
| С. Жанхотеко, р. Баксан; 740 | 85 | 7.53 | 77 | 39.8 | 27.6 | 8.9 | 0.45 | 5.0 | 3.1 | 1.9 | 22.4 | 9.7 | 190 | 166 | 6.2 |
| С. Заюково р. Баксан; 633 | 98 | 8.05 | 84 | 32.7 | 30.0 | 7.1 | 0.56 | 6.2 | 3.6 | 2.8 | 22.0 | 20.7 | 299 | 210 | 6.6 |
| Р. Баксан, устье; 492 | 110 | 8.15 | 128 | 26.0 | 37.4 | 17.7 | 0.84 | 6.8 | 4.0 | 3.0 | 34.1 | 15.0 | 310 | 220 | 6.5 |
Воды р. Баксан и впадающих в нее ручьев и рек по химическому составу в основном относятся к гидрокарбонат-кальциевому типу. Их отличает низкое содержание кальция (11.7–34 мг/л). Содержание магния составляет 4.1–20.7 мг/л, то есть меньше концентрации кальция. Уровень содержания сульфатов и хлоридов равен 15.2–37.4 мг/л $\left( {{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}} \right)$ и 3.5–17.7 мг/л (С1–). Концентрации йода и селена составляют 5.1–6.6 мкг/л и 113–330 нг/л, соответственно (табл. 1), что характерно для поверхностных вод суши. Практически для всех компонентов проб воды р. Баксан на всем ее протяжении от истока до устья наблюдается увеличение их концентраций, что согласуется с гидрогеохимическими данными. При этом pH изменяется от 6.32 до 8.15, минерализация – от 46 до 110 мг/л, содержание сульфатов – от 15.6 до 37.4 мг/л, хлоридов – от 3.5 до 17.7 мг/л.
Особо следует остановиться на химическом составе воды ручья Большой Мукулан. Ее химический состав резко отличается от состава воды р. Баксан по всем компонентам. Минерализация воды этого ручья достигает 518 мг/л, что на порядок выше минерального остатка проб воды из р. Баксан. В воде ручья также повышено содержание гидрокарбонат-иона, сульфатов, хлоридов, фтора, натрия, калия, общей жесткости, стронция и селена. Содержание кальция достигает 188.4 мг/л, что в 10 раз выше концентрации магния. Повышенное содержание минеральных веществ в воде ручья Большой Мукулан обусловлено взаимодействием потока воды с породами и минералами Высотного и Мукуланского карьеров, где велась добыча W-Mo руд. Ручей протекает через оползневые и селевые отложения, поэтому вода отличается высокой мутностью с высоким содержанием взвешенных веществ, частиц пород и минералов. Однако влияние этого ручья на состав воды в р. Баксан (ее растворимой части) ниже по течению незначительно из-за малого дебита. Однако в период обильных осадков и селевых процессов это влияние может быть заметным.
Изменение концентраций Cu, Mo и W в воде р. Баксан отражено на рис. 2.
Рис. 2.
1 – под Эльбрусом, р. Баксан мутная (устье реки); 2 – пос. Эльбрус, р. Баксан; 3 – п. Верхний Баксан, р. Баксан; 4 – р. Баксан, выше ручья Большой Мукулан; 5 – ручей Большой Мукулан; 6 – 500 м западнее г. Тырныауза, р. Баксан; 7 – центр г. Тырныауза, р. Баксан; 8 – с. Былым, р. Баксан; 9 – с. Жанхотеко, р. Баксан; 10 – с. Заюково, р. Баксан; 11 – с. Исламей, р. Баксан; 12 – г. Баксан, р. Баксан; 13 – устье р. Баксан.
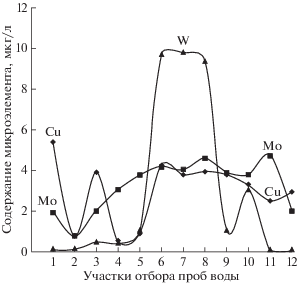
Здесь приведены средние концентрации по анализам трех партий проб. Нетрудно заметить, что в отфильтрованной воде концентрации Mo не превышают 10 мкг/л. Содержание Cu в воде истока реки максимально и достигает 5.8 мкг/л, что, по-видимому, связано с породами, обогащенными этим микроэлементом. Это отмечают и другие авторы (Дреева и др., 2019). Слабый максимум по Cu обнаружен в воде после впадения ручья Большой Мукулан в Баксан. Затем концентрации Cu монотонно нарастают и остаются повышенными до 4.0–4.5 мкг/л на протяжении всей длины реки. Аналогичным образом изменяются концентрации Mo. Его среднее содержание не превышает 4.6 мкг/л. Содержание вольфрама резко нарастает на участке Тырныауз-Былым, достигая максимума до 9–10 мкг/л. Это связано с впадением ручьев по правобережью р. Баксан, имеющих контакт с промышленной зоной. Прежде всего, это ручьи, контактирующие с трубопроводом пульпы ТВМК, хвостохранилищем и водотоком.
Следует отметить, что при выходе р. Баксан на равнину уменьшается только содержание W. Концентрации Mo и Cu остаются повышенными для этого типа вод. На основании обнаружения металлов во фракциях воды, пропущенной через мембрану с отверстием пор <25 нм сделано, заключение о том, что металлы мигрируют с водой в ионной форме (Винокуров и др., 2018). Это согласуется с данными Л.П. Чечель (2009).
Полученные данные отличаются от результатов других исследователей (Дреева и др., 2018). Различия обусловлены особенностями отбора проб воды и подготовкой их к анализу (отбор проб в разные сезоны года, фильтрование через фильтр с отверстием пор <45 нм, анализ без добавления кислот). Содержание же металлов во взвеси превосходит их содержание в растворе на один-два порядка (Винокуров и др., 2018).
В пробах воды р. Баксан и ее левых притоков на участке Тырныауз-Былым обнаружен рений. Он присутствует в воде, взятой из трубопровода с минерализацией 306 мг/л – 0.54 мкг/л. В других ручьях и р. Камыксу содержание рения составляет 0.19–0.55 мкг/л, что выше фона в 10–50 раз.
ПДК меди, молибдена и вольфрама в питьевых водах равны 1.00; 0.25 и 0.05 мг/л (Надеенко и др., 1977). ПДК молибдена и вольфрама в воде водных объектов рыбохозяйственного значения равны: Mo и Cu – 1 мкг/л, W – 0.8 мкг/л (СанПин, 2018). Таким образом, содержание металлов в отфильтрованной части воды р. Баксан не превышает гигиенических нормативов по питьевым водам, но превышает нормативы по критериям токсичности металлов в воде водных объектов рыбохозяйственного назначения. В этом случае превышение по W характерно только для воды р. Баксан на отрезке реки Тырныауз-Былым. Однако, существующие санитарно-гигиенические нормативы нуждаются в региональном и субрегиональном ранжировании (Моисеенко и др., 2018).
Mo, Cu и W в поченно-растительном комплексе
Почвенный покров бассейна реки Баксан разнообразен, что связано с высотной зональностью и сложной структурой ландшафтов. В верховьях Эльбруса преобладают горно-тундровые и щебнистые почвы на вулканических породах. В устье р. Баксан и в альпийском поясе распространены горно-луговые почв. Ниже распространены горно-коричневые и горно-луговые почвы. По берегам р. Баксан встречаются лугово-аллювиальные и аллювиальные почвы. В средней части бассейна р. Баксан распространены горно-степные, дерново-луговые почвы, а также черноземы.
Почвообразующие породы фоновых территорий (Эльбрус, В. Баксан, Заюково) не обогащены Mo, W и Cu. Концентрации молибдена и вольфрама в образцах гранита зернистого, туфобрекчий, дацита и риодацита изменялись в пределах 2–3 мг/кг (Mo) и 2–4 мг/кг (W). Содержание меди, как правило, не превышало 10 мг/кг.
В табл. 2 приведены данные по содержанию Mo, W и Cu в почвах бассейна р. Баксан от истока до устья. Концентрации Mo и W в районе Эльбруса являются фоновыми и соответствуют их средним содержаниям в верхней части литосферы (Григорьев, 2009). Содержание Cu также является фоновым, но не достигает типичного для почв мира значения 25–30 мг/кг. Уровень содержания Cu увеличивается на участках, высоко аномальных по W и Mo. Это луговые почвы около р. Большой и Малый Мукулан, в районе хвостохранилищ (Тырныауз, Былым). Левобережье р. Баксан в пределах г. Тырныауза и с. Былым представляет собой техногенно-геохимическую аномалию с очень высоким содержанием W и Mo в среде. Кроме того, почвы этих территорий в ряде случаев обогащены мышьяком (до 60–80 мг/кг) и свинцом (до 150 мг/кг). Прежде всего, это участки под трубопроводом для транспортировки пульпы, отвалы и хвостохранилища отходов, расположенные по левому берегу р. Баксан. На правом берегу реки редко встречаются участки с высоким содержанием металлов, например, в городском парке и западнее города, напротив высокогорного рудного карьера.
Таблица 2.
Концентрации и соотношения Mo, W и Cu в почвах бассейна р. Баксан (мг/кг сухого вещества)
| Место отбора, № участка | Тип почвы | Mo | W | Cu | Mo : W : Cu |
|---|---|---|---|---|---|
| 1. Эльбрус, 2 станция | Коллювий | 1.5 | 1.3 | 10.8 | 1 : 0.9 : 7.2 |
| 2. Эльбрус, 2 станция | Щебнистая горно-тундровая | 3.2 | 8.4 | 23.1 | 1 : 2.6 : 1.7 |
| 3. Эльбрус, 1 станция | Горно-луговая | 3.7 | 3.7 | 16.3 | 1 : 1 : 4.4 |
| 4. У основания Эльбруса | Горно-луговая | 3.2 | 4.0 | 17.1 | 1 : 1.3 : 5.3 |
| 5. П. Эльбрус | Горно-луговая | 3.8 | 6.2 | 6.8 | 1 : 1.6 : 1.8 |
| 6. П. Верхний Баксан | Горная степная | 2.9 | 0.9 | 9.7 | 1 : 0.3 : 3.3 |
| 7. П. Верхний Баксан | Горно-луговая | 2.4 | 2.4 | 10.3 | 1 : 1 : 4.3 |
| 8. М. Мукулан | Аллювиальная | 50.6 | 67.1 | 13.4 | 1 : 1.3 : 0.3 |
| 9. М. Мукулан | Горно-коричневая | 68.6 | 55.8 | 9.9 | 1 : 0.8 : 0.1 |
| 10. Б. Мукулан | Горно-коричневая | 125.2 | 102.6 | 10 | 1 : 0.8 : 0.1 |
| 11. В 1.5 км восточнее Б. Мукулана | Горно-коричневая | 50.4 | 57.1 | 13.6 | 1 : 1.1 : 0.3 |
| 12. У ручья за дачными участками в г. Тырныаузе | Горно-луговая | 9.8 | 14.8 | 10.9 | 1 : 1.5 : 1.1 |
| 13. Там же, на берегу ручья. | Лугово-аллювиальная | 62.2 | 99.0 | 31.3 | 1 : 1.6 : 0.5 |
| 14. Правый берег ручья. Выше бывшей фабрики в г. Тырныаузе | Аллювиальная | 16.8 | 42.6 | 31 | 1 : 3.9 : 1.8 |
| 15. Левый берег р. Герхожансу в г. Тырныаузе | Лугово-аллювиальная | 6.5 | 8.9 | 10 | 1 : 1.4 : 1.5 |
| 16. Тырныауз, под фабрикой | Почво-грунт | 4.9 | 9.6 | 4.9 | 1 : 2.0 : 1.0 |
| 17. Тырныауз, парк | Дерновая | 276 | 211 | 36 | 1 : 1 : 5.3 |
| 18. 1 км западнее Тырныауза | Дерново-луговая | 276.0 | 211.5 | 36.0 | 1 : 0.8 : 0.1 |
| 19. С. Былым, у хвостохранилища | Лугово-аллювиальная | 396.2 | 598.1 | 20.8 | 1 : 1.5 : 0.1 |
| 20. Тырныауз, подъем к ГОКу | Почва с пульпой | 315 | 339 | 30.6 | 1 : 1.1 : 0.1 |
| 21. 1-е Хвостоханилище | Пульпа | 341 | 511 | 63 | 1 : 1.5 : 0.2 |
| 22. Бывшее х-ще, в 1 км от Тырныауза к Былыму | Горная, техногенно преобразованная |
117.2 | 246.3 | 70.5 | 1 : 2.1 : 0.6 |
| 23. С. Былым, горный луг | Горно-степная, выпас скота | 64.7 | 232.6 | 36.7 | 1 : 3.6 : 0.6 |
| 24. С. Былым | Чернозем (огород) | 4.5 | 7.6 | 19.8 | 1 : 1.7 : 2.6 |
| 25. С. Былым | Горно-степная | 62.2 | 99.0 | 21 | 1 : 1.6 : 0.3 |
| 26. С. Бедык | Чернозем | 12.6 | 12.3 | 28.4 | 1 : 1.0 : 2.3 |
| 27. С. Бедык | Чернозем | 12.6 | 12.3 | 28 | 1 : 1.0 : 2.2 |
| 28. C. Жанхотеко | Дерново-луговая | 2.8 | 2.7 | 10.3 | 1 : 1.0 : 3.7 |
| 29. С. Жанхотеко | Дерново-луговая | 3.4 | 4.3 | 17.0 | 1 : 1.3 : 5.0 |
| 30. С. Заюково | Лугово-аллювиальная | 1.3 | 1.1 | 7.2 | 1 : 0.8 : 5.5 |
| 31. С. Заюково | Дерново-луговая | 3.2 | 8.1 | 23.4 | 1 : 2 5: 7.3 |
| 32. Устье р. Баксан | Аллювиальная | 2.3 | 3.0 | 15.0 | 1 : 1.3 : 6.5 |
Следует заметить, что пульпа бывшего ТВМК характеризуется высоким содержанием W, Mo и в ряде случаев, – Cu. Их средние концентрации составляют: 341 (Mo) и 511 (W) мг/кг. В некоторых образцах пульпы содержание металлов достигает 1000 мг/кг, то есть 0.1%. Поэтому хвостохранилища пульпы и отходов ТВМК рассматриваются как техногенные месторождения (Винокуров и др., 2018). При этом практически во всех случаях W преобладает над Mo; соотношение Mo : W 1 : 1.5–1 : 2 наиболее типично.
Изменение концентраций металлов в почвах по профилю р. Баксан отражено на рис. 3.
Рис. 3.
Изменение концентраций Mo, W и Cu в почвах по профилю р. Баксан Номер участка приведен в табл. 2.
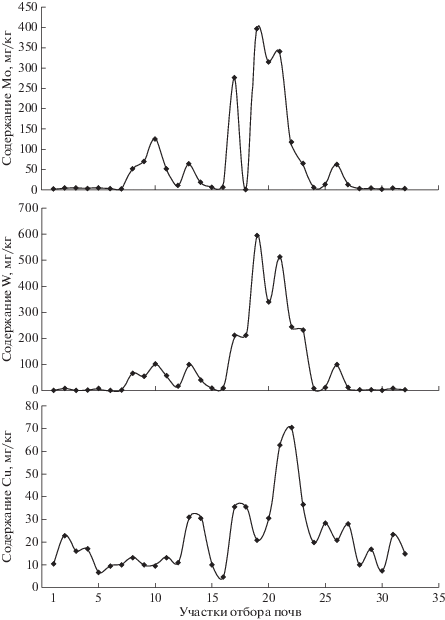
Концентрации Mo и W имеют определенный максимум, начиная с участков р. Малого и Большого Мукулана и продолжаясь на отрезке Тырныауз-Былым. Затем содержание металлов резко снижается в предгорной и степной зонах. Для меди максимальные концентрации в почвах наблюдаются в пределах хвостохранилищ, расположенных за пределами г. Тырныауза и в районе с. Былым на левом берегу р. Баксан.
При сравнении концентраций Mo с содержанием W и Cu в почвах установлена определенная положительная корреляция: для связи Mo–W коэффициент корреляции r = + 0.944; для связи Mo–Cu r = +0.506 и для связи Cu–W – r = +0.611.
Содержание металлов в речном аллювии
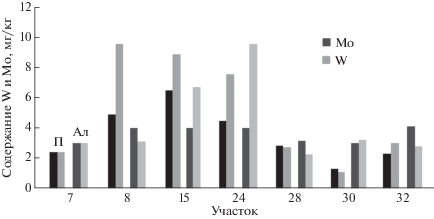
На рис. 4 показано изменение концентраций Mo и W в ряде лугово-аллювиальных почв в сравнении с содержанием металлов в аллювии р. Баксан. Уровень содержания металлов в почвах и аллювии коррелирует. Как и в случае почвенного профиля, он становится максимальным на участке Тырныауз-Былым, затем уменьшается практически до фонового уровня. Тем не менее, концентрации металлов, в особенности молибдена, могут быть повышены при внесении речных осадков из отстойника Баксанской ГЭС в почвы сельскохозяйственных угодий.
Рис. 4.
Сравнительное содержание Mo и W в речном аллювии р. Баксан и лугово-аллювиальных почвах. П – почва, А – аллювий. Номер участка отражен в табл. 2.
Mo, W и Cu в растениях
Содержание микроэлементов в отдельных растениях и укосах оценивалось нами прежде в 2003, 2009 и 2011 гг. (Ermakov et al., 2011). Варьирование концентраций микроэлементов в растениях бассейна р. Баксан представлено в табл. 3.
Таблица 3.
Содержание микроэлементов в укосах травянистых растений долины р. Баксан (в мг/кг сухого вещества)
| Участок | Cu | Zn | Pb | Cd | Ni | Se | Co | As | Mn | Fe | Sr | Mo | W |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Эльбрус | |||||||||||||
| 1 | 11.4 | 116.7 | 11.1 | 0.66 | 59.9 | 0.03 | 2.54 | 0.1 | 62.7 | 166 | 21.0 | 1.13 | 0.21 |
| 2 | 9.9 | 87.0 | 11.7 | 10.30 | 44.5 | 0.03 | 1.43 | 0.45 | 26.1 | 55 | 28.3 | 0.60 | 0.26 |
| 3 | 11.1 | 76.5 | 1.0 | 0.18 | 13.3 | 0.06 | 0.86 | 0.08 | 87.6 | 80 | 21.5 | 0.38 | 0.15 |
| 5 | 12.6 | 75.0 | 0.8 | 0.33 | 1.8 | 0.07 | 1.35 | 0.08 | 18.6 | 50 | 45.4 | 1.12 | 0.32 |
| Верхний Баксан | |||||||||||||
| 7 | 7.4 | 34.2 | 4.8 | 0.12 | 0.8 | 0.13 | 0.26 | 1.31 | 100.5 | 21 | 21.9 | 1.94 | 0.46 |
| Большой Мукулан | |||||||||||||
| 10 | 23.4 | 80.4 | 0.7 | 0.12 | 54.2 | 0.12 | 2.36 | 0.72 | 52.8 | 350 | 36.1 | 4.37 | 3.80 |
| 1.5 км восточнее Большого Мукулана | |||||||||||||
| 11 | 26.4 | 103.8 | 1.3 | 1.59 | 99.5 | 0.13 | 7.36 | 1.72 | 29.8 | 362 | 15.4 | 10.07 | 6.32 |
| Тырныауз, парк | |||||||||||||
| 17 | 15.9 | 88.2 | 13.2 | 15.1 | 18.0 | 0.13 | 3.36 | 1.56 | 32.4 | 280 | 13.8 | 16.74 | 6.18 |
| Тырныауз, фабрика | |||||||||||||
| 16 | 7.0 | 54.3 | 4.5 | 0.50 | 19.2 | 0.07 | 2.33 | 0.43 | 24.9 | 228 | 15.4 | 31.90 | 26.9 |
| Былым | |||||||||||||
| 25 | 6.4 | 37.0 | 2.0 | 0.27 | 14.0 | 0.08 | 0.20 | 0.95 | 38.0 | 242 | 15.0 | 31.00 | 12.8 |
| Заюково | |||||||||||||
| 31 | 3.0 | 12.5 | 0.1 | 0.05 | 0.9 | 0.08 | 0.03 | 0.12 | 19.0 | 342 | 16.6 | 1.36 | 0.24 |
Обращает внимание сравнительно низкое содержание в растениях Cu и Se – жизненно важных микроэлементов. Концентрации Fe, напротив, очень высокие (до 342 мг/кг), что может быть связано с эоловым загрязнением. Уровень содержания молибдена и вольфрама повышен в пробах укосов из Тырныауза и Былыма (до 31 мг/кг – Mo и до 12 мг/кг – W). Тем не менее, укосы с лугов около хвостохранилищ характеризуются токсичными для животных концентрациями металлов, достигая иногда 64.5 (Mo) и 33 (W) мг/кг. При этом аккумулирование вольфрама значительно ниже, чем молибдена, что характерно для рудопроявлений с высоким содержанием W (Смирнов, Юргенсон, 2008).
Mo, W и Cu в организме животных
При биогеохимических исследованиях W-Mo рудных ландшафтов Северного Кавказа установлено не только аккумулирование металлов почвами, но и пастбищными растениями (табл. 3 и 4). Концентрации Fe и Cu в растениях отдельных территорий не имели резких отличий. Однако по содержанию Mo и W отличия весьма существенны. Наиболее интенсивно W и Mo аккумулируются в пределах рудной аномалии (Тырныауз, Былым) Обнаружено также повышенное аккумулирование Re растениями в пределах Тырныаузского месторождения.
Таблица 4.
Содержание металлов в растениях пастбищ бассейна р. Баксан (в мг/кг сухого вещества, в скобках – число образцов)
| Место отбора проб | Fe | Cu | Mo | W | Re |
|---|---|---|---|---|---|
| Верхний Баксан (5) | 21–120 | 3.3–7.4 | 0.32–1.94 | 0.01–0.05 | 0.0016–0.0039 |
| Тырныауз (16) | 228–500 | 7.0–15.9 | 1.2–31.9 | 0.8–26.9 | 0.023–0.054 |
| Былым (21) | 242–538 | 6.4–12.1 | 7.0–31.0 | 1.0–12.8 | 0.011–0.130 |
| Заюково (5) | 234–392 | 3.0–11.4 | 0.5–2.2 | 0.03–0.24 | 0.0010–0.0018 |
| Баксан (7) | 218–624 | 5.0–12.0 | 0.2–2.8 | 0.02–0.20 | 0.0021–0.0037 |
| Прохладный (5) | 242–832 | 3.0–10.2 | 0.7–2.9 | 0.09–0.28 | 0.0011–0.0030 |
Указанные металлы обнаружены как в молоке коров, так и в пахте (табл. 5). Их содержание в пахте увеличивалось в 5–10 раз.
Таблица 5.
Среднее содержание железа, меди, молибдена и вольфрама в молоке и пахте животных (мкг/л)
| Место oтбора | Молоко | Пахта | ||||||
|---|---|---|---|---|---|---|---|---|
| Fe | Cu | Mo | W | Fe | Cu | Mo | W | |
| В. Баксан | 28 | 13 | 20 | 0.1 | 114 | 130 | 320 | 0.3 |
| Тырныауз | 56 | 60 | 56 | 0.50 | 112 | 684 | 556 | 4.3 |
| Былым | 44 | 52 | 42 | 0.22 | 82 | 210 | 374 | 2.0 |
| Заюково | 39 | 12 | 14 | 0.08 | 98 | 148 | 189 | 0.2 |
| Баксан | 32 | 13 | 8 | 0.05 | 84 | 130 | 93 | 0.4 |
| Прохладный | 39 | 12 | 14 | 0.08 | 102 | 148 | 189 | 0.1 |
Используя известные методы выделения КСО из пахты (Gilbert. Bergel, 1964; Цой, 1974), были получены очищенные фракции фермента с параметрами, свойственными для КСО молока (табл. 6).
Таблица 6.
Сравнительный химический состав КСО молока коров из различных местообитаний животных (мкг/мг белка)
| Местообитание животных | ФАД | Fe | Mo | Cu | W | Re |
|---|---|---|---|---|---|---|
| Сибай* | 0.70 | 0.26 | 0.12 | 0.02 | – | – |
| Армения* | 1.20 | 0.40 | 0.40 | <0.01 | – | – |
| Кудиново | 1.15 | 0.44 | 0.31 | 0.03 | 0.002 | 0.0004 |
| Заюково | 1.50 | 0.64 | 0.47 | 0.06 | 0.005 | 0.0004 |
| Былым | 0.80 | 0.60 | 0.44 | 0.01 | 0.010 | 0.0005 |
| Тырныауз | 0.80 | 0.56 | 0.60 | 0.03 | 0.012 | 0.0006 |
Оказалось, что обогащенные ферментные фракции содержали не только Fe, Mo и Cu, но также следы вольфрама и рения. Содержание W в ферменте значительно меньше, чем Mo, но оно практически сравнимо с количеством Cu. Представляет интерес наличие во фракциях КСО ультрамикроэлемента Re. Его концентрации на 1–2 порядка меньше, чем Cu и Mo.
Ряд биохимических параметров животных приведен в табл. 7. Сравнение концентраций микроэлементов в молоке и пахте с активностью КСО и КДГ позволило выявить определенную связь между концентрациями W в молоке и пахте и ферментативной активность (r = –1 в обоих случаях). Железо усиливало активность КДГ. Для Cu, Mo и W отмечалась тенденция к угнетению активности КСО.
Таблица 7.
Биохимические параметры биосред крупного рогатого скота
| Параметр | Тырныауз (n = 6) | Былым (n = 7) | R* |
|---|---|---|---|
| Кровь | |||
| Гемоглобин, г/л (минимум–максимум) |
125.4 ± 8.5 (104.3–151.6) |
112.7 ± 8.4 (85.1–139.8) |
91–125 |
| Глутатионпероксидаза, ед/г Hb/мин (минимум–максимум) |
235 ± 36 (166–313) |
243 ± 23 (168–344) |
221–498 |
| Дегидратаза δ-аминолевулиновой кислоты, ед (минимум–максимум) |
0.06 ± 0.01 (0.04–0.10) |
0.11 ± 0.02 (0.08–0.16) |
0.13–0.86 |
| Мочевина (плазма), мМоль/л (минимум–максимум) |
6.63 ± 0.82 (4.15–8.74) |
5.82 ± 0.89 (2.64–10.17) |
4.80–6.20 |
| Мочевая кислота, мкг/мл (плазма) (минимум–максимум) |
85.3 ± 8.3 (67.4–125.3) |
97.7 ± 14.9 (77.3–128.0) |
12–120 |
| Селен в цельной крови, мкг/л (минимум–максимум) |
74 ± 8 (57–96) |
79 ± 5 (53–94) |
100–150 |
| Медь, мкг/л (минимум–максимум) |
446 ± 135 (192–640) |
480 ± 123 (291–792) |
900–1100 |
| Молибден, мкг/л (минимум–максимум) |
35.5 ± 10.6 (16.1–61.0) |
40.9 ± 10.6 (18.2–73.9) |
5–15 |
| Вольфрам, мкг/л (минимум–максимум) |
2.7 ± 0.9 (1.4–3.5) |
2.3 ± 1.0 (1.3–3.7) |
0.05–1.0 |
| Волосяной покров | |||
| Медь, мг/кг (минимум–максимум) | 6.2 ± 1.0 (4.0–8.2) |
7.8 ± 1.1 (5.4–10.4) |
7–10 |
| Молибден, мг/кг (минимум–максимум) | 1.3 ± 0.6 (0.6–2.8) |
1.0 ± 0.4 (0.5–2.1) |
0.1–0.3 |
| Вольфрам, мг/кг (минимум–максимум) | 0.10 ± 0.04 (0.05–0.20) |
0.11± 0.05 (0.06–0.21) |
0.01–0.05 |
| Молоко | |||
| Белок, г/л (минимум–максимум) | 1.79 ± 0.16 (1.44–2.23) |
0.99 ± 0.18 (0.67–1.43) |
2.8–3.6 |
| Активность КСО, ед./мг белка | 1.8 ± 0.5 (1.1–2.8) |
1.5 ± 0.3 (1.1–2.2) |
1.3–3.2 |
| Активность КДГ, ед./мл | 0.6 ± 0.1 (0.5–0.7) |
0.5 ± 0.1 (0.4–0.7) |
0.2–0.6 |
При изучении молибденовых токсикозов животных был отмечен антагонизм между молибденом, медью и серой (сульфатами) (Pan, 1986; Telfer et al., 2003). Антагонизм наиболее четко проявляется в районных с заметным преобладанием Cu над Mo в рационе животных. В бассейне р. Баксан такое взаимодействие также имеет место в наиболее обогащенных металлами рудных и примыкающих к ним территориям (Тырныауз, Былым). Это сказывается на уровне содержания меди и молибдена в растениях, крови и волосяном покрове крупного рогатого скота (табл. 4, 5, 7). Однако полученные данные указывают и на антагонизм молибдена и вольфрама. Это следует из результатов исследований не только почв и пастбищных растений, но и биохимических данных. Результаты исследований согласуется с существующими данными по влиянию вольфрама на развитие молибденового токсикоза в экспериментах на животных, а также в опытах in vitro (Yuldiz, 1988; Ермаков и др., 2016). Тем не менее, следует иметь в виду и особенности рудной минерализации. В условиях медно-молибденовых аномалий более четко проявляется антагонизм между Cu и Mo, что сказывается на активировании ферментной системы КСО-КДГ (Ермаков и др., 2016). В Тырныаузской техногенно-геохимической аномалии медь имеет соподчиненное значение, а в рудах преобладает вольфрам. Его влияние сказывается на активности комплекса КСО-КДГ, а оба микроэлемента (Mo и W) блокируют всасывание меди в организме животных, о чем свидетельствует резкое снижение ее концентраций в крови животных (табл. 7).
В частности, снижение активности дегидратазы δ-аминолевулиновой кислоты и низкое содержание белка в молоке указывают на проявление субтоксикоза. По данным медицинских и ветеринарных специалистов случаи “молибденовой” подагры среди населения практически не зарегистрированы, а среди крупного рогатого скота не выявлено явных признаков “молибденозиса”. По общим показателям заболеваемости населения техногенные территории не отличаются от других районов республики. (Доклад, 2014). Однако среди жителей Баксанского ущелья зарегистрированы случаи эндемического зоба и кретинизма, что может быть связано с дефицитом селена и йода в среде и продуктах питания. А низкое содержание селена в крови животных является фактором риска проявления беломышечной болезни животных. Это заболевание встречается у телят в Эльбрусском районе республики. Кроме того, в пределах территорий, граничащих с хвостохранилищами и карьером, растения и водоисточники в ряде случаев обогащены никелем, свинцом и мышьяком.
ЗАКЛЮЧЕНИЕ
При биогеохимческом исследовании W-Mo рудных ландшафтов и относительно фоновых территорий установлено аккумулирование не только молибдена и меди, но также вольфрама и рения в почвах, речном аллювии, растениях, молоке, крови и волосяном покрове крупного рогатого скота. При увеличении уровня содержания молибдена и вольфрама в среде миграция последнего резко усиливается в рудных районах.
По степени аккумулирования металлов организмами они располагаются в следующий ряд: Cu > Mo > W. Указанные химические элементы слабо вовлекаются в биогеохимический цикл. Наблюдается выраженная биогеохимическая дифференциация флоры по степени аккумулирования микроэлементов. Среди растений существуют виды, селективно аккумулирующие металлы, независимо от их содержания в почвах. В условиях рудных ландшафтов Северного Кавказа при различном содержании и соотношении металлов в почвах ряд высших растений характеризуется высоким содержанием молибдена и меди и реже – вольфрама. По степени аккумулирования металлов организмы располагаются в ряд: почвенные микроорганизмы > растения > животные (млекопитающие).
Интенсивность аккумулирования металлов организмами следующая: Mo ≥ Cu > W. Высокая степень концентрирования Mo растениями сопровождается увеличением его содержания в волосяном покрове животных, крови и молоке; изменяется активность дегидратазы δ-аминолевулиновой кислоты и КСО-КДГ молока, изменяется содержание металлов во фракции КСО, что свидетельствует о взаимодействии металлов в биогеохимических циклах и проявлении адаптивных реакций организмов.
Данные являются основой для оценки взаимного влияния микроэлементов (Cu, Mo, W) в процессе их биогенной миграции. Антагонизм микроэлементов зависит от геохимических свойств среды. Но почвообразовательный процесс и организмы меняют связи в миграции микроэлементов. И в этом отношении определенную роль играет вольфрам, по-видимому, ослабляя биологические функции молибдена и усиливая функции меди. При этом вольфрам способен включаться в биомолекулы. Полученные данные существенно меняют представления о биологической роли вольфрама и молибдена в организме млекопитающих. Однако механизм связи W, Cu и Re c КСО-КДГ млекопитающих еще предстоит выяснить.
В целом, проведенные исследования выявили формирование техногенной геохимической аномалии с комплексом опасных загрязнителей – минеральных отходов бывшего ТВМК. Учитывая высокую степень аккумулирования Mo и сопутствующих химических элементов растениями, а также специфические реакции животных (признаки субтоксикоза, случаи беломышечной болезни и йодной недостаточности – кретинизма), центральную часть территории бассейна р. Баксан, ее левобережную часть можно отнести к субрегиональным природно-техногенным биогеохимическим провинциям с избытком молибдена и вольфрама, недостатком селена и йода в среде и организмах. В настоящее время территория этой биогеохимической провинции недостаточно очерчена и существует необходимость в ее биогеохимическом картировании, выявлении вторичных аномалий, а также в профилактике микроэлементозов человека и животных.
Поддержано грантом РФФИ № 19-05-00054-а.
Список литературы
Ашабоков Б.А., Бисчоков Р.М., Федченко Л.М., Калов Х.М., Богаченко Е.М. (2005). Анализ и прогноз изменения климата в Кабардино-Балкарской республике. Нальчик: КБГСХА, 150 с.
Бедина С.А., Мозговая Е.Э., Трофименко А.Сс., Девятаева Н.М., Мамус М.А., Спицина С.С., Тихомирова Е.А. (2019). Активность ксантиноксидазы, ксантиндегидрогеназы и супероксиддисмутазы плазмы крови в зависимости от клинических особенностей системной склеродермии. Международный журнал прикладных и фундаментальных исследований. Пенза: Издательский Дом “Академия Естествознания” (10-2), 268-272.
Винокуров С.Ф., Богатиков О.А., Гурбанов А.Г., Карамурзов Б.С., Газеев В.М., Лексин А.Б., Шевченко А.В., Долов С.М., Дударов З.И., Серегин О.Д., Сычкова В.А. (2018). Экологические риски хранения отходов Тырныаузского вольфрамово-молибденового комбината и проблемы их комплексной утилизации. Нальчик: Кабардино-Балкарский университет, 130 с.
Григорьев Н.А. (2009) Распределение химических элементов в верхней части континентальной коры. Екатеринбург: УрО РАН, 382 с.
Дженбаев Б.М. (2009). Геохимическая экология наземных организмов. Бишкек: изд-во НАН респ. Кыргызстан. 240 с.
ДОКЛАД (2015) о состоянии и об охране окружающей среды в Кабардино-Балкарской Республике в 2014 году. Нальчик, 311 с.
Дреева Ф.Р., Реутова Н.В., Реутова Т.В. (2019) Оценка загрязненности реки Баксан (Центральный Кавказ) и ее притоков микроэлементами. Известия Кабардино-Балкарского научного центра РАН 91(5), 38-46.
Ермаков В.В., Карпова Е.А., Корж В.Д., Остроумов С.А. (2012). Инновационные аспекты биогеохимии / Отв. ред. М.А. Федонкин, С.А. Остроумов. М.: ГЕОХИ РАН, 345 с.
Ермаков В.В., Тютиков С.Ф., Сафонов В.А. (2018) Биогеохимическая индикация микроэлементозов. М.: Издание РАН. 386 с.
Ермаков В.В., Мойсеенок А.Г., Сафонов В.А., Тютиков С.Ф. (2017) Геохимическая экология и ее значение в науках о питании. Наука, питание и здоровье: материалы конгресса (Минск, 8–9 июня 2017 г.). Минск: Беларуская навука, 10-17.
Критерии оценки экологической обстановки территорий для выявления зон чрезвычайной экологической ситуации и зон экологического бедствия. (1992) М.: Мин-во охраны окружающей среды и природных ресурсов РФ. РД ГНТУ, 58 с.
Моисеенко Т.И., Гашкина Н.А., Дину М.И. (2018) Закисление вод: уязвимость и критические нагрузки. М.: URRS, 400 с.
Молибденовые руды. (2007). Методические рекомендации по применению классификации запасов месторождений и прогнозных ресурсов твердых полезных ископаемых (Распоряжение № 37-р от 05.06.2007 г.). М.: МПС России, 6 с.
Надеенко В.Г., Ленченко В.Г., Ощепкова А.Н., Полыковская Н.А. (1977) Новые данные к нормированию вольфрама и молибдена при раздельном и одновременном присутствии в водоемах. Гигиена и Санитария (3), 7-11.
Риш М.А. (2003). Наследственные микроэлементозы. Техногенез и биогеохимическая эволюция таксонов биосферы. Труды Биогеохимической лаборатории XXIV. М.: Наука, 301-348.
СанПиН 2.1.4.1074-01 (2018). Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения. Постановление от 26 сентября 2001 г. N 24 О введении в действие санитарных правил (с изменениями на 2 апреля 2018 г.). М., 5 с.
Смирнов А.А., Юргенсон Г.А. (2008). Вольфрам в полыни Гмелина на территории Шерловогорского горнорудного района.Минералогия и геохимия ландшафта горнорудных территорий. Современное минералообразование. Чита: ИПРЭК СО РАН, 178-182.
Сумбаев В.В., Розанов А.Я. (2001). Ксантиноксидаза как компонент системы генерирования активных форм кислорода. Современные проблемы токсикологии (1), 16-22.
Федонкин М.А.(2003) Сужение геохимического базиса жизни и эвкариотизация биосферы: причинная связь. Палеонтологический журн. (6), 33-40.
Хорошев А.В. (2001). Химический состав поверхностных вод бассейна р. Баксан (Центральный Кавказ). География и природные ресурсы (1), 85-88.
Цой Г.Г. (1974) Адаптивные изменения ксантиноксидазы в условиях медных и молибденовых биогеохимических провинций. Дис. … кандидата биологических наук. М.: МГУ им. М.В. Ломоносова, 138 с.
Чечель Л.П. (2009). Основные формы водной миграции металлов в зоне гипергенеза вольфрамовых месторождений Агинского рудного узла (Восточное Забайкалье). Вестник краунц. Науки о земле 2(14), 153-158.
Шидловская В.П. (2006). Справочник технолога молочного производства. Т. 10. Ферменты молока. СПб.: ГИОРД. 296 с.
Anke M., Seifert M., Arnhold W., Anke S., Schäfer U. (2010). The biological and toxicological importance of molybdenum in the environment and the nutrition of plants, animals and man. Acta Alimentaria 39(1), 12-26.
Anke M., Seifert M. (2010).The biological and Toxicological importance of molybdenum in the environment and the nutrition of plants and man. Acta Biologica Hungarica 58(3), 311-324.
Boll M., Schink B., Messerschmidt A., Kroneck M.H. (2005) Novel bacterial molybdenum and tungsten enzymes: three-dimensional structure, spectroscopy, and reaction mechanism. Biological Chemistry 386, 999-1006.
Bortels H. (1930). Molybdan als Katalysator bei der biologischen Strickstoffbindung. Arch. Microbiol. 1, 333-342.
Brondino C.D., Romao M.J., Moura I., Moura J.J. (2006). Molybdenum and tungsten enzymes: the xanthine oxidase family. Current Opinion in Chem. Biology 10, 109-114.
Ermakov V., Jovanovic L., Degtyarev A., Danilova V., Krechetova E., Tjutikov S., Khushvakhtova S. (2011) The interrelation of copper and molybdenum in biogeochemical processes. Ecologica 18(3), 363-367.
Gilbert D.A., Bergel F. (1964) The chemistry of xanthine oxidase. 9. On improved method of preparing the bovine milk enzyme. Biochem. J. 90(2), 350-353.
Gradova N., Ermakov V., Kovalsky Yu. (2013). The use of microbiological synthesis products for correction of microelementhoses. Ecologica 20 (72), 575-580.
Kovalsky V.V., Vorotnitskaya I.E., Tsoi G.G. (1974). Adaptive changes of the milk xantine oxidase and its isoenzymes during molybdenum and copper action. Trace Element Metabolism in Animals-2. Baltimore: University: Park Press, 161-170.
Pan Yi Wen. (1986) Effects of molybdenum and tungsten supplementations on molybdenum- and copper-enzymes of female rats. A thesis in food and nutrition. Submitted to the Graduate Faculty. Texas Tech. Uiversity. Lubboc: TSU, 46 p.
Telfer, S.B., Kendall, N.R., Illingworth, D.V., Mackenzie, A.M. (2003). Copper deficiency or molybdenum toxicity? Diagnosis and treatment requires a new perspective. Cattle Practice 11, 190-192.
Vinogradova Kh.G. (1943). Presence of molybdenum in Leguminosae. Geochemistry XL. (1), 26-29.
Wayne J., Gijsbert B., van der Voet, Todor I. Todorov, Jose A. Centeno, Wayne Jonas, John Ives, Florabel G. Mullick (2007). Metals and Health: A Clinical Toxicological Perspective on Tungsten and Review of the Literature. Military medicine 172(9), 1002-2005.
Yuldiz S. (1988). Activation of xanthine oxidase by MoO3. Chim. Acta Turc. 16(1), 105-117.
Дополнительные материалы отсутствуют.