Геохимия, 2020, T. 65, № 10, стр. 939-948
Эволюция экосистем в условиях антропогенных нагрузок: через дезорганизацию к самоорганизации
Т. И. Моисеенко *
Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: moiseenko.ti@gmail.com
Поступила в редакцию 02.03.2020
После доработки 02.04.2020
Принята к публикации 05.04.2020
Аннотация
Сформировано представление о механизмах устойчивости водных экосистем, их дезорганизации в период антропогенного загрязнения и эволюционного развития после снижения токсичного воздействия. Объясняются общие закономерности модификаций экосистем с позиций экологической теории и термодинамического механизма упорядочивания вещества в живых системах. Показано, что эволюционное развитие экосистем после снижения антропогенных пертурбаций согласуется с закономерностями сукцессий экосистем: от природной через критическую стадию к стабильной ее модификации, характеризующейся более высокой степенью упорядочивания вещества и снижением энтропии. Сделано заключение о невозможности возврата экосистем к их природному состоянию вследствие эволюции экосистемы через критическое в новое устойчивое состояние с высокой степенью упорядочивания вещества.
ВВЕДЕНИЕ
Важнейшая термодинамическая характеристика организмов, экосистем и биосферы в целом – состояние низкой энтропии, т.е. способность создавать и поддерживать высокую степень упорядоченности вещества. Использование энергетического критерия для оценки основных тенденций в эволюции биосферы было реализовано в работах многих исследователей (Завадский, 1959; Щварц, 1980; Галимов, 2009; Ervin, 1991; Chesser, Sugg, 1996). В ходе эволюции биосферы была выработана оптимальная организация, связанная с особенностями использования ассимилированной энергии на различных уровнях организации живого (Шварц, 1976). Эволюционное упорядочивание обеспечивается сочетанием производства низкоэнтропийного продукта с итеративным его воспроизводством (Галимов, 2009).
Эволюция реализуется через экологические взаимоотношения, в которые вступают все организмы, а ее механизмы поддерживают высокую степень упорядоченности структуры и функционирование экологических систем (Гиляров, 2003). Под понятием “механизм” понимают некоторую систему причина – следственных взаимоотношений в цепи процессов в экосистеме. Обычно понятие “механизм” связывается с процессами, проходящими, главным образом, на уровне организма, по отношению к уровню популяций и сообществ оно применяется редко. Тем не менее, понимание взаимосвязи процессов в системах надорганизменного уровня для экологии часто оказывается более важным, чем раскрытие индивидуальных нарушений, происходящих в особях, входящих в сообщество" (Филенко и др., 2005).
Загрязнение окружающей среды становится фактором, стремительно изменяющим условия жизни на планете, что предоставило нам уникальную возможность наблюдать эволюцию в действии (Бигон и др., 1998; Моисеенко, 2017). Понимание антропогенной трансформации структурно–функциональной организации экосистемы, потоков вещества и энергии в условиях ее антропогенного загрязнения, которые происходят в единстве и взаимодействии всех элементов, является одной из актуальных задач современной экологии и биогеохимии.
Цель работы – сформировать представление о механизмах антропогенной изменчивости экосистемы в условиях высокого антропогенного воздействия и механизмов ее самоорганизации (восстановления) после прекращения действия загрязнения. Устойчивость экосистем, протекающие процессы дезорганизации под действием токсичного загрязнения и восстановительной самоорганизации рассмотрены с позиций экологической теории (Одум, 1986; Пианка, 1981; Алимов, 2000) и термодинамического механизма упорядочивания вещества в живых системах (Пригожин, Стенгерс, 2008; Галимов, 2009). Мы предприняли попытку привести характеристики пертурбаций в экосистемах и механизмов их самоорганизации к понятиям, характеризующим универсальность “феномена жизни” в свете теории Э.М. Галимова (2005, 2009).
Озёрные экосистемы являются удобным объектом для рассмотрения эволюции надорганизменного уровня организации живого в условиях активного антропогенного воздействия и восстановительной самоорганизации. В основу работы легли показатели деградации и восстановительной эволюции водных экосистем после токсичного загрязнения (на примере загрязняемых заливов крупных озер) (Моисеенко, 2011; Moiseenko et al., 2009; Moiseenko, Sharov, 2019).
МЕХАНИЗМЫ ПОДДЕРЖАНИЯ СТАБИЛЬНОСТИ
Рассмотрим в первую очередь устойчивое (стабильное) функционирование водной экосистемы. Анализ публикаций (Алимов, 1994, 2000; Odum, 1985; Cains, 1990; Pratt, Cains, 1996; Chesser, Sugg, 1996) показывает многообразие подходов и определений к оценке устойчивости экосистем, т.е. ее способности противостоять потоку загрязнений. Устойчивость может быть оценена как ее способность противостоять пертурбациям (резистентная), так и способность возвращаться к исходному состоянию (эластичная) после действия стрессового фактора. Эластичную устойчивость часто называют упругостью экосистемы (Алимов, 2000).
Э.М. Галимов, изучая феномен зарождения жизни на уровне возникновения самовоспроизводящихся молекул, отмечал, что биологическая система стремится организоваться таким образом, чтобы в ней возникли необратимые линейные процессы, которые препятствовали нарастанию энтропии и свели это нарастание к минимуму “…устойчивость биологических систем обусловлена их существенной линейностью, способностью к воспроизводству и тем, что они являются не просто сложными, а представлены подсистемными множествами …” (Галимов, 2009).
Стабильность функционирования (стационарность) есть функция устойчивости экосистемы к действию дестабилизирующего фактора – будь то токсичное загрязнение, эвтрофирование, или изменение гидрологических характеристик. В процессе сукцессионного развития экосистемы достигают зрелого (климаксного) состояния. А.Ф. Алимов (2000) измеряемыми параметрами стабильности сообществ или экосистем предлагает принять пределы варьирования их характеристик, не выходящих за рамки среднего уровня годовых флуктуаций, сложившихся в ходе эволюционного развития и свойственного данной системе. В табл. приведены ключевые характеристики природного состояния трех озер Северо–Запада (период 1 – природное состояние), которые мало изменялись с момента сформированной относительно стабильной экосистемы. Бесспорно, в отдельных случаях экосистемы эволюционируют, например, происходит старение озер (вплоть до образования болотных систем), но этот процесс может развиваться тысячи и миллионы лет. Мы рассматриваем доиндустриальный период, когда условия окружающей среды мало видоизменялись (на отрезке 100–200 доиндустриальных лет).
Выделим признаки устойчивости экосистем и постараемся дать объяснение с точки зрения универсальности механизмов функционирования живых систем в свете теории Э.М. Галимова (2009). Признаки устойчиво функционирующей экосистемы объясним в терминах, описывающих сущность “феномена жизни” надорганизменного уровня организации живого.
Соотношения сил и потоков. Приток энергетических субсидий в экосистему (в виде биогенных и органических веществ) постоянен, образование продукции (Р) в пределах годовых флуктуаций, уравновешен тратами на дыхание (R), т.е. P/R ≈ 1. Биодоступные формы элементов и веществ утилизированы в экосистеме, т.е. поступающие извне вещества потребляются в биогеохимических циклах, избыток – выводится из экосистемы путем захоронения или оттока, что характерно для открытых систем.
Необратимость и сопряжение линейных процессов осуществляется путем восходящих (от продуцентов к консументам 1, 2, 3….Ni – порядка) и нисходящих потоков передачи энергии и вещества вследствие “работы” редуцентов, т.е. выполняется важное условие стационарности – линейность передачи энергии внутри открытой системы, каковыми являются экосистемы. На каждом уровне иерархической организации потребление энергетических ресурсов сопряжено с их тратами на дыхание, наращивание биомассы и воспроизводство в ансамбле функциональных единиц экосистемы (в подсистемах). Продукция сопряжена с деструкцией в общем биогеохимическом круговороте. Развитие последовательной цепи (сети) стационарных систем Э.М. Галимов (2005) рассматривает как путь эволюционного упорядочивания как в онтогенезе, так и филогенезе.
Низкоэнтропийные системы. Структурная сложность экосистем определяется, таким количеством и разнообразием видов, которые минимизирует потери (рассеивание) энергии при передаче из одной подсистемы в другую в трофической структуре. Она зависит от ряда природных абиотических факторов, таких как климат, ландшафтные характеристики и др. Более сложно организованные экосистемы формируются в условиях высокого потока энергии и вещества (например, тропические экосистемы), поэтому биоразнообразие закономерно возрастает от северных к более южным широтам, где потоки энергии увеличиваются при уравновешенных тратах на продукцию, дыхание, ассимиляцию и выведение. В зрелой устойчивой экосистеме энтропия минимальна.
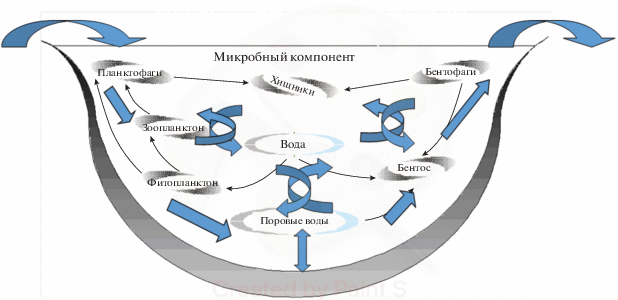
Функциональное соответствие, как мера упорядочивания – одно из условий стационарности определяется таким количеством видов и особенностями их функционирования в трофической структуре экосистемы (как в восходящей, так и нисходящей линии передачи энергии), которые минимизируют рассеивание энергии. В каждой стационарной экосистеме с ее абиотическими и биотическими характеристиками достигается высокое функциональное соответствие от продуцентов к консументам и редуцентам. Биоразнообразие определяется функциональным соответствием как внутри множества подсистем (микробов, фито-, зоопланктона, бентоса и рыбного сообщества), так и между ними, что снижает потери энергии.
Итеративность процессов. Экосистемы не просто сложные системы, а представлены большим множеством подсистем: среда–сообщества–члены (виды)–организмы. В стабильно действующих условиях доминантность видов постоянна и обеспечивается видами К-стратегии жизненного цикла (Пианка, 1981), т.е. долгоживущими видами, которые потребляют более энергии на поддержание метаболизма, обеспечение роста и воспроизводства. Воспроизводство, как итеративный процесс, является энергозатратным. Поэтому более позднее созревание и более редкое воспроизводство по сравнению с r-стратегами уменьшает диссипацию энергии при воспроизводстве (т.е. итеративности), поскольку каждая итерация сопровождается неизбежным рассеиванием энергии. Итеративность свойственна не только особям, но всей системе в слаженном ансамбле воспроизводящихся структур.
В стабильно функционирующей экосистеме, характеризующейся большой сложностью и определенной амплитудой естественной вариабельности, всем видам необходимы пищевые ресурсы, обеспечивающие метаболические процессы энергией. Однако виды различаются по потреблению пищевых ресурсов на рост, продукцию, и поддержание основного метаболизма, а также тем, сколько вещества может быть запасено в тканях, жировых отложения или органах репродукции. Если приход вещества равен расходу с учетом минимизации рассеивания, то состояние экосистемы остается стабильным во времени в пределах годовых флуктуаций. Если приход превышает расход, система приспосабливается за счет возрастания численности организмов, обеспечивающих экосистеме более полное использование поступающего и образующегося вещества. Это может выглядеть как усложнение. Наконец, если возникает дефицит вещества (расход превышает приход), то система упрощается (Одум, 1986; Алимов, 2000). Таким образом, экосистема будет находиться в стационарном состоянии столь долго, сколько приток веществам в экосистему будет уравновешен его тратами с учетом минимального рассеивания (рис. 1).
Рис. 1.
Признаки стабильно функционирующей экосистемы: приток вещества в экосистему постоянен, образование продукции в пределах годовых флуктуаций и уравновешено тратами на дыхание; сбалансированное соотношение потоков вещества; сопряжение процессов в ансамбле структурных единиц; функциональное соответствие видов в трофической структуре; относительно низкая итеративность подсистем.
ТОКСИКАНТ КАК ДЕЗОРГАНИЗУЮЩИЙ ФАКТОР
Когда деструктивный фактор, каковым является токсичное загрязнение, внедряется в экосистему, то может уничтожать те или иные виды в зависимости от их генотипической толерантности и фенотипической пластичности. Пертурбации затрагивают структуру (число видов и размеры популяций), соответственно – нарушаются функции в подсистемах и во всей экосистеме (Atchison et al., 1996). По мере того, как одни популяции снижают свою численность, а другие увеличивают, изменяются потоки энергии в экосистеме. Стационарные системы обладают высокой устойчивостью и гибкостью, пока выполнены два обязательные условия стационарности: приток энергии и обмен веществом. Нарушение этих условий закрывает путь формирования низкоэнтропийных структур, и система гибнет (или реорганизуется) (Галимов, 2009). Гибель может происходить на молекулярном, клеточном и организменном уровнях, на экосистемном – только как процессы дезорганизации.
Ю. Одум (1986) сформулировал концепцию “энергетических субсидий”, под которой понимает всякий источник энергии, увеличивающий ту долю энергии, которая может пойти на продукцию. К ним он относит умеренный поток органических и биогенных веществ в экосистему, однако, высокий и нерегулярный их приток он рассматривает как фактор стресса. Токсичное загрязнение – только как фактор стресса, приводящий к дезорганизации экосистемы и диссипации энергии. Если энергетические субсидии превышают токсичную нагрузку, то продуктивность системы увеличивается на фоне ее упрощения, при дальнейшем усилении фактора токсичного стресса продуктивность и биоразнообразие снижаются. При изменении энергетических потоков в одном из этих направлений экосистема будет претерпевать изменения, т.е. находиться в критическом состоянии, пока не достигнет качественно нового равновесного состояния. C.H. Walker et al. (1996) приводят обобщающие данные по изменениям в экосистемах под действием токсичного загрязнения и выделяет следующую стадийность в изменчивости сообществ: в первую очередь, число некоторых видов снижается; во вторую – число особей в популяции сокращается; на третьем этапе размер популяций может увеличиваться у устойчивых видов.
Мы выделили основные признаки, которые характеризовали водные экосистемы трех озер в период их дезорганизации под действием комплексного загрязнения (Moiseenko, Sharov, 2019). В таблице (период 2 – интенсивного загрязнения) приведены основные показатели биогеохимического круговорота и структурных изменений сообществ, которые демонстрирует сходство модификаций экосистем трех озер в загрязняемых заливах.
Наряду с увеличением общего содержания фосфора, повышается роль биодоступных форм, которые экосистема на этой стадии трансформации не может утилизировать, и они становятся резервом для интенсификации продукционных процессов и нарастания биомассы первичных продуцентов – фитопланктона. Структура биомассы фитопланктона изменяется в сторону преобладания устойчивых к загрязнению сине-зеленных, зеленых и криптофитовых водорослей. Известно, что криптофитовые водоросли способны к миксотрофному питанию и, являясь мелкоразмерными формами, обеспечивают быстрый оборот биомассы в экосистеме, т.е. более активное использование энергетических субсидий в противодействие неупорядоченного рассеивания. В зоопланктоне преобладают мелкие коловратки. В сообществах зоопланктона и бентоса снижается численность типичных северных видов, уязвимых к токсикантам, что приводит к снижению общего видового разнообразия.
Численность эврибионтных видов в зоопланктонных и бентосных сообществах возрастает вследствие высоких концентраций биогенных элементов и отсутствию конкурентных связей с типичными обитателями северных вод, уязвимых к токсичному воздействию. Возрастает видовая доминантность эврибионтных видов во всех сообществах. В зоопланктонных сообществах преобладают мелкоразмерные коловратки; в бентосных прослеживается формирование высокой биомассы организмов хирономидно-олигохетного комплекса. Уменьшение показателя условной индивидуальной массы, характерное для фито- и зооплактонных сообществ, свидетельствует о преобладания мелких форм (r–стратегов), обеспечивающих более быстрый оборот биомассы в экосистеме и утилизацию дополнительно поступающих энергетических субсидий. Снижается доля хищных видов в зоопланктоне и рыбной части сообществ (Моисеенко, 2009; Moiseenko, Sharov, 2019).
Приведенные признаки свидетельствуют о критическом состоянии экосистем трех озер в местах интенсивного загрязнения и соответствуют признакам их неустойчивого стрессового состояния. С одной стороны, вследствие элиминации наиболее уязвимых видов, снижается конкуренция, с другой – способные выживать виды получают больше энергетических субсидий и имеют преимущества для роста и размножения. Это в свою очередь ведет к упрощению биоразнообразия системы, нарушению путей передачи энергии. В этих случаях, формирование новой структуры системы становится непредсказуемым, поскольку могут наблюдаться опосредованные вторичные эффекты реколонизации (Chesser, Sugg, 1996).
Экспериментальные данные подтверждают общие закономерности изменчивости в водных экосистемах. О.Ф. Филенко и др. (2005) показано, что преимущественное развитие получают не только более мелкие члены сообщества, но и внутри одной популяции происходит увеличение мелкоразмерных форм, что свидетельствует об универсальности этого механизма. Сокращение видового разнообразия, регрессия оппортунистических и подъем мелкоразмерных видов многие исследователи приводят как результат структурных изменений в сообществах под селективным действием токсичного фактора (Pratt, Cains, 1996; Falk et al., 2006; Palmer et al., 2007).
С позиций энергетического критерия при действии деструктивного (возмущающего) фактора, например, поступления токсичных веществ, увеличивается энтропия биологических систем в период дезорганизации. Хаос – явление детерминированное и подчиняется определенной закономерности (Пригожин, Стенгерс 2008). Приведем основные признаки критического состояния экосистем, как высокоэнтропийной хаотичной системы, но подчиняющейся детерминированной закономерности.
Нарушение сбалансированности потоков вещества и энергии. Вследствие антропогенных потоков биогенных элементов накапливается избыток биодоступных форм азота и фосфора, то есть наблюдается превышение притока энергетических субсидий над их утилизацией в экосистеме (соотношение Робщ/РО4 уменьшается на фоне резкого увеличения биомассы фитопланктона) (табл. 1, период 2 – интенсивного загрязнения). Относительно высокая численность некоторых устойчивых видов будет поддерживаться большим количеством энергетических ресурсов, которые высвобождаются вследствие разрушенных путей их передачи в исходной исторически сложившейся экосистеме.
Таблица 1.
Основные индикаторы качества вод и состояния сообществ крупных озер Северо–запада России в ключевые периоды их модификаций: 1 – природное состояние; 2 – интенсивное загрязнение; 3 – снижение загрязнения и оживления экосистемы (составлена по данным Moiseenko, Sharov, 2019)
| Показатели | Озеро Имандра | Онежское озеро | Ладожское озеро | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Периоды и численные значения показателей | |||||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| Ptot/PO4, мг/л | 6/1 | 26/21 | 28/5 | 8/1 | 54/30 | 23/4 | 10/3 | 178/100 | 30/8 |
| Ntot/NO3, мг/л | 260/17 | 436/102 | 360/80 | 350/110 | 750/120 | 620/77 | 450/130 | 920/240 | 705/220 |
| Si, мг/л | 1.0 | 1.1 | 0.3 | 2.0 | 1.2 | 0.3 | 1.0 | 0.5 | 0.2 |
| Токсическая нагрузка (ΣCi/MPCi)* | 0.1 | 3.2 | 1.5 | 0.1 | 0.9 | 0.3 | 0.1 | 1.8 | 0.8 |
| Фитопланктон | |||||||||
| Chl “a”, мкг/м3 | 0.3 | 3.8 | 5.9 | 0.7 | 8.4 | 8.6 | 0.7 | 8.0 | 9.6 |
| Биомасса, г/м3 | 0.1 | 3.6 | 4.8 | 0.1 | 2.4 | 2.2 | 0.5 | 5.5 | 2.5 |
| Численность, клеток 106/л | 0.1 | 3.8 | 4.6 | 0.1 | 3.6 | 3.4 | 0.4 | 12.3 | 3.7 |
| H (Индекс биоразнообразия Шенона), bit/spec. | 3.2 | 2.5 | 4.7 | 3.7 | 3.3 | 5.6 | 3.4 | 3.1 | 5.4 |
| Зоопланктон | |||||||||
| Биомасса, г/м3 | 0.3 | 1.7 | 2.2 | 0.1 | 2.9 | 1.4 | 0.6 | 2.8 | 1.9 |
| Численность, 103/м3 | 15.0 | 271.0 | 407.0 | 3.0 | 110.0 | 91.0 | 13.0 | 143.0 | 58.0 |
| H (Индекс биоразнообразия Шеннона), bit/spec. | 2.8 | 1.9 | 3.6 | 2.3 | 1.7 | 3.7 | – | – | 4.1 |
| Макрозообентос | |||||||||
| Биомасса, г/м2 | 0.6 | 35.0 | 24.5 | 0.6 | 3.2 | 15.2 | 1.6 | 4.8 | 12.9 |
| Численность, 103/м2 | 0.5 | 4.3 | 8.6 | 0.2 | 2.4 | 8.5 | 0.8 | 1.1 | 3.7 |
| H (Индекс биоразнообразия Шеннона), bit/spec. | 3.5 | 1.6 | 1.8 | 2.6 | 2.0 | 2.2 | – | – | 2.4 |
Разрывы в линейности передачи энергии (или искажение) и ее диссипация. На фоне снижения численности типичных стенобионтных северных видов, уязвимых к токсикантам, возрастает численность нескольких эврибионтных (резкое увеличение доминантности), которые благодаря высоким концентрациям биогенных элементов и отсутствию конкурентных связей в токсичных условиях с другими обитателями, значительно увеличивают свою численность, например, коловраток в сообществе фитопланктона, хирономид – в составе зообентоса; зеленых и сине-зеленых водорослей в составе фитопланктона и др. При воздействии токсичного загрязнения условия для выживания устойчивых эврибионтных видов улучшаются вследствие высвобождения пищевых ресурсов, тогда как на другие виды токсичный агент действует угнетающе. Нарушение передачи энергии в трофической структуре приводит к ее неупорядоченному рассеиванию при передаче из одной в другую подсистему.
Ускорение итеративности системы. Уменьшение условной индивидуальной массы членов фито- и зоопланктонных сообществ свидетельствует о преобладания мелких форм (r–стратегов), что приводит к более частой итеративности в подсистемах и экосистеме в целом. Среди видов близкой толерантности преимущества в конкуренции получают мелкие формы с высокой частотой воспроизводства и сменой поколений. Этот феномен характерен для многих систематических групп и подтвержден, как было упомянуто, в эксперименте (Филенко и др., 2005).
Таким образом, вследствие нарушения линейности процессов небольшая ошибка (сбои в функционировании в приложении к экосистемам) усиливаются итерациями так, что результат эволюционного развития через некоторое число итераций (искажений) практически непредсказуем. Проявление нелинейности с накоплением итеративных ошибок приводит к деградации системы (Галимов, 2009), что мы наблюдаем в загрязняемых заливах озер.
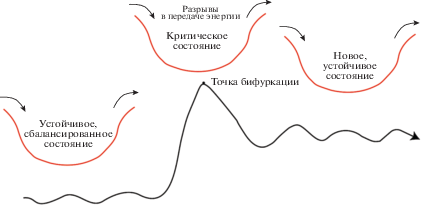
Критическое состояние экосистем можно принять за точку бифуркации, при которой система перестраивается (рис. 2).
Признаки критического состояния экосистем (в стадии усиления диссипации энергии) носят одновременно черты противодействия хаосу и нарастания энтропии: уменьшение размеров членов сообщества и более эффективное ими использование пищевых (энергетических) ресурсов, повышение численности доминантных устойчивых видов; более быстрый оборот биомассы в экосистеме, экспорт продукции и т.д. Эти механизмы обеспечивают утилизацию излишков энергетических ресурсов, поступающих в виде субсидий или высвобождающихся вследствие нарушения линейности процессов передачи вещества в экосистеме. Уменьшение энтропии может достигаться не только за счет усложнения структуры, но и ускорения оборота биомассы организмов, которое обеспечивается короткоцикловыми и более мелкими видами (или особями одного вида).
ЭВОЛЮЦИЯ ЭКОСИСТЕМ ПОСЛЕ ЗАГРЯЗНЕНИЯ
Большинство работ по изучению процессов восстановления в природе посвящены изучению последействия одного фактора или восстановлению отдельных видов без учета всего комплекса взаимодействия в экосистемах и сообществах (Erwin, 1991; Atchison et al., 1996; Palmer et al., 2005; Falk et al., 2006). Природа изменений сообществ может быть истолкована из свойств популяций, состоящих из отдельных особей (Бигон и др., 1989). C.H. Walker et al. (1996) отмечал, что в случае загрязнения нарушаются многие связи в экосистеме и восстановление (точнее формирование экосистемы с новыми свойствами) будет происходит со множеством прямых, опосредованных и обратных путей взаимодействия. Наука пока не может предсказать до конца направление эволюции системы после токсичного стресса (Cairns, 2005).
Рассмотрим эволюцию экосистем в новую стадию после прекращения действия дезорганизующего фактора, в приведенном случае – потока токсичных веществ. Формирование устойчивой экосистемы (возврат к стабильному состоянию) управляется законами минимизации энтропии, характерными для живых систем всех уровней организации.
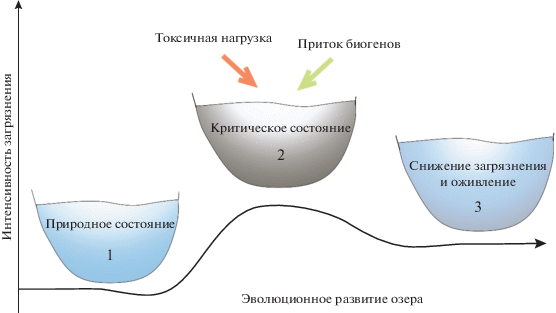
Ключевые признаки, которые характеризуют упорядочивание вещества и самоорганизацию экосистем в устойчивую (зрелую) стадию после критического состояния (точки бифуркации), сопоставим с процессами, протекающими в озерных экосистемах Северо-Запада (рис. 3; табл. 1, период 3 – снижения загрязнения).
Рис. 3.
Особенности состояния экосистем на разных стадиях их антропогенной эволюции: 1 – природное состояние – биогеохимические циклы в рамках сезонных флуктуаций стабильны; 2 – критическое состояние – разбалансирование продукционно-деструкционных процессов под влиянием энергетических субсидий и стрессовых факторов; 3 – новая стадия эволюционного развития – устойчивое состояние, но отличное от природного (Moiseenko, Sharov, 2019).
Восстановление сбалансированности потоков вещества и энергии. Накопленные биогенные элементы вовлечены в биологических круговорот в экосистеме, о чем свидетельствует снижение концентраций минеральных форм фосфора и азота, т.е. происходит более эффективная утилизация биодоступных форм биогенных элементов. Например, в озере Имандра соотношение Робщ/РО4 в 2003 г. стало 8.7 (после снижения загрязнения), тогда как в период загрязнения (1978–1983 г.) было 2.6 (Moiseenko et al., 2009). Снижение концентраций биодоступных форм биогенных элементов является следствием утилизации их диатомовыми водорослями, которые в период реколонизации занимают доминирующее положение, но при более высокой численности по сравнению с природными показателями. Поэтому биомасса водорослей практически не снижается или снижется незначительно на протяжении последних десятилетий, свидетельствуя о повышенной биопродуктивности озера по отношению к природной. В озерах Ладога и Онега (загрязняемых заливах), несмотря на снижение потока фосфора в экосистему, величины максимальных и средних значений биомасс, а также содержания хлорофилла в период восстановления почти не изменились (Moiseenko, Sharov, 2019). Концентрации биодоступных форм фосфора по отношению к общим снизились, хотя в меньшей степени, чем на озере Имандра.
Совершенствование линейности передачи энергии, как условие снижения ее диссипации. В условиях снижения токсичного загрязнения, например, в озере Имандра, наблюдалась реколонизация биотопов обитателями северных и также вселенцами из более южных вод, что подтверждается очередной сменой доминирующих комплексов, при этом увеличивается индекс биоразнообразия, т.е. сложность системы. Однако видовая структура сообществ отлична от природной, несмотря на частичную реколонизацию участков озер обитателями северных вод. Структурная сложность экосистемы восстанавливается, однако ряд видов, характерных для природного состояния, не возвращаются или встречаются в единичных экземплярах, изменяется доминантность в сообществах. Например виды, единичные в природном состоянии, развиваются в высокой численности; появляются интродyценты.
Снижается итеративность системы и, следовательно, чувствительность к “ошибкам”. В эволюционировавшей экосистеме увеличивается роль верхних трофических уровней и хищных форм. Индекс видового разнообразия планктонных сообществ возрастает. Происходит увеличение числа крупных форм и хищных организмов (К–стратегов) в структуре зоопланктона и бентоса, очевидно, и рыб, что свидетельствует о снижении итеративности подсистем и неизбежное рассеивание энергии при стремлении системы к упорядочиванию.
Приведенные показатели модификации экосистем после токсичного стресса, сопровождаемого биогенным загрязнением, согласуются с характером эволюции больших Американских озер. Например, в озере Онтарио с 1968 г. по 1985 г. отмечалось плавное снижение концентраций фосфора, количество которого уменьшилось вдвое к 1985 г. и к 2000 г. – до 6 мкг/л. Однако продукция фитопланктона и хлорофилла “а” не изменялась вследствие интенсивного развития криптомонад – очень мелкой формы первичных продуцентов. Высокие биомассы криптомонад поддерживают биомассу первичных продуцентов (Grey et al., 1994; Greate Lakes Ecosystem: Report, 2001). В последние годы отмечается повышение роли хищных форм в сообществах зоопланктона и возрастание рыбопродуктивности. Эти факты не позволяют объяснить ответные реакции экосистемы только медленной скоростью воодообмена, хотя очищение вод, бесспорно, вносит вклад в процессы улучшения состояния озер.
По нашему мнению, понятие “запаздывание ответных реакций” (Grey et al., 1994) на снижение фосфорной и токсичной нагрузки не адекватно отражает сложившуюся ситуацию с модификациями экосистем данных озер. Исходя из экологической теории и термодинамических законов упорядочивания вещества в биологических системах, ведущим механизмов стабильности модифицированной экосистемы являются ее новые свойства, направленные на уменьшение диссипации энергии: вовлеченные в биогеохимический круговорот биогенные элементы из антропогенных источников продолжают функционировать в системе, поддерживая продуктивность фитопланктона и передачу энергии по трофической структуре. В ответ на новые пертурбации, связанные уже с уменьшением притока энергетических субсидий и снижения токсичного стресса, “ответные перестройки” экосистемы развиваются по новой траектории, но не возвращаются к ранним сукцессионным условиям. “Вследствие нарушения линейности процессов небольшая ошибка усиливаются итерациями так, что результат через некоторое число итераций практически непредсказуем” (Галимов, 2009). К таким ошибкам можно отнести “сбои” в воспроизводстве популяций или функционировании экосистем в условиях загрязнения, поэтому направленность и скорость эволюционного процесса в современной биосфере являются неопределенными (на современном уровне знаний). Термин “восстановление экосистем” в данном случае нельзя отождествлять с понятием возвращения к природному состоянию, скорее он может трактоваться – как эволюция экосистемы к новой устойчивой модификации (рис. 4).
Рис. 4.
Эволюционный процесс в экосистеме под влиянием стрессовых факторов антропогенного загрязнения.
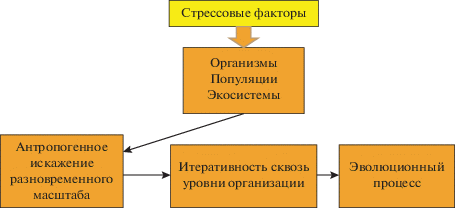
Необратимость существует на всех уровнях, является однонаправленной во времени и играет конструктивную роль в формировании новой структуры. Вблизи бифуркаций основную роль играют случайные элементы, тогда как в интервалах бифуркаций – детерминистические аспекты (Пригожин, Стенгерс, 2008). Эти фундаментальные положения объясняют антропогенно обусловленные процессы, протекающие в водных экосистемах в период увеличения и снижения токсичных нагрузок, подтверждают формирование экосистемы с новыми свойствами. Очевидно, что экосистема эволюционирует (через противодействие “хаосу”) в новую устойчивую модификацию и возврат к природному состоянию невозможен (рис. 4).
ЗАКЛЮЧЕНИЕ
В процессе сукцессионного развития экосистемы достигают зрелого (климаксного) состояния, которое имеет следующие характерные признаки стабильности: низкую степень рассеивания энергии (энтропии); сопряжение процессов; сбалансированное соотношение потоков вещества и энергии; функциональное соответствие видов в трофической структуре; относительно низкую итеративность подсистем.
Токсикант действует на экосистему как дезорганизующий фактор, изменяет структуру и функции экосистемы, что приводит к диссипации энергии (повышению энтропии). Уменьшение размеров членов сообщества и повышение численности устойчивых видов в критическом состоянии обеспечивают более эффективную утилизацию энергии в экосистеме, поступающей в виде энергетических субсидий или высвобождающуюся вследствие нарушения ее передачи в трофической структуре экосистемы. Критическое состояние экосистемы в период токсичного загрязнения носит черты противодействия хаосу и снижения диссипации энергии путем преимущественного развития мелких форм, частая итеративность которых ускоряет оборот биомассы в экосистеме и утилизацию энергии в период ее перестройки на новое стабильное функционирование.
Развитие новой модификации водной экосистемы после снижения токсичного загрязнения согласуются с закономерностями сукцессий экосистем: от природной через критическую стадию к более стабильной ее модификации, но отличной по структуре от природной. Поэтому, термин “восстановление экосистем” в данном случае нельзя отождествлять с понятием возвращения к природному состоянию, скорее он может трактоваться – как эволюция экосистемы в новое устойчивое состояние.
Возможно ли воссоздать природное состояние тех или иных экосистем, и насколько это оправдано? Переход через критическое состояние (точку или последовательность точек бифуркации) приводит к необратимой изменчивости и формированию новых модификаций экосистем. Ученые поднимают вопрос – надо ли стремиться воссоздать природные характеристики экосистем. По нашему мнению, основная цель улучшения состояния природных объектов должна быть направлена на поддержание основных показателей структуры и функций экосистемы, т.е. высокого качества вод и ее биопродуктивность.
Список литературы
Алимов А.Ф. (1994) Разнообразие, сложность, стабильность, выносливость экологических систем. Журн. общей биологии 55(3), 285-302.
Алимов А.Ф. (2000) Элементы теории функционирования водных экосистем. СПб.: Наука, 148 с.
Бигон М., Харпер Дж., Таунсенд К. (1989) Экология. Особи, популяции и сообщества. М.: Мир, Т. 1, 667 с.; Т. 2, 447 с. Begon M., Harper J., Townsend C. Ecology: individuals, populations and communities. Blackwell Scientific Publications, Oxford. 1986, 876 p.
Галимов Э.М. (2005) Предпосылки и условия возникновения жизни. Задачи исследования. Геохимия (5), 467-484.
Galimov E.M. (2005) Prerequisites and conditions of the origin of life: bjectives for research. Geochem. Int. 43(5), 421-437.
Галимов Э.М. (2009) Феномен жизни: между равновесием и нелинейностью. Происхождение и принципы эволюции. М.: Книжный дом “ЛИБРОКОМ”, 269 с.
Гиляров А.М. (2003) Становление эволюционного подхода как объяснение началa в экологии. Журн. общей биологии 64(1), 3-22.
Завадский К.М. (1959) К пониманию прогресса в органической природе. Проблема развития в природе и обществе. Л.: Наука, С. 78-120.
Моисеенко Т.И. (2009) Водная токсикология: фундаментальные и прикладные аспекты. М.: Наука, 400 с.
Моисеенко Т.И. (2011) Устойчивость водных экосистем и их изменчивость в условиях токсичного загрязнения. Экология (6), 441-448. Moiseenko T.I. (2011) Stability of aquatic ecosystems and their variation under conditions of toxic pollution. Russian journal ecology. 42(6) 485-492/
Моисеенко Т.И. (2017) Эволюция биогеохимических циклов в современных условиях антропогенных нагрузок: пределы воздействий. Геохимия (10), 841-862. Moiseenko T.I. (2017) Evolution of Biogeochemical Cycles under Anthropogenic Loads: Limits Impacts. Geochem. Int. 55(10), 841-860.
Одум Ю. (1986) Экология (Пер. с англ./Под ред. Гилярова А.М.). М.: Мир, 328 с. Odum Eu.P. Ecology. Harcourt Brace College Publishers 1983, 325 p
Пианка Э.P. (1981) Эволюционная экология. М.: Мир, 399 с. Pianka E.R. 1978. Evolutionary Ecology. Second Edition. Harper and Row, N.Y., 397 p.
Пригожин И., Стенгерс И. (2008) Порядок из хаоса: Новый диалог человека с природой (Пер. с англ./Под ред. Аршинова В.И., Климонтовича Ю.Л., Сачкова Ю.В.) М., 269 с. Prigogine I., Stengers I. Order out of chaos. Heinemann. London 1984, 432.
Филенко О.Ф., Дмитриева А.Г., Исакова Е.Ф. (2005) Механизмы реагирования водных организмов на воздействие токсичных веществ // Антропогенное влияние на водные экосистемы. М.: Изд-во МГУ, 70-93.
Шварц С.С. (1980) Экологические закономерности эволюции. М.: Наука, 278 с.
Atchison G.J., Sandheinrich M.B., Bryan M.D. (1996) Effect of Environment Stressors on Interactive Interactions of Aquatic Animals. Ecotoxicology: a Hierarchical Treatment. N.Y.: Levis publishers Ltd., 319-345 p.
Cairns J.Jr. (2005) Restoration Ecology and Ecotoxicology. Handbook of Ecotoxicology (Eds Hoffman et al.). N.Y.: Levis publishers Ltd., 1015-1029 p.
Chesser R.K., Sugg D.W. (1996) Toxicant as selective Agents in Population and Community Dynamics. Ecotoxicology: a Hierarchical Trieatment (Eds. Newman M.C., Jagoe Ch.H.). N.Y.: Levis publishers Ltd., 293-317 p.
Erwin T.A. (1991) An Evolutionary basis for conservation strategies. Science 253, 750-752.
Falk D.A., Palmer M., Zedler J. (2006) Foundation of restoration ecology. The Science and Practice of Ecological restoration. W.: Island Press, 518 p.
Gunn J.M., Keller W., Negushit J. (1995) Ecosystem recovery after emission reductions: Sudbury. Canada. Water, Air and Soil Pollution, 1783-1788.
Hobbs R.J., Harris J.A. (2001) Restoration ecology: repairing the earth’s ecosystems in the new millennium. Restoration ecology 9, 239-246.
Moiseenko T.I., Sharov A.N., Vandish O.I. (2009) Long–term modification of arctic lake ecosystem: reference condition, degradation and recovery. Limnologica 39(1), 1-13.
Moiseenko T, Sharov A. (2019) Large Russian Lakes Ladoga, Onega, and Imandra under Strong Pollution and in the Period of Revitalization: A Review. Geosciences 9, 492.
Odum E.P. (1985) Trends Expected in Stressed Ecosystems. Bioscience 35, 419-422.
Palmer M.A., Ambrose R.F., Poff N. (2007) Ecology theory and community restoration. Restoration Ecology 5(4), 291-300.
Pratt J.R. Cairns J. (1996) Ecotoxicology and the redundancy problem: understanding effect on community structure and function. Ecotoxicology: a Hierarchical Treatment. N.Y.: Levis publishers Ltd., 347-398 p.
Shindler D.W. (1987) Detective ecosystem response to anthropogenic stress. Can J Fish Aquat Sci 55, 6-25.
Walker C.H., Hopkin S.P., Sibly R.M. (2001) Principles of Ecotoxicology (2nd Edit). L.: Taylor&Francis Ltd., 309 p.
Дополнительные материалы отсутствуют.