Геохимия, 2020, T. 65, № 12, стр. 1212-1230
Основные условия формирования химического состава вод соленых и солоноватых озер Восточного Забайкалья
С. В. Борзенко *
Институт природных ресурсов, экологии и криологии СО РАН
672014 Чита, ул. Недорезова, 16а, Россия
* E-mail: svb_64@mail.ru
Поступила в редакцию 12.03.2019
После доработки 17.06.2019
Принята к публикации 08.08.2019
Аннотация
На обширном фактическом гидрогеохимическом материале и термодинамических расчетах установлено, что наряду с испарением огромную роль в формировании состава озер играет их взаимодействие с горными породами, которое начинается на водосборной площади конкретного озера и продолжается непосредственно в озере, поскольку воды независимо от их солености продолжают оставаться неравновесными ко многим минералам эндогенного генезиса. Наиболее масштабно такие процессы проявлены в содовых озерах, что подтверждается наличием в них наиболее высоких значений рН (9.0–10.7) которые являются свидетельством максимального по масштабам взаимодействия таких вод с первичными алюмосиликатами. Выделено два процесса ответственных за поведение в озерах серы: сульфатредукция и окисление сульфидов. Показано, что сформированная разная геохимическая среда в озерах разного типа способствует тому, что содержания только некоторых подвижных в этих условиях элементов растут и накапливаются до значительных концентраций.
ВВЕДЕНИЕ
Исторически сложилось так, что формирование химического состава соленых озер и связанных с ним солей объясняли в основном испарительным концентрированием изначально морской воды (Вант-Гофф, 1936; Курнаков, Николаев, 1938). С более общих геологических позиций к проблеме солеобразования как части литологических процессов подошел Н.М. Страхов (Страхов, 1962). Из западных исследователей необходимо назвать П. Сонненфельда (Сонненфельд, 1988), который развивает геолого-географический подход в области познания ведущих факторов формирования рассолов и эвапоритов. Близкую методологию изучения этих объектов применяет В.В. Куриленко (Куриленко, 1997). В 70-е–80-е годы прошлого века выполнялись многочисленные работы по фазовым равновесиям в водно-солевых системах (Harvi and Eugster, 1980; Greenberg et al., 1989; Филиппов, Черемных, 1983; Filippov and Charykova, 1989 и др.). В конце XX в. появилось и активно развивается в наше время новое направление исследований по термодинамическому моделированию фазовых процессов в водно-солевых системах озер (Чарыкова, Чарыков, 2004; Zheng, 2014 и др.). Большой вклад в разработку методов моделирования внесли французские ученые, которые изучали многие соленые озера Франции (Droubi, 1976; Droubi et al., 1976; Gueddari et al., 1983; Gueddari, 1984 и др.). Перечень работ, выполняемых по геохимии соленых озер всего мира можно продолжить бесконечно.
Все эти исследования выявили одно важное обстоятельство: практически на любой достаточно ограниченной территории с близкими ландшафтно-климатическими и геолого-геоморфологическими условиями всегда развиты разнообразные геохимические типы озер, включая содовые, хлоридные, сульфатные, кислые, щелочные, отличающиеся соленостью, химическим и изотопным составами, а также типом органических соединений. Такая картина характерна для любого региона мира: Африки, Австралии, Китая, Монголии, Крыма, Западной Сибири, Прибайкалья (Warren, 1989; Jones et al., 1977; Дзенс-Литовский, 1967; Леонова и др., 2007; Страховенко и др., 2010; Шварцев и др., 2014; Kolpakova et al., 2016 и др.). Такое же разнообразие озер характерно и для Забайкалья (Власов, 1961; Иванов, 1977; Замана, Борзенко 2010; Склярова и др., 2011). Поэтому основной целью данной работы является раскрытие природы, определяющей разнообразие состава соленых озер Восточного Забайкалья.
МЕТОДЫ И ОБЪЕКТЫ ИССЛЕДОВАНИЙ
В данной статье представлены результаты гидрохимических исследований соленых озер, выполненных в 2013–2017 гг. Химико-аналитические измерения водных проб проведены по общепринятым методикам (Руководство.., 1977; Новиков и др., 1990 и др.). Определения микрокомпонентов были выполнены в Аналитическом центре Института геохимии им. А.П. Виноградова СО РАН (г. Иркутск) методом масс-спектрометрии с индуктивно-связанной плазмой на приборе ELEMENT-2 (Finnigan MAT, Германия) по методике НСАМ № 480Х. Анализы стабильных изотопов серы, растворенных сульфатов и сероводорода выполнены на масс-спектрометре MAT 253 (Thermo Fisher Sсientifiс, Германия) в ДВГИ ДВО РАН, г. Владивосток. Рентгенофазовый анализ (РФА) применялся для исследования донных отложений и осадков из седиментационных ловушек на аппарате ДРОН-3. Количественное соотношение компонентов рассчитано по корундовым числам методом RIR. Пробы солей и донных отложений были исследованы с помощью бинокулярного микроскопа фирмы МБС – 10.
Таблица 1.
Минерализация, рН и содержания основных компонентов подземных вод региона
| Показатели | Бассейн р. Ингоды | Бассейн р. Онон | Область внутреннего стока | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| рН | 7.52 | 7.07 | 8.10 | 7.87 | 6.47 | 9.24 | 7.99 | 6.90 | 9.02 |
| HСO3; г/л | 0.31 | 0.06 | 0.78 | 0.27 | 0.08 | 1.17 | 0.46 | 0.15 | 1.87 |
| S${\text{O}}_{4}^{{2 - }}$ | 0.040 | 0.007 | 0.443 | 0.030 | 0.003 | 0.594 | 0.089 | 0.002 | 1.126 |
| Сl– | 0.015 | 0.001 | 0.052 | 0.028 | 0.002 | 0.730 | 0.063 | 0.005 | 0.362 |
| F– | 0.0003 | 0.0001 | 0.0016 | 0.0010 | 0.0002 | 0.0027 | 0.0017 | 0.0003 | 0.0063 |
| Сa2+ | 0.06 | 0.01 | 0.15 | 0.06 | 0.01 | 0.16 | 0.05 | 0.01 | 0.15 |
| Mg2+ | 0.028 | 0.006 | 0.098 | 0.020 | 0.005 | 0.064 | 0.039 | 0.005 | 0.219 |
| Na+ | 0.022 | 0.003 | 0.098 | 0.035 | 0.006 | 0.232 | 0.130 | 0.007 | 0.528 |
| K+ | 0.002 | 0.000 | 0.008 | 0.002 | 0.001 | 0.010 | 0.006 | 0.000 | 0.058 |
| М | 0.49 | 0.11 | 1.34 | 0.50 | 0.14 | 3.72 | 0.87 | 0.25 | 3.12 |
| Si | 0.007 | 0.001 | 0.012 | 0.007 | 0.003 | 0.012 | 0.008 | 0.004 | 0.016 |
Физико-химические расчеты, необходимые для выявления активностей компонентов выполнялись с использованием программного комплекса HydroGeo, разработанного М.Б. Букаты (1997) с использованием базы данных Питцера для высокоминерализованных вод (Питцер, 1992). Для оценки степени насыщения вод минералами рассчитывался индекс насыщения (SI), значения которого при пересыщении раствора становятся положительными (SI = lg Q – lg K), а нулевое характеризует равновесие раствора с минералом (Paces, 1972).
В основу классификации озер взята схема, разработанная С.Л. Шварцевым (Borzenko, Shvartsev, 2019). Она учитывает не только химический состав, как это принято в наиболее популярных классификациях (Курнакова-Валяшко, Алекина), но и геохимические условия среды рН, Eh, а также химические элементы, которые входят в состав вторичных минералов.
Все изученные соленые озера приурочены к лесостепной и степной ландшафтно-климатическим зонам и расположены в бассейнах рр. Ингоды, Онона, Аргунь, а также в пределах бессточного Торейского бассейна (рис. 1). С запада и востока территория ограничена координатами 112°–118° в.д., с севера – широтой 52°, с юга – государственной границей с Республикой Монголия и КНР. Большая часть соленых озер расположена в пределах Цасучейской впадины. Водовмещающие породы представлены здесь преимущественно глинистыми сланцами и песчаниками, среди которых встречаются прослои эффузивных базальтов. За пределами впадины в выступах фундамента распространены метаморфические пароды палеозоя, в составе которых значительную долю занимают глинистые сланцы, гнейсы, известняки, аргиллиты и алевролиты, которые прорваны гранитами мезозоя (Государственная…, 2010). Климат района исследований резко континентальный. Годовое количество атмосферных осадков более чем в два раза ниже испаряемости.
Рис. 1.
Схема размещения озер на территории Восточного Забайкалья по приуроченности к бассейнам р. Ингода (I) и р. Онон (II), а также области внутреннего стока (III). В скобках указана абсолютная высота (м) расположения озера.
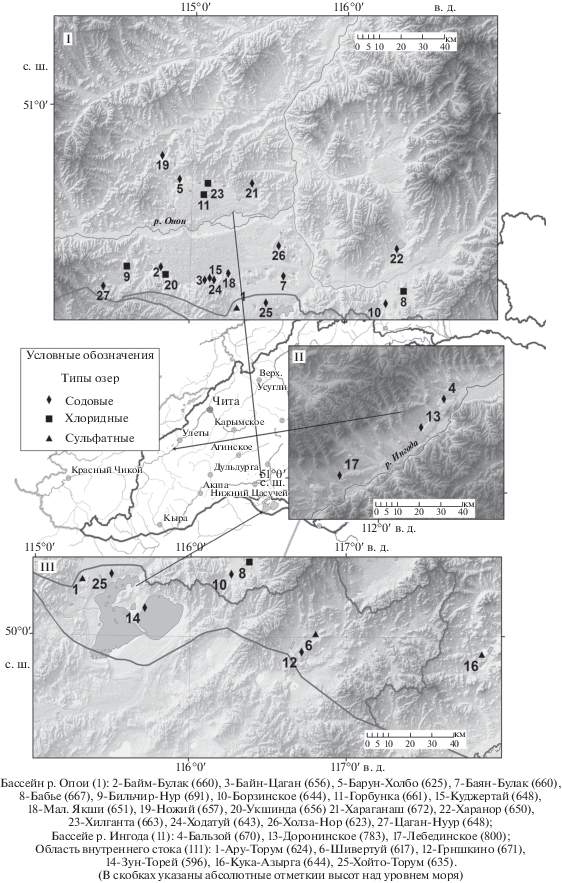
Подавляющее большинство озер (72%) относится к числу так называемых небольших водоемов площадью акватории от 1.0 до 10.0 км2. Крупные озера (более 10 км2) относительно малочисленны (4%), но их суммарная площадь сравнительно велика и составляет 82% от общей площади всех озер этого региона. Самые крупные это содовые озера Барун-Торей и Зун-Торей, акватории которых составляют в многоводный период 500 и 380 м2 соответственно. При значительной вариации площадей озер общим является их относительно небольшая глубина, как правило, не превышающая первых метров от зеркала воды. Наиболее глубокие это содовые озера, среди которых оз. Байн-Цаган (7.5 м), оз. Ножий (7.0 м) и оз. Доронинское (7.0 м) и др. Все озера бессточные, с отсутствием поверхностного стока, только во влажные периоды в отдельных случаях соединенные между собой временными руслами, но все изолированы от рек. Многие озера располагаются в замкнутых западинах, имеющих чаще всего характер концевого бассейна, собирающего грунтовые воды.
ПОДЗЕМНЫЕ ВОДЫ ВОДОСБОРНЫХ ТЕРРИТОРИЙ ОЗЕР
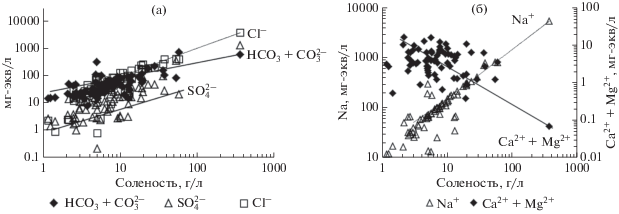
Нами были проанализированы грунтовые воды, отобранные на химический анализ из неглубоких скважин (до 30 м), родников и колодцев на водосборах рассматриваемых озер. Всего было отобрано и проанализировано 129 проб воды. По приуроченности к определенному бассейну все водопункты подземных вод, как и озера, были разделены на три группы (табл. 1), первая отнесена к речному бассейну р. Ингода, вторая – р. Онон и третья – бассейну внутреннего стока (Торейская равнина и бассейн р. Аргунь). Химический состав изученных нами подземных вод представлен в таблице 1. Как можно видеть из этих данных, на водосборных территориях озер развиты разнообразные по составу и солености подземные воды, минерализация которых изменялась от 0.10 до 3.79 г/л, а рН – от 6.47 до 9.24. Если принять во внимание содержания основных ионов более 20 г-экв %, то в бассейне р. Ингоды вода по химическому составу преимущественно HСO3–Сa–Mg–Na, с минерализацией, изменяющейся в пределах 0.11–1.34, при среднем 0.49 г/л и рН – 7.07–8.10, среднее 7.52. Выявляется следующая последовательность преобразования химического состава вод по мере увеличения их солености они переходят из HСO3–Сa–Mg в SO4–HСO3–Na–Mg–Сa. В бассейне р. Онон развиты воды с соленостью от 0.14 до 3.72, среднее 0.50 г/л и рН 6.47–9.24, среднее 7.87. Как и в первом случае, доминируют воды HСO3–Сa–Mg–Na состава. По средним оценкам отмечается рост Сl– по мере роста солености вод. Как правило, это воды HСO3–Na состава с повышенной минерализацией и рН. Аналогичная картина, но с более выраженным процессом засоления отмечается для подземных вод бассейна внутреннего стока. По всем трем статистическим параметрам значение минерализации и рН вод выше, чем в первых двух группах. В больших масштабах накапливаются здесь все основные анионы. В катионном составе доля Na+ достигает 86 г-экв %. Увеличиваются также содержания Mg2+, напротив, Сa2+ снижаются. В этом районе формируются преимущественно HСO3–Na воды.
РЕЗУЛЬТАТЫ ГИДРОХИМИЧЕСКИХ ИССЛЕДОВАНИЙ СОЛЕНЫХ ОЗЕР И ИХ ОБСУЖДЕНИЕ
Химический состав озер
Согласно принятой классификации нами было выделено три типа озер: содовые, с рН ≥ 9.0, которые в свою очередь были разделены на 3 подтипа; хлоридные, если рН < 9.0, а среди анионов преобладает хлор, и сульфатные, если рН < 9.0, но среди анионов доминирует сульфат. Состав типичных представителей каждого типа показан в табл. 2. Наибольшим распространением среди изученных озер пользуются озера содового типа, на долю которого приходится 87%, реже встречаются сульфатные (3%) и хлоридные типы (10%).
Таблица 2.
Основные параметры соленых озер Восточного Забайкалья по выделенным типам и подтипам
| Показатели | Ед. изм. | Содовый тип | Сульфатный тип, n = 3 | Хлоридный тип, n = 10 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Усредненный, n = 84 | I подтип, n = 37 | II подтип, n = 5 | III подтип, n = 42 | ||||||||||||||||
| Сред. | Мин. | Макс. | Сред. | Мин. | Макс. | Сред. | Мин. | Макс. | Сред. | Мин. | Макс. | Сред. | Мин. | Макс. | Сред. | Мин. | Макс. | ||
| Площадь зеркала озера | км2 | 7.45 | 0.13 | 260.00 | 11.80 | 0.13 | 260.00 | 0.85 | 0.20 | 1.42 | 1.89 | 0.18 | 13.30 | 2.42 | 3.80 | 7.27 | 0.83 | 0.15 | 1.67 |
| Глубина | м | 2.08 | 0.10 | 8.00 | 2.81 | 0.50 | 8.00 | 1.36 | 0.50 | 3.00 | 1.21 | 0.10 | 5.20 | 1.47 | 3.20 | 4.40 | 0.76 | 0.20 | 1.90 |
| pH | 9.53 | 9.02 | 10.74 | 9.47 | 9.02 | 10.74 | 9.53 | 9.20 | 9.83 | 9.55 | 9.09 | 10.02 | 8.74 | 8.32 | 8.90 | 8.17 | 7.40 | 8.70 | |
| Eh | мВ | –250 | –423 | 25 | –120 | –423 | 120 | 85 | –33 | 155 | –250 | –380 | 120 | 120 | 0 | 180 | –180 | –300 | 44 |
| СО2 | мг/л | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 | 144 | 132.0 | 156.0 |
| С${\text{O}}_{3}^{{2 - }}$ + HС${\text{O}}_{3}^{ - }$ | г/л | 3.10 | 0.05 | 30.00 | 3.49 | 0.42 | 30.00 | 4.29 | 0.63 | 17.00 | 2.85 | 0.24 | 22.13 | 0.81 | 0.07 | 1.80 | 0.50 | 0.06 | 2.11 |
| S${\text{O}}_{4}^{{2 - }}$ | 2.20 | 0.01 | 62.00 | 0.59 | 0.01 | 2.02 | 6.17 | 1.68 | 13.79 | 3.14 | 0.06 | 62.34 | 2.90 | 0.49 | 7.58 | 3.45 | 0.21 | 13.68 | |
| Сl– | 4.20 | 0.03 | 134.00 | 1.39 | 0.03 | 14.18 | 2.71 | 0.32 | 6.60 | 7.16 | 0.39 | 133.74 | 0.90 | 0.27 | 2.05 | 17.78 | 1.20 | 101.09 | |
| F– | 0.01 | 0.001 | 0.41 | 0.01 | 0.001 | 0.07 | 0.02 | 0.001 | 0.11 | 0.02 | 0.001 | 0.41 | 0.002 | 0.001 | 0.005 | 0.007 | 0.001 | 0.04 | |
| Сa2+ | 0.02 | 0.001 | 0.08 | 0.02 | 0.001 | 0.06 | 0.008 | 0.003 | 0.02 | 0.01 | 0.001 | 0.08 | 0.05 | 0.005 | 0.08 | 0.10 | 0.006 | 0.62 | |
| Mg2+ | 0.07 | 0.001 | 0.40 | 0.06 | 0.003 | 0.18 | 0.21 | 0.05 | 0.38 | 0.05 | 0.001 | 0.40 | 0.06 | 0.03 | 0.09 | 0.62 | 0.01 | 3.8 | |
| Na+ | 5.1 | 0.27 | 125 | 2.4 | 0.27 | 19 | 5.8 | 1.4 | 17 | 7.4 | 0.37 | 125 | 2.2 | 0.39 | 5.4 | 13 | 1.35 | 65 | |
| K+ | 0.06 | 0.002 | 0.44 | 0.05 | 0.003 | 0.44 | 0.16 | 0.05 | 0.36 | 0.06 | 0.002 | 0.20 | 0.02 | 0.01 | 0.04 | 0.08 | 0.01 | 0.24 | |
| Минерализация | 15 | 1.2 | 343 | 7.8 | 3.2 | 59 | 19 | 5.5 | 54 | 21 | 3.1 | 343 | 6.9 | 1.8 | 17 | 35 | 4.6 | 185 | |
| Si | мг/л | 5.5 | 2.3 | 22.0 | 6.4 | 3.6 | 22.0 | 5.9 | 4.5 | 6.8 | 4.8 | 2.3 | 10.0 | 3.6 | 2.9 | 4.1 | 3.6 | 3.4 | 4.5 |
| Al | 0.35 | 0.01 | 17.00 | 0.17 | 0.01 | 3.50 | 0.38 | 0.01 | 2.10 | 0.50 | 0.01 | 17.00 | 0.20 | 0.07 | 0.40 | 0.13 | 0.02 | 0.42 | |
| Fe | 0.440 | 0.001 | 18.000 | 0.340 | 0.001 | 2.600 | 0.140 | 0.010 | 0.520 | 0.590 | 0.010 | 18.000 | 0.230 | 0.080 | 0.390 | 0.080 | 0.010 | 0.260 | |
| As | 0.420 | 0.001 | 6.000 | 0.530 | 0.001 | 1.400 | 0.530 | 0.010 | 1.700 | 0.310 | 0.020 | 6.000 | 0.070 | 0.030 | 0.140 | 0.100 | 0.014 | 0.280 | |
| Br | 30.00 | 0.03 | 624.00 | 12.00 | 0.03 | 152.00 | 24.00 | 3.50 | 74.00 | 48.00 | 3.20 | 624.00 | 5.00 | 2.10 | 10.00 | 84.00 | 11.00 | 369.00 | |
| Sr | 0.55 | 0.07 | 9.20 | 0.40 | 0.08 | 1.60 | 0.83 | 0.09 | 3.3.00 | 0.66 | 0.07 | 9.20 | 0.59 | 0.24 | 0.97 | 4.4 | 0.13 | 19.00 | |
| Mo | 0.12 | 0.003 | 3.00 | 0.06 | 0.003 | 0.54 | 0.78 | 0.013 | 3.00 | 0.09 | 0.01 | 0.92 | 0.07 | 0.02 | 0.16 | 0.09 | 0.02 | 0.38 | |
| U | 0.22 | 0.003 | 11.00 | 0.07 | 0.003 | 0.36 | 1.00 | 0.003 | 5.40 | 0.23 | 0.01 | 11.00 | 0.07 | 0.01 | 0.14 | 0.08 | 0.02 | 0.25 | |
| Th | мкг/л | 2.90 | 0.01 | 209.00 | 0.64 | 0.01 | 13.00 | 0.80 | 0.01 | 4.40 | 5.50 | 0.01 | 209.00 | 0.20 | 0.03 | 0.53 | 0.04 | 0.01 | 0.10 |
| Li | 107.0 | 2.0 | 646.0 | 183.0 | 2.0 | 326.0 | 266.0 | 101.0 | 646.0 | 88.0 | 5.2 | 585.0 | 157.0 | 85.0 | 242.0 | 269.0 | 62.0 | 1470.0 | |
| Ni | 8.14 | 0.94 | 243.47 | 4.94 | 0.94 | 65.59 | 55.68 | 3.01 | 243.47 | 5.41 | 1.24 | 26.60 | 16.75 | 5.00 | 24.48 | 4.94 | 1.18 | 8.14 | |
| Сu | 27.04 | 0.79 | 437.56 | 6.40 | 0.79 | 31.01 | 179.67 | 2.31 | 437.56 | 23.81 | 1.00 | 303.86 | 140.09 | 9.50 | 236.28 | 6.01 | 1.90 | 27.04 | |
| Co | 1.73 | 0.01 | 77.61 | 0.70 | 0.01 | 5.03 | 14.10 | 0.66 | 77.61 | 0.93 | 0.12 | 12.70 | 16.9 | 0.80 | 33.3 | 0.54 | 0.24 | 0.93 | |
| S2– | 508.7 | 5 | 370200 | 861 | <5.0 | 370 200 | 6.7 | <5.0 | 37.3 | 572.2 | 5 | 6700 | 19 | <5.0 | 27.8 | 469 | <5.0 | 1250 | |
| SO4/Сl | – | 0.57 | 0.01 | 5.85 | 0.81 | 0.01 | 5.85 | 2.14 | 1.09 | 4.52 | 0.36 | 0.03 | 1.05 | 1.54 | 1.21 | 2.05 | 0.15 | 0.1 | 0.26 |
| δ34${\text{S}}_{{{\text{VCDT}}}}^{{{\text{6 + }}}}$ | ‰ | 15.9 | –8.4 | 27.4 | 14.9 | 1.7 | 26.2 | 4.3 | –0.9 | 8.8 | 16.8 | –8.4 | 27.4 | 7.7 | 1.1 | 9.3 | 18.2 | 16 | 22.1 |
| δ34${\text{S}}_{{{\text{VCDT}}}}^{{{\text{2}} - }}$ | –13.1 | –30.8 | 13 | –12.7 | –26.3 | 13 | –7.5 | –18.6 | 0.2 | –14.8 | –30.8 | 0.9 | – | – | – | –2.8 | –5.6 | 1.2 | |
Основным отличием I подтипа содовых озер является относительно низкая минерализация их вод (среднее 7.78 г/л) при среднем значении рН равном 9.47. По средним оценкам содержание ${\text{HСO}}_{3}^{ - }$ + ${\text{СO}}_{3}^{{2 - }}$ здесь равно 3.49 г/л, что в относительных единицах измерения составляет 55 г-экв %. Минимум определен в солоноватом оз. Хойто-Торум, а максимум в наиболее соленом и щелочном оз. Куджертай. Содержание S${\text{O}}_{4}^{{2 - }}$ варьируют от 0.01 в солоноватом оз. Лебединское до 2.02 г/л в более минерализованном оз. Ара-Торум (среднее по выборке – 0.59 г/л или 15 г-экв %). Концентрации Сl– изменяются в еще большем диапазоне от 0.03 (оз. Лебединское) до 14.18 (оз. Куджертай), среднее 1.39 г/л (30 г-экв %). В катионном составе доминирует Na+, количество которого изменяются от 0.27 в оз. Хойто-Торум до 18.57 г/л в оз. Куджертай при среднем значении по выборке 2.35 г/л (87 г-экв %). Вторым является Mg2+ с концентрацией от 0.003 в солоноватом оз. Баян-Булак до 0.18 г/л в том же оз. Куджертай при среднем значении 0.06 г/л (10 г-экв %). В сопоставимых количествах присутствуют K+ и Сa2+, усредненное количество которых равно 0.05 и 0.02 г/л (1.3 и 1.8 г-экв %) соответственно.
Немногочисленные содовые озера II подтипа более щелочные (среднее рН 9.53) и минерализованные (среднее 19.40 г/л). Диапазон варьирования содержания ${\text{SO}}_{4}^{{2 - }}$ находится в границах от 1.68 в солоноватом оз. Хараганаш до 13.79 мг/л в рассольном оз. Гришкино при среднем значении 6.17 г/л. В сумме анионов на их долю приходится от 38 до 59 при среднем 42 г-экв %. Абсолютные содержания ${\text{HСO}}_{{\text{3}}}^{ - }$ + ${\text{СO}}_{3}^{{2 - }}$ здесь выше (4.29 г/л), чем в озерах I подтипа. Аналогичная ситуация складывается и с Сl– (2.71 г/л). Доли Сl– и ${\text{HСO}}_{{\text{3}}}^{ - }$ + ${\text{СO}}_{3}^{{2 - }}$ в среднем равны 34 и 24 г-экв % соответственно. Среди катионов основным является также Na+, усредненная концентрация которого составляет 5.83 г/л (или 88 г-экв %).
III подтип в пределах содового типа отличается относительно высокой минерализацией (21.20 г/л) и рН (9.55) вод. Основным анионом здесь является уже Cl–, концентрация которого варьирует от 0.39 г/л в солоноватом оз. Цаган-Нуур до 133.74 г/л в рассольном оз. Борзинское при среднем значении 7.16 г/л (60 г-экв %). Сумма содержаний ${\text{HСO}}_{{\text{3}}}^{ - }$ + ${\text{СO}}_{3}^{{2 - }}$ меняется от 0.24 в оз. Барун-Холво-2 до 22.13 г/л в оз. Борзинское, при средней величине 2.85 г/л или 25 г-экв % в рамках содового типа.
Максимальное значение ${\text{SO}}_{4}^{{2 - }}$ (62.34 г/л) определено также в самом соленом оз. Борзинское, а минимальное (0.06 г/л) в солоноватом оз. Цаган-Нуур при среднем значении 3.14 г/л. По средним оценкам доля ${\text{SO}}_{4}^{{2 - }}$ равна, как и в I подтипе, 15 г-экв %. Среди катионов со значительным преимуществом доминирует Na+, усредненное содержание которого равно 7.39 г/л или 95 г-экв %. В сопоставимых количествах между собой присутствуют Mg2+ и K+, средние концентрации которых равны 0.05 и 0.06 г/л или 3 г-экв %. В этом подтипе количество Ca2+ ниже (0.001–0.08 г/л) составляя в среднем 0.01 г/л (1 г-экв %).
В целом в содовом типе озер переход от I подтипа к последующему сопровождается ростом минерализации воды и рН. Одновременно увеличиваются содержания всех основных анионов и натрия, напротив, по мере роста солености в сумме концентрации кальция и магния снижаются (рис. 2).
Содовые озера выделяются более высокими концентрациями F (до 0.41, среднее 0.01 г/л), As (до 6.00 среднее 0.42 мг/л), U (до 11.00, среднее 0.22 мг/л), Th (до 209.00, среднее 2.90 мкг/л), РЗЭ (до 109.00, среднее 8.30 мкг/л).
Среди изученных озер можно выделить только три озера сульфатного типа. Этот тип выделяется относительно низкой минерализацией (от 1.83 до 16.90, среднее 6.91 г/л), но высокой сульфатностью (${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ – 51 г-экв %) вод. Значение рН изменяется от 8.32 до 8.90, среднее 8.74. Самое соленое и менее щелочное в этой группе водоемов оз. Барун-Шивертуй. Оно отличается максимальными концентрациями ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ (7.58 г/л) и Cl– (2.05 г/л). В наименее минерализованном оз. Кука-Азырга содержание ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ равно 0.49 г/л (40 г-экв %). Вторым по значимости является ${\text{CO}}_{3}^{{2 - }}$ + ${\text{НСО}}_{3}^{ - }$ в количестве 0.81 (34 г-экв %). На долю Cl– приходится всего 28 г-экв % или 0.27 г/л. Основным катионом выступает также Na+, с содержанием от 0.39 до 5.35 г/л при среднем значении по выборке равным 2.18 г/л (82 г-экв %). Вторым является Mg2+ со средним содержанием 0.06 г/л (11 г-экв %). Количество Ca2+ не выходит за пределы 0.005–0.08 при среднем значении 0.05 г/л (5 г-экв %). В минимальных количествах присутствует здесь K+ (0.01–0.04, среднее 0.02 г/л).
Хлоридные озера отличаются максимальной по всей выборке соленостью (35.20 г/л) и минимальным значением рН вод (8.17). Минерализация изменяется от 4.63 в оз. Укшинда до 184.8 г/л в оз. Горбунка, а величина рН от 7.40 в рассольном оз. Бильчир-Нуур до 8.70 в том же солоноватом оз. Укшинда. На долю Cl– здесь приходится в среднем 80 г-экв %, при этом по мере роста солености вод его процент неуклонно растет (до 90 г-экв %). В абсолютных единицах измерения концентрации Cl– варьируют от 1.20 в оз. Укшинда до 101.09 г/л в оз. Горбунка при среднем значении 17.78 г/л. Усредненное количество сульфатов равно 3.45 (12 г-экв %.) при минимуме 0.21 и максимуме 13.68 г/л в указанных выше озерах. Производные угольной кислоты присутствуют еще в меньших количествах и преимущественно в форме ${\text{HСO}}_{{\text{3}}}^{ - }$ с содержанием от 0.06 до 2.11 г/л при среднем значении 0.50 г/л. С ростом солености сумма карбонатов резко снижается до 0.06 г/л, напротив, содержание Cl– и ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ увеличивается (рис. 3). Доля Na+ остается высокой, составляя в среднем 91 г-экв %. Его абсолютное содержание варьирует от 1.35 до 65.00 при среднем 12.47 г/л. Максимальная концентрация Ca2+ равна 0.62 г/л, что составляет 3 г-экв %, зафиксированная в наименее щелочном оз. Бильчир-Нуур при среднем его значении 1 г-экв %. Максимум Mg2+ 3.79 г/л (19 г-экв %) определен в оз. Хилганта. Наиболее высокая концентрация K+ (0.24 г/л) отмечается в наиболее соленом оз. Горбунка.
Рис. 3.
Зависимость содержаний ведущих анионов (а) и катионов (б) от минерализации хлоридных и сульфатных озер.
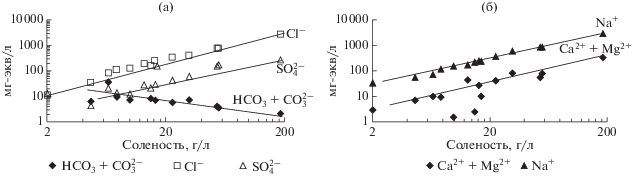
В хлоридных в больших количествах присутствуют Br (до 369.00, среднее 84.00 мг/л), Sr (до 19.00, среднее 4.40 мг/л), Li (до 1470, среднее 269 мкг/л). В сульфатных озерах накапливаются Cu (до 236.3, среднее 140.1 мкг/л), Со (до 33.3, среднее 16.9 мкг/л) и Ni (до 24.5, среднее 16.8 мкг/л).
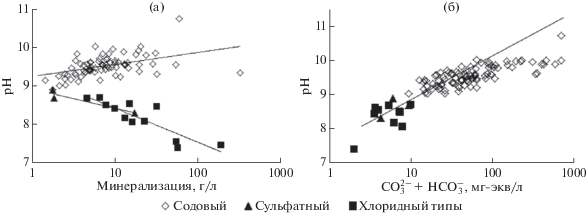
Анализ полученных данных показал, что во всех выделенных типах и подтипах озер среди катионов резко доминирует натрий, концентрация которого по мере увеличения минерализации вод растет. В хлоридных и сульфатных озерах с ростом солености не накапливаются карбонаты, в то время как в содовых их содержание неуклонно растет. Одновременно повсеместно увеличиваются концентрации хлорид- и сульфат-ионов. Однако рост содержаний Cl–, за небольшим исключением, существенно опережает рост ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$ Более сложной оказалась зависимость солености от рН вод, т.е. в содовых озерах значение рН воды растет с ростом солености, а в хлоридных и сульфатных, наоборот уменьшается (рис. 4а). Одновременно с ростом значений рН растут содержания карбонатов (рис. 4б).
Вторичное минералообразование
С целью выявления условий формирования определенного типа озер были рассчитаны индексы насыщения SI озерных вод вторичными минералами и построены зависимости изменения параметра насыщения от различных показателей раствора. В расчеты включены те минералы, которые наиболее часто встречаются во вмещающих породах водосборных территорий озер и в их донных отложениях. В табл. 3 приведены все основные показатели, необходимые для формирования определенного вторичного минерала для каждого типа природной воды. Анализ полученного материала позволил выявить следующие закономерности.
Таблица 3.
Необходимые геохимические параметры для формирования определенного вторичного минерала
| Минерал | Подземные воды | Содовый тип | Сульфатный тип | Хлоридный тип | ||||
|---|---|---|---|---|---|---|---|---|
| Каолинит | М = 0.1 г/л рН 6.5 Si = 3.3 мг/л | М = 1.0 г/л рН 9.0 Si = 2.3 мг/л | М = 1.8 г/л рН 8.32 Si = 2.9 мг/л | М = 4.6 г/л рН 7.4 Si = 0.37 мг/л | ||||
| Сa–Mt* | M > 0.2
рН > 7.1–7.5 Si > 5.0 мг/л |
Ca не зависит | M > 1.0 г/л
рН > 9.0 Si > 4.8 мг/л |
Ca не зависит | M > 1.8 г/л
рН > 8.3 Si > 4.8 мг/л |
Ca не зависит | 4.6 < M > 15.0 г/л рН > 8.1 Si > 1.5 мг/л |
Ca не зависит |
| Na–Mt | Na > 0.007 г/л | Na > 0.27 г/л | Na > 0.40 г/л | 2.0 < Na < 7.0 г/л | ||||
| Иллит | K > 0.0002 г/л | K > 0.002 г/л | K > 0.006 г/л | K > 0.01 г/л | ||||
| Кальцит | M > 0.6 г/л рН > 7.3 НСО3 + СО3 > 0.2 г/л Ca > 0.03 г/л |
M > 1.0 г/л рН > 9.0 НСО3 + СО3 > 0.2 г/л Ca > 0.001 г/л |
M > 1.8 г/л рН > 8.3 НСО3 + СО3 > 0.5 г/л Ca > 0.005 г/л |
M > 4.6 г/л рН > 7.4 НСО3 + СО3 > 0.3 г/л Ca > 0.007 г/л |
||||
| Доломит | M > 1.0 г/л рН > 8.1 НСО3 + СО3 > 0.3 г/л Ca Mg > 0.1 г/л |
M > 1.0 г/л рН > 9.0 НСО3 + СО3 > 0.3 г/л Ca + Mg > 0.01 г/л |
M > 1.8 г/л рН > 8.7 НСО3 + СО3 > 0.5 г/л Ca+ Mg > 0.05 г/л |
M > 4.6 г/л рН > 7.4 НСО3 + СО3 > 0.2 г/л Ca+Mg > 0.02 г/л |
||||
| Мусковит | M > 0.3 г/л рН > 7.7 K > 0.001 г/л |
M > 1.0 г/л рН > 9.0 K > 0.002 г/л |
M > 1.9 г/л рН > 8.3 K > 0.002 г/л |
4.6 < M < 31.0 г/л рН > 8.1 0.01 < K < 0.10 г/л |
||||
| Mg–хлорит | M > 0.6 г/л рН > 8.1 Mg > 0.03 г/л |
M > 1.0 г/л рН > 9.0 Mg > 0.001 г/л |
M > 2.0 г/л рН > 8.9 Mg > 0.04 г/л |
M < 6.6 г/л рН > 8.5 Mg не зависит |
||||
| Пренит | M > 1.1 г/л рН > 8.5 Si > 8.3 мг/л |
M > 1.0 г/л рН > 9.0 Si > 5.0 мг/л |
1.9 < M < 16.0 г/л рН > 8.7 Si > 5 мг/л |
– | ||||
| Сепиолит | M > 1.9 г/л рН > 8.7 Si > 8.5 мг/л | M > 1.2 г/л рН > 9.0 Si > 6.0 мг/л | – | |||||
| Ломонтит | M > 2.1 г/л рН > 8.8 Si > 7.1 мг/л | M не зависит рН > 9.0 Si > 4.8 мг/л | – | |||||
| Флюорит | – | M > 5.0 г/л рН > 9.3 F– > 0.02 г/л | – | |||||
| Альбит | – | M > 8.0 г/л рН > 9.4 Na > 2.0 г/л | – | |||||
| Гейлюссит | – | M > 10.0 г/л рН > 9.2 НСО3+СО3 > 1.4 г/л Na > 2.4 г/л |
– | |||||
| Гипс | – | – | – | M > 56.0 г/л рН > 7.4 Ca > 0.6 г/л SO4 > 8.8 г/л |
||||
| Мирабилит | – | M > 343 рН > 9.4 Na > 125 г/л SO4 > 62 г/л |
– | |||||
| Сода | – | M > 130.0 рН > 9.2 НСО3+СО3 > 19.0 г/л Na > 44.0 г/л |
– | |||||
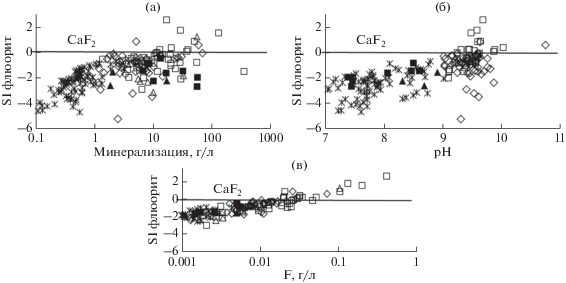
Для формирования кальцита необходимо, чтобы минерализация была более 0.6 г/л, а рН > 7.3 (рис. 5а). Незначительный рост солености вод (>1.0 г/л), рН, количества Ca2+ + Mg2+ (>0.01 г/л) приводит к насыщению вод уже доломитом (рис. 5б). Гейлюссит формируется исключительно в содовых озерах. В данном случае обязательными условиями являются: более высокое значение минерализации воды (>10.0 г/л), рН (>9.2), ${\text{НСО}}_{3}^{ - }$ + ${\text{СО}}_{3}^{{2 - }}$ (>1.4) и Na+ (>2.4 г/л) (рис. 5в). Для насыщения вод содой надо, чтобы соленость была более 130 г/л, рН > 9.4, а ${\text{НСО}}_{3}^{ - }$ + ${\text{СО}}_{3}^{{2 - }}$ > 19.0 и Na+ > 44.0 г/л (рис. 5г). Гипс и мирабилит формируются в единичных случаях, но в разных озерах. Насыщение вод гипсом отмечается в единственном хлоридном оз. Бильчир-Нуур, с соленостью 55 г/л, рН 8.47, содержанием Сa2+ и ${\text{SO}}_{4}^{{2 - }}$ 0.6 и 8.75 г/л соответственно. Мирабилит образуется в содовом оз. Борзинское с соленостью 343 г/л, рН 9.34, концентрацией Na+ 125.0 и ${\text{SO}}_{4}^{{2 - }}$ 62.3 г/л. В тоже время все природные воды остаются не равновесны с такими сульфатными минералами, как бледит, глауберит и эпсомит. Не равновесны воды с хлоридными солями, в частности с гидрогалитом и галитом (Борзенко, 2018). С флюоритом достигается равновесие вод исключительно в содовых озерах с соленостью вод более 5.0 г/л и рН > 9.30 при концентрации F– > 0.02 г/л (рис. 6).
Рис. 5.
Зависимость параметра степени насыщения вод кальцитом (а), доломитом (б), гейлюсситом (в), содой (г) от минерализации и рН.
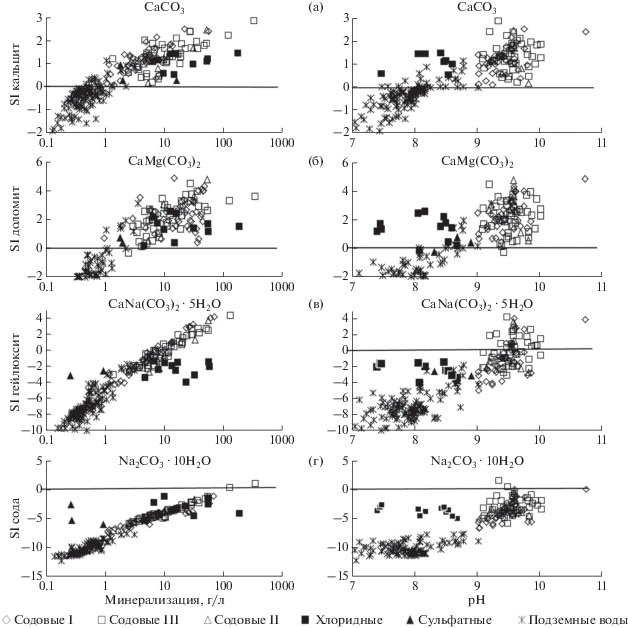
Рис. 6.
Зависимость параметра степени насыщения вод флюоритом от минерализации (а), рН (б) и содержания фтора (в). Условные обозначения по аналогии с рис. 5.
Наличие в озерах сероводорода способствует образованию сульфидов железа, преимущественно гидротроилита и пирита. Наряду с этим железо в восстановительной среде может формировать сидерит. В окислительных условиях термодинамически выгодно образование широкого ряда различных оксидов и гидроксидов, преимущественно железа (Борзенко, 2018).
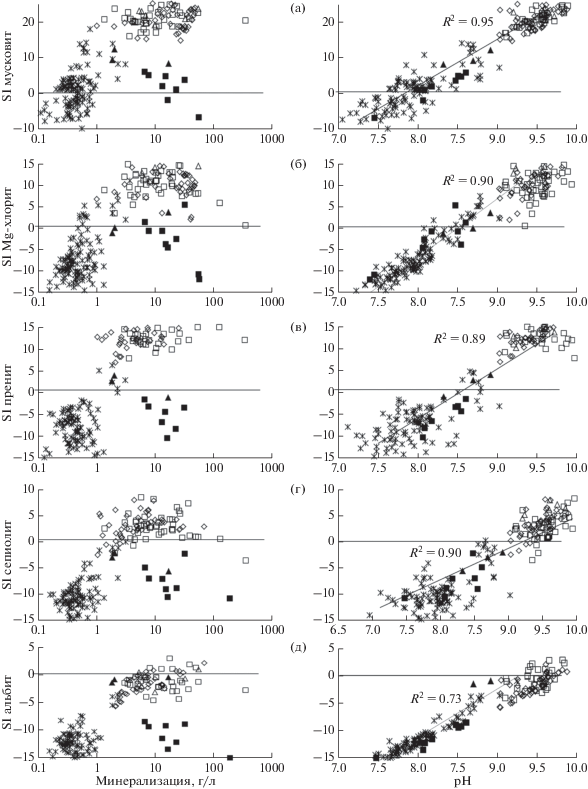
Возможность формирования аутигенных алюмосиликатных минералов, в частности глин и гидрослюд, продиктовано следующими условиями. Насыщение воды каолинитом возможно уже при минерализации равной 0.1 г/л, рН 6.9, содержании Si 0.37 мг/л и Al 0.18 мкг/л (рис. 7а). Для формирования монтмориллонитов и иллитов необходимо, чтобы солёность вод была уже более 0.2 г/л, рН > 7.1–7.5, а содержание Si > 4.5 мг/л (рис. 7б). Мусковит и Mg-хлорит образуются при относительно небольшой минерализации, но в более щелочной среде (рН > 7.7 и 8.1 соответственно) (рис. 8а, 8б). Следующая группа алюмосиликатов – пренит, сепиолит и ломонтит образуются при солености свыше 1.0 г/л и рН > 8.5, с содержанием Si > 5.0 мг/л, такие условия чаще соблюдаются для содовых озер и реже для сульфатных и не характерны для хлоридных озер (рис. 8в, 8г). Рост солености (>8.0), рН (>9.4), содержания Na (>1.5 г/л) и (Si > 6.5) мг/л вод приводит к насыщению вод альбитом (рис. 8д). Такие условия складываются исключительно для более минерализованных и щелочных вод содовых озер.
Рис. 7.
Зависимость параметра степени насыщения вод каолинитом (а) и Са-монтмориллонитом (Са-Мt) от минерализации, рН и содержания кремния. Условные обозначения по аналогии с рис.5.
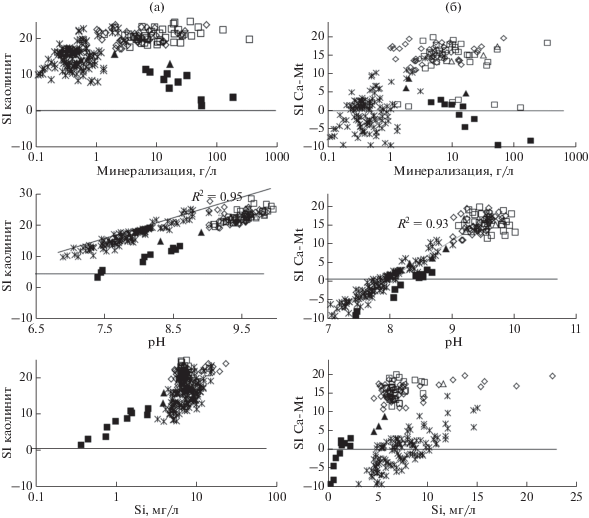
Рис. 8.
Зависимость параметра степени насыщения вод мусковитом (а), Mg-хлоритом (б), пренитом (в), сепиолитом (г), альбитом (д) от минерализации и рН вод. Условные обозначения по аналогии с рис.5.
В соответствии с полученными данными выходит, что состав того или иного вторичного минерала контролируется определенным химическим составом, рН и соленостью вод. А это значит, что между этими параметрами и минеральными новообразованиями существует парагенетическая связь. При этом, чем выше значение рН, тем к большему количеству минеральных новообразований вода приходит в равновесие. Заметим, что содовые озера как бы продолжают виток эволюции подземных вод, занимая при этом наивысшие позиции на графиках. Напротив, наиболее минерализованные хлоридные и сульфатные озера, в сравнении с содовыми, находятся на более низких позициях, в сравнении с содовыми, зачастую оставаясь на стадии формирования глин.
Термодинамические расчеты подтверждаются рентгенофазовым анализом донных осадков 30 озер, в составе которых обнаружены кальцит, доломит, глинистые минералы, полевые шпаты (преимущественно альбит), кварц (табл. 4). Значительная часть глинистого материала представлена гидрослюдой, несовершенным смектитом, смешаннослойными минералами (хлорит и смектит), на долю которых приходится в среднем 30% от общей массы донных осадков. Во всех пробах отмечается рентгеноаморфная фаза, состоящая из органических соединений, окислов и гидроксидов, сульфидов железа. В среднем в содовых озерах по сравнению с хлоридными в общей массе минералов выше доля кварца (46% – в содовых и 15% – в хлоридных) и альбита (40 и 35% соответственно). Карбонатные минералы кальцит и доломит присутствуют повсеместно в объеме до 20% кальцита (содовое оз. Гришкино) и 15% доломита (хлоридное оз. Бабье и содовое III подтипа оз. Холза-Нор). Наличие соды и мирабилита определено в донных осадках самого соленого содового оз. Борзинское, а гейлюссита в оз. Доронинское.
Таблица 4.
Средние содержания основных минералов донных осадков разнотипных озер (%), определенных методом РФА
| Минерал | Содовый | Сульфатный | Хлоридный |
|---|---|---|---|
| Альбит, ортоклаз, микроклин | 40.0 | 35.0 | 35.0 |
| Кварц | 46.0 | 35.0 | 15.0 |
| Кальцит | 14.6 | 10.9 | 10.8 |
| Доломит | 5.6 | 5.0 | 5.8 |
| Каолинит | + | + | + |
| Смектит | + | + | + |
| Хлорит | + | + | + |
Считается, что полевые шпаты привносятся в озера с территории водосбора. С целью выявления их генезиса в период ледостава в центральной части, на разных глубинах меромиктического содового (I подтип) соленого (>30 г/л) оз. Доронинское были установлены седиментационные ловушки. В которых спустя 3 месяца повсеместно был обнаружен альбит. Что доказывает, что среди кислых полевых шпатов возможно образование аутигенного альбита. Понятно, что в донных осадках доля его несравнимо мала по сравнению с терригенным. Помимо альбита в массе минералов доминировал кальцит, на долю которого приходилось до 80%. В меньших количествах выявлены оксиды и оксигидроксиды железа: маггемит Fe2O3, лепидокрокит FeO(OH), гётит FeO(OH), которые установлены на границе смены сероводородной на глеевую обстановку (0 < Eh < 100 мВ). В следовых количествах были определены доломит, моногидрокальцит CaCO3 ⋅ H2O и несквегонит MgCO3 ⋅ (H2O)3.
Поведение серы в озерах
Как было показано ранее, в большинстве изученных озер не происходит пропорционального накопления ${\text{SO}}_{4}^{{2 - }}$ с Cl–, хотя согласно существующим представлениям по мере роста солености вод в процессе испарения они должны накапливаться приблизительно в равных соотношениях, по крайней мере, до садки гипса (Shvartsev, 2000). Отставание в накоплении в озерах ${\text{SO}}_{4}^{{2 - }}$ от Cl– объясняется процессом сульфатредукции, активно протекающем в большинстве исследованных озер (85% озер). Из них выделены алкалофильные сульфатредуцирующие бактерии Desulfonatronum laсustre, Desulfonatronumaсeae δ-подкласса Proteobaсteria (Захарюк, 2010). Одним из продуктов реакций бактериального восстановления сульфатов является сероводород, содержание которого достигает 370.0 мг/л (придонный слой оз. Доронинское) (табл. 2). Наиболее высокие его концентрации определены в хлоридных и содовых озерах I и III подтипов, со средним содержанием 469.0, 861.0 и 572.2 мкг/л соответственно. В сульфатных и содовых озерах II подтипа содержания сероводорода ниже на один и даже два порядка (19.0 и 6.7 мкг/л соответственно).
Известно, что сульфатредукция сопровождается фракционированием серы с накоплением тяжелого ее изотопа в остаточных сульфатах, а легкого в сульфидах (Гриненко и Гриненко, 1974; Chen et al., 2008; Matsuo et al., 1978 и др.). В озерах среднее значение δ34S растворенных сульфатов равно 10‰, хотя диапазон варьирует от –8.4 до 27.4‰, определенных в первом случае в оз. Харанор, а во втором – оз. Ходатуй. В озерах с изотопно-легкой серой не обнаружено признаков сульфатредукции. Как правило, здесь доминирует окислительная обстановка (табл. 2). По средним значениям δ34S облегченный состав серы характерен для сульфатных (7.7‰) и содовых озер II подтипа (4.2‰) с диапазоном вариаций от –0.9‰ в содовом оз. Гришкино до 9.3‰ сульфатном оз. Барун-Шивертуй. Большая часть этих озер локализована в пределах интрузивных образований, несущих сульфидную минерализацию, отсюда окисление сульфидов (в основном пирита) водовмещающих пород водосборных площадей приводит к накоплению в озерах сульфат-ионов с относительно легкой серой. Максимальное обогащение сульфатов 34S отмечено в содовом оз. Ходатуй с высоким содержанием в воде сероводорода (6.7 мг/л) и низким значением SO4/Cl. В целом выявляется следующая закономерность: чем больше в озерах присутствует восстановленной серы, тем ниже значение коэффициента SO4/Сl и тем изотопно-тяжелей становится сера ${\text{SO}}_{4}^{{2 - }}$ (рис. 9).
Рис. 9.
Связь значений коэффициента SO4/Сl с содержанием сульфидной серы (а) и δ34S $\left( {{\text{SO}}_{4}^{{2 - }}} \right)$ (б).
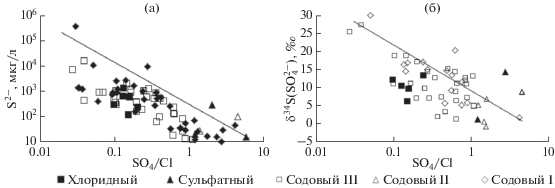
Определенные изотопные отношения S2– варьируют от 13 в оз. Доронинское до –30.8‰ оз. Малые Якши. Фракционирование изотопов серы отмечается по большинству озер с относительно высоким содержанием в них сероводорода. В среднем коэффициент фракционирования составляет 1.023‰, с наибольшей величиной для содовых озер III подтипа (1.031‰).
Испарение
Eще один важный процесс, который неотъемлемо связан с формированием озер, это испарительное концентрирование вод. В аридных условиях исследуемого региона широко развиты процессы континентального засоления, начальная стадия которых отчетливо проявляется уже в формировании содовых грунтовых вод с повышенной минерализацией и рН. В таких условиях процессы испарительного концентрирования обеспечивают прогрессивное накопление солей, как в грунтовых водах, так и озерах. В связи с этим первостепенной задачей стало определение степени испарения воды в озерах. В качестве показателя степени испарения использовался Cl как наиболее консервативный компонент, не вступающий в реакции взаимодействия с образованием вторичных минералов в исследованном диапазоне солености, а также не принимающий участие в сорбционных и биохимических процессах. По среднему его содержанию в грунтовых водах определенного бассейна (р. Ингоды или р. Онон) или области внутреннего стока и его концентрации в конкретном озере того же района была рассчитана степень испарения озерных вод (табл. 5).
Таблица 5.
Степень испарения озерных вод в выделенных типах и подтипах озер
| Показатели | Содовый тип | Сульфатный тип | Хлоридный тип | |||
|---|---|---|---|---|---|---|
| Усредненный | I подтип | II подтип | III подтип | |||
| Среднее | 141* | 45 | 55 | 202 | 18 | 722 |
| Минимум | 2 | 2 | 5 | 12 | 4 | 44 |
| Максимум | 2218 | 487 | 105 | 2218 | 33 | 3744 |
Полученные данные показывают, что испарение озерной воды колеблется в широких пределах от 2 до 3744, среднее 280. Минимум относится к солоноватым содовым озерам, а максимум к рассолам хлоридного типа (оз. Горбунка). Если сравнивать этот показатель между разными типами озер, то его минимальные значения характерны для сульфатных озер, а максимальные – для хлоридных. Содовые озера занимают промежуточное положение. Внутри содового типа отмечается постепенное увеличение величины степени испарения от I к III подтипу.
Справедливость полученных цифр в целом подтверждается и проведенными нами расчетами водного баланса для некоторых озер (Борзенко, 2018). Оказалось что соотношение приходной и расходной составляющих в изученных озерах разные. Так, в содовых озерах (Доронинское, Бальзой, Зун-Торей, Байн-Цаган, Баян-Булак, Ножий) отношение приходной части воды к расходной колеблется в пределах 0.60–0.99, а в хлоридных (Горбунка, Хилганта, Бильчир-Нуур, Дабаса-Нор) оно значительно ниже и составляет только 0.46–0.52. Возможно, что такая картина частично связана и с еще одним фактором: изученные содовые озера геоморфологически расположены ниже, чем хлоридные, абсолютные отметки уровней воды первых колеблются от 629 до 657 м, а вторых – от 661 до 691 м, т.е. первые дренируют более глубокие горизонты воды, отсюда они глубже и имеют больший объем воды.
Геохимические особенности формирования соленых озер
Учитывая все изложенное выше, появилась возможность выделить основные параметры формирования определенного геохимического типа озер (табл. 6). Для содового типа такими являются: Ca, Mg, K, Na, ${\text{HCO}}_{3}^{ - },$ ${\text{CO}}_{3}^{{2 - }},$ Si, F, которые связываются карбонатами, глинами, гидрослюдами, цеолитами, хлоритами, фторидами, Na-полевым шпатом, мирабилитом (на высших стадиях осолонения водоема); сульфатредукция, сопровождающаяся разделением изотопов серы; относительно невысокая степень испарения. Высокие значения рН и содержание Na, ${\text{HCO}}_{3}^{ - },$ ${\text{CO}}_{3}^{{2 - }},$ Cl–, реже ${\text{SO}}_{4}^{{2 - }},$ а также F, Sc, Ti, V, Cr, Mn, Fe, Al, Zn, Zr, Y, Nb, Hf, Ta, W, Mo, Re, As, Th, U, РЗЭ, но относительно низкое значение Eh (155…–423 мВ). Для сульфатных озер такими показателями служат: ${\text{SO}}_{4}^{{2 - }},$ Na, Ca, Mg, K, Si, содержание которых, контролируется вторичными минералами, такими как монтморилониты, иллиты, кальцит, доломит, реже цеолиты и гидрослюды; рН < 9.0; Eh ≥ 0; наличие дополнительного источника ${\text{SO}}_{4}^{{2 - }},$ облегченный изотопный состав серы, а также низкая степень испарения воды. Этот тип выделяется окислительной обстановкой, относительно высокой долей ${\text{SO}}_{4}^{{2 - }}$ (>40 г-экв %), накоплением в водах таких микроэлементов как Cu, Ni, Co. Для хлоридного типа озер характерными признаками являются относительно низкие значения рН (<9.0), Eh (44…–300 мВ), высокая соленость воды, значительная доля в анионном составе Cl– (>50 г-экв %), но низкая карбонатность (<20 г-экв %), повышенные концентрации Ва, Rb, B, Br, Se, Sr и Li. Равновесие с карбонатами кальция и магния, каолинитом, реже монтмориллонитом, иллитом, Mg-хлоритом и гипсом; сульфатредукция и высокая степень испарения воды.
Таблица 6.
Основные показатели различных геохимических типов соленых озер
| Тип озер | Контролирующие показатели | Вторичные минералы | Основные особенности состава воды |
Степень испарения |
|---|---|---|---|---|
| Содовый | рН, ${\text{HCO}}_{3}^{ - },$${\text{CO}}_{3}^{{2 - }},$ Na, F, Ca, Mg, K, Si, Eh, сульфатредукция | Каолинит, Mt, иллиты, кальцит, доломит, мусковит, Mg-хлорит, пренит, сепиолит, ломонтит, флюорит, альбит, гейлюссит, мирабилит, сода |
М = 1–343 г/л рН 9–11
Si = 5.5–22 мг/л Повышенные содержания ${\text{HCO}}_{3}^{ - },$${\text{CO}}_{3}^{{2 - }},$ Cl–, Na, F, Sc, Ti, V, Cr, Mn, Fe, Al, Zn, Zr, Y, Nb, Hf, Ta, W, Mo, Re, As, Th, U, РЗЭ, реже ${\text{SO}}_{4}^{{2 - }},$$^{{{\text{34}}}}{\text{SO}}_{4}^{{2 - }}$ и 32S2– |
140 |
| Сульфатный | рН, ${\text{SO}}_{4}^{{2 - }},$ Na, Ca, Mg, K, Si, Eh, окисление сульфидов– | Каолинит, Mt, иллит, кальцит, доломит, мусковит, Mg-хлорит, пренит | М = 1–17 г/л рН 8.32–8.91 Si = 2.9–4.1 Повышенные содержания Na, ${\text{SO}}_{4}^{{2 - }},$ Co, Ni, Cu, $^{{{\text{34}}}}{\text{SO}}_{4}^{{2 - }}$ |
18 |
| Хлоридный | рН, Сl–, Na, Ca, Mg, K, Si, Eh сульфатредукция | Каолинит, иллиты, кальцит, доломит, реже Mt (особенно Ca-Mt), мусковит, Mg-хлорит, гипс | М = 5–184 г/л рН 8.3–8.9 Si = 0.37–4.5 Повышенные содержания Сl–, Na, Ва, Rb, B, Br, Se, Sr и Li, $^{{{\text{34}}}}{\text{SO}}_{4}^{{2 - }}$ и 32S2– |
722 |
Получается, что каждый тип природной воды отличается не только соленостью, значением рН, Eh и химическим составом, но главное, составом формирующихся вторичных минералов. Отсюда, такой подход позволил нам сравнивать озера не только по химическому составу вод, как это принято в наиболее используемых классификациях (Курнакова-Валяшко и Алекина), но и по основным процессам их формирования, что имеет уже геохимическое значение.
Механизмы формирования различных геохимических типов озер
Многочисленными исследованиями установлено, что все природные воды не равновесны с теми или иными эндогенными минералами, которые они непрерывно растворяют, но равновесны ко многим вторичным минералам, которые они также непрерывно формируют (Гаррелс, 1968; Шварцев, 1978; Крайнов и др., 2004). Это происходит потому, что при растворении эндогенных алюмосиликатов образуются еще менее растворимые алюмосиликатные вторичные минералы (окислы и гидроксиды Fe, Al, глины, гидрослюды и т.д.), которые связывают своим составом многие ведущие химические элементы горных пород и тем самым выступают геохимическими барьерами на пути установления равновесия воды с эндогенными алюмосиликатами (Шварцев, 1998; Алексеев и др., 2005). Как известно, эндогенные алюмосиликаты растворяются по механизму гидролиза, общая реакция которых предложена У.Д. Келлером (Келлер, 1963).
(1)
$\begin{gathered} {\text{МеAlSi}}{{{\text{O}}}_{n}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{М}}{{{\text{е}}}^{{n + }}} + {\text{O}}{{{\text{H}}}^{--}} + \\ + \,\,\left[ {{\text{Si}}{{{\left( {{\text{OH}}} \right)}}_{{0--{\text{4}}}}}} \right] + \left[ {{\text{A}}{{{\text{l}}}^{o}}{{{\left( {{\text{OH}}} \right)}}_{{\text{6}}}}} \right]_{n}^{{{\text{3}} - }}, \\ \end{gathered} $Как видно из реакции, в воде появляется ОН– в количествах эквивалентных положительно заряженным катионам (Men+). В реальных природных условиях в воде всегда присутствует растворенный СО2, который по реакции:
(2)
${\text{О}}{{{\text{Н}}}^{ - }} + {\text{С}}{{{\text{О}}}_{{\text{2}}}} = {\text{HСO}}_{3}^{ - }\,\,\,\,\left( {{\text{Шварцев}},\,\,{\text{1978}}} \right)$Согласно термодинамическим расчетам, первым минералом, формирующимся в системе грунтовые воды–горная порода, является каолинит, образование которого протекает согласно следующей реакции:
2Al3+ + 6ОН– + 2H4SiO4 = = Al2Si2O5(OH)4 + 5H2O.
Далее по мере взаимодействия образуется монтмориллонит:
0.167Сa2+ + 2.3Al3+ + 7.32ОН– + 3.67H4SiO4 = = Ca0.167Al2.33O10(OH)2 + 10H2O,
для образования этого минерала, как было показано выше, необходимы уже более высокие концентрации Si4+ и ОН–. Параллельно формируются и другие по составу монтмориллониты и иллиты. На следующем этапе образуются кальцит и доломит. Установление равновесия грунтовых вод с карбонатными и глинистыми минералами является существенным геохимическим барьером, который ограничивает концентрирование в них Ca, Mg, Fe, K, Sr. Связывается и кремний, но поскольку в исходной растворяемой породе его содержание выше, чем во вторичных минералах, он продолжает накапливаться, параллельно концентрируются Na+, OH– и др. подвижные элементы. В этих условиях вместо HCO3–Ca формируются HCO3–Na воды или содовые с несколько более высокой соленостью и значением рН.
Попадая в озера, подземные воды оказываются в условиях, где степень испарения их возрастает, что сопровождается не только концентрированием в них анионов Cl и SO4, но и всех других элементов, включая Na и многие микрокомпоненты. Наши исследования убедительно показывают, что в озерах идет не только испарение воды, но и продолжается взаимодействие с горными породами. Убедительным доказательством этого является рост в большинстве из них рН, увеличение значения которого без взаимодействия воды с алюмосиликатами невозможен (поскольку озерная вода насыщена карбонатами щелочноземельных элементов). С ростом рН растет также количество вторичных образований, однако равновесие воды с исходными первичными минералами преимущественно основного состава (анортит, форстерит, фаялит и др.) так и не достигается, поскольку вновь сформированные минералы выступают геохимическими барьерами, препятствующими установлению такого равновесия (рис. 10).
Рис. 10.
Степень насыщения природных вод первичными и вторичными минералами в зависимости от рН среды (при [H4SiO4] = 10–2.5).
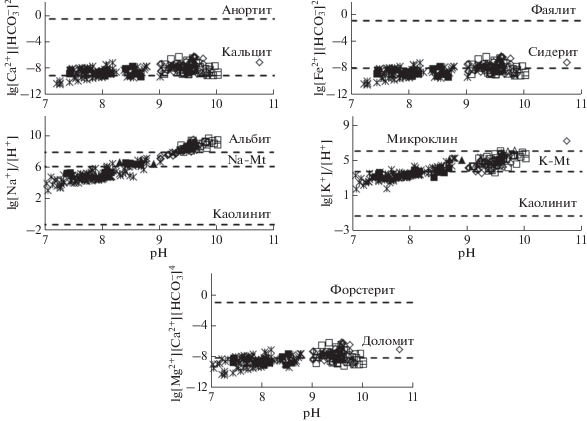
Конечно, последовательность вторичного минералообразования в разных типах озер несколько меняется, и не во всех из них она достигает последних стадий. Например, к хлоридам равновесие не установлено ни в одном озере, к мирабилиту, гипсу, соде – только в одном, но разном. Но в целом направленность этого процесса сохраняется, и он служит важнейшим процессом, контролирующим способность химических элементов к концентрированию. Именно в результате растворения одних минералов и осаждения других формируется содовый тип озер, а при наличии сульфидов в горных породах и окислительной среды – сульфатный тип озер. Если же испарение велико, а количество карбонатных ионов в озере не растет или растет медленно из-за связывания их выпадающими карбонатными минералами, то содержание хлора становится более высоким, рН < 9.0, а тип вод переходит в хлоридный. Третий основной процесс формирования озерных вод – это сульфатредукция, в результате которой появляется H2S, что принципиально меняет характер геохимической среды из окислительной в восстановительную и приводит к изменению валентности многих элементов (S, C, Fe, Mn, As, U, Mo, Se и т.д.), меняя их миграционную способность, а значит и их способность к концентрированию или связыванию вторичными минералами. Сформированная таким образом разная геохимическая среда в озерах разного типа способствует тому, что содержания только некоторых подвижных в этих условиях элементов растут и накапливаются до значительных концентраций. Поэтому в содовых озерах охотно концентрируются F, U, Zr, As, Th, РЗЭ и др., в хлоридных – Br, Sr, Li, Rb, Ba, Se, в сульфатных – Сu, Ni, Co.
Таким образом, формирование химического состава соленых озер исследуемого региона – многофакторный процесс, в котором наряду с испарительным концентрированием участвуют процессы растворения водой одних минералов и образования других, а также бактериального восстановления сульфатов и окисления органического вещества и сульфидов. Поэтому в каждом озере региона имеются продукты всех перечисленных процессов, а именно, натрий, карбонаты, хлориды и сульфаты, но их соотношение в разных типах озер неодинаково (табл. 2). В среднем хлорид-ионы преобладают не только в хлоридных озерах, что естественно, но и содовых. Все это отражает очевидный факт большой роли процессов испарения в формировании всех озер. Содержание карбонатов в среднем немного ниже даже в содовых озерах, чем хлоридов, но если брать только менее минерализованные озера, то в них значительно преобладает карбонатная составляющая. Очевидно, что процесс накопления соды на начальных этапах испарения преобладает над концентрированием хлоридов, но на последних этапах процесс концентрирования хлоридов становится более весомым. Сульфаты занимают относительно невысокие позиции по накоплению, потому что их значительная доля восстанавливается до сероводорода.
ВЫВОДЫ
Анализ фактического материала показал, что содовые озера выделяются наиболее высокими значениями рН, Na, ${\text{НСО}}_{3}^{ - },$ ${\text{СО}}_{3}^{{2 - }}{\text{,}}$ повышенными концентрациями U, Th, As, F, РЗЭ и др. микрокомпонентов, большим количеством вторичных минералов. Хлоридные озера характеризуются высокой соленостью, но низкой щелочностью с большим содержанием Br, Li, Sr и др. элементов. Отличительным признаком сульфатных озер является минимальная их соленость, высокая сульфатность и относительно низкие концентрации большинства микроэлементов.
Установлено, что наряду с испарением огромную роль в формировании состава озер играет и их взаимодействие с алюмосиликатами, поскольку равновесия озерной воды, как и других типов вод, носит равновесно-неравновесный характер. Со многими минералами магматических пород основного состава все природные воды не равновесны. С алюмосиликатными минералами кислых и средних пород равновесие наступает только при относительно высокой минерализации и рН озерных вод. Неравновесное состояние озерных вод со многими первичными минералами обеспечивает их непрерывное растворение и, соответственно, накопление подвижных элементов, т.е. тех, которые не связываются образующимися в озерных водах вторичными минералами, что существенно меняет состав озер. Наиболее масштабно такие процессы проявлены в содовых озерах, что подтверждается наличием в них наиболее высоких значений рН (9.0–10.7) которые являются свидетельством максимального по масштабам взаимодействия таких вод с эндогенными алюмосиликатами, гидролиз которых обеспечивает рост рН и, соответственно, повышенное содержание карбонатных ионов. Высокие значения рН и содержания ионов ${\text{HCO}}_{3}^{ - }$ и ${\text{CO}}_{3}^{{2 - }},$ в свою очередь приводят к максимальному выпадению карбонатов Ca, Mg, Fe и частично Na (гейлюссит, альбит, парагонит и др.). В то же время в этом типе озер активно концентрируются Na, U, Th, As, F, редкоземельные элементы и др., для которых щелочная среда благоприятна для их накопления. Естественно, что содовые озера содержат и высокие концентрации хлора, поскольку процесс испарения и в содовых озерах имеет место, хотя и не максимальный по масштабам.
Иное поведение характерно для сульфат-иона в озерных водах: его содержания в большинстве случаев значительно ниже относительно рассчитанной степени испарения. Исключение составляют только несколько озер, в которых содержания сульфатов, по сравнению с другими анионами, значительно выше, так как имеются дополнительные источники этого иона. Относительно низкие концентрации сульфатов объясняются тем, что во многих озерах активно протекают процессы микробиологического восстановления сульфатов. Масштабы таких процессов разные в каждом озере и доля восстановленных форм серы, поэтому, тоже разная. И только в редких случаях, когда в озере сульфатредукция проявлена слабо, а горные породы содержат сульфиды, развиваются противоположные геохимические процессы, а именно имеет место окисление сульфидов. Содержание сульфатов в таком озере растет, а рН озерной воды уменьшается. Если при этом не достигается равновесие с гипсом и другими сульфатными минералами, а испарение остается незначительным, формируются озера сульфатного типа. Напротив, формирование хлоридных озер происходит в условиях относительно слабого водообмена, т.е. в озерах с высокой степенью испарения воды и наличии процессов сульфатредукции. Степень взаимодействия таких вод с алюмосиликатами относительно небольшая. Геохимическая среда в этом случае способствует концентрированию в них наряду с Na и Cl, также Li, Br, Sr и др. элементов.
Исследования выполнены в рамках выполнения государственного задания и частично при финансовой поддержке проекта РФФИ № 18-05-00104.
Список литературы
Борзенко С.В., Замана Л.В. (2011) Восстановленные формы серы в рапе содового озера Доронинское (Восточное Забайкалье). Геохимия (3), 268-277.
Borzenko S.V., Zamana L.V. (2011) Reduced forms of sulfur in the brine of saline-soda Lake Doroninskoe, Eastern Transbaikal Region. Geochem. Int. 49(3), 253-261.
Борзенко С.В. (2018) Геохимия соленых озер Восточного Забайкалья. Дис. … док. геол.-мин. наук. Чита: Федеральное государственное бюджетное учреждение науки Институт природных ресурсов, экологии и криологии Сибирского отделения Российской академии наук, 271 с.
Букаты М.Б. (1997) Разработка программного обеспечения в области нефтегазовой гидрогеологии. Разведка и охрана недр (2), 37-39.
Вант Гофф Я.Г. (1936) Океанические соляные отложения. Л.: Химтеорет, 345 с.
Власов Н.А. (1961) Минеральные воды южной части Восточной Сибири. В 2 т. Т. 1. Гидрогеология минеральных вод и их народнохозяйственное значение / АН СССР. Сиб. Отд-ние Вост.-Сиб. Геол. Ин-т. (Под ред. В.Г. Ткачук, Н.И. Толстихина). М.–Л.: Изд-во АН СССР, 1, 89-245.
Гаррелс Р.М. (1968) Растворы, минералы, равновесия. М.: Мир, 368 с.
Алексеев В.А., Букаты М.Б., Зверев В.П., Чудаев О.В., Шварцев С.Л. (2005) Геологическая эволюция и самоорганизация системы “вода–порода”. В 5 т. Т. 1. Система вода–порода в земной коре: взаимодействие, кинетика, равновесие, моделирование (Отв. ред. С.Л. Шварцев). Новосибирск: СО РАН, 244 с.
Государственная геологическая карта Российской Федерации. (2010) Масштаб 1 : 1 000 000 (третье поколение). Серия Алдано-Забайкальская. Лист М-50 – Борзя. Объяснительная записка / Е.А. Шивохин [и др.]. (Науч. ред. В.В. Старченко). – СПб.: Картографическая фабрика ВСЕГЕИ, 553 с.
Гриненко В.А., Гриненко Л.Н. (1974) Геохимия изотопов серы. М.: Наука, 274 с.
Дзенс-Литовский А.И. (1967) Кара-Богаз-Гол. Л.: Недра, 95 с.
Жеребцова И.К., Волкова Н.Н. (1966) Экспериментальное изучение поведения микроэлементов в процессе естественного солнечного испарения воды Черного моря и рапы Сасык-Сивашского озера. Геохимия (7), 832-845.
Замана Л.В., Борзенко С.В. (2010). Гидрохимический режим засоленных озер Юго-Восточного Забайкалья. География и природные ресурсы 31 (4), 370-376.
Захарюк А.Г. (2010) Распространение и активность алкалофильных сульфат- и железоредуцирующих бактерий в содовых озерах Забайкалья. Автореф. Дис. … канд. биол. Наук. Улан-Удэ: Институт общей и экспериментальной биологии, 22 с.
Иванов А.В. (1977) Гидрохимия рек и озер в зоне резко континентального климата. Владивосток: ДВГУ, 128 с.
Келлер У.Д. (1963) Геохимия литогенеза. М.: Изд-во иностр. лит., 85-197.
Крайнов С.Р., Рыженко Б.Н., Швец В.М. (2004) Геохимия подземных вод. Теоретические, прикладные и экологические аспекты. М.: Наука, 677 с.
Куриленко В.В. (1997) Современные бассейны эвапоритовой седиментации. СПб.: СпбГУ, 256 с.
Курнаков H.C., Николаев В.И. (1938) Солнечное испарение морской воды и озерных рассолов. Изв. Ин-та физ.-хим. анализа АН СССР. 10, 333-366.
Леонова Г.А., Бобров В.А., Богуш А.А., Бычинский В.А., Аношин Г.Н. (2007) Геохимическая характеристика современного состояния соляных озер Алтайского края. Геохимия (10), 1114-1128.
Leonova G.A., Bobrov V.A., Bogush A.A., Anoshin G.N., Bychinskii V.A. (2007) Geochemical characteristics of the modern state of salt lakes in Altai Krai. Geochem. Int. 45 (10), 1025-1039.
Новиков Ю.В., Ласточкина К.О., Болдина З.Н. (1990) Методы исследования качества воды водоемов. М.: Медицина, 400 с.
Пиннекер Е.В. (1982) Основные гипотезы формирования состава концентрированных рассолов. Основы гидрогеологии. Гидрогеохимия. Новосибирск: Наука, 202-206.
Питцер, К.С. (1992) Термодинамическая модель плотных водных растворов. Термодинамическое моделирование в геологии: минералы, флюиды, расплавы. М.: Мир, 110-153.
Руководство по химическому анализу поверхностных вод суши. (1977). (Под ред. А.Д. Семенова). Л.: Гидрометеоиздат, 541 с.
Скляров Е.В., Склярова О.А., Меньшагин Ю.В., Данилова М.А. (2011) Минерализованные озера Забайкалья и северо-восточной Монголии: особенности распространения и рудогенерирующий потенциал. География и природные ресурсы (4), 29-39.
Сонненфелд П. (1988) Рассолы и эвапориты: М.: Мир, 480 с.
Страхов Н.М. (1962). Основы теории литогенеза. ТЛИ. М.: АН СССР, 551 с.
Страховенко В.Д., Щербов Б.Л., Маликова И.Н., Восель Ю.С. (2010) Закономерности распределения радионуклидов и редкоземельных элементов в донных отложениях озер Сибири. Геология и геофизика 51 (11), 1501-1514.
Филиппов В.К., Черемных Л.М. (1983) Расчет термодинамических функций системы Na2SО4–K2SО4–H2О при 25°С. Журн. Прикладной Химии 56 (7), 1475-1479.
Шварцев С.Л., Колпакова М.Н., Исупов В.П., Владимиров А.Г., Ариунбилэг С. (2014) Геохимия и формирование состава соленых озер Западной Монголии. Геохимия (5), 432-449.
Shvartsev S.L., Kolpakova M.N., Isupov V.P., Vladimirov A.G., Ariunbileg S. (2014) Geochemistry and chemical evolution of saline lakes of western Mongolia. Geochem. Int. 52(5), 388-403.
Шварцев С.Л. (1978) Гидрогеохимия зоны гипергенеза. М.: Недра, 287 с.
Шварцев С.Л. (1998) Гидрогеохимия зоны гипергенеза. М.: Недра, 366 с.
Borzenko S.V., Shvartsev S.L. (2019) Chemical composition of salt lakes in East Transbaikalia (Russia) Appl. Geochem. (103), 72-84. https://doi.org/10.1016/j.apgeochem.2019.02.014
Chen J., Wang F., Wan G., Tang D., Zang D.D., Hunag R., Li J., Xiao T. (2008) Sulphate reduction and sulfur cycling in lake sediments. Acta Geol. Sinica 82(5), 975-981.
Droubi A. (1976) Geochimie des sels et des solutions concentrees par evaporation. Mod-ele thermodynamique de simulation. Application aux sols sales du Tchad. Sci.Ceol., Mem. (46), 177 p.
Droubi A., Cheverry C., Fritz B., Tardy Y. (1976) Geochimie des eaux et des sels dans les sols des polders du lac Tchad: application d’un model thermodynamique de simulation de l’evaporation. Chem.Geol. 17(3), 165-177.
Filippov V.K., Charykova M.V. (1989) Die Anwendung der Pitzer-Gleichungen fur die Ber-echnung der Phasengleichgewichte in quaternaren system Na+, ${\text{NH}}_{4}^{ + }$ Cl, ${\text{SО}}_{4}^{{2 - }}$ H2O. Z. Phys. Chem. 270(1), 49-56.
Greenberg J.P., Moller N. (1989) The prediction of mineral solubilities in natural waters: A chemical equilibrium model the Na–K–Ca–Cl–SO4–H2O system to high concentration from 0 to 250°C. Geochim. Cosmochim. Acta. 53(10), 2503-2518.
Gueddari M. (1984) Geochimie et thermodynamique deseri dena eri denals. Etude du Lac Natron en Tanzanie et du Chott el eri den Tunisie. Sci.Ceol., Mem. (76), 143
Gueddari M., Monnin C., Perret D., Fritz B., Tardy Y. (1983) Geochemistry of brines of the Chott el Jerid in Southern Tunisia application of Pitzer’s equations. Chem. Geol. 39(1), 165-178.
Hardie L.A., Eugster H.P. (1980) Evaporation of Seawater: Calculated Mineral Sequences. Sci. 208, 498-500.
Jones B.F., Eugster H.P., Rettig S.L. (1977) Hydrochemistry of the Lake Magadi basin, Kenya Geochim. Cosmochim. Acta. 41(1), 53-72.
Kolpakova M.N. Shvartsev S.L. Borzenko S.V. Isupov V.P. Shatskaya, S.S., 2016. Geochemical features of Kulunda plain lakes (Altay region, Russia). IOP Conference Series: Earth and Environmental Science. 33(1), article number 012007.
Matsuo S., Kuroda Y., Suzuoki T. (1978). Mantle water based on the hydrogen isotope ratios of hydrouse silicates in the mantel. Geol. Surv. Open-file Rep. (701), 278-280.
McCaffrey M.A., Lazar B., Holland H.D. (1987) The evaporation path of seawater and the coprecipitation of Br– and K+ with halite. J. Sedim. Petrol. (57), 928-937.
Warren J.K. (1989) Evaporite Sedimentology. J. Sedimentology. Prentice-Hall, Englewood Cliffs, 29(5), 548-556.
Zheng M. (2014) Saline lakes and salt basin deposits in China. Beijing: Science Press, 321 p.
Дополнительные материалы отсутствуют.