Геохимия, 2020, T. 65, № 2, стр. 165-177
Комплексообразование ионов металлов с органическими вещестами гумусовой природы: методы исследования и структурные особенности лигандов, распределение элементов по формам
М. И. Дину a, *, В. М. Шкинев a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: marinadinu999@gmail.com
Поступила в редакцию 30.01.2019
После доработки 27.03.2019
Принята к публикации 31.03.2019
Аннотация
В статье рассмотрены данные о поступлении и поведении гумусовых веществ в природных водах. Проанализированы наиболее распространенные методы анализа физико-химических свойств природных полимеров, обусловливающие их взаимодействия с ионами металлов. На основе результатов собственных оригинальных исследований и литературного обзора по оценке форм нахождения металлов в природных объектах (озера, реки, моря) сформировано представление о процессах комплексообразования ионов металлов с гумусовыми веществами при различных химических равновесиях.
ВВЕДЕНИЕ
Антропогенное поступление растворимых соединений ионов металлов в воды и почвы окружающей среды – широко распространенное явление. Формы нахождения металлов в природных объектах обладают различной степенью токсичности, но особенно опасными для большинства из них считаются ионные формы нахождения. Образование комплексов катионов с органическими веществами гумусовой природы способствует практически полному снижению токсичных свойств (Добровольский, 2004; Moiseenko et al., 2013). Содержания гумусовых веществ в поверхностных водах находятся в интервале 1–100 мг/л, они обладают различной молекулярной массой (от 10 Да до 10 000 кДа), концентрации под-фракций (фульвокислоты и гуминовые кислоты) и их количество и качество варьируются в сезонном срезе (Buffle, 1990; Dinu, 2015).
На территории России широко распространены воды с высокими содержаниями органических веществ, а природно-климатические факторы регионов обусловливают достаточное разнообразие структурных особенностей и свойств этих компонентов (Moiseenko et al., 2013).
Органические вещества гумусовой природы представляют собой высокомолекулярные соединения переменного состава и супрамолекулярной структуры, образовавшиеся в результате сложных биохимических процессов. Эти механизмы зависят от конкретных ландшафтных характеристик, климатических факторов и антропогенного воздействия (Орлов, 1991; Орлов и др., 1996; Линник и др., 1986; Перминова, 2000; Орлов Д.С. и др., 2002; Moiseenko et al., 2013). Вклад химических процессов в образование гумусовых соединений является спорным вопросом. Большое число ученых указывают на доминирующую биологическую роль преобразований практически на всех стадиях формирования и лишь на заключительном этапе – о вкладе химических процессов (Варшал и др., 1979; Орлов, 1996; Орлов, 2002; Попов, 2004; Дину, 2017; Моисеенко и др., 2017). Кроме того, природные высокомолекулярные соединения являются кислотами различной активности и характеризуются значительными комплексообразующими свойствами по отношению к ионам металлов в природных водах, что определяет их протекторную роль в Биосфере (Dudare et al., 2000; Дину, 2017). Образованные в природных водах комплексы металлов с гумусовыми лигандами – гуматы и фульваты, а также те комплексные соединения, которые поступили с водосбора водоема в процессе выщелачивания определяют экологическое состояние объекта и его буферную способность. Существует большое число работ, посвященных изучению физико-химических особенностей гумусовых веществ и механизмов связывания с ионами металлов, однако единой методологии на данный момент нет (Орлов, 2002; Clark et al., 2010; Wu, 2014; Dinu, 2015).
Современной проблемой для оценки распределения элементов по формам при проведение экспедиционных исследований большого количества водных объектов является разработка так называемых экспресс-методов (“полевых методов”) разделения компонентов проб и их анализа, что позволяет рассматривать тенденции в сезонном и климатическом срезах (Моисеенко и др., 2017). Сравнительно недавно появились литературные данные об отличиях в количестве и качестве органических веществ в разных гидрологических объектах – моря, реки, озера, и данные о геохимических особенностях в распределение элементов по формам (Rostard et al., 2004; Tsuda et al., 2010; Линник и др., 2013).
Цель данной работы – проанализировать существующие подходы в оценке геохимии гумусовых веществ в природных водах, а также современные методы их исследования. Опираясь на литературные данные и собственные экспериментальные результаты, сформировать представление о возможных путях изучения процессов комплексообразования ионов металлов с гумусовыми веществами в поликомпонентной системе. Проанализировать особенности распределения элементов по формам в различных природных водах (озера, реки, моря), в частности образование гуматов и фульватов металлов.
ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ГУМУСОВЫХ ВЕЩЕСТВ В ПРИРОДНЫХ ВОДАХ И ИХ ПРОТЕКТОРНЫЕ СВОЙСТВА
Органические вещества в водах представлены соединениями различной природы. Считается возможным разделение их на аллохтонную и автохтонную составляющую (Зобкова и др., 2013) для чего применяют ионообменную технику и электролитическое разделение как первый этап пробоподготовки природных вод. В настоящее время развивается направления синтеза и прикладного использования различных типов полимерных смол для наиболее полного и подробного разделения органических веществ по молекулярным массам (Перминова, 2010; Tsuda et al., 2010).
Автохтонная составляющая это легкоокиляемые, низкомолекулярные соединения (белки, липиды), которые образуются в водоеме за счет многочисленных биохимических процессов. Согласно литературным данным (Buffle, 1990) их вклад в химическое равновесие невелик и в большей степени зависит от физико-химических условий и биологических процессов. К аллохтонным веществам относят гумусовые соединения, вымываемые с водосбора, а также органику сточных вод. Как указывалось, их протекторная роль наиболее значима для существующих химических равновесий за счет ярко выраженных кислотно-основных и окислительно-восстановительных свойств.
Вопросы структуры и, естественно, свойств органических веществ гумусовой природы, привлекают ученых уже не первое десятилетие (Stevenson, 1994; Орлов и др., 1996; Перминова, 2000; Орлов, 2002; Meng, 2013). Особое внимание уделяется почвенному гумусу (органическим веществам), содержащемуся в почвах и вымываемому в природные воды. Научного материала о качественном составе гумусовых веществ (ГВ) в почвах достаточно, однако проблемы зональной и сезонной изменчивости их строения и свойств, а также при поступлении в природные воды остаются малоизученными.
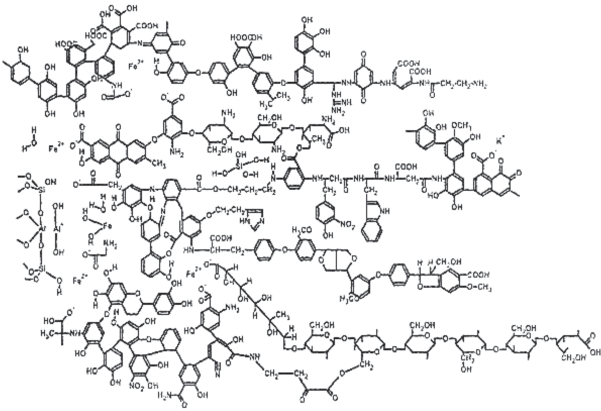
Из последних работ (Proceedings Book, 2010; Федотов и др., 2012) известно, что аллохтонные ГВ природных вод представляют собой надмолекулярные ассоциаты гетерогенных молекул, связанные гидрофобными взаимодействиями (Ван-дер-ваальсовыми силами, π–π и ион-дипольными связями) и водородными связями. Все эти силы стабилизируют структуру молекулярных агрегатов, хотя определить точно в какой степени какая связь преобладает невозможно. Можно лишь утверждать, что различные уровни и типы взаимодействия образуют супрамолекулярные структуры органического конгламерата с индивидуальными физико-химическими свойствами. Однако не существует доказательно подтвержденной структуры гумусовых веществ. Наиболее общепризнанная структура, отражающая возможные химические свойства веществ, представлена на рис. 1.
Стабильность глобул ГВ изменяется в зависимости от ионной силы раствора и pH (Моисеенко и др., 2017). Супрамолекулярные структуры ГВ, которые в настоящее время уделяется достаточное внимание позволяют убедиться в различиях строения органических веществ при неодинаковых условиях. Например, в работах (Федотов и др., 2010) говорится о пяти возможных уровнях организации гумусовых веществ в зависимости от биогеохимической природы. Основные параметры градации представлены в табл. 1.
Таблица 1.
Уровни организации гумусовых веществ и методы их исследования (Федотов и др., 2010)
| Уровни организации гумусовых веществ | Параметры и свойства ГВ, изменяющиеся на данном уровне организации | Методы, позволяющие изучать ГВ на данном уровне организации |
|---|---|---|
| Молекулы низкомолекулярных веществ, взаимодействующие между собой и образующие супрамолекулярные частицы ГВ за счет нековалентных связей | Состав и природа низкомолекулярных веществ, из которых образованы супрамолекулы ГВ, прочность их закрепления в супрамолекулах, способность к обмену на другие низкомолекулярные вещества | Метод меченых атомов, хроматография и электрофорезя, масс-спектрометрия, спектральные методы, ЭПР, ЯМР |
| Супрамолекулярные частицы гумусовых веществ | Размер, форму и вид супрамолекулярных частиц ГВ, а также их изменение под влиянием различных факторов, распределение в них функциональных групп, характер взаимодействия с различными веществами и между собой, соотношение разных видов супрамолекулярных частиц ГВ в почвах, биологическую активность супрамолекулярных частиц ГВ | Электронные растровая и просвечивающая микроскопии, атомно-силовая микроскопия, туннельная микроскопия, другие виды зондовой микроскопии, фотон-корреляционная спектрометрия, различные виды хроматографии и электрофореза, спектральные методы, потенциометрическое титрование, фракционирование ГВ и химические методы анализа, методы оценки различных типов биологической активности |
| Кластеры из супрамолекулярных частиц ГВ, включающие в свой состав частицы вторичных минералов | Структура, размер, форма и вид кластеров из супрамолекулярных частиц ГВ, тип связей в кластерах, а также их изменение под влиянием различных факторов, характер взаимодействия с различными веществами и их биологическую активность | Электронные растровая и просвечивающая микроскопии, атомносиловая микроскопия, туннельная микроскопия, другие виды зондовой микроскопии, малоугловое рассеяние нейтронов и рентгеновский лучей, фотон-корреляционная спектрометрия, различные виды хроматографии и электрофореза, химические методы анализа, методы оценки различных типов биологической активности |
| Гели почв, возникающие при объединении первичных частиц ГВ, кластеров из них и минеральных частиц | Структурная организация и ее изменения под влиянием различных факторов, химический и минеральный составы гелей, характер объединения частиц ГВ и минералов при образовании гелей. В связи с тем, что почвенные гели определяют многие свойства почв, возникает возможность поиска корреляций между свойствами почвенных гелей и свойствами почв | Электронные растровая и просвечивающая микроскопии, зондовый микроанализ, атомно-силовая микроскопия, туннельная микроскопия, другие виды зондовой микроскопии, рентгено-фазовый и рентгено-флуоресцентный анализы, химические методы анализа, а также установление корреляций между свойствами почвенных гелей и свойствами почв |
| Размещение гелей различных типов в почве | Характер распределения гелей в почвенной массе | Методы, применяемые при изучении микроморфологии почв |
Из данных таблицы можно заключить, что размерность и вид ассоциата гумусовых веществ могут быть изучены широким набором методов, в том числе и в динамических условиях. В частности, в перемещении гумусовых веществ наибольший вклад вносят супрамолекулярные молекулы небольшого размера. Исходя из особенностей органических веществ гумусовой природы в поверхностных водах, стоит отметить более низкие молекулярные массы и преобладание фульвокислот (в большинстве поверхностных вод) и большую активность в реакциях комплексообразования (Варшал, 1979; Clarck, 2010). Согласно данным о специфике распределения гумусовых веществ и их функциональных особенностях в зональном срезе (Орлов и др., 1996; Перминова. 2000; Орлов и др., 2002; Дину, 2018) территории черноземных почв содержат больший процент гуминовых веществ (иногда превышающий содержания фульвокислот), что распространяется и на природные воды региона. Эти факты подтверждены (Дину, 2017) в экспериментальных исследованиях. Установлено, что воды озер черноземных территорий Западной Сибири (ЗС) содержат в большем количестве гуминовые кислоты. Эти органические кислоты характеризуются “тяжелым” молекулярным весом и придают более высокую цветность природным водам.
Особенности изменения компонентного состава гумусовых веществ в зональном срезе также явно прослеживаются на примере регионов Западной Сибири (ЗС) и Европейской территории России (ЕТР). Органические вещества природных вод северных районов – тундры и тайги ЕТР и ЗС обогащены фульватным типом гумусовых веществ. В свою очередь, воды степных районов тех же территорий содержат большие концентрации гуминовых фракций, т.е. гумусовые вещества, поступившие в природные воды, характеризуются насыщенным коричневым цветом (Попов, 2004; Dinu, 2015; Моисеенко и др., 2017).
В зависимости от рН среды количество вымываемого органического вещества, соотношение мигрирующих ФК/ГК могут значительно варьироваться, также как и пропорции основных элементов С : О : N (Орлов, 2002). В работе (Моисеенко и др., 2017) рассмотрены литературные данные (Baglieri, 2014) о том, что снижение рН способствует уменьшению растворимой фракции гумусовых веществ. Другими словами, в кислой среде выщелачивание гуминовой фракции максимально снижается и лишь частично перемещаются фульвокислоты. Согласно данным (Baglieri, 2014) при рН 7 концентрация растворимой составляющей почвенных кислот в девять раз больше чем при рН 3. Одновременно с этим, снижается доля С и Н и увеличивается доля О в растворе, что может означать большую агрессивность фульвокислот в сильно кислой среде за счет снижение молекулярной массы и большей активности краевых кислородных групп, энергетически занятых протонами водорода.
Величины дзета-потенциала как индикатора стабильности сосуществующих коллоидов изменяются в зависимости от рН системы. Дзета-потенциал становится более отрицательным с увеличением рН, что связывают с ионизацией фенольных групп гумусовых веществ. В публикации (Saab et al., 2010) изучены стабильности коллоидов органических веществ, выделенных из природных вод рек, согласно результатам исследования, при значениях рН в диапазоне от 1 до 6 величины дзета-потенциалов равны от –0.5 до –15 мВ, при рН более 6 величины дзета-потенциала становятся ниже -30 мВ (Моисеенко и др., 2017).
В литературе встречается достаточное количество разрозненных и очень конкретных работ (Варшал, 1979; Ling et al., 2012; Meng, 2013), рассматривающих определенные взаимодействия ионов металлов с гумусовыми веществами вод и почв. Каждая из работ содержит свою методологию и, естественно, результаты достоверные при конкретных условиях исследования. На основе каждой конкретной работы говорить о закономерностях поведения гуматов в природе – поверхностных водах, озерах, реках и т.д. достаточно трудно. Но, применение идентичной системы исследования водных проб позволяет проследить тенденции в распределение элементов по формам.
Методология изучения комплексообразования ионов металлов с органическими веществами природных вод
Исследования процессов связывания ионов металлов гумусовыми компонентами можно условно поделить на несколько групп:
Экспериментальные (лабораторные) работы по изучению реакций металл-фульвокислоты, металл-гуминовые кислоты или металл-гумусовые кислоты (смесь фульвокислот/гуминовых кислот). В подобных работах органические вещества, выделяются из почв или вод с помощью выщелачивания (экстрагирования) или вымораживания, соответственно. Далее следует очистка методами диализа, катионообменных смол и др. и проведение реакций между металлами и органическим веществом. Результатами исследования могут быть как вычисленные константы устойчивости комплексов (условные константы устойчивости); так и оценка несвязанных/связанных форм металлов с органическими лигандами (Dinu, 2015; Schneider et al., 2016).
Анализ возможных механизмов взаимодействия металл-лиганд позволил рядом авторов на основе экспериментов установить некие соотношения (Варшал и др., 1979; Линник и др., 1986). Например, Fe(III) образует комплексы с фульвокилотами в соотношении 1 : 3, ионы щелочноземельных металлов 1 : 1. В ходе работ использовались методы аналитической и физической химий – потенциометрические и другие электрохимические методы детектирования, УФ-фотометрия и т.д. Объяснить более подробно механизмы взаимодействия не удалось. Хотя сложный состав ГВ и их фракций позволяет предположить некие мультилигандные свойства по отношению ко многим металлам. Экспериментально доказано взаимодействие ГВ с разнообразными ионами металлов различной концентрации без конкуренции за лиганды, т.е. не выявлено изменения доли несвязанных ионов металлов при прибавлении конкурентных ионов (Линник и др., 1986; Дину, 2017).
Для измерений незакомплексованной доли металла применяют электрохимические и абсорбционные методы. Хотя данный подход все же характеризуется долей условности из-за присутствия в системе органических компонентов – растворы гумусовых веществ, фульвокислот. При работе с растворами фульвокислот или гумусовых веществ сложно подобрать условия, при которых органическое вещество уже не разрушается, и прибор регистрирует только ионы металлов в пробах без воздействия на лиганды. Также сложны этапы разделения подобных смесей по молекулярному весу для последующего измерения.
Более упрощенными вариантами анализа являются эксперименты по взаимодействию металлов с гуминовыми веществами (твердая кислото-нерастворимая часть гумусовых веществ), так как происходит удаление органических солей до измерения параметров жидкой пробы (центрифугирования или фильтрация).
Соответствующих публикаций по адсорбции (хемосорбции) металлов на поверхности гуминовых кислот достаточно (Перминова, 2000; Папина, 2001; Doig, 2007). Авторами подтверждено, что гуминовые компоненты характеризуются высокой адсорбционной способностью. Работы также проводились при конкурентном связывании металлов с фульвокислотами и гуминовыми кислотами в единой системе (Варшал, 1979; Перминова, 2000).
Экспериментальные работы вносят значимые вклад в получение качественной информации о процессе взаимодействия ионов металлов с органическим веществом – константы устойчивости комплексов, координационное число комплекса и т.д., но не позволяют рассмотреть целостную поликомпонентную систему.
Натурные измерения распределения по формам металлов на основе ионообменной техники (в том числе хроматографической), а также методами мембранной фильтрации. Разделение компонентов природных вод по формам возможно при использовании ионообменных материалов – или колонка с обменными смолами в непосредственной близости от водоема; или хроматография в лабораторных условиях. Наиболее распространенными благодаря физико-химическим свойствам являются смолы марки Dowex. Применяя катионо- и анионнообменные смолы данной фирмы было получено большое количество данных о формах существования компонентов (Родюшкин, 1995; Перминова, 2000; Линник и др., 2016). Масштабную съемку природных вод с точки зрения форм распределения элементов разработали и провели специалисты из Норвегии и Шведции в 1990-х гг., позже это работы были проведены в группе Моисеенко Т.И. для вод РФ.
Наиболее подробные исследованием связывания металлов с гумусовыми веществами в РФ является изучение вод озер на Кольском полуострове. В 1995 г. Родюшкиным (Родюшкин, 1995) была использована подобная технология и доказано, что наибольшей степенью сродства к органическим веществам вод с молекулярной массой более 100 кДа обладают ионы Fe(III), Al(III), Ni(II), Cu(II). В той же работе было выявлено, что связывание металлов с гумусовыми веществами – это конкурентный процесс и содержание несвязанных ионов железа обратно пропорционально содержанию несвязанных ионов меди и никеля. В работах (Дину, 2015; Моисеенко и др., 2017) были также отражены экспериментальные и натурные результаты о конкурентном связывании металлов с гумусовыми веществами в диапазоне указанных молекулярных масс (рис. 2). Данные получены двумя путями – в ходе экспериментальных лабораторных работ с определением условных констант устойчивости комплексов, расчетов степени связывания металлов и с применением ионообменной техники в водах Кольского пол-ва. Результаты измерений и расчетов коррелировали в достаточной степени (R = 0.97).
Рис. 2.
Влияние присутствия ионов металлов на степень связывания других элементов с гумусовыми веществами. В прямоугольниках отражено влияние ионов металлов с более высокими комплексообразующими свойствами на формы существования некоторых других элементов. Крупными стрелками представлены значимые изменения в формах нахождения элементов при минимальных концентрациях ряда ионов металлов с высокими комплексообразующими свойствами: алюминия, железа; меди; свинца, кадмия, цинка.
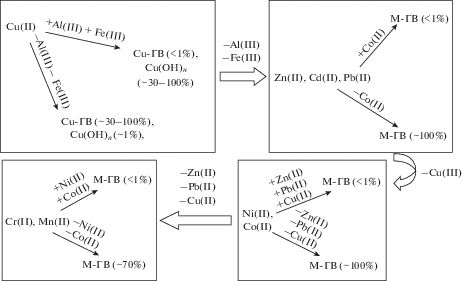
Полученные данные (рис. 2) указывают, что, наличие в системе ионов Al(III), Fe(III) (в концентрациях выше предела обнаружения) способствуют снижению степени связывания ионов Cu(II) с органической составляющей вод; в свою очередь, присутствие ионов Cu(II) в природных водах (особенно в водах ЕТР с низким/ниже предела обнаружения содержанием ионов Al(III), Fe(III)) влияют на степень инактивации ионов Zn(II), Cd(II), Pb(II) и т.д. Результаты подтверждают существующие тенденции в гидрохимии – Fe(III), Al(III), Cu(II) играют определяющую роль в формировании химического равновесия природных вод (Линник и др., 2016; Моисеенко и др., 2017).
Применение различных видов и типов смол при разделении природных вод в сравнении дают различные результаты для группы лантаноидов, актиноидов, благородных металлов и других рассеянных элементов, но (Nifatena et al., 2000; Линник и др., 2016) указывают на стабильность в распределении ионов Al(III), Fe(III) по формам. Кроме того, разработанная (Henshaw et al., 1989) и применяемая для ежесезонного мониторинга вод Норвегии, Финляндии, Швеции, Европейской территории России (Кольский Север) уже более 30 лет содержит подробную методологию и позволяет сравнивать полученные в единой системе результаты.
В настоящее время, методы фильтрации представляют собой самостоятельный блок исследования, который позволяет получить исчерпывающую информацию о размерах комплексов металлов с органическим веществом, а также о неорганических соединениях элементов (Buffle, 1990; Линник и др., 2016).
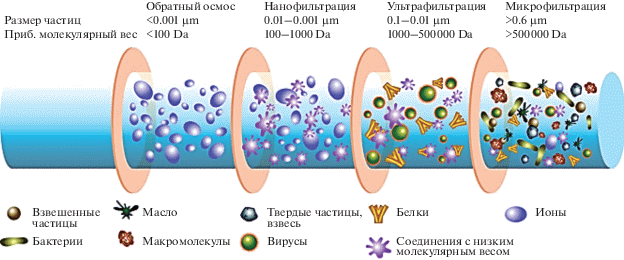
Методы мембранной фильтрация в применении к анализу природных вод развиваются стремительными темпами. Создание новых материалов фильтров и систем фильтрации (ядерная, обратного осмоса и т.д.) предоставляет возможность разделить многокомпонентные системы вод на биологические (вирусы бактерии, микрорастения и другие), органические (макромолекулы, простые органические кислоты и белки и другие) и неорганические (ионы металлов, комплексы с неорганическими лигандами и другие) компоненты вод. Существуют нормативы при анализе природных водных объектов – это использование фильтра с диаметром пор 0.45 мкм для отделения грубодисперсной фракции и 0.22 мкм для экологических исследований. Однако многие исследовательские работы (Nifatena et al., 1999; Nifatena et al., 2000; Mostafa, 2013; Monteiro et al., 2016; Reza, 2016) выполняются с применением набора мембран с различным размером пор и многоступенчатых фильтрационных систем.
Мембранная фильтрация часто сочетается с другими методами разделения веществ, обзор данных методов дан в работе (Apello et al., 2005; Rivas et al., 2010). Выбор материала и размера пор мембран во многом определяется поставленной исследователем задачи (рис. 3). При последовательной многоступенчатой фильтрации на первой стадии используют мембраны с большим размером пор и далее размер пор уменьшается (Крушенко и др., 2000). Данный подход дает возможность получить фракции с различным размером веществ и молекул. Последующий анализ фракций различными физико-химическими методами, такими как масс-спектрометрия с индуктивно связанной плазмой, спектрофотомерические методы, электрохимические методы и другие дает возможность получить информацию о распределении металлов, органических (гуминовых) веществ (Spivakov et al., 1994).
Прикладные аспекты методов мембранной фильтрации достаточно спорны, также, как и рассматриваемые ранее методы ионообменного разделения. Изменение материала фильтров, скорости и давления автоматической мембранной фильтрации способны привести к значительным различиям результатов (Apello et al., 2005). Несмотря на это, достаточная экспрессность данного метода, возможность использовать в полевых условиях способствует активному применению и развитию. Авторы (Линник, 2013; Vinodh et al., 2011; Wu, 2014) считают такой способ разделение более щадящим, без использования химических процессов, что является их бесспорным достоинством. Многочисленные литературные данные о методологии анализа разноразмерных форм способствовали развитию смешенного метода разделения – применение ядерных/трековых фильтров после пропускания образцов через смолы. Такой подход позволяет оценить долю гуминовой и фульвокислотной составляющей.
Расчетные методы и “ряды активности металлов” требуют данные экспериментальных изучений процессов комплексообразования – это условные константы устойчивости комплексов с гумусовыми веществами, константы кислотно-основного равновесия органических веществ гумусовой природы, произведение растворимости и тд.
Логика и алгоритм расчета степени связывания ионов металлов с органическими лигандами является наиболее трудной для согласования между российскими и зарубежными учеными. Существует ряд работ, в которых условно для всех металлов выбрано соотношение (Линник и др., 1986) 1 : 1 (металл–лиганд) и из этих соображений проводятся дальнейшие расчеты и выводы. Другие авторы (Buffle, 1990) говорят о мультилигандностий гумусовых веществ, что не характерно для неорганических лигандов.
Из наиболее актуальных моделей оценки распределения элементов по формам, в том числе и связанных с органическими лигандами, можно говорить о следующих (Дину, 2018):
Термодинамические равновесия, которые являются результатом взаимодействия “вода–порода” (Шваров, МГУ). В основе программного расчетного моделирования лежит минимизация энергии Гиббса, что позволяет определить химический состав раствора, количественный состав равновесных ассоциаций твердых фаз при заданных условиях (Рыженко, Сидкина, 2017).
NICA-Donnan модель взаимодействия гетерофаз в природных водах на основе неравновесной конкурентной адсорбции и хемосорбции. Активно применяется для расчета распределения элементов в системе “вода–донные отложения”, а также описания адсорбционных процессов на твердых природных носителях – почва, песок – в открытой природной системе (Saito et al., 2004).
CHEAQS (Химическое равновесие в водных системах) модель, которая позволяет вводить данные о 52 катионах, большом числе неорганических и низкомолекулярных органических анионах, общие химически параметры – рН, Еh, электропроводность для оценки концентрационного равновесного распределения с учетом редокс-цикла (http://www.cheaqs.eu/index.html).
Программы ACIDFORMMET и ElementPhaseMigration (Дину, 2017) для расчета химических равновесий в поверхностных водах без учета взвешенной составляющей и с учетом образования гетерофазы. Расчет основан на математическом моделировании химических реакций, протекающих в природных водах, и опирается на основные законы аналитической и физической химии: уравнения материального баланса; математическом выражении констант равновесий; уравнения электронейтральности; уравнения протонных равновесий; протекание конкурирующих реакции с учетом фазовых переходов “вода–твердый осадок”.
Из наиболее обобщенных русскоязычных работ по вопросу образования гуматов и их протекторной роли можно выделить монографию (Линник, Набиванец, 1986) в которой помимо многочисленных условных констант устойчивости комплексов металлов с фульвокислотами, гуминовыми кислотами были представлены данные о молекулярных массах, сорбционных способностях и т.д. К сожалению, в настоящее время подобного многофакторного обобщения по данному вопросу крайне мало.
Несмотря на многочисленный систематизированный материал, новаторский для своего времени, опубликованные данные авторов, также как и другие литературные материалы-ссылки монографии, содержат большое количество несоответствий и трудностей в использовании:
Достаточно широкие вариации рН для проведенных анализов – от 6 до 8–9, что отражается на полученных данных об условных константах устойчивости комплексов металлов с гумусовыми веществами и их фракциями. В некоторых примерах для представленных констант устойчивости комплексов авторы не указали рН системы в эксперименте, что затрудняет использование данных.
Различия в методическом исполнении эксперимента; в монографии и статьях отражены результаты аналитических экспериментов методами электрохимии, спектральными методами, гравиметрическими и т.д. Результаты таких экспериментов могут отличаться для одного и того же комплекса металла более чем на два порядка, что как раз и связано с аналитическими возможностями.
Различия в используемых образцах. Авторы пытались систематизировать органические вещества гумусовой природы без учета зональной специфики в которой сформировался объект исследования – представлены данные о фульвокислотах или гуминовых кислотах различных почв, вод из различных территорий. Зачастую работая с исходным литературным материалом монографии (опираясь на список литературы) выяснялось, что способ выделения гумусовых веществ и их фракций также был различным. Позже появились статьи, в которых отражена информация о структурных вариациях органических веществ гумусовой природы в зависимости от выбора элюента (Орлов, 1991; Орлов, 2002). Доказано, что более щелочная среда (экстрагирование при рН более 10) и промежуточные стадии без дополнительного охлаждения “разрывают” полимерные молекулы органических веществ снижая тем самых их молекулярные размеры. Как следствие доказано, что ряд металлов (таких как ионы свинца и кадмия) лучше связываются с небольшими (низкомолекулярными) лигандами органических веществ гумусовой природы.
“Ряды активности металлов” (РАМ) как способ оценки степени связывания металлов с гумусовыми веществами (Moiseenko et al., 2013). С точки зрения характеристики способности металлов к связыванию с гумусовыми веществами в геохимии применяется термин “ряды активности металлов” (РАМ), не имеющий аналогов в химии. Используемый термин широко применяется также в других экологических областях науки и кардинально отличается от известного в химии электрохимического ряда активности металлов. Словосочетание “ряды активности металлов” означает сравнение способности ионов металлов образовывать комплексы с ГВ или фракциями в конкретных условиях. Существующие “ряды активности металлов” в реакциях комплексообразования составлены на основании изучения определенных водных объектов или модельных экспериментов и математических расчетов. Зачастую в работах сравниваются ряды активности металлов, в которых лигандами служат как гумусовые вещества (ГВ), так и фульвокислоты (ФК) или гуминовые и гематомелановые кислоты (ГимК). Авторы объяснют возможность сопоставления сходимостью результатов или доминированием определенной фракции в структуре ГВ. Подобные сравнения лишь частично отражают существующие тенденции, так как ГВ и их фракций – это высокомолекулярные сложные соединения, но обладающие специфическими особенностями.
Практически не удалось найти два одинаковых РАМ, описывающих способность ионов металлов к комплексообразованию. Но в литературе рассматриваются приблизительные сходства рядов по местонахождению отдельных ионов металлов – это положение Fe3+, Cu2+ и Al3+ как наиболее активных катионов в природных водах и Sr2+, Mn2+ как компонентов с наименьшей способностью к образованию комплексов. В работах (Dinu, 2015; Моисеенко, 2018) опираясь на литературные данные и результаты экспериментов, представлен следующий ряд:
В нем степень связывания Cr3+ приравнивается к Cu2+, Al3+, Fe3+ и Hg2+. Co2+ и Ni2+ занимают положение после Zn2+. У других авторов (Evans, 2000) представлены степени связывания ионов металлов с гумусовыми веществами вод и выявлен другой РАМ: Sr2+ < Cr3+ < Mn2+ < Zn2+ < Ni2+ < < Al3+ < Cu2+ < Fe3+.
Ионы Cr3+ в представленном ряду менее способны к связыванию в комплексы, чем Fe3+ и Al3+, Cu2+. Ионы Sr2+, как представителя группы щелочноземельных металлов, обладает низкой способностью к образованию комплексов с гумусом, что совпадает с выводами других авторов.
Результаты наших экспериментальных работ подтверждают данные о роли условных констант устойчивости комплексов ионов с ФК в распределении металлов: Mg2+ < Mn2+ < Zn2+ < Ca2+ < < Pb2+ < Co2+ < Ni2+ < Cu2+ < Al3+ < Fe3+.
Но, в представленном ряду, ионы Ca2+ в большей степени способны к образованию комплексов с конкретным типов органических веществ, чем Zn2+.
Величина рН оказывает влияние на константы устойчивости комплексов и изменение величины рН приводит к изменению порядка устойчивости комплексов ТМ с РОВ (Моисеенко и др., 2017).
Например, при рН 2.4:
а при рН 5.8:
Хотя рассматриваемые ряды активности металлов носят в некоторой степени условный характер, с их помощью можно выявить металлы, обладающие преимущественным сродством к органическим веществам вне зависимости от их природы и катионы для которых характерны эти процессы в наименьшей степени.
При рассмотрении методологии оценки гуматов, фульватов металлов в природных водах стоит отметить ряд особенностей, существенно влияющих на полученные данные. Во-первых, вклад химических взаимодействий при попытке измерить содержание ионных форм металлов и связанных с органической составляющей; смещение химического равновесия при воздействии ионообменных смол и хроматографических методов анализа. Во-вторых, это вариации получаемых образцов при выделении органических веществ из природных вод в зависимости от способа экстрагирования и температурного воздействия. В-третьих, это особенности, привнесенные биогеохимическими предпосылками объекта и его типом – моря, озера, реки; загрязненные и незагрязненные объекты.
ОСОБЕННОСТИ РАСПРЕДЕЛЕНИЯ МЕТАЛЛОВ ПО ФОРМАМ В РАЗЛИЧНЫХ ВОДНЫХ ОБЪЕКТАХ
Разнообразие физических и химических состояний элементов в определенных условиях физико-химической обстановки по мнению В.И. Вернадского (Вернадский, 1940) есть “форма нахождения”. Опираясь на наиболее распространенную классификацию выделяют грубодисперсные, мелкодисперсные, истинно растворенные формы нахождения.
Кроме того, при классификации сосуществующих форм металла в воде, в зависимости от размера связанной с ним фракции, принята следующая схема деления (Папина, 2000):
<0.001 мкм – истинно растворенные формы;
0.001–1 мкм – коллоидные формы;
>1 мкм взвешенные формы (так называемые particulate forms).
Согласно многочисленным литературным данным (Линник и др., 1986; Alberts et al., 2000; Evans et al., 2000; Vinodh et al., 2011) распределения металлов среди сосуществующих форм включают гетерофазные переходы, органические, неорганические и смешанные комплексы истинно растворенного и коллоидного состава. Установление равновесия зависит от многих внешних факторов. В зависимости от выбора этих факторов возможно проводить расчеты сосуществующих равновесных форм. Помимо тривиально сложившейся классификации в настоящее время благодаря развитию нанотехнологий возможно разделение органических веществ в природных водах на фульвокислотную и гуминовую составляющие.
В работах Линник Р.П. и др. (2006, 2013) систематизированы классические представления о формах нахождения металлов и их определении. В зависимости от типа вод равновесия в системах обладают различной степенью устойчивости к воздействию химических и физических факторов. Применяя методы ионообменного разделения и фракционирования авторами получены данные о распределении элементов по формам в различных объектах.
Речные и морские воды. Достаточное количество работ посвящено распределению металлов по формам в реках и речных системах, это связано со значительной рекреационной и транспортной ролью водоемов (Линник и др., 1986, 2013; A-lberts et al., 2000; Evans et al., 2000; Vinodh et al., 2011; Сиротюк, 2011; Wu, 2012). За счет значительного влияния гидрологических особенностей – течение, регулирование речной системы и т.д. влияние биогеохимических факторов – в зависимости от ландшафта, климата – не так явно проявляется для них. Значительное количество авторов говорит о доминирующих взвешенных формах нахождения металлов, относительно растворенных.
Авторами выявлено, что сопоставление концентрации тяжелых металлов во взвешенном веществе реки Арктического региона с мутностью воды для ионов тяжелых металлов наблюдается четкая пропорциональная зависимость: с уменьшением мутности увеличивается удельное содержание металла во взвешенном веществе при рН воды от 7.9 до 8.1. Этот факт авторы объясняют тем, что обычно при уменьшении мутности воды в реке в составе ее взвешенных веществ увеличивается доля мелких фракций, имеющих большую относительно крупных фракций удельную площадь поверхности. Поэтому по значению удельной концентрации тяжелых металлов во взвешенном веществе нельзя однозначно судить о существующей на изучаемый момент времени экологической нагрузке.
Наиболее интересна с точки зрения образования частиц различного размера система перехода реки в море. В эстуарии происходи смешение вод с очень разным химически составом, различным физико-химическим (ионная сила, рН, Еh) и физическим (плотность, иногда температура) свойствами. Концентрации многих элементов, в то числе биогенных и таких металлов, как Fe, Мп, Си, Zn, Pb, Ni, с поступающими речными водами, как правило, выше, чем в морских. С другой стороны, ионная сил и содержание основных ионов в речных вода на 1–2 порядка ниже чем в морских. Это дает основание рассматривать эстуарии как комплексные биогеохимичесие барьеры, которые во много являются определяющими для форм нахождения металлов, поступивших из рек (Шульгин, 2012). В данных условиях наиболее сложно рассчитать равновесные процессы в системе, поскольку “не работают” существующие константы равновесия металлов с неорганическими и органическими лигандами.
С точки зрения оценки изменчивости растворимых органических и неорганических веществ, представляет интерес работа, проведенная в Венеции (Италия) рядом авторов (Calance et al., 2006). Было показано, что наибольший вклад в распределение гумусовых веществ вносят компоненты с молекулярной массой ниже 3000 Да, представленные фульватным типом. Авторами рассмотрены несколько способов подготовки образцов – с применением мембранной фильтрации и последующим разделением пробы на фульвокислотную и гуминовую составляющие и без мембранной фильтрации. Выявлено, что процесс гумификации (содержание гумусовых веществ в общем количестве органических веществ) развивается быстрее в более теплое время, вызывая цветение вод.
Для морских вод следует отметить роль коллоидных органических компонентов, помимо взвешенной составляющей. Повышенные значения рН морской воды способствуют более интенсивному поступлению фульвокислотной и гуминовой фракций в водную среду, а также образованию гидрооксилов железа и их комплекообразованию с органическими веществами по монодентантному механизму (Krashler et al., 2015). В морских водах органические вещества гумусовой природы наиболее обогащены минеральными составляющими (солевой эффект неорганического типа соли). Подобные ассоциаты нейтрализуемые ионами натрия с большим трудом, чем органика речных вод образуют поликомпонентные соединения и инактивируют ионы металлов.
Болотные системы. Для торфяных и заболоченных вод характерно высокое содержание органических веществ гумусовой и торфяной природы, которые имеют достаточно высокие молекулярные массы. Это наглядный пример гетерофазного распределения элементов по формам: в болотах и заболоченных водоемах вклад более ароматических под-фракций гумусовых веществ существенен. Ряд работ показывает, что влияние на равновесие системы гиматомелановых и гуминовых под-фракций в таких водах наибольший (Линник, 2013). Проявление зональной специфики в данном случае может быть связано, например, с биогеохимическими предпосылками. Химический состав болотных вод Западной Сибири (ЗС) характеризуется рядом специфических особенностей, влияющих на формообразование металлов (Dinu, 2015). Высокие содержания хлоридов в них объясняются природными (геохимическими) и (или) антропогенными факторами – хлориды присутствуют в водах ЗС как элемент загрязнения при разработке нефтяных и газовых месторождений. Высокие содержания нитратов и нитритов, как и аммонийного азота в водах ЗС, являются следствием широкого распространения в регионе низинных болот, что приводит к естественному обогащению вод гумусовыми кислотами и органическими формами азота, а также возможно техногенное обогащение вод соединениями азота за счет сжигания попутного газа на местах нефтедобычи.
При оценке распределения металлов по формам в болотных водах ЗС методами ионообменного разделения выявлено воздействие ионов натрия и хлорид ионов (солевой эффект) на степени связывания ионов других металлов с органическим вещество. Изменение электростатического заряда коллоидной системы в целом способствует снижению комплексообразования тяжелых металлов. Кроме того, высокие молекулярные массы органических веществ менее предпочтительны для комплексообразования ионов большинства металлов. Вместе с тем, в процессе формирования и старения гумусовых веществ болотных вод происходит медленный “захват” металлов, поэтому при выделении (вымораживании) старой органики в ней содержится большое разнообразие элементов.
Воды малых озер. Природные воды малых озер – это индикаторы геохимических особенностей и антропогенных воздействий. Бессточные озера наиболее отражают природный вклад в химическую композицию водоема и климатические изменения (Burba et al., 1998; Alberts et al., 2000; McDonald et al., 2004; Clark et al., 2010).
В настоящий момент, распределению элементов по формам в озерах уделяется не столько внимания, как речным системам. Согласно существующим нормативам применяется фильтрация озерной воды через фильтр 0.45 мкм (в ГОСТ РФ также указан фильтр “синяя лента”). Поэтому большинство работ, связанных с химическим составом озер рассматривает некоторые диапазон растворимых форм (включая коллоиды), но без учета взвесей. Из наиболее масштабны исследований озер – работы, проведенные в районе Кольского полуострова (малые озера) включали ионообменную технологию и мембранную фильтрацию. В зависимости от расположения от источника загрязнения синхронно снижалась доля взвешенных форм и увеличивались истинно растворенные формы металлов. Достаточное присутствие ионов никеля и кобальта в отдельных загрязненных озерах способствовали их конкурентному связыванию с органическим веществом относительно других ионов металлов.
В работе (Reitzel et al., 2017) представлены результаты экспериментального исследования распределения La по формам в мягких и жестких озерных водах (относительно их химического состава). Показано, что в зависимости от типа вод, элемент может находится в виде коллоидов или в виде низкомолекулярных комплексов с органическими веществами, что связано с конкурентным равновесием в системе.
В литературе (Моисеенко и др., 2017) представлены данные о формах нахождения ряда тяжелых металлов в зависимости от рН системы. Представленные данные указывают на резкий переход ионов железа и алюминия во взвесь при изменении рН от 5.5 до 6.0. При этом происходит увеличение молекулярного веса фульвокислот и снижение доли коллоидных комплексов ионов меди и свинца.
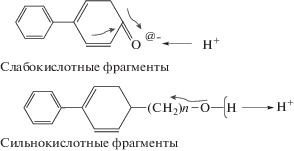
Стоит отметить, что достаточно гумусированные озера имеют природные низкие значения рН вследствие высоких концентраций неорганических и органических кислот. Структура гумусовых соединений, в частности активность функциональных групп, сильно варьируется в зависимости от рН среды. В нейтральных средах (рН около 6–7) система характеризуется наиболее стабильным дзета-потенциалом и равновесным содержанием сильных и слабых кислот. В условиях низких рН (менее 6) за счет избытка протонов водорода стабильность полимерной структуры гумусовых веществ нарушается. Наиболее активные сильнокислотные составляющие органических веществ представляют собой полимеры с достаточно низкой электронной плотностью краевых атомов кислорода, азота или серы, функциональные группы связаны одинарными связями с каркасом матрицы. За счет протекающих мезоморных и индуктивных эффектов в этих соединениях происходит диссоциация с образованием протона. Слабокислотные компоненты гумусовых веществ, напротив, могут характеризоваться кратной связью и повышенной отрицательной плотностью на активном краевом атоме и способствовать тем самым образованию фрагментов –ОН, =NH и т.д. Схематично подобные различия в структуре сильных и слабых органических кислот можно изобразить следующим образом (Моисеенко, Дину, 2018):
ЗАКЛЮЧЕНИЕ
Органические вещества гумусовой природы играют важную роль в формировании химического состава вод, протекании гомогенных и гетерогенных процессов. Развитие представлений об их протекторных свойствах напрямую связано с увеличением антропогенного воздействия: поступление ионов тяжелых металлов, органических синтетических токсикантов, нефтепродуктов и радионуклидов. Гумусовые вещества способны связывать и инактивировать токсичные элементы и вещества в природных объектах.
Современное развитие аналитической химии позволяет рассмотреть более детально функциональные и структурные особенности, механизмы связывания металлов с учетом фульватной или гуматной природы гумусовых веществ, а также зональной специфики комплексообразования. Из наиболее современных аналитических методов разделения и исследования природных органических веществ в системе “полевого анализа” можно указать различные виды фильтрации – от мембранной до ядерной.
Несмотря на доказанность факта протекторных свойств гумусовых веществ не существует единой методологии в оценке процессов комплексообразования и алгоритма аналитических исследований. Анализ литературных данных выявил, что существуют ряд решений, способных в определенной степени описать взаимодействие металл-органическое вещество гумусовой природы: натурные измерения форм нахождения, расчетные математические программы на основе термодинамических и концентрационных равновесий, а также “ряды активности металлов”. Все эти способы характеризуются своими достоинствами и недостатками. Ионнобменное разделение элементов по формам характеризуется достаточной степень условности, но простота использования дает возможность применять его к большому количеству проб. Наиболее щадящим в сточки зрения разрушения органического вещества является метод мембранной фильтрации.
Экспериментальные и литературные данные указывают на высокую перспективность сочетания ряда методов – ионообменной техники и мембранной фильтрации для выделения и более тонкого исследования органических веществ гумусовой природы с различной молекулярной массой и природой.
Работа выполнена при финансовой поддержке гранта РНФ 18-17-00184.
Список литературы
Варшал Г.М., Кощеева И.Я., Сироткина И.С., Велюханова Т.К., Инцкирвели Л.Н., Залюкина Н.С. (1979) Изучение органических веществ поверхностных вод и их взаимодействие с ионами металлов. Геохимия (4), 598-608.
Вернадский В.И. (1940) Биогеохимические очерки. 1922–1932 гг. М. Л., 250 с.
Дину М.И. (2017) Формирование органических веществ гумусовой природы и их биосферные функции. Геохимия (10), 917-933.
Dinu M.I. (2017) Formation of organic substances of humus nature and their Biospheric properties. Geochem. Int. 55(10), 911-926.
Добровольский В.В. (2004) Роль гуминовых кислот в формировании миграционных массопотоков тяжелых металлов. Почвоведение 1, 32-39.
Зобкова М.В., Ефремова Т.А., Лозовик П.А., Сабылина А.В. (2015) Органическое вещество и его компоненты в поверхностных водах гумидной зоны. Успехи современного естествознания (12), 115-120.
Крушенко Г.Г., Сабиров Д.Р., Петров С.А., Талдыкин Ю.А. (2000) Проблема воды. Вода и экология. Проблемы и решения (3), 2–8.
Линник И.А., Набиванец Б.И. (1986) Формы миграции металлов в пресных поверхностных водах. Л.: Гидрометиздат, 1986. 272 с.
Линник Р.П., Линник П.Н., Запорожец О.А. (2006) Методы исследования сосуществующих форм металлов в природных водах (обзор). Методы и объекты химического анализа 1(1), 4-26.
Линник П.Н., Иванченко Я.С., Линник Р.П., Жежеря В.А. (2000) Гумусовые вещества поверхностных вод и особенности их распределения среди различных фракция. Гидрохимия 49(3), 99-120.
Моисеенко Т.И. (2017) Эволюция биогеохимических циклов в современных условиях антропогенных нагрузок: пределы воздействий. Геохимия (10), 841-862.
Moiseenko T.I. (2017) Evolution of Biogeochemical Cycles under Anthropogenic Loads: Limits Impacts. Geochem. Int. 55(10), 841-860.
Моисеенко Т.И., Гашкина Н.А., Дину М.И. (2017) Закисление вод: Уязвимость и критические нагрузки. Москва: URSS, 400 с.
Моисеенко Т.И., Дину М.И. (2018) Оценка буферных свойств природных вод с учетом кислотно-основных характеристик гумусовых веществ. ДАН 481(1), 75-79.
Орлов Д.С. (1991) Гумусовые кислоты почв и общая теория гумификации. Изд-во: МГУ, 325 с.
Орлов Д.С., Бирюкова О.Н., Суханова Н.И. (1996) Органическое вещество почв Российской Федерации. Изд-во: Наука, 258 с.
Орлов Д.С., Садовников Л.К., Лозановская И.Н. (2002) Экология и охрана биосферы при химическом загрязнении. М.: Высшая школа, 340 с.
Рыженко Б.Н., Сидкина Е.С. (2017) Система “вода-гранит”: время формирования состава пресных вод. Известия Томского политехнического университета 328(4), 108–115.
Папина Т.С. (2001) Транспорт и особенности распределения тяжелых металлов в ряду: вода – взвешенное вещество – донные отложения речных экосистем. Новосибирск, 58 с.
Перминова И.В. (2000) Анализ, классификация и прогноз свойств гумусовых веществ. Диссертация на соискание ученой степени доктора химических наук. Москва, 359 с.
Попов А.И. (2004) Гуминовые вещества: свойства, строение, образование. С.-П. Гос. Университет, 202.
Родюшкин И.В. (1995) Основные закономерности распределения металлов по формам в поверхностных водах Кольского Севера: Дис. … канд. геогр. наук. СПб., 161.
Федотов Г.Н., Шалаев В.С. (2012) Минеральные наночастицы в гумусовой матрице почвенных гелей. Лесной вестник 7, 50-57.
Alberts J.J., Takacs M., Pattanayek M. (2000) Naturel organic matter from a Norwegian lake: possible structural changes resulting from Lake Acidification In book: Humic Substances. Nova, 261-275.
Apello C.A.J., Postma D. (2005) Geochemistry, Groundwater and Pollution. Taylor & Francis 683 p.
Baglieri A., Vindrol D., Gennari M., Negre M. (2014) Chemical and spectroscopic characterization of insoluble and soluble humic acid fractions at different pH values. Chem. and Biol. Technol. in Agricul. 1(1), 1-11.
Buffle, J. (1990) Complexation Reactions in Aquatic Systems: an Analytical Approach. Ellis Horwood Ltd. N.Y., 636-672.
Burba P., Aster B., Nifant’eva T., Shkinev V., Spivakov B.Ya. (1998) Membrane filtration studies of aquatic humic substances and their metal species: a concise overview Part 1. Analytical fractionation by means of sequential-stage ultrafiltration. Talanta 45, 977-988.
Calance N., Palmieri N., Mirante S., Petronio B.M., Pietroletti M. (2006) Dissolved and particulate humic substances in water channels in the historic center of Venice. Water res. 40, 1109-1118.
Clark J.M., Bottrell S.H., Evans C.D., Monteith D.T., Bartlett R., Rose R., Newton R.J., Chapman P.J. (2010) The importance of the relationship between scale and process in understanding long-term DOC dynamics. Sci. Total Environ. 408(13), 68-75.
Dinu M.I. (2015) Chapter “Influence of Humus Substances Functional Characteristics.
Doig N. (2007) Speciation in the presence of different sources and fractions of dissolved organic matter. AJAC 2 (2), 116-125.
Dudare D., Klavins M. (2000) The interaction between Humic Substances and Metals, depending on structure and properties of Humic Sustances. 4th Intern. Conf. on Environ., Energy and Biotechn. 85, 10-15.
Evans C.D. and Monteith D.T. (2000) Water chemistry discussion. UK Acid Waters Monitoring Network: 10 Year Report. ENSIS Publishing, London.
Henshow J.M., Heithmat E.M., Hinners T.A. (1989) Trace elements speciation. Anal. Chem. 61, 335-342.
Ling W.Y., Aris A.Z., Zakaria M.P. (2012) Spatial variability of metals in surface water and sediment in Langat River and geochemical Factors that influence their water-sediment interaction Sci. World J. 14(2) 15-30.
McDonald S., Bishop A.G., Prenzler P.D., Robards K. (2004) Analytical chemistry of freshwater humic substances. Anal. Chim. Acta 527, 105-124.
Meng F., Huang G., Yang X., Li Z., Li J., Cao J.; Wang Z.; Sun L. (2013) Identifying the sources and fate of anthropogenically impacted dissolved organic matter (DOM) in urbanized rivers. Water res. 3, 75-82.
Michałowska-Kaczmarczyk A.M. (2015) Application of Simms Constants in Modeling the Titrimetric Analyses of Fulvic Acids and Their Complexes with Metal Ions. J. Solution. Chem. 45, 200-220.
Moiseenko T.I., Gashkina N.A., Dinu M.I. (2013) Aquatic geochemistry of small lakes: effects of environment changes. Geochem. Int. (13), 1031-1148.
Monteiro A.S.C., Parat C., Rosa A.H., Pinheiro, J.P. (2016) Towards field trace metal speciation using electroanalytical techniques and tangential ultrafiltration. Talanta 152, 112-118.
Mostafa R., Enge E. (2013) Heavy metals seasonal variability and distribution in Lake Qaroun sediments, El-Fayoum. J. Afr. Earth Sci.10, 48-55.
Nifanteva T.I., Burba P., Fedorova O., Shkinev V.M., Spivakov B.Yu. (2000) Ultafiltration and determination of Zn and Cu-humic substances complexes stability constant. Talant-a 53, 1127-1131.
Nifanteva T.I., Shkinev V.M., Spivakov B., Yu Burba P. (1999) Membrane filtration studies of aquatic humic substances and their metal species: a concise overview. Talanta 48, 257-267.
Proceedings Book of the Communications presented to the 15th Meeting of the International Humic Substances Society Tenerife: Canary Islands. 2010.
Reza J. (2016) Development of ionic liquid-based in situ solvent formation microextraction for iron speciation and determination in water and food samples. J. Mol. Liq. 216, 666-670.
Rivas B.L., Shkinev V.M., Dzherajan T.G., Danilova T.V., Pereira E.D., Maureira A. (2010) On-line multi-stage membrane filtration of synthetic polydispersed water-soluble polymers with UV visible absorption as a mode for their detection. J. Chil. Chem. Soc. 55(1), 53-55.
Rostad C.E., Leenheer J.A. (2004) Factors that affect molecular weight distribution of Suwanee river fulvic acid as determined by electrospray ionization/mass spectrometry. Anal. Chem. Acta 523, 269-278.
Saito B.Y., Nagasaki S., Tanaka S., Koopal L.K. (2004) Application of the NICA-Donnan model for proton, copper and uranyl binding to humic acid. Radiochim. Acta (92), 567-574.
Schneider A.R., Ponthieu M., Cances B., Conreux A., Morvan X., Gommeaux M., Marin B., Benedetti M.E. (2016) Influence of dissolved organic matter and manganese oxides on metal speciation in soil solution. A modelling approach. Envir. Pollut. (213), 618-627.
Sjöstedt S. (2009) Speciation of aluminium, arsenic and molybdenum in excessively limed lakes. Sci. Tot. Environ. 407(18), 1888-1895.
Spivakov B.Ya., Shkinev V.M., Geckeler K. (1994) Separation and Preconcentration of Trace Elements and Their Forms in Aquatic Media Using Inert Porous Membranes. Pure Appl. Chem. 66(3), 631-640.
Tsuda K., Mori H., Asakawa D., Yanagi Yu., Kodama H., Nagao S., Yonebayashi K., Fujitake N. (2010) Characterization and grouping of aquatic fulvic acid isolated from clear-water rivers and lakes in Japan. Water Res. (44), 3837-3846.
Stevenson F.J. (1994) Humus Chemistry. Genesis, Composition, Reactions. Wiley & Sons, Inc., New York, 565 p.
Vasyukova E.V., Pokrovsky O.S., Viers J., Oliva P., Dupre B., Martin F., Candaudap F. (2010) Geochemistry of Iron in Fresh Groundwater of the Sredneobskoy Basin, Russia. Geochim. Cosmochim. Acta (74), 449-468.
Vinodh R., Padmavathi R., Sangeetha D. (2011) Separation of heavy metals from water samples using anion exchange polymers by adsorption process. Desalin. 267, 267-276.
Wu D. (2012) Fluorescent characteristics and metal binding properties of individual molecular weight fractions in municipal solid waste leachate. Analyt. Meth. 3, 21-27.
Wu D. (2014) Speciation analysis of As, Sb and Se Simultaneous speciation analysis of As, Sb and Se redox couples by SF-ICP-MS coupled to HPLC. Analyt. Meth. 2, 2-17.
Ziechmann, Hubner (2000) Humic substances and humification. Versatile components of plants, soil and water 3, 9-20.
Дополнительные материалы отсутствуют.