Геохимия, 2020, T. 65, № 6, стр. 583-598
Органический углерод и карбонатная система в донных отложениях мелководных бухт залива Петра Великого (Японское море)
П. Я. Тищенко a, *, Е. В. Медведев b, Ю. А. Барабанщиков a, Г. Ю. Павлова a, С. Г. Сагалаев a, П. П. Тищенко a, М. Г. Швецова a, Е. М. Шкирникова a, О. А. Уланова a, Е. Ю. Тибенко a, Н. А. Орехова b
a Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, ул. Балтийская, 43, Россия
b Морской гидрофизический институт РАН
299011 Севастополь, ул. Капитанская, 2, Россия
* E-mail: tpavel@poi.dvo.ru
Поступила в редакцию 10.07.2018
После доработки 24.07.2019
Принята к публикации 24.07.2019
Аннотация
Исследован диагенез органического вещества (ОВ) донных отложений, отобранных в феврале 2018 г. в местах залежей лечебных грязей: заливе Угловой, бухтах Воевода и Экспедиции (залив Петра Великого, Японское море). Была изучена карбонатная система донных отложений, состав поровой воды на содержание биогенных веществ, растворенного органического углерода, гумусового вещества, концентраций сульфатов, хлоридов. В твердой фазе осадков были измерены концентрации органического углерода, хлорофилла-а, гуминовые и фульвовые кислоты, подвижные формы сульфидов. Подводной фотосъемкой установлено, что места отбора проб в бухтах Воевода и Экспедиции были покрыты зарослями зостеры морской, а в заливе Угловой – матами диатомей. Соотношения между растворенным неорганическим углеродом и щелочностью, а также данные по сульфат-хлорным отношениям и подвижным формам сульфидов указывают, что сульфатредукция является основным процессом деградации ОВ в донных осадках. Были получены разные значения коэффициентов биотурбации для залива Угловой, бухт Воевода и Экспедиции: 3.0, 107.6 и 14.5 см2/сут, соответственно. Оценены потоки взвешенного органического углерода из водной среды в осадок и растворенного неорганического углерода из осадка в водную среду, которые существенно различаются между собой. Предполагается, что основные причины дисбаланса между потоками органического и неорганического углерода обусловлены: а) неучтенным потоком углекислого газа, который выделяют морские организмы из донных отложений через свои сифонные системы; б) частичным потреблением ОВ инфауной в пищу с последующим в ней депонированием.
ВВЕДЕНИЕ
В настоящее время существует много независимых доказательств о глобальных изменениях Мирового океана, таких как уменьшение содержания кислорода в открытой части океана (Sсhmidtko et al., 2017) и на шельфе (Breitburg et al., 2018), а также уменьшение рН в открытом океане (Dore et al., 2009) и в прибрежных акваториях (Cai et al., 2011). Эти изменения отчасти обусловлены ростом концентрации двуокиси углерода в атмосфере и эвтрофикацией шельфовых вод океана. Большинство исследователей полагают, что рост концентрации углекислого газа в атмосфере обусловлен сжиганием ископаемых углеводородов. В настоящее время предложено много технологий по сдерживанию роста углекислого газа в атмосфере. Одна из таких технологий, под названием ”голубой углерод”, разрабатывается международным сообществом по инициативе UNEP. Суть этого проекта сводится к увеличению на нашей планете площадей, занятых высокопродуктивными растениями, которые сдерживали бы рост углекислого газа в атмосфере (Duarte et al., 2013). В этом проекте мелководные бухты, заросшие зостерой морской (Zostera marina L.), рассматриваются как перспективные бассейны по изъятию углекислого газа из атмосферы, с последующим его захоронением в форме органического вещества (ОВ) в донных осадках. Из-за высокой продукции зостера, наряду с тропическими лесами, мангровыми зарослями и солевыми маршами, включена в проект ”голубого углерода” (Röhr et al., 2016).
Зостера морская образует заросли на мягких илисто-песчаных грунтах в мелководных прибрежных акваториях. Это многолетнее растение с хорошо развитой корневой системой является чрезвычайно продуктивным, его валовая продукция достигает 2 мгО2/час на 1 грамм сырой массы (Бергер, 2011). На основе экспериментальных данных было установлено, что средняя ”чистая” продукция в летний сезон равна 4.8 гС/(м2 сут) (McRoy, 1974). Путем натурных наблюдений в бухте Витязь (залив Петра Великого) были получены значения 0.1–3.1 гС/(м2 сут) (Лысенко, Матюшин, 1984). Однако высокая продукция морских трав не является достаточным условием для изъятия атмосферного углекислого газа из биогеохимического цикла. Другим необходимым условием является захоронение этой биомассы в современных осадках (Dahl et al., 2016). Эффективность захоронения органического углерода в осадках зависит от многих причин. К ним относятся интенсивность и пути деградации ОВ, а также величина потоков продуктов диагенеза ОВ из донных отложений в морскую воду.
Диагенез ОВ в зарослях зостеры морской вызывает интерес также в связи с механизмом формирования лечебных грязей. Наибольшие запасы лечебных грязей бывшего СССР находятся в прибрежных акваториях Азовского моря (Мурадов, 2014). В заливе Петра Великого также существуют месторождения лечебных грязей: залив Угловой, бухты Экспедиции, Новгородская, Воевода (Иванова и др., 2009; Васильченко и др., 2014; Мурадов, 2014). Наиболее распространенным видом макрофитобентоса в этих акваториях является зостера морская. Например, плотность заселения зостеры морской в бухте Мелководной, расположенной в восточной части бухты Воевода достигает 3 кг сырой массы на кв. м (Барабанщиков и др., 2018). Знания о химическом составе лечебных грязей и путях протекания в них диагенеза ОВ имеют фундаментальный и прикладной характер.
Данная работа представляет собой сравнительное изучение диагенеза ОВ в донных осадках трех мелководных бассейнов залива Петра Великого: залив Угловой, бухта Воевода и бухта Экспедиции (рис. 1). Был использован широкий комплекс гидрохимических параметров придонной воды, поровой воды донных отложений и твердой фазы для установления доминирующих процессов в диагенезе ОВ и для оценки потоков органического углерода из морской воды в донные осадки и неорганического углерода из донных осадков в морскую воду. Соотношение потоков органического и неорганического углерода выполнено с целью оценки эффективности захоронения ОВ в мелководных бассейнах.
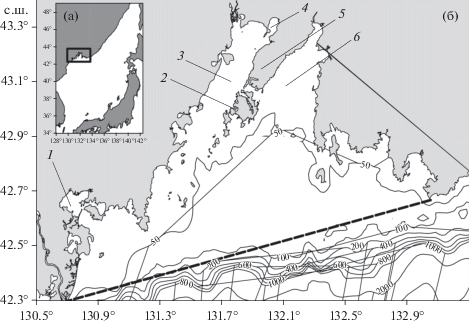
Рис. 1.
Географическое положение изучаемого района. (а) Японское море; (б) залив Петра Великого, пунктирная линия указывает внешнюю границу залива. 1 – бухта Экспедиции; 2 – бухта Воевода; 3 – Амурский залив; 4 – залив Угловой; 5 – полуостров Муравьева-Амурского, на котором расположен г. Владивосток; 6 – Уссурийский залив.
ОБЪЕКТЫ И МЕТОДЫ ИЗУЧЕНИЯ
Залив Угловой и бухта Воевода являются мелководными бассейнами второго порядка Амурского залива, а бухта Экспедиции – бассейн второго порядка залива Посьета (рис. 1). Их географическое описание дано в Лоции (1996). Более подробное гидрологическое описание этих бассейнов можно найти в работах Бычкова с коллегами (1989), Барабанщикова с коллегами (2015), Григорьевой (2012), Васильченко и др. (2014). Точные координаты геохимических станций: в заливе Угловой (ст. 1) – 43°18.809′ с.ш., 132°01.583′ в.д.; в бухте Воевода (ст. 2) – 43°00.081′ с.ш., 131°47.715′ в.д.; в бухте Экспедиции (ст. 3) – 42°41.770′ с.ш., 130°48.640′ в.д. Работы на станциях 1, 2 и 3 проводились 14, 8 и 19 февраля 2018 года, соответственно. Толщина льда составляла 58, 70 и 58 см, соответственно. Глубина места была 1, 2.1, 1.5 м для залива Угловой, бухты Воевода и бухты Экспедиции, соответственно. После бурения льда проводилось зондирование воды зондом RINKO, оснащенным датчиками температуры (Т), давления, электропроводности (солености), растворенного кислорода (DO), хлорофилла-а (флюоресценция), мутности. В данном случае использовался оптический датчик для определения кислорода с высоким быстродействием. Отбор проб воды осуществлялся с придонного горизонта на следующие гидрохимические параметры: соленость, DO, рН, общая щелочность (ТА), содержание хлорофилла-а, концентрация растворенного органического углерода (РОУ), концентрации биогенных веществ (фосфаты, силикаты, нитраты, нитриты, ион аммония). Также проводилось подводное фотографирование дна. Прямоточной геологической трубкой (1 м) отбирали керн осадка. Трубку с керном помещали в теплоизоляционный тубус и доставляли в лабораторию. В лаборатории керны фотографировали и делили по слоям с интервалом 10 см. Для каждого горизонта был измерен рН в осадках. После измерения рН осадок каждого горизонта отжимали в прессе для получения поровой воды. В поровой воде измеряли ТА, концентрации главных биогенных веществ (фосфаты, силикаты, нитриты, аммоний, общий азот и общий фосфор), концентрации анионов (Cl–, ${\text{SO}}_{4}^{{2 - }}$), гумусовых веществ (HS – Humic Substances), РОУ. В твердой фазе осадков определяли влажность, процентное содержание органического углерода (Сорг), концентрации гуминовых и фульвовых кислот, содержание феофитина и хлорофилла-а.
Значения рН в морских осадках измеряли потенциометрическим методом, используя ячейку безжидкостного соединения, калибровка которой проводилась при разных температурах, что позволило проводить измерения без термостатирования (Tishchenko et al., 2010). ТА анализировали прямым титрованием по методу Бруевича (Павлова и др., 2008). Элементы карбонатной системы (pHin situ; DIC, Dissolved Inorganic Carbon, – растворенный неорганический углерод; pCO2 – парциальное давление двуокиси углерода) рассчитывали с учетом поправки на содержание органической щелочности (Тищенко и др., 2011).
Концентрации макро-анионов (Cl–, ${\text{SO}}_{4}^{{2 - }}$) измеряли методом ионно-обменной хроматографии на хроматографе LC-20A производства Shimadzu (Япония).
Анализ биогенных веществ (нитриты, аммонийный азот, анионы ортофосфорной кислоты, кремний) проводили спектрофотометрическим методом с помощью стандартной процедуры (Grasshoff et al., 1983). Определение общего фосфора и азота выполняли на автоматическом анализаторе SKALAR SAN++. В этом случае пробу смешивали с раствором персульфата калия. Для азотной линии добавляли гидроксид натрия, а для фосфатной линии – серную кислоту. Растворы помещали в УФ-реактор и нагревали до 110°C. После окисления органического вещества нитраты восстанавливали до нитритов с помощью кадмиево-медного восстановителя. Содержание нитритов определяли реакцией Грисса, интенсивность окраски измерена при длине волны 540 нм. В фосфатной линии после разложения органических форм до ортофосфата добавляли гидроксид натрия для нейтрализации раствора. Концентрацию фосфора измеряли по интенсивности окраски фосфорномолибденового комплекса при длине волны 880 нм.
Органический углерод в твердой фазе осадков, поровой воде и придонной морской воде измеряли на анализаторе TOC-VCPN с приставкой для сжигания твердых проб SSM_5000А производства Shimadzu. Концентрации гуминовых и фульвовых кислот в твердой фазе осадка были измерены методом щелочной экстракции (Ходоренко и др., 2012). Содержание гумусовых веществ в поровой воде донных отложений определяли спектрофотометрическим методом при длине волны 254 нм на спектрофотометре Shimadzu UV, модели UV-1650PC. Воспроизводимость данного метода оценивалась нами в 2% (Тищенко и др., 2006).
Содержание в пробах грунта хлорофилла-а (Хл) и феофитина измеряли спектрофотометрическим методом в соответствии с ГОСТ 17.1.4.02.-90, используя вместо объема профильтрованной воды массу сырой навески грунта. Концентрации хлорофилла в сыром грунте пересчитывали на сухой вес с учетом его влажности и объемной массы. Пробы грунта экстрагировали в 10 мл 90% раствора ацетона и помещали в холодильник. Через сутки на спектрофотометре фирмы Shimadzu, модель РС 3600, проводили измерение оптической плотности в экстракте. Перед измерением феофитина экстракт предварительно подкисляли 2–3 каплями раствора соляной кислоты в ацетоне. Концентрации хлорофилла-а и феофитина рассчитывались по известным формулам (Jeffrey, Humphrey, 1975).
Содержание ”подвижных” (кислотно-растворимых) форм сульфидов проводилось по методике (Остроумов, 1953). Для переноса сероводорода из реакционного сосуда в ловушку, содержащую ацетат кадмия, использовался аргон. Образовавшийся сульфид кадмия растворяли в йодном растворе, избыток йода оттитровывали раствором тиосульфата. Концентрации рассчитывались на вес сухого осадка (мг/г).
Влажность осадков определяли взвешиванием осадка (около 1 г.) до высушивания и после высушивания при температуре 100–105°С в течение 1–2 сут до постоянного веса осадка.
РЕЗУЛЬТАТЫ
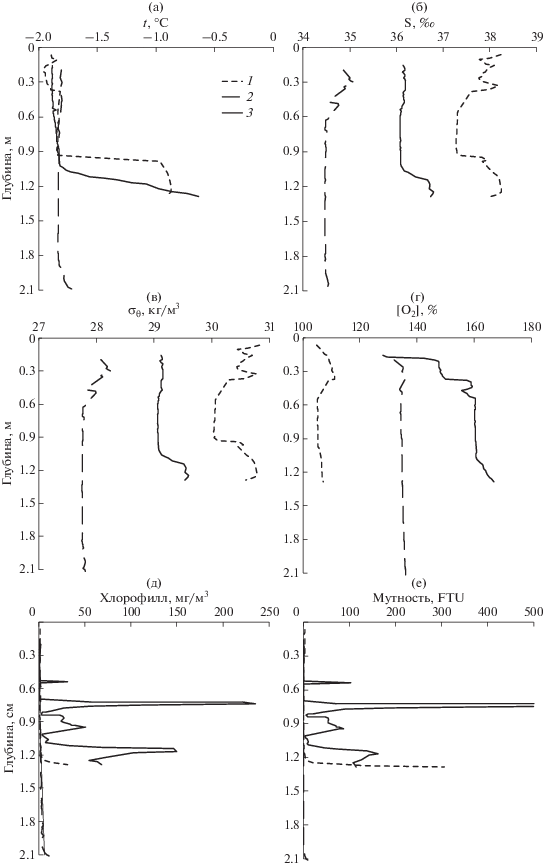
Подводное фотографирование подтвердило, что отбор кернов донных осадков в бухтах Воевода и Экспедиции был осуществлен в местах зарослей зостеры, а в заливе Угловой дно в месте отбора было покрыто ажурными матами диатомей. Профили зондирования водной толщи над донными осадками показали, что гидрологические характеристики воды имели C-образную форму (рис. 2а, 2б, 2в), что, на первый взгляд, можно посчитать ошибкой, т. к. плотность верхнего слоя до горизонта 0.6 м выше нижележащих слоев. Однако, этот факт можно объяснить тем, что после сверления льда лунка заполняется водой, находящейся в непосредственном контакте с нижней кромкой льда, где идет ледообразование, которое дает соленую воду с температурой замерзания. Значения гидрохимических параметров придонной воды приведены в таблице 1.
Рис. 2.
Профили зондирования водной толщи зондом RINKO на геохимических станциях в заливе Угловой – 1, бухте Воевода – 2, бухте Экспедиции – 3. (а) – температура (°С); (б) – соленость (‰); (в) – условная плотность (кг/м3); (г) – содержание кислорода в процентах от насыщения; (д) – концентрация хлорофилла (мг/м3); (е) – мутность (FTU – Formazin Turbidity Unit).
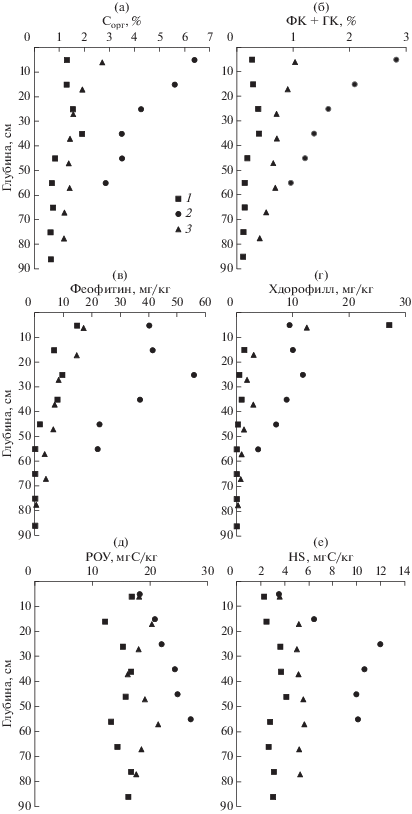
Во всех исследуемых акваториях были подняты керны мелкоалевритовых илов разного цвета: серый цвет характерен для залива Угловой, для бухт Воевода и Экспедиции цвет донных отложений был темно-серый, почти черный. Результаты анализа содержания разных форм ОВ в донных отложениях и поровой воде исследуемых мелководных бассейнов приведены на рис. 3. Суммарное содержание хлорофилла-а и феофитина в верхнем слое донных отложений составляет 41.8, 49.5 и 29.5 мг/кг в заливе Угловой, бухтах Воевода и Экспедиции, соответственно (рис. 3в, 3г). Ранее также отмечались высокие концентрации хлорофилла-а в морских донных осадках бухты Экспедиции (Андреева, Агатова, 1981). Измеренные в данной работе концентрации хлорофилла-а выше значений 6.6 и 10.3 мг/кг, полученных ранее для мелкоалевритовых илов центральной части бухты Экспедиции в летний сезон (Андреева, Агатова, 1981). Возможной причиной наблюдаемого различия является разное географическое положение станций и разный сезон исследования.
Рис. 3.
Профили содержания форм органического вещества в донных отложениях залива Угловой – 1, бухты Воевода – 2 и бухты Экспедиции – 3. (а) – органический углерод в сухом осадке; (б) – сумма гуминовых и фульвовых кислот в сухом осадке; (в) – феофитин в сухом осадке; (г) – хлорофилл в сухом осадке; (д) – концентрация растворенного органического углерода в поровой воде; (е) – концентрация гумусового вещества в поровой воде.
Концентрации продуктов диагенеза ОВ (биогенные вещества, DIC, TA) увеличиваются с глубиной осадка (рис. 4, 5). Их профили позволяют уточнить сложный характер процессов преобразования ОВ в донных осадках. Наиболее существенные изменения в концентрациях биогенных веществ относятся к верхнему горизонту донных осадков. В сравнении с придонной водой концентрации фосфатов в поровой воде осадков на горизонте 5 см увеличились в 2, 20 и 40 раз для залива Угловой и бухт Воевода и Экспедиции, соответственно. Подобные сравнения для аммония: 60, 229 и 46 раз; для растворенного кремния: 55, 70 и 112 раз. Такие контрастные изменения, особенно для районов обитания зостеры, обусловлены тем, что именно для верхних горизонтов осадка (0–3 см) наблюдаются высокие скорости регенерации биогенных веществ, достигающие 150 нмоль/(г час) (Izumi et al., 1982). Более высокие концентрации биогенных веществ в поровой воде характерны для донных отложений с высоким содержанием ОВ. Следует отметить различие в формах нахождения фосфора и азота в поровой воде: для растворенного фосфора доминирует неорганическая форма (ортофосфаты), для азота – органическая форма (рис. 4). Увеличение концентрации биогенных веществ сопровождается систематическим уменьшением сульфат-хлорных отношений для поровых вод бухт Воевода и Экспедиции (рис. 4е). Наличие кислотно-растворимых форм сульфидов в твердой фазе донных отложений (рис. 6) также является прямым доказательством процесса сульфатредукции.
Рис. 4.
Профили концентраций биогенных веществ и сульфат-хлорного отношения в поровой воде донных отложений залива Угловой – 1, бухты Воевода – 2 и бухты Экспедиции – 3. (а) – неорганический фосфор; (б) – общий фосфор; (в) – ион аммония; (г) – общий азот; (д) – кремний; (е) – молярное сульфат-хлорное отношение, штриховая линия соответствует морской воде.
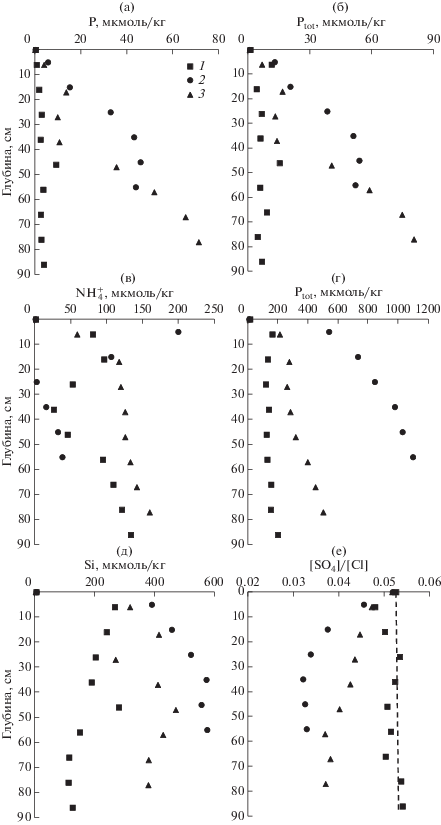
Рис. 5.
Вертикальные профили параметров карбонатной системы донных отложений залива Угловой – 1, бухты Воевода – 2 и бухты Экспедиции – 3. (а) – ТА; (б) –DIC; (в) – рНin situ; (г) – pCO2; (д) – степень насыщенности вод по отношению кальциту; (е) – степень насыщенности вод по отношению к арагониту. Штриховые линии соответствуют степени насыщенности поровой воды равной 1 по отношению к кальциту (д) и арагониту (е).
ОБСУЖДЕНИЕ
Гидрологические характеристики основной толщи воды однородны, что является результатом зимней конвекции (рис. 2). Подледный фотосинтез обуславливает перенасыщение подледной воды всех трех бассейнов кислородом (рис. 2г). Особенно высокий уровень перенасыщения характерен для мест, покрытых зарослями зостеры в бухтах Экспедиции и Воевода. Полученные значения гидрохимических параметров придонной воды указывают на интенсивность продукционных процессов подо льдом (табл. 1). Этот вывод следует из сочетания низких концентраций неорганических форм азота и фосфора и высоких концентраций общего азота и общего фосфора. Следует также отметить, что на фоне высоких концентраций РОУ, особенно для придонной воды залива Угловой, вода недонасыщена по отношению к атмосферному углекислому газу (рСО2атм = = 400 мкатм), что также указывает на высокую интенсивность продукционных процессов. Одной из причин высокой продукции в исследуемый период является отсутствие снега на льду, поэтому в мелководных бассейнах фотосинтетически активная радиация достигает дна, обеспечивая фотосинтез не только травы (зостеры) и фитопланктона, но и микроводорослей, прикрепленных к донным осадкам (перифитон). Необычайно высокие концентрации хлорофилла-а и мутности были обнаружены в толще воды в бухте Экспедиции (рис. 2д, 2е). Данный результат мы связываем с эпифитоном (микроводоросли, покрывающие листья зостеры), который стряхивается с листьев травы при их соприкосновении с зондирующим устройством. Подводная видеосъемка зарегистрировала этот процесс. Таким образом, продукция кислорода обеспечивается не только зостерой, но и эпифитоном, находящимся на ее листьях.
В районе зарослей зостеры в бухтах Воевода и Экспедиции концентрации органического углерода в верхнем слое донных отложений (0–10 см) соответственно в пять и два раза выше, чем в заливе Угловой (рис. 3а). Существует три возможных механизма поступления ОВ в верхний слой донных отложений: а) седиментация взвешенной формы ОВ с последующим его захоронением потоком неорганических форм взвешенного вещества; б) седиментация взвешенной формы ОВ с последующим его захоронением посредством биотурбации; в) потребление ОВ на границе раздела вода/осадок инфауной (двустворчатые моллюски, полихеты и т.д.) с последующей экскрецией продуктов метаболизма в более глубокие слои донных отложений. В отсутствии аллохтонных источников, главным источником ОВ донных отложений данных районов является взвешенное вещество, продуцированное зостерой. Таким взвешенным ОВ могут быть зостераты – соли полисахарида зостерина. Общее количество углеводов, продуцируемое зостерой, может достигать более 35% от сухой массы травы, из которых около 20% составляет зостерин (Лоенко и др., 1997). Примерно половина ОВ твердой фазы осадка гумифицируется (рис. 3б). Из вертикальных профилей ОВ и суммы концентраций гуминовых и фульвовых кислот следует, что скорость деградации тем выше, чем выше их концентрация. Для бухт Воевода и Экспедиции максимальные скорости уменьшения ОВ соответствуют верхнему 35-см слою осадка. В отличие от бухт, в верхнем 35-см слое осадка залива Угловой наблюдается небольшое увеличение содержания ОВ.
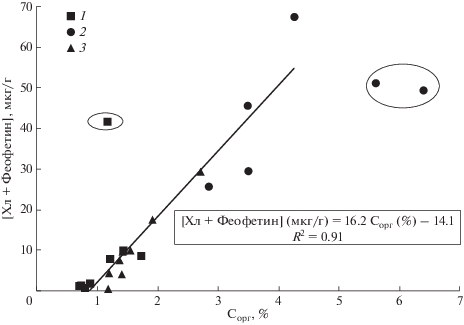
Наличие высокой концентрации хлорофилла-а и феофетина в донных осадках (рис. 3в, 3г) указывает на возможный вклад микроводорослей в общую долю ОВ донных отложений. Из наших результатов следует явная зависимость между суммарной концентрацией хлорофилла-а и феофитина и содержанием органического углерода в твердой фазе (рис. 7). Подобная зависимость также отмечалась ранее (Szymczak-Zyla et al., 2011). Из зависимости, представленной на рис. 7, можно оценить долю углерода в донных отложениях, обусловленную клетками водорослей. Зависимость между содержанием органического углерода и концентрацией хлорофилла в клетках разных типов водорослей и растений широко исследовалась (Behrenfeld et al., 2005). На основе данных, полученных в период с 1947 по 1987 гг., авторы работы (Behrenfeld et al., 2005) установили, что среднемедианное отношение между углеродом и хлорофиллом-а, (С : Хл, г/г) равно 100. Угол наклона для зависимости, представленной на рис. 7, равен 16.2, а не 100. Это означает, что доля углерода, поставляемая клетками водорослей в донные отложения, равна 16%. Очевидно, что в эту долю входит фитопланктон водной толщи, микроводоросли, прикрепленные к листьям зостеры (эпифитон), микроводоросли, прикрепленные к грунту (перифитон), а также часть фрагментов листьев зостеры для станций, расположенных в бухтах Воевода и Экспедиции. Необходимо отметить, что для поверхностного горизонта на станции в заливе Угловой, отмеченного эллипсом над прямой линией на рис. 7, вклад микроводорослей, рассчитанный из соотношения: С : Хл = 100, равен 36%. Более высокая доля органического углерода, обусловленная микроводорослями для залива Угловой, связана с перифитоном (диатомовые маты на поверхности донных отложений залива). Для двух верхних горизонтов бухты Воевода (отмечены эллипсом на рис. 7) такой вклад составляет лишь 7.7 и 9.1%. В этом случае существенно повышается роль других источников ОВ. К таким источникам можно отнести выделяемые листьями травы зостераты, эпифитон и перифитон, содержащие бактериопланктон и микрозоопланктон, а также аллохтонное ОВ.
Рис. 7.
Зависимость суммарной концентрации пигментов (хлорофилл-а + феофитин) в донных осадках от концентрации органического углерода в твердой фазе. Февраль 2018 г. 1 – залив Угловой; 2 – бухта Воевода; 3 – бухта Экспедиции. Прямая линия получена методом наименьших квадратов с привлечением всех данных за исключением трех точек, отмеченных эллипсами.
Хлорофилл в глубинные слои донных осадков может поступать с поверхности осадка под влиянием биотурбации, т.е. в результате вертикального перемешивания частиц осадка под действием живых организмов (двустворчатые моллюски, черви и т.д.). На временной шкале 1–2 мес., без учета сезонной изменчивости потока хлорофилла на поверхность дна бассейна, вертикальный профиль в осадке может описываться уравнением (Sun et al., 1991):
(1)
$С = ({{С}_{o}} - {{С}_{\infty }})\exp \left( { - x\sqrt {{{{{k}_{d}}} \mathord{\left/ {\vphantom {{{{k}_{d}}} {{{D}_{B}}}}} \right. \kern-0em} {{{D}_{B}}}}} } \right) + {{C}_{\infty }}.$Концентрации РОУ в поровой воде (рис. 3д) в несколько раз выше в сравнении с придонной водой (табл. 1), что не является неожиданностью (Burdige, 2002). Чем выше начальное содержание ОВ в твердой фазе (в верхнем слое осадка), тем выше его концентрация в поровой воде (рис. 3д, 3е). Несмотря на то, что содержание ОВ в твердой фазе осадка уменьшается с глубиной осадка, концентрации РОУ и гуминовых веществ (HS) (HS – Humic Substances) в поровой воде имеют тенденцию увеличиваться с глубиной. Такой характер изменения РОУ объясняется увеличением доли устойчивых к диагенезу растворенных органических веществ с глубиной осадка (Burdige, 2002). Действительно, если для верхнего слоя осадка концентрационные отношения HS/РОУ были 0.13, 0.19 и 0.19 для залива Угловой, бухт Воевода и Экспедиции, соответственно, то для нижних горизонтов эти отношения были – 0.19, 0.30 и 0.37, т.е. доля гуминовых веществ в поровой воде возрастает с глубиной. Гуминовые вещества рассматриваются как более устойчивые к микробиологическому разложению в сравнении с углеводами, белками, аминокислотами.
Таблица 1.
Гидрохимические характеристики придонной воды на геохимических станциях: № 1 (зал. Угловой), № 2 (бухта Воевода), № 3 (бухта Экспедиции)
| № | S, ‰ | [O2], % | Pнеорг | Pобщ | NO3 | NH4 | Nобщ | РОУ | рН(10) | TA | рСО2 | DIC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 37.424 | 91 | 0.35 | 1.21 | 0.22 | 1.39 | 14.74 | 3.71 | 8.247 | 2432 | 141 | 2060 |
| 2 | 34.494 | 118 | 0.22 | 0.95 | 0.19 | 0.89 | 8.34 | 1.83 | 7.890 | 2324 | 362 | 2151 |
| 3 | 36.108 | 141 | 0.08 | 0.88 | 0.09 | 1.33 | 10.91 | 2.54 | 8.206 | 2466 | 162 | 2127 |
Примечания. S – соленость, ‰; [O2] – степень насыщенности вод кислородом (%); Рнеорг – неорганический фосфор (мкмоль/л); Робщ – общий фосфор (мкмоль/л); ${\text{NO}}_{{\text{3}}}^{ - }$ – нитраты (мкмоль/л); ${\text{NH}}_{{\text{4}}}^{ + }$ – аммоний (мкмоль/л); Nобщ – общий азот (мкмоль/л); РОУ – растворенный органический углерод (мг/л); pH (10) – измерения рН при 10°С; TA – общая щелочность (мкмоль/кг); pCO2 – парциальное давление углекислого газа (мкатм); DIC – растворенный неорганический углерод (мкмоль/кг).
Диагенез ОВ твердой фазы осадка приводит к уменьшению его процентного содержания (рис. 3а, 3б) и к увеличению концентраций продуктов диагенеза в поровой воде: биогенных веществ (рис. 4), DIC и TA (рис. 5). Следует отметить различие в формах нахождения фосфора и азота в поровой воде: для растворенного фосфора доминирует неорганическая форма (ортофосфаты), для азота – органическая форма (рис. 4). На распределение ортофосфатов в донных отложениях важное влияние оказывают процессы адсорбции-десорбции, которые выполняют роль “буферного механизма” в формировании концентрации ортофосфатов в поровой воде (Sundby et al., 1992). Роль буферного механизма сводится к поддержке почти постоянной концентрации ортофосфатов в водной фазе за счет высокой сорбционной емкости твердой фазы по отношению к ортофосфатам (Froelich, 1988). Именно такое распределение фосфора наблюдается в поровой воде донных осадков залива Угловой, которые содержат небольшое количество ОВ (рис. 4а). Разложение ОВ внутри осадка должно приводить к увеличению концентрации растворенного фосфора в поровой воде, но этого не происходит, т.к. он адсорбируется на твердой фазе осадка. Другая крайняя ситуация относится к б. Воевода. Высокое содержание ОВ в этом случае приводит к тому, что в результате диагенеза все активные сорбционные центры твердой фазы заполнены ортофосфатами, буферный механизм твердой фазы перестает работать. Начиная с верхнего слоя осадка происходит увеличение неорганического фосфора в поровой воде. Бухта Экспедиции занимает в этом отношении промежуточное положение. До глубины 40 см наблюдается почти постоянная концентрация фосфора в поровой воде, ниже которой буферные свойства твердой фазы осадка перестают работать. Эти три ситуации рассмотрены в работе (Sundby et al., 1992). Органический азот является доминирующей формой (рис. 4в, 4г), содержание которой в поровой воде плавно увеличивается с глубиной осадка. Однако, для бухты Воевода и залива Угловой профили концентрации аммония в поровой воде показывают глубокие минимумы на горизонтах 25 и 35 см, соответственно. По-видимому, аммонийный азот на этих горизонтах более интенсивно ассимилируется морскими организмами и корнями зостеры (Rubio et al., 2007). Содержание нитритов в поровой воде было немногим меньше 1 мкмоль/л (за исключением одного горизонта) и имело тенденцию к небольшому уменьшению по глубине осадков.
Вклад микроводорослей в ОВ донных осадков проявляется по увеличению концентрации растворенного кремния в поровой воде (рис. 4д). Увеличение концентрации кремния в поровой воде объясняется растворением кремнистых створок диатомей и/или флагеллят (Lisitzin, 1985; Treppke, et al., 1996). Асимптотический профиль растворенного кремния в поровой воде бухты Воевода является типичным и обусловлен растворением створок диатомей (Aller, 2014). Однако предельные концентрации растворенного кремния для разных бухт различны. Это не удивительно, т.к. скорость растворения и равновесные концентрации растворенного кремния по отношению к твердой фазе в значительной степени зависят от концентраций таких микроэлементов как алюминий и железо (Aller, 2014), которые не изучались в этой работе. Необходимо также отметить, что после резкого увеличения содержания кремния в верхнем слое осадка залива Угловой, происходит его плавное уменьшение в нижележащих горизонтах. Это уменьшение обычно объясняется аутигенным образованием глинистых минералов (März et al., 2015).
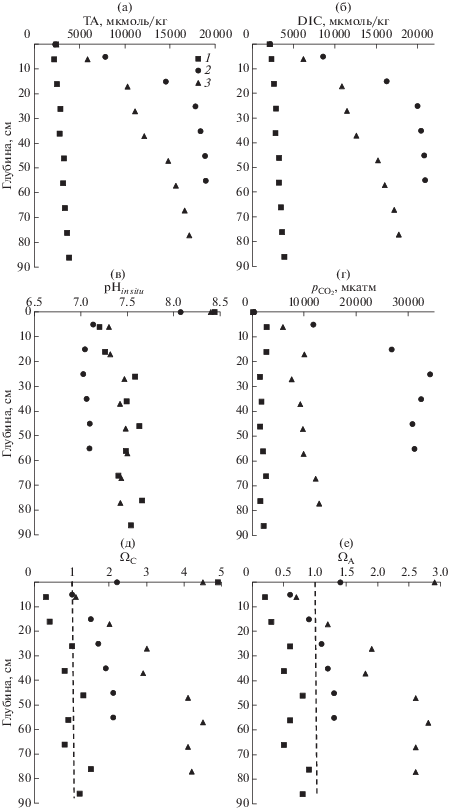
В результате диагенеза ОВ параметры карбонатной системы поровой воды (рис. 5) существенно изменились в сравнении с придонной водой (табл. 1). Увеличение ТА поровой воды (рис. 5а) указывает на анаэробный характер диагенеза ОВ. Увеличение ТА сопровождается увеличением DIC, уменьшением рН и увеличением рСО2 (рис. 5). Очевидно, что главными продуктами минерализации ОВ являются гидрокарбонат ион $\left( {{\text{HCO}}_{{\text{3}}}^{ - }} \right)$ и двуокись углерода. Микробиологическая минерализация ОВ в зависимости от внешних условий среды может осуществляться с использованием разных акцепторов электронов, которые будут приводить к разным соотношениям в приращении DIC и TA. Для акцепторов О2, ${\text{NO}}_{{\text{3}}}^{ - },$ ${\text{Mn}}{{{\text{O}}}_{{\text{2}}}},$ ${\text{FeOOH}}$, ${\text{SO}}_{{\text{2}}}^{{ - 2}}$ отношения ${\Delta DIC}\,\,{\text{:}}\,\,{\Delta TA}$ будут: –106 : 16, 1 : 0.8, 1 : 4, 1 : 8, 1 : 1, соответственно (Berner et al., 1970). Аэробная минерализация ОВ приводит к увеличению DIC и к уменьшению ТА, т.е. угол наклона отрицательный. На рис. 8а зависимость DIC от TA демонстрирует положительный угол наклона, близкий к 1, т.е. диагенез ОВ сопровождается сульфатредукцией. Этот вывод также подтверждается систематическим уменьшением сульфат-хлорных отношений для поровых вод бухт Воевода и Экспедиции (рис. 4е). Используя стехиометрию Редфилда (Redfield et al., 1963) для ОВ, этот процесс формально можно представить следующей схемой:
(2)
$\begin{gathered} {{{\text{(C}}{{{\text{H}}}_{{\text{2}}}}{\text{O)}}}_{{{\text{106}}}}}{{{\text{(N}}{{{\text{H}}}_{{\text{3}}}}{\text{)}}}_{{{\text{16}}}}}{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + {\text{53SO}}_{{\text{4}}}^{{{\text{2}} - }} \to \\ \to {\text{38}}{{{\text{H}}}_{{\text{2}}}}{\text{S}} + {\text{16NH}}_{{\text{4}}}^{ + } + {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - } + {\text{106HCO}}_{{\text{3}}}^{ - } + {\text{15H}}{{{\text{S}}}^{ - }}. \\ \end{gathered} $Рис. 8.
Зависимость DIC от ТА (а) и сульфат-иона от ТА (б) в донных осадках залива Углового – 1, бухт Воевода – 2, и бухта Экспедиции – 3. Для зависимости (а) углы наклона, полученные методом наименьших квадратов, были соответственно равны: 1.01 (r2 = 0.981), 1.11 (r2 = 1.000) и 1.03 (r2 = 0.999); для зависимости (б) осадков бухт Воеводы и Экспедиции угол наклона был: –0.67 (r2 = 0.96).
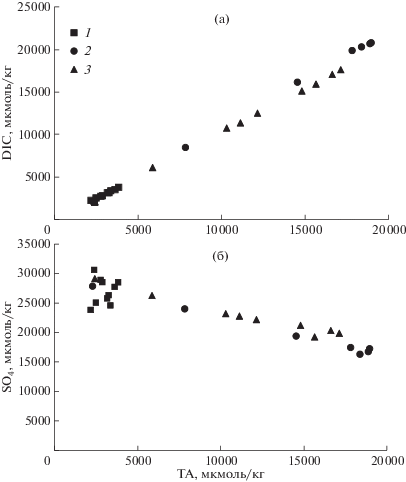
В соответствии с уравнением реакции (2) отношения между ${\Delta DIC}:{\Delta TA}$ и ${\Delta SO}_{{\text{4}}}^{{{\text{2 - }}}}:{\Delta TA,}$ должны быть 106 : 121 = 0.88 и –0.53 : 121 = –0.44, соответственно. Методом наименьших квадратов были получены углы наклона для зависимости DIC от TA: 1.01 (r2 = 0.981), 1.11 (r2 = 1.000) и 1.03 (r2 = 0.999) для осадков залива Угловой, бухт Воевода и Экспедиции, соответственно. Заметим, что во всех случаях угол наклона немного больше, чем это следует из минерализации ОВ по пути сульфатредукции (реакция (2)). Для зависимости концентрации сульфат-ионов от щелочности (рис. 7б) для осадков бухт Воевода и Экспедиции был получен угол наклона –0.67 (r2 = 0.96), который также выше (по абсолютной величине) в сравнении с теоретическим значением (–0.44). Наиболее вероятной причиной отклонения углов наклона для зависимостей, представленных на рис. 8, от теоретических значений в соответствии с реакцией (2), является образование твердой фазы карбоната кальция в донных осадках. Изъятие щелочности из поровой воды в твердую фазу осадка (образование карбоната кальция) будет приводить к повышению угла наклона для обеих зависимостей, представленных на рис. 8. Этот процесс, по-видимому, происходит в донных осадках бухт Воевода и Экспедиции, но не в осадках залива Угловой, где отсутствует корреляционная зависимость между щелочностью и концентрацией сульфат-иона. Поровая вода залива Угловой близка к насыщению по отношению к кальциту, в отличие от бухт, где наблюдается перенасыщенное состояние (рис. 5д). Однако извлечение карбоната кальция из водной среды идет, скорее всего, биологическим путем, т.е. сопровождается ростом живых организмов, имеющих карбонатный скелет, например, створок двустворчатых моллюсков. Уменьшение щелочности поровой воды может также обуславливаться образованием сульфидных минералов, что будет приводить к увеличению углов наклона для зависимостей, представленных на рис. 8. Такая возможность подтверждается уменьшением концентрации подвижных форм сульфидов с глубиной осадка (рис. 6).
Диагенез ОВ является движущей силой преобразования химического состава поровых вод. Мы постулировали, что скорость деградации ОВ формально подчиняется реакции первого порядка. Используя данные по содержанию ОВ в твердой фазе осадка (рис. 3) и коэффициенты биотурбации (3.0, 107.6 и 14.5 см2/сут), полученные из данных по хлорофиллу, по уравнению (1) были оценены константы скорости деградации ОВ: ${{k}_{{\text{C}}}} = 5.0 \times {{10}^{{ - 3}}}\,\,{\text{су}}{{{\text{т}}}^{{ - {\text{1}}}}},$ ${{k}_{{\text{C}}}} = 6.4 \times {{10}^{{ - 3}}}\,\,{\text{су}}{{{\text{т}}}^{{ - {\text{1}}}}}$ и ${{k}_{{\text{C}}}} = 1.2 \times {{10}^{{ - 3}}}\,\,{\text{су}}{{{\text{т}}}^{{ - {\text{1}}}}}$ для залива Угловой, бухт Воевода и Экспедиции, соответственно. В этом расчете было принято, что концентрация не разлагаемого ОВ равна 0.6%, в уравнении (1) этот параметр будет иметь смысл ${{C}_{\infty }}.$ Если распределение ОВ (рис. 3а) существенно не меняется во времени, т.е. имеет стационарный характер, то для поддержания этого состояния необходим постоянный поток взвешенного ОВ через границу раздела вода-осадок. Величину этого потока, J, можно приближенно оценить через балансное соотношение и константу скорости деградации ОВ (Sun et al., 1991):
Здесь, ${{k}_{{\text{C}}}}$ – константа скорости деградации ОВ; Сn – концентрация углерода в единице объема осадка для слоя “n”; Ln – толщина слоя “n”. С помощью соотношения (3) были получены следующие суточные потоки взвешенного органического углерода в донные осадки залива Угловой, бухт Воевода и Экспедиции: 53, 232 и 57 ммоль/(м2 сут), соответственно. Одним из главных продуктов минерализации ОВ является DIC (рис. 6б). Оценка потока растворенного неорганического углерода в осадках, подвергнутых биотурбации, была проведена с помощью соотношения (Berner, 1980):(4)
$J = - {{D}_{B}}\frac{{\partial (\phi C)}}{{\partial x}} - \phi {{D}_{I}}\frac{{\partial C}}{{\partial x}}.$Наиболее важными характеристиками эффективности технологии “голубого углерода” являются скорость захоронения ОВ и общая аккумуляция ОВ в пределах верхнего однометрового слоя донных отложений (Howard et al., 2014). Из полученных нами результатов следует, что использование скорости захоронения ОВ в качестве исходного параметра может привести к завышенной оценке изъятия атмосферного СО2 по двум причинам. Во-первых, большая доля захороненного ОВ по пищевой цепи трансформируется в биомассу инфауны с неизвестным “временем жизни”. Во-вторых, в результате диагенеза ОВ, образовавшийся DIC, частично возвращается в водную среду.
ЗАКЛЮЧЕНИЕ
Исследован диагенез органического вещества донных отложений, отобранных в феврале 2018 г. в заливе Угловой, бухтах Воевода и Экспедиции (залив Петра Великого, Японское море), в местах залежей лечебных грязей. По величине содержания органического углерода в верхнем слое осадков донные отложения этих экосистем располагаются в следующем порядке: 6.4, 2.8 и 1.2% в бухтах Воевода, Экспедиции и заливе Угловой, соответственно. Высокие концентрации ОВ, которые обеспечиваются зарослями зостеры, привели к тому, что основным процессом диагенеза донных отложений является анаэробное окисление ОВ по пути сульфатредукции, протекающей в соответствии с уравнением (2). Об этом свидетельствуют вертикальные профили поровых вод: распределение кислотно-растворимых форм сульфидов, аналогичное распределению ОВ в донных отложениях; увеличение ТА, DIC, рСО2 и снижение рН с глубиной. Зависимость DIC от ТА, близкая к 1 для всех изучаемых районов, также указывает на анаэробный характер разложения ОВ.
Рассчитаны потоки органического углерода, направленные из водной среды в донные отложении, и DIC из донных осадков в водную среду. Их величины отличаются примерно на порядок. Основная причина различия между потоками органического и неорганического углерода обусловлена разной интенсивностью двух важных процессов. Один из них – сульфатредукция, который сопровождается продукцией DIC и обеспечивает поток неорганического углерода. Другой – трансформация ОВ в биомассу инфауны, о чем свидетельствует резкое снижение концентрации в пределах верхних 0–35 см осадка. Второй процесс является доминирующим, его интенсивность на порядок выше микробиологической деструкции ОВ, что ограничивает накопление ОВ в донных отложениях. Оба процесса (поток DIC в придонную воду, трансформация ОВ в биомассу инфауны) будут вносить неопределенность в оценке изъятия атмосферного СО2 морскими травами.
Отмечены пространственные особенности протекания диагенеза изучаемых экосистем, обусловленные условиями формирования ОВ. Донные отложения залива Угловой характеризуются минимальным содержанием ОВ (1.2%), коэффициентом биотурбации (3.0 см2/сут) и меньшими скоростями деградации ОВ (5.0 × 10–3 сут–1) в верхнем 35-см слое. При этом, для бухты Воевода наблюдаются максимальные концентрации ОВ в верхнем слое (0–35 см) донных осадков и, как результат, максимальная скорость деградации ОВ (6.4 × 10–3 сут–1). Величины потоков на границе раздела фаз также проявляют пространственную изменчивость и зависят, в частности, от содержания ОВ и коэффициента биотурбации в донных отложениях. Установлено, что величина коэффициента биотурбации прямопропорциональна содержанию ОВ в донных отложениях. Этот фактор определяет интенсивность жизнедеятельности инфауны.
Установлено, что, в среднем, доля углерода, поставляемая клетками водорослей в донные отложения составляет 16%. Однако, в верхнем слое донных отложениях залива Угловой за счет вклада перифитона эта доля увеличивается до 36%. При этом, в верхнем слое донных осадков бухты Воевода вклад клеток водорослей в ОВ значительно меньше, и составляет 8–9%, что свидетельствует о наличии другого источника органического вещества, например, вклад бактерио- и микрозоопланктон или экскреция полисахаридов листьями зостеры морской.
Необходимо также отметить – в результате диагенеза ОВ продуцируются сероводород, сульфидные минералы, гуминовые и фульвовые кислоты, являющиеся важными и необходимыми компонентами лечебных грязей. По-видимому, ключевым фактором их формирования является именно наличие зарослей зостеры. Если это так, то для практического использования лечебных грязей необходимо сохранять заросли зостеры морской.
Работа выполнена при финансовой поддержке грантов РФФИ, 17-35-50072”мол_нр”, 16-55-50071-а, 20-05-00381-а, программы “Дальний Восток” (гранты № 18-1-007; № 18-1-010) и темы гос. задания ФГБУ-Н МГИ 0827-2018-0004 “Прибрежные исследования”.
Список литературы
Андреева Н.М., Агатова А.И. (1981) Органическое вещество в донных осадках залива Посьета (Японское море). Биология моря 2, 40-49.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю., Михайлик Т.А., Косьяненко А.А. (2018) Условия образования лечебных грязей в бухте Воевода (Амурский залив, Японское море). Известия ТИНРО 192, 167-176.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю., Волкова Т.И., Звалинский В.И., Михайлик Т.А., Сагалаев С.Г., Сергеев А.Ф., Тищенко П.П., Швецова М.Г., Шкирникова Е.М. (2015) Сезонные гидролого-гидрохимические исследования бухты Воевода (Амурский залив, Японское море). Известия ТИНРО 180, 161-178.
Бергер В.Я. (2011) О продукции зестеры Zostera Marina Linnaeu, 1753 в Белом море. Биология моря 37(5), 362-366.
Бычков А.С., Павлова Г.Ю., Кропотов В.А. (1989) Карбонатная система. Химия морской воды и аутигенное минералообразование (Под ред. Ильичева В.И.). М.: Наука, 49-111.
Васильченко В.Ф., Бадалов Н.Г., Деркачева Л.Н. (2014) Природные ресурсы бухты Экспедиции как основа создания курортного центра на побережье залива Петра Великого Японского моря. Вопросы курортологии, физиотерапии и лечебной физической культуры 91(4), 53-60.
Григорьева Н.И. (2012) Залив Посьета: физико-географическая характеристика, климат, гидрологический режим. Современное экологическое состояние залива Петра Великого Японского моря (Под ред. Христофоровой Н.К.). Владивосток: Дальневосточный федеральный университет, 31-61.
Иванова В.Л., Медведева Л.А., Афанасьева Т.Б., Баринов Н.Н., Карабцов А.А. (2009) Результаты геолого-биологических исследований лечебных грязей залива Петра Великого. Успехи наук о жизни 1, 162-170.
Лоция северо-западного берега Японского моря (1996) СПб.: ГУНИО МО, 354 с.
Лысенко В.Н., Матюшин В.М. (1984) Сезонные изменения роста и продукции зостеры в бухте Витязь Японского моря. Биология моря 4, 38-45.
Мурадов С.В., 2014 Экологические и микробиологические особенности формирования и состояния месторождений лечебных грязей. Дис. д. б. н. Петропавловск-Камчатский: ФГБУ Научно-исследовательский геотехнологический центр ДВО РАН, 237 с.
Остроумов Э.А. (1953) Метод определения форм соединений серы в отложениях Черного моря. Труды института океанологии 7, 57-69.
Павлова Г.Ю., Тищенко П.Я., Волкова Т.И., Диксон А., Вальман К. (2008) Интеркалибрация метода Бруевича для определения общей щелочности в морской воде. Океанология 48(3), 477-483.
Тищенко П.П., Тищенко П.Я., Звалинский В.И., Сергеев А.Ф. (2011) Карбонатная система Амурского залива (Японское море) в условиях гипоксии. Океанология 51(2), 246-257.
Тищенко П.Я., Вальманн К., Василевская Н.А., Волкова Т.И., Звалинский В.И., Ходоренко Н.Д., Шкирникова Е.М. (2006) Вклад органического вещества в щелочной резерв природных вод. Океанология 46(2), 211-219.
Ходоренко Н.Д., Волкова Т.И., Звалинский В.И., Тищенко П.Я. (2012) Кинетика извлечения и количественное определение гуминовых веществ в донных отложениях. Геохимия (4), 423-430.
Khodorenko N.D., Volkova T.I., Zvalinskii V.I., Tishchenko P.Ya. (2012) Extraction kinetics and quantitative analysis of bottom sediments for humic substances. Geochem. Int. 50(4), 385–391.
Aller R.C. (2014) Sedimentary diagenesis, depositional environments, and benthic fluxes. In Treatise on Geochemistry, 2nd edition (Eds. Holland, H.D., Turekian, K.K.). Oxford: Elsevier 8, 293-334.
Behrenfeld M.J., Boss E., Siegel D.A., Shea D.M. (2005) Carbon-based ocean productivity and phytoplankton physiology from space. Glob. Biogeochem. Cycles 19, GB1006, https://doi.org/10.1029/2004GB002299
Berner R.A. (1980) Early Diagenesis. A Theoretical Approach. Princeton, N.J.: Princeton University Press., 241 p.
Berner R.A., Scott M.R., Thomlinson C. (1970) Carbonate alkalinity in the pore waters of anoxic marine sediments. Limnol. Oceanogr. 15(4), 544-549.
Breitburg, D., Levin, L.A., Oschlies, A., Gregoire, M., Chavez, F.P., Conley, D.J., Garcon, V., Gilbert, D., Gutierrez, D., Isensee, K., Jacinto, G.S., Limburg, K.E., Montes, I., Naqvi, S.W.A., Pitcher, G.C., Rabalais, N.N., Roman, M.R., Rose, K.A., Seibel, B.A., Telszewski, M., Yasuhara, M., Zhang, J. (2018) Declining oxygen in the global and coastal waters. Science 359, 1-11.
Burdige D.J. (2002) Sediment pore waters. Biogeochemistry of marine dissolved organic matter. USA: Elsevier Science (13), 611-663.
Burdige D.J., Zimmerman R.C., Hu X. (2008) Rates of carbonate dissolution in permeable sediments estimated from pore-water profiles: The role of sea grasses. Limnol. Oceanogr. 53(2), 549-565.
Cai W.-J., Hu X., Huang W.-J., Murrell M.C., Lehrter J.C., Lohrenz S.E., Chou W.-C., Zhai W., Hollibaugh J.T., Wang Y., Zhao P., Guo X., Gundersen K., Dai M., Gong G.-C. (2011) Acidification of subsurface coastal waters enhanced by eutrophication. Nature Geoscience 4, 766–770, https://doi.org/10.1038/NGEO1297
Dahl M., Deyanova D., GuÈtschow S., Asplund M.E., Lyimo L.D., Karamfilov V, Santos R., Bjoerk M., Gullstrom M. (2016) Sediment Properties as Important Predictors of Carbon Storage in Zostera marina Meadows: A Comparison of Four European Areas. PLOS ONE 11(12): e0167493, https://doi.org/10.1371/journal.pone.0167496
Dore J.E., Lukas R., Sadler D.W., Church M.J., Karl D.M. (2009) Physical and biogeochemical modulation of ocean acidification in the central North Pacific. Proceed. Nat. Acad. Sci. 106(30), 12235-12240.
Duarte C.M., Sintes T., Marba N. (2013) Assessing the CO2 capture potential of seagrass restoration projects. J. Appl. Ecol. 50, 1341-1349.
Forster S., Graf G., Kitlar J., Powilleit M. (1995) Effects of bioturbation in anoxic and hypoxic conditions: a microcosm experiment with a North Sea sediment community. Mar. Ecol. Prog. Ser. 116, 153-161.
Froelich P.N. (1988) Kinetic control of dissolved phosphate in natural rivers and estuaries: A primer on the phosphate buffer mechanism. Limnol. Oceanogr. 33(4), 649-668.
Grasshoff K., Ehrhardt M., Kremling K. (1983) Methods of Seawater Analysis. Weinheim/Deerfield Beach, Florida: Verlag Chemie, 419 p.
Green M.A., Aller R.C., Cochran J.K., Lee C., Aller J.Y. (2002) Bioturbation in shelf/slope sediments off Cape Hatteras, North Carolina: the use of 234Th, Chl-a, and Br to evaluate rates of particle and solute transport. Deep-Sea Res. II 49, 4627-4644.
Howard J., Hoyt S., Isensee K., Telszewski M., Pidgeon E. (eds.) (2014) Coastal Blue Carbon: Methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrasses. Arlington, Virginia, USA: Conservation International, Intergovernmental Oceanographic Commission of UNESCO, International Union for Conservation of Nature. 184 p.
Iizumi H., Hattori A., McRoy C.P. (1982) Ammonium regeneration and assimilation in Eelgrass (Zostera marina) Beds. Mar. Biol. 66, 59-65.
Jeffrey S.W., Humphrey G.F. (1975) New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem. Physiol. Pflanz. 167(2), 191-194.
Lisitzin A.P. (1985) The silica cycle during the last ice age. Palaeogeogr., Palaeoclimat., Palaeoecol. 50, 241-270.
März C., Meinhardt A.-K., Schnetger B., Brumsack H.-J. (2015) Silica diagenesis and benthic fluxes in the Arctic Ocean. Marine Chem. 171, 1-9.
McRoy C.P. (1974) Seagrass productivity: carbon uptake experiments in eelgrass, Zoster Marina. Aquaculture 4, 131-137.
Redfield A.C., Ketchum B.H., Richards F.A. (1963) The influence of organisms on the composition of seawater. The Sea (Ed. Hill. M.N.) N.Y.: Interscience, 2, 26-77.
Röhr M.E., Boström C., Canal-Vergés P., Holmer M. (2016) Blue carbon stocks in Baltic Sea eelgrass (Zostera marina) meadows. Biogeosciences 13, 6139-6153.
Rubio L., Linares-Rueda A., García-Sánchez M.J., Fernández J.A. (2007) Ammonium uptake kinetics in root and leaf cells of Zostera marina L. J. Exper. Mar. Ecol. Prog. Ser. 352, 271-279.
Schmodtko S., Stramma L., Visbeck M. (2017) Decline in global oceanic oxygen content during the past five decades. Nature 542(7641), 335-339, doi.1038/nature21399
Sun M., Aller R.C., Lee C. (1991) Early diagenesis of chlorophyll-a in Long Island Sound sediments: A measure of carbon flux and particle reworking. J. Mar. Res. 49, 379-401.
Szymczak-Zyla M., Kowalewska G., Louda J.W. (2011) Chlorophyll-a and derivatives in recent sediments as indicator productivity and depositional conditions. Marine Chem. 125, 39-48.
Tishchenko P., Pavlova G., Sagalaev S., Shvetsova M., Tishchenko P. (2010) Observations of carbonate system parameters in seawater using discrete samples, in surface waters by underway system and in sediments on a board of R/V Hakuho Maru at June–July 2010. Preliminary Report of the R/V Hakuho Maru KH-10-2 Cruise CARINA Expedition – ASIAN GEOTRACES June 11, 2010–July 23, 98-120.
Treppke U.F., Lange C.B., Wefer G. (1996) Vertical fluxes of diatomes and silicaflagellates in the eastern eaquatarial Atlantic, and their contribution to the sedimentary record. Mar. Micropaleont. 28, 73-96.
Дополнительные материалы отсутствуют.