Геохимия, 2020, T. 65, № 6, стр. 548-565
Влияние С–О–Н летучих компонентов на распределение Ni, Co и P между силикатным расплавом и жидким металлическим сплавом железа при 4 ГПа, 1550°С
О. А. Луканин a, *, Т. И. Цехоня a, **, В. В. Колташев a, b, ***, Н. Н. Кононкова a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b Научный центр волоконной оптики РАН
119333 Москва, ул. Вавилова, 38, Россия
* E-mail: lukanin@geokhi.ru
** E-mail: tsekhonya@geokhi.ru
*** E-mail: kvv@fo.gpi.ru
Поступила в редакцию 24.10.2019
После доработки 12.12.2019
Принята к публикации 30.12.2019
Аннотация
Проведена серия экспериментов в модельной системе NaAlSi3O8–FeO–NiO–CoO–SiC– NaH2PO4 при 1550°С, 4 ГПа и летучестях кислорода (fO2) на 0.5–2.9 лог. ед. ниже буфера железо-вюстит (IW), чтобы оценить влияние присутствия С–О–Н летучих компонентов на фракционирование Ni, Co и Р между силикатным расплавом и жидкой металлической фазой при редокс условиях, соответствующих сегрегации металлической фазы в продуктах плавления ранней восстановленной мантии Земли и других планетных тел. Установлено, что коэффициенты распределения Ni, Co, P между силикатными расплавами, насыщенными углеродом и содержащими в растворенном виде С–О–Н летучие компоненты (главным образом, в виде ОН групп, Н2 и СН4), и жидкими сплавами Fe–Ni–Co–P–C (D(М)met/sil), при относительно окислительных условиях (fO2 > IW–1.5) соответствуют ожидаемым значениям D(М)met/sil для равновесий металл–силикатный расплав в системе без летучих при аналогичных P, T, fO2 и nbo/t параметрах. При более восстановительных условиях (fO2 ≤ IW–2) присутствие С–О–Н летучих вызывает снижение D(М)met/sil для Ni и Р по сравнению с D(М)met/sil в “сухих” системах. С уменьшением fO2 эти различия возрастают, при fO2 = IW–2.9 они составляют ~0.5 и более 1 порядка для Ni и Р, соответственно. Влияние летучих на D(Co)met/sil значительно менее выражено, вследствие этого при уменьшении fO2 происходит сближение значений D(Ni)met/sil и D(Co)met/sil. КР спектроскопия экспериментальных стекол и определение в них концентрации водорода методом SIMS показывают, что с уменьшением fO2 содержание воды (ОН + Н2О) в расплавах уменьшается, при этом существенно возрастает содержание СН4 и комплексов с С–Н связью. Предполагается, что причинами уменьшения D(M)met/sil в сильно восстановительных условиях могут быть изменения в структуре силикатных расплавов и формирование в них комплексных соединений сидерофильных элементов с летучими компонентами.
ВВЕДЕНИЕ
Знание распределения сидерофильных и других элементов между силикатной и обогащенной железом металлической фазами имеет ключевое значение для понимания глобальных процессов химической дифференциации ранней Земли, с которыми связано образование обогащенного железом ядра и силикатной мантийной оболочки – двух основных геохимических резервуаров планетных тел. Экспериментальному определению коэффициентов распределения металл/силикат сидерофильных элементов (D(М)met/sil) посвящено множество работ. Обобщение полученных данных методом регрессионного анализа дало возможность предложить уравнения зависимости D(М)met/sil от Т, Р, летучести кислорода (fO2) и состава фаз для большого числа элементов разной степени сидерофильности (в том числе для Ni, Co и P), что позволяет рассчитывать D(М)met/sil в широком диапазоне параметров, охватывающим почти полностью физико-химические условия, которые предполагаются в мантии “современной” Земли, а также которые могли быть на ранних этапах ее формирования (Righter et al., 1997; Righter, Drake, 1999; Righter, 2011; Siebert et al., 2011, 2012; Fischer et al., 2015; Clesi et al., 2016; см. также ссылки в этих работах на другие первоисточники экспериментальных данных по определению D(М)met/sil).
Эмпирические данные для D(М)met/sil при высоких температурах и давлениях стали основой для развития и проверки геохимических моделей формирования состава мантии Земли и, в частности, объяснения парадокса с “избытком” в ней сидерофильных элементов, который возникает в рамках гипотезы формирования ядра путем сегрегации обогащенной железом металлической фазы на заключительных стадиях гомогенной аккреции планеты. Наблюдаемые содержания Ni, Co и других сидерофильных элементов в мантии должны быть значительно более низкими из-за их преимущественного фракционирования в металлическую фазу, если исходить из экспериментальных значений D(М)met/sil, полученных при относительно низких Р–Т параметрах.
Большинство экспериментов по определению D(М)met/sil проводилось в модельных системах, в которых силикатное вещество имело базит-ультрабазитовый или хондритовый состав, а металлическая фаза была представлена сплавом железа с добавками никеля и некоторых “легких” в том числе и летучих элементов (S, C, O), которые в небольших количествах могут находиться в составе земного ядра. Было показано, что присутствие в металлической фазе серы и углерода оказывает заметное влияние на распределение сидерофильных элементов и его необходимо учитывать при оценках D(M)met/sil (Jones, Drake, 1983; Jana, Walker, 1997a; b; Fischer et al., 2015). Вместе с тем влияние других летучих компонентов в силикатных расплавах, включая С, О, Н, N и их соединений, на распределение сидерофильных элементов металл-силикат пока остается мало изученным (Righter, 2015; Clesi et al., 2016). Актуальность такого изучения связана с тем, что современные модели формирования ядра путем сегрегации железной металлической фазы в условиях существования магматического океана предполагают присутствие в силикатных расплавах воды, водорода, С–О, С–Н и других летучих соединений, которые могли различными путями входить в состав планетного вещества: в составе аккрецирующего материала (Wänke, Dreibus, 1988; Jarosewich, 1990; Marty, 2012; O’Brien et al., 2014; Sarafian et al., 2014; Hallis et al., 2015) и, в частности, благодаря участию в аккреции вещества комет (Morbidelli et al., 2000; Marty et al., 2016; Маров, Ипатов, 2018), а также в результате взаимодействия образующегося магматического океана с первичной плотной газовой оболочкой планеты (Abe, Matsui, 1985).
Jana и Walker (1999) в экспериментах, проведенных в графитовых капсулах при 1 ГПа и 1400°С, оценили влияние летучих компонентов и их смесей (СО2, Н2О, СО2 + Н2О, СН4 + Н2) на фракционирование Fe, Ni, Co, W, Ge, P между силикатным расплавом основного состава и жидкой металлической фазой и установили понижение D(М)met/sil для всех элементов при добавлении в систему СО2 и Н2О, причем в первом случае эффект был более значительным, чем во втором. Эксперименты с восстановленными летучими компонентами (СН4 + Н2) не обнаружили их заметного влияния на D(М)met/sil. Авторы пришли к выводу, что влияние С–О–Н летучих компонентов на Dmet/sil обусловлено, главным образом, изменением редокс состояния (fO2) системы, а не индивидуальными особенностями состава самих летучих соединений.
Righter и Drake (1999) выполнили эксперименты при 1 ГПа и 1300°С для определения влияния H2O на фракционирование Ni, Co, Mo, W, и P между металлом и водосодержащим силикатным расплавом. Они показали, что независимо от fO2 в системе коэффициенты распределения для Ni, Co, Mo, W остаются без существенных изменений в водных условиях вплоть до 4 мас. % H2O, растворенной в силикатном расплаве. Однако для фосфора постоянство D(Р)met/sil сохраняется только до ~1.5 мас. % H2O. При более высоких содержаниях воды в расплаве наблюдается увеличение D(Р)met/sil и, соответственно, степень сидерофильности фосфора несколько возрастает. Следует отметить, что в данной работе опыты проводились при относительно окислительных условиях в сравнительно узком интервале fO2 близких к буферу железо–вюстит (IW): от 1.1 лог. ед. ниже до 0.4 лог. ед. выше относительно fO2 буфера IW (от IW – 1.1 до IW + 0.4).
Исследование влияния воды на распределение металл/силикат Ni, Co, V, Cr и Fe в более широком диапазоне T–P–fO2 условий (1800–2227°C, 5–20 ГПа, fO2 от IW-1 до IW-5) провели Clesi с соавторами (2016). При этом содержание воды в хондритовом расплаве варьировало от 0.03 до 1.44 мас. %. Опыты проводились в графитовых капсулах, таким образом, в расплаве помимо воды (в виде ОН групп) и Н2 могли присутствовать углеродсодержащие летучие соединения и комплексы, хотя методами FTIR спектроскопии в закалочных стеклах после опытов в явном виде они не были обнаружены. При сравнении с данными для “сухих” систем при аналогичных T–P–fO2 параметрах заметного влияния воды на D(М)met/sil для Ni, Co, V, Cr не было выявлено. Однако для Fe оно оказалось более существенным – повышение концентрации воды в расплаве до 1.44 мас. % вызывало примерно двукратное снижение D(Fе)met/sil. На основании обобщения полученных и имеющихся данных авторами были рассмотрены особенности формирования ядра и мантии в процессе аккреции Земли и Марса – планет, исходный строительный материал которых, по мнению авторов, мог иметь различные содержания воды (1.2–1.8 и 2.5–3.5 мас. %, соответственно).
Цель данной работы – оценка возможного влияния С–О–Н летучих компонентов на распределение Ni, Co, Р между силикатным расплавом и жидким обогащенным железом металлическим сплавом в интервале низких значений fO2, характерных для процессов глобального плавления ранней мантии Земли (Wood et al., 2006; Frost et al., 2008; Rubie et al., 2011). Для этого нами проведена серия экспериментов в модельной системе NaAlSi3O8–FeO–NiO–CoO–SiC–Na2HPO4 при 4 ГПа, 1550°С и fO2 на 0.5–3 лог.ед. ниже буфера IW (IW–0.5…–2.9). Опыты проводились в условиях повышенной летучести водорода (fН2), что оказывало влияние на количество и состав летучих в системе. По давлению эксперименты соответствуют приповерхностным частям гипотетического магматического океана (на глубине ~150 км), образование которого связывают с формированием ядра планеты на ранних стадиях эволюции Земли.
МЕТОДИКА
Исходные смеси и условия проведения опытов. В качестве исходного материала в экспериментах была использована тонкодисперсная смесь синтезированного альбитового стекла NaAlSi3O8, оксидов FeO, NiO, CoO с добавками фосфора в виде гидрофосфата натрия Na2HPO4 и карбида кремния SiC (табл. 1). Исследуемая смесь массой 200–300 мг помещалась в Pt капсулу, которая герметизировалась сваркой. Внутри капсулы образец изолировался от Pt стенок вольфрамовой фольгой толщиной в 0.05 мм, которая ограничивала взаимодействие между Pt и железосодержащим расплавом. Na2HPO4 был не только источником фосфора, но и воды, исходное содержание которой во всех смесях составляло 0.28 мас. %. SiC служил источником углерода и восстановителем для Fe2+, а также Ni2+, Co2+ и Р5+ в исходной смеси. В условиях экспериментов SiC, реагируя с оксидами FeO, NiO, CoO и Р2О5, полностью разлагается c образованием дополнительных количеств SiO2 в силикатном расплаве, металлического сплава (Fe–Ni–Co–P), а также углерода в виде графита и его соединений, растворенных в расплаве, по следующей схеме:
(1a)
$\begin{gathered} {\text{SiC}}\, + \,2{\text{Fe}}\left( {{\text{Ni,Co}}} \right){\kern 1pt} {\text{O}}\left( {{\text{распл}}{\text{.}}} \right) \to {\text{Si}}{{{\text{O}}}_{2}}\left( {{\text{распл}}{\text{.}}} \right)\, + \\ + \,\,2{\text{Fe}}\left( {{\text{Ni,Co}}} \right)\left( {{\text{металл}}} \right) + {\text{С}}\left( {{\text{графит, распл}}{\text{.}}} \right), \\ \end{gathered} $(1б)
$\begin{gathered} {\text{5SiC}} + 2{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}\left( {{\text{распл}}{\text{.}}} \right) \to 5{\text{Si}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{распл}}{\text{.}}} \right) + \\ + \,\,4{\text{Р}}\left( {{\text{металл}}} \right) + 5{\text{С}}\left( {{\text{графит, распл}}{\text{.}}} \right). \\ \end{gathered} $Таблица 1.
Исходный состав смесей, используемых в экспериментах (мас. %)
| Опыты | SiO2 | Al2O3 | FeO | Na2O | P2O5 | NiO | CoO | SiC | H2O | Сумма |
|---|---|---|---|---|---|---|---|---|---|---|
| L1 | 49.90 | 14.12 | 18.15 | 10.51 | 2.21 | 1.93 | 1.93 | 0.97 | 0.28 | 100.00 |
| L2 | 49.37 | 13.97 | 17.96 | 10.42 | 2.21 | 1.93 | 1.93 | 1.93 | 0.28 | 100.00 |
| L3 | 47.78 | 13.52 | 17.38 | 10.15 | 2.21 | 1.93 | 1.93 | 4.82 | 0.28 | 100.00 |
| L4 | 46.71 | 13.22 | 16.99 | 9.97 | 2.21 | 1.93 | 1.93 | 6.76 | 0.28 | 100.00 |
Опыты проводились на установке высокого давления анвильного типа при 4 ± 0.02 ГПа и 1550 ± 25°С в условиях контролируемой летучести водорода, используя метод, описанный более детально в (Кадик и др., 2014). Он основан на способности водорода диффундировать через стенки Pt капсулы в результате чего достигается равенство химического потенциала Н2 в самой капсуле и в окружающем ее твердом ансамбле рабочей камеры установки с графитовым нагревателем, содержащим следы Н2О. Оценка летучести водорода (fH2), выполненная на основании расчета мольной доли водорода в С–О–Н флюиде, находящимся в равновесии с графитом при Р–Т параметрах опытов и fO2, буферируемой наковальнями установки из карбида вольфрама согласно реакции WC + O2 = WO2 + C, соответствует значению lg fH2(бар) = 2.78 (Кадик и др., 2014).
В результате протекания реакций в системе с участием летучих компонентов внутри платиновой капсулы создаются fO2 ниже буфера IW. Степень уменьшения fO2 пропорциональна количеству SiC в исходной смеси. При добавлении от 1 до 6.8 мас. % SiC к исходной смеси значения fO2 в опытах варьировали от IW–0.5 до IW–2.9. Продолжительность опытов составляла 30–60 минут.
Методы анализа. Химический состав продуктов экспериментов – стекол и металлической фазы определялся с помощью электронного микрозонда CAMEBAX SX-100 фирмы Cameca с 4-мя вертикальными спектрометрами в Институте геохимии и аналитической химии им. В.И. Вернадского РАН. Ток зонда при анализе стекол составлял 20 нA, при анализе металлических глобул – 30 нA, ускоряющее напряжение 15 кВ. Расфокусировка электронного пучка при определении химического состава силикатной части образцов составляла 10 мкм, локальность электронного пучка при определении состава металлической фазы была около 2 мкм. Концентрации Ni, Co, P в стеклах определялись по специально разработанной методике. Для уменьшения предела обнаружения элементов ток зонда повышался до 50–60 нА и увеличивалось время набора информационного сигнала до 40 с. Тем самым нижняя граница определения концентраций снижалась почти на порядок и составляла для Ni и Co 0.007 мас. %, а для фосфора 0.008 мас. %.
Для определения концентраций Ni, Co, P а также водорода в стеклах применялся метод вторичной ионной масс-спектрометрии (SIMS) с использованием ионного микрозонда Cameca IMS-4F в Институте микроэлектроники и информатики РАН, г. Ярославль. Первичный пучок ионов О2– разгонялся посредством номинального потенциала ~10 кВ и фокусировался в пятно диаметром 20 мкм. Интенсивность тока бомбардирующих ионов составляла 5 нА. Концентрации каждого элемента определялась из отношений интенсивностей ионных потоков изотопов элементов к 30Si+ с использованием калибровочных кривых, построенных для стандартных образцов стекол и минералов. Относительная погрешность в определении элементов не превышала 10 отн. % (подробнее Sobolev, Chaussidon, 1996; Кадик и др., 2014).
Определение вида комплексов С и Н в закалочных стеклах (расплавах) проводилось методом спектроскопии комбинационного рассеяния (КР) в Научном центре волоконной оптики РАН с использованием тройного спектрографа T-64 000 (Jobin Yvon), в котором возбуждающее излучение от Ar+-лазера (SpectraPhysics) фокусировалось на поверхности образца через микроскоп Olympus HB2-UMA с 50-кратным объективом в пятно диаметром 2 мкм. Регистрация стоксовых спектров КР производилась охлаждаемой жидким азотом CCD матрицей в геометрии обратного рассеяния. Все измеренные спектры нормировались на интенсивность фундаментальной полосы КР в силикатных стеклах.
Расчет fO2. Значения fO2 в опытах рассчитывались относительно буфера IW на основании распределения Fe между силикатным расплавом и равновесным жидким сплавом железа по уравнению (Drake et al., 1989; Кадик и др., 2014):
(2)
$\begin{gathered} \Delta {\text{IW}} = \lg f{\text{O}}_{2}^{{\exp }}--\lg f{\text{O}}_{2}^{{{\text{IW}}}} = 2\lg ({\text{X}}_{{{\text{FeO}}}}^{{{\text{sil}}}}/{\text{X}}_{{{\text{Fe}}}}^{{{\text{met}}}}) + \\ + \,\,{\text{ }}2\lg (\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}/\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}), \\ \end{gathered} $Согласно уравнению (2) для расчета ΔIW необходимо знать значения $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ и $\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}$. Имеющиеся многочисленные экспериментальные определения $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ в силикатных природных и синтетических расплавах различного состава, выполненные при 1 атм в широком диапазоне Т и fО2, соответствующих равновесию расплав–сплав железа, в целом относительно хорошо согласуются между собой. Однако они не позволяют рассчитать с большой точностью $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ для конкретного состава расплава при заданных Т–fО2 параметрах. По данным (Holzheid et al., 1997) величина $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ в расплавах системы анортит-диопсид – Fe(Ni,Co)O и природных коматиитах практически не зависит от fО2 (ΔIW = 1.5…–2.3 ), температуры (1300–1600°C) и содержаний FeO и МgО, варьируя от 1.12 до 2.47 (среднее 1.70 ± 0.22). Эти значения были получены путем пересчета результатов опытов в системах силикатный расплав–сплав Fe(Ni,Co) к равновесиям с чистым железом. Поэтому помимо экспериментальных погрешностей, связанных с определением концентрации Fe в силикатных стеклах и сплавах, они имеют некоторую дополнительную неопределенность, возникающую при расчете $\gamma _{{{\text{FeO}}}}^{{{\text{met}}}}$ в FeNiCo сплавах. В работе (O’Neill, Eggins, 2002) для расплавов системы CaO–MgO–Al2O3–SiO2–FeO при 1400оС и fО2 = IW–2.9 был определен более чем двукратный разброс $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ – от 0.88 до 2.26, однако для большинства изученных составов величина $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ составляла 1.27 ± 0.28. Для составов, обогащенных SiO2 (53.8–66.8 мас. %), $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ был близок к 1.11(±0.16), хотя четкой зависимости $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ от SiO2 и величины структурного параметра nbo/t (отношения немостиковых атомов кислорода к катионам в тетраэдрической координации) авторы не обнаружили. Эти значения $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ хорошо согласуются с данными, полученными для модельных составов MORB (1.24 ± 0.09) и “диабаза” (1.16 ± 0.10) (Doyle, Naldrett, 1986). Последний состав отличался от MORB повышенным содержанием SiO2. Специально проведенное исследование влияния SiO2 на $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ в расплавах системы анортит–диопсид–FeO–SiО2 при 1350–1500°С (1 атм) и fO2 = IW–2.6…–1.5 (Борисов, 2007) выявило сложную зависимость $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ от содержания SiО2 при постоянных Т и fO2: с увеличением ${{{\text{X}}}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ в исходном расплаве основного состава $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ (1.3–1.1) сначала уменьшается на ~10–15%, достигая минимальных значений 1–0.85 при ${{{\text{X}}}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 0.57 ± 0.02 (SiO2 ~ 56–63 мас. %), а затем снова возрастает. В кислых расплавах (SiO2 > 70–75 мас. %) величина $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ приближается к исходным значениям. Из данных, представленных в этой работе, также следует, что увеличение температуры на 100°С при fO2 = const вызывает уменьшение $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ примерно на 0.1. Предложенные к настоящему времени эмпирические уравнения зависимости $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ от температуры и состава силикатного расплава, обобщающие экспериментальные данные в рамках модели регулярных растворов (Рябчиков, Когарко, 2013), ограничены составами основного и ультраосновного состава. Таким образом, суммируя результаты экспериментальных определений, в качестве наиболее оптимальной величины $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ в относительно высококремниземистых расплавах, характерных для настоящего исследования, принято значение 1.15 ± 0.15, влияние давления не учитывалось, предполагая, что оно незначительно (Toplis, 2005).
Сплавы, образующиеся в наших опытах, помимо железа содержат в значительных количествах Ni, Co и P, при этом ${\text{X}}_{{{\text{Fe}}}}^{{{\text{met}}}}$ варьирует от 0.31 до 0.71. Поэтому для железа можно ожидать заметные отклонения от идеального поведения. В данной работе $\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}$ рассчитывался, используя параметры взаимодействия компонентов – подход, разработанный для термодинамического описания многокомпонентных металлических растворов (Ma, 2001), который применялся в ряде работ при изучении равновесий металл-силикат в условиях высоких температур и давлений (Siebert et al., 2011, Chi et al., 2014; Li et al., 2015; Clesi et al., 2016). Расчеты проводились по программе http:// norris.org.au/expet/metalact/. Такой подход учитывает влияние температуры, но не учитывает влияние давления, а также присутствия некоторых компонентов в сплавах, для которых данные о величинах параметров взаимодействия отсутствуют. Неопределенность в оценке ΔIW, обусловленная точностью принятых значений $\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}$ и $\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}$ и аналитических определений составов стекол и металлических сплавов, составляет ±0.15 лог. ед. Значения ΔIW, рассчитанные с учетом отклонения от идеальности, оказались на 0.3–0.5 лог. ед. выше по сравнению с идеальным случаем.
РЕЗУЛЬТАТЫ
Продукты экспериментов представляли собой прозрачные стекла с включениями глобулей (капель) металлической фазы размером <60 мкм и кристалликов графита размером 2–10 мкм, которые в основном концентрировались у поверхности глобулей (рис. 1). Цвет стекла зависел от fO2 в опытах и менялся от золотисто-желтого до зеленоватого при наиболее восстановительных условиях. Сферическая форма металлической фазы позволяет заключить, что она была жидкой во время экспериментов. Рис. 1 наглядно демонстрирует формы выделения металлического сплава и его количественные соотношения с силикатным стеклом в продуктах закалочных опытов, полученных в опытах при относительно окислительных (обр. L1, IW–0.5) и наиболее восстановительных условиях (обр. L4, IW–2.9). Хорошо видно, что при более низких значениях fO2 количество металлических глобулей (светлые шарики) заметно возрастает. Более темные участки на фото – выделения графита, которые в основном концентрируются вокруг металлических глобулей. Составы стекол и металлической фазы представлены, соответственно, в табл. 2 и 3, расчетные значения fO2 в табл. 4.
Рис. 1.
Продукты экспериментов при 4 ГПа 1550°С и различных fO2: а – IW-0.5, б – IW-2.9. На фото показаны включения в закалочном стекле металлических глобулей (светлые кружки) и микрокристаллического графита (более темные участки, главным образом, вокруг металлических глобулей).

Таблица 2.
Состав закалочных стекол (мас. %) А) По данным электронного микрозондного анализа (EMA)
| Образец | SiO2 | Al2O3 | FeO | Na2O | P2O5 | CoO | NiO | W | Pt | С | Сумма |
|---|---|---|---|---|---|---|---|---|---|---|---|
| L1 | 60.20 | 13.70 | 14.03 | 9.10 | 2.223 | 0.680 | 0.045 | 0.03 | 0.02 | 0.10 | 100.13 |
| (0.37) | (0.26) | (0.20) | (0.52) | (0.056) | (0.018) | (0.020) | (0.02) | (0.02) | (0.06) | ||
| L2 | 66.67 | 14.83 | 7.18 | 9.32 | 1.540 | 0.226 | 0.017 | 0.02 | 0.01 | 0.20 | 100.02 |
| (0.19) | (0.36) | (0.61) | (0.26) | (0.239) | (0.017) | (0.009) | (0.02) | (0.01) | (0.12) | ||
| L3 | 71.07 | 14.05 | 4.84 | 9.45 | 0.422 | 0.081 | 0.038 | 0.03 | 0.02 | 1.53 | 101.51 |
| (0.99) | (0.17) | (0.73) | (0.34) | (0.036) | (0.018) | (0.014) | (0.02) | (0.02) | (0.22) | ||
| L4 | 73.48 | 13.69 | 2.14 | 9.70 | 0.252 | 0.027 | 0.021 | нпо | 0.03 | 1.51 | 100.85 |
| (1.07) | (0.19) | (0.37) | (0.44) | (0.027) | (0.013) | (0.009) | (0.02) | (0.37) |
| Б) Содержания Ni, Co, P и Н по данным SIMS и ЕМА | ||||||||
|---|---|---|---|---|---|---|---|---|
| Образец | Ni | Co | P | Н | ||||
| (SIMS) (ЕМА) | (SIMS) (ЕМА) | (SIMS) (ЕМА) | (SIMS) [H2O] | |||||
| L1 | 0.079 | 0.035 | 0.488 | 0.535 | 1.026 | 0.970 | 0.707* | 6.37 |
| (0.029) | (0.016) | (0.060) | (0.014) | (0.037) | (0.024) | (0.042) | (0.37) | |
| L2 | 0.011* | 0.014 | 0.108* | 0.178 | 0.858* | 0.672 | 0.542* | 4.88 |
| (0.003) | (0.007) | (0.010) | (0.013) | (0.041) | (0.104) | (0.039) | (0.35) | |
| L3 | 0.020 | 0.030 | 0.026 | 0.064 | 0.197 | 0.184 | 0.393* | 3.54 |
| (0.014) | (0.011) | (0.009) | (0.014) | (0.045) | (0.016) | (0.091) | (0.82) | |
| L4 | 0.011 | 0.016 | 0.013 | 0.021 | но | 0.110 | 0.382* | 3.44 |
| (0.005) | (0.007) | (0.007) | (0.009) | (0.012) | (0.029) | (0.27) | ||
Примечания. В скобках указаны стандартные отклонения. Количество определений (n) методом EMA в каждом образце для Ni, Co и P составляло – 10, для остальных элементов 6–7, n методом SIMS для Ni, Co, P – 10 (концентрации, полученные для H и Ni, Co, P при n = 5, отмечены *). нпо – ниже предела определения, но – не определялось. В табл. 2Б для сравнения приведены также результаты определений Ni, Co и P методом ЕМА. [H2O] – концентрация водорода в виде H2O.
Таблица 3.
Состав металлического сплава (мас. %), определения методом ЕМА
| Образец | n | Fe | Ni | Co | P | C | Si | Al | W | Pt | Сумма |
|---|---|---|---|---|---|---|---|---|---|---|---|
| L1 | 6 | 29.40 | 41.33 | 23.21 | 2.55 | но | 0.06 | 0.02 | 0.03 | 0.01 | 96.62 |
| (0.16) | (1.40) | (0.40) | (0.49) | (0.01) | (0.01) | (0.02) | (0.01 | ||||
| L2 | 6 | 32.72 | 33.55 | 24.20 | 7.93 | 0.13 | 0.05 | 0.01 | 0.02 | 0.10 | 98.70 |
| (1.66) | (1.64) | (0.31) | (0.40) | (0.05) | (0.01) | (0.01) | (0.02) | (0.07 | |||
| L3 | 8 | 66.79 | 12.89 | 11.79 | 6.16 | 1.42 | 0.04 | 0.01 | 0.03 | 0.08 | 99.20 |
| (0.83) | (0.73) | (0.26) | (0.90) | (0.10) | (0.01) | (0.01) | (0.03) | (0.05 | |||
| L4 | 12 | 73.12 | 9.75 | 9.67 | 5.27 | 0.71 | 0.03 | 0.01 | 0.08 | 0.03 | 98.68 |
| (1.25) | (0.44) | (0.58) | (0.18) | (0.08) | (0.03) | (0.01) | (0.07) | (0.03 |
Таблица 4.
Расчетные значения fO2 в опытах (ΔIW = lg fO2(exp) – lg fO2(IW))
| Опыт (образец) | ΔIWсред. | ΔIWмакс. | ΔIWмин. | ΔIWидеал. |
|---|---|---|---|---|
| L1 | –0.51 | –0.33 | –0.64 | –0.75 |
| L2 | –1.03 | –0.83 | –1.17 | –1.37 |
| L3 | –2.01 | –1.88 | –2.16 | –2.30 |
| L4 | –2.91 | –2.75 | –3.04 | –3.12 |
Состав стекол. Характерной особенностью состава стекол (расплавов) является уменьшение концентрации FeO по мере понижения fO2 в результате восстановлении FeO в расплаве с образованием железосодержащей металлической фазы (табл. 2). При IW–0.5 содержание FeO составляет 14.03 мас. %, а при IW–2.9 оно снижается до 2.14 мас. %. Понижение fO2 сопровождается также уменьшением в расплаве концентраций Ni, Co и Р, которые переходят в металлическую фазу (рис. 2а). Несмотря на то, что в некоторых случаях погрешности в анализах относительно велики, результаты ЕМА и SIMS достаточно хорошо согласуются между собой. Измерения концентраций Ni, Co и Р в стекле по профилю через каждые 20 мкм по мере удаления от границы с каплей металла демонстрирует относительное равномерное распределение этих элементов в стеклах (рис. 3а). По данным микрозондного анализа наблюдается существенное увеличение содержания углерода в расплаве при уменьшении fO2 в интервале от IW–0.5 до IW–2.9 с 0.10 ± 0.6 до 1.5 ± 0.4 мас. %. Значительный разброс в значениях, по-видимому, свидетельствует о возможности загрязнения участков анализируемого стекла микрочастицами графита, образующегося во время опыта в результате реакций (1а, б). Измерения методом SIMS показывают существенное почти двукратное понижение концентрации водорода в стеклах с увеличением степени восстановленности стекол от 0.71 (IW–0.5) до 0.38 (IW–2.9) мас. %. В пересчете на воду это соответствует 6.37 и 3.44 мас. %. Эти значения весьма условны, так как водород, по данным КР спектроскопии стекол, кроме Н2О и ОН-групп присутствует в стекле в виде молекул Н2, СН4 и других соединений и комплексов. Концентрации W и Pt в стеклах близки к пределу обнаружения и не превосходят 0.02–0.03 мас. %.
Рис. 2.
Влияние fO2 на содержания NiO, CoO, P2O5 в стекле (а), а также Ni, Co, P и Fe в металлической фазе (б), ΔIW = = ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{exp}}}}$ – ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{IW}}}}$. Определение содержаний NiO, CoO, P2O5 в стекле проводилось методом SIMS (залитые значки) и микрозондом (незалитые значки).
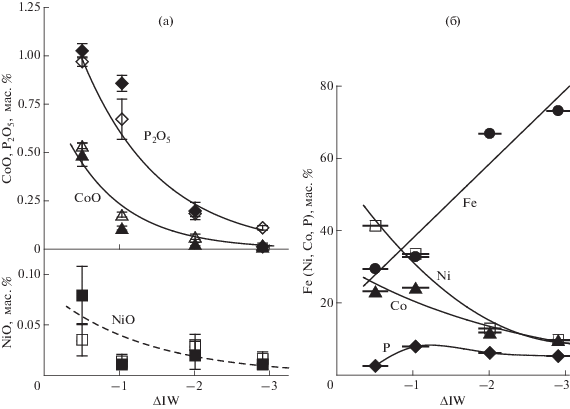
Рис. 3.
Концентрации Ni, Co и P, измеренные микрозондом по профилю в закалочном стекле (а) и капле металлического сплава (б). Опыт L3(fO2 = IW–2). Штриховые линии – средние содержания элементов.
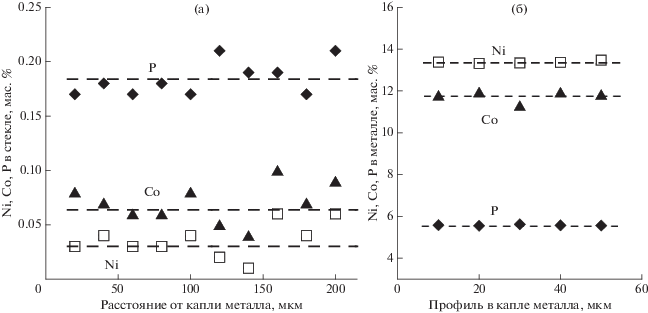
Состав металлических сплавов. Образующиеся при IW–0.5 металлические глобули обогащены Ni (41.3 мас. %) и Co ( 23.2 мас. %) (табл. 3, рис. 2б). Изменение их состава по мере снижения fO2 характеризуется увеличением концентрации Fe (от 29.4 до 73.1 мас. %) и, соответственно, уменьшением концентрации Ni, Co. Концентрация Р изменяется при снижении fO2 более сложным образом: в диапазоне до ~IW–1 она несколько возрастает, достигая ~8 мас. %, а затем уменьшается. Проведенные измерения концентраций Fe, Ni, Co и Р по профилю внутри крупных металлических капель через каждые 10 мкм демонстрируют их равномерное распределение (рис. 3б). Равномерное распределение этих элементов в металле и силикатном стекле подтверждает достижение равновесного состояния в системе во время опытов.
В сплавах, как и в стеклах, по данным ЕМА с уменьшением fO2 в интервале от IW–1 до IW–2 наблюдается резкое увеличение содержания углерода с 0.13 до 1.42 мас. %. В сплаве, образующемся при IW–2.9, концентрация С несколько снижается и составляет 0.71 мас. %. Концентрации других малых компонентов в сплавах Si, Pt, W, Al, определяемые микрозондом, не превосходят 0.02 (Al)–0.08 (Si, W, Pt) мас. %. Относительно большая погрешность в данных не позволяет их использовать для оценки коэффициентов распределения металл/силикат.
КР спектроскопия стекол. КР спектры стекол в области 1300–4300 см–1 обнаруживают ряд пиков, соответствующих различным формам нахождения С–О–Н летучих компонентов в расплавах (рис. 4). Широкая и асимметричная полоса 3000–3800 см–1 с максимумом на 3550–3580 см–1 особенно ярко проявлена в стеклах, образующихся при относительно окислительных условиях при IW–0.5 (рис. 4а). Она соответствует колебаниям O–H связей в молекуле Н2О и OH– группах в структуре силикатных стекол (расплавов), содержащих С–О–Н компоненты в широком диапазоне fO2 (Mysen, Virgo, 1986, Luth et al., 1987; Mysen et al., 2009; Кадик и др., 2006, 2014). Анализ данной полосы КР в полученных стеклах показывает, что основная часть ОН-групп находится в виде структурных единиц ≡Si−OH. Об этом свидетельствуют характерная ассиметричная форма полосы, очень похожая на форму полосы в кварцевом стекле с известным содержанием только ОН-групп (0.02 мас. %), а также отсутствие перегибов на низкочастотном склоне, что указывало бы на присутствии молекул Н2О. В более восстановленных стеклах при IW–2.9 полоса 3000–3800 см–1 выражена значительно слабее (рис. 4б), что свидетельствует о существенном понижении концентрации ОН (и Н2О) в расплаве.
Рис. 4.
КР спектры закалочных стекол в области 20–4500 см–1 после экспериментов при 4 ГПа 1550°С; а – fO2 = IW–0.5 (опыт L1), б – fO2 = IW–2.9 (опыт L4).
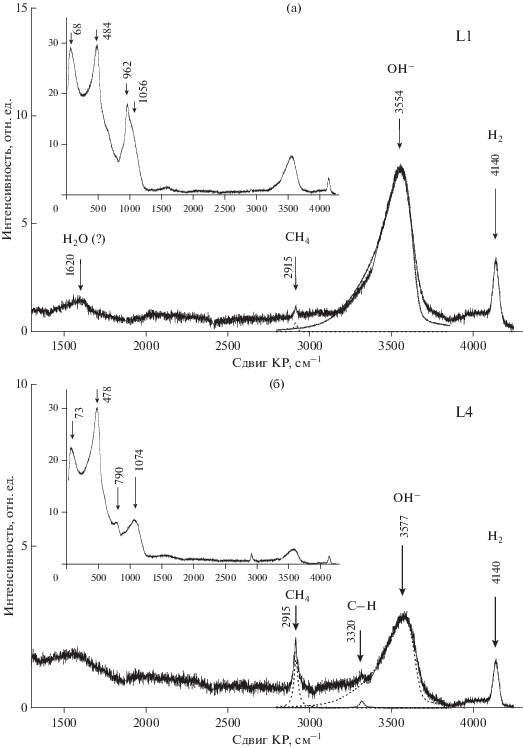
Полоса 4100–4180 см–1 достаточно четко проявляется на КР спектрах и принадлежит молекулярному Н2 (Н–Н связи), растворенному в стекле (Luth et al., 1987; Hirschmann et al., 2012). С понижением fO2 интенсивность пика 4140 см–1 падает более чем два раза. Существует опасность, что водород, обладая высокой диффузионной подвижностью, может частично теряться из закалочных стекол. Однако, как было показано в (Kadik et al., 2004; Hirschmann et al., 2012), длительное хранение экспериментальных стекол (месяцы), содержащих С–О–Н летучие компоненты, не обнаруживает заметных изменений характера ИК спектров и концентраций водорода, определяемых методом SIMS.
Полоса с четким пиком на 2915 см–1 соответствует колебательным движениям молекулярного СН4 (Pouchert, 1981). Помимо СН4 она также может быть обусловлена присутствием в стекле других углеводородных групп, таких как СН3– или ${\text{CH}}_{2}^{{2 - }},$ связанных с силикатной матрицей (Mysen et al., 2009; 2011). Ее интенсивность многократно возрастает с понижением fO2. В стеклах, полученных при наиболее низких fO2, проявляется полоса 3320 см–1, которая, вероятно, отражает наличие связей С–Н в алкиновой группе (С≡С–Н) (Mysen et al., 2009; 2011; Dasgupta et al., 2013).
Пики на 962–1074, 790, 656, 478–484 и 68–73 см–1 соответствуют колебаниям алюмосиликатных матрицы стекол. Изменение характера КР спектров стекол в области 20–1200 см–1 при понижении fO2 (см. врезки на рис. 4а, 4б) свидетельствует о существенных преобразованиях в структуре расплава вследствие растворения С–О–Н соединений, а также изменения состава расплава в отношении содержания в нем Si, Fe, P, Ni, Co. Их природа, требует дальнейших исследований.
Таким образом, спектральные исследования свидетельствуют об образовании восстановленных (Н2, СН4) и окисленных (ОН–, Н2О) форм С–О–Н летучих компонентов при взаимодействии их с силикатным расплавом. Соотношения между ними находятся в существенной зависимости от величины fO2. В области значений ΔIW = –0.5…–1 преобладающими соединениями водорода в расплаве являются ОН– группы и, очевидно, в меньшей степени Н2О. Некоторое количество водорода растворено в молекулярной форме и в виде соединений с углеродом. Углерод растворен в виде СН4 и, по-видимому, частично в виде групп с С–Н связью типа (СН3–, ${\text{CH}}_{2}^{{2 - }}$ и др.). С понижением fO2 в более восстановительных условиях содержание в расплаве ОН– и Н2О уменьшается. Несколько уменьшается и содержание Н2. Содержание СН4 напротив существенно возрастает, кроме того появляются дополнительно и другие С–Н группы и комплексы. Наблюдаемые формы С–О–Н летучих и изменения их соотношений в силикатных расплавах (стеклах) с уменьшением fO2 хорошо согласуются с данными исследования методами КР и Фурье-ИК спектроскопии экспериментальных железосодержащих стекол близкого состава, полученных при аналогичных Р–Т–fO2–fН2 параметрах (Кадик и др., 2014).
Коэффициенты распределения для Ni, Co, P между металлической фазой и силикатным расплавом. На основании полученных экспериментальных данных были рассчитаны значения коэффициентов распределения для Ni, Co, P, Fe между жидкой металлической фазой и силикатным расплавом, который в растворенном виде содержит комплексы и молекулы С–О–Н (D(M)met/sil = = [М] мас. % в мет./[М] мас. % в сил. распл.) (табл. 5).
Таблица 5.
Коэффициенты распределения Ni, Co, P и Fe металл/силикат (lg D(M)
| Образец | lg D(M) по данным ЕМА | lg D(М) по данным SIMS | ||||
|---|---|---|---|---|---|---|
| сред. | мин. | макс. | сред. | мин. | макс. | |
| Никель | ||||||
| L1 | 3.27 | 3.18 | 3.38 | 2.70 | 2.55 | 2.91 |
| L2 | 3.53 | 3.50 | 3.55 | 3.49 | 3.34 | 3.72 |
| L3 | 2.63 | 2.48 | 2.85 | 2.81 | 2.56 | 3.37 |
| L4 | 2.71 | 2.53 | 2.98 | 2.95 | 2.77 | 3.25 |
| Кобальт | ||||||
| L1 | 1.64 | 1.62 | 1.66 | 1.68 | 1.63 | 1.72 |
| L2 | 2.13 | 2.10 | 2.17 | 2.35 | 2.30 | 2.40 |
| L3 | 2.23 | 2.12 | 2.37 | 2.66 | 2.52 | 2.85 |
| L4 | 2.61 | 2.42 | 2.87 | 2.88 | 2.65 | 3.28 |
| Фосфор | ||||||
| L1 | 0.42 | 0.32 | 0.51 | 0.40 | 0.29 | 0.49 |
| L2 | 1.07 | 0.99 | 1.17 | 0.97 | 0.93 | 1.00 |
| L3 | 1.53 | 1.42 | 1.62 | 1.49 | 1.36 | 1.63 |
| L4 | 1.66 | 1.61 | 1.72 | но | ||
| Железо | ||||||
| L1 | 0.43 | 0.42 | 0.44 | |||
| L2 | 0.77 | 0.74 | 0.79 | |||
| L3 | 1.25 | 1.19 | 1.32 | |||
| L4 | 1.64 | 1.57 | 1.72 | |||
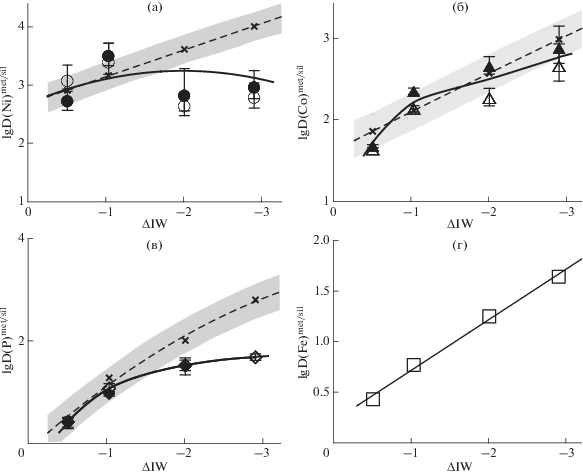
Во всем изученном интервале fO2 никель и кобальт, а также, хотя и в меньшей степени, фосфор четко проявляют сидерофильные свойства, распределяясь преимущественно в металлическую фазу. Рис. 5 демонстрирует зависимость D(M)met/sil от fO2 в логарифмическом масштабе. С понижением fO2 от IW–0.5 до IW–1 (–1.5) коэффициенты распределения Ni, Co, P существенно возрастают. Однако при дальнейшем снижении fO2 до IW–2.9 степень увеличения коэффициентов распределения для кобальта и фосфора становится все меньше, а для никеля величина D(Ni)met/sil даже несколько снижается и при IW–2 и IW–2.9 она остается примерно постоянной, не превышая значения D(Ni)met/sil, соответствующего IW–0.5.
Рис. 5.
Коэффициенты распределения (D(М)met/sil) Ni (а), Co (б), P (в) и Fe (г) между силикатным расплавом, содержащим С–О–Н летучие компоненты, и равновесной с ним жидкой металлической фазой при 4 ГПа и 1550°С как функция fO2, полученные по результатам данного исследования (залитые значки –SIMS, незалитые –EMA). ΔIW = = ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{exp}}}}$.– ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{IW}}}}$. Для сравнения приведены значения D(M)met/sil Ni, Co и P для “сухих” силикатных расплавов (косые крестики, штриховые линии) при аналогичных T, P, fO2, nbo/t и ${\text{X}}_{{\text{C}}}^{{{\text{met/sil}}}}$, рассчитанные по уравнениям регрессии вида (8) для Ni, Co (Righter, Drake, 1999) и (9) для Р (Righter, 2011). Затененные области – диапазон возможных отклонений ±1σ. Дополнительные объяснения в тексте.
Зависимость D(М)met/sil от fO2 в условиях равновесия при постоянных Т и Р может быть выражена, используя константу равновесия реакции, описывающей распределение элемента М между металлической фазой и силикатным расплавом
(3)
${\text{М}}\left( {{\text{металл}}} \right) + n/4{{{\text{O}}}_{2}} = {\text{M}}{{{\text{O}}}_{n}}_{{/2}}\left( {{\text{сил}}{\text{. расплав}}} \right),$(4)
${\text{K}} = {{\left( {Х_{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {Х_{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}} \right)} {\left( {{\text{ }}Х_{{\text{М}}}^{{{\text{met}}}}\gamma _{{\text{M}}}^{{{\text{met}}}}} \right)}}} \right. \kern-0em} {\left( {{\text{ }}Х_{{\text{М}}}^{{{\text{met}}}}\gamma _{{\text{M}}}^{{{\text{met}}}}} \right)}}{{\left( {f{{{\text{O}}}_{2}}} \right)}^{{n/4}}}.$После логарифмирования и простых преобразований уравнения (4) получаем
(5)
$\begin{gathered} \lg {{{\text{D}}}^{\# }}{{\left( {\text{M}} \right)}^{{{\text{met/sil}}}}} = \\ = - n/4\lg f{{{\text{O}}}_{2}} - \lg {\text{K}} + \lg \left( {\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}/\gamma _{{\text{M}}}^{{{\text{met}}}}} \right), \\ \end{gathered} $(6)
${\text{D}}{{\left( {\text{M}} \right)}^{{{\text{met/sil}}}}} = \beta {{{\text{D}}}^{{\text{\# }}}}{{\left( {\text{М}} \right)}^{{{\text{met/sil}}}}},$Таким образом, зависимость lg D(M)met/sil от lg fO2 может быть записана в форме аналогичной уравнению (5):
(7)
$\lg {\text{D}}{{\left( {\text{M}} \right)}^{{{\text{met/sil}}}}} = а\lg f{{{\text{O}}}_{2}} + b\lg \left( {\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}/\gamma _{{\text{M}}}^{{{\text{met}}}}} \right) + c,$Согласно уравнению (7) величина lg D(M)met/sil должна линейно возрастать при уменьшении lg fO2, если $\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}$ и $\gamma _{{\text{М}}}^{{{\text{met}}}}$ или их отношение остаются постоянными. В том случае, если (${{\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}} \mathord{\left/ {\vphantom {{\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}} {\gamma _{{\text{М}}}^{{{\text{met}}}}}}} \right. \kern-0em} {\gamma _{{\text{М}}}^{{{\text{met}}}}}}$) = 1, то коэффициент a, определяющий наклон прямой на графиках lg D(M)met/sil – lg fO2 для Ni и Co должен быть равен –0.5, а для Р –2.511. Соответственно, отклонение от линейной зависимости (при постоянных Т и Р) может быть вызвано изменением состава и структурного состояния силикатного расплава и/или металлического сплава, в том числе и вследствие растворения в этих фазах летучих компонентов.
На рис. 5 полученные нами экспериментально коэффициенты распределения приведены в сравнении с расчетными значениями D(M)met/sil для Ni, Co, P при аналогичных T, P, fO2 в системах с силикатными расплавами, не содержащими С–О–Н летучие компоненты. Расчеты проводились на основании уравнений регрессии (8), описывающих имеющиеся экспериментальные данные по равновесию металла с силикатными расплавами в зависимости от T, P, fO2, а также nbo/t силикатных жидкостей и содержания углерода в металлической фазе (${\text{X}}_{{\text{C}}}^{{{\text{met}}}}$) (Righter et al., 1997; Righter, Drake, 1999; Righter, 2011). Зависимость от nbo/t учитывает влияние на D(M)met/sil степени полимеризации силикатного расплава, которая может быть оценена по отношению немостиковых атомов кислорода к катионам в тетраэдрической координации (Mysen, 1991). Для расчета D(P)met/sil дополнительно было использовано уравнение (9), в котором вместо nbo/t учитывалось влияние состава силикатного расплава в отношении концентраций основных оксидных компонентов (Righter, 2011).
(8)
$\begin{gathered} \ln {\text{D}}{{\left( {\text{M}} \right)}^{{{\text{met/sil}}}}} = a\ln f{{{\text{O}}}_{2}} + b/T + cP/T + \\ + \,\,d\ln \left( {1 - {\text{X}}_{{\text{C}}}^{{{\text{met}}}}} \right) + e\left( {{\text{nbo}}{\text{/}}{\text{t}}} \right) + h, \\ \end{gathered} $
(9)
$\begin{gathered} \ln {\text{D}}{{\left( {\text{M}} \right)}^{{{\text{met/sil}}}}} = a\ln f{{{\text{O}}}_{2}} + b/T + cP/T + \\ + \,\,d\ln \left( {1 - {\text{X}}_{{\text{C}}}^{{{\text{met}}}}} \right) + \sum \left( {{{f}_{i}}X_{i}^{{{\text{sil}}}}} \right) + h. \\ \end{gathered} $Сравнение экспериментальных и расчетных значений D(М)met/sil для Ni, Co и Р при относительно окислительных условиях (fО2 ≥ IW–1) показывает их хорошее соответствие, несмотря на то, что именно в этих условиях силикатные расплавы (в опытах L1 и L2) содержат наибольшие концентрации “воды” (ОН + Н2О), достигающие нескольких мас. %. Таким образом полученные данные хорошо согласуются с выводом о том, что присутствие растворенной воды в расплавах не оказывает существенного влияния на D(M)met/sil Ni, Co и Р (Jana, Walker, 1999; Clеsi et al., 2016). Кроме того необходимо отметить, что расплавы в наших экспериментах имеют высокие содержания SiO2 и низкие значения nbo/t в отличие от преобладающей части расплавов базит-ультрабазитового состава в базе экспериментальных данных, послужившей основой для вывода уравнений регрессии. Это подтверждает вывод о незначительном влиянии структурного параметра nbo/t, особенно для никеля и кобальта, а также свидетельствует о применимости в этих редокс условиях предложенных расчетных уравнений для равновесий металлической фазы с высоко-кремнеземистыми водосодержащими расплавами.
В более восстановительной области при fО2 ≤ ≤ IW–2 между экспериментальными и расчетными коэффициентами распределения металл/силикат для Ni и P наблюдаются заметные расхождения (рис. 5). Значения D(Ni)met/sil и D(P)met/sil для равновесий металлической фазы с расплавами, содержащими С–О–Н летучие компоненты, ниже ожидаемых расчетных значений для “сухих” систем. С понижением fO2 это разница возрастает и при IW–2.9 она составляет ~0.5 и более 1 порядка для Ni и Р, соответственно. Для D(Co)met/sil влияние летучих, как это видно из графика на рис. 5, при низких fО2 значительно слабее, все экспериментальные точки располагаются в диапазоне возможных отклонений ±1σ от расчетных значений D(Co)met/sil. Вместе с тем, если провести линию, описывающую усредненные экспериментальные данные, то можно заметить, что ее наклон в восстановительной области несколько меньше, чем при fО2 ≥ IW–1. Вследствие того, что влияние летучих на распределение Ni существенно меньше, чем на распределение Co, при уменьшении fO2 происходит сближение значений D(Ni)met/sil и D(Co)met/sil (табл. 5).
ОБСУЖДЕНИЕ
Коэффициенты разделения М–Fe металл/силикат (Kd(M–Fe)met/sil). Для более четкого выявления влияние присутствия С–О–Н летучих на распределение Ni, Co и Р между металлической и силикатной фазами необходимо исключить влияние других возможных факторов: Т, Р, fО2, состава силикатной и металлической фаз в отношении других компонентов. Наши эксперименты проводились при постоянных Т и Р, поэтому эти параметры здесь не рассматриваются. Сравнение значений коэффициентов разделения M–Fe металл/силикат Кd(M–Fe)met/sil = (${{{\text{X}}_{{\text{М}}}^{{{\text{met}}}}} \mathord{\left/ {\vphantom {{{\text{X}}_{{\text{М}}}^{{{\text{met}}}}} {{\text{X}}_{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}}}} \right. \kern-0em} {{\text{X}}_{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}}}$)/(${{{\text{X}}_{{{\text{Fe}}}}^{{{\text{met}}}}} \mathord{\left/ {\vphantom {{{\text{X}}_{{{\text{Fe}}}}^{{{\text{met}}}}} {{\text{X}}_{{{\text{FeO}}}}^{{{\text{sil}}}}}}} \right. \kern-0em} {{\text{X}}_{{{\text{FeO}}}}^{{{\text{sil}}}}}}$)n/2 в системах с летучими компонентами и в “сухих” системах, дает возможность исключить эффект изменения fО2 в опытах (Righter, Drake, 1999; Righter, 2011; Clеsi et al., 2016). Для обменной реакции, описывающей восстановление элемента М, находящегося в силикатном расплаве в виде оксида, и его переход в железосодержащую металлическую фазу с замещением в ней Fe,
(10)
$\begin{gathered} {\text{M}}{{{\text{O}}}_{{n/2}}}\left( {{\text{сил}}{\text{. расплав}}} \right) + n/2{\text{Fe}}\left( {{\text{металл}}} \right) = \\ = n/2{\text{FeO}}\left( {{\text{сил}}{\text{.расплав}}} \right) + {\text{М}}\left( {{\text{металл}}} \right) \\ \end{gathered} $(11)
${\text{K}}\, = \,({\text{Х}}_{{\text{М}}}^{{{\text{met}}}}\gamma _{{\text{М}}}^{{{\text{met}}}}/{\text{Х}}_{{{\text{M}}{{{\text{O}}}_{{n{\text{/2}}}}}}}^{{{\text{sil}}}}\gamma _{{{\text{M}}{{{\text{O}}}_{{n{\text{/}}{\text{2}}}}}}}^{{{\text{sil}}}})/{{({\text{Х}}_{{{\text{Fе}}}}^{{{\text{met}}}}\gamma _{{{\text{Fе}}}}^{{{\text{met}}}}/{\text{Х}}_{{{\text{FeO}}}}^{{{\text{sil}}}}\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}})}^{{n/2}}}$(12)
$\begin{gathered} \ln {\text{Кd}}{{\left( {{\text{M}}{\kern 1pt} - {\kern 1pt} {\text{Fe}}} \right)}^{{{\text{met/sil}}}}} = \\ = \ln {\text{K}} + \ln \left[ {{{{{{\left( {\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}/\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}} \right)}}^{{n/2}}}} \mathord{\left/ {\vphantom {{{{{\left( {\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}/\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}} \right)}}^{{n/2}}}} {\left( {\gamma _{{\text{M}}}^{{{\text{met}}}}/\gamma _{{{\text{MOn/2}}}}^{{{\text{sil}}}}} \right)}}} \right. \kern-0em} {\left( {\gamma _{{\text{M}}}^{{{\text{met}}}}/\gamma _{{{\text{MOn/2}}}}^{{{\text{sil}}}}} \right)}}} \right] = \\ = \ln {\text{K}} + \ln {{\left( {\gamma _{{{\text{Fe}}}}^{{{\text{met}}}}} \right)}^{{n/2}}}/\left( {\gamma _{{\text{M}}}^{{{\text{met}}}}} \right) + \ln \left( {\gamma _{{{\text{MOn/2}}}}^{{{\text{sil}}}}} \right)/{{\left( {\gamma _{{{\text{FeO}}}}^{{{\text{sil}}}}} \right)}^{{n/2}}}. \\ \end{gathered} $Таким образом, если предположить, что соотношение коэффициентов активностей компонентов, участвующих в реакции, в металлической и силикатной фазах не меняется при изменении fО2, то значения Кd должны оставаться при данных Т и Р постоянными.22
На рис. 6 показаны значения lnKd для Ni, Co и Р, полученные в опытах L1–L4 при различных fО2. На верхней горизонтальной оси графика приведены концентрации водорода в силикатных расплавах. На этом же графике показаны значения Kd, рассчитанные при параметрах (Т, Р, nbo/t, ${\text{X}}_{{\text{C}}}^{{{\text{met}}}}$), соответствующих L1–L4, используя для этой цели уравнения регрессии, предложенные разными авторами для “сухих” систем, которые по виду аналогичны уравнению (8) (Righter, 2011; Fischer et al., 2015; Clesi et al., 2016)
(13)
$\begin{gathered} \ln {\text{Kd}} = b/T + cP/T + \\ + \,\,d\ln \left( {1 - {\text{X}}{{{\text{c}}}^{{{\text{met}}}}}} \right) + e\left( {{\text{nbo}}/t} \right) + h, \\ \end{gathered} $Рис. 6.
Коэффициенты разделения M-Fe (Kd(M-Fe)met/sil) для Ni, Co и P между силикатным расплавом, содержащим С–О–Н летучие компоненты, и равновесной с ним жидкой металлической фазой при 4 ГПа и 1550°С по результатам данного исследования (залитые значки – SIMS, незалитые – EMA). ΔIW = = ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{exp}}}}$.– ${\text{lg}}{\kern 1pt} f{\text{O}}_{2}^{{{\text{IW}}}}$.
Для сравнения приведены (косые крестики, штриховые линии) значения Kd(M-Fe)met/sil для Ni, Co, P в “сухих” системах при аналогичных T, P, fO2, nbo/t и ${\text{X}}_{{\text{C}}}^{{{\text{met/sil}}}}$, рассчитанные по уравнениям регрессии (13) для Ni, Co (Righter, 2011) и Р (Siebert et al., 2011). Затененные области – диапазон возможных отклонений ±1σ (для Ni, Co) и ± 2σ (для Р). Расчетные значения Kd(M–Fe)met/sil для Ni, Co по другим уравнениям аналогичного вида (Righter, 2011; Fisher et al., 2015; Clesi et al., 2016) располагаются в пределах указанных областей. Дополнительные объяснения в тексте.
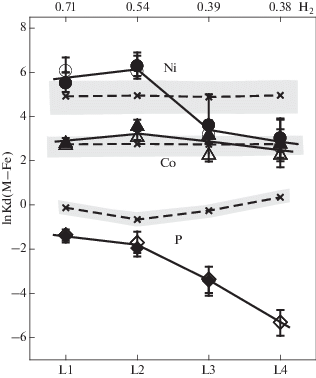
Экспериментальные значения lnKd(Co–Fe) во всех опытах меняются мало, оставаясь в среднем примерно равными 2.90 ± 0.35. В целом они хорошо согласуются с расчетными и не выходят за пределы общего интервала погрешностей, который соответствует различным уравнениям регрессии. Для никеля и фосфора постоянства коэффициентов разделения не наблюдается. Значения lnKd(Ni–Fe) в опытах L1 и L2 заметно выше (в среднем 5.97 ± 0.45), чем в опытах L3 и L4 (3.39 и 2.82 ± 0.60, соответственно), которые были проведены при более восстановительных условиях. Эти значения заметно отличаются от ожидаемых и выходят за приделы возможного коридора погрешностей. Еще большие вариации наблюдаются для lnKd(Р–Fe). В ряду L1–L4 происходит существенное уменьшение lnKd(Р–Fe) от –1.4 ± 0.3 (L1) до –5.3 ± 0.6 (L4). При этом все экспериментальные значения сильно отличаются от расчетных значений для “сухих” систем (Siebert et al., 2011).
Рассмотрим возможные причины изменения соотношений коэффициентов активностей компонентов в силикатном расплаве и в металлической жидкости, принимающих участие в обменной реакции (10), которые могут объяснить наблюдаемые изменения коэффициентов разделения.
Влияние nbo/t. В качестве параметра, характеризующего в первом приближении влияние состава силикатного расплава на распределение сидерофильных и других элементов металл/силикат, в уравнениях регрессии (8, 13) используется величина nbo/t. Экспериментально показано, что в “сухих” условиях изменение nbo/t силикатных расплавов от основного до ультраосновного состава (в диапазоне 1–3.5) практически не влияет на D(M)met/sil (при Т, Р и fО2 = const) и Kd(M–Fe)met/sil (при Т, P = const) для никеля и кобальта (Righter, 2011; Palme et al., 2011; Siebert et al., 2011). Влияние nbo/t на распределение этих металлов в водных условиях также весьма незначительно, так как растворение воды в расплаве до нескольких мас. %, по-видимому, не приводит к существенному изменению отношения немостиковых атомов кислорода к катионам в тетраэдрической координации (Kohn et al., 1998; Righter, Drake, 1999). Силикатные расплавы в наших экспериментах имеют значения nbo/t характерные для кислых расплавов, варьируя от 0.35 (L1) до 0.07 (L4). Близкое совпадение экспериментальных и расчетных значений D(M)met/sil и Kd для Co подтверждает отсутствие существенной зависимости от nbo/t. С другой стороны наблюдаемые расхождения экспериментальных и расчетных значений для Ni при низких fО2 < IW–1.5 (L3 и L4), очевидно, не связаны с изменением nbo/t (рис. 5 и 6), а обусловлены другими причинами в первую очередь, по-видимому, присутствием летучих компонентов.
Распределение металл–силикат для фосфора, как и для других высоковалентных элементов, согласно имеющимся экспериментальным данным, в значительно большей степени зависит от nbo/t, чем для низковалентных никеля и кобальта. Это является следствием двойственной роли фосфора в структуре силикатного расплава, его возможности быть в зависимости от состава расплава (прежде всего концентраций и соотношений таких компонентов как SiO2, Al2O3 и Na2O + K2O) не только модификатором, но и сеткообразователем, занимая в структуре расплава тетраэдрическую координацию. Кроме того способность фосфора образовывать комплексы с немостиковыми кислородами повышает его растворимость в расплаве с увеличением nbo/t, что в свою очередь ведет к уменьшению Kd(P–Fe) и D(P)met/sil (при fО2 = = const) (Righter, Drake, 1999, Righter, 2011; Siebert, 2011). В наших экспериментах наблюдается обратная тенденция – с увеличением nbo/t эти коэффициенты не уменьшаются, а возрастают. Сравнение с расчетными значениями коэффициентов Kd(P–Fe) и D(P)met/sil для “сухих” систем при аналогичных Р, Т, fО2, nbo/t и ${\text{X}}_{{\text{C}}}^{{{\text{met}}}}$ демонстрирует увеличение расхождения экспериментальных данных в сторону их понижения в ряду от L1 до L4, т.е. при уменьшении fО2 в системе (рис. 5 и 6). Таким образом, на распределение фосфора помимо nbo/t, очевидно, оказывают влияние другие возможно более сильные факторы.
Влияние растворения С в металле. Присутствие в металлической фазе в растворенном виде углерода, является одним факторов, оказывающим влияние на распределение сидерофильных элементов металл/силикат, который учитывается в уравнениях регрессии (8, 9, 13) в качестве специального терма. Расчеты по этим уравнениям показывают, что содержание С в металле (${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$) очень мало влияет на распределение никеля и еще меньше кобальта, однако влияние ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ на распределение фосфора заметно больше и противоположно по знаку. Это наглядно проявляется при сравнении Kd, определенных в экспериментах для одних и тех же исходных составов, Р и Т (3 ГПа, 1850°С) с использованием капсул, изготовленных из различных материалов – графита и МgО (Siebert et al., 2011). Насыщение системы углеродом практически не влияет на Kd для никеля и кобальта, но ведет к заметному снижению Kd для фосфора. Согласно уравнениям (8, 9) увеличение ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ на 1 мас. % в наших опытах L1–L4 приводит к увеличению lg D(Ni)met/sil на ≤ 0.01 и, соответственно, уменьшению lg D(Р)met/sil на ≤ 0.12. В целом расчеты показывают, что изменения Dmet/sil и Kd не только для Ni, Cо, но и для фосфора вследствие возможных вариаций ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ в L1–L4 не выходят за пределы экспериментальных погрешностей. Таким образом, наблюдаемое снижение коэффициентов распределения Ni и Р в наших экспериментах при более восстановительных условиях по сравнению с расчетными, которое достигает в L4 для никеля ~0.5, а для фосфора более одного порядка (рис. 5), очевидно, нельзя объяснить повышением ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ в этих условиях, даже принимая во внимание возможные погрешности в определении концентрации углерода в металлической фазе.
Следует отметить, что существенно более низкие ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ в опытах L3 (IW–2.1) – 1.42 и L4 (IW–2.9) – 0.71 мас. %, по сравнению с ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ (3.7 и 2.7 мас. %), характерными для равновесия силикатный расплав–жидкий сплав железа–графит в модельной системе NaAlSi3O8–FeO–(С–О–Н) при тех же Р, Т и близких fO2 (IW–2 и IW–3.8, соответственно), которые были получены в опытах, проведенных по аналогичной методике (Кадик и др., 2014), очевидно, обусловлены влиянием на растворимость углерода в металлической фазе железа присутствия в ней никеля и кобальта. Экспериментально показано, что увеличение содержания Ni в сплаве Fe–Ni, равновесном с силикатным расплавом и графитом, вызывает существенное понижение растворимости С в сплаве (Dasgupta et al., 2013; Chi et al., 2014). Поэтому еще более низкие ${\text{C}}_{{\text{C}}}^{{{\text{met}}}}$ в опыте L2 (0.13 мас. %), по-видимому, объясняются высокими концентрациями Ni и Co в металлической фазе – 33.5 и 24.2 мас.%, соответственно (табл. 3).
Влияние С–О–Н летучих. Как было показано выше, по данным КР спектроскопии водород и углерод присутствуют в силикатных расплавах L1–L4 в виде трех основных форм: воды (ОН + + Н2О), молекул СН4 и других углеводородных комплексов, а также молекулярного водорода. Концентрации водорода в стеклах, определенные методом SIMS, пересчитанные на Н2О, дают максимально возможные содержания воды в расплавах (${\text{C}}_{{{{{\text{H}}}_{2}}{\text{O}}}}^{{{\text{sil}}}}$ = 6.4(L1) – 3.4(L4) мас. %), учитывая, что часть водорода в них находится в других формах (табл. 2б). С уменьшением fO2 от IW–0.5 (L1) до IW–2.9 (L4) концентрация водорода, а также интенсивность пика 3550 см–1 (ОН + Н2О) на спектре КР уменьшается примерно в два раза. Это свидетельствует о том, что водород преимущественно растворяется в расплаве в виде воды и с уменьшением fO2 ее концентрация уменьшается примерно в два раза. Приближенные количественные оценки ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ в расплавах L1–L4 можно сделать воспользовавшись результатами измерения ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{met}}}}$ методами FTIR и КР спектроскопии в расплавах системы NaAlSi3O8–FeO–(С–О–Н), которые имеют близкие содержания SiO2 (60–70.5 мас. %), Al2O3 (17.2–17.6 мас. %), Na2O (10.3–11 мас. %) и были получены в экспериментах при тех же Р и Т в диапазоне fO2 от IW–2 до IW–3.8 (Кадик и др., 2014). ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ в этих расплавах при IW–2 и IW–3.8 составляет в среднем 4.6 ± 0.3 и 1.9 ± 1 мас. %. соответственно. Экстраполяция этих данных в окислительную область дает основание предполагать, что ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ при IW–0.5 (L1) должна быть не менее 5.5–6 мас. %. Отсюда следует, что ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ при IW–2.9 (L4) составляет ~2.5–3 мас. %. В целом эти оценки хорошо согласуются с измерениями концентрации водорода в экспериментальных стеклах.
Полученные результаты по распределению Ni, Со и Р металл/силикат в опытах L1 (IW–0.5) и L2 (IW–1) показывают, что даже высокие ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ до 4.5–6 мас. % не вызывают заметных отклонений коэффициентов распределения Ni, Co и Р от ожидаемых расчетных значений D(M)met/sil для этих элементов в “сухих” системах (рис. 5). Значимые отклонения в сторону уменьшения коэффициентов D(M)met/sil, а также Kd(М–Fe) для никеля и фосфора имеют место при более восстановительных условиях в опытах L3(IW–2) и L4(IW–2.9) при меньших ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ ~ 3–4 мас. %. Для Co и в этих условиях влияние летучих остается слабо выраженным, в результате чего величина D(Ni)met/sil приближается к D(Co)met/sil. Следует отметить, что для фосфора с повышением содержания воды наблюдается существенное увеличение Kd(P–Fe) (рис. 6). Такая же тенденция отмечалась в (Righter, Drake, 1999) при изучении равновесия металл–силикатный расплав основного состава (1 ГПа, 1300°С): с повышением ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ до 2.75 мас. % Kd(P–Fe) увеличивался почти на ~4 порядка.
Таким образом, присутствие С–О–Н летучих компонентов, несмотря на высокие содержания воды в расплаве и насыщение системы углеродом не оказывают заметного влияния на распределение металл–силикат Ni, Со и Р при относительно окислительных условиях (fO2 ≥ IW–1.5). Оно проявляется для Ni и особенно сильно для Р только в более восстановительной области при более низких ${\text{C}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{{\text{sil}}}}$ и более высоких концентрациях углерода как в силикатном расплаве, так и в металлическом сплаве.
Возможными причинами уменьшения D(M)met/sil в сильно восстановительных условиях являются те существенные изменениями в структуре силикатных расплавов, которые были установлены КР спектроскопией, а также формирование в них комплексных соединений сидерофильных элементов с летучими компонентами. Wetzel et al. (2013) по КР спектрам стекол – продуктов закалочных экспериментов, проведенных с водосодержащими, насыщенными углеродом коматиитовыми расплавами, равновесными с обогащенной железом металлической фазой при 0.9 ГПа 1530°С и fO2 ≤ IW–1, обнаружили наряду с Н2О, СН4 присутствие карбонила железа Fe(CO)5 по пику 2110 см–1. На КР спектрах стекол L1–L4 соответствующего пика не наблюдалось. Однако, нельзя исключать, что в очень малых концентрациях в восстановленных расплавах могут присутствовать карбонилы не только Fe, но и Ni и Co (Hirschmann, 2013, Stanley, 2014), а также другие комплексы со связями типа M–C и M–H. В этом случае при очень малых концентрациях никеля и кобальта образование подобных комплексов в расплаве может вызвать заметное снижение коэффициентов распределения металл/силикат. Этот эффект будет проявляться тем сильнее, чем устойчивей такого рода комплексы и чем ниже концентрация Ni и Co в расплаве. Фосфор также может иметь в силикатной жидкости не выявленные спектроскопией соединения и комплексы с участием углерода, водорода и кислорода. Определенное влияние может оказывать также изменение состава металлической фазы в результате растворения в ней углерода и водорода.
ЗАКЛЮЧЕНИЕ
1. В серии экспериментов, проведенных в системе NaAlSi3O8–FeO–NiO–CoO–SiC– NaH2PO4 при 1550°С, 4 ГПа и fO2 в интервале от IW–0.5 до IW–2.9 (в условиях повышенной летучести водорода, lg fH2 (бар) ≈ 2.8), определены коэффициенты распределения умеренно сидерофильных элементов Ni, Co, Р между жидкой металлической фазой Fe(Ni,Co,Р,С) и силикатным расплавом, содержащим С–О–Н летучие компоненты. Показано, что при относительно окислительных условиях (fO2 ≥ IW–1.5) присутствие летучих, несмотря на высокие содержания воды в расплаве (до 4–6 мас. %) и насыщение системы углеродом, не оказывает заметного влияния на распределение металл-силикат Ni, Со и Р. Таким образом, предлагаемые ранее уравнения регрессии, описывающие равновесие металла с силикатными расплавами в зависимости от T, P, fO2, ${\text{X}}_{{\text{C}}}^{{{\text{met}}}}$, nbo/t, которые основаны на экспериментальных данных для “сухих” расплавов, главным образом, базит-ультрабазитового состава (Righter, Drake, 1999; Righter, 2011), могут быть использованы при данных Т–Р–fO2 для расчета коэффициентов распределения между жидкими сплавами Fe с относительно высокими содержаниями Ni, Co, Р и водосодержащими силикатными расплавами кислого состава.
2. В более восстановительной области (при fО2 ≤ IW–2) D(Ni)met/sil и D(P)met/sil для равновесий металлической фазы с расплавами, содержащими С–О–Н летучие, становятся ниже ожидаемых расчетных значений для “сухих” систем. С уменьшением fO2 это разница возрастает и при IW–2.9 она составляет ~0.5 для Ni и более 1 порядка для Р. Влияние летучих на D(Co)met/sil проявляется значительно слабее, в результате этого при понижении fО2 значения D(Ni)met/sil и D(Со)met/sil сближаются.
3. По данным изучения экспериментальных стекол методом КР спектроскопии водород и углерод присутствуют в силикатных расплавах виде трех основных форм: воды (ОН + Н2О), молекул СН4 и других углеводородных комплексов, а также молекулярного водорода. КР спектры стекол и определение в них концентрации водорода показывают, что с уменьшением fO2 содержание воды (ОН + Н2О) в экспериментальных расплавах существенно уменьшается (от 5.5–6 до 2.5–3 мас. %), при этом возрастает содержание СН4 и других соединений с С–Н связью.
4. Предполагается, что причинами уменьшения степени сидерофильности Ni и Р (возможно и других элементов) в сильно восстановительных условиях могут быть существенные изменениями в структуре силикатных расплавов, содержащих С–О–Н летучие, и формирование в них соединений и комплексов со связями типа M–C и M–H. Определенное влияние может оказывать также изменение состава металлической фазы в результате растворения в ней водорода. Решение этих вопросов требует дальнейших исследований.
5. Полученные данные о возможном влиянии С–О–Н летучих на распределении Ni, Со и Р металл/силикатный расплав в сильно восстановительных условиях следует учитывать, анализируя процессы сегрегации металлической фазы при плавления ранней восстановленной мантии Земли и других планетных тел в присутствии летучих, а также при взаимодействии мантийных магм с водородсодержащими высоко восстановленными флюидами на больших глубинах.
Статья посвящается светлой памяти профессора доктора геол.-мин. наук Арнольда Арнольдовича Кадика, который был инициатором данного исследования, определил его основные цели и задачи.
Авторы выражают искреннею благодарность Б.Н. Рыженко и О.И. Яковлеву за обсуждение статьи и сделанные замечания.
Работа выполнена в рамках госзадания № 0137-2019-0017 при финансовой поддержке гранта РФФ-И 17-05-00713 и Программы Президиума РАН I.16.
Список литературы
Борисов А.А. (2007) Экспериментальное исследование влияния SiO2 на растворимость кобальта и железа в силикатных расплавах. Петрология 15 (6), 563-570.
Кадик А.А., Колташев В.В., Крюкова Е.Б., Плотниченко В.Г., Цехоня Т.И., Кононкова Н.Н. (2014) Особенности растворения С–O–H летучих в расплавах FeO–Na2O–Al2O3–SiO2, равновесных с жидким сплавом железа и графитом при 4 ГПа и 1550°С. Геохимия (9), 771-790.
Kadik A.A., V.V. Koltashev, E.B. Kryukova, V.G. Plotnichenko, T.I. Tsekhonya, N.N. Kononkova (2014) Solution behavior of C–O–H volatiles in FeO–Na2O–Al2O3–SiO2 melts in equilibrium with liquid iron alloy and graphite at 4 GPa and 1550°C. Geochem. Int. 52(9), 707-725.
Кадик А.А., Литвин Ю.А., Колташев В.В., Крюкова Е.Б., Плотниченко В.Г. (2006) Растворимость водорода и углерода в восстановленных магмах ранней мантии Земли. Геохимия (1), 38-53.
Kadik A.A., Litvin Yu.A., Koltashev V.V., Kryukova E.B., Plotnichenko V.G. Solubility of hydrogen and carbon in reduced magmas of the early Earth’s mantle. Geochem. Int. 44 (1), 38-53.
Маров М.Я., Ипатов С.И. (2018) Доставка воды и летучих к планетам земной группы и к Луне. Астрономический вестник, 52 (5), 402-410.
Marov M.Ya., Ipatov S.I., (2018) Delivery of water and volatiles to the terrestrial planets and the Moon. Solar System Research 52, (5), 392-400).
Рябчиков И.Д., Когарко Л.Н. (2013) Aктивность FеО и потенциал кислорода магнезиальных магм. Геохимия (12), 1055-1065.
Ryabchikov I.D., Kogarko L.N. (2013) FeO activity and oxygen potential in magnesian magmas. Geochem. Int. 51 (12), 949-958.
Abe Y., Matsui T. (1985) The formation of an impact-generated H2O atmosphere and its implications for the early thermal history of the Earth. J. Geophys. Res. 90, (suppl.), C545-C559.
Chi Han, Dasgupta R., Duncan M.S., Shimizu N. (2014) Partitioning of carbon between Fe-rich alloy melt and silicate melt in a magma ocean—Implications for the abundance and origin of volatiles in Earth, Mars, and the Moon. Geochim. Cosmochim. Acta 139, 447-471.
Clesi V., Bouhifd M.A., Bolfan-Casanova N., Manthilake G., Fabbrizio A., Andrault D. (2016) Effect of H2O on metal–silicate partitioning of Ni, Co, V, Cr,Mn and Fe: Implications for the oxidation state of the Earth and Mars. Geochim. Cosmochim. Acta 192, 97-121.
Dasgupta R., Ananya Mallik, Tsuno K., Withers Anthony C., Hirth Greg, & Hirschmann Marc M. (2013) Carbon-dioxide⎯rich silicate melt in the Earth’s upper mantle. Nature 493, 211-215.
Doyle C.D., Naldrett A.J. (1986) Ideal mixing of divalent cations in mafic magma and its effect on the solution of ferrous oxide. Geochim. Cosmochim. Acta 50, 435-443.
Drake M.J., Newsom H.E., Capobianco C.J. (1989). V, Cr, and Mn in the Earth, Moon EPB and SPB and the origin of the Moon: experimental studies. Geochim. Cosmochim. Acta 53, 2101-2111.
Fischer R.A., Nakajima Y., Campbell A.J., Frost D.J., Harries D., Langenhorst F., Miyajima N., Pollok K., Rubie D.C. (2015) High pressure metal-silicate partitioning of Ni, Co, V, Cr, Si, and O. Geochim. Cosmochim. Acta 167, 177-194.
Frost D., Mann U., Asahara Y. and Rubie D. (2008) The redox state of the mantle during and just after core formation. Philos. Trans. Roy. Soc. A 366, 4315-4337.
Hallis L.J., Huss G.R., Nagashima K., Taylor G.J., Halldórsson S.A., Hilton D.R., Mottl M.J., Meech K.J. (2015) Evidence for primordial water in Earth’s deep mantle. Science 350 (6262), 795-797.
Hirschmann M.M. (2013) Fe-carbonyl is a key player in planetary magmas. Proc. Nat. Acad. Sci. 110 (20), 7967-7968.
Hirschmann M.M., Withers A.C., Ardia P., Foley N.T. (2012) Solubility of molecular hydrogen in silicate melts and consequences for volatile evolution of terrestrial planets. Earth Planet Sci. Lett. 345–348, 38-48.
Holzheid A., Palme H., and Chakraborty S. (1997) The activities of NiO, CoO and FeO in silicate melts. Chem. Geol. 139, 21-38.
Jana D., Walker D. (1997a) The impact of carbon on element distribution during core formation. Geochim. Cosmochim. Acta 61, 2759-2763.
Jana D., Walker D. (1997b) The influence of sulfur on partitioning of siderophile elements. Geochim. Cosmochim. A-cta 61, 5255-5277.
Jana D., Walker D. (1999) Core formation in the presence of various C–H–O volatile species. Geochim. Cosmochim. Acta 63, 2299-2310.
Jarosewich E. (1990) Chemical analyses of meteorites: A compilation of stony and iron meteorite analyses. Meteoritics 25, 323-338.
Jones J.H., Drake M.J. (1983) Experimental investigations of trace element fractionation in iron meteorites, II: The influence of sulfur. Geochim. Cosmochim. Acta 47, 1199-1209.
Kadik A.A., Pineau F., Litvin Y., Jendrzejewski N., Martinez I., and Javoy M. (2004) Formation of carbon and hydrogen species in magmas at low oxygen fugacity. J. Petrol. 45, 1297-1310.
Kohn S.C., Smith M.E., Dirken P.J., van Eck E.R.H., Kentgens A.P.M., Dupree R. (1998) Sodium environments in dry and hydrous albite glasses: Improved 23Na solid state NMR data and their implications for water dissolution mechanisms. Geochim. Cosmochim. Acta 62, 79-87.
Li Yuan, Dasgupta R., Tsuno K. (2015) The effects of sulfur, silicon, water, and oxygen fugacity on carbon solubility and partitioning in Fe-rich alloy and silicate melt systems at 3 GPa and 1600°C: Implications for core-mantle differentiation and degassing of magma oceans and reduced planetary mantles. Earth Planet Sci. Lett. 415, 54-66.
Luth R.W., Mysen B.O., Virgo D. (1987) Raman spectroscopic study of the solubility behavior of H2 in the system Na2O–Al2O3–SiO2–H2. Am. Mineral. 72, 481-486.
Ma Z. (2001) Thermodynamic description for concentrated metallic solutions using interaction parameters. Metall. Mater. Trans. B 32, 87-103.
Marty B. (2012) The origins and concentrations of water, carbon, nitrogen and noble gases on Earth. Earth Planet Sci. Lett. 313–314, 56-66.
Marty B., Avice G., Sano Y., Altwegg K., Balsiger H., Hässig M., Morbidelli A., Mousis O., Rubin M. (2016) Origins of volatile elements (H, C, N, noble gases) on Earth and Mars in light of recent results from the ROSETTA cometary mission. Earth Planet Sci. Lett. 441, 91-102.
Morbidelli A., Chambers J., Lunine J. I., Petit J., Robert F., Valsecchi G. and Cyr K. (2000) Source regions and timescales for the delivery of water to the Earth. Meteor. Planet. Sci. 35, 1309-1320.
Mysen B.O. (1991). Relations between structure, redox equilibria of iron, and properties of magmatic liquids. In Perchuk L.L. and Kushiro I., Eds., Physical Chemistry of Magmas, Springer-Verlag, New York. 9, 41-98.
Mysen B.O., Fogel M.L., Morrill P.L., Cody G.D. (2009) Solution behavior of reduced C–O–H volatiles in silicate melts at high pressure and temperature. Geochim. Cosmochim. Acta, 73, 1696-1710.
Mysen B.O., Kumamoto K., Cody G.D., Fogel M.L. (2011) Solubility and solution mechanisms of C–O–H volatiles in silicate melt with variable redox conditions and melt composition at upper mantle temperatures and pressures. Geochim. Cosmochim. Acta 75, 6183-6199.
Mysen B.O., Virgo D. (1986) Volatiles in silicate melts at high pressure and temperature. 2. Water in melts along the join NaA1O2–SiO2 and a comparison of solubility mechanisms of water and fluorine. Chem. Geol. 57, 333-358.
O’Brien D.P., Walsh K.J., Morbidelli A., Raymond S.N. and Mandell A.M. (2014) Water delivery and giant impacts in the Grand Tack scenario. Icarus 239, 74-84.
O’Neill H.St.C., Eggins S.M. (2002) The effect of melt composition on trace elements partitioning: an experimental investigation of the activity coefficients of FeO, NiO, CoO, MoO2 and MoO3 in silicate melts. Chem. Geol. 186, 151-181.
Palme H., Kegler Ph., Holzheid A., Frost D.J., Rubie D.C. (2011) Comment on “Prediction of metal-–silicate partition coefficients for siderophile elements: An update and assessment of PT conditions for metal-silicate equilibrium during accretion of the Earth” by K. Righter, EPSL 304 (2011) 158–167, 2011. Earth Planet Sci. Lett. 312, 516-518.
Pouchert C.G. (1981) The Aldrich Library of Infrared Spectra, 3rd ed. (Aldrich Chemical Co, 1981).
Righter K. (2011) Prediction of metal-silicate partition coefficients for siderophile elements: An update and assessment of PT conditions for metal-silicate equilibrium during accretion of the Earth. Earth Planet Sci. Lett, 304, 158-167.
Righter K. (2015) Modeling siderophile elements during core formation and accretion, and the role of the deep mantle and volatiles. Am. Mineral. 100, 1098-1109.
Righter K., Drake M.J. (1999) Effect of water on metal–silicate partitioning of siderophile elements: a high pressure and temperature terrestrial magma ocean and core formation. Earth Planet Sci. Lett. 171, 383-399.
Righter K., Drake M.J., Yaxley G. (1997) Prediction of siderophile element metal-silicate partition coefficients to 20 GPa and 2800°C: the effects of pressure, temperature, oxygen fugacity, and silicate and metallic melt compositions. Phys. Earth Planet Inter. 100, 115-134.
Rubie D.C., Frost D.J., Ute Mann, Asahara Y., Nimmo F., Tsuno K., Kegler Ph., Holzheid A., Palme H. (2011) Heterogeneous accretion, composition and core-mantle differentiation of the Earth. Earth Planet Sci. Lett., 301, 31-42.
Sarafian, A.R., Nielsen, S.G., Marschall, H.R., McCubbin, F.M., Monteleone, B.D. (2014) Early accretion of water in the inner solar system from a carbonaceous chondrite-like source. Science, 346, 623-626.
Siebert J., Corgne A., Ryerson F.J. (2011) Systematics of metal–silicate partitioning for many siderophile elements applied to Earth’s core formation. Geochim. Cosmochim. Acta 75, 1451-1489.
Siebert Julien, Badro J., Antonangeli D., Ryerson F.J. (2012) Metal–silicate partitioning of Ni and Co in a deep magma ocean. Earth Planet Sci. Lett. 321–322, 189-197.
Sobolev A.V., Chaussidon M., 1996. H2O concentrations in primary melts from supra-subduction zones and mid-ocean ridges: implications for H2O storage and recycling in the mantle. Earth Planet Sci. Lett. 137, 45-55.
Stanley Ben D., Hirschmann Marc M., Withers Anthony C. (2014) Solubility of C–O–H volatiles in graphite-saturated martian basalts. Geochim. Cosmochim. Acta 129, 54-76.
Toplis, M.J. (2005) The thermodynamics of iron and magnesium partitioning between olivine and liquid: criteria for assessing and predicting equilibrium in natural and experimental systems. Contr. Mineral. Petrol. 149, 22-39.
Wänke H. and Dreibus G. (1988) Chemical composition and accretion history of terrestrial planets. Philos. Trans. Roy. Soc. A Math. Phys. Eng. Sci. 325, 545-557
Wetzel D.T., Rutherford M.J., Jacobsen S.D., Hauri E.H., and Saal A.E. (2013) Degassing of reduced carbon from planetary basalts. Proc. Nat. Acad. Sci. 110 (20), 8010-8013.
Wood B.J., Walter M.J., Wade J. (2006) Accretion of the Earth and segregation of its core. Nature 441, 825-833.
Дополнительные материалы отсутствуют.


