Геохимия, 2020, T. 65, № 8, стр. 778-785
Термическое и термохимическое изучение блёдита (астраханита)
Л. П. Огородова a, *, Л. В. Мельчакова a, Ю. Д. Гриценко a, b, М.Ф. Вигасина a, Д. А. Косова c, Д. А. Ксенофонтов a
a Московский Государственный Университет имени М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские Горы, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
c Московский Государственный Университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские Горы, Россия
* E-mail: logor@geol.msu.ru
Поступила в редакцию 15.05.2019
После доработки 18.07.2019
Принята к публикации 18.07.2019
Аннотация
Исследован природный водный сульфат натрия и магния–блёдит (астраханит) Na2Mg(SO4)2 ⋅ 4H2O из отложений соленого озера Бай-Шагыр (Россия). На основании термического, рентгенографического, ИК- и КР-спектроскопического исследований изучена стадийность процесса разложения блёдита при нагревании. На микрокалориметре Тиана-Кальве методом высокотемпературной расплавной калориметрии растворения определена энтальпия образования блёдита из элементов ${{\Delta }_{f}}H_{{el}}^{0}$ (298.15 K) = – 3845 ± 13 кДж/моль. Оценены значения стандартных энтропии и энергии Гиббса образования блёдита.
ВВЕДЕНИЕ
Блёдит (астраханит) – природный водный сульфат натрия и магния состава Na2Mg(SO4)2 ⋅ 4H2O. Минерал был открыт в первой половине 19 века в соляных отложениях в районе г. Зальцбург (Австрия). В России он впервые был обнаружен в астраханских соленых озерах хлорид-сульфатного типа и залива Кара-Богаз-Гол, что и определило его название − “астраханит”. Название “блёдит” (в честь немецкого химика К. Блёде) принято Международной Минералогической Ассоциацией в 1982 году.
Блёдит является типичным минералом эвапоритов и пещерных отложений, где он образует довольно крупные скопления. Он выделяется из рассолов и соляных озер или при диагенезе осадков; встречается также в выцветах солей в пустынях и как вторичный минерал в соляных месторождениях морского генезиса. Его скопления установлены в соляных озерах в устье р. Волга, в эвапоритовых осадочных породах района Большого Соленого озера в штате Юта и Содового озера в штате Калифорния (США), в Чили, Китае и т.д. Кроме того, минерал совместно с другими сульфатами натрия, магния и калия образуется в виде возгонов фумарол и корок на поверхности лав в зонах активного вулканизма, таких как остров Вулкано в Италии, вулканы Мутновский и Толбачик на Камчатке (Россия) и др. (Pekov et al., 2012). Блёдит вместе с другими сульфатами был установлен в составе сульфатных и сульфатно-силикатных расплавных включений в хромдиопсиде щелочно-ультраосновного массива Инагли, Якутия (Наумов и др., 2008).
В значительных количествах блёдит в составе других сульфатных солей накапливается как естественный побочный продукт переработки неметаллических полезных ископаемых, например, на севере Чили (Ushak et al., 2014; Gutierrez et al., 2016; Gutierrez et al., 2017). Кроме того сульфаты калия, натрия, магния входят наряду с углеводородами и полимерами в состав солевых растворов, обеспечивающих гидроразрыв несущих пластов при добыче нефти и газа сланцевых месторождений, и которые в качестве возвратных растворов возвращаются на поверхность, ухудшая экологическую обстановку региона (Bhattacharia et al., 2015а, 2015б).
Изучение фазовых равновесий в многокомпонентной солевой системе Na+−K+−Mg2+−Ca2+−Cl−−(SO4)2−−H2O, включающей водные сульфатные соли натрия, калия и магния, является актуальной задачей утилизации токсичных отходов, изучения процессов образования природных эвапоритовых отложений (Wollman, Voigt, 2010), а также интерпретации данных о минеральном солевом составе Марса, где были обнаружены компоненты исследуемой солевой системы (Peterson, Wang, 2006; Chipera, Vaniman, 2007). Для построения термодинамической модели, описывающей равновесия в этой системе, требуются надежные термодинамические данные, наличие которых в настоящее время ограничено, в том числе и для кристаллических водных сульфатов натрия, калия и магния.
Имеющиеся публикации по физико-химическому изучению блёдита посвящены определению структуры и уточнению параметров элементарной ячейки этого минерала (Руманова, Малицкая, 1959; Wyckoff, 1963; Hawthorne, 1985; Vizcayno, Garcia-Gonzalez, 1999; Stoilova, Wildner, 2004; Comodi et al., 2014, 2017) и исследованию методами инфракрасной спектроскопии и спектроскопии комбинационного рассеяния света (Stoilova, Wildner, 2004; Lane, 2007; Jentzsch et al., 2011; Lindström et al., 2016; Cabestrero et al., 2018). Изучение процесса дегидратации блёдита было выполнено на природном образце в работе (Balić-Žunić et al., 2016) и на синтетическом его аналоге в (Ushak et al., 2014; Gutierrez et al., 2017), однако результаты, представленные авторами, не согласуются между собой. Литературные данные по термодинамическим свойствам блёдита ограничиваются оценочными величинами энтальпии и энергии Гиббса образования (Harvie et al., 1984; Bhattacharia et al., 2015б).
В настоящей работе проведено термическое и термохимическое изучение природного водного сульфата натрия и магния − блёдита.
МЕТОДЫ ИССЛЕДОВАНИЯ
Изучен образец блёдита из отложений соленого озера Бай-Шагыр (Астраханская губерния, Россия) из фондов Минералогического музея им. А.Е. Ферсмана РАН (№ 20 355), поступивший в фонды в 1907 г.
Рентгенографическое изучение проведено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 1.790300 Å). Сбор данных осуществлялся в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора, угол захвата которого составлял 5° по углу 2Θ с шириной канала 0.02°.
Химический анализ выполнен на электронно-зондовом микроанализаторе “Camebax-microbeam” (Франция) c энергодисперсионным Si(Li)-детектором и системой анализа INCA Energy Oxford (ускоряющее напряжение 20 кВ, ток пучка 30 нА).
ИК-спектроскопическое исследование проведено на Фурье-спектрометре “ФСМ-1201” (ЛОМО, Россия) в диапазоне от 400 до 4000 см–1 с точностью определения частот ±1 см–1. Образцы были приготовлены в виде суспензии в вазелиновом масле, съемка проводилась на воздухе при комнатной температуре в режиме пропускания.
КР-спектроскопическое изучение выполнено на Рамановском микроскопе “EnSpectr R532” (Россия). Длина волны лазерного излучения составляла 532 нм, выходная мощность луча – около 16 мВт, голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение составляло 6 см–1, диаметр фокального пятна – около 5 мкм при 40-кратном увеличении. Спектры получены для неориентированных образцов в интервале от 100 до 4000 см–1 с экспозицией 1 с и усреднением по 50–100 экспозициям.
Термическое поведение минерала от комнатной температуры до Т = 670 K изучено на термовесах “NETZSCH TG 209 F1” (Германия) и ди-фференциальном сканирующем калориметре “NETZSCH DSC 204 F1” (Германия) в потоке азота (40 мл мин–1) со скоростью нагревания 10 K мин–1.Термогравиметрическое исследование выполнено на образце массой 22.77 (±2 × 10−5) мг. Термовесы были откалиброваны по температуре плавления стандартных веществ (Ag, Al, Bi, In, Sn 99.999% чистоты). Калибровку дифференциального сканирующего калориметра проводили согласно рекомендациям стандартов ASTM E967 и ASTM E2253. Измерения проводили в стандартных алюминиевых контейнерах с проколотой крышкой; масса образца составляла 5.63 мг.
Термохимическое определение энтальпии образования блёдита проведено на высокотемпературном теплопроводящем микрокалориметре Тиана-Кальве “SETARAM” (Франция) методом растворения в расплаве состава 2PbO ⋅ B2O3. Эксперименты осуществляли следующим образом: образцы массой 3.5–5.5 (±2 × 10–3) мг сбрасывали от комнатной температуры в расплав–растворитель, находящийся в калориметре при T = 973 K, при этом измеряемый тепловой эффект состоял из приращения энтальпии минерала и энтальпии его растворения ΔH = [H 0(973 K)−H 0(298.15 K) + + ΔраствH 0(973 K)] (Киселева и Огородова, 1983). При проведении 6–8 экспериментов в порции расплава массой 30–35 г соотношение растворенное вещество−растворитель могло быть отнесено к бесконечно разбавленному раствору с близкой к нулю энтальпией смешения. Микрокалориметр калибровали по приращению энтальпии эталонного вещества – платины, необходимые термохимические данные для которой заимствовали из (Robie, Hemingway, 1995).
Электронно-зондовый микроанализатор “Camebax-microbeam” установлен в Минералогическом музее имени А.Е. Ферсмана РАН; порошковый дифрактометр “STOE-STADI MP”, инфракрасный Фурье-спектрометр “ФСМ-1201”, рамановский микроскоп “EnSpectr R532” и микрокалориметр Тиана-Кальве “Сетарам” установлены на геологическом факультете МГУ имени М.В. Ломоносова; термовесы “NETZSCH TG 209 F1” и дифференциальный сканирующий калориметр “NETZSCH DSC 204 F1” – на химическом факультете МГУ имени М.В. Ломоносова.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика образца
Образец представляет собой мелко-среднезернистый плотный агрегат бесцветных прозрачных кристаллов блёдита без видимых механических и газово-жидких включений.
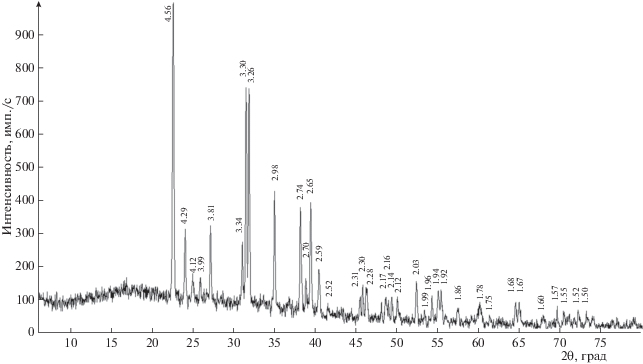
Рентгендифракционный спектр изученного минерала (рис. 1) согласуется с данными ICDD (2013) № 88-1789 для блёдита и № 71-0307 для синтетического аналога.
По данным микрозондового анализа изученный минерал имеет следующий состав (мас. %): MgO 12.22; FeO 0.04; Na2O 17.82; SO3 48.47. Содержание воды было получено по данным термогравиметрического анализа и составило 21.5%. Химическая формула, рассчитанная на 4 заряда, Na1.96Mg1.04(SO4)2.02 ⋅ 4.04H2O близка к теоретической Na2Mg(SO4)2 ⋅ 4H2O, на которую были проведены расчеты полученных в работе термодинамических констант.
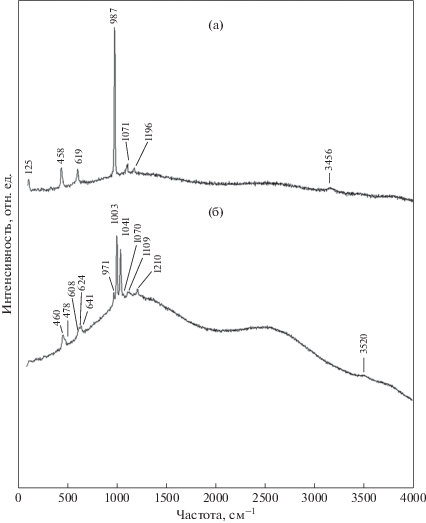
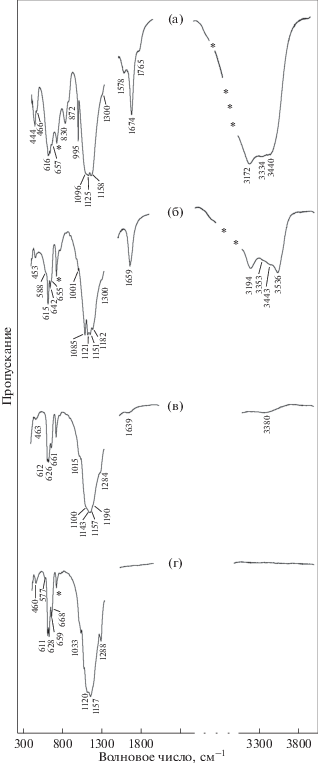
Спектр инфракрасного поглощения блёдита (рис. 2а) согласуется со спектром природного образца из Калифорнии, США (спектр № S244 (Chukanov, 2014)).
Рис. 2.
Спектры ИК-поглощения блёдита (а) и продуктов его нагревания до Т = 460 K (б), Т = 560 K (в) и Т = 650 K (г).
Спектр комбинационного рассеяния изученного минерала (рис. 3а) согласуется со спектрами блёдита, приведенными в базе данных RRUFF (RRUFF project) образец R050317 и в работах (Jentzsch et al., 2011; Lindström et al., 2016; Cabestrero et al., 2018).
Термическое изучение
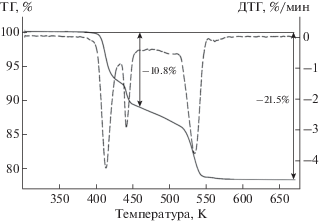
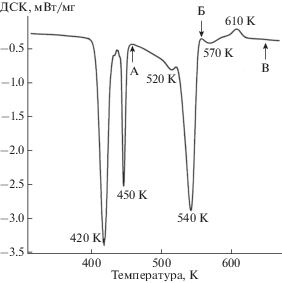
Результаты термогравиметрического анализа представлены на рис. 4. Кривые ТГ и ДТГ демонстрируют ступенчатую дегидратацию блёдита, который начинает терять массу с существенной скоростью при Т = 390 K и заканчивает при Т = = 580 K. В интервале температур 390–460 K потеря массы составила 10.8% (~2 молекулы воды), удаление оставшейся воды (еще 2-х молекул) произошло в интервале 460–580 K (10.7%). На кривой дифференциального термического анализа (ДСК) (рис. 5) зафиксированы соответствующие эндотермические эффекты, сопровождающие процесс дегидратации: первый − с двумя максимумами при Т = 420 и 450 K, второй – с максимумом при Т = 540 K и плечом при Т = 520 K, третий – с максимумом при Т = 570 K и экзотермический эффект в интервале 590–625 K с максимумом при Т = 610 K.
Для интерпретации результатов термического анализа были проведены ИК- и КР-спектроскопические и рентгенографическое исследования продуктов поэтапного обезвоживания блёдита. На ИК-спектре (рис. 2б) образца, нагретого до T = 460 K (точка А на рис. 5), зафиксировано удаление части воды и образование лёвеита, для идентификации которого были использованы данные для образца лёвеита № S379 из (Chukanov, Chervonnyi, 2016). Спектр комбинационного рассеяния (рис. 3б) продукта нагревания при этой температуре также соответствует лёвеиту (Jentzsch et al., 2011). Полученные нами результаты согласуются с данными работы (Balić-Žunić et al., 2016), в которой замещение блёдита лёвеитом подтверждено данными рентгенофазового анализа. На основании приведенных результатов реакция дегидратации на этом этапе может быть написана в следующем виде:
(1)
$\begin{gathered} \mathop {{\text{7N}}{{{\text{a}}}_{{\text{2}}}}{\text{Mg}}{{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{2}}}\limits_{{\text{блёдит }}} \, \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \mathop {{\text{N}}{{{\text{a}}}_{{{\text{12}}}}}{\text{M}}{{{\text{g}}}_{{\text{7}}}}{{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{{{\text{13}}}}}}\limits_{{\text{лёвеит}}} \cdot 15{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} + 13{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $В связи с малым содержанием сульфата натрия в продукте термического разложения блёдита (~6 мас. %) спектры комбинационного рассеяния и инфракрасного поглощения, соответствующие этому веществу на данном этапе нагревания, не могут быть выделены, поскольку перекрываются спектрами лёвеита. Обнаруженный на кривой ДСК эндотермический эффект при Т = 520 K (рис. 5), вероятно, связан с обратимым полиморфным превращением орторомбического сульфата натрия в гексагональный согласно справочным данным (Термодинамические свойства индивидуальных веществ, 1982; Robie, Hemingway, 1995). ИК-спектр (рис. 2в) образца, нагретого до Т = 560 K (точка Б на рис. 5), зафиксировал начало образования новой фазы и незначительное количество остаточной воды. ИК-спектр (рис. 2г) прокаленного при Т = 650 K образца, т.е. после экзотермического эффекта (точка В на рис. 5), показал наличие хорошо окристаллизованной безводной сульфатной фазы. Рентгендифракционный спектр (рис. 6) этой фазы позволил диагностировать продукт разложения блёдита как соединение состава Na2Mg2(SO4)3 в соответствии с (Balić-Žunić et al., 2016). Реакция дегидратации и термического разложения на этом этапе может быть записана следующим образом:
(2)
$\begin{gathered} \mathop {{\text{N}}{{{\text{a}}}_{{{\text{12}}}}}{\text{M}}{{{\text{g}}}_{{\text{7}}}}{{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{{{\text{13}}}}}{{{\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}}_{{15}}}}\limits_{{\text{лёвеит}}} \to \\ \to 3{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{M}}{{{\text{g}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + \mathop {{\text{N}}{{{\text{a}}}_{{\text{6}}}}{\text{Mg}}{{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{4}}}\limits_{{\text{вантгоффит}}} \, + 15{{{\text{H}}}_{{\text{2}}}}{\text{O }}. \\ \end{gathered} $Рис. 6.
Рентгенограмма продукта разложения блёдита Na2Mg2(SO4)3. Межплоскостные расстояния даны в ангстремах.
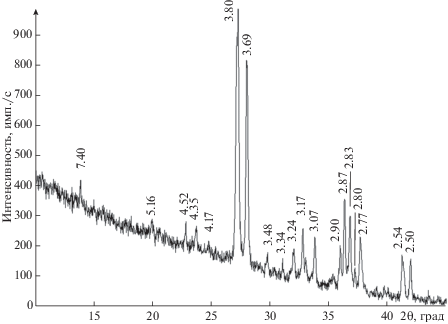
Вантгоффит, зарегистрированный в (Balić-Žunić et al., 2016) на рентгенограмме продукта разложения, нами не был обнаружен ни на порошкограмме (рис. 6) и ни в спектре ИК-поглощения (рис. 2г), по-видимому, из-за недостаточного для кристаллизации вантгоффита времени в ходе термического анализа. Как отмечается авторами работы (Balić-Žunić et al., 2016), для однозначного определения этого минерала методом порошковой рентгеновской дифракции ими было проведено дополнительное прокаливание образца в печи.
Термохимическое изучение
Энтальпия образования блёдита. Среднее значение из 7 измерений на микрокалориметре суммарного теплового эффекта ΔH = [H 0(973 K) − ‒ H 0(298.15 K) + Δраств.H 0(973 K)] составляет для блёдита 1684.3 ± 17.3 Дж/г = 563.4 ± 5.8 кДж/моль (М = 334.48 г/моль); погрешности рассчитывались с вероятностью 95%.
С использованием полученных данных по растворению было рассчитано значение стандартной энтальпии образования из элементов изученного водного сульфата натрия и магния на основании реакции (3), уравнений (4) и (5).
(3)
$\begin{gathered} {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + {\text{MgO}} + {\text{8/3Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + 2{\text{CaS}}{{{\text{O}}}_{4}} = \\ = {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{Mg}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 8{\text{/}}6{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $(4)
$\begin{gathered} {{\Delta }_{{{\text{р - ции(1)}}}}}{{H}^{0}}\left( {298.15{\text{ K}}} \right) = \\ = \Sigma {{\nu }_{i}}\Delta H{\text{ком}}{{{\text{п}}}_{i}}--\Delta H{\text{минерала}}, \\ \end{gathered} $(5)
$\begin{gathered} {{\Delta }_{f}}H_{{el}}^{0}(298.15\,{\text{K}}){\text{минерала}} = \\ = {{\Delta }_{{{\text{р - ции}}\left( {\text{1}} \right)}}}{{H}^{0}}(298.15\,{\text{K}})\, + \,\Sigma {{\nu }_{i}}{{\Delta }_{f}}H_{{el}}^{0}({\text{298}}{\text{.}}{\text{15}}\,{\text{K}}){\text{ком}}{{{\text{п}}}_{i}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпий образования блёдита и леонита (кДж/моль)
| Компонент | ΔHа | $ - {{\Delta }_{f}}H_{{el}}^{0}$(928.15 K)б |
|---|---|---|
| Na2O(к.) | −111.8 ± 0.8в | 414.8 ± 0.3 |
| K2O(к.) | −193.7 ± 1.1в | 363.2 ± 2.1 |
| MgO(периклаз) | 36.38 ± 0.59г | 601.6 ± 0.3 |
| CaO(к.) | −21.78 ± 0.29д | 635.1 ± 0.9 |
| Al2O3(корунд) | 107.38 ± 0.59е | 1675.7 ± 1.3 |
| CaSO4(ангидрит) | 131.3 ± 1.6ж | 1434.4 ± 4.2 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9з | 1293.1 ± 1.2 |
Примечания. аΔH = [H0(973 К) – H0(298.15 К) + ΔраствH0(973 К)]. б Справочные данные (Robie, Hemingway, 1995). в По данным (Kiseleva et al., 2001). г–ж Рассчитано с использованием справочных данных по [H0(973 К) – H0(298.15 К)] (Robie, Hemingway, 1995) и экспериментальных данных по растворению Δраств.H0(973 К): г (Navrotsky, Coons, 1976), д (Киселева и др., 1979), е (Ogorodova et al., 2003), ж (Котельников и др., 2000). з По данным (Огородова и др., 2011).
Таблица 2.
Термодинамические свойства блёдита и леонита, полученные в настоящей работе
| Состав минерала | $ - {{\Delta }_{f}}H_{{el}}^{0}$ (298.15 K), кДж/моль | S0(298.15 K), Дж/(K моль) | $ - {{\Delta }_{f}}G_{{el}}^{0}$ (298.15 K), кДж/моль |
|---|---|---|---|
| Na2Mg(SO4)2 · 4H2O блёдит |
3845 ± 13 | 412.7 | 3385 ± 13 |
| K2Mg(SO4)2 · 4H2O леонит |
3929 ± 13 | 426.8 | 3466 ± 13 |
Энергия Гиббса образования блёдита. Для расчета значения энергии Гиббса образования из элементов необходима отсутствующая в литературе величина его стандартной энтропии. Оценку проводили по методу Латимера с учетом усредненных значений энтропий, приходящихся на катионы и анионы в твердых веществах, и энтропийного вклада гидратной воды (Наумов и др., 1971). С использованием оцененной величины S0(298.15 K) и определенной в настоящей работе энтальпии образования было рассчитано значение ${{\Delta }_{f}}G_{{el}}^{0}$(298.15 K) блёдита (табл. 2).
Термодинамические свойства леонита. Наряду с блёдитом характерным минералом солевых морских отложений на Земле является также и леонит. Среди двойных сульфатных солей с катионами K, Na и Mg эти соединения считаются важными представителями сульфатных минералов в составе других планет с высоким содержанием серы (Balić-Žunic et al., 2016). Леонит является калиевым гомологом блёдита, близкие кристаллические структуры которых имеют схожее кластерное строение: кластеры [Mg(SO4)2(H2O)4] образуют слои, связанные щелочными катионами (Hawthorne, 1985; Hawthorne et al., 2000).
Используя полученные данные по растворению изученного блёдита, мы рассчитали энтальпию образования из элементов леонита K2Mg(SO4)2 ⋅ 4H2O, калориметрическое изучение которого затруднено из-за практической невозможности отбора мономинеральной фракции этого минерала для исследования. Экспериментальные данные по растворению блёдита были пересчитаны на молекулярную массу леонита (M = = 366.70 г/моль). Расчет значения ${{\Delta }_{f}}H_{{el}}^{0}$(298.15 K) проводили по реакции, аналогичной (3). Оценку стандартной энтропии также проводили по методу Латимера. Основываясь на полученных величинах энтальпии образования и энтропии, мы рассчитали значение стандартной энергии Гиббса образования леонита из элементов (табл. 2).
Полученные в настоящей работе значения энтальпий и энергий Гиббса образования блёдита и леонита могут быть использованы при построении термодинамической модели образования водных сульфатов как в земных условиях, так и в условиях других планет.
Работа выполнена при поддержке Российского Фонда Фундаментальных Исследований (грант № мк 18-29-12128).
Список литературы
Киселева И.А., Огородова Л.П. (1983) Об использовании высокотемпературной калориметрии растворения для определения энтальпий образования гидроксил-содержащих минералов (на примере талька и тремолита). Геохимия (12), 1745-1755.
Киселева И.А., Огородова Л.П., Топор Н.Д., Чигарева О.Г. (1979) Термохимическое исследование системы СаО–MgO–SiO2. Геохимия (12), 1811-1825.
Котельников А.Р., Кабалов Ю.К., Зезюля Т.Н., Мельчакова Л.В., Огородова Л.П. (2000) Экспериментальное изучение твердого раствора целестин–барит. Геохимия (12), 1286-1293.
Kotel’nikov A.R., Kabalov Yu.K., Zezyulya T.N., Mel’chakova L.V., Ogorodova L.P. (2000) Experimental study of celestine–barite solid solution. Geochem. Intern. 38(12), 1181-1187.
Наумов В.Б., Каменецкий В.С., Томас Р.Р., Кононкова Н.Н., Рыженко Б.Н. (2008). Включения силикатных и сульфатных расплавов в хромдиопсиде Инаглинского месторождения (Якутия, Россия). Геохимия (6), 603-614.
Naumov V.B., Kamenetsky V.S., Tomas R.R., Kononkova N.N., Ryzhenko B.N. (2008) Inclusions of silicate and sulphate melts in the chrome-diopside of the Inaglinskoye deposit (Yakutia, Russia). Geochem. Intern. 46(6), 554-564.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин (для геологов). М.: Атомиздат, 239 с.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ (9), 1609-1611. Ogorodova L.P., Kiseleva I.A., Mel’chakova L.V., Vigasina M.F., Spiridonov E.M. (2011) Calorimetric determination of the enthalpy of formation for pyrophyllite. Russ. J. Phys. Chem. A85(9), 1492-1494.
Руманова Н.М., Малицкая Г.И. (1959) Уточнение структуры астраханита методом фазовых взвешенных проекций. Кристаллография 4(4), 523-525.
Термодинамические свойства индивидуальных веществ (1982) Т. IV, кн. 2, М.: Наука, 559 с.
Balić-Žunić T., Birkedal R., Katerinopoulou A., Comodi P. (2016) Dehydration of blödite, Na2Mg(SO4)2(H2O)4, and leonite, K2Mg(SO4)2(H2O)4. Eur. J. Mineral. 28, 33-42.
Bhattacharia S.K., Hossain N., Chen C.-C. (2015a) Thermodynamic modeling of aqueous Na+−K+−Cl−−${\text{SO}}_{4}^{{2 - }}$ quaternary system with electrolyte NRTL model. Fluid Phase Equilib. 403, 1-9.
Bhattacharia S.K., Tanveer S., Hossain N., Chen C.-C. (2015б) Thermodynamic modeling of aqueous Na+−K+−Mg2+−${\text{SO}}_{4}^{{2 - }}$ quaternary system. Fluid Phase Equilib. 404, 141-149.
Cabestrero Ó., del Buey P., Sanz-Montero M.E. (2018) Biosedimentary and geochemical constraints on the precipitation of mineral crusts in shallow sulphate lakes. Sedimentary Geol. 366, 32-46.
Chipera S.J., Vaniman D.T. (2007) Experimental stability of magnesium sulfate hydrates that may be present on Mars. Geochim. Cosmochim. Acta 71, 241-250.
Chukanov N.V. (2014) Infrared Spectra of Mineral Species: Extended Library. Springer-Verlag GmbH, Dordrecht–Heidelberg–New York–London, 1703 p.
Chukanov N.V., Chervonnyi A.D. (2016) Infrared Spectroscopy of Minerals and Related Compounds. Springer Cham, Heidelberg–New York–Dordrecht–London, 1109 p.
Comodi P., Nazzareni S., Balić-Žunić T., Zuccini A., Hanfland M. (2014) The high-pressure behavior of bloedite: A synchrotron single X-ray diffraction study. Am. Mineral. 99, 511-518.
Comodi P., Stagno V., Zucchini A., Fei Y., Prakapenka V. (2017) The compression behavior of blödite at low and high temperature up to ~10 GPa: Implications for the stability of hydrous sulfates on icy planetary bodies. Icarus 285, 137-144.
Gutierrez A., Miró L., Gil A., Rodríguez-Aseguinolaza J., Barreneche C., Calvet N., Py X., Fernández A.I., Grágeda M., Ushak S., Cabeza L.F. (2016) Advances in the valorization of waste and by-product materials as thermal energy storage (TES) materials. Renew. Sust. Energy Rev. 59, 763-783.
Gutierrez A., Ushak S., Mamani V., Vargas P., Barreneche C., Cabeza L.F., Grágeda M. (2017) Characterization of wastes based on inorganic double salt hydrates as potential thermal energy storage materials. Sol. Energy Mater. Sol. Cells 170, 149-159.
Harvie C.E., Møller N., Weare J.H. (1984) The prediction of mineral solubilities in natural water: The Na–K–Mg–Ca–H–Cl–SO4–OH–HCO3–CO3–CO2–H2O system to high ionic strengths at 25°C. Geochim. Cosmochim. Acta 48, 723-751.
Hawthorne F.C. (1985) Refinement of the crystal structure of bloedite: structural similarities in the [VIM(IVTΦ4)2Φn] finite-cluster minerals. Can. Mineral. 23, 669-674.
Hawthorne F.C., Krivovichev S.V., Burns P.C. (2000) The Crystal Chemistry of Sulfate Minerals in “Sulfate minerals: crystallography, geochemistry, and environmental significance” (Alpers C.N., Jambor J.L., Nordstrom D.K., eds.) Rev. Mineral. Geochem., 40, 608 p.
ICDD (2013) The International Centre for Diffraction Data, http: //www.icdd.com.
Jentzsch P.V., Kampe B., Rösch P., Popp J. (2011) Raman spectroscopic study of crystallization from solutions containing MgSO4 and Na2SO4: Raman spectra of double salts. J. Phys. Chem. A 115(22), 5540-5546.
Kiseleva I.A., Navrotsky A., Belitsky I.A., Fursenko B.A. (2001) Thermochemical study of calcium zeolites – heulandite and stilbite. Am. Mineral. 86, 448-455.
Lane M.D. (2007) Mid-infrared emission spectroscopy of sulfate and sulfate-bearing minerals. Am. Mineral. 92, 1-18.
Lindström N., Talreja T., Linnow K., Stahlbuhk A., Steiger M. (2016) Crystallization behavior of Na2SO4−MgSO4 salt mixtures in sandstone and comparison to single salt behavior. Appl. Geochem. 69, 50-70.
Navrotsky A., Coons W.J. (1976) Thermochemistry of some pyroxenes and related compounds. Geochim. Cosmochim. Acta 40, 1281-1295.
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta 403, 251-256.
Pekov I.V., Zelenski M.E., Zubkova N.V., Ksenofontov D.A., Kabalov Y.K., Chukanov N.V., Yapaskurt V.O., Zadov A.E., Pushcharovsky D.Y. (2012) Krasheninnikovite, KNa2CaMg(SO4)3F, a new mineral from the Tolbachik volcano, Kamchatka, Russia. Am. Mineral. 97, 1788-1795.
Peterson R.C., Wang R. (2006) Crystal Molds on Mars: Melting of a possible new mineral species to create Martian chaotic terrain. Geology: 34: 957-960.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U.S. Geol. Surv. Bull. 2131, 461 p.
RRUFF project. Database of Raman spectroscopy, X-ray diffraction and chemistry of minerals, http://www.rruff.info/
Stoilova D., Wildner M. (2004) Blödite-type compounds Na2Me(SO4)2 ⋅ 4H2O (Me = Mg, Co, Ni, Zn): crystal structures and hydrogen bonding systems. J. Mol. Struct. 706, 57-63.
Ushak S., Gutierrez A., Flores E., Galleguillos H., Grageda M. (2014) Development of thermal energy Storage materials from waste-process salts. Energy Procedia 57, 627-632.
Vizcayno C., Garcia-Gonzalez M.T. (1999) Na2Mg(SO4)2 ⋅ 4H2O, the Mg end-member of the bloedite-type of mineral. Acta Crystallogr. C 55, 8-11.
Wollmann G., Voigt W. (2010) Solid-liquid phase equilibria in the system K2SO4–MgSO4–H2O at 318 K. Fluid Phase Equilib. 291, 151-153.
Wyckoff R.W.G. (1963) Crystal structures (2nd edition). New York, Interscience, V. 3, 731 p.
Дополнительные материалы отсутствуют.