Геохимия, 2021, T. 66, № 2, стр. 183-190
Кинетико-термодинамическое моделирование кислотного дренажа объединенной технологической пробы с месторождения Павловское (архипелаг Новая Земля, о. Южный). Предварительная оценка
Е. В. Черкасова a, *, М. В. Мироненко a, **, Е. С. Сидкина a, ***
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: wri-lab@geokhi.ru
** E-mail: mironenko@geokhi.ru
*** E-mail: sidkinaes@yandex.ru
Поступила в редакцию 24.10.2019
После доработки 09.01.2020
Принята к публикации 22.01.2020
Аннотация
Для оценки потенциальной угрозы загрязнения окружающей среды при разработке месторождения Павловское проведено кинетико-термодинамическое моделирование взаимодействия объединенной технологической пробы с атмосферными водами. Рассчитано накопление основных (Zn, Pb) и примесных (Cu, Co, Cd, As, Se, Hg, Sb) элементов в водном растворе за летний период. Показано, что водный раствор после взаимодействия с пробой становится сульфатным кальциевым и происходит накопление Zn, Sb, Hg до концентраций, превышающих ПДК.
ВВЕДЕНИЕ
Оценка воздействия на окружающую среду (ОВОС) при разработке рудных сульфидных месторождений обязательно учитывает кислотный дренаж – процесс окисления сульфидных руд отвалов водой в присутствии кислорода воздуха. Реакция окисления пирита выглядит следующим образом: FeS2 + 3.5O2 + H2O = Fe2+ + ${\text{2SO}}_{{\text{4}}}^{{{\text{2}} - }}$ + 2H+. С этим процессом связано не только образование кислых сернокислых растворов, но и растворение в них и возможная последующая миграция микрокомпонетов руд, включая рассеянные в сульфидах тяжелые металлы, для которых установлены жесткие ПДК (ГН 2.1.5.1315-03). Кислотный дренаж на различных месторождениях имеет свои особенности. На его протекание влияют, в первую очередь, составы вмещающих пород и руд, климат, особенности гидрологии. В частности, в работе (Лиманцева и др., 2015) выполнено термодинамическое моделирование кислотного дренажа на месторождении золото–хлорит–сульфидно–кварцевого типа. Были рассчитаны предельные концентрации компонентов в водном растворе в равновесии с итоговой ассоциацией вторичных минералов и показаны резкие различия в составе дренажных растворов в зависимости от того, являются вмещающие породы карбонатными или алюмосиликатными.
Для ОВОС на месторождениях разработаны различные стандартные методики модельных лабораторных тестов на кислотный дренаж (Blowes et al., 2003). Основным результатом таких тестов является измерение рН раствора и концентраций компонентов в растворах в течение экспериментов. К недостаткам модельных экспериментов следует отнести их недостаточную продолжительность по времени, а также то обстоятельство, что они отражают лишь суммарный результат многих взаимодействующих между собой химических процессов и, таким образом, не способны предсказать влияние каких-либо изменений в системе на протекание процесса.
Ранее (Лиманцева и др., 2019) проводилось термодинамическое моделирование кислотного дренажа на месторождении Павловское в зависимости от интенсивности водообмена, которая имитировалась изменением соотношения вода/порода (W/R) в системе. В работе показано, что при уменьшении соотношения W/R происходит экспоненциальный рост концентраций загрязняющих элементов в водных растворах, сделан вывод о целесообразности применения равновесно-кинетического моделирования кислотного дренажа.
В данной работе рассчитано изменение химического состава водного раствора и масс первичных и новообразованных минералов во времени для ситуации, когда вода находится в контакте с минералами объединенной технологической пробы месторождения Павловское, а также сделан термодинамический и кинетический анализ полученных результатов с целью оценки полноты учета химических взаимодействий, существенно влияющих на миграцию и фиксацию загрязняющих компонентов.
КРАТКОЕ ОПИСАНИЕ МЕСТОРОЖДЕНИЯ
Полиметаллическое месторождение Павловское расположено на о. Южный архипелага Новая Земля. Период оттаивания снега и таяния ледников продолжается не более трех месяцев в году. Месторождение локализовано в осадочных породах палеозоя, на участке сочленения одной из наиболее крупных структур Пайхойско-Новоземельской складчатой области – Северноновоземельского антиклинория с сопредельными отрицательными структурами – Баренцевским синклинорием и Кармакульским перегибом, а также в зоне влияния крупных региональных разрывных нарушений – Главного Новоземельского разлома и Байдарацкого глубинного разлома древнего заложения. Интрузивные образования имеют ограниченное распространение и представлены двумя фазами базитового магматизма: силлами и дайками габбро-диабазов позднего девона и субщелочными долеритами мезозоя. Главной продуктивной толщей является грибовская свита органогенных известняков нижнего девона. Рудные тела слагают линзообразные залежи среди известняков и песчаников в сводах и на крыльях антиклинальных структур, а также секущие жилы и тела со сложной морфологией (Губина, 2000).
Моделирование производилось на основе минерального состава объединенной технологической пробы месторождения, приведенного в (Козырьков и др., 2016). Он пересчитан нами в моль/кг руды (табл. 1). Главными рудными минералами являются сфалерит, галенит и пирит, в качестве акцессорных минералов отмечаются халькопирит, пирротин, миаргирит, пираргирит, буланжерит, геокронит, грейтонит, шульцит. Нерудные жильные минералы представлены кальцитом, доломитом, кварцем. Размер зерен минералов в пробе варьировал от 0.01 до 1 мм. Для расчетов принят средний размер 0.1 мм.
Таблица 1.
Минеральный состав объединенной технологической пробы месторождения Павловское по (Козырьков и др., 2016)
| Минерал | Химическая формула | Мас. % | моль/кг |
|---|---|---|---|
| Пирит | FeS2 | 38.13 | 3.178292 |
| Галенит | PbS | 1.05 | 0.043828 |
| Сфалерит | ZnS | 6.67 | 0.684799 |
| Кальцит | CaCO3 | 16.68 | 1.666805 |
| Доломит | CaMg(CO3)2 | 16.68 | 0.904689 |
| Кварц | SiO2 | 17.16 | 2.855868 |
| Мусковит | KAl3Si3O12H2 | 0.95 | 0.023933 |
| Дафнит | Fe5Al2Si3O18H8 | 0.48 | 0.00668 |
| Клинохлор | Mg5Al2Si3O18H8 | 0.48 | 0.008576 |
| Альбит | NaAlSi3O8 | 0.96 | 0.036354 |
| Органическое в-во | C16H10 | 0.76 | 0.037707 |
Пирит, по данным (Козырьков и др., 2016) содержит значительные концентрации следующих элементов-примесей (мас. %): As (0.14), Sb (0.02), Se (0.01), Cu (0.01), Cd (0.1), Co (0.04), Pb (0.3), Zn (0.02); галенит (мас. %): Ag (100–200 г/т), Sb (0.14), Se (<0.01), Hg (0.03), Cu (0.01), Co (<0.01). Химический состав сфалерита соответствует стехиометрии этого минерала, основные элементы-примеси (мас. %): Cd (0.12–0.29), Fe (0.6–1.7%), Pb (0.16–0.35%), Cd (0.2), As (0.01), Hg (<0.01), Co (<0.01).
Равновесно-кинетическое моделирование предполагает, что примесные химические элементы поступают в водный раствор по мере растворения минералов-хозяев, поэтому их содержания были пересчитаны в химические формулы этих минералов. Например, галенит имеет состав (Pb0.995Co0.0002Cu0.00038Hg0.00036)(S1.0Sb0.00277Se0.00015)
МЕТОДИКА МОДЕЛИРОВАНИЯ
Кинетико-термодинамическое моделирование химических взаимодействий технологической пробы полиметаллического месторождения с поверхностной водой было проведено для условий равновесия с атмосферой. Учитывались: скорость окислительного растворения пирита, галенита и сфалерита, скорость окисления Fe(II) при атмосферном давлении кислорода и переменном рН, скорости растворения жильных минералов в условиях меняющейся кислотности. Рассчитано выпадение вторичных минералов. Учитывалось возможное соосаждение кадмия с новообразованным кальцитом.
Кинетико-термодинамическая модель необратимых химических взаимодействий в системе “вода–порода” описана в (Мироненко, Золотов, 2013). Она базируются на принципе частичного равновесия (Helgeson et al., 1970), который сводится к следующим допущениям: наиболее медленными химическими взаимодействиями в системе являются реакции растворения минералов; гомогенные реакции в растворе протекают практически мгновенно; реакции осаждения протекают быстро и контролируются насыщением. Моделирование заключается в последовательном расчете серии частичных равновесий в системах, валовый химический состав которых рассчитывается из состава водного раствора с предыдущего шага по времени и масс минералов, растворившихся за время Δt. Кинетика растворения большинства минералов при постоянном рН описывается реакциями псевдо-нулевого порядка (Brantley, 2004). Кинетику окислительного растворения сульфидов при постоянных рН и концентрации растворенного кислорода ${{m}_{{{{{\text{O}}}_{2}}}}}$ также можно описать реакциями псевдо-нулевого порядка, например (Williamson, Rimstidt, 1994). Для того, чтобы изменение рН на каждом шаге по времени было несущественным, его продолжительность Δt должна быть достаточно малой, она регулируется автоматически.
ПРОГРАММНАЯ РЕАЛИЗАЦИЯ, ВХОДНЫЕ ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ ДАННЫЕ
Термодинамико-кинетическая модель реализована на основе комплекса GEOCHEQ_M (Мироненко и др., 2008). Основу базы термодинамических данных составляет известная база SUPCRT92 (Johnson et al., 1992) с многочисленными дополнениями. В базу, для наиболее важных силикатов, алюмосиликатов, карбонатов, оксидов введены значения кинетических параметров для расчета скоростей конгруэнтного растворения минералов в зависимости от рН при различных температурах.
Для расчета скорости реакций окислительного растворения пирита, галенита и сфалерита взято уравнение для скорости растворения пирита из (Williamson and Rimstidt, 1994): r = 10–8.19(±0.10)$\frac{{m_{{DO}}^{{0.5( \pm 0.04)}}}}{{m_{{{{{\text{H}}}^{ + }}}}^{{0.11( \pm 0.01)}}}},$ где r – скорость растворения для 25°С, моль м–2 с–1; mDO – моляльность растворенного О2, ${{m}_{{{{{\text{H}}}^{ + }}}}}$ – моляльность иона Н+. Уравнение применимо для широкого диапазона концентраций растворенного кислорода и интервала рН 2–10. Энергия активации реакции равна 57.9 ± 7.5 кДж/моль (McKiblen, Barnes, 1986). Учтена также кинетика окисления растворенного Fe2+ кислородом: –d[Fe(II)]/dt = = k[Fe(II)][O2][OH–]2. Константы скорости реакции взяты из (Millero et al., 1987).
Программа расчета взаимодействий содержит рутины, которые готовят входные данные для расчета частичных равновесий на каждом шаге по времени: текущие площади поверхности минералов, и текущие скорости их растворения, оптимальный шаг по времени и, в конечном итоге, материальный баланс системы для расчета точечного химического равновесия.
ОПИСАНИЕ СИСТЕМЫ
Расчет химических взаимодействий производился в системе O–H–K–Mg–Ca–Al–C–Si–S–Na–Fe–Co–Cu–Zn–Cd–Pb–As–Hg–Sb, открытой в отношении атмосферных О2 и СО2. Список рассматриваемых частиц водного раствора и минералов представлен в табл. 2. Первичные минералы пробы выделены жирным шрифтом. Мы по возможности стремились охватить наиболее важные химические взаимодействия в системе. После изучения результатов расчетов выяснилось, что это удалось далеко не для всех нормируемых химических элементов.
Таблица 2.
Минералы и частицы водного раствора, учтенные при моделировании
| Минералы | Растворенные частицы | Газовая фаза | ||||
|---|---|---|---|---|---|---|
| Пирит | HgO | H2O | CaCO3,aq | HCu${\text{O}}_{2}^{ - }$Fe2+ | PbO,aq | CO2,g |
| Галенит | Иллит | H+ | CaHSi${\text{O}}_{3}^{ + }$ | Fe3+ | PbOH+ | H2O,g |
| Сфалерит | Каолинит | OH– | CaHC${\text{O}}_{3}^{ + }$ | FeO,aq | HPbO2 | O2,g |
| Альбит | Литаргит PbO | H2,aq | CaSO4,aq | Fe${\text{O}}_{2}^{ - }$ | Pb(HS)2,aq | |
| Аморфный кремнезем | Органическое вещество | O2,aq | Cd2+ | FeO+ | Pb(HS)3 | |
| Англезит PbSO4 | Магнезит | Al3+ | CdO,aq | FeOH+ | HS– | |
| Арсенолит As2O3 | Магнетит | AlO+ | Cd${\text{O}}_{2}^{{2 - }}$ | FeOH2+ | S${\text{O}}_{4}^{{2 - }}$ | |
| Азурит Cu3(СО3)2(ОН)2 | Малахит Cu2CO3(ОН)2 | Al${\text{O}}_{2}^{ - }$ | CdOH+ | HFe${\text{O}}_{2}^{ - }$ | HS${\text{O}}_{4}^{ - }$ | |
| Кальцит | Mg-Fe-сапонит | AlOH2+ | HCd${\text{O}}_{2}^{ - }$ | HFeO2,aq | HSe– | |
| Cd-кальцит | Микроклин | HAlO2,aq | CdSO4, aq | Hg2+ | HSe${\text{O}}_{3}^{ - }$ | |
| Отавит CdCO3 | Ca-монтморилонит | As2S3,aq | Co2+ | Hg22+ | HSe${\text{O}}_{4}^{ - }$ | |
| Церуссит PbCO3 | K-монтморилонит | As2${\text{S}}_{4}^{{2 - }}$ | Co3+ | HgO,aq | Se${\text{O}}_{3}^{{2 - }}$ | |
| Халцедон | Na-монтморилонит | As4${\text{S}}_{7}^{{2 - }}$ | CoO,aq | HHg${\text{O}}_{2}^{ - }$ | Se${\text{O}}_{4}^{{2 - }}$ | |
| Халькопирит CuFeS | Мусковит | As${\text{O}}_{3}^{{3 - }}$ | Co${\text{O}}_{2}^{{2 - }}$ | HgOH+ | H2SeO3,aq | |
| Клаудетит As2O3 | Аурипигмент As2S3 | As${\text{O}}_{4}^{{3 - }}$ | CoOH+ | K+ | Sb(OH)3,aq | |
| Клинохлор | Гидроцеруссит Pb3(CO3)2(OH)2 | HAs${\text{O}}_{4}^{{2 - }}$ | CoOH2+ | KHSO4,aq | Sb(OH$)_{4}^{ - }$ | |
| Гауссманит Co3O4 | Глет PbO2 | HAs${\text{O}}_{3}^{{2 - }}$ | HCo${\text{O}}_{2}^{ - }$ | KS${\text{O}}_{4}^{ - }$ | Sb2${\text{S}}_{4}^{{2 - }}$ | |
| CoO | Кварц | HAs2${\text{S}}_{4}^{ - }$ | CoSO4, aq | Mg2+ | HSb2${\text{S}}_{4}^{ - }$ | |
| Куприт Cu2O | Сенармонтит Sb2S3 | H2As${\text{O}}_{3}^{ - }$ | Cu+ | MgOH+ | H2Sb2S4,aq | |
| Дафнит | Сидерит | H2As${\text{O}}_{4}^{ - }$ | Cu2+ | MgHC${\text{O}}_{3}^{ + }$ | SiO2,aq | |
| Доломит | Смитсонит ZnCO3 | H3AsO3,aq | CuHS,aq | MgSO4,aq | HSi${\text{O}}_{3}^{ - }$ | |
| Fe(OH)3 | Тенорит CuO | H3AsO4,aq | CuO,aq | MgHSi${\text{O}}_{3}^{ + }$ | Zn2+ | |
| Гиббсит | Валентинит Sb2O3 | C${\text{O}}_{3}^{{2 - }}$ | Cu${\text{O}}_{2}^{{2 - }}$ | MgCO3,aq | ZnOH+ | |
| Гетит | Цинкит ZnO | HC${\text{O}}_{3}^{ - }$ | CuOH,aq | Na+ | ZnO,aq | |
| Гипс | CO2,aq | CuOH+ | NaHSiO3,aq | Zn${\text{O}}_{2}^{ - }$ | ||
| Ca2+ | Cu(OH$)_{2}^{ - }$ | NaS${\text{O}}_{4}^{ - }$ | HZn${\text{O}}_{2}^{ - }$ | |||
| CaOH+ | CuSO4, aq | Pb2+ | ZnSO4, aq | |||
Был взят 1 кг объединенной технологической пробы и 1 кг воды, равновесной с атмосферой (${{Р}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ = 0.2 атм., ${{Р}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$ = 3.98 × 10–4 атм.). Зерна всех исходных минералов полагались сферическими диаметром 0.1 мм. Температура принята равной 5°С. Взаимодействия продолжались в течение 90 дней, что немного превышает период сезонного оттаивания на острове. Следует отметить, что, поскольку вода не обновлялась, принятая схема расчетов дает максимально возможные концентрации компонентов в водном растворе. В дальнейшем, если тяжелый металл не выпадает в виде собственной твердой фазы, не сорбируется или не соосаждается с макрокатионами, возможно лишь понижение его концентрации за счет разбавления этого раствора атмосферными осадками и дальнейший поверхностный или подземный сток.
Для свинца были предусмотрены следующие вторичные минералы: англезит, церуссит, гидроцеруссит, глет; для меди – азурит, куприт, малахит, тенорит; для цинка – смитсонит, цинкит; для мышьяка – арсенолит, клаудетит, аурипигмент, для сурьмы – сенармонтит, валентинит; для к-обальта – гаусманит и оксид кобальта(II), для кадмия – очень редкий минерал отавит.
Для учета соосаждения кадмия с карбонатом кальция мы воспользовались моделью твердого раствора. Поскольку при равновесно-кинетическом моделировании необходимо различать твердые растворы, образованные на разных этапах процесса, мы раздробили непрерывные составы раствора на ряд фаз промежуточного постоянного состава Cd-содержащего кальцита: Ca0.99Сd0.01CO3, Ca0.98Сd0.02CO3, …, Ca0.8Сd0.2CO3. При расчете свободных энергий этих промежуточных составов твердый раствор полагался идеальным. Это допущение дает незначительные погрешности в области низких содержаний минала CdCO3 (Papadopoulos, Rowell, 1988).
РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ
Основные результаты расчетов показаны на рисунках. Вначале отметим изменение макрокомпонентного состава раствора. Благодаря заметным содержаниям кальцита и доломита в технологической пробе и достаточно высокой скорости их растворения, кислотность раствора быстро повышается до слабощелочной (рН ≈ 7.9) и остается далее постоянной (рис. 1). Пирит, галенит и сфалерит постепенно растворяются, раствор становится сульфатным. Насыщения раствора в отношении гипса не зафиксировано. Двухвалентное железо в водном растворе окисляется до трехвалентного, выпадает гетит (рис. 2).
Рис. 1.
Рассчитанное изменение макрокомпонентного состава водного раствора в контакте с технологической пробой во времени.
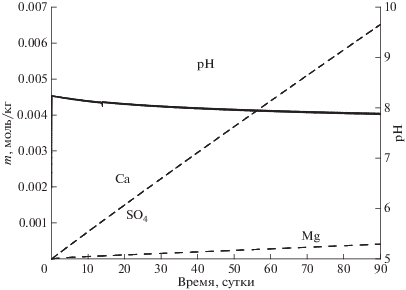
Рис. 2.
Изменение масс растворяющихся кальцита, пирита, сфалерита, галенита и новообразованного гетита во времени.

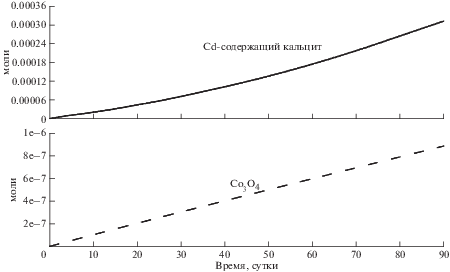
Кобальт, поступающий в раствор по мере растворения пирита, вначале накапливается в нем, пока раствор кислый, затем осаждается в виде практически нерастворимого Co3O4 (рис. 3, 4). Его концентрация в растворе стабилизируется на уровне 1.12 × 10–6 мг/л (1.91 × 10–11 моль/кг).
Рис. 3.
Изменение концентраций некоторых нормируемых компонентов водного раствора в контакте с технологической пробой во времени.
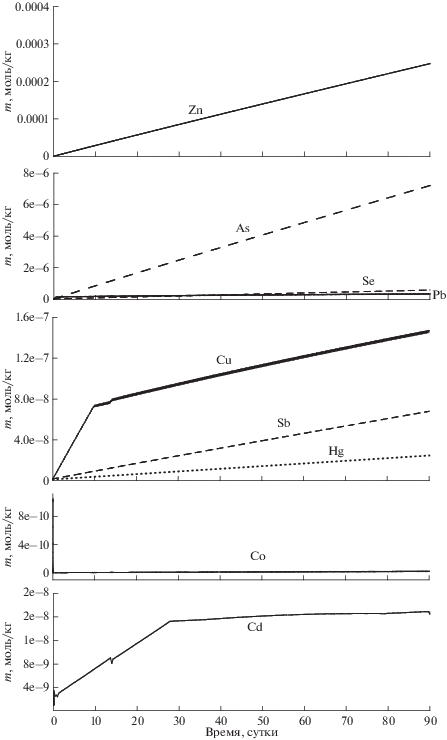
Концентрация кадмия в растворе, благодаря его соосаждению с кальцитом (рис. 3, 4), уже через 30 дней стабилизируется на уровне 2.14 × 10–4–1.86 × 10–3 мг/л (1.90 × 10–9–1.65 × 10–8 моль/кг). Разброс значений объясняется достаточно грубым разбиением твердого раствора (Ca,Cd)CO3 на промежуточные члены. На рис. 3 показаны сглаженные значения содержаний кадмия в растворе. Энергетически более выгодно, чтобы часть кальция из растворенного жильного кальцита вновь отлагалась в виде твердого раствора. При этом следует отметить, что схожая по концентрации фиксация кадмия в твердой фазе должна иметь место и при сорбции кадмия на кальците вмещающих пород и после полного растворения жильного кальцита.
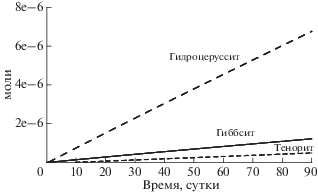
Поступающая в раствор медь (рис. 3), содержащаяся изначально в виде примеси в пирите и галените, быстро откладывается в виде вторичного минерала тенорита (рис. 5). Ее концентрация в растворе стабилизируется на уровне около 9.23 × × 10–3 мг/л (1.45 × 10–7 моль/кг), что значительно ниже ПДК (1 мг/л).
Свинец из галенита и сфалерита соответственно, переоткладываются в виде гидроцеррусита (рис. 5). Концентрация свинца в водном растворе стабилизируется на уровне 9.23 × 10–3 мг/л (1.45 × × 10–7 моль/кг), что почти соответствет ПДК (0.01 мг/л). Содержание цинка в водном растворе – 16.2 мг/л (2.47 × 10–4 моль/кг). Это значительно выше ПДК (1 мг/л). Насыщение относительно смитсонита и цинкита не достигается. Возможно, цинк может сорбироваться на кальците по механизму катионного обмена или соосаждаться с ним. Для моделирования этих процессов требуется внести в базу данных термодинамику сорбированной формы цинка.
Концентрации мышьяка, сурьмы, ртути монотонно возрастают, поскольку раствор не достигает насыщения в отношении рассматриваемых арсенолита (As2O3), валентинита (Sb2O3), оксида ртути HgO. Для селена минеральные формы вообще не предусматривались. Сорбция на поверхностях минералов или соосаждение этих химических элементов с макрокомпонентами не рассматривались.
ВЫВОДЫ
Проведенное кинетико-термодинамическое моделирование взаимодействия обобщенной технологической пробы месторождения Павловское с атмосферной водой в течение летнего периода показало: 1) вода приобретает сульфатный кальциевый состав; 2) кислотность раствора нейтрализуется растворением кальцита; 3) концентрации в воде основных рудных элементов месторождения: свинца не превышают ПДК, цинка – многократно превышают ПДК; 4) среди примесных элементов превышение в воде отмечено по сурьме и ртути, содержание кадмия находится на уровне ПДК, а концентрации меди, кобальта, мышьяка, селена ниже ПДК.
Таким образом, можно сделать вывод, что взаимодействие воды с минералами технологической пробы приводит к накоплению в воде токсичных химических элементов даже без образования кислотного дренажа. Принятая схема расчетов позволила получить максимально возможные концентрации компонентов в водном растворе. В природных условиях при обновлении воды концентрации могут быть ниже. Однако, учитывая токсичность рассмотренных элементов, при разработке месторождений такого типа должны приниматься меры по мониторингу за состоянием водных ресурсов и при необходимости их очистке.
Список литературы
ГН 2.1.5.1315-03. Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. Постановление 30.04.2003 Москва № 79.
Губина Т.А. (2000) Минералогия и геохимия полиметаллических проявлений бассейна реки Безымянной (архипелаг Новая Земля). Автореферат диссертации на соискание ученой степени кандидата геолого-минералогических наук, Санкт-Петербург.
Козырьков В.Д., Лаврентьев А.В., Щербакова С.Н. (2016) Особенности вещественного состава и технологических свойств свинцово-цинковых руд Павловского месторождения. ВНИИХТ – 65 лет: Сборник научных трудов. ООО “Винпресс”, 79-85.
Лиманцева О.А., Рыженко Б.Н., Черкасова Е.В. (2015) Прогноз влияния кислотного дренажа на изменение гидрохимической обстановки в районах сульфидсодержащих месторождений. Геохимия. (10), 945-960.
Limantseva O.A., Ryzhenko B.N., Cherkasova E.V. (2015) Prediction of the effects of acid mine drainage on variations in the hydrogeochemical environment at sulfide-bearing ore deposits. Geochem. Int. 53(10), 922-936.
Лиманцева О.А., Рыженко Б.Н., Черкасова Е.В. (2019) Проявление кислотного дренажа на месторождении Павловское (Новая Земля). Геохимия. 64(5), 538-547. Limantseva O. A., Ryzhenko B.N., Cherkasova E.V. (2019) Acidic Drainage at the Pavlovskoe Ore Deposit, Novaya Zemlya Archipelago. Geochem. Int. 57(5), 583-592.
Мироненко М.В., Мелихова Т.Ю., Золотов М.Ю., Акинфиев Н.Н. (2008) GEOCHEQ_M – комплекс для термодинамического и кинетического моделирования геохимических процессов в системе вода-порода-газ. Версия 2008. Вестник ОНЗ РАН (URL: http: // www. s-cgis.ru/russian/cp1251/h_dgggms/1-2008/informbul_1_ 2008/mineral_22.pdf).
Мироненко М.В., Золотов М.Ю. (2012) Равновесно-кинетическая модель взаимодействий вода-порода. Геохимия. (1), 3-9.
Mironenko M.V., Zolotov M.Y. (2012) Equilibrium-kinetic model of water-rock interaction. Geochem. Int. 50(1), 1-7.
Blowes D.W., Ptacek C.J., Jambor J.L., Weisener C.G. (2005) The Geochemistry of Acid Mine Drainage. Treatise on Geochem. (9), 150-204; Acid Base Accounting (ABA) Test Procedures. Ed. Chris Mills.
Brantley S.L. (2004) Reaction kinetics of primary rockforming minerals under ambient conditions. Treatise on Geochem. (5), 73-118.
Johnson J.W., Oelkers E.H., Helgeson H.C. (1992) SUPCR-T92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bars and 0 to 1000°C. Comp. Geosci. (18), 899-947.
Helgeson H.C., Brown T.H., Nigrini A., Jones T.A. (1970) Calculation of mass transfer in geochemical processes involving aqueous solutions. Geochim. Cosmochim. Acta. 34(5), 569-592.
McKiblen M.A., Barnes H.L. (1986) Oxidation of pyrite in low temperature acidic solutions; rate laws and surface texture. Geochim. Cosmochim. Acta. 50(7), 1509-1520.
Millero F.J., Sotolongo S. and Izaguirre M. (1987) The oxidation kinetics of Fe(II) in seawater. Geochim. Cosmochim. Acta. 51, 793-801.
Papadopoulos P., Rowell D.L. (1988) The reactions of cadmium with calcium carbonate surfaces. J. Soil Sci. (39), 23-36.
Williamson M.A., Rimstidt J.D. (1994) Rate kinetics and electrochemical rate-determining step of aqueous pyrite oxidation. Geochim. Cosmochim. Acta. 58(2), 5443-5454.
Дополнительные материалы отсутствуют.