Геохимия, 2021, T. 66, № 3, стр. 275-280
Физико-химическая модель поведения скандия в профиле выветривания
В. А. Копейкин *
Ухтинский государственный технический университет Россия
169300 Республика Коми, Ухта, ул. Первомайская, 13, Россия
* E-mail: vkopeikin@ugtu.net
Поступила в редакцию 15.05.2020
После доработки 22.06.2020
Принята к публикации 23.06.2020
Аннотация
Представлены авторские и литературные данные по стандартной свободной энергии 31 иона и комплекса скандия в водном растворе. Методом физико-химического моделирования на ЭВМ по программе “Селектор” выполнен анализ поведения скандия в процессе выветривания филлитовидных сланцев. Содержание Sc в сланцах аналогично его среднему содержанию в земной коре и равно 10–3 вес. %. Установлено, что в профиле выветривания скандий в растворе представлен практически только одним гидроксокомплексом – ${\text{Sc}}({\text{OH}})_{3}^{0}.$ Содержание растворенного скандия контролируется растворимостью его оксида – Sc2O3 и фосфата – ScPO4 и меньше 10–9 моль/л.
ВВЕДЕНИЕ
Скандий (Sc) – (от латинского слова Scandia) Скандинавия, предсказан Д.И. Менделеевым в 1870 году как эка-бор. Открыл скандий в 1879 г. шведский химик Ларс Фредерик Нильсон.
Среднее содержание скандия в земной коре 10, в каменных метеоритах 6, в породах: ультраосновных – 5, основных – 24, средних – 2.5, кислых – 3 ppm. (Ярошевский, 2006). Содержание Sc в морской воде 0.04 мкг/л.
Основоположник геохимии России, Владимир Иванович Вернадский (1908) указал на эту необычную особенность скандия – большое содержание в земной коре и отсутствие самостоятельных скандиевых минералов. Он также указал на возможную концентрацию скандия во вторичных продуктах выветривания.
Среднее содержание скандия в бокситах (Броневой и др., 1983) 3 г/т. По сравнению с исходным субстратом в бокситах скандия больше – первые граммы на тонну. Для бокситов Среднего Тимана характерно повышенное содержание редкоземельных металлов, которые предположительно осаждаются на глинистой фракции (Лихачев, 1993).
Представлен одним стабильным изотопом 45Sc. Это мягкий, серебристо-белый металл с желтым оттенком. Радиус атома 160.6 пм. Типичный ион – Sc3+ (радиус 83 пм). Отмечается совершенный изовалентный изоморфизм с другими лантаноидами, с иттрием, с Zr4+ (87 пм) и Hf4+ (84 пм); несовершенный изовалентный – с Al3+ (57 пм), Fe3+ (67 пм); несовершенный гетеровалентный – с Mg2+ (78 пм), Fe2+ (82 пм). Размеры ионов (пикометры) по Эмсли Дж., (1993).
Скандий один из самых дорогих металлов (стоимость 1 гр. чистого скандия сравнима с ценой платиноидов и золота). Причина – отсутствие его промышленных месторождений. Это очень рассеянный литофильный элемент, с большим трудом извлекаемый из пород. Добывается в основном из гранитных пегматитов, вольфрамитовых грейзенов. Получается при переработке бокситов и руд W, Sn, Ti, U, Zr. Главный минерал – тортвейтит (Sc2Si2O7), довольно редок, но более сотни минералов содержат изоморфный скандий (от 0.001 до 0.4%) – вольфрамит, бефанамит, баццит, эвксенит, давидит, самарскит, ортит, циркон, касситерит.
Одной из первых работ, посвященных геохимии, минералогии и генетическим типам месторождений скандия, это работа Борисенко (1961). В ней отмечалось рассеяние скандия в земной коре и предсказаны возможные источники скандия, такие, как зола каменных углей, железистые бокситы, обогащенные костными остатками рыб осадочные породы.
При переработки каменных углей на жидкое топливо (бензин) можно извлекать скандий, поэтому следует ожидать увеличение его производства. Согласно принятой в РФ типизации химических элементов твёрдых топлив, скандий относится к ценным и потенциально ценным химическим элементам (Юдович, Кетрис, 2006).
Микродобавка оксида скандия в управляющие стержни атомных реакторов применяется в качестве весьма эффективного замедлителя нейтронов. Сегодня в РФ скандий над используется только в оборонной промышленности.
Для выяснения причин накопления скандия в бокситах, с помощью программного комплекса “Селектор” (Чудненко, 2010) было проведено физико-химическое моделирование поведения скандия в процессе выветривания.
На основании опубликованных данных об окислительно-восстановительных потенциалах соединений cкандия в водном растворе и констант ступенчатой диссоциации с различными лигандами (табл. 1), автором вычислены значения стандартной энергии Гиббса – $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ Дж/моль для 31 иона и комплекса скандия (табл. 2). В качестве твердых минеральных фаз скандия рассматривались Sc2O3, Sc(OH)3, ScPO4, ScPO4 ⋅ 2Н2О. Бромидные, иодидные, роданидные, цианидные и другие ионы скандия, отсутствующие в профиле выветривания, не учитывались.
Таблица 1.
Значения $pi_{n}^{{\text{o}}}$ диссоциации лигандов Sc3+ при 25°С и 1 бар
| Лиганд/$pi_{n}^{{\text{o}}}$ | $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$, Дж/моль | $pK_{{\text{1}}}^{{\text{0}}}$ | $pK_{{\text{2}}}^{{\text{0}}}$ | $pK_{{\text{3}}}^{{\text{0}}}$ | $pK_{{\text{4}}}^{{\text{0}}}$ |
|---|---|---|---|---|---|
| OH– | –157 262 | 9.70 | 8.60 | 7.60 | 4.9 |
| SO$_{4}^{{2 - }}$ | –744 459 | 4.35 | 2.82 | 0.59 | – |
| HCO$_{3}^{ - }$ | –586 870 | 2.00 | 1.53 | 0.84 | – |
| CO$_{3}^{{2 - }}$ | –527 983 | 10.1 | 5.49 | – | – |
| Cl– | –131 290 | 1.95 | 0.14 | –0.56 | –1.6 |
| F– | –281 751 | 7.03 | 6.04 | 4.14 | 2.86 |
| NO$_{3}^{ - }$ | –43 522 | 0.9 | –0.87 | – | – |
| S2O$_{3}^{{2 - }}$ | –522 582 | 4.0 | – | – | – |
Таблица 2.
Значения стандартной свободной энергии Гиббса $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ Дж/моль для соединений скандия
| Ион, соединение | $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$, Дж/моль | Ион, соединение | $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$, Дж/моль | Ион, соединение | $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$, Дж/моль |
|---|---|---|---|---|---|
| H2O(ж) | –237 141 | ScОН$_{{{\text{(p - p)}}}}^{{2 + }}$ | –799 217 | ScC2О$_{{{\text{4(p - p)}}}}^{ + }$ | –1 301 851 |
| Sc$_{{{\text{(p - p)}}}}^{{3 + }}$ | –586 597 | Sc(ОН)$_{{{\text{2(p - p)}}}}^{ + }$ | –1 005 559 | Sc(C2О4)$_{{{\text{2(p - p)}}}}^{ - }$ | –2 003 508 |
| ScSO$_{{{\text{4(p - p)}}}}^{ + }$ | –1 355 881 | Sc(ОН)$_{{{\text{3(p - p)}}}}^{0}$ | –1 206 194 | Sc(C2О4)$_{{{\text{3(p - p)}}}}^{{3 - }}$ | –2 685 500 |
| Sc(SO4)$_{{{\text{2(p - p)}}}}^{ - }$ | –2 116 434 | Sc(ОН)$_{{{\text{4(p - p)}}}}^{ - }$ | –1 391 420 | Sc(C2О4)$_{{{\text{4(p - p)}}}}^{{5 - }}$ | –3 351 174 |
| Sc(SO4)$_{{{\text{3(p - p)}}}}^{{3 - }}$ | –2 864 260 | Sc(ОН)$_{{{\text{5(p - p)}}}}^{{2 - }}$ | –1 577 788 | OH$_{{{\text{(p - p)}}}}^{ - }$ | –157 262 |
| ScS2O$_{{{\text{3(p - p)}}}}^{ + }$ | –1 132 011 | Sc(ОН)$_{{{\text{6(p - p)}}}}^{{3 - }}$ | –1 771 004 | CO$_{{{\text{3(p - p)}}}}^{{2 - }}$ | –527 983 |
| ScCl$_{{{\text{(p - p)}}}}^{{2 + }}$ | –729 016 | ScCО$_{{{\text{3(p - p)}}}}^{ + }$ | –1 172 221 | НСО$_{{{\text{3(p - p)}}}}^{ - }$ | –586 870 |
| ScCl$_{{{\text{2(p - p)}}}}^{ + }$ | –865 728 | Sc(CО3)$_{{{\text{2(p - p)}}}}^{ - }$ | –1 731 535 | SO$_{{{\text{4(p - p)}}}}^{{2 - }}$ | –744 459 |
| ScCl$_{{{\text{3(p - p)}}}}^{0}$ | –993 822 | ScHCО$_{{{\text{3(p - p)}}}}^{{2 + }}$ | –1 184 881 | H2PO$_{{{\text{4(p - p)}}}}^{ - }$ | –1 289 885 |
| ScCl$_{{{\text{4(p - p)}}}}^{ - }$ | –1 115 981 | Sc(HCО3)$_{{{\text{2(p - p)}}}}^{ + }$ | –1 780 483 | HPO$_{{{\text{4(p - p)}}}}^{{2 - }}$ | –1 286 161 |
| Sc(NO3)$_{{{\text{(p - p)}}}}^{{2 + }}$ | –635 255 | Sc(HCО3)$_{{{\text{3(p - p)}}}}^{0}$ | –2 372 147 | C2О$_{{{\text{4(p - p)}}}}^{{2 - }}$ | –668 879 |
| Sc(NO3)$_{{{\text{2(p - p)}}}}^{ + }$ | –672 812 | ScF$_{{{\text{(p - p)}}}}^{{2 + }}$ | –908 468 | NO$_{{{\text{3(p - p)}}}}^{ - }$ | –43 522 |
| Sc(H2PO4)2+ | –1 738 243 | ScF$_{{{\text{2(p - p)}}}}^{ + }$ | –1 224 689 | F$_{{{\text{(p - p)}}}}^{ - }$ | –281 751 |
| Sc(HPO4)$_{{{\text{(p - p)}}}}^{ + }$ | –1 730 712 | ScF$_{{{\text{3(p - p)}}}}^{0}$ | –1 530 067 | Cl$_{{{\text{(p - p)}}}}^{ - }$ | –131 290 |
| Sc2O3 кр. | –1 818 927 | ScF$_{{{\text{4(p - p)}}}}^{ - }$ | –1 828 140 | ScPO4 . 2Н2О sterretit (кольбекит) | –2 194 026 |
| Sc(OH)3 кр. | –1 242 648 | ScPO4кр. | –1 753 096 | Ca10(PO4)6(CO3)кр. апатит-СО3 |
–12 959 748 |
ТЕРМОДИНАМИЧЕСКАЯ ИНФОРМАЦИЯ И МЕТОД МОДЕЛИРОВАНИЯ
Цель данной работы – выяснить, какие минералы и ионы скандия существуют в профиле выветривания. Моделирование проводилось при 25°С и 0.1 МПа.
Анализ поведения скандия в процессе выветривания проведен на основе литературных и авторских данных по величинам стандартной энергии Гиббса для 32 иона и комплекса скандия.
Свободная энергия иона $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{Sc}}_{{\left( {{\text{р - р}}} \right)}}^{{{\text{3}} + }}$ = = ‒586597 Дж/моль рекомендована (Shock, Helgeson, 1988). Это значение мы принимаем за основу дальнейших вычислений.
Величину стандартного электродного потенциала скандия в водных растворах (при 25°C, 0.1 МПа) получим из реакции
по уравнению(2)
$Е^\circ = {{--{{\Delta }_{{\text{f}}}}G_{{\text{R}}}^{^\circ }} \mathord{\left/ {\vphantom {{--{{\Delta }_{{\text{f}}}}G_{{\text{R}}}^{^\circ }} {n{\text{F}}}}} \right. \kern-0em} {n{\text{F}}}},$Лурье (1989), Крайнов и др., (2012, далее КРШ), рекомендуют константы $pK_{n}^{0}$ ступенчатой диссоциации разных лигандов (сульфатов, оснований, карбонатов, гидрокарбонатов и других) для иона скандия (Sc3+) в водном растворе (табл. 1). Эти константы весьма близки к экспериментальным, например для сульфатов Sc3+$pK_{1}^{0}$ рекомендуемое равно 4.35, а экспериментальное 4.40; $pK_{2}^{0}$ рекомендуемое 2.82, а экспериментальное 1.97 (Smith, Martell, 1978; Turner еt al., 1981).
Диссоциация сульфата скандия по первой ступени протекает по реакции:
(3)
${\text{Sc}}\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)_{{\left( {{\text{p - p}}} \right)}}^{ + } = {\text{Sc}}_{{\left( {{\text{p - p}}} \right)}}^{{3 + }} + {\text{SO}}_{{4\left( {{\text{p - p}}} \right)}}^{{2 - }},\,\,\,pK_{1}^{0}~ = 4.35.$Отсюда для ${\text{Sc}}({\text{S}}{{{\text{O}}}_{{\text{4}}}})_{{{\text{(р - р)}}}}^{ + }$ получаем значение $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ = –1 355 881 Дж/моль.
Диссоциация сульфата скандия по второй ступени:
(4)
$\begin{gathered} {\text{Sc}}\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)_{{2\left( {{\text{p - p}}} \right)}}^{ - } = {\text{Sc}}\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)_{{{\text{(p - p)}}}}^{ + } + {\text{SO}}_{{{\text{4(p - p)}}}}^{{2 - }}, \\ pK_{2}^{0} = 2.82. \\ \end{gathered} $Значение свободной энергии $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ иона ${\text{Sc}}({\text{S}}{{{\text{O}}}_{{\text{4}}}})_{{{\text{2(р - р)}}}}^{ - }$ = ‒2 116 434 Дж/моль.
Диссоциация сульфатов скандия по третьей ступени:
(5)
$\begin{gathered} {\text{Sc}}\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)_{{3{\text{(p - p)}}}}^{{3 - }} = {\text{Sc}}\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)_{{2{\text{(p - p}})}}^{ - } + {\text{SO}}_{{4{\text{(p - p}})}}^{{2 - }}, \\ pK_{3}^{0} = 0.59. \\ \end{gathered} $Величина свободной энергии $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ иона ${\text{Sc}}({\text{S}}{{{\text{O}}}_{{\text{4}}}})_{{{\text{3(р - р)}}}}^{{{\text{3}} - }}$ = –2 864 260 Дж/моль.
По данным Комиссаровой (2001) для реакции
(6)
${\text{Sc}}{{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{}}^{ + } = {\text{S}}{{{\text{c}}}^{{3 + }}} + {{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{ - }$Свободная энергия $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{Sc}}{{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{{\text{3(p - p)}}}}^{ + }$ = = ‒113 2011 Дж/моль.
Карапетьянц (1965) и Киреев (1970) предложили методы сравнительного расчета физико-химических свойств химических веществ. В основу расчетов положено предположение о равномерном изменении этих свойств. Поэтому следует ожидать, что изменение констант ступенчатой диссоциации скандия для фтора и хлора должны иметь сходство. Уравнение аппроксимации для фторидов скандия (табл. 1) У = –1.441Х + 8.62, достоверность аппроксимации R2 = 0.9865. Для хлоридов скандия (КРШ, 2012) уравнение аппроксимации У = –0.907Х + 2.195, достоверность аппроксимации R2 = 0.8959. Обращает на себя внимание превышение значения константы рK2 = = 0.95 над первой константой (рK1= 0.92), тогда как величина рK2 не должна её превышать. Если не учитывать это значение рK2 = 0.95, то уравнение аппроксимации для хлоридов скандия У = = –1.278Х + 3.575, достоверность аппроксимации R2 = 0.941. Поэтому мы приняли значение рK1 = = 1.95 по рекомендации Лурье (1989), а остальные – по КРШ (2012). С учетом этой поправки уравнение аппроксимации для хлоридов скандия У = = –1.216Х + 3.225, достоверность аппроксимации R2 = 0.9935, тогда значение рK2 равно 0.14.
В справочнике “Термические константы веществ” (ТКВ) приведены значения свободной энергии ионов фосфатов скандия и фосфорной кислоты: $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{Sc}}_{{\left( {{\text{р - р}}} \right)}}^{{{\text{3}} + }}$ = –583877 Дж/моль, $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{Sc}}{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{{{\text{2}} + }}$ = –1735523 Дж/моль, $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{ScHPO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{ + }$ = –1 727 992 Дж/моль, $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{ - }$ = –1 289 885 Дж/моль, $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{HPO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{{{\text{2 - }}}}$ = –1 286 161 Дж/моль.
Shock, Helgeson (1988), КРШ (2012) рекомендуют для ионов фосфорной кислоты величину свободной энергии $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{ - }$ = –1 130 266 Дж/моль и $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{HPO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{{{\text{2}} - }}$ = –1 089 136 Дж/моль.
Диссоциация фосфатов скандия протекает согласно реакциям (7) и (8):
(7)
${\text{Sc}}{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{{2 + }} = {\text{S}}{{{\text{c}}}^{{3 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - },$(8)
${\text{ScHPO}}_{{\text{4}}}^{{\text{ + }}} = {\text{S}}{{{\text{c}}}^{{3 + }}} + {\text{HPO}}_{4}^{{2 - }}.$Согласно принятым нами за основу данным (Shock, Helgeson (1988), КРШ (2012), $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{Sc}}{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{{{\text{2}} + }}$ = –1 738 243 Дж/моль и $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{ScHPO}}_{{{\text{4}}\left( {{\text{р - р}}} \right)}}^{ + }$ = –1 730 712 Дж/моль.
Свободная энергия ${\text{Sc}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})_{{{\text{(р - р)}}}}^{{{\text{2}} - }}$ = = ‒33 179 Дж/моль (ТКВ), включает в себя свободную энергию иона ${\text{NO}}_{{{\text{3}}\left( {{\text{р - р}}} \right)}}^{ - },$ равную ‒111 420 Дж/моль (Наумов и др., 1971). Однако Карпов и др. (1996) считают эту величину ошибочной и рекомендуют значение $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{NO}}_{{{\text{3}}\left( {{\text{р - р}}} \right)}}^{ - }$ = = –43 522 Дж/моль и $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{HNO}}_{{{\text{3}}\left( {{\text{р - р}}} \right)}}^{0}$ = = ‒35 363 Дж/моль. С учетом этой поправки нами приняты величины $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ для ${\text{Sc}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})_{{{\text{(р - р)}}}}^{{{\text{2}} + }}$ –635255 Дж/моль и для ${\text{Sc}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})_{{{\text{2(р - р)}}}}^{ + }$ ‒673 812 Дж/моль.
Значения констант ступенчатой диссоциации оснований скандия взяты по КРШ (2012) ($pK_{1}^{0}$ = = 9.70, $pK_{2}^{0}$ = 8.60, $pK_{3}^{0}$ = 7.60), а для других реакций ($pK_{4}^{0}$ = 4.9, $pK_{5}^{0}$ = 5.1 и $pK_{6}^{0}$ = 6.3) по данным Иванова–Эмин и др. (1970).
Используя принятые нами значения $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ для Sc$_{{({\text{p - p)}}}}^{{3 + }}$ –586 597 Дж/моль и $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ ${\text{ОН}}_{{{\text{(р - р)}}}}^{ - }$ ‒157 262 Дж/моль, получаем следующие значения $\Delta G_{{\left( {{\text{298}}.{\text{15}}} \right)}}^{{{\text{of}}}}$ для ${\text{Sc}}({\text{OН}})_{{{\text{(р - р)}}}}^{{{\text{2}} + }}$ –799 227 Дж/моль, для ${\text{Sc}}({\text{OН}})_{{{\text{2(р - р)}}}}^{ + }$ –1 005 578 Дж/моль, для ${\text{Sc}}({\text{OН}})_{{{\text{3(р - р)}}}}^{0}$ ‒12 062 221 Дж/моль, для ${\text{Sc}}({\text{OН}})_{{{\text{4(р - р)}}}}^{ - }$ –1 391 430 Дж/моль, для ${\text{Sc}}({\text{OН}})_{{{\text{5(р - р)}}}}^{{{\text{2 - }}}}$ –1 577 788 Дж/моль и –1 771 004 Дж/моль для ${\text{Sc}}({\text{OН}})_{{{\text{6(р - р)}}}}^{{3 - }}.$
Подобным образом вычислены величины свободных энергий карбонатов, гидрокарбонатов, хлоридов и фторидов скандия (табл. 2). Свободная энергия твeрдых фаз скандия – Sc2O3кр, Sc(OH)3кр, ScPO4кр И ScPO4 ⋅ 2Н2О взята по данным ТКВ.
Минеральный состав (вес. %): использованных при моделировании филлитовидных сланцев представлен мусковитом (49.4); хлоритом (18); каолинитом (5); биотитом (6); альбитом (1); кварцем (8.1); магнетитом (2.5); гематитом (2.5); пиритом (2); кальцитом (2); ильменитом (1); флюоритом (0.5); ангидритом (1); апатитами – пять разновидностей (Каржавин, 1981) по 0.2%. Всего ∑ = 100%.
РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ
Выветривания протекает единообразно по любым породам. Это латеритный процесс в условиях жаркого влажного климата.
Смена окислительных условий на восстановительные нами проводилась за счет титрования кислорода атмосферы органическим веществом породы за счет изменения соотношении вода (water) : порода (rock) – [W/R] = 1000 : 1 (p[W/R] = 3) (Копейкин, 2017, 2018, 2020).
Моделировалось взаимодействие 1 кг воды (55.51 моль Н2О) с различным количеством филлитовидных сланцев (далее породы). При взаимодействии минимального количества породы (10–7–10–6 моль) с водой (верхней части профиля выветривания, Борисов, Шваров, 1992), все растворимые продукты переходят в раствор и вымываются, а остаются только не растворимые (Sc2O3, гетит и гиббсит). Это зона боксита, существующая вниз по разрезу до соотношения W/R = 4.55 (рис. 1 ).
Рис. 1.
Поведение скандия в профиле выветривания филлитовидных сланцев. R – порода, W – вода. Gbs – гиббсит, Gth – гетит, Rt – рутил, Kln – каолинит, Ilt – иллит, Py – пирит, Sd – сидерит, Qz – кварц, Ap – апатит (сокращенные названия минералов даны по рекомендации Whitney D., Evans B. W. (2010)).
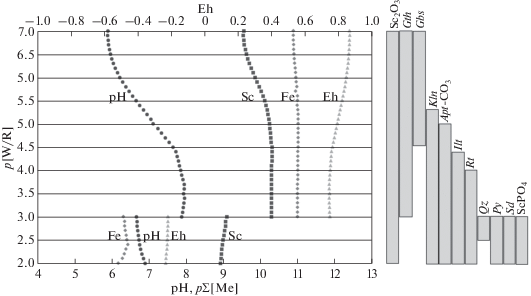
Далее в разрезе образуются каолинит, соотношение содержаний SiO2/Al2O3) уменьшается и выходит за пределы бокситового модуля. Здесь гиббсита уже нет и до границы смены окислительных условий на восстановительные наблюдается парагенезис Sc2O3, гетит и каолинит.
Визуально окислительная зона представлена сменой красно-рыжей окраски породы трёхвалентным железом, поскольку в восстановительных условиях железо двухвалентно и входит в состав новообразованных глин (алюмосиликатов).
При израсходовании на процессы окисления растворенного в атмосферных осадках атмосферного кислорода в профиле выветривания создается восстановительная среда. Здесь проходит граница геохимического барьера смены Eh и рН.
В восстановительных условиях профиля выветривания минеральный парагенезис представлен пиритом, сидеритом, доломитом, кварцем, карбонат-апатитом, каолинитом, иллитами. Здесь образуются фосфат скандия, ScPO4, и Sc2O3. Общее содержание скандия в растворе меньше 10–9 мол/л.
Причиной необычной геохимии скандия – его высокое содержание в земной коре и отсутствие самостоятельных скандиевых минералов (Вернадский, 1908), может быть очень малая растворимость Sc2O3 – по всему разрезу профиля выветривания меньше 10–9 мол/л (преобладает ион ${\text{Sc}}({\text{OH}})_{3}^{0}$), а также большое количество образующегося при выветривании гетита. HFeO2 – гетит является главной составной частью лимонита (гидрогетит) HFeO2 ⋅ aq (Бетехтин, 2007). Все, богатые водой разновидности гётита, являются гидрогелями, содержащими различное количество адсорбированной воды и хорошими сорбентами. Лимонит является гидратированной разновидностью гётита.
В зоне отрицательных значений Eh (восстановительная обстановка), скандий сразу совместно с ионом Fe2+ (радиус 82 пм) за счет изоморфизма включается в кристаллическую решетку минералов железа, главным образом в новообразованные при выветривании алюмосиликаты железа и фосфаты.
Список литературы
Бетехтин А.Г. (2007) Курс минералогии: учебное пособие. М.: КДУ, 736 с.
Борисенко Д.Ф. (1961) Скандий. Основные черты геохимии, минералогии, генетические типы месторождений. М.: Изд. АН СССР, 130 с.
Борисов М.В., Шваров Ю.В. (1992) Термодинамика геохимических процессов. Учебное пособие. М.: МГУ, 211 с.
Броневой В.А., Зильберминц А.В., Липин В.М., Теняков В.А. (1983) Средние коэффициенты концентрации химических элементов в бокситах. ДАН. 270(5), 1167-1170.
Вернадский В.И. (1908) К вопросу о распределении скандия.. Известiя Императорской Академiи Наукъ. 6 серия, том 2. № 17, 1273-1275.
Иванов-Эмин Б.Н., Егоров Л.М., Романюк В.И., Сифорова Е.Н (1970) Константы образования анионных гидроксокомплексов некоторых элементов III группы периодической системы. Журн. неорганической химии. 15(5), 1224-1228.
Карапетьянц М.Х. (1965) Методы сравнительного расчета физико-химических свойств. М.: Наука, 404 с.
Каржавин В. К. (1981) Термодинамические величины некоторых фосфатов кальция группы апатита. Журн. физической химии, т. LV(8). 1933-1936.
Карпов И.К. (1981) Физико-химическое моделирование на ЭВМ в геохимии. Новосибирск: Наука, 248 с.
Карпов И.К, Чудненко К.В., Бычинский В.А., Кашик С.А. (1996) Определение станлартного изобарно-изотермического потенциала образования нитрат-иона по физико-химической модели озера Байкал. ДАН. 346(3), 383-386.
Киреев В.А. (1970) Методы практических расчетов в термодинамике химических реакций. М.: Химия, 520 с.
Комиссарова Л.Н. (2001) Неорганическая и аналитическая химия скандия. М.: Эдиториал УРСС, 512 с.
Копейкин В.А. (2017) Физико-химическая модель поведения олова в профиле выветривания. Геохимия. (4), 368-371.
Kopeikin V.A. (2017) Physicochemical Model of Tin Behavior in Weathering Profiles. Geochem. Int. 55(4), 389-392.
Копейкин В.А. (2018) Физико-химическая модель поведения титана в профиле выветривания. Сыктывкар: Вестник ИГ Коми НЦ УрО РАН. (10), 35-38.
Копейкин В.А. (2020) Физико-химическая модель поведения серебра в профиле выветривания. Геохимия. 65(6), 618-625.
Kopeikin V.A. (2020) Physicochemical Model of Silver Behavior in Weathering Profiles. Geochem. Int. 58(6), 746-752.
Крайнов С.Р., Рыженко Б.Н., Швец В.М. (2012) Геохимия подземных вод. Теоретические, прикладные и экологические аспекты. М.: ЦентрЛитНефтеГаз, 672 с.
Лихачев В.В. (1993) Редкометальность бокситоносной коры выветривания Среднего Тимана. Сыктывкар. Коми НЦ УрО РАН. 224 с.
Лурье Ю.Ю. (1989) Справочник по аналитической химии. М.: Химия, 448 с.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин (для геологов). М.: Атомиздат, 240 с.
Термические константы веществ. (1965–1979) Справочник. Под ред. В.П. Глушко. М.: Наука. Вып. 1–10.
Чудненко К.В. (2010) Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: ГЕО, 287 с.
Эмсли Дж. (1993) Элементы: Пер. с англ. М.: Мир, 256 с.
Юдович Я.Э., Кетрис М.П. (2006) Ценные элементы-примеси в углях. Екатеринбург: УрО РАН, 538 с.
Ярошевский А.А. (2006) Распространённость химических элементов в земной коре. Геохимия. (1), 54-62.
Yaroshevsky A.A. (2006) Abundances of Chemical Elements in the Earth,s Crast. Geochem. Int. 44(1), 48-55.
Shock E.L., Helgeson H.C. (1988) Calculation of the thermodynamic and transport properties of aqueous species in high pressures and temperatures. Correlation algorithms for ionic species and equation of state pedicthions to 5 kb and 1000°C. Geochim. Cosmochim. Acta. 52 2), 2009-2036.
Smith R.H., Martell A.E. (1977) Critical stability constants. 4. N.Y.–L.: Plenum Press. 156 p.
Turner D.R., Whitefield M., Dickson A.G. (1981) The equilibrium speciation of dissolved components in freshwater and seawater at 25°C and 1 atm pressure. Geochim. Cosmochim. Acta. 45(6), 855-881.
Whitney D., Evans B.W. (2010) Abbreviations for names of rock-forming minerals. Amer. Mineral., 95, 185-187.
Дополнительные материалы отсутствуют.


