Геохимия, 2021, T. 66, № 4, стр. 329-340
Превращение кварца в опал у границы вода–пар
В. А. Алексеев a, *, А. А. Бурмистров a, И. Н. Громяк a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: alekseyev-v@geokhi.ru
Поступила в редакцию 20.01.2020
После доработки 06.04.2020
Принята к публикации 30.07.2020
Аннотация
Кинетика реакций минералов с водяным паром или с двумя фазами воды (жидкость + пар) одновременно до сих пор остается неизученной. Без этих знаний количественное описание эволюции гидротермальной системы после гетерогенизации флюида не может быть полным и адекватным. Чтобы восполнить эти пробелы, выполнены опыты с кристаллами кварца и водой при 300°С и Рнас. = 86 бар методом закалки. Помимо обычных методов исследования (ИСП-АЭС, СЭМ, рентгенография, оптическая микроскопия), в работе использовалось 3d-сканирование кристаллов для измерения их площади поверхности и для построения диаграмм отклонений размеров кристаллов, вызванных реакциями растворения и осаждения. В опытах, где кристалл располагался в паровой фазе, впервые измерена константа скорости растворения кварца для насыщенного водяного пара (Рнас. = 86 бар) при 300°С (2.7 нмоль м–2 с–1), которая оказалась меньше, чем для жидкой воды, в 630 раз. Расчеты показали, что время достижения равновесия кварца с водой и паром близко, но перекристаллизация кварца, вызванная температурным градиентом, в паре происходит на 2 порядка медленнее, чем в воде. В опытах, где кристалл располагался и в воде, и в паре, происходило не только растворение стабильного кварца, но и образование метастабильного кристобалит-тридимитового опала. Опал отлагался на стенках автоклава и даже на самом кварце выше уровня жидкой воды, а концентрация кремнезема в воде оставалась заметно ниже растворимости кварца. Скорость образования опала (10–7.5 моль м–2 с–1) была на 3.5 порядка выше, чем скорость перекристаллизации кварца (единственный процесс, возможный в данной системе согласно традиционному геохимическому подходу). Объяснение противоречию дано в рамках гипотезы дистилляции, основанной на преимущественном испарении тонкого (<100 нм) слоя раствора на краю мениска. Обнаружены два пути эволюции системы, приводящие к рассеянному и компактному отложению опала, что объясняется разным отношением скоростей подъема пленки раствора и испарения. Описанное явление может быть причиной асимметрии природных кристаллизационных полостей, нижние части которых растворялись, а в верхних частях осаждались минералы.
ВВЕДЕНИЕ
Кремнезем (SiO2) в земной коре входит в состав силикатов, а также образует собственные минералы, самыми распространенными из которых являются кварц и опал (Дэна и др., 1966; Dove, 1995). Кварц (здесь и далее имеется в виду низкотемпературный тригональный α-кварц) стабилен по крайней мере до 573°С и 20 кбар (Dove, 1995). Он является важным породообразующим минералом в изверженных, метаморфических и осадочных породах, в гранитных пегматитах и гидротермальных жилах (Дэна и др., 1966). Природный опал существует в области стабильности кварца при невысоких температурах (до 150°С), т.е. является метастабильным минералом (Дэна и др., 1966). Он накапливается на дне морей в виде кремнеземных скелетов водорослей и микроорганизмов, а также осаждается из пересыщенных растворов, которые образуются при понижении температуры (гейзериты) или при растворении силикатов. Обычно сначала образуется некристаллический опал-А (близкий аналог аморфного кремнезема) т.к. его критический зародыш меньше, чем у кварца (Okamoto et al., 2010). Со временем опал-А превращается в кварц через промежуточные стадии образования микрокристаллических опалов с кристобалит-тридимитовой структурой. Эти превращения протекают по механизму растворение–кристаллизация (Williams, Crerar, 1985) как в экспериментальных (Bettermann, Liebau, 1975), так и в природных условиях (Isaacs, 1982; Lynne et al., 2005).
Взаимодействие кремнезема с водой обычно изучается с использованием термодинамики и кинетики химических реакций, а также транспортных процессов: фильтрации, диффузии, теплопереноса. В последнее время происходит смещение этих исследований на наноуровень, где обнаруживаются новые свойства частиц и флюидов (Алексеев, 2019). Наибольший интерес представляют те свойства, которые кардинально изменяют поведение макросистем. Например, испарение тонкого (<100 нм) слоя раствора на контакте со стенкой ампулы приводило к превращению стабильного кварца в метастабильный опал, который отлагался на стенке выше уровня раствора (Алексеев, Медведева, 2018). В данной работе мы попытались выполнить подобное превращение в более реальных для природы условиях, заменив платиновую стенку самим кристаллом кварца. Это может послужить убедительным доказательством, что наблюдаемый феномен не является исключительно экспериментальным артефактом.
МЕТОДИКА
В опытах использовалась бидистиллированная вода (6 г) и природные кристаллы α-кварца из Бразилии (штат Минас-Жерайс). Прозрачные и бесцветные кристаллы имели форму шестигранной призмы с небольшой конусностью к вершине длиной 6–7 см, в поперечнике 8–10 мм и массой 4.5–8.6 г. Опыты проводились в автоклавах из нержавеющей стали с простым (неуплотняющимся) затвором, с внутренним диаметром 21 мм и глубиной 14 см. Каждый кристалл фиксировался внутри автоклава по его оси двумя проволочными хомутами (нержавеющая сталь), которые охватывали кристалл с двух концов и своими усиками упруго упирались в стенки автоклава. Для надежной фиксации хомутов на ребрах кристалла по его периметру делались пропилы алмазным надфилем. Выполнено 3 серии опытов, которые различались положением кристаллов кварца в автоклаве относительно воды (рис. 1 ). Другие различия серий заключались в следующем. В серии I использовались новые автоклавы, внутренняя поверхность которых осталась шероховатой после сверления (спиральные канавки и выступы). Кристаллы кварца в этой серии предварительно кипятились в HCl и промывались водой. В сериях II и III была предпринята попытка уменьшить шероховатость внутренних стенок автоклавов путем их шлифования абразивными шкурками с помощью электрической дрели. В серии II грани кристаллов предварительно шлифовались на стекле кварцевым порошком с размером зерен 20–50 мкм для создания шероховатой поверхности. В сериях II и III кристаллы кварца подвергались также предварительному многократному кипячению в концентрированной кислоте (1 ч в 150 мл HCl), а затем в дистиллированной воде (2 ч в 300 мл в тефлоновом стакане) до тех пор, пока убыль массы каждого кристалла после такой обработки не превышала 0.2 мг. В эту убыль входит не только растворенный материал, но и мелкие кусочки, возможно отколотые от кристаллов при их соударениях. Автоклавы герметично закрывались с использованием отожженных медных прокладок и ставились в гнезда алюминиевого блока, который располагался внутри вертикальной электрической печи, парами друг на друга. Опыты проводились при 300 ± 2°С. На поверхности нижнего и верхнего автоклава температура снизу-вверх слегка повышалась и понижалась: 0.15 и –0.08°/см соответственно. Эти температурные градиенты были измерены нами ранее (Алексеев, Медведева, 2018) при 300°С именно для тех печей и автоклавов, которые использовались в данной работе, и при том же взаимном расположении автоклавов. Малая толщина стенок автоклава (3 мм) позволяет предполагать, что температура на внутренних стенках автоклава не сильно отличалась от температуры, измеренной на внешних стенках. По истечении заданной длительности прогрева, автоклавы закаливались в холодной воде, растворы фильтровались (размер пор фильтра 0.05 мкм) и анализировались на Si (АЭС-ИСП) с точностью 5 отн. % и чувствительностью 0.01 ppm. Новообразованный кремнезем изучался с помощью эндоскопа, рентгеновской дифракции (система STOE STADI MP), оптического и сканирующего электронного микроскопа (СЭМ) Supa 50 VP. Новым для подобного рода исследований было 3d-сканирование кристаллов, которое осуществлялось на сканере RangeVision Pro (оптический, с технологией структурной подсветки) с разрешением 30 мкм. Перед съемкой кристаллы опрыскивались спреем (порошок мела + спирт) для нанесения непрозрачного поверхностного слоя толщиной 10–20 мкм. Отдельные сканы каждого кристалла соединялись в полигональную 3d-модель (формат stl), для которой рассчитывались объем и площадь поверхности. Совмещение моделей кристаллов до и после опытов (серия II) позволило построить диаграммы отклонений и выявить области убыли и прибыли материала.
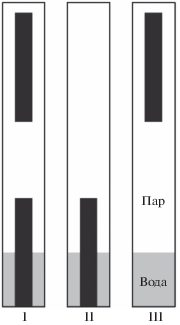
Рис. 1.
Положение кристаллов кварца в автоклавах: I – вверху и внизу, II – внизу, III – вверху. Верхние кристаллы целиком находились в паре, нижние – наполовину в воде и наполовину в паре.
Измеренные концентрации SiO2 в закалочных растворах пересчитывались на температуру опытов с учетом разбавления растворов конденсатом при закалке. Эта процедура особенно важна при небольшом коэффициенте заполнения автоклава раствором (Verma, 2000), как в данной работе. Для пересчета использовались балансы масс воды и растворенного кремнезема, которые описываются уравнениями:
(1)
$\begin{gathered} {{\rho }_{w}}_{{,25}}{{K}_{{25}}}V + {{\rho }_{{v}}}_{{,25}}\left( {1 - {{K}_{{25}}}} \right)V = \\ = {{\rho }_{w}}_{{,300}}{{K}_{{300}}}V + {{\rho }_{{v}}}_{{,300}}\left( {1 - {{K}_{{300}}}} \right)V, \\ \end{gathered} $(2)
$\begin{gathered} {{\rho }_{w}}_{{,300}}{{K}_{{300}}}V{{m}_{{w,}}}_{{300}} + {{\rho }_{{v}}}_{{,300}}\left( {1 - {{K}_{{300}}}} \right)V{{m}_{{{v},}}}_{{300}} = \\ = {{\rho }_{w}}_{{,25}}{{K}_{{25}}}V{{m}_{{w,}}}_{{25}} + {{\rho }_{{v}}}_{{,25}}\left( {1 - {{K}_{{25}}}} \right)V{{m}_{{{v},}}}_{{25}}, \\ \end{gathered} $(3)
${{K}_{{300}}} = \frac{{{{\rho }_{{w,25}}}{{K}_{{25}}} - {{\rho }_{{v,300}}}}}{{{{\rho }_{{w,300}}} - {{\rho }_{{v,300}}}}},$(4)
$N = \frac{{{{m}_{{w,300}}}}}{{{{m}_{{w,25}}}}} = \frac{{{{\rho }_{{w,25}}}{{K}_{{25}}}\left( {{{\rho }_{{w,300}}} - {{\rho }_{{v,300}}}} \right)}}{{{{\rho }_{{w,300}}}\left( {{{\rho }_{{w,25}}}{{K}_{{25}}} - {{\rho }_{{v,300}}}} \right)}}.$В вычислениях использованы значения ρw,300 и ρv,300 из табл. 1, ρw,25 = 0.997, при допущениях ρv,25 = 0, mv,25 = 0 и mv,300 = 0 из-за низких значений этих величин. Значения К25 составляли 0.148 (серия I) и 0.140 (серии II и III). Значения K300, вычисленные по уравнению (3), составляли соответственно 0.152 и 0.140, т.е. были близки к K25. Коэффициент N, вычисленный по уравнению (4), составлял 1.36 (серия I) и 1.40 (серии II и III). Поскольку полученные значения N значительно больше 1, они должны учитываться при вычислении mv,300.
Таблица 1.
Параметры, использованные в настоящей работе для 300°С и давления насыщенного водяного пара (8.588 МПа)
| Название | Обозначение | Значение | Источник |
|---|---|---|---|
| Плотность воды, г/см3 | ρw,300 | 0.7121 | Wagner and Pruss, 2002 |
| Плотность пара, г/см3 | ρv,300 | 0.0462 | Wagner and Pruss, 2002 |
| Растворимость кварца в воде, моль/кг | mw,eq | 0.01057 | Plyasunov, 2012 |
| Растворимость кварца в паре, моль/кг | mv,eq | 4.947 × 10–5 | Plyasunov, 2012 |
| Константа распределения mv/mw | κ | 0.00468 | Plyasunov, 2012 |
| Константа скорости растворения кварца в воде, моль м–2 с–1 | kw | 1.7 × 10–6 | Tester et al., 1994 |
| Константа скорости растворения кварца в паре, моль м–2 с–1 | kv | 2.7 × 10–9 | Данная работа |
РЕЗУЛЬТАТЫ
Серия I
Концентрация растворенного кремнезема (mw) в верхнем автоклаве (8.25 ммоль/кг) была больше, чем в нижнем (табл. 2), но заметно ниже растворимости кварца 10.57 ммоль/кг (табл. 1), отвечающей равновесию при данных условиях. Потеря массы верхних кристаллов в обоих опытах была незначительной, а для нижних кристаллов она была больше и превышала массу растворенного кремнезема М1 (табл. 2). Новообразованный кремнезем массой 9 мг отложился на внутренние стенки обоих автоклавов в виде белых колец на уровне поверхности воды (М2). Согласно рентгеновской дифракции, этот кремнезем является микрокристаллическим кристобалит-тридимитовым опалом (рис. 2), структура которого представляет собой неупорядоченное чередование тридимитовых и кристаболитовых слоев (Graetsch, 1994). На одной из граней нижнего кристалла кварца в нижнем автоклаве опал отложился выше уровня воды и при небольшом увеличении выглядел как натечный агрегат неправильной формы (рис. 3а и 3б). На поверхности кварца ниже опала наблюдались многочисленные корытообразные ямки травления (рис. 3в). В переходной зоне между кварцем и агрегатом опала наблюдались отдельные опаловые сферы (рис. 3б), сложенные микрокристаллами (рис. 3г). Основная масса опала сложена подобными же сферами, сросшимися полностью или частично в корки (рис. 3д и 3е).
Таблица 2.
Условия и результаты опытов с водой (6 г) и кристаллами кварца при 300°С: положение автоклава в печи и кристалла в автоклаве (рис. 1 ), масса кристалла (Мк), продолжительность прогрева (t), концентрация кремнезема в воде к концу опыта (mw), потеря массы кристалла в опыте (ΔМк), масса кремнезема в растворе (М1) и в новой твердой фазе (М2), площадь поверхности кристалла (S) и его объем (V)
| Положение | Мк, г | t, сут |
mw, ммоль/кг | Баланс масс кремнезема, мг | S, см2 | V, см3 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| автоклава | кристалла | ΔМк | М1 | М2 | Σ | |||||
| Серия I: в автоклаве два кристалла кварца, вверху и внизу | ||||||||||
| Верх* | Верх | 7.028 | 42 | 8.25 | –0.8 | 3.0 | 9.0 | –13.2 | ||
| Низ | 8.552 | –24.4 | ||||||||
| Низ** | Верх | 6.428 | 42 | 6.29 | –1.1 | 2.2 | 9.0 | –8.2 | ||
| Низ | 7.850 | –18.3 | ||||||||
| Серия II: в автоклаве один кристалл кварца внизу | ||||||||||
| Верх* | Низ | 7.049 | 77 | 7.87 | –2.1 | 2.0 | 0*** | –0.1 | 14.38 | 2.671 |
| Низ** | Низ | 4.524 | 77 | 7.37 | –6.0 | 1.9 | 4.0 | –0.1 | 11.38 | 1.723 |
| Серия III: в автоклаве один кристалл кварца вверху | ||||||||||
| Верх* | Верх | 7.849 | 77 | 5.98 | –0.9 | 1.5 | 0 | 0.6 | 16.19 | 2.987 |
| Низ** | Верх | 8.260 | 77 | 2.29 | –0.8 | 0.6 | 0*** | –0.2 | 16.33 | 3.143 |
| Верх* | Верх | 7.348 | 7.9 | 0.661 | 0.1 | 0.2 | 0 | 0.3 | 15.93 | 2.796 |
| Низ** | Верх | 7.202 | 7.9 | 0.630 | –1.4 | 0.2 | 0 | –1.2 | 15.78 | 2.753 |
Рис. 2.
Рентгеновская дифрактограмма кристобалит-тридимитового опала, отложившегося на стенках автоклавов в серии I на границе вода–пар. CoKα1 излучение. Числа показывают межплоскостные расстояния в Å. Стрелка показывает положение самого интенсивного пика исходного кварца, который на данной дифрактограмме отсутствует.
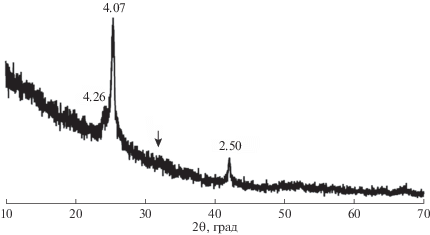
Рис. 3.
СЭМ-фото опала (Opl), образовавшегося по кварцу (Qz). (а) – общий вид (пунктир показывает уровень раствора в опыте, стрелка показывает канавку, по которой поднимался раствор); (б) – деталь фото (а) при большем увеличении; (в) – ямки травления на кварце; (г) – сферы опала, сложенные микрокристаллами; (д) – гроздеобразный агрегат опала; (е) – деталь фото (д) при большем увеличении.

Серия II
Значения m в верхнем и нижнем автоклаве близки и находились между соответствующими значениями в серии I (табл. 2). Сходимость баланса масс кремнезема была значительно лучше, что объясняется более тщательной очисткой кристаллов от примесей перед опытами путем многократного кипячения их в HCl и в воде (см. методику). Шлифование внутренних стенок автоклавов перед опытами сказалось в уменьшении количества опала на стенках, особенно в верхнем автоклаве. Однако создание шероховатой поверхности граней кристаллов не привело к увеличению количества вторичного опала на кварце. Опал на кварце образовался только в нижнем автоклаве в виде белого ободка шириной 2 мм в средней части кристалла, где находилась граница вода-пар. Совмещение для этого кристалла 3d-моделей, построенных до и после опытов, позволило получить диаграмму отклонений размеров кристалла (рис. 4). На этой диаграмме был вырезан кусок изображения кристалла с ободком. Разность объемов этого куска до и после опытов (объем ободка) равна 1.4 мм3, что соответствует массе опала 3 мг (при плотности опала 2.2 г/см3). Следует отметить, что сразу после опыта опала на ободке было больше, но после промывки и высушивания кристалла кварца часть опала (2 мг) от ободка отвалилась.
Серия III
Эти данные использовались для определения константы скорости растворения кварца в насыщенном водяном паре при 300°С. Вычисления проводились с использованием интегрального уравнения скорости растворения кварца в жидкой воде (Rimstidt, Barnes, 1980):
(5)
${{m}_{w}} = {{m}_{{w,eq}}}\left[ {1 - \exp \left( { - \frac{{S{{k}_{w}}{\text{t}}}}{{{{M}_{w}}{{m}_{{w,eq}}}}}} \right)} \right],$(6)
${{k}_{v}} = - \frac{{{{m}_{{w,eq}}}{{M}_{w}}}}{{S{\text{t}}}}\ln \left( {1 - \frac{{{{m}_{w}}}}{{{{m}_{{w,eq}}}}}} \right).$(7)
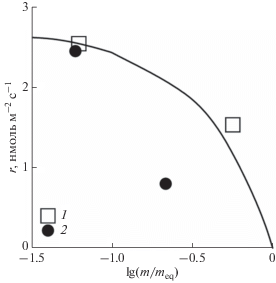
$r = \frac{{dn}}{{Sd{\text{t}}}} = {{k}_{{v}}}\left( {1 - \frac{{{{m}_{w}}}}{{{{m}_{{w,eq}}}}}} \right),$Рис. 5.
Удельная скорость растворения кварца в водяном паре (r) в зависимости от степени насыщения пара кремнеземом (m/meq). Линия – расчет по уравнению (7) при kv = 2.7 нмоль м–2 с–1, значки – экспериментальные данные, полученные в верхних (1) и нижних (2) автоклавах.
В другом способе измерения kv используется только уравнение (7), но лишь для условий, далеких от равновесия (mw$ \ll $ mw,eq). В этом случае выражение в скобках близко к 1, а величина n возрастает линейно с увеличением t. В результате
Условия, далекие от равновесия, были в двух кратковременных опытах (табл. 2). Для них значения kv, вычисленные по уравнению (8), были 2.5 и 2.6 нмоль м–2 с–1, что практически совпадает со значением, приведенным на рис. 5. Следует отметить, что во всех случаях величина kv нормировалась к геометрической площади поверхности, вычисленной по данным 3d-сканирования кристаллов. В отличие от нормирования к общей площади поверхности, измеренной методом БЭТ, такой подход лучше соответствует механизму реакции, когда активно растворяются донья ямок травления (рис. 3в), а их боковые стенки остаются пассивными (Gautier et al., 2001). Температурная зависимость константы скорости растворения кварца в воде, тоже нормированная к геометрической площади поверхности, имеет вид (Tester et al., 1994):
где Еа – энергия активации реакции (90.1 кДж/моль), R – газовая постоянная (0.008314 кДж моль–1 град–1), Т – абсолютная температура (К). Вычисление по уравнению (9) для 300°С (Т = 573.15) дает kw = 1.7 × 10–6 моль м–2 с–1. Отношение kw/kv =1.7 × 10–6/2.7 × 10–9 = 630 показывает большое различие в скоростях растворения кварца в воде и паре.ОБСУЖДЕНИЕ
Традиционный подход к поведению системы SiO2–H2O
В начальный период должно происходить насыщение воды и пара кремнеземом. Длительность этого процесса можно оценить по уравнению (5), представив его в виде:
(10)
${\text{t}} = - \left[ {\frac{{{{m}_{{eq}}}M}}{{kS}}} \right]\ln \left( {1 - \frac{m}{{{{m}_{{eq}}}}}} \right),$После достижения состояния, близкого к равновесию, должна начаться перекристаллизация кварца, если существует хотя бы небольшой температурный градиент. Поскольку растворимость кварца в воде и паре вблизи 300°С растет с повышением температуры, кварц должен растворяться в более горячей зоне и осаждаться в более холодной. Смоделируем этот процесс для серии II, когда граница вода-пар имеет температуру 300°С. С учетом высоты кристалла (6 см) и реальных температурных градиентов, температура воды и пара (Tw и Tv) равна 300 + 0.24 и 300–0.24°С в верхнем автоклаве, 300–0.45 и 300 + 0.45°С в нижнем. Такое скачкообразное изменение температуры принято для упрощения расчетов и может рассматриваться как условие оценки максимально возможной скорости перекристаллизации, равной скорости растворения или осаждения кварца в воде (слева) и осаждения или растворения его в паре (справа):
(11)
${{k}_{w}}{{S}_{w}}\left( {1 - {{m}_{w}}/{{m}_{{w,eq}}}} \right) = - {{k}_{{v}}}{{S}_{{v}}}\left( {1 - {{m}_{{v}}}{\text{/}}{{m}_{{{v},eq}}}} \right).$Поскольку mv = κmw, обе скорости влияют друг на друга. В результате устанавливается устойчивое состояние реакции с постоянным значением mw, которое можно вычислить из равенства (11) при Sw = Sv:
(12)
${{m}_{w}} = {{m}_{{w,eq}}}{{m}_{{{v},eq}}}\left( {{{k}_{w}} + {{k}_{{v}}}} \right){\text{/}}\left( {{{k}_{w}}{{m}_{{{v},eq}}} + {{k}_{{v}}}{{m}_{{w,eq}}}\kappa } \right).$Для температур, отличных от 300°С, значения mw,eq и mv,eq вычислены из уравнений, приведенных в работе (Plyasunov, 2012), значения kw вычислены из уравнения (9), kv = 0.00159kw (табл. 1), κ = = mv,eq/mw,eq (обе величины при температуре пара). Значения mw, вычисленные по уравнению (12), подставлялись в уравнение (11) и вычислялись скорости растворения и осаждения. Эти вычисления выполнены для широкого интервала значений Tw и Tv (от 300 ± 0.24 до 300 ± 30°С), причем не только для водно-паровой среды, но также для однофазных сред, водной и паровой.
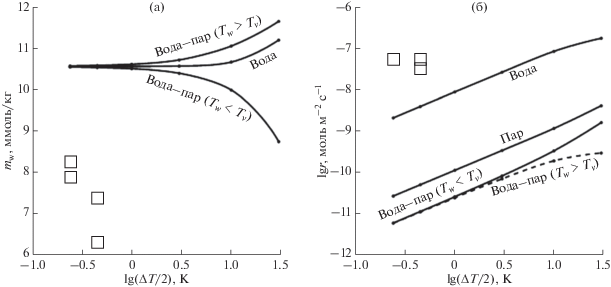
Расчеты показали, что в воде и паре при низкой разности температур воды и пара (ΔT) величина mw близка к равновесному значению, а с увеличением ΔT превышает его. То же происходит и в водно-паровой среде при Tw > Tv, но при Tw < Tv величина mw уменьшается (рис. 6а). В последнем случае минимальное значение mw = 8.75 ммоль/кг достигнуто при максимальном значении ΔT = 60°С. В экспериментах, выполненных по той же схеме, значения mw были ниже, а ΔT значительно меньше (0.48 и 0.9°С). Расчетные значения lg r растут почти линейно с увеличением lg ΔT/2 для всех сред с примерно одинаковым наклоном, но для паровой среды они ниже, чем для водной на ∼2 порядка, а для водно-паровой среды еще ниже на ∼0.5 порядка (рис. 6б). Расчетные значения скоростей для водной и паровой среды при T1 < T2 и T1 > T2 (1 и 2 – низ и верх кристалла) были идентичными за исключением знака, т.к. направление переноса SiO2 было противоположным. На рис. 6 приведены максимально возможные скорости при допущении, что перенос растворенного кремнезема не сдерживает скорость реакции. Это справедливо лишь при T1 > T2, когда возникают силы плавучести: более плотный (холодный) флюид опускается вниз, а менее плотный (горячий) всплывает вверх. В результате раствор перемешивается, что вызывает быстрый конвективный перенос кремнезема от места растворения к месту осаждения. При T1 < T2 раствор не перемешивается, перенос SiO2 осуществляется только путем медленной диффузии. В результате скорость перекристаллизации кварца может быть значительно меньше (Hosaka, Taki, 1986). Сказанное выше относится и к водно-паровой среде. Здесь расхождения в расчетах для Tw < Tv и Tw > Tv возникли только из-за отсутствия значений κ для воды и пара, которые имеют разные температуры. Поэтому величина κ принималась равной отношению mv,eq/mw,eq при температуре пара Tv. Поскольку это отношение уменьшается с уменьшением температуры, уменьшение κ в уравнении (12) с увеличением ΔT для серии Tw > Tv приводит к дополнительному увеличению mw (по сравнению с чистой водой), а увеличение κ для серии Tw > Tv дает обратную картину (рис. 6а).
Рис. 6.
Концентрации растворенного кремнезема mw (а) и удельные скорости растворения кварца r (б) при его перекристаллизации в зависимости от разности температур (ΔT) между верхом и низом кристалла кварца для водной, паровой и водно-паровой среды. В последнем случае температура воды больше температуры пара (Tw > Tv) или наоборот (Tw < Tv). Линии – расчет по уравнениям (11) и (12), значки – опыты по превращению кварца в опал (серии I и II).
Суммируя изложенное выше, в данной системе можно было ожидать лишь быстрое (за 2–3 сут) насыщение воды кремнеземом и последующую медленную (экспериментально практически незаметную) перекристаллизацию кварца. Образование опала в результате растворения кварца термодинамически запрещено, т.к. опал имеет более высокую растворимость, чем кварц, а пересыщенный относительно опала раствор не может образоваться в результате растворения кварца.
Серии опытов I и II показали, что реакция превращения кварца в опал не только возможна, но она протекает со значительно большей скоростью (на ∼3.5 порядка), чем простая перекристаллизация кварца (рис. 6б). При этом значения mw сохраняются заметно ниже растворимости кварца на протяжении всей реакции (рис. 6а). Таким образом, традиционный подход не способен адекватно предсказать ни фазовый состав данной системы, ни скорости минеральных превращений в ней.
Самопроизвольная дистилляция раствора
Интенсивность испарения жидкости в лиофильных капиллярах возрастает линейно с увеличением не площади сечения, как при равномерном испарении, а диаметра (окружности) капилляра (Buffone, Sefiane, 2004a; Sefiane, Ward, 2007). Температура поверхности жидкости при ее испарении сильно понижается вблизи стенки капилляра (Buffone, Sefiane, 2004b; Buffone et al., 2004). Эти и многие другие данные говорят о том, что испарение жидкости происходит не равномерно со всей поверхности, а преимущественно на контакте с твердой стенкой, где образуется вогнутый мениск. На краю мениска выделяют три области (Plawsky et al., 2008). Внешняя область представляет собой тонкую адсорбционную пленку, которая не испаряется, т.к. находится под действием сильных адгезионных сил (расклинивающего давления). Во внутренней области, которая находится под действием капиллярных сил, большая толщина мениска увеличивает его термальное сопротивление и, соответственно, уменьшает испарение. В промежуточной области мениска толщиной до 100 нм расклинивающее давление уже ослаблено, а термальное сопротивление еще небольшое, что обеспечивает максимальный локальный перегрев и, соответственно, максимальную интенсивность испарения. Испарение уменьшает толщину края мениска и увеличивает его кривизну, что вызывает градиенты расклинивающего и капиллярного давления. К этим силам присоединяется термокапиллярный эффект (эффект Марангони), т.к. понижение температуры в области максимального испарения увеличивает поверхностное натяжение жидкости и вызывает его градиент. В результате суммарного действия трех сил жидкость движется в область максимального испарения из основного ее объема.
В закрытой системе с установившемся физическим равновесием вода–пар скорости испарения и конденсации равны. Обычно это равенство скоростей относят к любому участку поверхности воды, игнорируя наличие стенок. Однако, с учетом сказанного выше, при наличии гидрофильных стенок испарение и конденсация должны несколько преобладать соответственно вблизи и вдали от них. Такое пространственное разъединение мест испарения и конденсации воды могло бы остаться незаметным, если бы не растворенный кремнезем, который визуализировал этот процесс осаждением опала и уменьшением mw. Этот процесс самопроизвольной дистилляции раствора описывается уравнением замены каждой порции испарившегося раствора на конденсат (Алексеев и др., 2018):
(13)
${{m}_{w}}_{{,{\text{t}}}} = \left( {{{m}_{w}}_{{,0}} - {{m}_{{v}}}} \right)\exp \left( { - JS{\text{t/}}{{M}_{w}}} \right) + {{m}_{{v}}},$Новые данные, полученные в этой работе, позволяют выделить два пути эволюции системы в зависимости от разной структуры поверхности кристаллов кварца. Первый путь (серия I) привел к рассеянному отложению опала на кварце значительно выше границы вода–пар (рис. 3а), что обусловлено высокой скоростью подъема пленки раствора и низкой скоростью испарения. Важную роль в этом сыграла естественная канавка на кварце, которая была изначально и пересекала границу вода–пар (стрелка на рис. 3а). Быстрому подъему раствора способствовали углы у дна канавки, которые инициировали этот процесс (Hofmann et al., 2010). Натечные отложения опала вокруг канавки фиксировали пути движения раствора, который поднимался по канавке, растекался по грани и, испаряясь, отлагал опал. Для этого случая возможно достижение устойчивого состояния с равными скоростями растворения кварца и осаждения опала, которое может быть описано уравнением (11), но параметры в правой части должны относиться к опалу (Op) и водной пленке (f):
(14)
${{k}_{w}}{{S}_{w}}\left( {1 - {{m}_{w}}{\text{/}}{{m}_{{w,eq}}}} \right) = - {{k}_{{Op}}}{{S}_{{Op}}}\left( {1 - {{m}_{f}}{\text{/}}{{m}_{{w,eq}}}} \right).$Второй путь (серия II) привел к компактному отложению опала на границе вода–пар (рис. 4), что обусловлено низкой скоростью подъема пленки раствора и высокой скоростью испарения раствора (осаждения опала). Испарение поднимающейся вверх пленки раствора увеличивает концентрацию кремнезема в верхней ее части в большей степени, чем в нижней, т.к. она дольше подвергается испарению. В пленке возникает градиент концентрации SiO2, который вызывает диффузионный поток кремнезема, направленный вниз, навстречу поднимающейся пленке раствора. Необходимым условием дистилляции является превышение скорости подъема пленки над скоростью диффузии растворенного кремнезема в этой пленке в обратном направлении. Расчеты показали, что это условие выполняется при толщине водной пленки менее 50 мкм (Alekseyev et al., 2019). Поскольку опал пористый, пленка порового раствора в толстой корке опала (рис. 4) превышает эту толщину и наступает режим диффузионного сдерживания дистилляции.
Концентрации растворенного кремнезема в нижних автоклавах были несколько меньше, чем в верхних, во всех сериях (табл. 2). Образование опала также больше приурочено к нижним автоклавам. Поскольку положение автоклава в печи влияло на температурный градиент (ТГ), можно говорить о некотором влиянии ТГ на результаты опытов. Это влияние проявилось и в опытах с кремний-содержащим раствором (Alekseyev et al., 2019), где дистилляция в верхних автоклавах протекала несколько медленнее, чем в нижних. В настоящее время не хватает данных, чтобы объяснить это различие. Можно только предполагать влияние конденсации пара на стенках при уменьшении температуры снизу–вверх или влияние абсолютной величины ТГ, связав ее с величиной перегрева на краю мениска. Если последнее предположение верно, то уменьшение ТГ до среднего геотермального градиента (30°/км или 3 × 10–4°/см) вроде бы должно привести к практическому прекращению дистилляции. Однако важен не средний, а локальный ТГ, величина которого в конкретных природных условиях (вблизи горячих интрузий и путей движения гидротермальных растворов, при протекании реакций) и в наших экспериментах может быть вполне соизмерима. Например, величина ТГ в отвале пород составляла 65°С на 10 м или 0.065°/см вследствие протекания экзотермической реакции окисления пирита с содержанием 7% (Lefebvre et al., 2001).
Геохимические приложения
Для открытых природных систем известны похожие процессы. Например, ползучесть (creeping) раствора соли по стенке и в порах в виде тонкой пленки за пределы его основного объема и последующее испарение пленки вызывает ползучесть самой соли (Van Enckevort, Los, 2013). Необычное превращение кварца в опал наблюдалось при выветривании окаменелого дерева (микрокристаллического кварца), которое частично выступало из склона реки (Senkayi et al., 1985). Обладая высокой пористостью, оно играло роль насоса, который во влажный период втягивал в себя грунтовую воду под действием капиллярных сил и насыщал воду кремнеземом. В сухой период эта вода поднималась к поверхности и испарялась, отлагая опал.
Для закрытых природных систем подобные явления тоже возможны в полостях с водой и паром, ограниченных гидрофильной стенкой. При затухании гидротермальной деятельности (при уменьшении Т, Р) происходит гетерогенизация (вскипание) водного флюида в этих полостях и появляется граница вода–пар. Стенки полостей состоят из минералов и пород, которые хорошо смачиваются водой (Mazurek et al., 2009; Kowalczuk et al., 2017), а при повышенных температурах их гидрофильность усиливается (Adamson, Gast, 1997; Friedman et al., 2013). Часто наблюдается асимметрия кристаллизационных полостей (крупные кристаллы вверху), которая объясняется ростом верхних кристаллов за счет растворения нижних (Асхабов, 1993). Дистилляция раствора может быть тем механизмом, который вызывает эту перекристаллизацию. Отличительной ее особенностью является переотложение любых компонентов раствора и возобновление растворяющей способности раствора. Поэтому полость имеет способность мигрировать вниз из-за постоянного растворения ее дна. В результате небольшой объем раствора может вызвать фазовые превращения в большом объеме породы. Эти превращения способны протекать даже от стабильных к метастабильным фазам, причем со скоростью, которая значительно превышает скорость простой перекристаллизации.
ЗАКЛЮЧЕНИЕ
Ранее в экспериментах мы получили необычное превращение стабильного кварца в метастабильный опал, который осаждался на стенки платиновых ампул выше уровня жидкой воды. В данной работе опал осаждался непосредственно на кварц, т.е. ситуация была более реальной для природных условий. Действительно, в опытах при 300°С нижняя часть кристалла кварца, расположенная в жидкой воде, растворялась, а на верхней его части, расположенной в паре, осаждался опал (рис. 3 и 4), который имел кристобалит-тридимитовую структуру (рис. 2). Концентрации кремнезема, растворенного в жидкой воде после длительных опытов (42 и 77 сут), оставались на 20–30 отн. % ниже равновесных, однако по кинетическим расчетам равновесие должно достигаться уже за 2 сут, причем и в воде, и в паре, хотя константа скорости растворения кварца для пара, впервые измеренная нами для 300°С (2.7 нмоль м–2 с–1), в 630 раз меньше, чем для воды (рис. 5).
Согласно традиционному подходу, после достижения близравновесного состояния возможна только перекристаллизация кварца, вызванная температурным градиентом (ТГ), причем со скоростью, значительно меньшей, чем фактическая скорость образования опала (рис. 6). Такие расхождения в направлении и скорости фазовых переходов объясняются тем, что в традиционном геохимическом подходе не учитывается влияние границы вода–пар и ее взаимодействие с твердой стенкой. Объяснение необычного поведения кремнезема дано в рамках гипотезы дистилляции, основанной на явлении преимущественного испарения воды в тонкой (<100 нм) пленке на краю мениска у гидрофильной твердой стенки. Новым дополнением этой гипотезы явилось обнаружение двух путей эволюции системы в зависимости от отношения скоростей подъема пленки раствора и испарения. При высоком и низком отношении этих скоростей происходило соответственно рассеянное (рис. 3) и компактное (рис. 4) осаждение опала. Таким образом, дистилляция раствора, вызванная аномальными свойствами нанопленки флюида на стенке, кардинально изменяет фазовый состав системы и скорость минеральных превращений.
Самопроизвольная дистилляция может протекать в кристаллизационных полостях, частично заполненных раствором, что типично для затухающей стадии гидротермального процесса, когда происходит гетерогенизация раствора. Отложение новых минералов (в том числе метастабильных) вверху полости и растворение старых минералов внизу со временем может привести к миграции полости вниз и к переотложению большой массы породы с помощью небольшой массы воды.
Авторы благодарят рецензентов Н.Н. Акинфиева и В.С. Балицкого за сделанные замечания, учет которых позволил улучшить качество статьи.
Список литературы
Алексеев В.А. (2019) Наночастицы и нанофлюиды при взаимодействиях вода–порода. Геохимия (4), 343-355.
Alekseyev V.A. (2019) Nanoparticles and nanofluids in water–rock interactions. Geochem. Int. 57(4), 357-368.
Алексеев В.А., Медведева Л.С. (2018) Распределение кремнезема в системе кварц–вода–пар в зависимости от температурного градиента. Геохимия (2), 147-159.
Alekseyev V.A., Medvedeva L.S. (2018) Silica distribution in the system quartz–water–vapor depending on the temperature gradient. Geochem. Int. 56 (2), 136-147.
Алексеев В.А., Медведева Л.С., Балашов В.Н., Бурмистров А.А., Громяк И.Н. (2018) Экспериментальное исследование неравновесного переноса кремнезема из жидкой воды в паровую фазу. Геохимия (7), 605-615.
Alekseyev V.A., Medvedeva L.S., Balashov V.N., Burmistrov A.A., Gromyak I.N. (2018) Experimental study of unequilibrated silica transfer from liquid water to the vapor phase. Geochem. Int. 56 (7), 617-627.
Алексеев В.А., Медведева Л.С., Старшинова Н.П. (2013) Парадоксальное превращение равновесной системы кварц–вода в неравновесную. Геохимия (5), 428-452.
Alexeyev V.A., Medvedeva L.S., Starshinova N.P. (2013) Paradoxical transformation of the equilibrium quartz–water system into an unequilibrated one. Geochem. Int. 51 (5), 382-404.
Асхабов А.М. (1993) Кристаллогенезис и эволюция системы “кристалл–среда”. Санкт-Петербург: Наука, 154 с.
Дэна Дж.Д., Дэна Э.С., Фрондель К. (1966) Система минералогии. Т. 3. Минералы кремнезема. М.: Мир, 431 с.
Лукашов Ю.М., Фурсенко В.Ф., Попов А.С. (1971) Методика экспериментального исследования распределения кремниевой кислоты между кипящей водой и равновесным с ней паром в широком диапазоне давлений и концентраций. Вопросы отопления и вентиляции (ред. Е.А. Штокман). Ростов-на-Дону: Мин-во высшего и среднего спец. образования РСФСР, 113-123.
Adamson A.W., Gast A.P. (1997) Physical chemistry of surfaces. 6th ed. John Wiley & Sons. New York.
Alekseyev V., Balashov V., Medvedeva L., Opolchentsev A. (2019) Spontaneous distillation of silica-bearing solution in closed system with rough walls. E3S Web of Conferences 98, 04001.
Bettermann P., Liebau F. (1975) The transformation of amorphous silica to crystalline silica under hydrothermal conditions. Contrib. Mineral. Petrol. 53, 25-36.
Bico J., Thiele U., Quéré D. (2002) Wetting of textured surfaces. Colloids and Surfaces A 206, 41-46.
Buffone C., Sefiane K. (2004a) Investigation of thermocapillary convective patterns and their role in the enhancement of evaporation from pores Int. J. Multiphase Flow 30 (9), 1071-1091.
Buffone C., Sefiane K. (2004b) IR measurements of interfacial temperature during phase change in a confined environment. Experim. Therm. Fluid Sci. 29 (1), 65-74.
Buffone C., Sefiane K., Christy J.R.E. (2004) Experimental investigation of the hydrodynamics and stability of an evaporating wetting film placed in a temperature gradient. Applied Therm. Engineering 24 (8-9), 1157-1170.
Dove P.M. (1995) Kinetic and thermodynamic controls on silica reactivity in weathering environments. Rev. Mineral. 31, 235-290.
Friedman S.R., Khalil M., Taborek P. (2013) Wetting transition in water. Phys. Rev. Lett. 111, (22), 226101.
Gautier J.-M., Oelkers E.H., Schott J. (2001) Are quartz dissolution rates proportional to B.E.T. surface areas? Geochim. Cosmochim. Acta 65 (7), 1059-1070.
Graetsch H., Gies H., Topalović I. (1994) NMR, XRD and IR study on microcrystalline opals. Phys. Chem. Minerals 21, 166-175.
Hofmann T., Tasinkevych M., Checco A., Dobisz E., Dietrich S., Ocko B. M. (2010) Wetting of nanopatterned grooved surfaces. Phys. Rev. Lett. 104 (10), 106102.
Hosaka M., Taki S. (1986) Hydrothermal growth of quartz crystals at low fillings in NaCl and KCl solutions. J. Cryst. Growth 78, 413-417.
Isaacs C.M. (1982) Influence of rock composition on kinetics of silica phase changes in the Monterey Formation, Santa Barbara area, California. Geology 10, 304-308.
Kowalczuk P.B., Akkaya C., Ergun M., Janicki M.J., Sanbaz O., Drzymala J. (2017) Water contact angle on corresponding surfaces of freshly fractured fluorite, calcite and mica. Physicochem. Probl. Miner. Process. 53 (1), 192-201.
Lefebvre R., Hockley D., Smolensky J.,Gélinas P. (2001) Multiphase transfer processes in waste rock piles producing acid mine drainage: 1. Conceptual model and system characterization. J. Contam. Hydrol. 52(3-4), 137-164.
Lynne B.Y., Campbell K.A., Moore J.N., and Browne P.R.L. (2005) Diagenesis of 1900-year-old siliceous sinter (opal-A to quartz) at Opal Mound, Roosevelt Hot Springs, Utah, U.S.A. Sedimentary Geology 179, 249-278.
Mazurek A., Pogorzelski S.J., Boniewicz-Szmyt K. (2009) Adsorption of natural surfactants present in sea waters at surfaces of minerals: Contact angle measurements. Oceanologia 51 (3), 377-403.
Okamoto A., Saishu H., Hirano N., and Tsuchiya N. (2010) Mineralogical and textural variation of silica minerals in hydrothermal flow-through experiments: Implications for quartz vein formation. Geochim. Cosmochim. Acta 74(13), 3692-3706.
Plawsky, J.L., Ojha, M., Chatterjee, A., Wayner Jr., P.C. (2008) Review of the effects of surface topography, surface chemistry, and fluid physics on evaporation at the contact line. Chem. Engin. Commun. 196, 658-696.
Plyasunov A.V. (2012). Thermodynamics of Si(OH)4 in the vapor phase of water: Henry’s and vapor–liquid distribution constants, fugacity and cross virial coefficients. Geochim. Cosmochim. Acta 77, 215-231.
Rimstidt J.D., Barnes H.L. (1980) The kinetics of silica–water reactions. Geochim. Cosmochim. Acta 44(11), 1683-1699.
Sefiane K., Ward C.A. (2007) Recent advances on thermocapillary flows and interfacial conditions during the evaporation of liquids. Adv. Colloid Interface Sci. 134-135, 201-223.
Senkayi A.L., Dixon J.B., Hossner L.R., Yerima B.P.K., Wilding L.P. (1985) Replacement of quartz by opaline silica during weathering of petrified wood. Clays Clay Miner. 33(6), 525-531.
Tester J.W., Worley W.G., Robinson B.A., et al. (1994) Correlating quartz dissolution kinetics in pure water from 25 to 625°C. Geochim. Cosmochim. Acta 58 (11), 2407-2420.
Van Enckevort W.J.P., Los J.H. (2013) On the creeping of saturated salt solutions. Cryst. Growth Des. 13 (5), 1838-1848.
Verma M.P. (2000) Chemical thermodynamics of silica: a critique on its geothermometer. Geothermics 29, 323-346.
Williams L.A., Crerar D.A. (1985) Silica diagenesis, II. General mechanisms. J. Sedimentary Petrology 55 (3), 312-321.
Дополнительные материалы отсутствуют.



