Геохимия, 2021, T. 66, № 4, стр. 379-384
Применение метода восстановления серы реактивом Киба для последующего изотопного анализа природных сульфатов и серной кислоты
В. В. Яковенко a, *, А. В. Игнатьев a, Т. А. Веливецкая a
a Дальневосточный геологический институт ДВО РАН
690022 Владивосток, просп. 100-лет Владивостоку, 159, Россия
* E-mail: yakovenko_v.v@mail.ru
Поступила в редакцию 03.06.2020
После доработки 23.07.2020
Принята к публикации 06.08.2020
Аннотация
В данной статье простой и надежный метод восстановления сульфатов с использованием реактива Киба, адаптирован для подготовки микроколичеств природных сульфатов и серной кислоты к изотопному (δ34S, δ33S и δ36S) анализу серы. Показано, что метод успешно применим для подготовки образцов сульфатов и серной кислоты с содержанием серы от 0.1 мг для изотопного анализа изотопов 34S, 33S и 36S. Точность определения δ34S природных сульфатов составила ±0.3‰, точность определения δ34S, ∆33S, ∆36S серной кислоты составила ±0.5, ±0.027 и ±0.38‰ соответственно.
ВВЕДЕНИЕ
Сера имеет четыре стабильных изотопа 32S, 33S, 34S и 36S с распространенностью 95.04, 0.75, 4.20 и 0.015%, соответственно. Соотношения всех четырех изотопов 33S/32S, 34S/32S, 36S/32S представляет особый интерес при изучении метеоритного вещества, а так же сульфидов из древних осадочных пород. В частности, речь идет об изотопной аномалии серы (Δ33S и Δ36S) в осадочных породах старше, чем 2.5 млрд лет. Данная аномалия заключается в избыточном содержании изотопа 33S и 36S в сульфидных минералах. Обнаружение изотопных аномалий серы явилось свидетельством глобальных изменений в геохимическом цикле серы на рубеже архея и протерозоя, что связывают с эволюцией газового состава атмосферы и фотохимическими процессами в атмосфере на ранних этапах развития Земли (Farquhar et al., 2000; Pavlov, Kasting, 2002; Lyons, 2007).
Понимание причин возникновения изотопной аномалии в архейских породах во многом основано на результатах экспериментальных исследований по выяснению возможных механизмов и специфических условий, которые приводят к формированию аномального изотопного состава серы. Основная часть экспериментальных работ связана с изучением фракционирования изотопов серы в процессе фотолиза SO2, как одного из возможных источников возникновения аномального изотопного состава серы. Эксперименты проводились при различных условиях с последующим исследованием закономерностей распределения изотопов серы (δ33S, δ34S, δ36S) и магнитуд изотопных аномалий (Δ33S, Δ36S) в продуктах фотохимических реакций (Farquhar et al, 2001; Masterson et al., 2011; Ono et al., 2013; Whitehill et al., 2015; Endo et al., 2019). Продуктами фотолиза SO2 являются: восстановленная форма серы – элементарная сера (S0) и окисленная форма – SO3 (Устинов и др., 1988). При взаимодействии SO3 с парами воды образуется серная кислота H2SO4.
Обычно анализ δ34S, δ33S и δ36S выполняют с использованием метода фторирования сульфидов (Hu et al., 2003; Ono et al., 2006, Franz et al., 2013). Для этого поэтапно проводят восстановление серы сульфатных образцов (${\text{SO}}_{4}^{{2 - }}$) до сероводорода (H2S) с последующим преобразованием H2S в сульфид серебра (Ag2S) (Ueno et al., 2008; Ono et al., 2009). Полученный образец сульфида серебра Ag2S фторируют для конвертирования серы в форму SF6 и дальнейшего измерения изотопных отношений серы на масс-спектрометре (Ono et al., 2009; Masterson et al., 2011; Penniston-Dorland et al., 2012; Geng et al., 2017). Проблема заключается в том, что при проведении фотохимических экспериментов количественный выход продуктов реакций (H2SO4) зачастую критично низкий. Поэтому возникает необходимость в простом и надежном методе для подготовки микрообразцов серной кислоты к масс-спектрометрическому измерению отношений четырех стабильных изотопов серы (32S, 33S, 34S и 36S).
В работах последних лет процедура восстановления ${\text{SO}}_{4}^{{2 - }}$ до H2S осуществляют с помощью реактива Тода. Это смесь иодистоводородной кислоты (HI) с фосфорноватистой кислотой (H3PO2) (Franz et al., 2013; Arnold et al., 2014; Guo ZhaoBing et al., 2014) или гипофосфитом натрия (NaH2PO2) (Geng et al., 2017). Стоимость данных реактивов довольно высока, кроме того сама процедура восстановления может занимать от 4 часов до недели.
В некоторых работах (Hong et al., 2000; Mandeville et al., 2009; Hammerly et al., 2017) упоминается метод восстановления сульфатов с помощью реактива Киба – раствора хлористого олова(II) (SnCl2) с фосфорной кислотой (H3PO4). Его готовят путем нагревания (280°C) смеси из 20-80 г чистого SnCl2 и 200 мл дегидратированной ортофосфорной кислоты в потоке N2 или CO2. Реакция идет с бурным выделением газообразного HCl. Полученный реактив Киба может храниться в эксикаторе над CaCl2 несколько месяцев (Kiba et al., 1955).
Сасаки с соавторами успешно использовали реактив Киба применительно к изотопному анализу δ34S серы. Было показано, что данный метод может работать наряду с реактивом Тода и превосходит его по таким параметрам, как экспрессность и количество восстановительного реактива, необходимого для одной реакции (Sasaki et al., 1979).
Основным недостатком классического варианта процедуры восстановления сульфатов с применением реактива Киба является то, что метод рассчитан на использование довольно большого объема образцов (0.5–10 г) и, соответственно, восстановительного реактива (50–100 мл). Это является серьезным ограничением в применении данного метода для работы с микрообразцами, в том числе с микроколичествами серной кислоты.
В данной работе метод восстановления сульфатов, с использованием реактива Киба, адаптирован для подготовки микроколичеств природных сульфатов и образцов серной кислоты к изотопному (δ34S, δ33S и δ36S) анализу серы. В качестве продувочного газа использовался гелий, т.к. он содержит меньшее количество кислорода, который может негативно сказаться на выходе продукта. Показано, что метод успешно применим для подготовки образцов сульфатов и серной кислоты с содержанием серы от 0.1 до 3.5 мг для изотопного анализа серы δ34S, δ33S и δ36S.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура и материалы
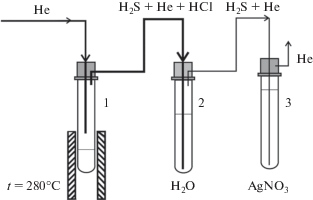
Для подготовки образцов к изотопному анализу серы и приготовления реактива Киба была использована установка, изображенная на рисунке 1. Она состоит из реакционной камеры (1), камеры очистки газа (2), камеры осаждения сульфида серебра (3). В качестве камер были использованы сменные пробирки объемом 10 мл из термостойкого стекла. Камеры соединены между собой тефлоновыми трубками с внешним диаметров 4 мм. Для уплотнения соединений были использованы тефлоновые переходники и витоновые кольца. Вся система находится под постоянной продувкой гелием. Предварительные опыты показали, что гелий, в качестве продувочного газа, обеспечивает наиболее полный выход продукта реакции (Ag2S), в сравнении с аргоном. Гелий поступает в реакционную камеру через капилляр с внешним диаметром 1.6 мм, поток 1 см3 Для выхода гелия, во избежание подсоса кислорода из атмосферы, использован капилляр с внешним диаметром 1.6 мм.
Для нагрева реакционной камеры (280°C) использована трубчатая печь.
Реактив Киба
Для приготовления реактива Киба в реакционную камеру 1 наливают 10 мл ортофосфорной кислоты (H3PO4) и продувают гелием (30 см3 мин–1) в течение 5 минут для удаления воздуха из камеры. Затем на камеру надвигают трубчатый нагреватель (280°C) и прогревают H3PO4 в течение 30 минут для обезвоживания кислоты. После этого дают кислоте остыть до комнатной температуры и добавляют к ней 1 г хлорида олова (SnCl2 ⋅ 2H2O). В камеру очистки газа (2) наливают 5 мл бидистиллированной воды. Камеры (1) и (2) последовательно подсоединяют к линии продувки гелием. При потоке гелия 10 см3 мин–1 достаточно 10 минут, чтобы вытеснить воздух из камер. Для получения реактива Киба производят нагрев реакционной камеры (280°C). Процесс образования реактива Киба сопровождается выделением хлороводорода (HCl). Для его поглощения служит камера (2), заполненная бидистиллированной водой. После того как закончится выделение хлороводорода (HCl) нагрев реакционной камеры продолжается еще в течение 30 минут. Готовый реактив охлаждают в токе гелия. Реактив хранят в закрытой стеклянной емкости в атмосфере гелия.
Процедура подготовки образцов сульфата к изотопному анализу серы
В реакционную камеру (1) помещают образец, добавляют 1 мл реактива Киба, перемешивают. В камеру (2) наливают 5 мл бидистиллированной воды, в камеру (3) – 10 мл 0.1 M раствора нитрата серебра (AgNO3). Камеры подсоединяют к линии и всю систему продувают гелием в течение 10 минут (поток гелия 10 см3 мин–1).
После этого реакционную камеру нагревают (280 °C). Происходит восстановление серы сульфата до сероводорода по реакции (1):
(1)
$4{\text{S}}{{{\text{n}}}^{{2 + }}} + {\text{S}}{{{\text{O}}}^{{4 - }}} + 10{{{\text{H}}}^{ + }} \to 4{\text{S}}{{{\text{n}}}^{{4 + }}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{\kern 1pt} \uparrow + \,4{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Образовавшийся в реакционной камере сероводород с потоком гелия (поток гелия 6 см3 мин–1) поступает сначала в камеру очистки (2) для удаления HCl из газовой смеси. Сероводород плохо растворим в воде, кроме того HCl создает рН < 5 (Алексеев, 1972). В этих условиях подавляется диссоциация сероводорода, поэтому H2S будет находиться в молекулярной форме и вместе с потоком гелия перейдет в камеру осаждения сульфида серебра (3). Полноту фиксации сероводорода в растворе AgNO3 контролировали с помощью фильтровальной бумаги смоченной раствором уксуснокислого свинца. Образование Ag2S идет по реакции (2):
(2)
${\text{AgN}}{{{\text{O}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}} = {\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{S}}{\kern 1pt} \downarrow + \,{\text{HN}}{{{\text{O}}}_{3}}.$Продолжительность реакции определялась экспериментально, по массовому выходу сульфида серебра из раствора серной кислоты известной концентрации (данные экспериментов представлены в разделе “Правильность и воспроизводимость метода для образцов H2SO4”). Установлено, что ~20 минут достаточно для завершения реакции. Вся процедура от начала нагрева до получения Ag2S занимает 30–40 минут.
Полученный образец сульфида серебра (Ag2S) промывают бидистиллированной водой 3 раза, затем просушивают при 85–90°C.
Для проведения изотопного анализа серы, полученный порошок сульфида серебра был сплавлен в небольшую таблетку. Это сделано для более удобной дальнейшей работы с образцами при проведении изотопного анализа с использованием метода лазерной абляции (Ignatiev et al., 2018, 2019).
Плавление полученного порошка Ag2S осуществлялось в проточном реакторе. Реактор представляет собой кварцевую трубку (наружный диаметр – 10 мм, внутренний диаметр – 8 мм). Один конец трубки подсоединен к системе подачи гелия (поток гелия 30 см3 мин–1), другой конец остается открытым на атмосферу. Для нагрева реактора использовали трубчатую печь. Плавление образцов Ag2S производили в атмосфере гелия при 800°C. Для этого образец Ag2S, помещенный в кварцевый прободержатель, вносят в холодную зону реактора на 30 с для продувки образца гелием и затем продвигают в зону плавления на 1 минуту. Сплавленный образец Ag2S используют для дальнейшего изотопного анализа.
Изотопный анализ
Изотопный анализ серы был выполнен в лаборатории стабильных изотопов ДВГИ ДВО РАН с применением локального лазерного метода (Ignatiev et al., 2018, 2019). Измерение изотопных отношений серы проводилось на изотопном масс-спектрометре MAT 253 в форме SF6. Результаты изотопных анализов представлены в общепринятом виде и выражены в промилле (‰) относительно V-CDT: δXS = [(XRобр/XRст) – 1] × 1000, где XR = XS/32S (X = 33, 34, 36). Измерение изотопных отношений в образцах выполнено относительно лабораторного стандартного газа SF6, калиброванного относительно международных стандартов IAEA-S-1, IAEA-S-2, IAEA-S-3 и NBS-123. Воспроизводимость результатов (1σ) в повторных анализах международного стандарта IAEA-S-1 была 0.15‰, 0.02‰ и 0.3‰ для δ34S, Δ33S и Δ36S, соответственно.
Величина отклонения от масс-зависимого изотопного фракционирования обозначена, как Δ и представлена в следующей форме:
Δ33S = δ33S – [(δ34S + 1)0.515 – 1],
Δ36S = δ36S – [(δ34S + 1)1.90 – 1].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Надежность и применимость предложенного метода подготовки проб сульфатов к изотопному анализу (δ34S, δ33S и δ36S) были установлены в серии тестов, используя природные образцы сульфатов с известным изотопным составом, а также образцы коммерческой серной кислоты. Достоверность полученных результатов оценена путем сопоставления данных изотопного анализа, полученных разными методами. Также измерение изотопных отношений в образцах выполнено относительно лабораторного стандартного BaSO4, калиброванного относительно международного стандарта NBS 127.
Воспроизводимость метода для образцов BaSO4
Воспроизводимость результатов была проверена прежде всего для δ34S величин на образцах природного сульфата и на образцах BaSO4 полученных путем осаждения серы из раствора коммерческой серной кислоты. Образцы природного сульфата бария, обозначенные как BaSO4-1, B-aSO4-2 и BaSO4-3, были проанализирован нами ранее, применяя классический метод окисления сульфатов окисью меди до SO2 при 1250°С в вакууме с последующим измерением δ34S на масс-спектрометре с двойной системой напуска. Значения δ34S, полученные классическим методом, составляли 7.4 ± 0.2, 25.4 ± 0.2, 11.5 ± 0.2‰ для BaSO4-1, BaSO4-2 и BaSO4-3, соответственно. Образец осажденного сульфата бария (обозначенный как BaSO4), также был проанализирован, используя классический метод, полученное значение δ34S = 10.65 ± 0.2‰. Навеска образцов составляла 5 мг.
В табл. 1 представлены результаты изотопного анализа δ34S для этих образцов, полученные с использованием методики восстановления сульфатов до Ag2S, предложенной в данной работе. Навеска образцов ~1 мг. Воспроизводимость δ34S для образцов, в среднем, составила 0.3‰ (1σ). Значения δ34S, полученные классическим и предложенным методом, согласуются в пределах ошибки. Достигнутая в нашем методе воспроизводимость анализов вполне удовлетворительная, что следует из сравнения с опубликованными данными (Arnold et al., 2014), полученными, с использованием реактива Тода и методом восстановления смесью иодистоводородной кислоты (HI) и гипофосфитом натрия (NaH2PO2) (Geng et al., 2017).
Таблица 1.
Изотопные данные δ34S образцов природного сульфата (BaSO4-1, BaSO4-2, BaSO4-3) и сульфата осажденного из раствора коммерческой серной кислоты (BaSO4), полученные классическим и предложенным методами. Навеска образов 1 мг
| Образец | δ34S, ‰ | |
|---|---|---|
| классический метод | предложенный метод | |
| BaSO4-1 | 7.4 ± 0.2 | 7.1 ± 0.3 (n = 3) |
| BaSO4-2 | 25.4 ± 0.2 | 25.7 ± 0.3 (n = 3) |
| BaSO4-3 | 11.5 ± 0.2 | 11.5 ± 0.4 (n = 2) |
| BaSO4 | 10.6 ± 0.2 | 10.8 ± 0.2 (n = 3) |
Полученные нами данные показывают, что процедура восстановления серы по предложенному методу не приводит к фракционированию изотопов серы, на что указывает совпадение изотопного состава серы δ34S (в пределах ошибки) для образцов, анализируемых разными методами (табл. 1).
Правильность и воспроизводимость метода для образцов H2SO4
Чтобы проверить возможность использования метода для подготовки проб серной кислоты к изотопному анализу серы, были приготовлены разные растворы H2SO4 с относительно высокой концентрацией (1 М) и низкой (0.05 M). В серии экспериментов была сделана оценка выхода продукта реакции Ag2S в процессе восстановления серы из образцов объемом 0.1 мл. Выход продукта реакции Ag2S был более 97% (табл. 2). Это свидетельствует о достаточно полном конвертировании сульфатной серы в сульфид, что позволяет избежать изотопного фракционирования серы. В табл. 2 приведены результаты δ34S для образцов серной кислоты с высокой и низкой концентрацией. Ярко выраженной зависимости значений δ34S от содержания серы в образцах не обнаружено. Точность определения δ34S для 1 M раствора составила 0.4‰, для 0.05 M раствора 0.5‰.
Таблица 2.
Выход продукта Ag2S и изотопный состав δ34S для образцов H2SO4 с концентрацией (1 М) и (0.05 M) и объемом 1 и 0.1 мл соответственно
| Концентрация H2SO4 в образце, моль/литр | Выход продукта Ag2S (%) | δ34S ,‰ |
|---|---|---|
| 1 | 96 | 9.9 |
| » | 95 | 10.7 |
| » | 97 | 10.1 |
| » | 99 | 10.0 |
| » | 95 | 10.6 |
| » | 98 | 10.8 |
| » | 95 | 10.4 |
| » | 96 | 10.0 |
| » | 92 | 9.8 |
| » | 98 | 11.0 |
| Среднее значение | 96 ± 2 | 10.3 ± 0.4 |
| 0.05 | 95 | 11.0 |
| » | 97 | 11.2 |
| » | 98 | 10.6 |
| » | 98 | 10.0 |
| » | 98 | 11.5 |
| » | 99 | 10.2 |
| » | 98 | 11.1 |
| Среднее значение | 98 ± 1 | 10.8 ± 0.5 |
Правильность результатов анализа δ34S была проверена путем сравнения δ34S с соответствующими результатами, полученными с помощью применения традиционного метода конвертирования H2SO4 в сульфат бария BaSO4. Анализы изотопного состава серы в полученных образцах BaSO4 были проведены тремя методами: (1) классическим методом окисления сульфатов окисью меди до SO2 в вакууме с последующим измерением δ34S на масс-спектрометре с двойной системой напуска, (2) по стандартному протоколу с применением элементного анализатора Thermo Scientific FlashEA 1112, соединенного с масс-спектрометром, в режиме непрерывного потока гелия и (3) методом восстановления BaSO4 до H2S и последующим превращением H2S в Ag2S, по предложенной нами методике. Результаты анализов представлены в табл. 3.
Мультиизотопный анализ микрообразцов серной кислоты
Применимость метода к изотопному анализу малораспространенных изотопов серы 33S и 36S была установлена в серии тестов, используя образцы раствора с низкой концентрацией H2SO4 (0.05 M). Это обусловлено тем, что растворы образцов H2SO4, представляющих интерес в фотохимических экспериментах, имеют довольно низкие концентрации H2SO4. В табл. 4 суммированы результаты определения δ34S значений и величины эффектов масс-независимого фракционирования изотопов 33S и 36S (∆33S и ∆36S). Для δ34S анализов получены практически такие же данные, как в предыдущих тестах. Результаты определений ∆33S и ∆36S показали значения близкие к нулю, что свидетельствует об отсутствии изотопной аномалии серы в данных образцах. Это ожидаемый результат, поскольку распределение изотопов в обычных химических процессах должно подчиняться закону масс-зависимого фракционирования. Отметим, что значимой величиной для ∆33S и ∆36S являются значения больше чем 0.1 и 1.5‰, соответственно, чтобы можно было рассматривать их как наличие масс-независимого эффекта. Полученные значения ∆33S и ∆36S воспроизводятся в пределах ±0.027 и ±0.38‰ (табл. 4), что не выходит за рамки той точности, которую может обеспечить метод фторирования проб с лазерной абляцией (Ignatiev et al., 2018).
Таблица 4.
Изотопные данные для микроообразцов 0.05 M H2SO4. (0.1 мл)
| № | δ34S, ‰ CDT | Δ33S, ‰ | Δ36S, ‰ |
|---|---|---|---|
| 1 | 11.0 | –0.002 | –0.86 |
| 2 | 11.2 | –0.038 | –0.57 |
| 3 | 10.6 | –0.013 | –0.86 |
| 4 | 10.0 | 0.005 | –0.86 |
| 5 | 11.5 | 0.019 | –0.66 |
| 6 | 10.2 | –0.003 | –0.95 |
| 7 | 11.0 | –0.061 | 0.16 |
Из этого следует, что предложенная процедура конвертирования микрообразцов сульфатной серы в сульфид не вносит дополнительной ошибки в конечный результат, а так же обеспечивает получение чистых проб Ag2S без примесных соединений, способных давать вклад в изотопное отношение серы 33S и 36S при масс-спектрометрических измерениях. Предложенный метод позволяет получать реальные результаты определения соотношений малораспространенных изотопов серы для исследования масс-независимых эффектов.
ЗАКЛЮЧЕНИЕ
Предложена адаптация метода восстановления сульфатной серы в сульфид с помощью реактива Киба для изотопного анализа серы. Метод применим для подготовки проб с низким содержанием сульфатной серы и пригоден для работы с образцами сульфатной серы, как в твердой (BaSO4), так и в жидкой фазе (H2SO4). В серии тестов продемонстрирована надежность и достоверность результатов определения изотопных соотношений серы, включая малораспространенные изотопы 33S и 36S. Возможность использовать одноразовые реакторы исключает наличие эффекта “памяти”. Метод способен обеспечить хороший уровень воспроизводимости результатов δ34S, ∆33S и ∆36S для образцов, как с низким, так и с высоким содержанием сульфатной серы. Для образцов в твердой фазе воспроизводимость δ34S составила ±0.2‰ для чистого BaSO4. Для образцов серной кислоты воспроизводимость составила 0.4 и 0.5‰ для растворов с концентрацией 1 и 0.05 M соответственно.
Достигнутый уровень воспроизводимости ±0.027‰ и ±0.38‰ для ∆33S и ∆36S, соответственно, является достаточным для изучения эффектов масс-независимого фракционирования серы в фотохимических экспериментах и исследования изотопных аномалий в природных архейских образцах. Т.е. предложенная адаптация метода, по все видимости, не влияет на воспроизводимость результатов мультиизотопного анализа серы. Достоинством метода является экспрессность, простота и малозатратность пробоподготовки сульфатов к мультиизотопному анализу серы. Предложенная система восстановления сульфатной серы в сульфид является простой в исполнении с использованием доступных и недорогих составных частей для установки.
Исследования выполнены при финансовой поддержке РФФИ (грант 18-05-00102).
Список литературы
Алексеев В.Н. (1972) Количественный анализ. М.: Химия, 504 с.
Устинов В.И., Гриненко В.А., Иванов С.Г. (1988) Изотопный эффект серы при фотолизе SO2. Известия академии наук СССР, химическая серия 5, 1192-1193.
Arnold GL, Brunner B, Müller IA, Roy H. (2014) Modern applications for a total sulfur reduction distillation method – what’s old is new again. Geochem. Transact. 15 (4).
De Hoog J., Taylor B., Van Bergen M. (2001) Sulfur isotope systematics of basaltic lavas from Indonesia: implications for the sulfur cycle in subduction zones. Earth Planet. Sci. Lett. 189 (3–4), 237-252.
Farquhar J., Bao H., Thiemens M.H. (2000) Atmospheric influence of Earths earliest sulfur cycle. Science 289(5480), 756-759.
Farquhar J., Savarino J., Airieau S., Thiemens M.H. (2001) Observation of wavelength-sensitive mass-independent sulfur isotope effects during SO2 photolysis: Implications for the early atmosphere. J. Geophys. Res. 106(E12), 32 829-32 839.
Franz H.B., Danielache S.O., Farquhar J, Wing B.A. (2013) Mass-independent fractionation of sulfur isotopes during broadband SO2 photolysis: comparison between 16O- and 18O-rich SO2. Chem. Geol. 362, 56–65.
Geng L., Savarino J., Savarino Clara A., Caillon N., Cartigny P., Hattori S., Ishino S., Yoshida N. (2017) A simple and reliable method reducing sulfate to sulfide for multiple sulfur isotope analysis. Rapid Commun. Mass Spectrom. 32, 333-341.
Guo ZhaoBing, Wu MengLong, Liu FengLing, Wei Ying, Li DongFang (2014) Multiple sulfur and oxygen isotope compositions in Beijing aerosol. Science China. Earth Sciences. 57 (11), 2671-2675.
Hammerli J., Kemp A., Barrett N., Wing B., Roberts M., Arculus R., Boivin P., Nude P.M., Rankenburg K. (2017) Sulfur isotope signatures in the lower crust: A SIMS study on S-rich scapolite of granulites. Chem. Geol. 454, 54-66
Hu G.X., Rumble D., Wang P.L. (2003) An ultraviolet laser microprobe for the in situ analysis of multisulfur isotopes and its use in measuring Archean sulfur isotope mass-independent anomalies. Geochim. Cosmochim. Acta 67, 3101-3118.
Ignatiev A.V., Velivetskaya T.A., Budnitskiy S.Y., Yakovenko V.V., Vysotskiy S.V., Levitskii V.I. (2018) Precision analysis of multisulfur isotopes in sulfides by femtosecond laser ablation GC-IRMS at high spatial resolution. Chem. Geol. 493, 316-326.
Ignatiev A.V., Velivetskaya T.A., Yakovenko V.V. (2019) Effect of Mass-Independent Isotope Fractionation of Sulfur (Δ33S and Δ36S) during SO2 Photolysis in Experiments with a Broadband Light Source. Geochem. Intern. 57(7), 751-760.
Kiba T., Takagi T., Yoshimura T. and Kishi T. (1955) Tin(II)-strong phosphoric acid: a new reagent for the determination of sulfate by reduction to hydrogen sulfide. Bull. Chem. Soc. Jpn. 28, 641-644.
Lyons J.R. (2007). Mass-independent fractionation of sulfur isotopes by isotope-selective photodissociation of SO2. Geophys. Res. Lett. 34 (22).
Mandeville C., Webster J., Tappen C., Taylor B., Timbal A., Sasaki A., Hauri E., Bacon C. (2009) Stable isotope and petrologic evidence for open-system degassing during the climactic and pre-climactic eruptions of Mt. Mazama, Crater Lake, Oregon. Geochim. Cosmochim. Acta. 73(10), 2978-3012.
Masterson A.L., Farquhar J., Wing B.A. (2011) Sulfur mass-independent fractionation patterns in the broadband UV photolysis of sulfur dioxide: pressure and third body effects. Earth Planet. Sci. Lett. 306(3–4), 253-260.
Ono S., Beukesb N.J., Rumble D. (2009) Origin of two distinct multiple-sulfur isotope compositions of pyrite in the 2.5 Ga Klein Naute Formation, GriqualandWest Basin, South Africa. Precambrian Research. 169(1–4), 48-57.
Ono S., Wing B., Rumble D., Farquhar J. (2006) High precision analysis of all four stable isotopes of sulfur (32S, 33S, 34S and 36S) at nanomole levels using a laser fluorination isotope-ratiomonitoring gas chromatography–mass spectrometry. Chem. Geol. 225(1–2), 30-39.
Ono S., Whitehill A.R., Lyons JR. (2013) Contribution of isotopologue self-shielding to sulfur mass-independent fractionation during sulfur dioxide photolysis. J. Geophys. Res. Atmos. 118(5), 2444-2454.
Pavlov A., Kasting J. (2002) Mass-independent fractionation of sulfur isotopes in Archaean sediments: Strong evidence for an anoxic Archaean atmosphere. Astrobiology. 2(1), 27-41.
Penniston-Dorland C., Mathez E., Wing B., Farquhar J., Kinnaird J. (2012) Multiple sulfurisotopeevidenceforsurface-derivedsulfurinthe Bushveld Complex. Earth Planet. Sci. Lett. 337–338, 236-242
Sasaki A., Arikava Y., Folinsbee R. (1979) Kiba reagent method of sulfur extraction applied to isotopic work. Geological Survey Japan. 30, 241-245.
Ueno Y., Ono S., Rumble D., Maruyama S. (2008) Quadruple sulfur isotope analysis of ca. 3.5 Ga Dresser Formation: New evidence for microbial sulfate reduction in the early Archean. Geochim. Cosmochim. Acta. 72, 5675-5691.
Whitehill A.R, Jiang B., Guo H., Ono S. (2015) SO2 photolysis as a source for sulfur mass-independent isotope signatures in stratospehric aerosols. Atmos. Chem. Phys. 15, 1843-1864.
Дополнительные материалы отсутствуют.