Геохимия, 2022, T. 67, № 10, стр. 1013-1028
Влияние стоков апатит-нефелинового производства на биогеохимические процессы в арктическом горном озере
В. А. Даувальтер a, *, Д. Б. Денисов a, З. И. Слуковский a, b
a Институт проблем промышленной экологии Севера Кольского научного центра РАН
184209 Мурманская обл, Апатиты, Академгородок, 14а, Россия
b Институт геологии Карельского научного центра РАН
185910 Республика Карелия, Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: v.dauvalter@ksc.ru
Поступила в редакцию 15.02.2021
После доработки 18.04.2021
Принята к публикации 16.05.2021
- EDN: NGEESF
- DOI: 10.31857/S0016752522090023
Аннотация
В Хибинском щелочном массиве с его апатит-нефелиновыми месторождениями сосредоточены крупнейшие в мире запасы фосфатного сырья, разработка которых ведется уже более 90 лет. В результате многолетних гидрохимических и гидробиологических исследований самого крупного озера Хибинского щелочного массива Большой Вудъявр установлено, что поступление стоков апатит-нефелинового производства привело к кардинальным изменениям естественных биогеохимических процессов. В воде озера, значительно возросла минерализация, величина pH, доля щелочных металлов и ${\text{SO}}_{4}^{{2 - }}$ в ионном составе, содержание соединений азота и фосфора. В толще воды оз. Б. Вудъявр прослеживается четкая вертикальная гидрохимическая стратификация вследствие распределения потоков воды в разных слоях от двух главных притоков. Сообщества фитопланктона и их количественные показатели в оз. Б. Вудъявр существенно отличаются от условно-фоновых, природно олиготрофный водоем в настоящее время соответствует мезотрофному статусу. В составе фитопланктона доминируют диатомовые водоросли, отмечено наличие видов цианобактерий, способных вызывать цветение и токсичное загрязнение воды озера. Сезонная динамика фитопланктона характеризуется одним ярко выраженным июльским максимумом. На развитие фитопланктона большое значение оказывают величина pH, содержание Si и ${\text{NH}}_{4}^{ + },$ определенную стимулирующую роль выполняет Cd. Биогеохимические условия, определяющие экологическое состояние водоема, формируются под влиянием двух основных факторов – антропогенного загрязнения стоками апатит-нефелинового производства и уровнем развития продукционных процессов.
ВВЕДЕНИЕ
Исследование экологического состояния водоемов Арктического региона имеет важное научное и прикладное значение в связи с глобальными изменениями климата и окружающей среды, усиливающимися в последние десятилетия. Водные системы, расположенные в техногенных районах, обычно подвергаются воздействию различных крупномасштабных видов деятельности человека, начиная от нарушения гидрологического, гидрохимического, гидродинамического и теплового режимов и заканчивая загрязнением воды (Моисеенко, 2015). В озерах Арктической зоны, на фоне изменения окружающей среды, климата и биогеохимических циклов, наблюдаются нарушения продукционных процессов гидробионтов, уменьшение видового разнообразия (Kashulin et al., 2017). Существенный вклад в формирование химического состава вод Арктического региона вносит антропогенный фактор, накладываясь на природные процессы (Moiseenko et al., 2019). Промышленные предприятия возводятся рядом с городами, и озера на их территории испытывают негативное влияние не только воздействием городской инфраструктуры, резко меняющего гидрологический и гидрохимический режим водоемов, но и в результате поступления загрязняющих веществ с выбросами и стоками промышленных предприятий. В условиях Арктики, из-за низкой способности водоемов к самоочищению, техногенное влияние приводит к необратимым последствиям для природной среды, что выражается в трансформации химического состава воды и донных отложений водных объектов, приводящей к смене комплексов и групп обитающих в них гидробионтов (Moiseenko et al., 2020).
Несмотря на большую востребованность озер хозяйством и населением, в первую очередь, для водоснабжения и рекреационных целей, специальных исследований водных объектов в урбанизированных и одновременно промышленных районах для оценки их экологического состояния проводится мало, как и исследований городской среды в арктической зоне, где природные и климатические условия способствуют высокой чувствительности экосистем к воздействию человека и значительно замедляют естественное восстановление после их загрязнения и нарушения (Моисеенко, Гашкина, 2015). В этих исследованиях гидрохимические и гидробиологические исследования озер чаще всего производятся на основе одноразового отбора проб воды и только из поверхностной части водоемов, без учета многолетних и сезонных изменений и вертикального распределения гидрохимических показателей, которые напрямую влияют на условия обитания гидробионтов и экологическое состояние водоемов.
Почти вековая разработка крупнейших в мире апатит-нефелиновых месторождений Хибинского щелочного массива предоставила уникальную экспериментальную модель для изучения биогеохимических особенностей функционирования горных арктических озер в условиях поступления сточных вод горно-перерабатывающих производств и атмосферного загрязнения их водосборов. Исследования изменений биогеохимических циклов элементов в поверхностных водах в результате деятельности горнодобывающей индустрии представляют собой актуальную проблему геохимии, но им уделяется недостаточное внимание. Целью данной статьи является анализ многолетнего влияния стоков горнодобывающего предприятия на протекание биогеохимических процессов в арктическом горном озере Большой Вудъявр.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Морфометрическая и гидрологическая характеристика озера
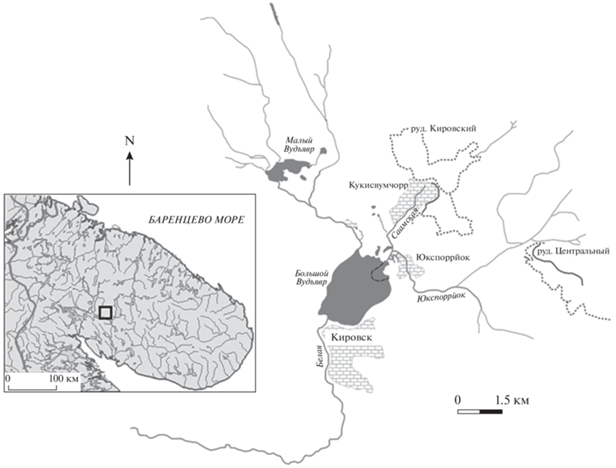
Большой Вудъявр (далее в тексте оз. Б. Вудъявр) является озером плотинного типа, самым крупным внутренним водоемом Хибин (рис. 1). Озеро имеет близкую к овальной форму и занимает впадину среди окружающих его гор в зоне северной тайги (Кашулин и др., 2008). На водосборной площади озера почвенный покров выражен слабо и преобладает горно-тундровая растительность. Горы отсутствуют только в южной части озера. Здесь впадину замыкает гряда отложений конечной морены, прорезанная узкой долиной вытекающей на юго-западе из озера рекой Белой, впадающей в оз. Имандра. Питание озера осуществляется за счет поверхностного и подземного стока. Абсолютная отметка озера равна 312 м, площадь водной поверхности – 3.9 км2, объем воды – 0.0579 км3. Амплитуда колебания уровня воды в озере не превышает 1.1 м (от 312.2 до 311.3 м н. у. м.). Максимальный уровень наблюдается в половодье, минимальный – в конце зимы. С северо-востока в оз. Б. Вудъявр впадает р. Юкспоррйок (расход 0.24–12 м3/с), с северо-запада – р. Вудъяврйок (расход 0.05–8 м3/с). В распределении глубин отмечается впадина в северо-восточной части озера глубиной 37.6 м. Общее годовое количество атмосферных осадков на территории водосбора находится в диапазоне 570–1060 мм, в среднем – 820 мм. Температурный режим оз. Б. Вудъявр определяется безледным периодом продолжительностью 5–6 мес. Изучение термического режима озера показало, что в летнее время имеет место прямая температурная стратификация (с июня по октябрь), а в зимний период – обратная. Полная весенняя и осенняя гомотермия обычно устанавливается соответственно в июне и октябре. В зимнее время температура в поверхностном слое воды равна 0.4°С, а на глубине 34 м 2°С. Летом температура поверхностного слоя достигает 15°С.
Геохимические особенности Хибинского массива и антропогенная нагрузка
Хибинский щелочной массив представляет собой сложное интрузивное тело палеозойского возраста, застывшее около 300 млн лет назад, сложенное нефелин-сиенитовыми породами, породообразующими минералами которых являются калиево-натриевые полевые шпаты, эгирин NaFe3+(Si2O6) и нефелин (Na,K)AlSiO4 (Ферсман, 1968). В результате выветривания этих горных пород нефелин разрушается скорее полевых шпатов, и в озеро в повышенных концентрациях поступают ионы щелочных металлов Na+ и K+.
Промышленное освоение региона началось со строительства Мурманской железной дороги во время Первой мировой войны, что позволило впоследствии осуществлять геологоразведочные работы и осваивать минеральные ресурсы региона. Результатом геологических съемок начала 1920-х гг. стало открытие в Хибинском горном массиве крупнейших в мире апатит-нефелиновых месторождений с огромными запасами фосфорного сырья. В 1929 г. был организован производственный трест “Апатит”, который осуществлял освоение минеральных ресурсов Хибин. С 1931 г. на берегу оз. Б. Вудъявр началась переработка апатитовой руды на обогатительной фабрике (АНОФ-I), с 1934 г. на этом предприятии была запущена вторая очередь. С этого времени в оз. Б. Вудъявр и далее по р. Б. Белая начали поступать без очистки сточные воды. Без очистки сбрасывались также коммунально-бытовые стоки г. Кировск. Апатитовая индустрия планомерно набирала мощность и к 1938 г. производила более 1 млн т апатитового концентрата (Барабанов и др., 1999). Воды р. Юкспорйок и далее оз. Б. Вудъявр обогащались соединениями азота и фосфора, кремнекислотой (Каныгина, 1939). В северо-восточной части озера располагается отстойник сточных вод Кировского и Расвумчоррского рудников, поступающих со стоками рек Юкспоррйок и Саамская, огороженный от основной акватории озера дамбой (рис. 1). Рост населения и неэффективные очистные сооружения обусловили загрязнение озера коммунально-бытовыми стоками г. Кировска, а также Ботанического сада (ПАБСИ). Ихтиофауна оз. Б. Вудъявр, насчитывающая 5 видов рыб, практически исчезла к 1931 г. в связи с загрязнением р. Б. Белая, по которой рыба поднималась на нерест из оз. Имандра. В настоящее время озеро населяет арктический голец и девятииглая колюшка (Денисов и др., 2009), а также европейская корюшка, активно мигрирующая в последние годы из оз. Имандра (Терентьев и др., 2017).
Химический состав воды озера зависит от природных (геохимических, гидрологических, климатических) особенностей водосбора и самого озера, а также прямого и аэротехногенного загрязнения горнодобывающих и металлургических предприятий (АО “Апатит” и Кольская горно-металлургическая компания (КГМК) дочернего предприятия ПАО “ГМК Норильский никель”), а также атмосферных трансграничных переносов загрязняющих веществ. Поступление сточных вод и пылевых выбросов рудников и АНОФ-I АО “Апатит”, содержащих главным образом нефелин и апатит Ca5(PO4)3(F,OH,Cl), обогащают воду озера Na, K, Ca, P, Al, Sr, F и другими элементами, входящими в состав апатитонефелиновой руды и продуктов их переработки. Хибинские месторождения представлены в основном фторапатитом, но присутствуют также и другие его разновидности. Апатит содержит также примеси Mn, Fe, Th, редкоземельных элементов, карбоната кальция CaCO3 (карбонат-апатит) и другие примеси (Ферсман, 1968).
Атмосферные выбросы металлургических комбинатов могут переноситься на расстояние нескольких десятков и даже сотен километров (Виноградова и др., 2017; Даувальтер, 2020). Медно-никелевый комбинат “Североникель” (Мончегорская площадка КГМК), находящийся на расстоянии 45 км на северо-запад от оз. Б. Вудъявр, специализируется на производстве электролитного Ni и Cu, кобальтового концентрата, серной кислоты и другой продукции. В процессе обогащения и металлургического передела участвуют такие минералы, как пентландит (Fe,Ni)9S8, халькопирит CuFeS2, кобальтит (Co,Ni)AsS, никелин NiAs и другие (Gregurek et al., 1999), поэтому в атмосферных выбросах комбината присутствуют все вышеперечисленные элементы в повышенных концентрациях.
Методы исследований
Детальные гидрохимические и гидробиологические исследования оз. Б. Вудъявр проводятся сотрудниками ИППЭС Кольского НЦ РАН с момента образования Института (1989 г.), и результаты отражены в публикациях (Денисов и др., 2009, 2016, 2018; Кашулин и др., 2008, 2010, 2019; Павлова и др., 2019; Сулименко и др., 2017). Пробы воды отбирались 2-х литровым пластиковым батометром с поверхностного слоя (1 м от поверхности), а также производился сезонный отбор по вертикали с шагом 5 м до дна в центральной части озера на акватории с максимальной глубиной. Химический состав воды определяли в центре коллективного пользования ИППЭС КНЦ РАН по единым методикам, описанным ранее (Методы…, 2019; Standard method…, 1999). Для контроля качества измерений pH и главных ионов использовался специализированный компьютерный пакет ALPEFORM, включающий оценку баланса ионов, измеренной и расчетной электропроводности. Качество химико-аналитических измерений подтверждалось участием в ежегодных международных верификациях (Intercomparison, 2016).
Отбор и анализ проб фитопланктона был произведен согласно ГОСТ 17.1.3.07-82, с использованием рекомендованных стандартных методик, принятых в мировой и отечественной практике (Karlson et al., 2010; Руководство…, 1992), по схеме, описанной ранее (Методы…, 2019; Павлова и др., 2019). Таксономические названия приведены в соответствие с альгологической базой данных (Guiry, Guiry, 2021). Трофический статус вод оценивался по шкале, предложенной С.П. Китаевым (2007). Сезонную динамику хлорофилла “a” (Chla) изучали с 2005 по 2008 гг., в другие годы проводились отдельные наблюдения в летний период. Концентрацию Chla рассчитывали стандартными общепринятыми методами (Минеева, 2004; Determination, 1996; Методы…, 2019). Сезонная динамика сообществ фитопланктона подробно была изучена в 2007 г.
Для классификации основных параметров, определяющих биогеохимические процессы в водоеме, был использован кластерный анализ; объединение переменных проводилось при помощи алгоритма квадратов эвклидова расстояния, методом Варда. Для выделения основных факторов формирования качества вод использовался метод главных компонент. Для указанных видов анализа были использованы данные 39 сезонных наблюдений за качеством вод озера за период 2006–2007 гг. по 32-м различным параметрам.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Многолетняя динамика гидрохимических показателей оз. Б. Вудъявр
Для природных вод Кольского Севера характерна низкая минерализация (20–30 мг/л) и следующий порядок распределения главных ионов: ${\text{HCO}}_{3}^{ - }$ > ${\text{SO}}_{4}^{{2 - }}$ > Cl–; Ca2+ > Na+ > Mg2+ > K+ (Моисеенко и др., 1996). В озерах восточной части Мурманской области, которые были приняты за фоновые водоемы, основные ионы по величинам распределяются следующим образом: ${\text{HCO}}_{3}^{ - }$ > Cl– > > ${\text{SО}}_{4}^{{2 - }};$ Na+ > Ca2+ > Mg2+ > K+ (Кашулин и др., 2010; Kashulin et al., 2017). Медианное значение pH воды фоновых озер находится на границе между слабокислым и нейтральным – 6.42, минерализации – 17 мг/л (табл. 1). Щелочные горные породы водосбора озер Хибинского массива поставляют в природные воды ионы щелочных металлов, поэтому по классификации O.A. Алекин (1970) вода озер относятся к гидрокарбонатному классу и натриевой группе и имеет характерное распределение главных ионов: ${\text{HCO}}_{3}^{ - }$ > ${\text{SO}}_{4}^{{2 - }}$ > Cl–; Na+ > K+ > Ca2+ > Mg2+ (Кашулин и др., 2008).
Таблица 1.
Гидрохимические показатели оз. Б. Вудъявр и его главных притоков и медианные значения показателей Хибинских озер (ХО) и озер восточной части Мурманской области (МО)
| Показатели | Единицы измерения | Вудъяврйок | Юкспоррйок | Б. Вудъявр | ХО3 | МО4 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 19391 | 19972 | 2007 | 2012 | 19391 | 19972 | 2007 | 2012 | 19391 | 19972 | |||||
| май | июль | |||||||||||||
| pH | 7.3 | 7.27 | 7.02 | 7.33 | 7.1 | 8.18 | 8.82 | 8.22 | 9.12 | 7.1 | 8.3 | 6.86 | 6.42 | |
| χ | мкСм/см | – | – | 25 | 28.7 | – | 343 | 273 | 157 | 304 | – | 128 | 16 | 28 |
| Ca2+ | мг/л | 0.82 | 0.7 | 0.71 | 0.82 | 4.502 | 9.9 | 3.38 | 3.40 | 5.65 | 2.0 | 3.89 | 0.4 | 1.4 |
| Mg2+ | мг/л | 0.196 | 0.06 | 0.07 | 0.07 | 0.39 | 0.8 | 0.29 | 0.25 | 0.43 | 0.24 | 0.44 | 0.04 | 0.71 |
| Na+ | мг/л | 4.2 | 5.77 | 4.39 | 5.21 | 4.8 | 52.5 | 49.7 | 27.5 | 55.0 | 4.1 | 20.0 | 2.8 | 2.50 |
| K+ | мг/л | 1.2 | 1.65 | 1.27 | 1.3 | 1.4 | 17.7 | 15.3 | 8.8 | 18.1 | 1.1 | 6.37 | 0.6 | 0.33 |
| ${\text{HCO}}_{3}^{ - }$ | мг/л | 11.84 | 15.7 | 11.4 | 14.4 | 13.6 | 85.6 | 92.3 | 49.0 | 95.4 | 12.42 | 40.0 | 6.3 | 4.8 |
| ${\text{SO}}_{4}^{{2 - }}$ | мг/л | 1.17 | 2.26 | 2.0 | 1.89 | 2.75 | 57.8 | 28.8 | 18.9 | 39.5 | 1.52 | 17.1 | 1.6 | 1.7 |
| Cl– | мг/л | 0.84 | 0.86 | 0.60 | 0.56 | 3.12 | 3.2 | 1.63 | 2.91 | 2.22 | 1.36 | 4.18 | 0.6 | 2.3 |
| Σион | мг/л | 20.3 | 27.0 | 20.2 | 24.2 | 30.6 | 228 | 192 | 111 | 216 | 22.7 | 92 | 11.9 | 17 |
| N${\text{H}}_{4}^{ + }$ | мкгN/л | – | 2.6 | 11 | 1 | 170 | 17 | 468 | 132 | 135 | 238 | 306 | 10 | 12 |
| N${\text{O}}_{3}^{ - }$ | мкгN/л | – | 200 | 64 | 63.5 | 3315 | 7400 | 3900 | 1927 | 4552 | 663 | 1633 | 87 | 2 |
| Nобщ | мкгN/л | – | – | 94 | 96 | – | 7765 | 4090 | 3258 | 5754 | – | 2153 | 175 | 248 |
| P${\text{O}}_{4}^{{3 - }}$ | мкгP/л | – | 3.1 | 1 | 3.5 | 1750 | 1420 | 2487 | 1121 | 1895 | 250 | 217 | 1 | 0.75 |
| Pобщ | мкгP/л | – | – | 8 | 5.5 | – | 1590 | 2890 | 1720 | 2675 | – | 249 | 4 | 8 |
| ХПКMn | мгO/л | – | – | 1.03 | 0.81 | – | 1.59 | 1.38 | 2.22 | – | 1.88 | 0.55 | 8.47 | |
| Cорг | мгC/л | – | 3.1 | 2.34 | 2.17 | – | 3.0 | 2.76 | 2.6 | 3.25 | – | 3.0 | 1.97 | 8.02 |
| Si | мг/л | 8.0 | – | 2.03 | 2.45 | 12 | 4.7 | 4.1 | 3.26 | 3.75 | 8.0 | 2.9 | 1.45 | 1.49 |
| Al | мкг/л | 294 | 22 | 316 | 110 | 339 | 1125 | 880 | 2717 | 1780 | 188 | 91.0 | 41.0 | 62 |
| Fe | мкг/л | 100 | 4.8 | 63 | 18.4 | 600 | 370 | 320 | 591 | 685 | 100 | 29.7 | 8.9 | 105 |
| Cu | мкг/л | – | 0.2 | 1.2 | 0.85 | – | 6.0 | 5.5 | 9.0 | 9.25 | – | 1.5 | 0.60 | 0.7 |
| Ni | мкг/л | – | 0.4 | 0.3 | 0.6 | – | 1.9 | 2.9 | 1.6 | 2.7 | – | 0.1 | 0.51 | 0.6 |
| Co | мкг/л | – | <0.1 | 0.14 | <0.1 | <0.1 | 0.55 | 1.7 | 1.95 | – | – | 0.17 | 0.20 | |
| Zn | мкг/л | – | 0.1 | 2.8 | 0.55 | – | 4.0 | 3.3 | 6.6 | 6.7 | – | 2.0 | 1.88 | 1.7 |
| Mn | мкг/л | 0 | 0.1 | 7.8 | 1.45 | – | 20 | 19 | 44.5 | 34 | 0 | 1.0 | 1.10 | 6.4 |
| Sr | мкг/л | – | 56 | 59 | 72 | – | 344 | 236 | 305 | 377 | – | – | 43 | 14 |
| Cr | мкг/л | – | <0.1 | 1.4 | 0.2 | 0.4 | 0.3 | 0.9 | 0.35 | – | – | 0.28 | 0.2 | |
| Cd | мкг/л | – | <0.01 | <0.01 | 0.01 | – | 0.33 | 0.84 | 0.01 | 0.02 | – | 0.23 | 0.05 | 0.05 |
Почти за столетнюю историю промышленного освоения апатит-нефелиновых месторождений Хибинского щелочного массива химический состав воды оз. Б. Вудъявр претерпел значительные трансформации вследствие изменения гидрологического и гидрохимического режимов, существующих на территории водосбора, в результате застройки городской территории, поступления коммунально-бытовых сточных вод, прокладывания подземных и наземных коммуникаций, выведения части поверхностного стока из баланса водоемов, и в основном – влияния деятельности промышленных предприятий АО “Апатит”. Интенсивное загрязнение оз. Б. Вудъявр уже к концу 30-х гг. прошлого века обусловило значительные изменения качества его вод. Однако уже тогда было сложно оценить в полной мере эти изменения из-за отсутствия достоверной информации о качестве вод в “доиндустриальный” период. А.В. Каныгина (1939) писала, что только по аналогии с оз. М. Вудъявр, можно предполагать, каков был природный химический состав воды в оз. Б. Вудъявр. Если раньше озера Б. и М. Вудъявр по химическому составу, вероятно, особо не отличались, то в к концу 1930-х гг. поступающие в оз. Б. Вудъявр соединения азота и фосфора, кремнекислота и другие вещества загрязнили озеро и создали для гидробионтов условия, отличные от прежних (табл. 1). Вода в оз. Б. Вудъявр была слабо минерализована – от 30 до 40 мг/л. Активная реакция воды в зимнее время являлась нейтральной (pH 6.7–6.8), летом при цветении воды она переходила в щелочную и достигала 9.75. Окисляемость воды в зимний период была несколько выше 1 мгО2/л. Летом при массовом отмирании фитопланктона из-за выделения ими органических веществ в воду окисляемость увеличилась до 4 мгО2/л. Зимой нитриты отсутствовали в воде, а летом имелись в виде слабых следов. Нитраты в воде оз. Б. Вудъявр появлялись осенью, присутствовали зимой (0.15–0.2 мгN/л) и исчезали летом, во время цветения воды.
Максимальная нагрузка на оз. Б. Вудъявр и на южную часть Большой Имандры приходится на конец 1980-х гг., когда АО “Апатит” произвело более 20 млн т апатитового концентрата (Барабанов и др., 1999). В начале 1990-х гг. после развала СССР и наступления экономического кризиса производство концентрата упало более чем в 3 раза, и в последние годы оно держится на уровне 10 млн т (Кашулин и др., 2008). Гидрохимический состав относительно незагрязненной р. Вудъяврйок в 1990-е гг. по сравнению с 1930-ми гг. мало изменился – минерализация и содержание главных ионов незначительно увеличилось, в то время как многие гидрохимические показатели р. Юкспоррйок увеличились на порядок (табл. 1). В 1990-е гг. по сравнению с 1930-ми гг. отношение эквивалентных концентраций ${{\left[ {{\text{HCO}}_{3}^{ - }} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{HCO}}_{3}^{ - }} \right]} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}} \right. \kern-0em} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}$ в воде р. Вудъяврйок уменьшилось с 8 до 5.5, а отношение ${{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}} \right. \kern-0em} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}$ увеличилось почти в 2 раза (с 1 до 1.9). Перемены в анионном составе воды р. Юкспоррйок еще значительнее – отношение ${{\left[ {{\text{HCO}}_{3}^{ - }} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{HCO}}_{3}^{ - }} \right]} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}} \right. \kern-0em} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}$ уменьшилось с 3.9 до 1.2, а ${{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}} \right. \kern-0em} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}$ увеличилось с 0.65 до 13. Отношение суммы ионов щелочноземельных металлов к сумме ионов щелочных металлов в воде р. Вудъяврйок более чем за полвека уменьшилось почти в 2 раза (с 0.27 до 0.14), в то время как в р. Юкспоррйок оно снизилось более, чем в 5 раз (с 1.05 до 0.20). В фоновых озерах Мурманской области соотношение [Ca2+ + Mg2+]/[Na+ + K+] в среднем близко к единице (Кашулин и др., 2008). В воде оз. Б. Вудъявр также зафиксированы существенные изменения соотношения между ионами – отношение главных анионов ${{\left[ {{\text{HCO}}_{3}^{ - }} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{HCO}}_{3}^{ - }} \right]} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}} \right. \kern-0em} {\left[ {{\text{SO}}_{4}^{{2 - }}} \right]}}$ уменьшилось с 6.4 до 1.8, ${{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{SO}}_{4}^{{2 - }}} \right]} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}} \right. \kern-0em} {\left[ {{\text{C}}{{{\text{l}}}^{--}}} \right]}}$ увеличилось с 0.8 до 3, а [Ca2+ + Mg2+]/[Na+ + K+] снизилось с 0.58 до 0.22. Эти изменения в составе главных ионов в основном связаны с резким увеличением содержания ${\text{SO}}_{4}^{{2 - }}$ и щелочных металлов в сточных водах АО “Апатит” (доля ${\text{SO}}_{4}^{{2 - }}$ в анионном составе рудничных вод увеличилась до 65%, а Na+ в катионном составе до 81%, (Кашулин и др., 2008), а также с деятельностью комбината “Североникель”, проявляющейся в увеличении выпадения ${\text{SO}}_{4}^{{2 - }}$ на водосборы озер (Моисеенко и др., 2015, 2020).
Вертикальное распределение гидрохимических показателей оз. Б. Вудъявр
В конце зимнего периода, когда на поверхности озера лежит лед толщиной до 1 м, в толще воды оз. Б. Вудъявр прослеживается четкая вертикальная стратификация, связанная с особенностями питания озера (рис. 2). Река Вудъяврйок поставляет в озеро относительно незагрязненные воды из оз. М. Вудъявр, а р. Юкспоррйок – загрязненные рудничные воды и стоки промышленной площадки АО “Апатит”. Вследствие наличия ледяного покрова и отсутствия ветрового волнения, в водной толще озера перемешивание вод двух главных притоков затруднено, и происходит раздельное течение вод с различными физико-химическими свойствами к истоку р. Б. Белая. По поверхности озера ближе к ледяному покрову распространяются низкоминерализованные воды из р. Вудъяврйок с температурой близкой к 0°C, и поэтому имеющие меньшую плотность, а в придонных слоях озера движутся более минерализованные воды р. Юкспоррйок с температурой +2…+3°C и поэтому более плотные, так как известно, что температура максимальной плотности пресной воды +4°C. Ранее проведенными исследованиями (Кашулин и др., 2008) установлено, что минерализация рудничных вод, поступающих в систему р. Юкспоррйок, достигает значений выше 1 г/л, т.е. они переходят в категорию солоноватых по классификации O.A. Алекина (1970). В устье р. Юкспоррйок в месте впадения в оз. Б. Вудъявр минерализация воды в зимнее время превышает 200 мг/л, что сопоставимо с минерализацией придонных слоев воды озера. Минерализация воды р. Вудъяврйок в настоящее время соответствует природному состоянию и находится в пределах 20–25 мг/л (табл. 1). В результате вертикального распределения потоков из двух притоков озера значения pH и минерализации, содержание главных ионов и соединений азотной и фосфорной группы, микроэлементов в придонном слое толщи воды оз. Б. Вудъявр выше в 2–3 раза по сравнению с поверхностным слоем (рис. 2). Подобная стратификация химического состава воды в зимний период отмечается в водоемах системы р. Кенти (Республика Карелия), что связано с распространением техногенных вод Костомукшского ГОКа, как более тяжелых, в придонных слоях, а речных вод с водосбора, как более легких, – в поверхностных (Лозовик, Галахина, 2017).
Рис. 2.
Вертикальное распределение гидрохимических показателей оз. Б. Вудъявр в апреле (1) и июле 2018 г. (2).
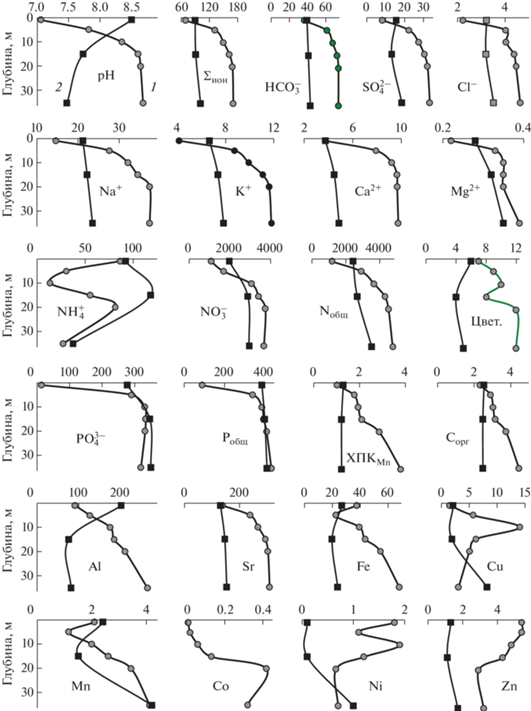
При добыче апатит-нефелиновых руд на АО “Апатит” используют азотсодержащие взрывчатые вещества, которые значительно увеличивают содержание в поверхностных водах азотных соединений. Содержание ${\text{NO}}_{3}^{ - }$ в придонном слое воды оз. Б. Вудъявр более чем 3 раза выше, чем в поверхностном слое, как и главных ионов (рис. 2). Содержание ${\text{NO}}_{3}^{ - }$ сопоставимо с концентрацией таких главных ионов, как Cl– и Ca2+, и на порядок выше, чем Mg2+, т.е. нитрат-ион в воде оз. Б. Вудъявр входит в разряд главных ионов. Содержание ${\text{NO}}_{3}^{ - },$ так же как и ${\text{NH}}_{4}^{ + }$ и Nобщ., в воде р. Вудъяврйок на два порядка меньше, чем в воде оз. Б. Вудъявр (Кашулин и др., 2019). Подобная закономерность в оз. Б. Вудъявр выявлена в распределении соединений другого биогенного элемента – фосфора. Содержание ${\text{PO}}_{4}^{{3 - }}$ и Pобщ в придонном слое воды на порядок выше, чем в поверхностном. Это содержание также на два порядка выше, чем в воде р. Вудъяврйок.
Главным рудным минералом Хибинских апатит-нефелиновых месторождений является фторапатит (Ca5(PO4)3F), который при выветривании поставляет в природные воды, в том числе и поверхностные, соединения P, Ca, а также F в повышенных концентрациях (Кашулин и др., 2008). Апатит содержит также примеси Sr, Al, Mn, Fe, Th, карбоната кальция, редкоземельных элементов. Поэтому вышеописанная закономерность наблюдается и в распределении щелочноземельного металла Sr, который в придонном слое воды оз. Б. Вудъявр более чем в 20 раз превышает содержание этого металла в фоновых озерах восточной части Мурманской области (Кашулин и др., 2010). Концентрация Sr в р. Юкспоррйок находится в диапазоне 370–510 мкг/л. Распределение Mn, Fe, Al в зимний период подобно распределению Sr, при котором происходит увеличение содержания ко дну озера, что подтверждается высокими значениями коэффициента корреляции между этими элементами (r = 0.85–0.99). Увеличение содержания Al по направлению ко дну озера объясняется также высокими (до щелочных) значениями pH воды, при которых Al приобретает повышенную миграционную способность. Дефицит O2 в придонных слоях воды вследствие микробиологического разложения органического материала в зимнее время способствует восстановлению Mn и Fe до степени окисления +2, при которой ионы этих металлов более растворимы, чем ионы с большей степенью окисления (Никаноров, 2001). В придонном слое воды оз. Б. Вудъявр в зимнее время содержание этих металлов в 2–3 раза выше, чем в поверхностном слое (рис. 2).
Молибденит MoS2 и другие минералы Mo присутствуют в пегматитах и мельтейгит-уртитах Хибинского горного массива и распространены очень широко (Сулименко и др., 2017). В воде оз. Б. Вудъявр обнаружено присутствие Mo в количествах, в несколько раз превышающих фоновые (Сулименко и др., 2017).
Несмотря на высокие концентрации соединений биогенных элементов в оз. Б. Вудъявр, содержание органических веществ (цветность, ХПКMn и Cорг) в воде оз. Б. Вудъявр (табл. 1) меньше, чем в озерах восточной части Мурманской области (Кашулин и др., 2010). Это связано со слабым развитием почвенного покрова водосбора озера и малой продуктивностью наземных экосистем на водосборной площади, поставляющих аллохтонный органический материал в озеро, и с тем, что водные массы оз. Б. Вудъявр формируются за счет поверхностного стока с промышленной и городской территории, в меньшей степени покрытой почвенно-растительным слоем по сравнению с природными условиями, что уменьшает поступление аллохтонного органического материала.
Летом вследствие волнового перемешивания водных масс озера происходит выравнивание гидрохимических показателей, но характерная для зимней стратификации закономерность увеличения содержания в придонных слоях воды сохраняется (рис. 2). Это касается в первую очередь главных ионов и биогенных элементов (${\text{NO}}_{3}^{ - },$ Nобщ, ${\text{PO}}_{4}^{{3 - }}$ и Pобщ), некоторых микроэлементов (Sr, Mn). В пик вегетационного периода наблюдается отличная от зимней стратификации картина распределения величины pH и содержания органического вещества (ХПКMn и Cорг), – в поверхностных слоях происходит увеличение этих показателей, что связано с интенсификацией образования первичной продукции.
Сезонная динамика гидрохимического состава оз. Б. Вудъявр
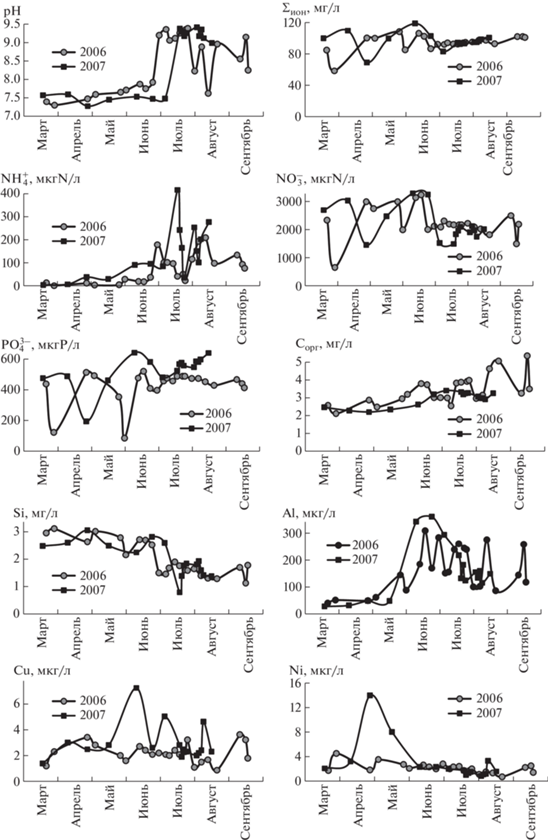
Динамика гидрохимических показателей описана на основе мониторинга в период 2001–2012 гг., в который осуществлялся регулярный отбор проб воды. В зимний период в отсутствие активной вегетации и распространения по поверхности озера главным образом водных масс р. Вудъяврйок, величины pH воды варьируют в небольшом диапазоне (7.3–7.6) (рис. 3). К концу зимы значения pH увеличиваются, потому что продукционные процессы начинаются при наличии ледяного покрова в солнечные дни и в условиях увеличивающейся их продолжительности (Денисов и др., 2009). В условиях открытой воды с наступлением активного вегетационного периода происходит резкое увеличение значений pH воды до максимального значения 9.5 в июле, что связано с потреблением большого количества CO2 и смещением значений pH в сторону щелочных (Никаноров, 2001). В этот период изменения величины pH находится в зависимости от местных метеорологических условий, в основном, от температуры и облачности (Денисов и др., 2009). Чем выше температура воды и меньше облачность, тем интенсивнее идет процесс образования первичной продукции. В придонных слоях озера идет снижение значений pH воды вследствие микробиологического разложения органического материала с выделением CO2 и сдвигом карбонатного равновесия в сторону образования ${\text{HCO}}_{3}^{ - }$ (Никаноров, 2001).
Ионный состав воды озер характеризуется неоднородностью как по акватории, так и по глубине (Никаноров, 2001). Довольно значительные флуктуации главных ионов происходят зимой во время наличия ледового покрова и с его сходом и наступлением периода весенней гомотермии, когда происходит интенсивное перемешивание воды (рис. 3). Во время летней межени вследствие влияния шахтных сточных вод происходит стабилизация минерализации воды (в пределах 100 мг/л) и содержания главных ионов. Минерализация воды оз. Б. Вудъявр в зимнее время, как правило, меньше, чем в летнее (рис. 3), что связано с влиянием вод р. Вудъяврйок на поверхностные слои воды озера в зимнее время.
В содержании биогенных элементов происходят изменения, подобные описанным ранее для величины pH. Концентрации Si в период ледового покрова достигают наибольших значений, а с наступлением вегетационного периода происходит резкое снижение содержания Si, который потребляется диатомовыми водорослями для образования створок (рис. 3). Сезонная динамика соединений азотной группы отличается. Содержание ${\text{NH}}_{4}^{ + }$ в зимнее время незначительное (единицы мкг/л), но с наступлением вегетационного периода (даже в период наличия ледяного покрова) происходит увеличение содержания вначале до десятков, а потом до сотен мкг/л в летний период (рис. 3). Вероятно, это связано с усиливающимся разложением органического вещества и образованием ${\text{NH}}_{4}^{ + }$ в летнее время. Содержание ${\text{NO}}_{3}^{ - }$ в зимнее время варьирует в больших пределах от 650 до 3000 мкг/г в зависимости от содержания его в рудничных стоках (рис. 3). Летом концентрация ${\text{NO}}_{3}^{ - }$ стабилизируется около значения 2000 мкг/г. Аналогичная закономерность проявляется в динамике содержания ${\text{PO}}_{4}^{{3 - }}$ – зимой варьирует в широких пределах (170–680 мкг/г), а летом находится вблизи значений 400–500 мкг/л (рис. 3). Стабилизация содержания ${\text{NO}}_{3}^{ - }$ и ${\text{PO}}_{4}^{{3 - }}$ в летнее время связана с их потреблением фитопланктоном в период вегетации. Показатели содержания органического вещества в летний период закономерно увеличиваются в несколько раз по сравнению с зимним периодом – ХПКMn с 1 до 5 мг/л и Cорг с 2 до 5 мг/л (рис. 3), что связано с интенсификацией продукционных процессов в озере.
Значительные колебания содержания в зимнее время характерно и для микроэлементов, особенно для Cu и Ni (рис. 3). В летнее время происходит некоторое выравнивание содержания микроэлементов, как минерализации и главных ионов. Летом содержание Al увеличивается параллельно с ростом значений pH воды, так как растворимость и миграционная способность этого микроэлемента напрямую зависит от кислотно-щелочных условий (Никаноров, 2001).
Фитопланктон и трофический статус вод оз. Б. Вудъявр
Всего за период наблюдений в составе сообществ фитопланктона было выявлено 131 таксон водорослей и цианопрокариот рангом ниже рода, из них: Cyanobacteria – 15, Bacillariophyta – 87, Chrysophyceae – 2, Chlorophyta – 12, Charophyta – 8, Dinophyceae– 1, Cryptophyta – 3, Xantophyta – 1, Euglenozoa – 2. Видовой состав, структура и количественные показатели сообществ фитопланктона водоема значительно отличаются от условно фоновых. В фитопланктоне озер Хибинского массива и прилегающих территорий, не подверженных загрязнению стоками апатитовой промышленности, по численности и биомассе преобладают диатомовые водоросли, позиции субдоминантов обычно занимают золотистые и (или) харовые водоросли при этом уровень летней биомассы составляет 0.81 (0.02–3.48) г/м3, а содержание Chla – 0.90 (0.00–6.42) мг/м3что соответствует олиготрофному статусу (Денисов, 2010; Кашулин и др., 2008).
Средний уровень биомассы фитопланктона в оз. Б. Вудъявр – 2.87 (0.00–41.2) г/м3, что соответствует β-мезотрофному статусу и на порядок превосходит фоновые значения. В фитопланктоне по численности, биомассе и видовому богатству доминируют диатомовые водоросли (до 100%), сравнительно высока доля зеленых водорослей (до 32.4%) и цианобактерий (до 10.5%), что является следствием трофической нагрузки на экосистему водоема. Массовыми видами диатомей являются типичные представители эвтрофируемых озер: Stephanodiscus hantzschii Grun., Fragilaria vaucheriae (Kütz.) Peters., F. capucina Desm. Среди цианобактерий были выявлены таксоны, способные вызывать “цветение” вод: Microcystis aeruginosa (Kütz.) Kütz., Pseudanabaena limnetica (Lemm.), P. catenata Lauterb., Planktothrix isothrix (Skuja) Kom. Et Komark (Давыдов, Шалыгин, 2009).
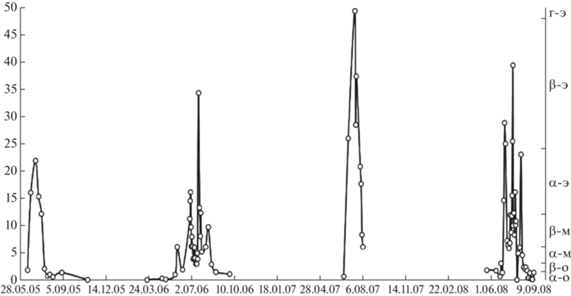
Сезонная динамика фитопланктона в течение периода открытой воды характеризуется одним ярко выраженным максимумом биомассы, приходящимся на июль, за счет развития диатомовых водорослей (рис. 4). В период максимального развития фитопланктона наблюдались самые высокие за сезон значения pH наряду со снижением концентрации общего азота и нитратов в воде в результате активного потребления водорослями. Основу биомассы составляли диатомовые водоросли, что объясняет снижение содержания кремния в период увеличения биомассы диатомового планктона (рис. 4). Для цианопрокариот большое значение имеет аммонийный азот (Domingues et al., 2011). Снижение концентрации ${\text{NH}}_{4}^{ + }$ в летний период совпадал с максимумом биомассы цианопрокариот (рис. 3 и 4). Соединения фосфора не являются лимитирующими факторами для развития фитопланктона в оз. Б. Вудъявр – их концентрации практически не уменьшались в период летнего максимума развития фитопланктона. Сточные воды апатитовых рудников круглый год содержат избыточное количество фосфора, доступного для фитопланктона.
Рис. 4.
Сезонная динамика биомассы фитопланктона и некоторых гидрохимических показателей оз. Б. Вудъявр (2007 г).
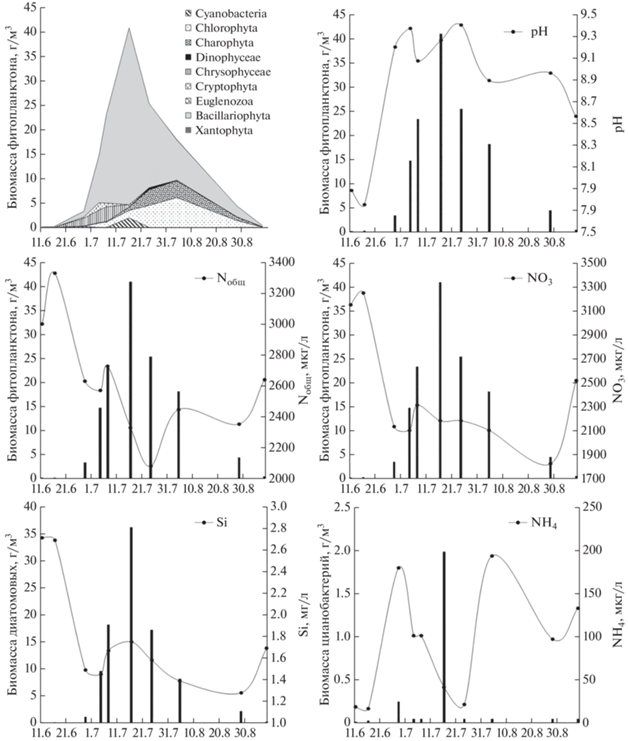
Среднее содержание Chla в планктоне – 9.02 (0.00–49.4) мг/м3, что многократно превосходит фоновые концентрации и соответствует β-мезотрофному статусу вод. Сезонная динамика Chla по результатам четырехлетних наблюдений демонстрирует схожий с биомассой сценарий, с выраженным июльским максимумом, совпадающим с пиком биомассы (рис. 5). Для озера характерно резкое увеличение содержания Chla, которое происходит сразу после вскрытия водоема ото льда в начале июня. В зависимости от метеорологических условий года, максимальная концентрация Chla в период наблюдений варьировала от 21.9 до 49.4 мг/м3. Таким образом, в период максимального развития фитопланктона трофический статус вод может достигать гиперэвтрофного (рис. 5). С учетом высокой скорости происходящих изменений, большое значение для фиксации максимальных концентраций Chla имеет частота отбора проб.
Основные факторы, определяющие экологическое состояние оз. Б. Вудъявр
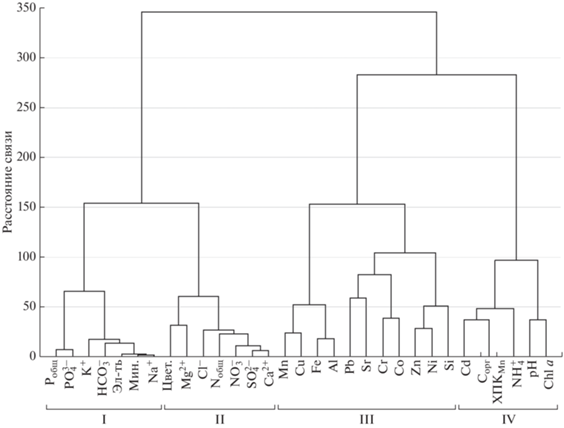
Как показывают результаты кластерного анализа, биогеохимические процессы в оз. Б. Вудъявр во многом определяются составом сточных вод апатитовых рудников. Анализ позволил выделить несколько групп взаимосвязанных показателей. Фосфорная нагрузка на водоем (Pобщ и ${\text{PO}}_{4}^{{3 - }}$) наряду с главными катионами щелочных металлов (Na+, K+) и анионом ${\text{HCO}}_{3}^{ - }$ в основном определяют общую минерализацию и, соответственно, величину электропроводности (рис. 6, I). Другая группа показателей включает содержание главных катионов щелочноземельных металлов (Ca2+, Mg2+, суммарное содержание которых в пять раз меньше, чем щелочных металлов) наряду с главными анионами (${\text{SO}}_{4}^{{2 - }},$ Cl–), а также содержание общего азота и ${\text{NO}}_{3}^{ - },$ от которых зависит такой показатель содержания органического вещества, как цветность воды озера (рис. 6, II). В отдельную группу выделились содержания микроэлементов и Si, входящих, преимущественно, в состав сточных вод апатитового производства, а также поступающих в водоем в ходе естественно-природных геохимических процессов формирования вод под влиянием коренных пород Хибинского горного массива (рис. 6, III). Результаты кластерного анализа также подтверждают тесную связь между содержанием Chla и pH воды в течение периода открытой воды (рис. 6, IV). Эта же группа показателей определяет продукционные процессы и количество органического вещества в воде (Cорг и ХПКMn). Как было отмечено ранее, большое значение для жизнедеятельности фитопланктона в озере имеют ионы ${\text{NH}}_{4}^{ + }.$ Связь элементов этой группы с концентрацией Cd может быть связана с его биохимической ролью в метаболизме фитопланктона. Так, была показана стимулирующая функция малых концентраций Cd для ряда физиологических процессов, включая ферментативную активность, у зеленых (Cheng et al., 2016) и диатомовых (Masmoudi et al., 2013) водорослей. Для преобладающих в оз. Б. Вудъявр диатомовых водорослей содержание Cd может быть одним из факторов, стимулирующих увеличение Chla, что было показано авторами (Mu et al., 2018). Для морских видов диатомовых водорослей было показано, что Cd способен функционально замещать Zn в составе фермента карбоангидраза для фиксации неорганического углерода для фотосинтеза (Lane et al., 2005; Xu et al., 2008). Можно предположить определенную биохимическую роль Cd и для пресноводных диатомей, с учетом того, что в период максимального развития фитопланктона в июле содержание Zn в воде было сравнительно невысоко (табл. 1, рис. 2).
Рис. 6.
Результаты кластерного анализа и основные группы параметров, определяющих качество вод оз. Б. Вудъявр (Эл-ть – электропроводность, мкСм/см; Мин. – минерализация, мг/л; Цвет. – цветность, °Pt).
Экологическое состояние водоема является результирующим двух основных взаимосвязанных факторов – антропогенного загрязнения стоками апатитовой промышленности и уровнем развития продукционных процессов, что подтверждают результаты анализа главных компонент (рис. 7). Так, оба эти фактора объясняют 63.3% общей дисперсии. Первый, наиболее значимый фактор, выражает величину антропогенной нагрузки на экосистему водоема, напрямую определяющей концентрации главных ионов, Nобщ и минерализации вод. Второй, менее значимый, включает комплекс показателей, положительно связанных с продукционными процессами: содержание Chla, Cорг, ${\text{NH}}_{4}^{ + },$ pH, Cd, и отрицательно – с концентрацией Si и Zn (рис. 7а). Содержание Pобщ, ${\text{PO}}_{4}^{{3 - }},$ ${\text{HCO}}_{3}^{ - }$ одинаково зависит от совместного воздействия двух главных факторов.
Рис. 7.
Результаты ординации методом главных компонент в пространстве двух первых факторов на основе данных о сезонных изменениях химического состава вод оз. Б. Вудъявр (2006–2007 гг.): (а) – показателей качества вод, (б) – дат отбор проб.
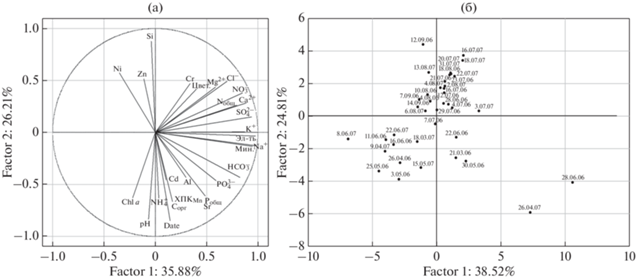
Проекция дней отбора проб на пространство двух главных факторов позволяет сгруппировать периоды сезона со схожими биогеохимическими условиями (рис. 7б). Так, результаты анализа главных компонент подтверждают выравнивание гидрохимических показателей летом (июль–август) и демонстрируют существенное отличие химического состава вод подо льдом (март–апрель). Весной и в начале лета биогеохимические процессы могут существенно различаться по годам, что определяется различными сроками начала половодья и активацией продукционных процессов (рис. 7б).
ЗАКЛЮЧЕНИЕ
Апатит-нефелиновые месторождения Хибинского щелочного массива относятся к крупнейшим в мире месторождениям фосфатного сырья с суммарными разведанными запасами P2O5 (с содержанием в рудах 7.5–17.5%) свыше 800 млн т. С конца 20-х гг. прошлого столетия началась их добыча и переработка, а также строительство г. Кировска и близлежащих поселков, что повлекло за собой трансформацию всех природных комплексов региона, включая многофакторное загрязнение водных объектов. Масштабное извлечение и переработка апатит-нефелиновых руд значительно изменили естественные биогеохимические циклы химических элементов, входящих в их состав. В результате ведения горнотехнических работ в природные воды поступают повышенные концентрации химических элементов и соединений, которые в ряде случаев приобретают токсичные свойства для водных организмов. Химический состав воды оз. Б. Вудъявр претерпел значительные перемены вследствие трансформации гидрологического и гидрохимического режимов в результате поступления сточных вод промышленных предприятий АО “Апатит” и коммунально-бытовых стоков, застройки городской территории, прокладывания подземных и наземных коммуникаций, выведения части поверхностного стока из баланса водоемов. Значительно возросла минерализация воды оз. Б. Вудъявр, величина pH, содержание соединений азота и фосфора. Установлена четкая вертикальная гидрохимическая стратификация вследствие распределения потоков воды от двух главных притоков оз. Б. Вудъявр, при которой гидрохимические показатели в придонном слое воды оз. Б. Вудъявр выше в 2–3 раза по сравнению с поверхностным слоем. Результатом резкого увеличения содержания биогенных элементов (на два порядка по сравнению с доиндустриальным) в воде озера является интенсивное развитие процессов эвтрофирования. Средний уровень биомассы фитопланктона в оз. Б. Вудъявр соответствует β-мезотрофному статусу и на порядок превосходит фоновые значения. В фитопланктоне по численности, биомассе и видовому богатству доминируют диатомовые водоросли, также сравнительно высока доля зеленых водорослей (до 30%) и цианобактерий (до 10%), способных вызывать цветение и токсичное загрязнение вод. Массовыми видами диатомей являются типичные представители эвтрофируемых озер. Сезонная динамика фитопланктона в течение периода открытой воды характеризуется одним ярко выраженным максимумом биомассы, приходящимся на июль, за счет развития диатомовых водорослей. На развитие фитопланктона большое значение оказывают величина pH, содержание соединений кремния и азота, выявлена стимулирующую роль Cd. Экологическое состояние оз. Б. Вудъявр является результирующим двух основных взаимосвязанных факторов – антропогенного загрязнения стоками апатитовой промышленности и уровнем развития продукционных процессов.
Авторы благодарят сотрудников ИППЭС КНЦ РАН за выполнение полевых работ и химических анализов.
Работа выполнена в рамках темы НИР № 0226-2019-0045 (полевые работы) и частично поддержана из средств грантов РФФИ №№ 18-05-60125 (химический анализ) и РНФ № 19-77-10007 (интерпретация результатов).
Список литературы
Алекин О.А. (1970) Основы гидрохимии. Л.: Гидрометеоиздат, 444 с.
Барабанов А.В., Калинина Т.А., Киселев А.А., Краснобаев А.И. (1999) Гигант в Хибинах. М.: Руда и металлы, 287 с.
Виноградова А.А., Котова Е.И., Топчая В.Ю. (2017) Атмосферный перенос тяжелых металлов в районы Севера Европейской территории России. География и природные ресурсы. (1), 108-116.
ГОСТ 17.1.3.07–82 (2010) Охрана природы. Гидросфера. Правила контроля качества воды водоемов и водотоков // Контроль качества воды: Сб. ГОСТов. М.: Стандартинформ.
Давыдов Д.А., Шалыгин С.С. (2009) Цианопрокариоты планктона озера Большой Вудъявр (Кольский п-ов) Биологическое разнообразие северных экосистем в условиях изменяющегося климата: тезисы докл. междун. науч. конф. Апатиты: Изд-во K&M, 36-37.
Даувальтер В.А. (2020) Геохимия озер в зоне влияния Арктического железорудного предприятия. Геохимия. 65(8), 797-810.
Dauvalter V.A. (2020) Geochemistry of Lakes in a Zone Impacted by an Arctic Iron-Producing Enterprise. Geochem. Int. 58(8), 933-946.
Даувальтер В.А., Денисов Д.Б., Дину М.И., Слуковский З.И. (2022) Биогеохимические особенности функционирования малых арктических озер Хибинского горного массива в условиях изменения климата и окружающей среды. Геохимия 67 (6), 559–575.
Dauvalter V.A., Denisov D.B., Dinu M.I., Slukovskii Z.I. (2022) Biogeochemical Features of Functioning of Small Arctic Lakes of the Khibiny Mountains under Climatic and Environmental Changes. Geochem. Int. 60 (6), 560–574.
Денисов Д.Б. (2010) Экологические особенности водорослевых сообществ разнотипных субарктических водоемов. Вестник Кольского научного центра РАН. (1), 48-55.
Денисов Д.Б., Кашулин Н.А., Терентьев П.М., Валькова С.А. (2009) Современные тенденции изменения биоты пресноводных экосистем Мурманской области. Вестник МГТУ. 12(3), 525-538.
Денисов Д.Б., Валькова С.А., Кашулин Н.А. (2016) Экологические особенности перифитона и зообентоса водных экосистем Хибинского горного массива (Кольский полуостров). Вестник МГТУ. 19(1/2), 165-175.
Денисов Д.Б., Валькова С.А., Кашулин Н.А. (2018) Водорослевые сообщества и макрозообентос водных экосистем Хибинского горного массива (Кольский полуостров). Вестник Кольского научного центра РАН. 10(1), 23-35.
Каныгина А.В. (1939) Гидробиологическое и гидрохимическое исследование озера Большой и Малый Вудъявр. Апатиты: Кольская научно-исследовательская база АН СССР, 206 с. (Фонды ФИЦ КНЦ РАН, № 105).
Кашулин Н.А., Денисов Д.Б., Сандимиров С.С., Даувальтер В.А., Кашулина Т.Г., Малиновский Д.Н., Вандыш О.И., Ильяшук Б.П., Кудрявцева Л.П. (2008) Антропогенные изменения водных систем Хибинского горного массива (Мурманская область). В 2 ч. Апатиты: Изд-во Кольского научного центра РАН, ч. 1. 250 с., ч. 2. 282 с.
Кашулин Н.А., Сандимиров С.С., Даувальтер В.А., Кудрявцева Л.П., Терентьев П.М., Денисов Д.Б., Валькова С.А. (2010) Аннотированный экологический каталог озер Мурманской области (Восточная часть. Бассейн Баренцева моря). В 2 ч. Апатиты: Изд-во Кольского научного центра РАН, ч. 1. 249 с., ч. 2. 128 с.
Кашулин Н.А., Беккелунд А., Даувальтер В.А., Петрова О.В. (2019) Апатитовое горно-обогатительное производство и эвтрофирование арктического озера Имандра. Арктика: экология и экономика. 35(3), 16-34.
Китаев С.П. (2007) Основы лимнологии для гидробиологов и ихтиологов. Петрозаводск, Изд-во Карельского НЦ РАН, 394 с.
Лозовик П.А., Галахина Н.Е. (2017) Изменение химического состава воды системы р. Кенти в результате техногенного влияния. Труды Карельского научного центра РАН. (3), 21-35.
Методы экологических исследований водоемов Арктики (2019) / С.С. Сандимиров [и др.]. Мурманск: Изд-во МГТУ, 180 с.
Минеева Н.М. (2004) Растительные пигменты в воде волжских водохранилищ. М.: Наука, 156 с.
Моисеенко Т.И. (2015) Влияние геохимических факторов водной среды на биоаккумуляцию металлов в организме рыб. Геохимия. (3), 222-233.
Moiseenko T.I. (2015) Impact of geochemical factors of aquatic environment on the metal bioaccumulation in fish. Geochem. Int. 53(3), 213-223.
Моисеенко Т.И., Родюшкин И.В., Даувальтер В.А., Кудрявцева Л.П. (1996) Формирование качества вод и донных отложений в условиях антропогенных нагрузок на водоемы арктического бассейна (на примере Кольского Севера). Апатиты: Изд-во Кольского научного центра РАН, 263 с.
Моисеенко Т.И., Гашкина Н.А. (2015) Формирование химического состава вод Мурманской области в условиях функционирования горнорудных и металлургических производств. Арктика: экология и экономика. 20(4), 4-13.
Моисеенко Т.И., Дину М.И., Гашкина Н.А., Кремлева Т.А., Хорошавин В.Ю. (2020) Геохимические закономерности распространения элементов в водах озер арктических регионов. Геохимия. 65(6), 521-532.
Moiseenko T.I., Dinu M.I., Gashkina N.A., Kremleva T.A., Khoroshavin V.Y. (2020). Geochemical features of elements distributions in the lake waters of the Arctic region. Geochem. Int. 58 (6), 613-623.
Никаноров А.М. (2001) Гидрохимия. СПб.: Гидрометеиздат, 444 с.
Павлова А.С., Кашулин Н.А., Денисов Д.Б., Терентьев П.М., Кашулина Т.Г., Даувальтер В.А. (2019) Распределение химических элементов между компонентами экосистемы арктического озера Большой Вудъявр (Хибины, Мурманская область). Сибирский экологический журн. (3), 348-366.
Руководство по методам гидробиологического анализа поверхностных вод и донных отложений (1992) / В.А. Абакумов [и др.]. СПб.: Гидрометеоиздат, 318 с.
Сулименко Л.П., Кошкина Л.Б., Мингалева Т.А., Светлов А.В., Некипелов Д.А., Макаров Д.В., Маслобоев В.А. (2017) Молибден в зоне гипергенеза Хибинского горного массива. Мурманск: Изд-во МГТУ, 148 с.
Терентьев П.М., Кашулин Н.А., Зубова Е.М. (2017) Роль европейской корюшки Osmeruseperlanus (Linnaeus) в структуре ихтиофауны бассейна оз. Имандра (Мурманская область). Труды ЗИН. 321(2), 228-243.
Ферсман А.Е. (1968) Наш апатит. М.: Наука, 136 с.
Cheng J., Qiu H., Chang Z., Jiang Z., Yin W. (2016) The effect of cadmium on the growth and antioxidant re-sponse for freshwater algae Chlorella vulgaris. Springer Plus. 5(1290).
Determination of photosynthetic pigments in sea water (1996) / Rep. of SCOP-UNESCO Working Group 17. Paris: UNESCO, 9-18.
Domingues R.B., Barbosa A.B., Sommer U., Galvão H.M. (2011) Ammonium, nitrate and phytoplankton interactions in a freshwater tidal estuarine zone: potential effects of cultural eutrophication. Aquat. Sci. 73, 331-343.
Gregurek D., Melcher F., Pavlov V.A., Reimann C., Stumpf E.F. (1999) Mineralogy and mineral chemistry of snow filter residues in the vicinity of the nickel-copper processing industry, Kola Peninsula, NW Russia. Miner. Petrol. 65, 87-111.
Guiry M.D., Guiry G.M. (2021) AlgaeBase. World-wide electronic publication. National University of Ireland, Galway, URL: http://www.algaebase.org (дата обращения 21.01.2021).
Intercomparison–2016 (2016) 1630: pH, Conductivity, Alkalinity, NO3–N, Cl, SO4, Ca, Mg, Na, K, TOC, Al, Fe, Mn, Cd, Pb, Cu, Ni and Zn. ICP Waters report 129/2016. Oslo: Norwegian Institute for Water Research, Report No. 7081, 72 p.
Karlson B., Cusack C., Bresnan E. (2010) Microscopic and molecular methods for quantitative phytoplankton analysis. Intergovernmental Oceanographic Commission Manuals and Guides 55. Paris: UNESCO, 114 p.
Kashulin N.A., Dauvalter V.A., Denisov D.B., Valkova S.A., Vandysh O.I., Terentjev P.M., Kashulin A.N. (2017) Selected aspects of the current state of freshwater resources in the Murmansk Region, Russia. J. Environ. Science and Health, Part A. 52(9), 921-929.
Lane T.W., Saito M.A., George G.N., Pickering I.J., Prince R.C., Morel F.M.M. (2005) A cadmium enzyme from a marine diatom. Nature. 435, 42.
Masmoudi S., Nguyen-Deroche N., Caruso A., Ayadi H., Morant-Manceau A., Tremblin G. (2013) Cadmium, Copper, Sodium and Zinc Effects on Diatoms: from Heaven to Hell – a Review. Cryptogamie, Algologie. 34(2), 185-225.
Moiseenko T.I., Dinu M.I., Gashkina N.A., Kremleva T.A. (2019) Aquatic environment and anthropogenic factor effects on distribution of trace elements in surface waters of European Russia and Western Siberia // Environ. Res. Lett. 14, 065010.
Moiseenko T.I., Gashkina N.A., Dinu M.I., Kremleva T.A., Khoroshavin V.Yu. (2020) Water Chemistry of Arctic Lakes under Airborne Contamination of Watersheds // Water 12, 1659.
Mu W., Chen Y., Liu Y., Pan X., Fan Y. (2018) Toxicological effects of cadmium and lead on two freshwater diatoms. Environ. Toxicol. Pharmacol. 59, 152-162.
Standard method for examination for water and wastewater (1999). 20-th Edition (Eds. Clescerl L.S., Greenberg A.E., Eaton A.D.). Washington: American Public Health Association USA, 2671 p.
Xu Y., Feng L., Jeffrey P.D., Shi Y., Morel F.M.M. (2008) Structure and metal exchange in the cadmium carbonic anhydrase of marine diatoms. Nature. 452, 56-61.
Дополнительные материалы отсутствуют.