Геохимия, 2022, T. 67, № 10, стр. 1029-1036
As-содержащий фосфосидерит из Чили (район Копьяпо, Атакама)
Ю. Д. Гриценко a, b, М. Ф. Вигасина a, С. К. Дедушенко c, Д. А. Ксенофонтов a, Л. В. Мельчакова a, Л. П. Огородова a, *
a Московский Государственный Университет им. М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские Горы, 1, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
c Московский Государственный Университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские Горы, 3, Россия
* E-mail: logor48@mail.ru
Поступила в редакцию 19.01.2022
После доработки 10.03.2022
Принята к публикации 14.03.2022
- EDN: CARQHE
- DOI: 10.31857/S0016752522100041
Аннотация
As-содержащий (3–9 мас. % As2O5) фосфосидерит (Атакама, Чили) был исследован методами порошковой рентгенографии, термического и микрозондового анализа, ИК, КР и мессбауэровской спектроскопии. Усредненная формула изученного фосфосидерита, рассчитанная на два катиона, имеет вид: $\left( {{\text{Fe}}_{{0.96}}^{{3 + }}{\text{A}}{{{\text{l}}}_{{0.04}}}} \right)$[(P0.94As0.06)O4]·2.02H2O. Методом порошковой рентгенографии определены параметры моноклинной ячейки As-содержащего фосфосидерита: a = 5.3258(6) Å, b = = 9.8003(11) Å, c = 8.7116(9) Å, β = 90.64(1)°. Установлено изоморфное замещение As → P в тетраэдрической позиции.
ВВЕДЕНИЕ
Фосфосидерит, водный фосфат трехвалентного железа Fe3+PO4·2H2O – относительно редкий минерал, открытый в 1890 г. в окисленных железных рудах месторождения Кальтерборн (Северный Рейн-Вестфалия, Германия) и названный по его основным компонентам – фосфору и железу. Фосфосидерит является моноклинной (пространственная группа P21/n) полиморфной модификацией ромбического штренгита (пространственная группа Pbca), изоструктурного скородиту Fe3+AsO4·2H2O.
Фосфосидерит встречается в гранитных пегматитах в качестве продукта преобразования трифилина, может быть составной частью коры выветривания и почвы; образует псевдоморфозы по костным фрагментам и раковинам моллюсков. Проявления фосфосидерита известны в Чили, Бразилии, Аргентине, Германии, Португалии и США. Предполагается наличие водных фосфатов железа, в частности, штренгита и фосфосидерита, на поверхности Марса (Lane et al., 2008; Dyar et al., 2014).
Структура фосфосидерита (Moore, 1966) представлена изолированными металлоцентрированными кислородными октаэдрами, связанными друг с другом через PO4-тетраэдры, образующими, таким образом, трехмерный каркас. Две молекулы воды связаны с каждым октаэдром в конфигурации cis-Fe(Op)4(Oh)2, где Op – кислород группы (PO4)3–, а Oh – кислород самой молекулы воды. Каждый кислород группы (PO4)3– связан с одним атомом фосфора и с одним атомом железа.
Для фосфосидерита характерны изоморфные замещения в позиции катиона Fe3+ ↔ Al с образованием в ряде случаев зональных кристаллов изоморфного ряда фосфосидерит–метаварисцит AlPO4·2H2O (Lamoso, Atencio, 2017) и в тетраэдрической позиции P5+ ↔ As5+ (Bolanz et al., 2016).
Физико-химические исследования (определение параметров ячейки, рамановская, инфракрасная и мессбауэровская спектроскопии) водного фосфата железа, описанные в опубликованной литературе, выполнены главным образом на синтезированных соединениях (Arlidge et al., 1963; Song et al., 2002; Reale et al., 2003; Ait-Salah et al., 2005; Zaghib Yulien, 2005; Alfonso et al., 2012; Dyar et al., 2014); природные образцы фосфосидерита изучены в немногочисленных рентгенографических работах (Paulis et al., 2015; Lamoso, Atencio, 2017) и методом КР спектроскопии в работе (Frost et al., 2004). Устойчивость при нагревании синтезированных фаз была исследована в работах (Arlidge et al., 1963; Волков и др., 1976; Reale et al., 2003; Alfonso et al., 2012). Изучению кинетики дегидратации Fe3+PO4·2H2O и определению энергии активации этого процесса посвящена работа (Khachani et al., 2015).
Целью настоящей работы явилось комплексное физико-химическое исследование природного образца мышьяксодержащего фосфосидерита.
ОПИСАНИЕ ОБРАЗЦА И МЕТОДЫ ИССЛЕДОВАНИЯ
Для исследований был выбран образец фосфосидерита (Копьяпо, Атакама, Чили) из коллекции Минералогического музея им. А.Е. Ферсмана РАН (№ 97 444). Образец представлял собой массивный микрокристаллический агрегат зональных уплощенных кристаллов размером до 100 мкм лилово-розового цвета с округлыми выделениями кварца размером до 3 мм и небольшими полостями (до 2 мм), выполненными мельчайшими кристаллами фосфосидерита с наросшими на них бурыми сферолитами ярозита. Для определения физико-химических параметров были отобраны мономинеральные фрагменты из центральных частей агрегата.
Химический анализ выполнен в лаборатории локальных методов исследования вещества кафедры петрологии МГУ имени М.В. Ломоносова с помощью сканирующего электронного микроскопа “JSM-6480LV” (Jeol Ltd., Japan) с вольфрамовым термоэмиссионным катодом с энергодисперсионным спектрометром X-Max-50 (Oxford Instruments Ltd., GB) при ускоряющем напряжении 20 кВ, силе тока 10.05 ± 0.05 нА. Обработка данных была произведена в программе INCA v. 22 (Oxford Instruments). Для определения элементного состава в качестве стандартов использовались: GaP для Р, InAs для As, Al2O3 для Al и металлический Fe для Fe.
Термическое поведение минерала изучено на дериватографе “Q-1500D” (Венгрия) в интервале температур от комнатной до 1273 K со скоростью нагрева 20 K/мин, масса образца составляла 29 мг.
Абсорбционные мессбауэровские спектры были записаны при комнатной температуре на спектрометре фирмы “Wissel” (Германия) в режиме постоянного ускорения с использованием стандартного мессбауэровского источника 57Со в матрице металлического родия активностью около 5 мКи (АО “РИТВЕРЦ”, Россия). Изомерные сдвиги представлены относительно α-железа. Моделирование спектра выполнено при помощи компьютерной программы HappySloth (www.happysloth.ru).
Рентгенографическое изучение проведено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлен в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора с углом захвата 5° по углу 2Θ с шириной канала 0.02°. Коррекция положения линий проведена по внутреннему стандарту – кварцу.
ИК-спектроскопические исследования (FTIR) были выполнены на Фурье-спектрометре “ФСМ-1201” (Россия) в режиме пропускания на воздухе при комнатной температуре в диапазоне волновых чисел от 400 до 4000 см–1, накопление сигнала осуществлялось в течение 20 сканов при точности съемки ±2 см–1. Образец был приготовлен в виде суспензии порошка минерала (3–5 мг) в вазелиновом масле. Приготовленная суспензия наносилась на пластинку из бромида калия, в качестве образца сравнения использовалась та же пластинка из KBr до нанесения на нее минеральной суспензии.
КР-спектроскопическое изучение выполнено на рамановском микроскопе “EnSpectr R532” (Россия). Длина волны лазерного излучения равнялась 532 нм, выходная мощность луча составляла около 6 мВт, голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение равнялось 6 см–1, диаметр фокального пятна – 15 мкм при увеличении 40×. Спектр был получен в интервале от 100 до 4000 см–1 на неориентированном образце в режиме накопления сигнала в течение 1 с при усреднении по 50 экспозициям.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химический анализ
В табл. 1 представлены результаты микрозондового анализа изученного образца фосфосидерита. Во всех проанализированных участках образец содержит примесь мышьяка (3–9 мас. % As2O5) и небольшое количество алюминия (0.4–1.5 мас. % Al2O3).
Таблица 1.
Состав изученного As-фосфосидерита*
| Мас. % | Формульные коэффициенты в расчете на 2 катиона | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Fe2О3 | Al2О3 | P2О5 | As2О5 | Н2О | сумма | Fe | Al | P | As | Н2О |
| 40.49 | 0.65 | 34.89 | 4.80 | 19.30 | 100.13 | 0.96 | 0.02 | 0.93 | 0.08 | 2.04 |
| 39.86 | 0.69 | 34.83 | 4.64 | 19.30 | 99.32 | 0.96 | 0.03 | 0.94 | 0.08 | 2.03 |
| 40.08 | 0.66 | 33.86 | 6.41 | 19.30 | 100.31 | 0.96 | 0.02 | 0.91 | 0.11 | 2.05 |
| 40.12 | 0.27 | 34.91 | 4.25 | 19.30 | 98.85 | 0.97 | 0.01 | 0.95 | 0.07 | 2.04 |
| 39.90 | 0.53 | 35.11 | 4.64 | 19.30 | 99.48 | 0.96 | 0.02 | 0.95 | 0.08 | 2.03 |
| 40.50 | 0.52 | 34.21 | 5.00 | 19.30 | 99.53 | 0.97 | 0.02 | 0.92 | 0.08 | 2.04 |
| 39.45 | 0.62 | 34.00 | 5.65 | 19.30 | 99.02 | 0.96 | 0.02 | 0.93 | 0.10 | 2.04 |
| 40.19 | 0.52 | 33.60 | 5.97 | 19.30 | 99.58 | 0.97 | 0.02 | 0.91 | 0.10 | 2.05 |
| 39.39 | 0.44 | 33.02 | 6.59 | 19.30 | 98.74 | 0.96 | 0.02 | 0.91 | 0.11 | 2.06 |
| 38.18 | 0.79 | 30.73 | 9.06 | 19.30 | 98.06 | 0.95 | 0.03 | 0.86 | 0.16 | 2.08 |
| 39.72 | 0.40 | 31.94 | 7.19 | 19.30 | 98.55 | 0.98 | 0.02 | 0.88 | 0.12 | 2.07 |
| 40.36 | 0.98 | 33.81 | 5.44 | 19.30 | 99.89 | 0.96 | 0.04 | 0.91 | 0.09 | 2.04 |
| 39.74 | 0.66 | 33.77 | 6.39 | 19.30 | 99.86 | 0.95 | 0.02 | 0.91 | 0.11 | 2.05 |
| 40.10 | 0.26 | 33.94 | 6.63 | 19.30 | 100.23 | 0.96 | 0.01 | 0.92 | 0.11 | 2.06 |
| 39.74 | 0.66 | 33.77 | 6.39 | 19.30 | 99.86 | 0.95 | 0.02 | 0.91 | 0.11 | 2.05 |
| 40.10 | 0.26 | 33.94 | 6.63 | 19.30 | 100.23 | 0.96 | 0.01 | 0.92 | 0.11 | 2.06 |
| 39.09 | 1.54 | 35.38 | 4.67 | 19.30 | 99.98 | 0.92 | 0.06 | 0.94 | 0.08 | 2.02 |
| 40.37 | 0.27 | 34.82 | 4.15 | 19.30 | 98.91 | 0.97 | 0.01 | 0.95 | 0.07 | 2.04 |
| 39.03 | 0.65 | 34.35 | 3.55 | 19.30 | 96.88 | 0.96 | 0.03 | 0.95 | 0.06 | 2.03 |
| 39.32 | 0.48 | 32.53 | 7.41 | 19.30 | 99.04 | 0.97 | 0.02 | 0.89 | 0.13 | 2.07 |
| 38.79 | 1.46 | 36.13 | 3.16 | 19.30 | 98.84 | 0.93 | 0.06 | 0.96 | 0.05 | 2.01 |
| 39.54 | 0.82 | 35.12 | 4.34 | 19.30 | 99.12 | 0.95 | 0.03 | 0.94 | 0.07 | 2.03 |
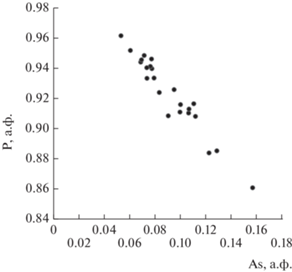
По результатам химического анализа в распределении элементов отмечается осцилляционная зональность (рис. 1), причем краевые части кристаллов в большей степени обогащены мышьяком и содержат меньшее количество алюминия (рис. 2), в центральных частях агрегатов наблюдается обратная закономерность.
Термический анализ
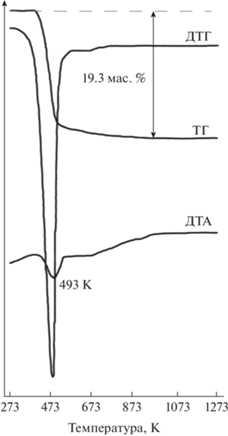
На кривой ДТА (рис. 3) в интервале температур 423–973 K (tmax = 493 K) обнаружен эндотермический эффект, связанный с процессом дегидратации минерала, на кривой ТГ зафиксирована соответствующая потеря массы образца, равная 19.3 мас. %.
Мессбауэровская спектроскопия
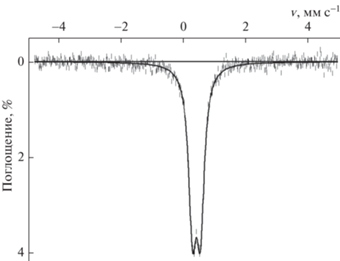
Мессбауэровский спектр образца (рис. 4) представляет собой симметричный разрешенный дублет. Поскольку в структуре фосфосидерита железо занимает только одну кристаллографическую позицию, а данных о присутствии других железосодержащих фаз получено не было, спектр был описан одним дублетом из уширенных линий лоренцевой формы. Параметры дублета (RTISα-Fe = 0.43 ± 0.01 мм с–1, RTQS = = 0.26 ± 0.01 мм с–1, FWHM = 0.30 ± 0.01 мм с–1) типичны для трехвалентного железа в высокоспиновом состоянии, находящегося в октаэдрическом окружении кислорода PO4-тетраэдров. Признаков примесей двухвалентного железа обнаружено не было.
Рентгенографическое изучение
Полученная дифрактограмма (рис. 5) соответствует дифрактограмме фосфосидерита согласно базе данных ICDD (The International Centre for Diffraction Data, 2013; карточка № 01-072-0471) (Moore, 1966). Все линии незначительно сдвинуты в область бóльших углов 2θ по сравнению с безарсенатным фосфосидеритом из-за бóльших размеров элементарной ячейки первого. Параметры элементарной ячейки для мышьяксодержащего чилийского фосфосидерита усредненного состава (5.5 мас. % As2O5), что соответствует химической формуле $\left( {{\text{Fe}}_{{0.96}}^{{3 + }}{\text{A}}{{{\text{l}}}_{{0.04}}}} \right)$[(P0.94As0.06)O4]·2.02H2O, равны: a = 5.3258(6) Å, b = 9.8003(11) Å, с = = 8.7116(9) Å, β = 90.64(1)°.
Рис. 5.
Порошковая дифрактограмма изученного As-содержащего фосфосидерита; *внутренний стандарт (кварц).
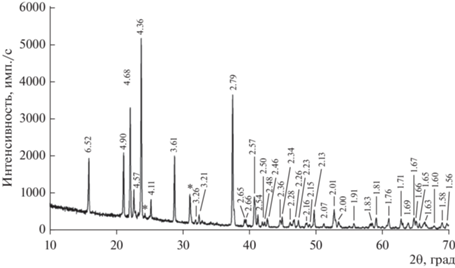
По данным работы (Bolanz et al., 2016) параметры элементарной ячейки и угол β синтетических аналогов фосфосидерита увеличиваются с увеличением содержания мышьяка в их составе – так, параметр a равен 5.32664(7) для беспримесной фазы Fe3+PO4·2H2O, для фосфосидерита, содержащего 2.11 мас. % As2O5 (что соответствует составу Fe3+(Р0.98As0.02)O4·2Н2О), параметр a = = 5.32901(7) Å; параметр b увеличивается от 9.79387(8) до 9.79753(6) Å; параметр c растет от 8.70933(11) Å до 8.71368(13) Å; угол β увеличивается от 90.5408(12)° до 90.5675(14)°, соответственно. Полученный параметр b больше, чем определенный в работе для синтетических аналогов (Bolanz et al., 2016), что, вероятно, связано с бóльшим содержанием мышьяка в природном образце. Значение параметра a для чилийского As-фосфосидерита меньше, чем для беспримесного (Bolanz et al., 2016); это может быть связано с вхождением Al в структуру природного фосфосидерита; по данным (Lamoso, Atencio, 2017) параметр a для метаварисцита (Al-аналог фосфосидерита) меньше, чем для фосфосидерита.
ИК и КР спектроскопические исследования
Спектральные свойства фосфосидерита из двух месторождений Южной Австралии были изучены в работе (Frost et al., 2004), результаты исследований гидротермально синтезированных аналогов фосфосидерита представлены в (Zaghib, Julien, 2005). В этих же статьях дано отнесение частот колебаний в ИК и КР спектрах к соответствующим колебательным модам.
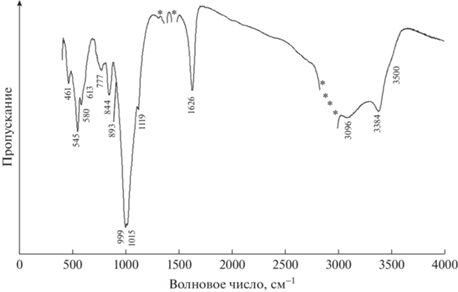
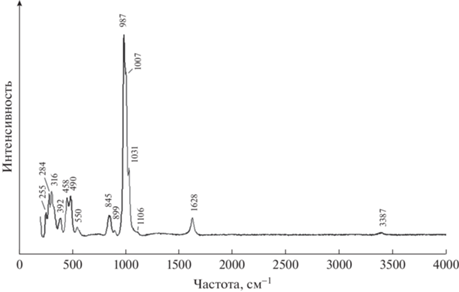
Полученные в настоящей работе спектры чилийского фосфосидерита приведены на рис. 6 и 7.
Отнесение полос поглощения и линий рассеяния, выполненное с учетом результатов упомянутых выше работ, а также справочного издания (Накамото, 1991), приведено в табл. 2.
Таблица 2.
Частоты колебаний (см–1) в ИК и КР спектрах изученного As-фосфосидерита и их отнесение к колебательным модам
| ИК | КР | Отнесение |
|---|---|---|
| 3500 плечо | 3387 слабая | Валентные колебания молекул воды |
| 3384 | ||
| 3096 | ||
| 1626 | 1628 | Деформационное колебание молекул воды |
| 1119 слабая | 1106 слабая | Трижды вырожденное валентное колебание ν3(F2) аниона [РO4]3– |
| 1015 сильная | 1031 | |
| 1007 сильная | ||
| 999 сильная | 987 сильная | Симметричное невырожденное валентное колебание ν1(А1) аниона [РO4]3– |
| 893 плечо | 899 | Трижды вырожденное валентное колебание ν3(F2) аниона [AsO4]3– |
| 847 | 845 | Симметричное невырожденное валентное колебание ν1(А1) аниона [AsO4]3– |
| 777 | – | Либрационные колебания молекул воды |
| 613 плечо | – | Трижды вырожденное деформационное колебание ν4(F2) аниона [РO4]3– |
| 580 | 550 слабая | |
| 545 сильная | ||
| 461 | 476 | Дважды вырожденное деформационное колебание ν2(Е) аниона [РO4]3– |
| 450 | ||
| – | 392 | Трансляционные колебания катионов + “решеточные” моды |
| 316 | ||
| 284 | ||
| 255 |
Характерной особенностью ИК и КР спектров исследованного образца по сравнению со спектрами безарсенатного фосфосидерита (Frost et al., 2004; Zaghib, Julien, 2005; Chukanov, 2014; Сhukanov, Vigasina, 2020) является наличие полос, указывающих на присутствие аниона [AsO4]3– в его составе: 893 см–1 (плечо) и 840 см–1 – в спектре ИК-поглощения; 899 и 845 см–1 (слабая) – в спектре КР (Накамото, 1991). Относительно невысокая интенсивность этих линий указывает на небольшое количество арсенат-иона в составе исследованного фосфосидерита. Присутствие в минерале воды в молекулярной форме подтверждается обоими методами: линии 3387 и 1626 см–1 – в спектре КР; полосы 3500 (плечо), 3384, 3096 и 1626 см–1 – в спектре ИК. Поскольку ИК спектроскопия более чувствительна к присутствию воды в веществе, относительная интенсивность соответствующих полос в спектре ИК-поглощения значительно выше относительной интенсивности соответствующих линий рассеяния в спектре КР. Кроме того, в ИК спектре изученного фосфосидерита зарегистрирована слабая полоса с волновым числом 777 см–1, приписываемая либрационным колебаниям молекул Н2О. Спектральный диапазон от 1130 до ~900 см–1 занимают трижды вырожденные антисимметричные и невырожденные симметричные валентные колебания аниона [РO4]3–. В диапазоне 650–500 см–1 располагаются частоты трижды вырожденного деформационного колебания, а в диапазоне 500–400 см–1 – частоты дважды вырожденного деформационного колебания аниона [РO4]3–. В области КР спектра ниже 400 см–1 сосредоточены частоты трансляционных колебаний катионов и крупных структурных единиц, так называемые “решеточные” моды – 392, 316, 284 и 255 см–1. Наблюдаемое в спектрах расщепление колебаний аниона [РO4]3– объясняется двумя причинами: понижением симметрии аниона в структуре минерала и присутствием в элементарной ячейке четырех анионов [РO4]3–, что приводит к фактор-групповому расщеплению колебательных уровней.
ЗАКЛЮЧЕНИЕ
Проведено комплексное физико-химическое изучение мышьяксодержащего фосфосидерита из района Копьяпо (Атакама, Чили). В природе неизвестен арсенат железа изоструктурный фосфосидериту в отличие от его полиморфной модификации штренгита Fe3+РO4·2H2O, которая изоструктурна скородиту Fe3+AsO4·2H2O.
Фосфор и мышьяк обладают схожими свойствами, например, предпочтительный пятивалентный характер (P5+, As5+), проявляемый в кислородных соединениях, преобладающая тетраэдрическая координация кислородного окружения и существование идентичных комплексных ионов в водном растворе $\left( {{{{\text{H}}}_{x}}{\text{PO}}_{4}^{{\left( {3 - x} \right)--}}} \right)$ и $\left( {{{{\text{H}}}_{x}}{\text{AsO}}_{4}^{{\left( {3 - x} \right)--}}} \right).$
В работе (Bolanz et al., 2016) было показано, что, несмотря на то, что ионный радиус P5+ в тетраэдрической координации (0.38 Å) существенно меньше радиуса As5+ (0.56 Å), вхождение мышьяка в тетраэдрическую позицию структуры фосфосидерита происходит по схеме изовалентного замещения. После замещения мышьяком фосфора происходит изменение расстояний As–O и As–Fe, при этом As5+, замещающий P5+ в фосфосидерите, оказывается в такой же локальной координации, как и в штренгите и/или скородите, что подтверждается данными XANES и EXAFS (Bolanz et al., 2016). Эти изменения прослеживаются в пределах 5–10 Å вокруг позиции замещенного катиона, что соразмерно с параметрами элементарной ячейки.
В исследованном нами чилийском фосфосидерите, содержащем до 9 мас. % As2O5, замещение As5+ → P5+ в тетраэдрически координированной кислородом позиции происходит в соответствии с механизмом, предложенным в вышеупомянутой работе (Bolanz et al., 2016). Методом порошковой рентгенографии не были обнаружены примесные фазы скородита и/или штренгита, содержание которых превышает 5 мас. %, отсутствие обособленных выделений скородита и/или штренгита размерами от 5 мкм и более было подтверждено локальным методом комбинационного рассеяния света (рис. 7); кроме того, изменение химического состава минерала происходит по схеме с заменой примерно одного атома фосфора одним атомом мышьяка (рис. 2).
Порошковый дифрактометр “STOE-STADI MP”, сканирующий электронный микроскоп “JSM-6480LV”, инфракрасный Фурье-спектрометр “ФСМ-1201”, рамановский микроскоп “EnSpectr R532” и дериватограф “Q-1500 D” установлены на геологическом факультете МГУ имени М.В. Ломоносова; мессбауэровский спектрометр “Wissel” находится на химическом факультете Московского государственного университета им. М.В. Ломоносова.
Авторы выражают благодарность заведующему лабораторией локальных методов исследования вещества кафедры петрологии МГУ им. М.В. Ломоносова В.О. Япаскурту за проведение микрозондовых анализов.
Список литературы
Волков А.И., Яглов В.Н., Новиков Г.И. (1976) Исследование кристаллогидратов ортофосфата железа. Известия ВУЗов. Сер. Химия и химическая технология. (8), 1278-1279.
Накамото К. (1991) ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 505 с.
Ait-Salah A., Jozwiak P., Garbarczyk J., Gendron F., Mauger A., Julien C.M. (2005) FTIR featutes of lithium iron phosphates used as positive electrodes in rechargeable lithium batteries. Electrochem. Soc. Proceed. 14, 103-112.
Alfonso B.F., Trobajo C., Pigué C., García J.R., Blanko J.A. (2012) From dihydrated iron(III) phosphate to monohydrated ammonium-iron(II) phosphate: Solvothermal reaction mediated by acetone-urea mixtures. J. Solid State Chem. 196, 458-464.
Arlidge E.Z., Farmer V.C., Mitchell B.D., Mitchell W. (1963) Infra-red, X-ray and thermal analysis of some aluminium and ferric phosphates. J. Appl. Chem. 13(1), 17-27.
Bolanz R.M., Wierzbicka-Wieczorek M., Giester G, Göttlicher J., Steininger R. (2016) Structural incorporation of As5+ into phosphosiderite by a strengite/scorodite-like arrangement. Chem. Select. 1(14), 4152-4160.
Chukanov N.V. (2014) Infrared Spectra of Mineral Species: Extended Library. Springer-Verlag GmbH, Dordrecht–Heidelberg–N.Y.–London. 1726 p.
Chukanov N.V., Vigasina M.F. (2020) Vibrational (Infrared and Raman) Spectra of Minerals and Related Compaunds. Springer Nature Switzerland AG. 1376 p.
Dyar M.D., Jawin E.R., Breves E., Marchand G., Nelms M., Lane M.D., Mertzman S.A., Bish D.L., Bishop J.L. (2014) Mössbauer parameters of iron in phosphate minerals: Implications for interpretation of martian data. Am.Mineral. 99, 914-942
Frost R.L., Weier M.L., Erickson K.L., Carmody O., Mills S.J. (2004) Raman spectroscopy of phosphates of the variscite mineral group. J. Raman Spectrosc. 35, 1047-1055.
Khachani M., Hamidi A.E., Kacimi M., Halim M., Arsalane S. (2015) Kinetic approach of multi-step thermal decomposition processes of iron(III) phosphate dihydrate FePO4∙2H2O. Thermochim. Acta. 610, 29-36.
Lamoso I.S.M., Atencio D. (2017) Zoned phosphosiderite-metavariscite crystals from Eduardo Mine, Conselheiro Pena, Minas Gerais, Brazil. Geol. USP, Sér. Cient., São Paulo. 17(3), 23-27.
Lane M.D., Bishop J.L., Dyar M.D., King P.L., Parente M., Hyde B.C. (2008) Mineralogy of the Paso Robles soils on Mars. Am. Mineral. 93, 728-739.
Moore P.B. (1966) The crystal structure of metastrengite and its relationship to strengite and phosphophyllite. Am. Mineral. 51, 168-176.
Paulis P., Venclik V., Malikova R., Pour O., Sejkora J. (2015) Phosphosiderite from Zdechovice and Chvaletice near Přelouč, Železné hory mts (Czech Republic). Bull. Mineral.-Petrol. Oddel. Narod. Muz. Praze. 23(2), 208-213.
Reale P., Scrosati B., Delacourt C., Wurm C., Morcrette M., Masqueller C. (2003) Synthesis and thermal behavior of crystalline hydrated iron(III) phosphates of interest as positive electrodes in Li batteries. Chem. Mater. 15(26), 50-51.
Song Y., Zavalij P.Y., Suzuki M., Whittingham M.S. (2002) New Iron(III) phosphate phases: Crystal structure and electrochemical and magnetic properties. Inorg. Chem. 41(22), 5778-5786.
www.happysloth.ru: Левин Д.М., Дедушенко С.К. Свидетельство о регистрации программы для ЭВМ № 2016660090.
Zaghib K., Yulien C.M. (2005) Structure and electrochemistry of FePO4∙2H2O hydrate. J. Power Sources. 142, 279-284.
Дополнительные материалы отсутствуют.