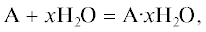Геохимия, 2022, T. 67, № 10, стр. 978-992
Оценка стандартных термодинамических функций гидратных сульфатов двухвалентных металлов (Ca, Mn, Cd, Fe, Zn, Cu, Mg, Ni, Co, Be)
О. С. Русаль a, *, О. В. Еремин a, **
a Институт природных ресурсов, экологии и криологии СО РАН
672014 Забайкальский край, Чита, ул. Недорезова, 16а, Россия
* E-mail: sergutskaya@mail.ru
** E-mail: yeroleg@yandex.ru
Поступила в редакцию 17.05.2021
После доработки 10.03.2022
Принята к публикации 15.04.2022
- EDN: THGRKL
- DOI: 10.31857/S0016752522100077
Аннотация
На основе известных стандартных термодинамических свойств: свободных энергий Гиббса ΔƒG° и энтальпий ΔƒH° образования, энтропий S° при температуре 298.15 K гидратных сульфатов двухвалентных металлов (Ca, Mn, Cd, Fe, Zn, Cu, Mg, Ni, Co, Be) получены уравнения линейных зависимостей величин термодинамических функций соединений от содержания кристаллизационной воды с использованием метода наименьших квадратов. Сравнение оценок с методом многомерного корреляционного анализа, показывает более высокую точность расчетов рассмотренного подхода. Выявлена корреляция термодинамических свойств гидратов и кристаллографических радиусов катионов. Полученные уравнения использованы для расчета неизвестных свойств некоторых гидратов. Сравнение расчетов термодинамических равновесий систем MeSO4–H2O в ПК “Селектор” показало хорошее согласование с экспериментальными диаграммами растворимости солей в воде.
ВВЕДЕНИЕ
В геохимических процессах, протекающих в зонах окисления сульфидных и сульфидсодержащих месторождений, активное участие принимают сульфатные минералы двухвалентных металлов (Jambor et al., 2000; Яхонтова, Зверева, 2007; Белогуб и др., 2007; Чарыкова и др., 2009, 2010; Chou, Seal, 2012; Елохина, Рыженко, 2014; Pfitzner, 2018; D’Orazio, 2021). Большинство простых сульфатных солей образуют кристаллогидратные формы, существование которых зависит от температуры и давления (влажности), обуславливая области их устойчивости, как при положительных, так и отрицательных по Цельсию температурах (Peterson et al., 2007; Chou, Seal, 2012; Fortes et al., 2017). Многие гидратные минералы нестабильны, редко встречаются или представлены в ассоциациях в незначительных количествах (Hazen, Ausubel, 2016).
Сульфаты двухвалентных металлов имеют большое значение в гидрометаллургическом производстве (Xiao et al., 2021; Vielma, 2021) и технологиях очистки (Ma et al., 2021).
Для этого представительного класса минералов и неорганических соединений проведено большое количество исследований их физико-химических свойств (DeKock, 1982; Mercury et al., 2001; Billon, Vieillard, 2015; Grevel, Majzlan, 2009; Grevel, Majzlan, 2011; Chou, Seal, 2007). Тем не менее, для некоторых минералов и солей значения стандартных термодинамических функций отсутствуют, например, бойлеит ZnSO4·4H2O, эплоуит CoSO4·4H2O, дробекит CdSO4·4H2O, MgSO4·3H2O (Grevel, et al., 2012), MgSO4·9H2O (Fortes et al., 2017), меридианит MgSO4·11H2O, хвалетицеит MnSO4·5H2O, NiSO4·8H2O, NiSO4·9H2O (Fortes et al., 2018), CaSO4·H2O (Kitajima et al., 2021) и др. Отсутствие термодинамических данных для некоторых гидратных сульфатов приводит к их исключению из расчетов, что снижает качество физико-химических моделей рассматриваемых процессов.
Одним из простых и достаточно точных методов оценки физико-химических свойств гидратов является алгоритм аддитивности кристаллизационной воды (Mercury et al., 2001; Hemingway, Robie, 1984; Jenkins, Housecroft, 2017; Jenkins, 2020), в частности один из его вариантов – интерполяция к прямым зависимостям (Grevel et al.,2012; Еремин, Юргенсон, 2001; Еремин и др., 2015).
Целью настоящей работы является получение зависимостей стандартных термодинамических свойств гидратных сульфатов двухвалентных металлов от количества кристаллизационной воды.
МЕТОДИКА РАСЧЕТОВ
В расчетах использовались величины изменений стандартных энергий Гиббса (ΔƒG°) и энтальпий (ΔƒH°) образования, стандартных значений энтропий (S°) при температуре 298.15 K сульфатов двухвалентных металлов (Ca, Mn, Cd, Fe, Zn, Cu, Mg, Ni, Co, Be) по данным справочных изданий (DeKock, 1982; Сидоров, 1999; Ko, Daut, 1979; Наумов и др., 1971; Лидин и др., 2006; Рябин и др., 1977; Еремин, 2004; Wolery, 1988; Yokokawa, 1988; Верятин и др., 1965; Wood, Garrels, 1987; Lemire et al., 2013; Hemingway et al., 2002; Карпов и др., 1968; Gamsjäger et al., 2005; Глушко и др., 1979; Булах, Булах, 1978) и периодических публикаций (Чарыкова, и др., 2009, 2010; Chou, et al., 2012; Mercury et al., 2001; Billon, Vieillard, 2015; Grevel, Majzlan, 2009; Grevel, Majzlan, 2011; Chou, Seal, 2007; Grevel et al., 2012; Hemingway, Robie, 1984; Wagman et al., 1982; DeKock, 1986; Pabalan, Pitzer, 1987; Cox et al., 1955; Harvie et al., 1984; Kobylin, Taskinen, 2012).
Построение интерполяционных прямых. Для гидратных сульфатов двухвалентных металлов (A·xH2O), образование которых можно записать реакцией:
обозначим через F(x) – зависимости величин ΔƒG°, ΔƒH° и S° от количества кристаллизационной воды x в виде интерполяционных прямых для каждого класса A·xH2O:Расчет коэффициентов a и b прямых (2) проводился по методу наименьших квадратов (МНК) в системе MatLab. Графический пример приближения ΔƒH° для сульфатов магния представлен на (рис. 1).
Для большей части рассмотренных гидратов коэффициенты линейной корреляции очень близки к 1 или равны ей в расчетной точности, поэтому в качестве характеристики приближения (2) примем среднее абсолютное отклонение использованных значений от интерполяционной линии:
где F(n) – расчетное значение по уравнению (2), Fn – использованные литературные данные, n – множество интерполяционных точек (стехиометрических гидратов и безводной соли). Результаты расчетов представлены в табл. 1–3.Таблица 1.
Параметры уравнений (2) для ΔƒG° (кДж/моль) при температуре 298.15 K сульфатов двухвалентных металлов, n – число гидратов, включая безводный сульфат, ε – отклонение (3). Значения ΔƒG° для безводных сульфатов взяты из (Yokokawa,1988)
| Катион | n | a, кДж/моль | b, кДж/моль | ε, кДж/моль | Источник |
|---|---|---|---|---|---|
| Ca | 3 | –238.40 | –1320.05 | 1.61 | (Yokokawa,1988) |
| Mn | 4 | –239.66 | –966.90 | 6.19 | (Kobylin, Taskinen,2012) |
| Cd | 3 | –240.51 | –824.78 | 2.12 | (Наумов и др., 1971) |
| Fe | 6 | –239.41 | –835.29 | 3.47 | (Grevel, Majzlan, 2011) |
| Zn | 5 | –240.69 | –882.80 | 6.20 | (Grevel, Majzlan, 2011) |
| Cu | 4 | –242.93 | –668.49 | 4.84 | (Grevel, Majzlan, 2011) |
| Mg | 5 | –241.60 | –1183.39 | 6.77 | (Grevel, Majzlan, 2009) |
| Ni | 3 | –243.53 | –760.27 | 2.19 | (Grevel, Majzlan, 2011) |
| Co | 4 | –240.42 | –792.43 | 5.29 | (Grevel, Majzlan, 2011) |
| Be | 5 | –245.94 | –1096.80 | 2.79 | (Глушко и др., 1979) |
Таблица 2.
Параметры уравнений (2) для ΔƒH° (кДж/моль) при температуре 298.15 K сульфатов двухвалентных металлов, n – число гидратов, включая безводный сульфат, ε – отклонение (3). Значения ΔƒH° для безводных сульфатов взяты из (Yokokawa,1988)
| Катион | n | a, кДж/моль | b, кДж/моль | ε, кДж/моль | Источник |
|---|---|---|---|---|---|
| Ca | 3 | –294.95 | –1432.03 | 1.85 | (Yokokawa,1988) |
| Mn | 4 | –295.17 | –1072.73 | 5.24 | (Kobylin, Taskinen, 2012) |
| Cd | 3 | –298.09 | –936.30 | 3.22 | (Наумов и др., 1971) |
| Fe | 6 | –296.60 | –939.94 | 3.80 | (Hemingway, Seal, Chou, 2002) |
| Zn | 5 | –298.15 | –994.49 | 6.42 | (Grevel, Majzlan, 2011) |
| Cu | 4 | –300.98 | –778.09 | 5.03 | (Yokokawa,1988) |
| Mg | 6 | –298.49 | –1299.55 | 5.36 | (Grevel, Majzlan, 2009; Yokokawa,1988) |
| Ni | 3 | –300.95 | –873.47 | 2.61 | (Grevel, Majzlan, 2011) |
| Co | 4 | –297.91 | –895.60 | 3.82 | (Mercury et al., 2001; Grevel, Majzlan, 2009; Grevel, Majzlan, 2011) |
| Be | 5 | –303.97 | –1207.38 | 2.03 | (Глушко и др., 1979) |
Таблица 3.
Параметры уравнений (2) для S° (Дж/моль K) при температуре 298.15 K сульфатов двухвалентных металлов, n – число гидратов, включая безводный сульфат, ε – отклонение (3). Значения S° для безводных сульфатов взяты из (Yokokawa, 1988)
| Катион | n | a, Дж/моль K | b, Дж/моль K | ε, Дж/моль K | Источник |
|---|---|---|---|---|---|
| Ca | 3 | 43.40 | 107.60 | 0.80 | (Yokokawa,1988) |
| Mn | 4 | 47.12 | 119.06 | 4.57 | (Kobylin P.M., Taskinen P.A., 2012) |
| Cd | 3 | 40.52 | 119.38 | 3.90 | (Наумов и др., 1971) |
| Fe | 6 | 41.39 | 118.32 | 1.72 | (Hemingway et al., 2002) |
| Zn | 5 | 41.01 | 109.08 | 4.67 | (Grevel, Majzlan, 2011) |
| Cu | 4 | 38.26 | 108.09 | 0.96 | (Yokokawa, 1988) |
| Mg | 6 | 41.84 | 89.27 | 4.47 | (Cox et al., 1955; Grevel, Majzlan, 2009; Grevel, Majzlan, 2011; Pabalan, Pitzer, 1987; Yokokawa, 1988; Гуревич и др., 2007) |
| Ni | 3 | 40.79 | 91.71 | 1.36 | (Grevel, Majzlan, 2011) |
| Co | 4 | 40.22 | 126.07 | 4.72 | (Mercury et al., 2001) (Grevel, Majzlan, 2009; Grevel, Majzlan, 2011) |
| Be | 5 | 38.67 | 80.83 | 2.26 | (Глушко и др., 1979) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ ошибок расчетов. Одним из широко используемых методов оценки термодинамических свойств веществ является алгоритм получения аддитивных вкладов химических составляющих посредством вывода уравнений множественной регрессии на основе известных данных (Карпов, Кашик, 1968; Mostafa et al., 1995; Chen et al., 1999; Garofalo et al., 2000; La Iglesia, 2009; Бычинский и др., 2018). Для сравнения ошибок расчетов нами была выбрана работа (Mostafa et al., 1995), в которой получены инкременты термодинамических функций для рассматриваемых соединений.
Используем формулу для относительных ошибок:
(4)
$\delta = 2\left( {{{F}_{L}} - {{F}_{C}}} \right)/\left( {{{F}_{L}} + {{F}_{C}}} \right) \times 100\% ,$Таблица 4.
Сравнение ошибок расчетов термодинамических потенциалов ΔƒH° и ΔƒG° (кДж/моль) при температуре 298.15 K гидратов сульфатов двухвалентных металлов
| Компонент | Химическая формула | ΔƒH°, литер./ источник литературы | ΔƒH°, Мостафа (Mostafa et al., 1995)/δ (4) |
ΔƒH°, уравнение (2)/δ (4) | ΔƒG°, литер./ источник литературы | ΔƒG°, Мостафа (Mostafa et al., 1995)/δ (4) | ΔƒG°, уравнение (2)/δ (4) |
|---|---|---|---|---|---|---|---|
| CaSO4·nH2O | |||||||
| Бассанит-(α) | CaSO4·0.5H2O | –1576.74 (Yokokawa, 1988) | –1485.12/5.98 | –1579.48/–0.17 | –1436.83 (Yokokawa, 1988) | –1349.62/6.26 | –1439.20/–0.16 |
| Сульфат кальция 1-водный | CaSO4·H2O | нет данных | –1634.59/– | –1726.95/– | Нет данных | –1417.78/– | –1558.40/– |
| Гипс | CaSO4·2H2O | –2022.63 (Yokokawa, 1988) | –1933.52/4.50 | –2021.90/0.04 | –1797.44 (Yokokawa, 1988) | –1716.09/4.63 | –1796.80/0.04 |
| Среднее значение |δ| | 5.24 | 0.11 | Среднее значение |δ| | 5.45 | 0.10 | ||
| MnSO4·nH2O | |||||||
| Ссмикит | MnSO4·H2O | –1375.75 (Kobylin, Taskinen, 2012) | –1363.72/0.88 | –1367.96/0.57 | –1216.95 (Kobylin, Taskinen, 2012) | –1206.57/0.86 | –1206.56/0.86 |
| Сульфат марганца 2-водный | MnSO4·2H2O | Нет данных | –1662.65/– | –1662.82/– | Нет данных | –1450.88/– | –1446.22/– |
| Илезит | MnSO4·4H2O | Нет данных | –2260.52/– | –2252.4/– | Нет данных | –1939.52/– | –1925.54/– |
| Джококуит | MnSO4·5H2O | –2551.23 (Kobylin, Taskinen, 2012) | –2559.45/–0.32 | –2547.40/0.15 | –2167.16 (Kobylin, Taskinen, 2012) | –2183.83/–0.77 | –2165.20/0.09 |
| Сульфат марганца 6-водный | MnSO4·6H2O | Нет данных | –2858.38/– | –2842.26/– | Нет данных | –2428.15/– | –2404.86/– |
| Маллардит | MnSO4·7H2O | –3135.92 (Kobylin, Taskinen, 2012) | –3157.32/068 | –3137.12/–0.04 | –2641.59 (Kobylin, Taskinen, 2012) | –2672.47/–1.16 | –2644.52/–0.11 |
| Среднее значение |δ| | 0.63 | 0.25 | Среднее значение |δ| | 0.93 | 0.35 | ||
| CdSO4·nH2O | |||||||
| Сульфат кадмия 1-водный | CdSO4·H2O | –1239.22 (Yokokawa, 1988) | –1243.94/–0.38 | –1234.50/0.38 | –1068.47 (Yokokawa, 1988) | –1073.67/–0.49 | –1065.51/0.28 |
| Сульфат кадмия 8/3-водный | CdSO4·8/3H2O | –1729.40 (Yokokawa, 1988) | –1742.16/–0.74 | –1731.28/–0.11 | –1464.94 (Yokokawa, 1988) | –1480.86/–1.08 | –1466.58/–0.11 |
| Среднее значение |δ| | 0.56 | 0.25 | Среднее значение |δ| | 0.78 | 0.19 | ||
| FeSO4·nH2O | |||||||
| Ссомольнокит | FeSО4·H2O | –1243.69 (Hemingway et al., 2002) |
–1240.16/–0.29 | –1236.53/0.58 | –1081.20 (Hemingway et al., 2002) |
–1082.93/–0.16 | –1074.70/0.60 |
| Роценит | FeSО4·4H2O | –2129.2 (Hemingway et al., 2002) |
–2136.96/–0.50 | –2126.33/0.13 | –1795.20 (Hemingway et al., 2002) |
–1815.88/–1.15 | –1792.93/0.13 |
| Сидеротил | FeSО4·5H2O | –2424.30 (Hemingway et al., 2002) |
–2435.90/–0.53 | –2422.93/0.06 | –2033.90 (Hemingway et al., 2002) |
–2060.20/–1.28 | –2032.34/0.08 |
| Феррогексагидрит | FeSО4·6H2O | –2719.40 (Hemingway et al., 2002) |
–2734.83/–0.56 | –2719.53/–0.01 | –2271.90 (Hemingway et al., 2002) |
–2304.52/–1.43 | –2271.75/0.01 |
| Мелантерит | FeSО4·7H2O | –3012.60 (Hemingway et al., 2002) |
–3033.76/–0.58 | –3016.33/–0.12 | –2507.75 (Hemingway et al., 2002) |
–2548.83/–1.62 | –2511.16/–0.14 |
| Среднее значение |δ| | 0.49 | 0.18 | Среднее значение |δ| | 1.13 | 0.16 | ||
| ZnSO4·nH2O | |||||||
| Ганнингит | ZnSО4·H2O | –1302.39 (Рябин и др., 1977) | –1305.33/–0.23 | –1281.93/1.58 | –1131,99 (Рябин и др., 1977) | –1131.31/0.06 | –1113.60/1.64 |
| Сульфат цинка 2-водный | ZnSО4·2H2O | –1597.10 (Рябин и др., 1977) | –1604.27/–0.45 | –1581.13/1.01 | –1271.18 (Рябин и др., 1977) | –1375.62/–7.89 | –1355.33/–6.41 |
| Бойлеит | ZnSО4·4H2O | Нет данных | –2202.13/– | –2179.53/– | Нет данных | –1864.26/– | –1838.79/– |
| Бианкит | ZnSО4·6H2O | –2780.83 (Рябин и др., 1977) | –2800.00/–0.69 | –2777.93/0.10 | –2325.56 (Рябин и др., 1977) | –2352.89/–1.17 | –2322.25/0.14 |
| Госларит | ZnSО4·7H2O | –3080.60 (Рябин и др., 1977) | –3098.93/–0.59 | –3077.13/0.11 | –2565.59 (Рябин и др., 1977) | –2597.21/–1.22 | –2563.98/0.06 |
| Среднее значение |δ| | 0.49 | 0.70 | Среднее значение |δ| | 2.59 | 2.06 | ||
| CuSO4·nH2O | |||||||
| Пуатвенит | CuSO4·H2O | –1085.83 (Yokokawa, 1988) | –1100.52/–1.34 | –1079.07/0.62 | –918.22 (Yokokawa, 1988) | –933.79/–1.68 | –911.26/0.76 |
| Бонаттит | CuSO4·3H2O | –1684.31 (Yokokawa, 1988) | –1698.38/–0.83 | –1681.03/0.19 | –1400.17 (Yokokawa, 1988) | –1422.42/–1.58 | –1397.02/0.23 |
| Халькантит | CuSO4·5H2O | –2279.65 (Yokokawa, 1988) | –2296.25/–0.73 | –2282.99/–0.15 | –1880.06 (Yokokawa, 1988) | –1911.06/–1.64 | –1882.78/–0.15 |
| Среднее значение |δ| | 0.97 | 0.32 | Среднее значение |δ| | 1.63 | 0.38 | ||
| MgSO4·nH2O | |||||||
| Кизерит | MgSО4·H2О | –1611.50 (Grevel, Majzlan, 2009) |
–1601.20/0.64 | –1598.08/0.84 | –1437.90 (Grevel, Majzlan, 2009) | –1411.78/1.83 | –1425.00/0.90 |
| Сандерит | MgSО4·2H2О | –1894.90 (Grevel, Majzlan, 2009) | –1874.43/1.09 | –1896.56/–0.09 | Нет данных | –1656.09/– | –1666.60/– |
| Сульфат магния 3-водный | MgSО4·3H2О | –2210.30 (Grevel, Majzlan, 2009) | –2173.36/1.69 | –2195.04/0.69 | Нет данных | –1900.41/– | –1908.20/– |
| Старкеит | MgSО4·4H2О | –2496.10 (Grevel, Majzlan, 2009) | –2495.30/0.03 | –2493.52/0.10 | –2153.80 (Grevel, Majzlan, 2009) | –2144.73/0.42 | –2149.80/0.19 |
| Пентагидрит | MgSО4·5H2О | Нет данных | –2771.22/– | –2792.00/– | Нет данных | –2389.05/– | –2391.40/– |
| Гексагидрит | MgSO4·6H2O | –3087.30 (Grevel, Majzlan, 2009) | –3085.40/0.06 | –3090.48/–0.10 | –2632.30 (Grevel, Majzlan, 2009) | –2633.36/–0.04 | –2633.00/–0.03 |
| Эпсомит | MgSO4·7H2O | –3388.70 (Grevel, Majzlan, 2009) | –3369.09/0.58 | –3388.96/–0.01 | –2871.00 (Grevel, Majzlan, 2009) | –2877.68/–0.23 | –2874.60/–0.13 |
| Сульфат магния 9-водный | MgSO4·9H2O | Нет данных | –3966.96/– | –3985.92/– | Нет данных | –3366.31/– | –3357.80/– |
| Меридианит | MgSO4·11H2O | –4579.79 (Chou, Seal, 2007) | –4564.82/0.33 | –4582.88/–0.07 | Нет данных | –3854.95/– | –3841.00/– |
| Среднее значение |δ| | 0.63 | 0.27 | Среднее значение |δ| | 0.63 | 0.31 | ||
| NiSO4·nH2O | |||||||
| Дворникит | NiSO4·H2O | Нет данных | –1205.07/– | –1174.42/– | Нет данных | –1029.01/– | –1003.80/– |
| Никельгексагидрит | NiSO4·6H2O | –2683.10 (Grevel, Majzlan, 2011) |
–2699.73/–0.62 | –2679.17/0.15 | –2224,70 (Grevel, Majzlan, 2011) |
–2260.59/–1.60 | –2221.45/0.15 |
| Ретгерсит | NiSO4·6H2O | Нет данных | –2699.73 | –2679.17/0.15 | Нет данных | –2260.59/– | –2221.45/– |
| Моренозит | NiSO4·7H2O | –2976.77 (Grevel, Majzlan, 2011) |
–2998.67/–0.73 | –2980.12/–0.11 | –2462,20 (Grevel, Majzlan, 2011) |
–2504.91/–1.72 | –2464.98/–0.11 |
| Сульфат никеля 8-водный | NiSO4·8H2O | Нет данных | –3297.60/– | –3281.07/– | Нет данных | –2743.23 | –2708.51/– |
| Среднее значение |δ| | 0.68 | 0.13 | Среднее значение |δ| | 1.66 | 0.13 | ||
| CoSO4·nH2O | |||||||
| Кобальт-кизерит | CoSO4·H2O | –1200.72 (Mercury et al., 2001) | –1189.96/0.90 | –1193.00/0.65 | –1042.95 (Mercury et al.,2001) | –1035.24/0.74 | –1032.85/0.97 |
| Мурхаузит | CoSO4·6H2O | –2683.49 (Mercury et al., 2001) | –2684.63/–0.04 | –2683.05/0.02 | –2235.43 (Mercury et al.,2001) | –2256.82/–0.95 | –2234.95/0.02 |
| Биберит | CoSO4·7H2O | –2979.59 (Mercury et al., 2001) | –2983.56/–0.13 | –2981.06/–0.05 | –2473.50 (Mercury et al.,2001) | –2501.14/–1.11 | –2475.37/–0.08 |
| Среднее значение |δ| | 0.36 | 0.24 | Среднее значение |δ| | 0.94 | 0.36 | ||
| BeSO4·nH2O | |||||||
| Сульфат бериллия 1-водный | BeSO4·H2O | –1511.26 (Глушко и др., 1979) | –1515.96/–0.31 | –1511.37/–0.01 | –1342.97 (Глушко и др., 1979) | –1337.19/0.43 | –1342.89/0.01 |
| Сульфат бериллия 2-водный | BeSO4·2H2O | –1819.20 (Глушко и др., 1979) | –1814.89/0.24 | –1815.34/0.21 | –1594.27 (Глушко и др., 1979) | –1581.51/0.80 | –1588.78/0.34 |
| Сульфат бериллия 3-водный | BeSO4·3H2O | –2120.45 (Глушко и др., 1979) | –2113.82/0.31 | –2119.31/0.05 | –1836.03 (Глушко и др., 1979) | –1825.82/0.56 | –1834.67/0.07 |
| Сульфат бериллия 4-водный | BeSO4·4H2O | –2420.44 (Глушко и др., 1979) | –2412.75/0.32 | –2423.28/–0.12 | –2076.81 (Глушко и др., 1979) | –2070.14/0.32 | –2080.56/–0.18 |
| Среднее значение |δ| | 0.30 | 0.10 | Среднее значение |δ| | 0.53 | 0.15 | ||
Таблица 5.
Сравнение ошибок расчетов термодинамических потенциалов ΔƒH° и ΔƒG° при температуре 298.15 K безводных сульфатов двухвалентных металлов
| Компо-нент | Δƒ${\text{H}}_{{{\text{литер}}}}^{^\circ }$ | Δƒ${\text{H}}_{{{\text{Mostafa}}}}^{^\circ }$ (Mostafaet al., 1995) / δ (4) | Δƒ${\text{H}}_{{{\text{уравнение}}}}^{^\circ }$/δ (4) | Δƒ${\text{G}}_{{{\text{литер}}}}^{^\circ }$ | Δƒ${\text{G}}_{{{\text{Mostafa}}}}^{^\circ }$ (Mostafa, et al., 1995) / δ (4) | Δƒ${\text{G}}_{{{\text{уравнение(2)}}}}^{^\circ }$/δ (4) |
|---|---|---|---|---|---|---|
| CaSО4 | –1434.11 | –1335.65/7.11 | –1432.00/0.15 | –1321.86 | –1227.46/7.41 | –1320.00/0.14 |
| MnSО4 | –1065.25 | –1064.78/0.04 | –1072.70/–0.70 | –957.43 | –962.25/–0.50 | –966.90/–0.98 |
| CdSО4 | –933.28 | –945.01/–1.25 | –936.43/–0.34 | –822.79 | –829.35/–0.79 | –824.87/–0.25 |
| FeSО4 | –932.20 | –941.23/–0.96 | –939.93/–0.83 | –828.30 | –838.61/–1.24 | –835.29/–0.84 |
| ZnSО4 | –982.01 | –1006.40/–2.45 | –994.86/–1.30 | –870.70 | –886.99/–1.85 | –871.87/–0.13 |
| CuSО4 | –771.36 | –801.58/–3.84 | –778.09/–0.87 | –661.90 | –689.47/–4.08 | –668.49/–0.99 |
| MgSО4 | –1284.90 | –1276.56/0.65 | –1299.60/–1.14 | –1170.70 | –1167.46/0.28 | –1183.40/–1.08 |
| NiSО4 | –872.91 | –906.14/–3.74 | –873.47/–0.06 | –759.80 | –794.69/–4.49 | –760.27/–0.06 |
| CoSО4 | –889.35 | –891.03/–0.19 | –888.53/0.09 | –783.71 | –790.92/–0.92 | –782.68/0.13 |
| BeSО4 | –1205.20 | –1217.02/–0.98 | –1207.40/–0.18 | –1093.87 | –1092.87/0.09 | –1087.00/0.63 |
| Среднее значение |δ| | 2.12 | 0.57 | Среднее значение |δ| | 2.16 | 0.52 | |
| |δ| общая (табл. 4,5) | 1.13 | 0.28 | |δ| общая (табл. 4,5) | 1.67 | 0.43 | |
Из таблиц 4 и 5 видно, что расчеты по уравнениям (2) характеризуются более высокой точностью для всех классов гидратов A⋅xH2O, за исключением оценок ΔƒG° для сульфатов цинка. Отметим достаточно большие погрешности оценок в методе (Mostafa et al., 1995) для соединений кальция.
Термодинамические свойства кристаллизационной воды, полученные из корреляционных методов, имеют конкретные фиксированные значения. Так, в работе (Mostafa et al., 1995) величины ΔƒH°(H2Ocryst) и ΔƒG°(H2Ocryst) равны ‒298.933 и –244.317 кДж/моль соответственно, а Jenkins (Jenkins et al., 2017; Jenkins, 2020) получают и используют в расчетах значения –298.6 и ‒242.4 кДж/моль. В отличие от корреляционных методов, уравнения (2) дают свойства кристаллизационной воды различные для каждого семейства A·xH2O гидратов.
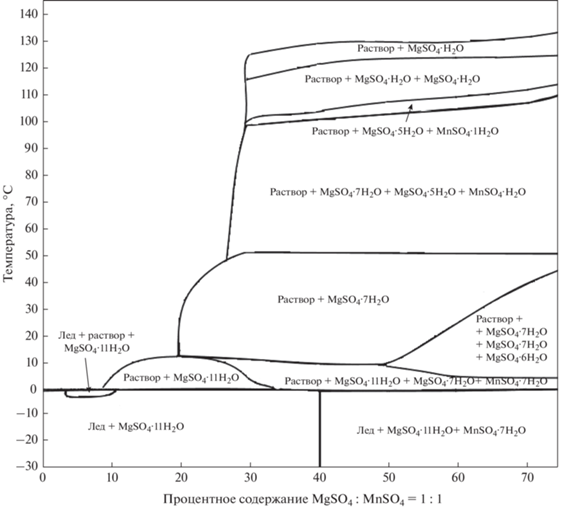
Корреляция свойств кристаллизационной воды с радиусами катионов. Согласно уравнению (2) коэффициенты наклона прямых a представляют соответствующие термодинамические свойства кристаллизационной воды для семейств MeSO4·nH2O гидратов. Построим корреляционные прямые связи коэффициентов a и радиусов двухвалентных катионов с координационным числом 6, чаще встречающимся среди множества сульфатных солей, используя данные работы (Gebhardt et al., 2019). Результаты представлены на рисунках 2–4. На этих рисунках вертикальными отрезками для каждого катиона обозначены величины 2ε (3), представляющие максимальные интервалы ошибок приближений (2) а также отмечены параллельными оси абсцисс линиями значения термодинамических функций для жидкой воды и льда-I по (Mercury et al., 2001). Использованные значения радиусов катионов приведены в табл. 6.
Рис. 2.
Корреляционная прямая коэффициентов а (2) для ΔƒG°(H2Ocryst) с радиусами двухвалентных катионов с координационным числом 6 по (Gebhardt, Rappe, 2019).
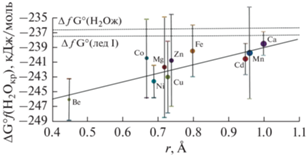
Рис. 3.
Корреляционная прямая коэффициентов а (2) для ΔƒH°(H2Ocryst) с радиусами двухвалентных катионов с координационным числом 6 по (Gebhardt, Rappe, 2019).
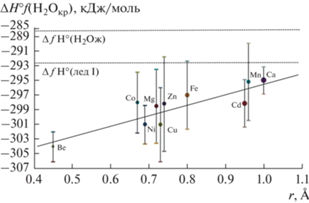
Рис. 4.
Корреляционная прямая коэффициентов а (2) для S°(H2Ocryst) с радиусами двухвалентных катионов с координационным числом 6 по (Gebhardt, Rappe, 2019).
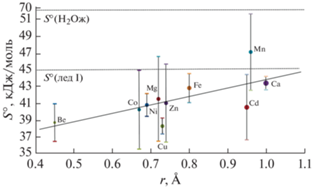
Таблица 6.
Радиусы двухвалентных катионов с координационным числом 6 по данным работы (Gebhardt, Rappe, 2019)
| Химический элемент | Радиус катиона Me2+, Å |
|---|---|
| Be | 0.45 |
| Co | 0.68 |
| Ni | 0.69 |
| Mg | 0.72 |
| Cu | 0.73 |
| Zn | 0.74 |
| Fe | 0.78 |
| Cd | 0.95 |
| Mn | 0.96 |
| Ca | 1.00 |
| Sr | 1.18 |
| Pb | 1.19 |
| Ba | 1.35 |
Отметим, что минимальные значения термодинамических величин кристаллизационной воды (рис. 2–4) характерны для сульфатов бериллия (за исключением S°(H2Ocryst) для CuSO4·nH2O), обладающим наименьшим радиусом катиона среди множества рассмотренных гидратов.
Известно, что при стандартных условиях не существует гидратов сульфатов свинца, стронция и бария. Если провести экстраполяцию прямой (рис. 2) для радиусов катионов этих металлов (табл. 6), то потенциалы Гиббса кристаллизационной воды окажутся выше линий жидкой воды и льда, что свидетельствует об энергетической невозможности образования соответствующих гидратов.
Расчеты фазовых равновесий в ПК “Селектор”. В ПК “Селектор” для расчета термодинамических равновесий используется метод минимизации энергии Гиббса систем, включающих твердые фазы, водные растворы и газы при заданных T, P-условиях (Чудненко, 2010). Термодинамические характеристики компонентов водных растворов рассчитываются с использованием уравнения Хельгесона–Киркхема–Флауэрса (HKF) (Helgeson et al., 1981).
Используя полученные данные (табл. 1–3), были оценены отсутствующие в литературе значения стандартных термодинамических функций некоторых гидратов (табл. 7). В крайнем правом столбце таблицы приведены значения абсолютных энтропий, полученные из расчетных ΔƒG° и ΔƒH° (2) по уравнению согласования в базах данных ПК “Селектор” (Чудненко, 2010):
(5)
${{\Delta }_{f}}G^\circ = {{\Delta }_{f}}H^\circ - T\left( {S_{T}^{^\circ } - {{L}_{T}}} \right),$Таблица 7.
Значения стандартных термодинамических функций, рассчитанные по уравнениям (2) (табл. 1–3) и стандартной энтропии по уравнению согласования ПК “Селектор” (5)
| Соединение (минерал) | ΔƒG°, кДж/моль | ΔƒH°, кДж/моль | S°, Дж/моль K | S°, Дж/моль K (5) |
|---|---|---|---|---|
| CaSO4·H2O | –1558.44 | –1726.99 | 151.60 | 151.91 |
| MnSO4·6H2O (хвалетицеит) | –2404.84 | –2843.76 | 401.77 | 401.76 |
| MnSO4·4H2O | –1925.53 | –2253.42 | 307.53 | 307.65 |
| MnSO4·2H2O | –1446.21 | –1663.07 | 213.30 | 213.53 |
| CdSO4·4H2O (дробекит) | –1786.82 | –2128.67 | 281.46 | 280.61 |
| ZnSO4·4H2O (бойлеит) | –1845.55 | –2187.11 | 273.14 | 271.42 |
| MgSO4·3H2O | –1908.18 | –2195.01 | 214.79 | 212.79 |
| MgSO4·9H2O | –3357.76 | –3985.91 | 465.82 | 467.50 |
| NiSO4·8H2O | –2708.51 | –3281.08 | 418.03 | 417.87 |
| NiSO4·9H2O | –2952.04 | –3582.03 | 458.82 | 458.54 |
| CoSO4·4H2O (эплоуит) | –1754.10 | –2086.93 | 286.96 | 289.14 |
Из табл. 7 можно видеть, что значения стандартных энтропий, рассчитанных по интерполяционному уравнению (2) и уравнению (5), достаточно близки, что свидетельствует о хорошем качестве приближений (2).
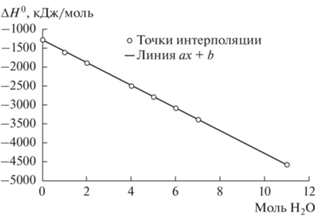
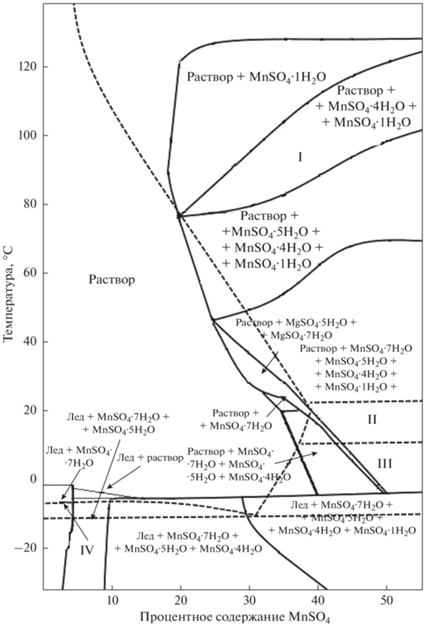
Полученное в настоящей работе множество термодинамических свойств гидратных сульфатов было внесено в базу данных ПК “Селектор” и проведены расчеты равновесий для систем MeSO4–H2O, где Me = (Ca, Mn, Cd, Fe, Zn, Cu, Mg, Ni, Co, Be) при атмосферном давлении и переменных температуре (–30…+150°С) и массовом содержании солей. Построение моделей проводилось в приближении ${\text{C}}_{{\text{p}}}^{^\circ }$(298) = Const (Чудненко, 2010). Проведенные расчеты показали хорошее согласование с экспериментальными диаграммами растворимости (Киргинцев и др., 1972; Vielma, 2021; Maet al., 2021). В случаях, когда в системах MeSO4–H2O присутствуют гидраты, не рассмотренные в экспериментальных или расчетных данных, появляются дополнительные области их устойчивости. На рисунках 5, 6 приведены примеры сравнения таких диаграмм. При построении расчетных диаграмм учитывались твердые фазы количеством более 1 мг в 1 литре раствора. Так для системы MgSO4–H2O (рис. 5) можно видеть, что расчетные равновесные составы кристаллогидратов отличаются от опубликованных присутствием 3- и 5-водных гидратов и отсутствием 4-х и 6-водных твердых фаз. Для MnSO4–H2O системы (рис. 6) в расчетных состояниях появляется 4-х водный сульфат.
Рис. 5.
Фазовая диаграмма системы MgSO4–H2O, построенная с использованием расчетов равновесий в ПК “Селектор” данных настоящей работы (сплошные линии) в сравнении с (Chou, Seal, 2007) (пунктирные линии и области, обозначенные римскими цифрами). Очередность написания минералов указана в соответствии с их процентным содержанием в системе от большего к меньшему. I – liquid + MgSO4·H2O; II – liquid + MgSO4·6H2O; III – liquid + MgSO4·7H2O; IV – MgSO4·6H2O + MgSO4·7H2O; V – MgSO4·6H2O + MgSO4·H2O; VI – MgSO4·7H2O + MgSO4·H2O; VII – M-gSO4·11H2O + MgSO4·7H2O; VIII – MgSO4·11H2O + ice; IX – liquid + MgSO4·11H2O; X – liquid + ice.
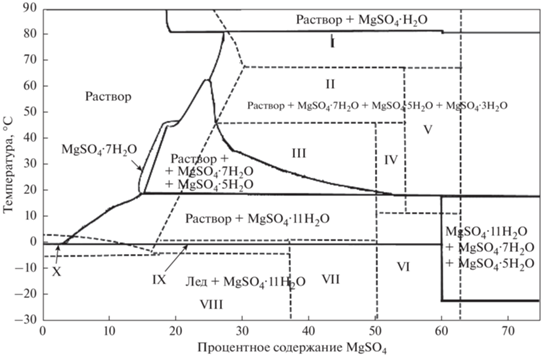
Рис. 6.
Фазовая диаграмма системы MnSO4–H2O, построенная с использованием расчетов равновесий в ПК “Селектор” данных настоящей работы (сплошные линии) в сравнении с (Kobylin, Taskinen, 2012) (пунктирные линии и области, обозначенные римскими цифрами). Очередность написания минералов указана в соответствии с их процентным содержанием в системе от большего к меньшему. I – liquid + MnSO4·H2O; II – liquid + MnSO4·5H2O; III – liquid + MnSO4·7H2O; IV – liquid + ice.
Пример расчета потенциальных условий разделения сульфатных растворов марганца и магния при переменной температурной кристаллизации
В металлургическом процессе переработки низкосортных марганцевых руд, получаемые растворы сульфата марганца обычно содержат некоторые количества магния, что негативно влияет на последующее извлечение марганца (Zhang, Cheng, 2007). Как правило, достаточно трудно удалить катионы магния из сульфатных растворов ввиду схожести некоторых химических свойств с Mn. К настоящему времени существуют три метода очистки – химическое осаждение (Lin et al., 2016), экстракция растворителями (Wang et al., 2019) и переменная температурная кристаллизация. Каждый имеет свои преимущества и недостатки. Кристаллизация при переменной температуре растворов проста и удобна в исполнении, однако, сложности заключаются в образовании смешанных солей сульфатов марганца и магния (Ding et al., 2021).
Рассчитаем в ПК “Селектор” равновесные состояния сульфатного раствора смеси солей MnSO4 и MgSO4 в соотношении 1 : 1 по массе при атмосферном давлении и переменных температуре и количестве солей (рис. 7). Из расчетной фазовой диаграммы видно, что при общем содержании солей в растворе до 35% возможно отделение сульфата магния при охлаждении (вымораживании). Также интересен интервал температур от 15 до 50°C, при котором при значительных концентрациях сульфатов в осадок выпадает только MgSO4·7H2O. Подобным образом можно расчетным путем определять потенциальные условия для разделения солей металлов в сульфатных растворах.
ЗАКЛЮЧЕНИЕ
Полученные линейные зависимости стандартных термодинамических свойств гидратных сульфатов двухвалентных металлов от количества кристаллизационной воды позволяют проводить расчеты неизвестных характеристик гидратов. В отличие от корреляционных методов, которые дают фиксированные значения термодинамических свойств кристаллизационной воды для всего множества гидратов, рассмотренный подход уточняет эти зависимости для каждого семейства MeSO4⋅nH2O. Выявлена связь термодинамических свойств рассмотренных гидратов с размерами радиусов катионов, которая проявляется в большей упорядоченности и энергетической выгодности кристаллизационной воды для меньших их радиусов. Полученные согласованные значения термодинамических свойств внесены в базу данных ПК “Селектор” и могут быть использованы в геохимических расчетах.
Работа поддержана РНФ (проект 22-27-00281).
Список литературы
Белогуб Е.В., Щербакова Е.П., Никандрова Н.К. (2007) Сульфаты Урала: распространенность, кристаллохимия, генезис. М.: Наука, 160 с.
Булах А.Г., Булах К.Г. (1978) Физико-химические свойства минералов и компонентов гидротермальных растворов. Л.: Недра, 143 с.
Бычинский В.А., Королева О.Н., Ощепкова А.В., Штенберг М.В. (2018) Способ определения термодинамических свойств веществ для изучения природных и технологических процессов методами физико-химического моделирования. Изв. Томского политехнического университета. Инжиниринг георесурсов. 329(5), 48-56.
Верятин У.Д., Маширев В.П., Рябцев Н.Г., Тарасов В.И., Рогожин Б.Д., Коробов И.В. (1965) Термодинамические свойства неорганических веществ. Атомиздат, 460 с.
Гуревич В.М., Кусков О.Л., Гавричев К.С., Тюрин А.В. (2007) Теплоемкость и термодинамические функции эпсомита MgSO4 · 7H2O(к) в области 0–330 K. Геохимия. 2, 237-240.
Gurevich V.M., Kuskov O.L., Gavrichev K.S., Tyurin A.V. Heat capacity and thermodynamic functions of epsomite MgSO4 7H2O at 0–303 K. Geochem. Int. 2007. 45(2), 206-209.
Глушко В.П., Медведев В.А., Бергман Г.А., Гурвич Л.В., Юнгман В.С., Алексеев В.И., Колесов В.П., Васильев В.П., Резницкий Л.А., Ходаковский И.Л., Воробьев А.Ф., Смирнова Н.Л., Гальченко Г.Л., Бирюков Б.П., Иоффе Н.Т. (1979). Термические константы веществ. Справочник в десяти выпусках. Выпуск IX. М. ВИНИТИ. 573 с.
Елохина С.Н., Рыженко Б.Н. (2014) Вторичное минералообразование в природно-техногенных гидрогеологических системах колчеданных месторождений. Моделирование образования фазы (Fe, Mg)SO4 · 7H2O при окислении сульфидов Дегтярского медно-колчеданного месторождения. Геохимия. (2), 178-192.
Elokhina S.N., Ryzhenko B.N. (2014) Secondary mineral-forming processes in natural-anthropogenic hydrogeological systems at sulfide deposits. Simulation of the origin of the phase (Fe,Mg)SO4 · 7H2O in the course of sulfide oxidation at the Degtyarka copper sulfide deposit. Geochem. Int. (2), 162-177.
Еремин О.В., (2004) Криоминералогенез в зоне окисления Удоканского месторождения. Диссертация канд. геол.-мин. наук. Чита, 102 с.
Еремин О.В., Русаль О.С., Бычинский В.А., Чудненко К.В., Фомичев С.В., Кренев В.А. (2015) Расчет стандартных термодинамических потенциалов сульфатов и гидроксосульфатов алюминия. Журн. неорганической химии. 60(8), 1048-1055.
Еремин О.В., Юргенсон Г.А. (2001) Термодинамические модели окисления сульфидных руд зоны криоминералогенеза как задачи линейного программирования (Удоканское месторождение). Изв. высших учебных заведений. Геология и разведка. 6, 153-156.
Карпов И.К., Кашик С.А., Пампура В.Д. (1968) Константы веществ для термодинамических расчетов в геохимии и петрологии. М: Наука, 144 с.
Карпов И.К., Кашик С.А. (1968) Расчет ЭВМ стандартных изобарно-изотермических потенциалов методом множественной регрессии на основе кристаллохимической классификации. Геохимия. (7), 806-814.
Киргинцев А.Н., Трушникова Л.Н., Лаврентьев В.Г. (1972) Растворимость неорганических веществ в воде. Л.: Химия, 248 с.
Лидин Р.А., Андреева Л.Л., Молочко В.А. (2006) Константы неорганических веществ. Справочник. 2-е изд., перераб. и доп. М.: Дрофа, 685 с.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. (1971) Справочник термодинамических величин: для геологов. М.: Атомиздат, 240 с.
Рябин В.А., Остроумов М.А., Свит Т.Ф. (1977) Термодинамические свойства веществ. Справочник. Л.: Химия, 339 с.
Сидоров Ю.И. (1999) Термодинамический анализ эволюции вещества в допланетном облаке и внешних оболочках Венеры и Марса. Дис. … докт. геол.-мин. наук. М., 335 с.
Чарыкова М.В., Кривовичев В.Г., Депмайер В. (2009) Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. I. Термодинамические константы при стандартных условиях. Записки Российского Минералогического Общества. 138(6), 105-117.
Чарыкова М.В., Кривовичев В.Г., Депмайер В. (2010) Термодинамика арсенатов, селенитов и сульфатов в зоне окисления сульфидных руд. II. Системы М1, ${{{\text{M}}}_{{\text{2}}}}{\text{//SO}}_{{\text{4}}}^{{2 - }}$–H2O (М1, M2 = Fe2+, Fe3+, Cu2+, Zn2+, Pb2+, Ni2+, Co2+, H+) при 25°С. Записки Российского Минералогического Общества. 139(1), 3-18.
Чудненко К.В. (2010) Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Академическое изд-во Гео, 176 с.
Яхонтова Л.К., Зверева В.П. (2007) Минералы зоны гипергенеза. Владивосток: Дальнаука, 331 с.
Billon S., Vieillard P. (2015) Prediction of enthalpies of formation of hydrous sulfates. Am. Mineral. 100, 615-627.
Chen F., Ewing R.C., Clark S.B. (1999) The Gibbs free energies and enthalpies of formation of U6+ phases: An empirical method of prediction. Am. Mineral. 84, 650-664.
Chou I.-M., Seal R.R. II. (2007) Magnesium and calcium sulfate stabilities and the water budget of Mars. J. Geophys. Res.112 (E11004), 10.
Chou I.-M., Seal R.R. II, Wang A. (2012) The stability of sulfate and hydrated sulfate minerals near ambient conditions and their significance in environmental and planetary sciences. J. Asian Earth Sciences. 62, 734-758.
Cox W.P., Hornung E.W., Giauque W.F. (1955) The spontaneous transformation from macrocrystalline to microcrystalline phases at low temperatures. The heat capacity of MgSO4 · 6H2O. J. Am. Chem. Soc. 77, 3935-3938.
DeKock C.W. (1986) Thermodynamic properties of selected metal sulfates and their hydrates. U.S. Bur. Mines Inf. Circ. 9081, 59.
DeKock, C.W. (1982) Thermodynamic properties of selected transition metal sulphates and their hydrates. U.S. Bur. Mines Inf. Circ. 8910, 45.
Ding M., Zhang Y., Ren Y. (2021) Solid–Liquid Phase Equilibrium of MnSO4–MgSO4–H2O and (NH4)2SO4–MnSO4–MgSO4–H2O Systems at T = 303.15 K. J. Chem. Eng. 66(1).
D’Orazio M., Mauro D., Valerio M., Biagioni C. (2021) Secondary Sulfates from the Monte Arsiccio Mine (Apuan Alps, Tuscany, Italy): Trace-Element Budget and Role in the Formation of Acid Mine Drainage. Minerals. 11, 206.
Fortes A.D., Browning F., Wood I.G. (2012) Cation substitution in synthetic meridianiite (MgSO4·11H2O) I: X-ray powder diffraction analysis of quenched olycrystalline aggregates. Phys. Chem. Minerals. 39, 419-441.
Fortes A.D., Knight K.S., Gibbs A.S., Wood I.G. (2018) Crystal structures of NiSO4 · 9H2O and NiSO4·8H2O: magnetic properties, stability with respect to morenosite (NiSO4·7H2O), the solid-solution series (MgxNi1 –x)SO4 · 9H2O. Phys. Chem. Miner. 45(8), 695-712.
Fortes A.D., Knight K.S., Wood I.G (2017) Structure, thermal expansion and incompressibility of MgSO4 · 9H2O, its relationship to meridianiite (MgSO4 · 11H2O) and possible natural occurrences. Acta Crystallogr., Sect. B: Struct. Sci. 73(1), 47-64.
Gamsjäger H., Bugajski J., Gajda T., Lemire R., Preis W. (2005) In: Mompean F.J., Illemassène M. (Eds.) Chemical Thermodynamics Vol. 6. Nuclear Energy Agency Data Bank, Organisation for Economic Co-operation and Development, North Holland Elsevier Science Publishers B.V., Amsterdam, The Netherlands.
Garofalo P., Audetat A., Gunther D., Heinrich C.A., Ridley J. (2000) Estimation and testing of standard molar thermodynamic properties of tourmaline end-members using data of natural samples. Am. Mineral. 85, 78-88.
Gebhardt J., Rappe A.M. (2019) Big data approach for effective ionic radii. Computer Physics Communications. 237, 238-243.
Grevel K.-D., Majzlan J. (2009) Internally consistent thermodynamic data for magnesium sulphate hydrates. Geochim. Cosmochim. Acta. 73, 6805-6815.
Grevel K.-D., Majzlan J. (2011) Internally consistent thermodynamic data for metal divalent sulphate hydrates. Chem. Geol. 286, 301-306.
Grevel K-D., Majzlan J., Benisek A., Dachs E., Steiger M., Fortes A.D., Marler B. (2012) Experimentally determined standard properties for synthetic MgSO4 ∙ 4H2O (starkeyite) and MgSO4 ∙ 3H2O; a revised internally consistent thermodynamic dataset for magnesium sulfate hydrates. Astrobiology. 12, 1042-1054.
Hazen R.M., Ausubel J.H. (2016) On the nature and significance of rarity in mineralogy. Am. Mineral. 101, 1245-1251.
Harvie C.E., Moller N.M., Weare J.H. (1984) The prediction of mineral solubilities in natural waters: Na–K–Mg–Ca–H–Cl–SO4–OH–HCO3–CO3–CO2–H2O system to high ionic strengths at 25°C. GCA. 48, 723-751.
Hemingway B.S., Robie R.A. (1984) Thermodynamic properties of zeolites: low-temperature heat capacities and thermodynamic functions for phillipsite and clinoptilolite. Estimates for the thermochemical properties of zeolitic water at low temperature. Am. Mineral. 69, 692-700.
Helgeson H.C., Kirkham D.H., Flowers G.C. (1981) Theoretical prediction of the thermodynamic behavior of aqueous electrolytes at high pressures and temperatures: IV. Calculation of activity coefficients, osmotic coefficients, and apparent molal and standard and relative partial molal properties to 600°C and 5 kb. Amer. J. Sci. 281, 1249-1516.
Hemingway B.S., Seal R.R., II, Chou I.-M. (2002) Thermodynamic data for modeling acid mine drainage problems: compilation and estimation of data for selected soluble iron-sulfate minerals. Open-File Report 02-161.
Jambor J.L., Nordstrom D.K., Alpers C.N. (2000) Metal-sulfate Salts from Sulfide Mineral Oxidation. Sulfate Minerals. Rev. Miner. Geochem. 40, 303-350.
Jenkins H.D.B. (2020) Expanding thermodynamic databases using the thermodynamic difference rule (TDR). Exemplified by an application to retrieve new thermodynamic data for thorium compounds. J. Chem. Thermodynamics. 144, 106052.
Jenkins H.D.B., Housecroft C.E. (2017) The thermodynamics of uranium salts and their hydrates – Estimating thermodynamic properties for nuclear and other actinoid materials using the Thermodynamic Difference Rule (TDR). J. Chem. Thermodynamics. 114, 116-121.
Kitajima T., Fukushi K., Yoda M., Takeichi Y., Takahashi Y. (2021) Simple, Reproducible Synthesis of Pure Monohydrocalcite with Low Mg Content. Minerals. 10, 346.
Ko H.C., Daut G.E. (1979) Enthalpies of formation of a- and b-magnesium sulfate and magnesium sulfate monohydrate. U.S. Bur. Mines Rpt. Invest. 8409, 8.
Kobylin P.M., Taskinen P.A. (2012) Thermodynamic modelling of aqueous Mn(II) sulfate solutions. Calphad. 38, 146-154.
La Iglesia A. (2009) Estimating the thermodynamic properties of phosphate minerals at high and low temperature from the sum of constituent units. Estud. Geol. 65, 109-119.
Lemire R.J., Berner U., Musikas C. et al. (2013) Chemical thermodynamics of iron. OECD Publications. 13a(1).
Lin Q., Gu G., Wang H., Wang C., Liu Y., Zhu R., Fu J. (2016) Separation of manganese from calcium and magnesium in sulfate solutions via carbonate precipitation. Trans. Nonferrous Met. Soc. China. 26, 1118-1125.
Ma Y., Svärd M., Xiao X., Sahadevan S.A., Gardner J., Olsson R.T., Forsberg K. (2021) Eutectic freeze crystallization for recovery of NiSO4 and CoSO4 hydrates from sulfate solutions. Separation and Purification Technology, https://doi.org/10.1016/j.seppur.2021.120308
Mercury L., Vieillard Ph., Tardy Y. (2001) Thermodynamics of ice polymorphs and “ice-like” water in hydrates and hydroxides. Appl. Geochem. 16, 161-181.
Mostafa A.T.M.G., Eakman J.M., Yarbo S.L. (1995) Prediction of Standart Heats and Gibbs Free Energies of Formation of Solid Inorganic Salts from Group Contributions. Ind. Eng. Chem. Res. 34, 4577-4582.
Pabalan R.T., Pitzer K.S. (1987) Thermodynamics of concentrated electrolyte mixtures and the prediction of mineral solubilities to high temperatures for mixtures in the system Na–K–Mg–Cl–SO4–OH–H2O. Geochim. Cosmochim. Acta. 51, 2429-2443.
Peterson R.C., Nelson W., Madu B., Shurvell H.F. (2007) Meridianiite (MgSO4 · 11H2O): a new mineral species observed on Earth and predicted to exist on Mars. American Min. 92(10), 1756-1759.
Pfitzner K.S., Harford A.J., Whiteside T.G., Bartolo R.E. (2018) Mapping magnesium sulfate salts from saline mine discharge with airborne hyperspectral data. Sci. Total Environ. 640-641, 1259-1271.
Vielma T. (2021) Thermodynamic model for CoSO4(aq) and the related solid hydrates in the temperature range from 270 to 374 K and at atmospheric pressure. Calphad. 72, 102 230.
Wagman D.D., Evans W.H., Parker V.B., Schumm R.H., Halow I., Bailey S.M., Churney K.L., Nuttall R.L. (1982) The NBS tables of chemical thermodynamic properties. Selected values for inorganic and C1 and C2 organic substances in SI units. J. Phys. Chem. Ref. Data. 11. Suppl. 2, 371.
Wang Y., Zeng L., Zhang G., Guan W., Sun Z., Zhang D., Qing J. (2019) A novel process on separation of manganese from calcium and magnesium using synergistic solvent extraction system. Hydrometallurgy. 185, 55-60.
Wolery T.J. (1988) EQ3NR, a computer program for geochemical aqueous speciation solubility calculations: user’s guide and documentation. Livermore, CA: Lawrence Livermore Nat. Lab.
Wood T.L., Garrels R.M. (1987) Thermodynamic values at low temperature for natural inorganic materials. Oxford University Press, 265 p.
Xiao T., Mu W., Shi S., Xin X., Xu X., Cheng H., Luo S., Zhai Y. (2021) Simultaneous extraction of nickel, copper, and cobalt from low–grade nickel matte by oxidative sulfation roasting-water leaching process. Minerals Engineering. 174, 107254.
Yokokawa H. (1988) Tables of thermodynamic properties of inorganic compounds. J. national chemical laboratory for industry. 83, 27-118.
Zhang M., Wu P., Li Y., Li W., Zhou H. (2021) Phase Equilibria and Phase Diagrams of the Mn2+, Mg2+, ${\text{NH}}_{4}^{ + }{\text{//SO}}_{4}^{{2 - }}$–H2O System at 298.15, 323.15, and 373.15 K. J. Chem. Eng. Data.
Zhang W, Cheng C.Y. (2007) Manganese metallurgy review. Part II: Manganese separation and recovery from solution. Hydrometallurgy. 89, 160-177.
Дополнительные материалы отсутствуют.