Геохимия, 2022, T. 67, № 11, стр. 1072-1088
Механизмы дегазации кимберлитовой магмы на начальном этапе ее подъема: по экспериментальным данным при 5.5 и 3.0 ГПа
А. Н. Крук a, *, А. Г. Сокол a, **
a Институт геологии и минералогии им. В.С. Соболева Сибирского отделения Российской Академии наук
630090 Новосибирск, пр-т. ак. Коптюга, 3, Россия
* E-mail: krukan@igm.nsc.ru
** E-mail: sokola@igm.nsc.ru
Поступила в редакцию 09.03.2022
После доработки 07.06.2022
Принята к публикации 10.06.2022
- EDN: NUHXSR
- DOI: 10.31857/S0016752522110061
Аннотация
Механизмы дегазации кимберлитовой магмы впервые экспериментально исследованы с использованием кимберлитоподобных расплавов, которые образуются за счет растворения гранатового лерцолита в модельных богатых CO2 и H2O карбонатных расплавах при 3.0 и 5.5 ГПа и диапазоне температур 1200–1350°С. В изученных системах при 3.0 ГПа и 1200°С степени плавления изученных систем варьируют от 30 до 68 мас. %. В системах с добавкой 9 мас. % CO2 и 2.5 мас. % H2O в виде щавелевой кислоты стабильны асcоциации Ol-Opx-Cpx-Phl(?)-Mgs-L (система Lc(лерцолит)-B10(астеносферный карбонатный расплав)–CO2–H2O) или Ol-Opx-Phl(?)-Mgs-L (система Lc–GS(субдукционный карбонатный расплав)-CO2-H2O). Флогопит в ассоциациях может иметь закалочную природу. В системах с добавкой 21 мас. % CO2 и 6 мас. % H2O в образцах стабильна асcоциация Opx-Cpx-Mgs-L или Opx-Mgs-L. При 3.0 ГПа и 1350°С гранатовый лерцолит практически полностью растворяется, стабильными остаются Opx-L или только расплав. По оценкам растворимость молекулярного CO2 в карбонатно-силикатных расплавах при 3.0 ГПа снижается с 14–23 мас. % до <10 мас. % со снижением температуры с 1350 до 1200°С. Эксперименты, выполненные по специально разработанной двухстадийной схеме, воспроизводящей быстрый подъем магмы с уровней 5.5 до 3.0 ГПа с падением температуры с 1350 до 1270°С, позволили добиться “вскипания” образцов. Основным фактором выделения CO2 флюида является реакция магнезита с расплавом без образования оливина: Mgs + L1= = L2+ Fl, где L2 обогащен MgO и обеднен SiO2 в сравнении с L1. Ортопироксен остается стабилен. Таким образом, захват и/или образование магнезита в ксеногенном материале, транспортируемом магмой, может создавать предпосылки для ее вскипания при подъеме с 5.5 ГПа до рубежа 3.0 ГПа и снижения температуры с 1350 до 1270°С.
ВВЕДЕНИЕ
Кимберлитовый магматизм – уникальное явление, связанное с выбросом глубинных магм на поверхность кратонов. Его отличительной особенностью является стремительный (длительностью от нескольких часов до нескольких дней) подъем магмы от уровня основания субкратонной литосферы до поверхности (Pearson et al., 1997; Kelley, Wartho, 2000; Peslier et al., 2008). Согласно расчетам, такие скорости подъема могли достигаться лишь в том случае, если на фронте движения магмы происходила нуклеация и рост пузырьков CO2. Они инициировали развитие системы трещин в породном массиве на фронте движения магмы, облегчая, тем самым, продвижение расплава (Lensky et al., 2006; Maimon et al., 2013). Образование CO2 флюида при “кипении” магмы было возможно лишь в случае ее пересыщения молекулярным CO2.
Традиционно считается, что причиной “вскипания” магмы может служить реакция инконгруэнтного растворения ортопироксена в кимберлитовом расплаве, обеспечивающая возможность образования макрокристов оливина и растворения SiO2 в расплаве и выделение CO2 (Le Roex et al., 2003; Kopylova et al., 2007; Mitchell, 2008; Luth-, 2009; Russell et al., 2012; Kamenetsky, Yaxley, 2015; Stone, Luth, 2016). В работах (Wyllie, 1975; Wyllie, Huang, 1975) в качестве тригера выделения CO2 флюида рассматривали реакцию декарбонатизации магмы и/или карбонатов при снижении давления до 2–3 ГПа. Согласно расчетам (Luth, 2009), предельное давление протекания таких реакций зависит от содержания CO2, температуры и активности SiO2. Так, при 1500°С и активности SiO2, буферируемой парой оливина и ортопироксена, магнезит остается стабильным до давления 4 ГПа. Магнезит может разлагаться с выделением CO2 флюида по реакции Mgs + En = Fo + Fl (Boyd, Gurney, 1982; Wyllie et al., 1983; Canil, 1990), что требует его контакта с ортопироксеном, либо по реакции Mgs + L = Fo + Fl – при взаимодействии непосредственно с кимберлитовым расплавом (Luth, 2009). Эксперименты (Russell et al., 2012; Kamenetsky, Yaxley, 2015) продемонстрировали, что в широком диапазоне давлений (от мантийных до 1 атм.) свободный CO2 флюид может образовываться за счет растворения ортопироксена в модельном Na2CO3 расплаве. Однако, данные (Sharygin et al., 2017) это не подтверждают. При растворении ортопироксена в доломитовом расплаве с примесью щелочей концентрация SiO2 в расплаве растет, но вскипания карбонатного расплава не происходит.
Другим механизмом насыщения кимберлитового расплава молекулярным CO2 может быть падение его растворимости при снижении давления и температуры (Girnis, Ryabchikov, 2005; Lensky et al., 2006). На сегодня количественные данные по растворимости CO2 в карбонатных и карбонатно-силикатных расплавах практически отсутствуют. В работе (Girnis et al., 2011) сообщается, что растворимость CO2 в кимберлитовом расплаве увеличивается почти линейно с давлением от ~10 мас. % при 4 ГПа до ~32 мас. % 7–8 ГПа. При этом расплавы с ~20 мас. % СО2 становятся СО2-насыщенными при 5–6 ГПа. В работе (Palyanov et al., 2016) было показано, что 16 мас. % CO2, образовавшиеся в результате разложения оксалата натрия (Na2C2O4) при 6.3 ГПa и 1400°С полностью растворяются в расплаве Na2CO3. Нами (Sokol et al., 2021) недавно было показано, что при 5.5 ГПa и 1200–1450°C содержание молекулярного CO2 в кимберлитовом расплаве буферирует реакция карбонатизации оливина (Mg2SiO4(Ol) + 2CO2(melt) ⇔ ⇔ Mg-2Si2O6 + MgCO3). Этот процесс должен предотвращать отделение CO2 флюида от расплава, который транспортирует значительное количество перидотитового материала. Согласно оценкам, при 5.5 ГПа и 1200–1350°С растворимость молекулярного CO2 в расплаве варьирует от 20–25 мас. % в существенно карбонатных расплавах, до 7–12 мас. % в кимберлитоподобных расплавах (Sokol, Kruk, 2021). На этом основании авторы предположили, что флюидная фаза может выделяться в поднимающейся магме при давлении ниже 5.5 ГПа из-за снижения растворимости CO2 на фоне роста содержания SiO2, а также вследствие реакции декарбонатизации с участием магнезита и ортопироксена.
В данной работе в экспериментах при 3.0 ГПа и 1200–1350°C были изучены реакции карбонатизации и декарбонатизации, сопровождающие взаимодействие между гранатовым лерцолитом и богатыми летучими карбонатными расплавами. Дан анализ зависимости растворимости молекулярного CO2 в кимберлитоподобных расплавах от температуры и проанализированы возможные причины вскипания таких расплавов. Для верификации выявленных механизмов вскипания расплава была разработана и реализована специальная схема двухстадийных экспериментов, выполненных в герметичных платиновых ампулах. Эксперименты были проведены в две стадии. На первой (длительной) стадии при 5.5 ГПа и 1350°C осуществлялось уравновешивание карбонатного расплава с гранатовым лерцолитом. Вторая (короткая) стадия с резким снижением давления до 3.0 ГПа и температуры до 1200–1300°С моделировала быстрый подъем магмы до уровня ~100 км.
МЕТОДИКА
Стартовые составы
Валовый состав экспериментальных систем (табл. 1) был выбран таким образом, чтобы при параметрах экспериментов получить за счет растворения перидотитового материала в карбонатных расплавах, составы близкие к кимберлитам I группы (Becker, Le Roex, 2006; Kopylova et al., 2007; Kamenetsky et al., 2009a; Kjarsgaard et al., 2009). Для этого мы смешали порошки природного гранатового лерцолита и модельных карбонатных смесей в пропорциях 2 : 1. В качестве перидотитового материала использовали свежий гранатовый лерцолит из ксенолита Уд-05-05 из кимберлитовой трубки Удачная. В качестве модельных карбонатных смесей мы использовали составы близсолидусных выплавок по данным (Grassi, Schmidt, 2011; Brey et al., 2011). Первый, богатый калием состав (GS) может образовываться при 8 ГПа и 1100°C при плавлении карбонатизированного пелита в зонах субдукции (Grassi, Schmidt, 2011). Второй, состав (B10) в первом приближении моделирует астеносферные карбонатные расплавы, которые потенциально могут формироваться при 10 ГПа и 1400°C при плавлении богатого калием карбонатизированного гарцбургита (Brey et al., 2011).
Таблица 1.
Составы лерцолита из ксенолита УД 05-05 (Lc), модельных карбонатных расплавов (GS, B10) и валовые составы экспериментальных образцов без добавления H2C2O4
| Компонент | Lc (Ud-05-05) | B10 | GS | Lc-B10 | Lc-GS |
|---|---|---|---|---|---|
| SiO2 | 43.24 | 16.01 | 0.62 | 34.25 | 29.18 |
| TiO2 | 0.13 | 0.19 | 0.02 | 0.15 | 0.09 |
| Al2O3 | 2.25 | 0.3 | 0.73 | 1.61 | 1.75 |
| Cr2O3 | 0.68 | 0.11 | – | 0.49 | 0.46 |
| FeO | 11.19 | 18.31 | 3.97 | 13.54 | 8.81 |
| MnO | 0.11 | 0.34 | – | 0.19 | 0.07 |
| NiO | 0.25 | 0.08 | – | 0.19 | 0.17 |
| MgO | 39.02 | 22.21 | 4.77 | 33.47 | 27.72 |
| CaO | 2.72 | 8.3 | 15.67 | 4.56 | 6.99 |
| Na2O | 0.23 | 0.47 | 0.18 | 0.31 | 0.21 |
| K2O | 0.19 | 5.8 | 31.3 | 2.04 | 10.46 |
| CO2 | – | 27.88 | 42.74 | 9.2 | 14.1 |
| Сумма | 100.01 | 100 | 100 | 100 | 100.01 |
Модельные составы B10 и GS (табл. 1) были приготовлены путем смешения карбонатов (MgCO3, CaCO3, Na2CO3 и K2CO3) и оксидов (MgO, SiO2, Al2O3, TiO2, FeO и т.д.) в соответствующих пропорциях. Молекулярный CO2 и H2O вводились в системы в виде безводной щавелевой кислоты (H2C2O4), далее OA. При параметрах экспериментов она разлагалась по реакции 2H2C2O4 → → 3CO2 + 2H2O + C0, что обеспечивало выделение CO2 и H2O в соотношении 3 : 2. а также небольшого количества C0, кристаллизующегося в образцах в виде чешуек графита.
Количество воды, введенной в системы, соответствует существующим представлениям о содержании воды в кимберлитовых магмах (Kjarsgaard et al., 2009). Согласно нашим оценкам, количество молекулярного CO2, введенного в экспериментальные системы, было достаточным для насыщения карбонатно-силикатных расплавов. Использованные для экспериментов Р-Т параметры соответствуют модельным расчетам по условиям в поднимающихся кимберлитовых магмах (Kavanagh, Sparks, 2009).
Образцы помещались в Au ампулы (эксперименты при 1200°С) или Pt ампулы с Re футеровкой, толщиной 0.1 мм. Ампулы имели диаметр 5.0 мм и толщину стенок 0.2 мм. Приготовленные к экспериментам ампулы герметично заваривали высокочастотной дуговой сваркой с использованием прибора Lampert PUK 4U. Детали использованной методики приведены в работе (Sokol, Kruk, 2021).
Методика экспериментов
Эксперименты при давлении 3.0 и 5.5 ГПа проведены на многопуансонном аппарате разрезная сфера (БАРС) (Palyanov et al., 2017). Ампулы для экспериментов размещали в ячейки высокого давления, которые имеют форму тетрагональной призмы размером 21.1 × 21.1 × 25.4 мм, с графитовым нагревателем высотой 18.5 мм. Детали изготавливаются из тугоплавких оксидов и солей, которые обладают низкой теплопроводностью и не имеют фазовых переходов при P-T параметрах экспериментов (корпус ячейки – ZrO2, внутренние детали – ZrO2, MgO, CsCl). Давление в ячейках было откалибровано по фазовым переходам в Bi при 2.55 ГПа и в PbSe при 4.0 и 6.8 ГПа при комнатной температуре. При температуре 900°С калибровка осуществлялась с использованием фазового перехода кварц-коэсит (Bohlen, Boettcher, 1982). Температура измерялась PtRh6/PtRh30 термопарой в каждом эксперименте. Термопара была откалибрована при 6.3 ГПа относительно точек плавления Al и Ag (Sokol et al., 2015). Измерение давления и температуры проводилось с погрешностью ±0.1 ГПа и ±20°C (Sokol et al., 2015; Palyanov et al., 2017). Закалка образцов проводилась со скоростью 150 град/с.
Основная часть экспериментов при 3.0 ГПа выполнена в одну стадию, включающую в себя нагрев образцов при целевом давлении, выдержку их в течение 40–150 ч и затем закалку (табл. 2). Три эксперимента были проведены по двухстадийной схеме. На первой длительной (40-часовой) стадии достигалось уравновешивание карбонатитового расплава и гранатового лерцолита в образцах при 5.5 ГПа и 1350°C после чего производилась закалка образцов. На второй стадии давление в ячейках сперва снижалось с 5.5 до 3.0 ГПа, затем образцы на 15 минут нагревались до 1270°С, после чего проводилась их закалка. Такая схема позволила нам моделировать подъем кимберлитовой магмы в режиме резкого падения давления с 5.5 до 3.0 ГПа и снижения температуры. Выбор составов для двухстадийных экспериментов осуществляли на основании данных (Luth, 2009) и (Sokol, Kruk, 2021). С учетом потенциально возможных при P-T параметрах второй стадии реакций Mgs + En = Fo + Fl или Mgs + L= = Fo + Fl в ассоциациях первой стадии в равновесии с расплавом должны были присутствовать магнезит ± ортопироксен. Этому условию отвечала система Lc-B10 с добавлением от 9 до 21 мас. % CO2 и от 2.5 до 6 мас. % H2O, а также система Lc-GS с добавлением ~21 мас. % CO2 и ~6 мас. % H2O.
Таблица 2.
Параметры экспериментов при 3.0 ГПа и количество синтезированных фаз (мас. %)
| № эксп. | Система | H2C2O4, мас. % | Материал ампулы | T, °C | t, ч | Кол-во фаз. мас. % | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ol | Grt | Opx | Cpx | Mst | Phl | Liq | ||||||
| 2202_2_1 | Lc–B10 | 12.8 | Au | 1200 | 150 | 33 | – | 11 | 3 | 12 | 12 | 30 |
| 2202_2_2 | Lc–GS | 12.8 | Au | 1200 | 150 | 3 | – | 15 | – | 18 | 9 | 55 |
| 2202_2_3 | Lc–B10 | 29.2 | Au | 1200 | 150 | – | – | 20 | – | 48 | – | 33 |
| 2202_2_4 | Lc–GS | 29.3 | Au | 1200 | 150 | – | – | 4 | 7 | 43 | – | 47 |
| 764_6_1 | Lc–B10 | 12.8 | Pt + Re* | 1350 | 40 | 27 | – | 6 | – | – | – | 67 |
| 2225_2_1 | Lc–GS | 12.7 | Pt + Re | 1350 | 40 | – | – | 16 | – | – | – | 84 |
| 764_6_2 | Lc–B10 | 29.3 | Pt + Re | 1350 | 40 | – | – | 5 | – | – | – | 95 |
| 2225_2_2 | Lc–GS | 29.1 | Pt + Re | 1350 | 40 | – | – | – | – | – | – | 100 |
| 1769_2_2** | Lc–B10 | 12.7 | Pt + Re | 1350–1270 | 40 + 0.25 | + | + | + | – | + | – | + |
| 1769_2_3** | Lc–B10 | 29.3 | Pt + Re | 1350–1270 | 40 + 0.25 | – | – | + | – | + | – | + |
| 2226_2_2** | Lc–GS | 28.9 | Pt + Re | 1350–1270 | 40 + 0.25 | – | – | – | – | + | – | + |
Аналитические методы
После извлечения из ячеек Pt-ампулы очищались от CsCl, сушились и проверялись на герметичность. Затем ампулы распиливались вдоль оси вращения на две равные части. Половинки образцов монтировались в шашки и заливалась низковязкой эпоксидной смолой под вакуумом. После полимеризации эпоксидной смолы шашки полировались без использования воды. Подготовленные образцы исследовались с использованием оптического (Carl Zeiss Stemi 2000-С) и сканирующего электронного (Tescan MIRA 3 LMU) микроскопов. Микрозондовые анализы (EMPA) были выполнены при ускоряющем напряжении 20 кВ и силе тока 20 нA на автоматизированном рентгеновском микроанализаторе Jeol JXA-8100. Диаметр пучка 1–2 мкм использовали для силикатных и карбонатных фаз. Время набора спектра для каждого элемента составляло 10 с. В качестве стандартов использовали: пироп (O-145) на Si. Al и Fe; Cr-гранат (Ud-92); Mn-гранат (Mn-IGEM); диопсид на Mg и Ca; альбит на Na; ортоклаз на K; ильменит на Ti; шпинель на Ni. Ошибка измерений была в пределах 2 отн. %. Закаленные расплавы анализировались на микрозонде Jeol JXA-8100 с использованием расфокусированного пучка диаметром 100 мкм при ускоряющем напряжении 20 кВ и силе тока 40 нА. Дополнительно состав закаленного расплава изучался методом EDS на сканирующем электронном микроскопе Tescan MIRA 3 LMU, снабженным INCA EDS 450 системой микроанализа с детектором EDS X-Max-80 Silicon Drift Detector. Ускоряющее напряжение составляло 20 кВ, ток пучка 1 нA, диаметр пучка 100 мкм; время набора спектра 20 с.
Массовые пропорции фаз в образцах после экспериментов были рассчитаны методом масс-баланса для ограниченного набора компонентов системы: SiO2, TiO2, Al2O3, Cr2O3, MgO и CaO. В расчетах использовали стартовые составы систем и составы фаз после экспериментов. Рассчитанные пропорции фаз (табл. 2) оказались близки к значениям, полученным на основе обработки BSE-изображений с помощью встроенного программного обеспечения MIRA 3 LMU.
РЕЗУЛЬТАТЫ
Равновесность образцов
Длительность наших экспериментов составляла 150 ч при 1200°С и 40 ч при 1350°С (за исключением двухстадийных экспериментов). Все образцы при параметрах экспериментов содержали богатый летучими карбонатно-силикатный расплав. Согласно данным (Brey et al., 2008, 2009; Girnis et al., 2011; Sokol et al., 2016; Stamm, Schmidt, 2017; Sun, Dasgupta, 2019), при мантийных давлениях скорости реакций в кимберлитоподобных системах с СО2-обогащенными расплавами достаточно высоки. По данным Brey et al., (2008), равновесие в кинетических экспериментах, выполненных при температурах ≥1300°C, достигалось за 9–10 ч. В полученных нами образцах обнаружены незональные, иногда частично ограненные зерна минералов размером до 1 мм. В целом большая продолжительность опытов и однородность состава кристаллических фаз указывают на то, что полученные в образцах после одностадийных опытов ассоциации были близки к равновесию. На второй, 15-минутной стадии двухстадийных экспериментов, равновесия не достигалось.
Текстуры и фазовый состав
Одностадийные эксперименты при 3.0 ГПа. Текстуры образцов, полученных в одностадийных экспериментах при давлении 3.0 ГПа и температуре 1200 и 1350°С, существенно различаются. Прежде всего, доля закаленного расплава в образцах при 1200°С заметно ниже. Она составляет 30–47 мас. % при малых добавках CO2 и H2O, но возрастает до 33–68 мас. % при больших добавках CO2 и H2O (табл. 2, рис. 1). Как правило, закаленный расплав в образцах представлен агрегатом дендритных кристаллов силикатов и карбонатов, и локализован в относительно более горячих частях образцов. Необычной текстурой обладает закаленный расплав в экспериментах 2202_2_4 и, отчасти, 2202_2_3, выполненных с большой добавкой щавелевой кислоты (табл. 2). В них совместно с дендритами карбонатов присутствуют выделения богатого калием силикатного стекла с огромным количеством мелких пузырьков, размером 1–5 мкм. Значительная часть пузырьков образует в стекле “дорожки” между закалочными кристаллами, другая часть расположена хаотично, как и в экспериментах при 5.5 ГПа и 1350°С (Sokol, Kruk, 2021). По нашему мнению, наличие большого количества дендритных кристаллов непосредственно в стекле и специфика распределения пузырьков свидетельствует о том, что выделение богатого калием силикатного расплава и образование пузырьков в нем происходило на стадии закалки образцов. В образце 2202_2_3 расплав локализован не в горячей зоне ампулы, а в интерстициях между кристаллами (рис. 1б). Причем в продуктах закалки этого расплава иногда встречается вспененное стекло.
Рис. 1.
BSE изображения представительных образцов, полученных при реакционном взаимодействии гранатового лерцолита с карбонатитами B10 и GS при 3.0 ГПа и T = 1200°C. a: эксп. 2202_2_1 (Lc-B10-CO2-H2O); б: эксп. 2200_2_3 (Lc-B10-CO2-H2O); в, г: эксп. 2202_2_4.

При 1200°С кристаллические фазы имеют размер не более 150 мкм (рис. 1). Данные расчета масс-баланса, характеризующие фазовые отношения в образцах, приведены в табл. 2. Образец 2202_2_1 системы Lc–B10–CO2–H2O (рис. 1а) c небольшой добавкой OA состоит из трех зон. Первая зона толщиной 1–1.2 мм расположена в нижней части ампулы и содержит ксеноморфные зерна магнезита, оливина и ортопироксена. Вторая зона лишена магнезита, но в ней присутствуют идиоморфные зерна оливина и ксеноморфные ортопироксена, небольшое количество интерстиционного расплава, флогопит и единичные зерна клинопироксена. Третья зона, толщиной около 0.2–0.3 мм. располагается в наиболее горячей области ампулы и состоит из дендритного агрегата, возникшего на месте закаленного расплава. Таким образом, в образце 2202_2_1 в равновесии с расплавом обнаружена ассоциация фаз Ol-Opx-Cpx-Phl-Mgs, воспроизводящая карбонатсодержащий лерцолит.
В образце 2202_2_2 (система Lc–GS–CO2–H2O) c небольшой добавкой OA в нижней части ампулы возникла линза, состоящая из агрегата магнезита, небольшого количества хорошо окристаллизованных зерен ортопироксена и единичных зерен оливина. Выше располагается закаленный расплав, а на границе с ним присутствуют отдельные кристаллы флогопита, размером до 70 мкм. В целом, в образце зафиксирована ассоциация фаз Ol-Opx-Phl-Mgs-L со следовыми количествами оливина (≈3 мас. %) (табл. 2). С ростом добавки OA количество магнезита в образцах также растет и достигает 43–48 мас. %. Образец 2202_2_3 (система Lc–B10–CO2–H2O) сложен субидиоморфными зернами магнезита, размером 30–50 мкм, ксеноморфными индивидами ортопироксена (иногда с включениями магнезита) размером до 150 мкм и закаленным раcплавом, сосредоточенным в интерстициях. Отметим, что кристаллы ортопироксена, находящиеся в контакте с расплавом, приобретают элементы огранки. В образце 2202_2_4 (система Lc–GS–CO2–H2O) твердые фазы формируют мозаичную текстуру (рис. 1в). Ксеноморфные зерна клинопироксена размером до 150 мкм содержат включения ортопироксена. Ортопироксен иногда сохраняет частичную огранку, но чаще ксеноморфен и несет следы растворения. Его включения неправильной формы встречаются также и в субидиоморфных зернах магнезита.
С ростом температуры до 1350°С степень плавления образцов возрастает до 54–84 мас. % для систем с небольшой добавкой OA, и достигает 85–100 мас. % в системах с большой добавкой OA. Закаленный расплав во всех образцах представлен агрегатом дендритных кристаллов силикатов и карбонатов. Крупных полостей или выделений силикатного стекла с пузырьками флюидной фазы обнаружено не было. Твердые фазы в образцах даже с небольшой добавкой OA не образуют плотных срастаний или агрегатов (рис. 2). Так в образце 764_6_1 (система Lc–B10–CO2–H2O) присутствуют очень крупные (до 1 мм), иногда ограненные, но, как правило, ксеноморфные зерна ортопироксена. В системах с большой добавкой OA в одном из двух образцов обнаружены единичные (до 0.5 мм) кристаллы ортопироксена с элементами огранки (табл. 2, рис. 2). Выделений флюидной фазы, которая была бы стабильна при Р-T параметрах экспериментов не фиксировалось.
Рис. 2.
BSE изображения представительных образцов, полученных при реакционном взаимодействии гранатового лерцолита с карбонатитами B10 и GS при 3.0 ГПа и T = 1350°C. a: эксп. 764_6_1 (Lc-B10-CO2-H2O); б: эксп. 764_6_2 (Lc-B10-CO2-H2O); в: эксп. 2225_2_2 (Lc–GS–CO2–H2O).
Подчеркнем, что ни в одном из образцов, полученных в одностадийных экспериментах, не был обнаружен гранат. В образцах, полученных при 1200°С с небольшой добавкой OA, совместно встречаются флогопит и магнезит. Важно отметить, что в экспериментах, выполненных ранее при давлениях 5.5–8 ГПа, ассоциация расплава, магнезита и флогопита зафиксирована не была (Enggist, Luth, 2016; Sokol et al., 2017, 2021).
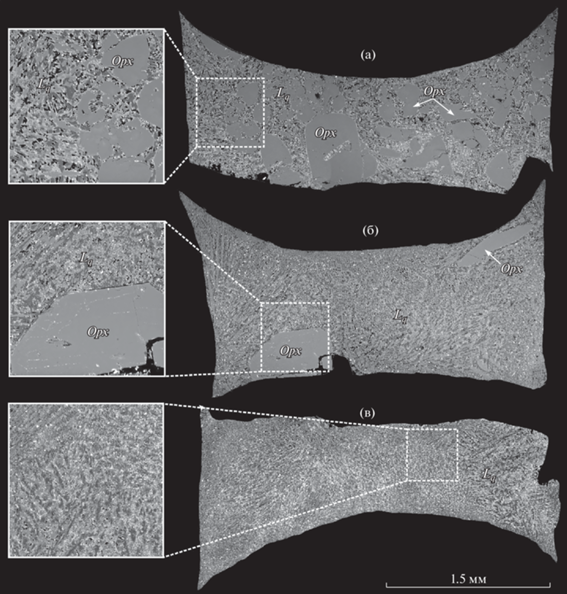
Двухстадийные эксперименты при 5.5 и 3.0 ГПа. В двухстадийном эксперименте 1769_1_2 (система Lc–B10–CO2–H2O), выполненном с небольшой добавкой OA (табл. 2, рис. 3а), крупных флюидных пузырей не обнаружено. В холодной части ампулы располагаются зерна магнезита со следами коррозии. Центральную часть образца занимает зона, сложенная достаточно крупными зернами (до 700 мкм) ксеноморфного ортопироксена, идиоморфного граната и субидиоморфного оливина. В горячей части ампулы располагается закаленный расплав. Закалочный агрегат содержит большое количество полостей неправильной формы размером до 10 мкм. В эксперименте 1769_1_3 (система Lc–B10–CO2–H2O с большей добавкой OA, финальная стадия которого проведена при 3.0 ГПа и 1270°С, подробно в разделе “Методика”) в центральной и верхней части образца возникли полости, лишенные закалочных фаз. Наиболее крупная полость (более 1.5 мм в длину и до 0.5 мм в высоту) со скругленными стенками оказалась приурочена к границе между закаленным расплавом и плотным минеральным агрегатом. Последний слагают ксеноморфный магнезит и зерна ортопироксена с элементами частичной огранки, размером до 0.5 мм (рис. 3б, рис. 4). Полости меньшего размера (от первых мкм до 0.5 мм) иногда сферической, а чаще неправильной формы со скругленными границами в большом количестве присутствуют в закаленном стекле. Очертания этих полостей и отсутствие в них закалочных кристаллов свидетельствует о том, что они были заполнены флюидной фазой с очень низкими концентрациями растворенных компонентов. Поверхность зерен магнезита на границе с расплавом/флюидом свидетельствует о его коррозии/растворении. В двухстадийном эксперименте 2227_2_2 (система Lc–GS–CO2–H2O с большой добавкой OA) (табл. 2, рис. 3в) были получены единичные крупные (до 1 мм) зерна магнезита со следами коррозии и закаленный расплав. В закаленном расплаве имеется достаточно крупные полости, размером до 100 мкм. Они, как правило, имеют неправильную форму, а их границы с закаленным расплавом не скруглены.
Рис. 3.
BSE изображения представительных образцов из одно- и двухстадийных экспериментов, моделирующих быстрый подъем магмы с уровней 5.5 ГПа до уровней 3.0 ГПа и снижения температуры с 1350 до 1270°C. Стадия I (5.5 ГПа и 1350°C) по реакционному уравновешиванию гранатового лерцолита с карбонатитами B10 и GS недоступна для изучения и реконструирована (левая часть рисунка) на основе данных работы (Sokol, Kruk, 2021). a: эксп. 707_6_1 (Lc‒B10–CO2–H2O); б: эксп. 707_6_3 (Lc–B10–CO2–H2O); в: эксп. 707_6_4 (Lc–GS–CO2–H2O). Cтадия II (3.0 ГПа и 1270°С, правая часть рисунка). a: эксп. 1769_1_2 (Lc–B10–CO2–H2O); б: эксп. 1769_1_3 (Lc–B10–CO2–H2O); в: эксп. 2226_2_2 (Lc–GS–CO2–H2O). Детали методики проведения двухсдадийных экспериментов приведены в разделе Методика. Grt = гранат; Fl = флюид.

Химический состав фаз
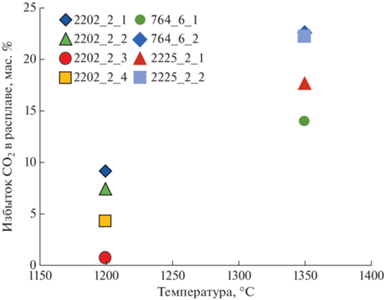
Закаленный расплав. Содержание SiO2 в расплавах (рис. 5а, табл. 3), полученных при температуре 1200°С с добавками 9 мас. % CO2 и 2.5 мас. % H2O, составляет 15 мас. % (система Lc–B10–CO2–H2O) и 21.7 мас. % (система Lc–GS–CO2–H2O). В системах с добавкой 21 мас. % CO2 и 6 мас. % H2O и низкой степенью плавления образцов содержание SiO2 достигает 40 мас. % в расплаве системы Lc–B10–CO2–H2O и 31.5 мас. % SiO2 в расплаве системы Lc–GS–CO2–H2O. Увеличение температуры до 1350°С, не зависимо от количества введенных дополнительно CO2 и H2O, приводило к увеличению степени плавления и к образованию расплавов c концентрацией SiO2 от 19–23 мас. % в системе Lc–GS–CO2–H2O до 25 мас. % в системе Lc–B10–CO2–H2O. На рис. 5а хорошо видно, что при 1350°С разброс содержания SiO2 в расплаве невелик (19–25 мас. %), при 1200°С этот разброс становится в несколько раз больше (15–40 мас. %). Причиной обнаруженного эффекта является разный вклад процессов карбонатизации лерцолита.
Рис. 5.
Температурная зависимость состава расплавов, полученных в одно- и двухстадийных экспериментах. a: содержание SiO2; б: весовое отношение MgO/CaO; в: содержание Al2O3; г: содержание K2O.
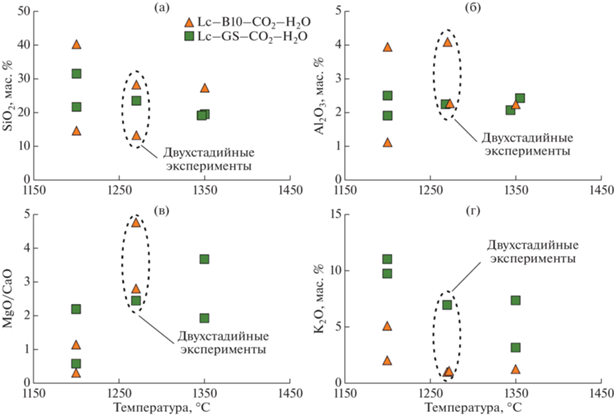
Таблица 3.
Средние составы синтезированных фаз (мас. %)
| № эксп. | Система | T, °C | Фаза | Кол-во анализов | SiO2 | TiO2 | Al2O3 | Cr2O3 | FeO | MnO | NiO | MgO | CaO | Na2O | K2O | Сумма |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2202_1 | Lc–B10–OA | 1200 | Ol | 6 | 39.4(4) | – | – | – | 17(2) | 0.18(3) | 0.24(5) | 44(2) | – | – | – | 100.82 |
| Phl | 9 | 40.5(4) | 0.5(2) | 12.1(2) | 0.9(1) | 7.1(1) | – | 0.12(1) | 21.6(2) | – | – | 10.14(9) | 92.96 | |||
| Opx | 6 | 57(6) | 0.14(6) | 0.7(1) | 0.12(3) | 7.8(4) | 0.14(2) | – | 32.8(6) | 1(1) | 0.21(3) | – | 99.91 | |||
| Cpx | 11 | 54.23(9) | – | 0.8(2) | 0.9(2) | 5.82(4) | 0.2(0) | – | 16.8(3) | 19.9(1) | 0.58(6) | – | 99.23 | |||
| Mst | 9 | – | – | – | – | 9.8(5) | 0.29(4) | – | 36.2(6) | 2.2(4) | – | – | 48.49 | |||
| Liq | 8 | 15(2) | 0.5(1) | 1.1(10) | – | 10(1) | 0.34(3) | – | 14(1) | 13(2) | – | 2(1) | 55.94 | |||
| 2202_2 | Lc–GS–OA | 1200 | Ol | 12 | 40.1(1) | – | – | – | 12.36(5) | 0.13(1) | 0.24(1) | 47.1(3) | – | – | – | 99.93 |
| Opx | 10 | 56.4(7) | – | 0.17(5) | 0.2(2) | 9.5(9) | 0.14(0) | 0.12(1) | 31(1) | 1.4(8) | – | – | 98.93 | |||
| Phl | 9 | 41.4(4) | 0.29(3) | 11.6(2) | 0.6(1) | 5.4(1) | – | – | 24(3) | – | – | 10.56(9) | 93.85 | |||
| Mst | 6 | – | – | – | – | 6.8(5) | 0.14(2) | – | 37.1(5) | 2.2(5) | – | – | 46.24 | |||
| Liq | 12 | 22(3) | – | 1.9(4) | 0.32(6) | 7.1(10) | – | – | 19(2) | 8(3) | 0.5(4) | 10(4) | 68.82 | |||
| 2202_3 | Lc–B10–OA | 1200 | Opx | 10 | 56.6(4) | – | 0.8(1) | 0.2(1) | 9(1) | 0.15(1) | 0.14(8) | 31.6(6) | 0.7(4) | 0.11(8) | – | 99.3 |
| Mst | 11 | – | – | – | – | 11(2) | 0.24(7) | 0.15(2) | 36(1) | 1.5(5) | – | – | 48.89 | |||
| Liq | 8 | 40(3) | 0.3(1) | 3.9(3) | – | 4(1) | – | – | 2(2) | 5(2) | 0.5(6) | 5(2) | 60.7 | |||
| 2202_4 | Lc–GS–OA | 1200 | Cpx | 7 | 54.5(7) | – | 0.6(2) | 2(5) | 5.2(3) | 0.11(2) | – | 16.6(6) | 19.4(5) | 0.8(2) | – | 99.21 |
| Opx | 6 | 58.4(3) | – | 0.8(1) | 0.8(1) | 8(1) | – | 0.18(8) | 29.2(5) | 3.2(4) | 0.19(8) | – | 100.77 | |||
| Mst | 6 | – | – | – | – | 7(2) | 0.13(6) | 0.13(3) | 37(1) | 1.9(4) | – | – | 46.16 | |||
| Liq | 8 | 31.48(1) | – | 2.51(1) | – | 3.5(8) | – | – | 3.2(4) | 5.6(4) | 0.53(0) | 10.97(0) | 57.79 | |||
| 764_6_1 | Lc–B10–OA | 1350 | Ol | 10 | 41(4) | – | – | – | 8(3) | – | – | 51(2) | – | – | – | 100 |
| Opx | 12 | 58(4) | – | 0.94(3) | 0.39(5) | 5.1(2) | – | – | 35.7(2) | 0.45(1) | – | – | 100.58 | |||
| Liq | 11 | 23(2) | 0.21(8) | 3.2(6) | – | 9(1) | 0.16(2) | – | 21(4) | 9(1) | 0.4(1) | 3.5(8) | 69.47 | |||
| 2225_2_1 | Lc–GS–OA | 1350 | Opx | 6 | 58.5(4) | – | 0.6(1) | 0.32(2) | 2.19(9) | – | – | 37.5(1) | 0.23(1) | – | – | 99.34 |
| Liq | 10 | 19.2(8) | – | 2.1(2) | – | 3.1(4) | – | – | 21(1) | 5.7(7) | 0.75(10) | 7.3(5) | 59.15 | |||
| 764_6_2 | Lc–B10–OA | 1350 | Opx | 8 | 58.4(5) | – | – | 0.1(1) | 5(2) | – | – | 36.1(7) | – | – | – | 99.6 |
| Liq | 11 | 25(2) | – | 1.9(6) | – | 9(1) | – | – | 24(4) | 5(1) | – | 1.2(8) | 66.1 | |||
| 2225_2_2 | Lc–GS–OA | 1350 | Liq | 7 | 25(2) | – | 1.1(5) | – | 7(1) | – | – | 24(5) | 6(2) | 0.19(10) | 9(3) | 72.29 |
| 1769_2 | Lc–B10–OA | 1350–1270 | Ol | 12 | 40.3(3) | – | – | – | 10(3) | 0.14(3) | 0.21(3) | 49(2) | – | – | – | 99.65 |
| Grt | 12 | 42.3(2) | 0.11(2) | 20.4(1) | 3(1) | 8.6(4) | 0.35(2) | – | 23(4) | 1.48(7) | – | – | 99.24 | |||
| Opx | 11 | 57.1(4) | – | 0.9(1) | 0.2(1) | 6(1) | 0.14(1) | – | 34.8(6) | 0.3(4) | – | – | 99.44 | |||
| Mst | 11 | – | – | – | – | 4.82(2) | 0.17(0) | – | 38.54(10) | 0.72(2) | – | – | 44.25 | |||
| Liq | 8 | 13(2) | 0.28(6) | 2.3(5) | – | 10(1) | 0.34(3) | – | 26(4) | 9.3(9) | – | 1(2) | 62.22 | |||
| 1769_3 | Lc–B10–OA | 1350–1270 | Opx | 9 | 56.7(5) | – | 0.4(1) | 0.3(1) | 8(1) | 0.17(1) | 0.1(1) | 33(6) | 0.2(5) | – | – | 98.87 |
| Mst | 11 | – | – | – | – | 7.5(4) | 0.2(2) | – | 38.1(2) | 0.6(9) | – | – | 46.4 | |||
| Liq | 9 | 28(2) | 0.35(6) | 4.1(4) | 0.23(1) | 9.3(5) | 0.28(2) | – | 23(1) | 5(1) | – | 1.1(5) | 71.36 | |||
| 2226_2 | Lc–GS–OA | 1350–1270 | Mst | 9 | – | – | – | – | 3.93(3) | – | – | 38(2) | 0.71(3) | – | – | 42.64 |
| Liq | 6 | 24(2) | – | 2.2(2) | – | 4.8(6) | – | – | 14(2) | 5.9(9) | – | 7(3) | 57.9 |
Отношение MgO/CaO часто используют для анализа степени соответствия синтезированных расплавов и природных кимберлитов (Stamm, Schmidt, 2017). В исходных карбонатных смесях B10 и GS соответствующие массовые MgO/CaO отношения составляют 2.7 и 0.3, соответственно. В системах Lc–B10 и Lc–GS они составляют 7.8 и 3.9, соответственно. При реакционном плавлении лерцолита с участием B10 и GS при 1200°C отношение MgO/CaO в расплавах составляет 0.3–1.1 для системы Lc–B10–CO2–H2O и 0.6–2.1 для Lc–GS–CO2–H2O (рис. 5б). Таким образом, в системе Lc–B10–CO2–H2O расплавы заметно обогащаются CaO относительно исходного B10 и еще более относительно валового состава системы Lc–B10. В системе Lc–GS–CO2–H2O при 1200°C отношение MgO/CaO в расплаве выше, чем в GS, однако заметно ниже, чем в валовом составе системы Lc–GS. С ростом температуры в расплавах растет MgO/CaO отношение. Наиболее выражен этот эффект для расплавов из экспериментов, выполненных при 1350°C с добавкой 21.5 мас. % CO2 и 6 мас. % H2O. Вследствие высокой степени плавления образцов, MgO/CaO отношение достигает 5.2 для системы Lc–B10–CO2–H2O и 3.7 для Lc–GS–CO2–H2O.
Для расплавов, образующихся при взаимодействии B10 и GS с лерцолитом, характерны вариации Al2O3 от 1.1 до 4.1 мас. % (рис. 5в). Причем концентрации Al2O3 максимальны для расплавов, полученных при 1350 в системе Lc–B10–CO2–H2O. Содержание K2O в расплаве варьировало от 1 до 11 мас. % (рис. 5г), а концентрация Na2O не превышала 1 мас. %. Содержания щелочей были максимальны в расплавах, полученных в системе Lc–GS–CO2–H2O при 1200°С, и минимальны в системе Lc–B10–CO2–H2O при 1350°С.
Расплавы из двухстадийных опытов, в целом, следуют тем же трендам изменения составов для одностадийных экспериментов при давлении 3.0 ГПа, температурах 1200 и 1350°С (рис. 5). Однако, эксперимент 1764_1_2, в котором в систему Lc–B10–CO2–H2O было введено большое количество летучих, имеет расплав с более высоким отношением MgO/CaO – 4.8 и пониженным содержанием SiO2 – 13.4 мас. %.
Твердые фазы. Оливин был обнаружен в двух одностадийных экспериментах при 1200°С и в одном двухстадийном эксперименте, и присутствовал только в опытах с низким содержанием щавелевой кислоты в смеси. В системе Lc–GS–CO2–H2O Mg# (мольное отношение MgO/(MgO + + FeO + CaO) × 100) оливина составил 86.5–87, а в системе Lc–B10–CO2–H2O – 82–89. Магнезиальность (Mg#) ортопироксена варьирует от 81–85 при 1200°С до 91–96 при 1350°С. Клинопироксен зафиксирован в двух экспериментах при 1200°С в системе Lc–B10–CO2–H2O и в системе Lc–GS–CO2–H2O; его Ca# (мольное отношение CaO/(MgO + FeO + CaO)·100) составил 0.21 и 0.42, соответственно. В магнезите из экспериментов при 1200°С содержание FeO изменялось в диапазоне 7–11 мас. %, а CaO – от 1.6 до 2.2 мас. %. С ростом температуры концентрации FeO и CaO в магнезите снижались (до 3.9–7.4 мас. % и до <1 мас. %. соответственно). Флогопит содержит 3.35–3.36 ф.е. Si и 0.28–0.3 ф.е. Al (при расчете формулы на 11 атомов кислорода). Концентрации TiO2 и Cr2O3 составляли 0.3–0.5 и 0.6–0.8 мас. % соответственно, а Mg# – варьировал в диапазоне 0.84–0.89. Согласно данным работы (Sokol et al., 2017) такие составы характерны для закалочного флогопита. Составы фаз из одностадийных и двухстадийных экспериментов значимо не различались.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ фазовых отношений в одностадийных экспериментах
Сопоставление образцов, полученных ранее в экспериментах при 5.5 ГПа и 1350°С (Sokol, Kruk, 2021), и в этой работе при 3.0 ГПа и 1350°С, позволяет сделать вывод, что снижение давления при постоянной температуре ведет к существенному росту степени плавления в системах Lc–B10–CO2–H2O и Lc–GS–CO2–H2O. Кроме того, при этих P-T параметрах в системах становится нестабилен магнезит. Стабильными фазами остаются расплав и ортопироксен либо только расплав. С другой стороны, при давлении 3.0 ГПа снижение температуры с 1350 до 1200°С ведет к снижению степени плавления изученных систем с 67–100 до 30–68 мас. %, а также приводит к стабилизации магнезита. При T = 1200°С в системах с добавкой 9 мас. % CO2 и 2.5 мас. % H2O оливин оказывается стабильной фазой. В равновесии с расплавом в системе Lc–B10–CO2–H2O стабильна асcоциация Ol-Opx-Cpx(-Phl?)-Mgs, а в системе Lc–GS–CO2–H2O – ассоциация Ol-Opx(-Phl?)-Mgs с небольшим количеством остаточного оливина. Таким образом, при давлении 3.0 ГПа и температуре 1200°С при метасоматозе мантийных перидотитов кимберлитоподобными расплавами могут возникать карбонатизированные лерцолиты. Вопрос о стабильности флогопита в присутствии расплава и магнезита требует дальнейшего изучения. При добавке 21 мас. % CO2 и 6 мас. % H2O оливин полностью карбонатизируется. В системе Lc–B10–CO2–H2O ортопироксен остаётся стабилен, а в системе Lc–GS–CO2–H2O сохраняются только его включения, изолированные в клинопироксене и магнезите. Следовательно, в более богатой кальцием системе Lc–GS–CO2–H2O ортопироксен также карбонатизируется.
Оценки растворимости CO2 в карбонатно-силикатных расплавах
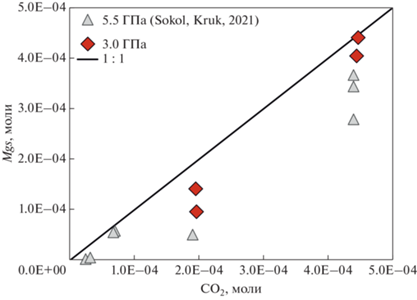
В этой работе оценка растворимости молекулярного CO2 была выполнена при давлении 3.0 ГПа в кимберлитоподобных расплавах, образующихся при реакционном взаимодействии богатых летучими модельных карбонатных смесей B10 и GS с гранатовым лерцолитом. Расчеты были основаны на трех базовых допущениях: (1) при 5.5 ГПа и 1200°С в системах Lc–B10–H2O и Lc–GS–H2O магнезит не стабилен; (2) при 1200°С количество молекулярного CO2 (введенного в системы в виде щавелевой кислоты) в основном было израсходовано в реакции карбонатизации оливина с образованием магнезита; в расплаве был растворен только непрореагировавший с силикатами остаток CO2; (3) при 1350°С образования магнезита в экспериментах зафиксировано не было; следовательно, весь молекулярный CO2, введенный в систему, при параметрах экспериментов был растворен в расплаве. Допущение (1) базируется на данных (Sokol, Kruk, 2021) для систем Lc–B10–H2O и Lc–GS–H2O, изученных при 5.5 ГПа и 1200–1350°С. Так же мы учитывали, что снижение давления приводит к снижению стабильности магнезита (Luth, 2009). Близкое к 1 мольное отношение количества введенного в системы CO2 и количества новообразованного магнезита доказывает, что весь магнезит в образцах, полученных при 3.0 ГПа и 1200°С, возник исключительно за счет CO2, источником которого была щавелевая кислота (рис. 6). За исключением одной фигуративной точки составов, все прочие располагаются ниже линии 1 : 1. Присутствие чешуек графита в продуктах экспериментов, а также предшествующие исследования в системах с карбонатно-водными флюидами (Сокол и др., 2004) свидетельствуют о том, что в наших экспериментах дополнительного CO2 не образовывалось. Таким образом, фактически дельта соответствует мольному количеству CO2, оставшемуся в расплаве.
Рис. 6.
Мольные отношения введенного в системы CO2 к количеству магнезита, образовавшегося при карбонатизации лерцолита. Линия 1 : 1 соответствует реакции карбонатизации оливина: 2Mg2SiO4 + 2CO2 = 2MgCO3 + Mg2Si4O6.
Допущение 2 построено на предположении, что в отсутствии магнезита весь молекулярный CO2 был растворен в расплаве. Однако, часть молекулярного CO2 могла быть растворена в карбонатно-силикатном расплаве в виде карбонат-иона ${\text{CO}}_{3}^{{2 - }}$ (Eggler, 1978; Brooker et al., 1999; Spickenbom et al., 2010; Mysen, 2013; Moussallam et al., 2015) по реакции (Eggler, 1978):
(1)
${\text{C}}{{{\text{O}}}_{2}} + 2{{{\text{Q}}}^{{\text{n}}}}\left( {{{{\text{M}}}^{{{\text{m + }}}}}} \right) \leftrightarrow {\text{CO}}_{3}^{{2 - }}\left( {{{{\text{M}}}^{{{\text{m + }}}}}} \right) + 2{{{\text{Q}}}^{{{\text{n + 1}}}}},$На рис. 7 приведены оценочные значения концентрации растворенного молекулярного CO2 в карбонатно-силикатном расплаве, буферируемой ассоциацией оливин-ортопироксен-магнезит при давлении 3.0 ГПа. Обращает на себя внимание, что расчетные значения снижаются с 14–23 мас. % при 1350°С до менее 10 мас. % при 1200°С. Со снижением растворимости молекулярного CO2 коррелирует рост концентрации SiO2 в расплаве. Отметим, что близкая к нулю растворимость CO2 оказалась именно в том расплаве, где концентрация SiO2 достигла максимума – 40 мас. %. Ранее нами уже было показано, что при 5.5 ГПа концентрация молекулярного CO2 в расплавах снижается от значений 20–25 мас. % в карбонатных расплавах до 26–32 мас. % при концентрации SiO2, характерных для “обычных“ кимберлитовых расплавов (Sokol, Kruk, 2021). Новые данные дополняют эти оценки. Как и при 5.5 ГПа, при 3.0 ГПа не наблюдается существенной вариации в концентрации растворенного молекулярного CO2 в расплавах из образцов Lc–B10 и Lc–GS.
Причины вскипания расплавов в двухстадийных экспериментах
Реконструкция процессов фазообразования на каждом из этапов двухстадийных экспериментов необходима для адекватной интерпретации их результатов. Поскольку первая стадия состояла в уравновешивании систем при 5.5 ГПа и 1350°С, то для реконструкции их фазового состава при этих параметрах мы использовали данные одностадийных экспериментов (Sokol, Kruk, 2021) с теми же составами систем. Можно видеть (рис. 3), что при 5.5 ГПа и 1350°С выбранные составы в зависимости от количества введенного OA обеспечивали в системе Lc–B10–CO2–H2O образование расплава и ассоциации фаз Ol-Opx-Grt-Mgs или Opx-Mgs, а в системе Lc–GS–CO2–H2O – расплава и магнезита. Промежуточная закалка образцов должна была привести к образованию закаленного расплава – агрегата дендритных кристаллов карбонатов и силикатов, в том числе и водосодержащего флогопита. Вероятно, часть летучих, растворенных в расплаве в молекулярной форме, после закалки осталась в межзерновом пространстве агрегата. После закалки расплавов в образцах сформировались плотные агрегаты дендритных кристаллов без макрополостей.
На второй стадии давление снижали с 5.5 до 3.0 ГПа и осуществляли повторный разогрев до температуры 1270°С. При этом агрегат дендритных кристаллов и сосредоточенные в межзерновом пространстве летучие компоненты вновь формировали расплав. В зависимости от растворимости, CO2 и H2O либо полностью растворялись в расплаве, либо могли образовать самостоятельную флюидную фазу. Сопоставление фотографий (рис. 3), свидетельствует о большой схожести образцов, полученных в одностадийных экспериментах при 5.5 ГПа и 1350°С (Sokol, Kruk, 2021) и после двухстадийных экспериментов со снижением давления с 5.5 до 3.0 ГПа и кратковременным снижением температуры с 1350 до 1270°С. В частности, в системе Lc–B10–CO2–H2O с небольшой добавкой OA снижение P-T параметров привело к исчезновению оливина из минеральной ассоциации Ol-Opx-Grt-Mgs и уменьшению доли магнезита. Поверхность зерен магнезита была корродирована. При закалке расплава сформировался дендритный агрегат карбонатов и силикатов, который в межзерновом пространстве содержал полости. Однако, их размеры и форма не позволяют нам однозначно интерпретировать их как следы существования флюида на второй стадии эксперимента.
Рост количества OA, введенного в систему Lc–B10–CO2–H2O, привел в двухстадийном эксперименте к формированию большой полости в центральной части образца и более мелких полостей в участках сосредоточения закаленного расплава (рис. 3б). Размеры полостей и их форма однозначно свидетельствует об образовании большого количества флюидной фазы на второй стадии эксперимента. В образце присутствуют также ортопироксен и магнезит. Сопоставление образцов на рис. 3 позволяет сделать вывод, что магнезит на второй стадии растворялся. Ортопироксен при этом оставался стабильной фазой. На это указывает то, что на поверхности между зоной расплава/флюида и зоной твердых фаз преобладает ортопироксен и на нем отсутствуют следы коррозии. Иная картина наблюдается в системе Lc–GS–CO2–H2O с большой добавкой OA (рис. 3в). Как и после первой стадии, после второй стадии эксперимента в этом образце присутствуют закаленный расплав и магнезит. В агрегате дендритных кристаллов находятся полости величиной до 100 мкм. Большая их часть расположена между закалочными кристаллами, однако некоторые все же имеют скругленные очертания. Мы полагаем, что мелкие пузырьки флюидной фазы существовали при P-T параметрах, соответствующих второй стадии эксперимента, однако не располагаем пока строгими доказательствами этого факта. Визуально количество магнезита уменьшилось, а его кристаллы слегка корродированы. При этом степень коррозии магнезита существенно ниже, чем в двухстадийных экспериментах в системе Lc–B10–CO2–H2O (рис. 3а–3в).
Анализ имеющихся данных позволяет нам назвать, как минимум, два фактора, которые могли обеспечить вскипание кимберлитоподобного расплава. Первый – это реакционное взаимодействие магнезита с расплавом. Второй фактор – это падение растворимости молекулярного CO2 в карбонатно-силикатном расплаве по мере снижения температуры и/или давления. Luth (2009) на основе расчетов оценивал границу стабильности магнезита при 1500°С в присутствии оливина и ортопироксена до давления 4–3 ГПа. В проведенных нами одностадийных экспериментах при 3.0 ГПа магнезит нестабилен в равновесии с кимберлитоподобным расплавом и ортопироксеном при 1350°С, но стабилен при 1200°С. Ранее предполагалось, что магнезит может разлагаться с выделением CO2 по реакции Mgs + En = Fo + Fl (Boyd, Gurney, 1982; Wyllie et al., 1983; Canil, 1990), либо по реакции Mgs + L= Fo + Fl, где L – кимберлитовый расплав (Luth, 2009). Проведенные нами эксперименты показали, что магнезит непосредственно реагировал с расплавом, в то время как ортопироксен в контакте с магнезитом не был корродирован и, значит, оставался стабильной фазой. На первый взгляд кажется, что получены экспериментальные подтверждения реализации реакции Mgs + L= Fo + Fl. Однако, в продуктах эксперимента с максимальным количеством новообразованного флюида, среди твердых фаз отсутствует оливин. В то время как в расплаве количество SiO2 оказалось ниже, а отношение MgO/CaO выше выявленного для одностадийных экспериментов тренда. Таким образом, реакцию можно записать: Mgs + L1= L2+ Fl. где L2 обогащена MgO и обеднена SiO2 в сравнении с составом расплава L1. Мы не обнаружили признаков реализации перитектической реакции ортопироксена с расплавом, во всех наших экспериментах эта фаза оставалась стабильной. Это не позволяет нам присоединиться к мнению авторов (Mitchell, 2008; Luth, 2009; Russell et al., 2012; Kamenetsky, Yaxley, 2015) о том, что при изученных нами P-T параметрах именно реакция ортопироксена с расплавом является основным источником CO2, необходимым для вскипания кимберлитовой магмы.
ЗАКЛЮЧЕНИЕ
Одностадийные эксперименты, выполненные нами в системах Lc–B10–CO2–H2O и Lc–GS–CO2–H2O при 3.0 ГПа и 1200 и 1350°С, а также двухстадийные эксперименты (первая 40-часовая стадия по уравновешиванию образцов при 5.5 ГПа, 1350°С и вторая, 15 минутная, моделирующая быстрый подъем магмы до уровней 3.0 ГПа, 1270°С) позволили выявить факторы способные обеспечить вскипание кимберлитоподобных расплавов на начальной стадии их подъема. В экспериментах кимберлитоподобные расплавы образовывались за счет растворения гранатового лерцолита в богатых летучими карбонатных расплавах. Расчеты показали, что в изученных системах при P = 3.0 ГПа падение температуры (от 1350 до 1200°С) влечет за собой резкое снижение растворимости молекулярного CO2 в карбонатно-силикатных расплавах (от 14–23 мас. % до <10 мас. %). Результаты одностадийных экспериментов позволили установить, что к снижению концентрации молекулярного CO2 в кимберлитоподобных расплавах приводит карбонатизация оливина, рост концентрации SiO2 и снижение температуры. Таким образом, при фиксированном количестве молекулярного CO2 вскипанию карбонатно-силикатных расплавов будет благоприятствовать отсутствие оливина в транспортируемом материале, снижение температуры и рост концентрации SiO2.
В двухстадийных экспериментах был установлен факт интенсивного вскипания расплава в системе Lc–B10–CO2–H2O. Выделения CO2 флюида при данных параметрах (3.0 ГПа и 1270°С) контролирует реакция магнезита с кимберлитоподобным расплавом: Mgs + L1= L2+ Fl, где расплав L2 богаче MgO и беднее SiO2 относительно исходного (L1). В этих экспериментах кристаллизации оливина не наблюдалось, а ортопироксен оставался стабильным. Таким образом, захват магнезита из карбонатизированного источника либо его образование на начальном этапе подъема магмы (P ~ ~ 5.5 ГПа и T ~ 1350°C) за счет частичной карбонатизации ксеногенного перидотитового материала кимберлитовым расплавом, богатым молекулярным CO2, может создать предпосылки для вскипания расплава при его подъеме (P ~ 3.0 ГПа; T ~ 1270°С). Реализация этого процесса наиболее вероятна непосредственно на фронте движения магмы, где карбонатизация оливина в перидотитовом материале могла быть наиболее полной. Полученные результаты также дают основание для вывода, что метасоматоз кимберлитоподобными расплавами при давлении 3.0 ГПа и температуре 1200°С способен приводить к образованию карбонатизированных, возможно флогопитсодержащих, лерцолитов.
Авторы выражают и благодарность В.С. Шацкому и А.Л. Рагозину за предоставленный для экспериментов образец ксенолита Уд-05-05, а также рецензентам А.В. Гирнису и А.Л. Перчуку за полезные замечания, которые позволили заметно улучшить представление материала.
Аналитические исследования выполнены в ЦКП многоэлементных и изотопных исследований СО РАН.
Исследование выполнено по государственному заданию ИГМ СО РАН.
Список литературы
Крук А.Н., Сокол А.Г., Пальянов Ю.Н. (2018). Фазовые отношения в системе гарцбургит-водосодержащий карбонатный расплав при 5.5–7.5 ГПа и 1200–1350°С. Петрология. 26(6), 583-598.
Пирсон Д.Г., Келли С.П., Похиленко Н.П., Бойд Ф.Р. (1997). Определение возрастов флогопитов из южноафриканских и сибирский кимберлитов и их ксенолитов лазерным 40Ar/39Ar методом: моделирование возраста извержения, дегазации расплава и состава мантийных флюидов. Геология и геофизика. 38(1), 100.
Сокол А.Г., Пальянов Ю.Н., Пальянова Г.А., Томиленко А.А. (2004). Кристаллизация алмаза во флюидных и карбонатно-флюидных системах при мантийных P,T параметрах часть 1. Состав флюида. Петрология. 9, 1-10.
Becker M., Le Roex A.P. (2006) Geochemistry of South African on- and off-craton, group I and group II kimberlites: Petrogenesis and source region evolution. J. Petrol. 47, 673-703.
Bohlen S.R., Boettcher A.L. (1982) The quartz ⇆ coesite transformation: a precise determination and the effects of other components. J. Geophys. Res.: Solid Earth, 87(B8), 7073-7078.
Boyd F.R., Gurney J.J. (1982) Low-calcium garnets: keys to craton structure and diamond crystallization. Carnegie Inst Wash Year Book. 81, 261-267.
Brey G.P., Bulatov V.K. Girnis A.V. (2009) Influence of water and fluorine on melting of carbonated peridotite at 6 and 10 GPa. Lithos. 112, 249-259.
Brey G.P., Bulatov V.K., Girnis A.V. (2011). Melting of K‑rich carbonated peridotite at 6–10 GPa and the stability of K-phases in the upper mantle. Chem. Geol. 281, 333-342.
Brey G.P., Bulatov V.K., Girnis A.V., Lahaye Y. (2008). Experimental melting of carbonated peridotite at 6–10 GPa. J. Petrol. 49, 797-821.
Brooker R.A., Kohn S.C., Holloway J.R., McMillan P.F., Carroll M.R. (1999). Solubility, speciation and dissolution mechanisms for CO2 in melts on the NaAlO2–2 join. Geochim. Cosmochim. Acta. 63(21), 3549-3565.
Canil D. (1990). Experimental study bearing on the absence of carbonate in mantle-derived xenoliths. Geology. 18, 1011-1013.
Eggler D.H. (1978). The effect of CO2 upon partial melting of peridotite in the system Na2O–CaO–Al2O3–MgO–SiO2–CO2 to 35 kb, with an analysis of melting in a peridotite-H2O–CO2 system. Am. J. Sci. 278, 305-343.
Enggist A., Luth R.W. (2016). Phase relations of phlogopite and pyroxene with magnesite from 4 to 8 GPa: KCMAS–H2O and KCMAS–H2O–CO2. Contrib. Mineral. Petrol. 171(11), 1-17.
Girnis A.V., Brey G.P., Ryabchikov I.D. (1995). Origin of group IA kimberlites: fluid saturated melting experiments at 45–55 kbar. Earth Planet. Sci. Lett. 134, 283-296.
Girnis A.V., Bulatov V.K., Brey G.P. (2011). Formation of primary kimberlite melts – constraints from experiments at 6–12 GPa and variable CO2/H2O. Lithos. 127, 401-413.
Girnis A.V., Ryabchikov I.D. (2005). Conditions and mechanisms of generation of kimberlite magmas. Geol. Ore Deposit. 47, 476-487.
Grassi D., Schmidt M.W. (2011). Melting of carbonated pelites at 8–13 GPa: generating K-rich carbonatites for mantle metasomatism. Contrib. Mineral. Petrol. 162, 169-191.
Kamenetsky V.S., Kamenetsky M.B., Weiss Y., Navon O., Nielsen T.F.D., Mernagh T.P. (2009). How unique is the Udachnaya-East kimberlite? Comparison with kimberlites from the Slave Craton (Canada) and SW Greenland. Lithos. 112, 334-346.
Kamenetsky V.S., Yaxley G.M. (2015). Carbonate–silicate liquid immiscibility in the mantle propels kimberlite magma ascent. Geochim. Cosmochim. Acta. 158, 48-56.
Kavanagh J.L., Sparks R.S.J. (2009). Temperature changes in ascending kimberlite magma. Earth Planet. Sci. Lett. 286, 404-413.
Kelley S.P., Wartho J.A. (2000). Rapid kimberlite ascent and the significance of Ar–Ar ages in xenolith phlogopites. Science, 289(5479), 609-611.
Kjarsgaard B.A., Pearson D.G., Tappe S., Nowell G.M., Dowall D.P. (2009). Geochemistry of hypabyssal kimberlites from Lac de Gras, Canada: Comparisons to a global database and applications to the parent magma problem. Lithos. 112S, 236-248.
Kopylova M.G., Matveev S., Raudsepp M. (2007). Searching for parental kimberlite melt. Geochim. Cosmochim. Acta. 71, 3616-3629.
Le Roex A.P., Bell D.R., Davis P. (2003). Petrogenesis of group I kimberlites from Kimberley, South Africa: Evidence from bulk-rock geochemistry. J. Petrol. 44, 2261-2286.
Lensky N.G., Niebo R.W., Holloway J.R., Lyakhovsky V., Navon O. (2006). Bubble nucleation as a trigger for xenolith entrapment in mantle melts. Earth Planet. Sci. Lett. 245(1–2), 278-288.
Luth R.W. (2009). The activity of silica in kimberlites, revisited. Contrib. Mineral. Petrol. 158, 283-294.
Maimon O., Lyakhovsky V., Melnik O., Navon O. (2012). The propagation of a dyke driven by gas-saturated magma. Geophys. J. Int. 189(2), 956-966.
Mitchell R.H. (2008). Petrology of hypabyssal kimberlites: relevance to primary magma compositions. J. Volcanol. Geotherm. Res. 174, 1-8.
Mitchell R.H., Giuliani A., O’Brien H. (2019). What is a kimberlite? Petrology and mineralogy of hypabyssal kimberlites. Elements. 15(6), 381-386.
Mysen B. (2013). Structure–property relationships of COHN-saturated silicate melt coexisting with COHN fluid: A review of in-situ, high-temperature, high-pressure experiments. Chem. Geol. 346, 113-124.
Moussallam Y., Morizet Y., Massuyeau M., Laumonier M., Gaillard F. (2015). CO2 solubility in kimberlite melts. Chem. Geol. 418, 198-205.
Palyanov Y.N., Kupriyanov I.N., Khokhryakov A.F., Borzdov Y.M. (2017). High-pressure crystallization and properties of diamond from magnesium-based catalysts. CrystEngComm 19, 4459-4475.
Palyanov Y.N., Kupriyanov I.N., Sokol A.G., Borzdov Y.M., Khokhryakov A.F. (2016). Effect of CO2 on crystallization and properties of diamond from ultra-alkaline carbonate melt. Lithos. 265, 339-350.
Peslier A.H., Woodland A.B. Wolff J.A. (2008). Fast kimberlite ascent rates estimated from hydrogen diffusion profiles in xenolithic mantle olivines from southern Africa. Geochim. Cosmochim. Acta. 72(11), 2711-2722.
Russell J.K., Porritt L.A., Lavallée Y., Dingwell D.B. (2012). Kimberlite ascent by assimilation-fuelled buoyancy. Nature. 481, 352-356.
Sharygin I.S., Litasov K.D., Shatskiy A., Safonov O.G., Golovin A.V., Ohtani E., Pokhilenko N.P. (2017). Experimental constraints on orthopyroxene dissolution in alkali-carbonate melts in the lithospheric mantle: implications for kimberlite melt composition and magma ascent. Chem. Geol. 455, 44-56.
Sokol, A.G., Kruk A.N. (2021). Role of CO2 in the evolution of Kimberlite Magma: Experimental constraints at 5.5 GPa and 1200–1450°C. Lithos. 386, 106042.
Sokol A.G., Borzdov Y.M., Palyanov Y.N., Khokhryakov A.F. (2015). High-temperature calibration of a multi-anvil high pressure apparatus. High Pressure Research. 35(2), 139-147.
Sokol A.G., Kruk A.N., Chebotarev D.A., Palyanov Y.N. (2016). Carbonatite melt–peridotite interaction at 5.5–7.0 GPa: Implications for metasomatism in lithospheric mantle. Lithos. 248, 66-79.
Sokol A.G., Kruk A.N., Palyanov Y.N., Sobolev N.V. (2017). Stability of phlogopite in ultrapotassic kimberlite-like systems at 5.5–7.5 GPa. Contrib. Mineral. Petrol. 172(4), 21.
Spickenbom K., Sierralta M., Nowak M. (2010). Carbon dioxide and argon diffusion in silicate melts: insights into the CO2 speciation in magmas. Geochim. Cosmochim. Acta. 74(22), 6541-6564.
Stamm N., Schmidt M.W. (2017). Asthenospheric kimberlites: volatile contents and bulk compositions at 7 GPa. Earth Planet. Sci. Lett. 474, 309-321.
Stone R.S., Luth R.W. (2016). Orthopyroxene survival in deep carbonatite melts: implications for kimberlites. Contrib. Mineral. Petrol. 171, 63.
Sun C., Dasgupta R. (2019). Slab–mantle interaction, carbon transport, and kimberlite generation in the deep upper mantle. Earth Planet. Sci. Lett. 506, 38-52.
Wyllie P.J., Huang W.L. (1975). Peridotite, kimberlite, and carbonatite explained in the system CaO–MgO–SiO2–CO2. Geology. 3(11), 621-624.
Wyllie P.J. (1980). The origin of kimberlite. J. Geophys. Res., 85, 6902-6910.
Wyllie P.J. (1977). Peridotite-CO2–H2O and carbonatitic liquids in the upper asthenosphere. Nature. 266, 45-57.
Wyllie P.J., Huang W.L., Otto J., Byrne A.P. (1983). Carbonation of peridotites and decarbonation of siliceous dolomites represented in the system CaO–MgO–SiO2–CO2 to 30 kbar. Tectonophysics. 100(1–3), 359-388.
Дополнительные материалы отсутствуют.