Геохимия, 2022, T. 67, № 11, стр. 1101-1108
Энтальпия образования бразилианита (по калориметрическим данным)
Л. П. Огородова a, *, Ю. Д. Гриценко a, b, **, М. Ф. Вигасина a, С. В. Вяткин a, Л. В. Мельчакова a, Д. А. Ксенофонтов a
a Московский государственный университет им. М.В. Ломоносова Геологический факультет
119991 Москва, Ленинские Горы, 1, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
* E-mail: logor48@mail.ru
** E-mail: ygritsenko@rambler.ru
Поступила в редакцию 20.04.2022
После доработки 12.05.2022
Принята к публикации 12.05.2022
- EDN: TKJFPG
- DOI: 10.31857/S0016752522110103
Аннотация
Исследован бразилианит Na0.91Al3.03(PO4)1.98(OH)4.06 (Галилея, Минас-Жерайс, Бразилия) методами термического и электронно-микрозондового анализа, порошковой рентгенографии, ИК, КР и ЭПР спектроскопии. Методом ЭПР установлено, что особенностью исследованного образца является присутствие структурной примеси ванадия. Методом калориметрии растворения в расплаве бората свинца 2PbO∙B2O3 на микрокалориметре Кальве “Setaram” (Франция) определена энтальпия образования бразилианита NaAl3(PO4)2(OH)4 из элементов ∆fH0(298.15 K) = –5322.3 ± 5.1 кДж/моль. Оценено значение абсолютной энтропии S0(298.15 K) = 303.8 ± 0.9 Дж/(моль · K), рассчитаны энтропии образования ∆fS0(298.15 K) = –1407.1 ± 1.1 Дж/(моль · K) и энергия Гиббса образования из элементов ∆fG0(298.15 K) = ‒4902.8 ± 5.1 кДж/моль.
ВВЕДЕНИЕ
Бразилианит – основной фосфат натрия и алюминия NaAl3(PO4)2(OH)4. В качестве изоморфных примесей в позициях катионов может содержать Fe, Mn, Ba, Sr, Ca, Mg, Na, K, в позиции гидроксильных групп – F и Cl, а анион [PO4]3– может замещаться на [VO4]3– или [AsO4]3–. Впервые бразилианит был найден в 1944 году в пегматитах Коррегу-Фриу в районе Линополис (штат Минас-Жерайс, Бразилия) и назван по месту своего первого обнаружения. В настоящее время самыми значительными месторождениями бразилианита являются бразильские штаты Эспириту-Санту и Минас-Жерайс, где найденные кристаллы бразилианита достигают размеров 12 × × 8 см. Он встречается также в пегматитах некоторых стран Европы (Австрии, Германии, Чехии) и Северной Америки (США и Канаде).
В большинстве случаев бразилианит описывается как относительно низкотемпературный гидротермальный минерал в богатых фосфатами зонах гранитных пегматитов. Он встречается вместе с кварцем, мусковитом, турмалином, бериллом, иногда образует срастания с другими, в том числе и самыми низкотемпературными фосфатами – фторапатитом, дзанадзиитом Ca2Mg5Be4(PO4)6(OH)4·6H2O, горманитом (Fe2+,Mg)3(Al,Fe3+)4(PO4)4(OH)6·2H2O, сузалитом (Mg,Fe2+)3(Al,Fe3+)4(PO4)4(OH)6·2H2O, скорцалитом Fe2+Al2(PO4)2(OH)2, бераунитом Fe2+${\text{Fe}}_{5}^{{3 + }}$(PO4)4O(OH)4·6H2O, чилдренитом Fe2+Al(PO4)(OH)2·H2O, дюфренитом Ca${\text{Fe}}_{2}^{{2 + }}{\text{Fe}}_{{10}}^{{3 + }}$(PO4)4(OH)12·4H2O, фронделитом Mn2+${\text{Fe}}_{4}^{{3 + }}$(PO4)3(OH)5, джанситом Ca Fe2+Mg2${\text{Fe}}_{2}^{{3 + }}$(PO4)4(OH)2·8H2O, росшеритом Ca2${\text{Mn}}_{5}^{{2 + }}$Be4(PO4)6(OH)4·6H2O, сабугалитом HAl(UO2)4(PO4)4·16H2O, штрунцитом Mn2+${\text{Fe}}_{2}^{{3 + }}$(PO4)2(OH)2·6H2O, уиллиитом (Na,Ca,Mn)(Mn,Fe)(Fe,Mg)Al(PO4)3 (Kostov, Dencheva, 2017). Бразилианит также образуется в результате метасоматического замещения минералов ряда амблигонит – монтебразит в участках пегматитовых тел, которые пересекаются более поздними гидротермальными жилами. Амблигонит LiAl(PO4)F при температурах выше 480°C в результате OH → F обмена замещается монтебразитом LiAl(PO4)(ОН) (Baldwin et al., 2000). Натромонтебразит NaAl(РО4)(OH) образуется при температурах ниже 450°C, когда происходит выщелачивание лития с заменой его на Na. Бразилианит завершает этот процесс, замещая натромонтебразит в ассоциации с фторапатитом.
Бразилианит кристаллизуется в моноклинной сингонии (пространственная группа P21/b, Z = 4). Cтруктура состоит из цепочек октаэдров AlO4(OH)2 и AlO3(OH)3, объединённых общими ребрами; цепи соединены через общие углы PО4 тетраэдрами, образуя трехмерный каркас с атомами Na, находящимися в искаженных полостях, располагающихся вдоль оси [100] (Gatta et al., 2013).
Имеющаяся в литературе информация о бразилианите представлена результатами физико-химических исследований этого минерала из месторождений Бразилии и Намибии. Изучение структуры и определение параметров элементарной ячейки было проведено нейтронографическим (Gatta et al., 2013) и рентгенографическим (Gatehouse, Miskin, 1974; Čobic et al., 2011; Kostov, Dencheva, 2017) методами. КРС и ИК спектроскопические исследования были выполнены в работе (Frost, Xi, 2012). Результаты ЭПР-спектроскопического изучения представлены в (Hill, Lehmann, 1978; Requardt et al., 1982; Landrath, Lehmann, 1987; Dencheva, Kostov, 2016).
Определение термодинамических свойств бразилианита и других фосфатов способствует развитию термодинамического моделирования процессов позднепегматитовой фосфатной минерализации. Настоящая работа является продолжением цикла исследований термодинамических свойств природных водных и гидроксилсодержащих фосфатов различного состава: вивианита ${\text{Fe}}_{3}^{{2 + }}$(PO4)2·8H2O (Ogorodova et al., 2017), псевдомалахита Cu5(PO4)2(OH)4 (Огородова и др., 2018), анапаита Ca2Fe(PO4)2·4H2O (Огородова и др., 2018), бобьерита Mg3(PO4)2·8H2O и ковдорскита Mg2(PO4)(OH)·3H2O (Огородова и др., 2020).
Целью настоящей работы является определение термодинамических свойств одного из гидроксилсодержащих природных фосфатов – бразилианита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы исследования и характеристика образца
Для исследований был выбран образец бразилианита № 84813 из коллекции Минералогического музея им. А.Е. Ферсмана РАН (район Галилея, штат Минас-Жерайс, Бразилия). Образец представлен фрагментами прозрачных кристаллов светло-желтого цвета с зеленоватым оттенком размером до 8 мм в ассоциации с пластинчатыми выделениями мусковита и кварцем.
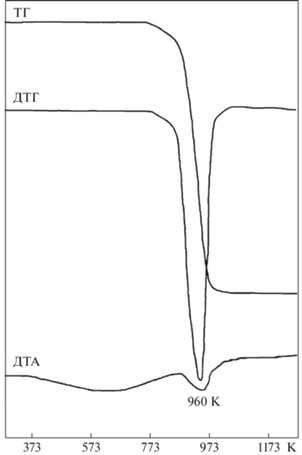
Термическое поведение минерала было изучено на дериватографе “Q-1500D” (Венгрия) от комнатной температуры до 1273 K, скорость нагрева составляла 20 K/мин, масса образца – 46.0 мг. На термогравиметрической кривой ТГ (рис. 1) в интервале 793–1063 K наблюдается потеря массы образца 10.3 мас. %, соответствующая его дегидроксилированию. На кривой ДТА этот процесс отражается эндотермическим пиком с максимумом при 960 K.
Химический анализ был выполнен на сканирующем электронном микроскопе с вольфрамовым термоэмиссионным катодом “JSM-6480LV” (Jeol Ltd., Япония), оборудованном энергодисперсионным спектрометром “X-Max-50” (Oxford Instruments Ltd., GB), при ускоряющем напряжении 20 кВ, силе тока 10.05 ± 0.05 нА. Обработка данных была произведена в программе INCA (Oxford Instruments, v. 22).
По данным микрозондового и термогравиметрического анализов был получен следующий химический состав изученного минерала (мас. %): Na2O 7.84, BaO 0.01, Al2O3 43.49, P2O5 39.07, H2O 10.3. Рассчитанная на 10 зарядов химическая формула минерала Na0.91Al3.03(PO4)1.98(OH)4.06 близка к идеальной NaAl3(PO4)2(OH)4, на которую и были рассчитаны все полученные в настоящей работе термодинамические величины.
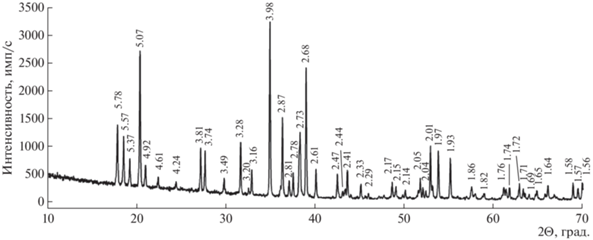
Рентгенографическое изучение было проведено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge(III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлялся в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора с углом захвата 5° по углу 2Θ с шириной канала 0.02°.
Полученный спектр (рис. 2) соответствует спектру бразилианита из пегматитов Бразилии согласно базам данных ICDD (The International Centre for Diffraction Data, 2013; карточка № 01-070-1004).
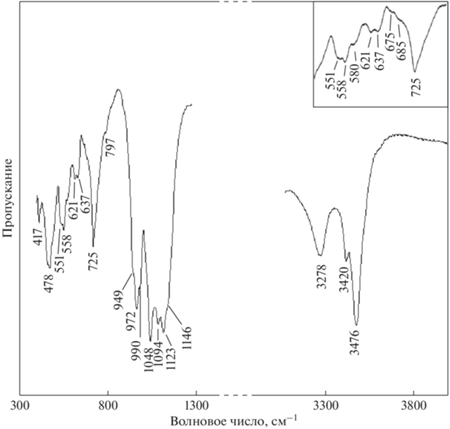
ИК-спектроскопическое исследование было выполнено на Фурье-спектрометре “ФСМ-1201” (Россия) в режиме пропускания на воздухе при комнатной температуре в диапазоне волновых чисел от 400 до 4000 см–1, накопление сигнала осуществлялось в течение 20 сканов при разрешении 4 см–1. Был изучен образец, приготовленный в виде суспензии 4 мг порошка минерала в вазелиновом масле. Приготовленная суспензия наносилась на пластинку из бромида калия, которая также была использована и в качестве образца сравнения до нанесения на нее минеральной суспензии.
Спектр ИК-поглощения (рис. 3) согласуется со спектрами образцов бразилианита из рудника Коррегу-Фриу (Frost, Xi, 2012) и района Консельейру-Пена (Chukanov, 2014), расположенных в штате Минас-Жерайс (Бразилия).
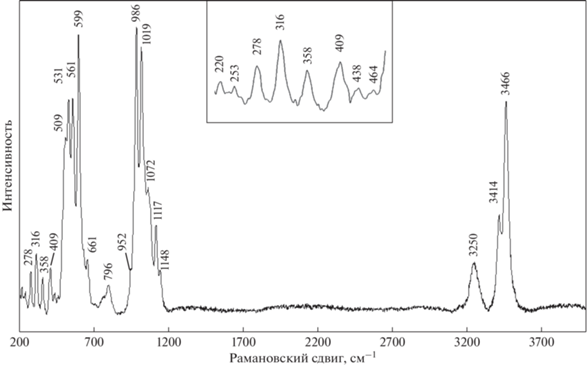
КР-спектроскопическое изучение было проведено на рамановском микроскопе “EnSpectrR 532” (Россия). Длина волны лазерного излучения равнялась 532 нм, выходная мощность луча составляла 7–8 мВт, голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение – около 6 см–1, диаметр фокального пятна при увеличении 40х равнялся 20 мкм. Спектр был получен в диапазоне от 100 до 4000 см–1 на неориентированном образце в режиме накопления сигнала в течение 1 с при усреднении по 100 экспозициям.
Полученный спектр КРС (рис. 4) также согласуется со спектром образца из рудника Коррегу-Фриу, представленным в (Frost, Xi, 2012), и с данными электронной базы RRUFF (Data base of Raman spectroscopy, X-ray diffraction and chemistry of minerals). Описание полученных спектров может быть выполнено с использованием результатов работ (Farmer, 1974; Накамото, 1991; Frost, Xi, 2012).
В высокочастотной спектральной области обоих спектров (рис. 3 и 4) зарегистрированы по три интенсивные полосы, относящиеся к валентным колебаниям гидроксильных групп, с максимумами поглощения в ИКспектре при 3476, 3420 и 3278 см–1 и с максимумами интенсивностей рассеяния в спектре КР при 3466, 3414 и 3250 см–1. Наличие трех компонентов с различными частотами указывает на существование в структуре минерала по крайней мере трех неэквивалентных структурных позиций гидроксильных групп, причем сдвиг максимумов полос поглощения и линий рассеяния в низкочастотную область в соответствии с (Farmer, 1974) может указывать на присутствие аниона (HOPO3)2–.
Серия полос ИК поглощения с волновыми числами 1146 плечо, 1123, 1094, 1048 см–1 и линий КР рассеяния частотами 1148 плечо, 1117, 1072 и 1019 см–1 относятся асимметричным валентным колебаниям ν3 аниона (PO4)3–. Интенсивная линия КР рассеяния с частотой 986 см–1 (рис. 4) и полоса поглощения малой интенсивности с волновым числом 990 плечо см–1 в ИК спектре (рис. 3) приписываются полносимметричным валентным колебаниям ν1 аниона (PO4)3–. Плечо слабой интенсивности при 952 см–1 (рис. 4) и полосы поглощения при 972 и 949 плечо см–1 (рис. 3) относятся к валентным колебаниям аниона (HOPO3)2– (Farmer, 1974).
Серия полос ИК (рис. 3 и врезка) поглощения с волновыми числами 797 плечо, 725, 685 плечо, 675 плечо, 637, 621, 580 плечо, 558 и 551 см–1, а также серия линий КР (рис. 4) рассеяния с частотами при 796, 661, 599, 561, 531 и 509 плечо см–1 приписываются деформационным колебаниям ν4 тетраэдров (PO4)3– и деформационным колебаниям аниона (HOPO3)2–.
Полосы ИК поглощения (рис. 3) с волновыми числами 478 и 417 см–1, а также линии рассеяния (рис. 4, врезка) со слабой интенсивностью при 464, 438 см–1 и линия при 409 см–1 относятся к деформационным колебаниям ν2 тетраэдров (PO4)3–. Линии рассеяния (рис. 4, врезка) в спектральной области ниже 400 см–1 приписываются к трансляционным колебаниям катионов и решеточным модам.
ЭПР спектроскопическое исследование бразилианита было проведено на ЭПР спектрометре “Varian E-115” (США–Швейцария) в X-диапазоне (~9.4 ГГц) при амплитуде модуляции 0.1 мТл с частотой модуляции 100 кГц и мощностью СВЧ излучения 5 мВт на кристалле бразилианита размерами 8 × 3 × 2 мм. Чувствительность метода позволяет обнаруживать свободные радикалы в количестве, начиная с 10–10 моля (Блюменфельд и др., 1962; Кукаев и др., 2014).
Спектр ЭПР исследованного образца имеет сложную структуру, образованную наложением сигналов от нескольких различных ЭПР-центров. В области g ≈ 4.3 регистрируется сильно анизотропный сигнал (рис. 5а), обусловленный примесными катионами Fe3+ согласно (Requardt et al., 1982; Dencheva, Kostov, 2016). Эта примесь в значительной мере отвечает за зеленоватый оттенок изученного бразилианита и является характерной для него. В области g ≈ 2.0 зафиксирован интенсивный сигнал (рис. 5б), за который, в соответствии с (Hill, Lehmann, 1978; Requardt et al., 1982; Landrath, Lehmann, 1987; Dencheva, Kostov, 2016) суммарно отвечают структурные дефекты полиэдров Al3+ и P5+.
Рис. 5.
Спектр ЭПР изученного бразилианита; вектор напряженности магнитного поля ($\vec {H}{\text{||}}b$).
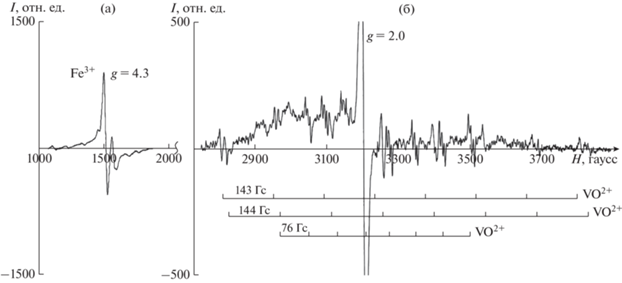
Наряду с сигналами от ЭПР центров, описанных ранее, в спектре исследованного образца (рис. 5б) был зарегистрирован слабый по интенсивности многокомпонентный сигнал, не зафиксированный в упомянутых выше ЭПР исследованиях. Этот спектр образован тремя частично перекрывающимися октетами линий с расщеплением до 144 Гс, что указывает на сильное сверхтонкое взаимодействие с ядром, обладающим магнитным моментом 7/2. Линии октетов отчетливо расщепляются на отдельные пики, являясь дублетами и триплетами; однако при каждой отдельной ориентировке кристалла во внешнем магнитном поле отчетливо разрешаются на отдельные пики лишь часть из них.
Принимая во внимание природное происхождение исследованного образца, распространенность в природе химических элементов, которые могут выступать в качестве незначительных примесей, а также значительный магнитный момент ядра, можно предположить, что полученный многокомпонентный ЭПР спектр (рис. 5б) принадлежит катиону 51V4+ с одним неспаренным электроном и спином равным si = 1/2, обеспечивающим парамагнитные свойства. Ванадий занимает 20 место по распространенности в Земной коре, изотоп 51V4+ стабилен, составляет 99.75% среди природных изотопов ванадия и имеет магнитный момент ядра sj = 7/2.
Во внешнем магнитном поле энергетический уровень неспаренного электрона со спином si = 1/2 расщепляется на два (mi = 2si + 1). За счет взаимодействия с магнитным моментом ядра каждый из этих уровней в свою очередь расщепляется еще на 8 подуровней (mj = 2sj + 1). Поскольку правилами отбора разрешены только переходы, для которых Δmi = ±1 и Δmj = 0, то в ЭПР спектре одиночного катиона 51V4+ может быть зарегистрирован сигнал, состоящий из восьми компонент. В свою очередь, наличие в спектре трех октетов линий указывает на занимаемые парамагнитным центром три неэквивалентные позиции, соответствующие трем позициям Al3+ в кристаллической структуре бразилианита. Компенсация заряда при вхождении 51V4+ в позицию Al3+, вероятно, может достигаться редукцией одной из окружающих 51V4+ групп OH– до О2–. При этом теряющий Н+ кислород может образовывать с ванадием двойную связь, формируя группу VO2+. Такая связь укорачивает соответствующее расстояние V–O, дополнительно искажая несовершенный координационный октаэдр, причем существуют несколько вариантов такого искажения – по числу атомов кислорода, способных потерять Н+ и образовывать двойную связь. Таким образом, возникают различные варианты размещения ванадия в виде группы VO2+ для каждого полиэдра Al3+ в кристаллической структуре, что также может приводить к дополнительному расщеплению пиков ЭПР спектра на две или три компоненты.
С другой стороны, можно было бы предположить, что расщепление составляющих октеты сигналов объясняется суперсверхтонким взаимодействием VO2+ с оставшимися в составе координационного полиэдра протонами, однако практически аналогичные триплетные структуры в спектре ванадиевого парамагнитного центра описаны в (Гейфман и др., 1998) в кристаллической структуре α-RbTiOPO4, при очевидном отсутствии в ней групп ОН–. Следует отметить, что описания катиона VO2+ в качестве парамагнитного центра в бразилианите пока не встречено, однако упоминание о его возможном существовании в структуре есть в работе (Dencheva, Kostov, 2016).
Сделанное предположение о присутствии примеси 51V4+ и возможности образования комплекса VO2+ в составе исследованного бразилианита позволяет объяснить сложную структуру полученного ЭПР спектра. Однако получить подтверждение наличия примеси ванадия в исследованном образце другими методами не удалось, вероятно, потому, что его концентрация ниже порогов чувствительности методов, примененных в данной работе.
Термохимическое исследование
На высокотемпературном теплопроводящем микрокалориметре Тиана-Кальве “Setaram” (Франция) было проведено определение энтальпии образования бразилианита методом калориметрии растворения в расплаве – растворителе состава 2PbO∙B2O3. Растворение осуществлялось на воздухе методом “сброса”: фрагменты образца бразилианита массой 3–9 (±2 × 10–3) мг сбрасывали от комнатной температуры в калориметр с расплавом, находящимся при T = 973 К; измеренный при этом тепловой эффект включал приращение энтальпии образца [(H0(973 K) – H0(298.15 K)] и энтальпию его растворения ΔраствH0(973 K). При использовании 30 г растворителя и проведении 6–8 экспериментов в одной порции расплава соотношение растворенное вещество – растворитель можно было отнести к бесконечно разбавленному раствору с пренебрежимо малой энтальпией смешения. Калибровку микрокалориметра проводили методом “сброса” эталонного вещества – платины в расплав в условиях экспериментов по растворению, при этом измерялось только приращение энтальпии Pt[(H0(973 K) – H0(298.15 K)], референсные значания для которого заимствовались из (Robie, Hemingway, 1995).
Среднее значение величины [H0(973 K) – ‒ H0(298.15 K) + ΔраствH0(973 K)] из 7 экспериментов, проведенных на микрокалориметре Кальве, составило 1178.9 ± 10.4 Дж/г = 426.7 ± 3.8 кДж/моль (М = 361.91 г/моль), погрешности определены с вероятностью 95%.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА БРАЗИЛИАНИТА NaAl3(PO4)2(OH)4
Энтальпия образования из элементов была рассчитана с использованием полученных калориметрических данных и термохимического цикла, включающего растворение минерала и составляющих его компонентов, по реакции (1) и уравнениям (2) и (3).
(1)
$\begin{gathered} 0.5{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + 4{\text{/3Al}}{{\left( {{\text{OH}}} \right)}_{3}} + {{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 5{\text{/}}6{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} = \\ {\text{ = }}\,\,{\text{NaA}}{{{\text{l}}}_{3}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}}{{\left( {{\text{OH}}} \right)}_{4}}, \\ \end{gathered} $(2)
$\begin{gathered} {{\Delta }_{{{\text{р - ции}}\left( {\text{1}} \right)}}}{{H}^{0}}(298.15\,{\text{K}}) = 0.5\Delta H{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,4{\text{/}}3\Delta H{\text{Al(OH}}{{)}_{3}} + \Delta H{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + 5{\text{/}}6\Delta H{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} - \\ - \,\,\Delta H{\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{{{\text{(OH}})}_{4}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\Delta }_{f}}{{H}^{0}}\left( {298.15{\text{ K}}} \right){\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{4}} = \\ = {{\Delta }_{{{\text{р - ции(1)}}}}}{{H}^{0}}\left( {298.15{\text{ K}}} \right) + \\ + \,\,0.5{{\Delta }_{f}}{{H}^{0}}\left( {298.15{\text{ K}}} \right){\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + \\ + {\text{ 4/3}}{{\Delta }_{f}}{{H}^{0}}\left( {298.15{\text{ K}}} \right){\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}}{\text{ + }} \\ {\text{ + }}\,\,{{\Delta }_{f}}{{H}^{0}}\left( {298.15{\text{ K}}} \right){{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{5}} + \\ + \,{\text{ }}5{\text{/}}6{{\Delta }_{f}}{{H}^{0}}\left( {298.15{\text{ K}}} \right){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпии образования бразилианита (кДж/моль)
| Компонент | H0(973 K) – H0(298.15 K) + ΔраствH0(973 K) | – ΔfH0(298.15 K)а |
|---|---|---|
| Na2O(к.) | –111.8 ± 0.8б | 414.8 ± 0.3 |
| Al2O3(корунд) | 107.38 ± 0.59в | 1675.7 ± 1.3 |
| P2O5(к.) | –326.5 ± 1.2г | 1504.9 ± 0.5 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9д | 1293.1 ± 1.2 |
Примечания. а Справочные данные (Robie, Hemingway, 1995). б По данным (Kiseleva et al., 2001). в Рассчитано с использованием справочных данных по [H0(973 K) – H0(298.15)] (Robie, Hemingway, 1995) и экспериментальных данных по растворению ΔраствH0(973 К) (Ogorodova et al., 2003). г По данным (Ushakov et al., 2001). д По данным (Огородова и др., 2011).
Таблица 2.
Термодинамические свойства бразилианита NaAl3(PO4)2(OH)4, полученные в настоящей работе
| –∆fH0(298.15 K), кДж/моль | S0(298.15 K), Дж/(моль K) | –∆fS0(298.15 K), Дж/(моль K) | –∆fG0(298.15 K), кДж/моль |
|---|---|---|---|
| 5322.3 ± 5.1а | 303.8 ± 0.9б | 1407.1 ± 1.1в | 4902.8 ± 5.1г |
Энергия Гиббса образования из элементов. Необходимое для расчета энергии Гиббса значение абсолютной энтропии бразилианита было рассчитано по аддитивной схеме по реакциям (4), (5) и (6) с использованием справочных данных по S0(298.15 K) для компонентов этих реакций из (Robie, Hemingway, 1995).
(4)
$\begin{gathered} \mathop {{\text{2AlP}}{{{\text{O}}}_{4}}\,}\limits_{{\text{берлинит}}} + {\text{Al}}{{\left( {{\text{OH}}} \right)}_{3}} + {\text{NaOH}} = \\ = {\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{4}}, \\ \end{gathered} $(5)
$\begin{gathered} \mathop {{\text{C}}{{{\text{a}}}_{{\text{5}}}}{{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{{\text{3}}}}\left( {{\text{OH}}} \right)}\limits_{{\text{гидроксиапатит}}} \, + 0.5{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + {\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + \\ + \,\,{\text{3/2A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} = {\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{4}} + {\text{AlP}}{{{\text{O}}}_{{\text{4}}}} + 5{\text{CaO}}, \\ \end{gathered} $(6)
$\begin{gathered} \mathop {{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{{\text{2}}}}}\limits_{{\text{витлокит}}} + {\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + {\text{NaOH}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} = \\ = {\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{{\text{4}}}} + 3{\text{CaO}}. \\ \end{gathered} $Значение S0(298.15 K) бразилианита (табл. 2) было рассчитана как среднее из полученных по уравнениям (4), (5) и (6) величин: 314.4 ± 0.8, 291.5 ± 2.1 и 305.4 ± 1.7 Дж/(моль K) соответственно. Значение ΔfS0(298.15 K) бразилианита (табл. 2) было рассчитано с использованием данных по S0(298.15 K) для элементов, входящих в состав минерала (Robie, Hemingway, 1995). Значение ΔfG0(298.15 K) бразилианита, вычисленное с учетом полученных данных по энтропии и энтальпии его образования, приведено в табл. 2.
Полученные впервые значения фундаментальных термодинамических констант бразилианита могут быть включены в базу термодинамических данных по минералам для построения моделей природного минералообразования, а также могут быть использованы при создании технологических схем получения синтетических аналогов.
Порошковый дифрактометр, сканирующий электронный микроскоп, инфракрасный Фурье-спектрометр, рамановский микроскоп, дериватограф, спектрометр ЭПР и микрокалориметр Тиана–Кальве установлены на геологическом факультете МГУ им. М.В. Ломоносова.
Список литературы
Блюменфельд Л.А., Воеводский В.В., Семенов А.Г. (1962) Применение электронного парамагнитного резонанса в химии. Новосибирск: Изд-во СО АН СССР, 240 с.
Гейфман И.Н., Головина И.С., Нагорный П.Г. (1998) ЭПР V4+ в монокристаллах α-RbTiOPO4. ФТТ. 40(3), 534-536.
Кукаев Е.Н., Куксин А.Ю., Тишкина А.О. (2014) Спектрометрия электронного парамагнитного резонанса. М.: Изд-во МФТИ, 38 с.
Накамото К. (1991) ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 504 с.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ. (9), 1609-1611.
Ogorodova L.P., Kiseleva I.A., Mel’chakova L.V., Vigasina M.F., Spiridonov E.M. (2011) Calorimetric determination of the enthalpy of formation for pyrophyllite.Russ.J. Phys. Chem. A. 85, 1492-1494.
Огородова Л.П., Мельчакова Л.В., Вигасина М.Ф., Гриценко Ю.Д., Ксенофонтов Д.А. (2018а) Калориметрическое изучение природного основного фосфата меди-псевдомалахита. Геохимия. (5), 485-489.
Ogorodova L.P., Melchakova L.V., Vigasina M.F., Ksenofontov D.A. (2018a) Calorimetric study of natural basic copper phosphate-pseudomalachite. Geochem. Int. 56(5), 484-487.
Огородова Л.П., Мельчакова Л.В., Вигасина М.Ф., Ксенофонтов Д.А., Брызгалов И.А. (2018б) Калориметрическое изучение природного анапаита. Геохимия. (4), 402-406.
Ogorodova L.P., Melchakova L.V., Vigasina M.F., Ksenofontov D.A., Bryzgalov I.A. (2018б) Calorimetric study of natural anapaite.Geochem. Int. 56(4), 397-401.
Огородова Л.П., Гриценко Ю.Д., Вигасина М.Ф., Косова Д.А., Мельчакова Л.В., Фомина А.Д. (2020) Природные водные ортофосфаты магния – бобьерит и ковдорскит: ИК- и КР-спектроскопическое, термическое и термохимическое исследования. Геохимия. 65(2), 153-164.
Ogorodova L.P., Gritsenko Yu.D., Vigasina M.F., Kosova D.A., Melchakova L.V., Fomina A.D. (2020) Natural aqueous magnesium orthophosphates – bobberite and kovdorskite: IR- and Raman-spectroscopic, thermal and thermochemical studies. Geochem. Int. 58(2), 189-199.
Baldwin J.R., Hill P.G., von Knorring O., Oliver G.J.H. (2000) Exotic aluminium phosphates, natromontebrasite, brazilianite, goyazite, gorceixite and crandallite from rare-element pegmatites in Namibia. Mineral. Magaz. 64(6), 1147-1164.
Čobič A., Zebec V., Scholz R., Bermanec V., Barreto S.B. (2011) Crystal morphology and xrd peculiarities of brazilianite from different localities. Nat. Croatica. 20(1), 1-18.
Chukanov N.V. (2014) Infrared Spectra of Mineral Species: Extended Library. Springer-Verlag GmbH, Dordrecht–Heidelberg–New York–London, 1726 p.
Dencheva S., Kostov R. (2016) New data on brazilianite from Minas Gerais, Brazil. Bulgarian Geological Society, National Conference with international participation “GEOSCIENCES 2016”, 19-20.
Farmer V.C. (1974) The infrared spectra of minerals. Mineralogical Society 41 Queens Gate, London SW7 5HR, 538 p.
Frost R.L., Xi Y. (2012) Molecular structure of the phosphate mineral brazilianite NaAl3(PO4)2(OH)4 – A semi precious jewel. J. Mol. Struct. 1010, 179-183.
Gatta G.D., Vignola P., Meven M., Rinaldi R. (2013) Neutron diffraction in gemology: Single-crystal diffractionstudy of brazilianite, NaAl3(PO4)2(OH)4. Am. Mineral. 98(8–9), 1624-1630.
Gatehouse B.M., Miskin B.K. (1974) The crystal structure of brazilianite, NaAl3(PO4)2(OH)4. Acta Crystallogr. 30, 1311-1317.
Hill F., Lehmann G. (1978) Atomic hydrogen in the mineral brazilianite NaAl3(PO4)2(OH)4. Z. Naturforsch. 33a, 1484-1486.
Kiseleva I.A., Navrotsky A., Belitsky I.A., Fursenko B.A. (2001) Thermochemical study of calcium zeolites – heulandite and stilbite. Am. Mineral. 86, 448-455.
Kostov R.I., Dencheva S. (2017) New data on the crystal morphology of brazilianite (Galiléia, Minas Gerais, Brazil). Bulgar. Chem. Comm. 49(A), 53-58.
Landrath K.D., Lehmann G. (1987) The strucrures of two hole centers in the mineral brazilianite NaAl3(PO4)2(OH)4. Z. Naturforsch. 37a, 280-286.
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta. 403, 251-256.
Ogorodova L., Vigasina M., Mel’chakova L., Rusakov V., Kosova D., Ksenofontov D., Bryzgalov I. (2017) Enthalpy of formation of natural hydrous iron phosphatite: vivianite. J. Chem. Thermodyn. 110, 193-200.
Requardt A., Hill F., Lehmann G. (1982) A firmly localized hole center in the mineral brazilianite NaAl3(PO4)2(OH)4. Z. Naturforsch. 42a, 572-576.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U S Geol. Surv. Bull. 2131.
Ushakov S.V., Helean K.V., Navronsky A., Boatner L.A. (2001) Thermochemistry of rare-earth orthophosphates. J. Mater. Res. 16(9), 2623-2633.
Дополнительные материалы отсутствуют.