Геохимия, 2022, T. 67, № 12, стр. 1297-1311
Формирование кислотности дождевых вод в залесенном бассейне Сихотэ-Алинской горной области
Н. К. Кожевникова a, *, А. Г. Болдескул b, **, Т. Н. Луценко b, Т. С. Губарева b, c, С. Ю. Лупаков b, В. В. Шамов b
a Федеральный научный центр биоразнообразия ДВО РАН
690022 Владивосток, пр. 100-летия Владивостока, 159, Россия
b Тихоокеанский институт географии ДВО РАН
690041 Владивосток, ул. Радио, 7, Россия
c Институт водных проблем РАН
119333 Москва, ул. Губкина, 3, Россия
* E-mail: nkozhevnikova@biosoil.ru
** E-mail: boldeskul@yandex.ru
Поступила в редакцию 02.03.2021
После доработки 31.03.2021
Принята к публикации 05.04.2021
- EDN: ZLCYRE
- DOI: 10.31857/S001675252211005X
Аннотация
Представлены результаты 7-летнего мониторинга макрокомпонентного состава и анализ формирования кислотности дождевых вод в фоновом районе Приморского края. Установлена внутрисезонная и межгодовая изменчивость их минерализации (М) и концентрации отдельных элементов. Из общей выборки было выделено 2 группы лет, характер атмосферной циркуляции которых сыграл важную роль в ионном балансе дождей. Выявлено, что в исследуемом районе выпадали преимущественно кислые осадки, pH которых, даже при низкой концентрации анионов сильных кислот, редко превышал значение 5.3. Для выявления факторов формирования кислотности дождевых вод в работе предлагается базу исходных данных ранжировать по величине фракционной кислотности. В ходе такого разделения выделяются блоки данных с высокой и низкой степенью нейтрализации кислотного потенциала. Внутри каждого блока определяются взаимосвязи величины рН и концентраций основных макрокомпонентов. В процессе анализа было установлено, что механизм формирования кислотных дождей определяется взаимным влиянием природных и техногенных источников. Показано, что соединения растворенного органического углерода (РОУ) участвовали, как в подкислении, так и нейтрализации дождевых вод. Полученные результаты указывают на преобладание природных факторов подкисления дождей. Однако, даже незначительное усиление антропогенной нагрузки в периоды циклональной активности, ведет к повышению кислотности атмосферных выпадений до критических величин.
ВВЕДЕНИЕ
Химический состав атмосферных осадков и их кислотность интенсивно изучаются в течение последних 40 лет. Подобные исследования дают объективную информацию о качестве воздушной среды и являются наиболее доступным и информативным способом оценки атмотехногенного загрязнения природных экосистем. Идентификация химических характеристик атмосферных вод помогает также оценить влияние различных источников на формирование их элементного состава и кислотности. Мониторинговые площадки для количественной оценки временной и пространственной изменчивости концентраций основных компонентов и потоков влажного осаждения созданы практически во всех густонаселенных регионах мира (Vet et al., 2014). Но исследованиям в удаленных от источников антропогенного загрязнения районах уделяется меньшее внимание. Между тем, полученные на фоновых станциях результаты являются важными показателями, по которым можно судить об оценках воздействия антропогенеза, изменении региональных климатических условий и биогеохимических процессов, о поступлении питательных веществ в экосистемы (Аржанова, Елпатьевский, 2005; Likens et al., 1987;). Как правило, в удаленных от источников загрязнения районах фиксируются слабокислые осадки с pH ниже величин 5.6–5.8, теоретически рассчитанных при фоновом содержании в атмосфере аммиака (NH3) диоксидов серы (SO2) и углерода (CO2) (Бримблкумб, 1988; Хорват, 1988). В отличие от индустриальных центров, где более 60% кислотности осадков определяется анионами сильных кислот, в геохимически чистых районах земли основной вклад в их кислотность вносит CO2 (Израэль и др., 1989). Однако, современные измерения атмосферных составляющих на фоновых территориях часто выявляют заметные антропогенные воздействия, связанные с дальним переносом загрязненных воздушных масс (Оболкин и др., 2013; Кондратьев, 2018; Баранов и др., 2020; Keene et al., 2015).
Важной особенностью климатических процессов Приморского края является выход на его территорию тропических и внетропических циклонов. Это определяет наличие в крае засушливых и очень влажных лет, а также внутригодовую неравномерность выпадения осадков. В среднем за год выпадает 500–1200 мм осадков, из них около 80% ‒ в виде дождей. Циклоны формируются в различных физико-географических и климатических зонах: Забайкалье, Монголии, Желтом море и примыкающих континентальных территориях Китая, Южно-Китайском море и прилегающих акваториях Тихого океана (Мезенцева и др., 2019). Состав примесей воздушных масс, вовлеченных в циркуляцию проходящих над краем циклонов, определяет особенности химического состава атмосферных выпадений. Установлено, что трансграничный перенос кислотосодержащих веществ является основным фактором, влияющим на ионный баланс и кислотность атмосферных осадков (Муха и др., 2012; Кондратьев, 2018). На трансграничный поток во Владивостоке, например, приходится до 30% всех выпадений сульфатов и нитратов, а снижение pH, по сравнению с 1980-ми годами, в городских и сельских районах края на сегодняшний день составляет более 15% (Кондратьев и др., 2017). Перенос воздушных масс, формирующихся над индустриальными провинциями Китая, обусловливает выпадение в Дальневосточном регионе осадков с повышенной концентрацией анионов сильных кислот и их аномально высокую кислотность (Муха и др., 2012; Кондратьев и др., 2013; Обзор состояния…, 2016). Рост повторяемости циклонов, зарождающихся над юго-восточными морями и Японией, а также Монголией и Забайкальем, определяет в осадках региона увеличение концентрации нитратов и терригенной примеси (Кондратьев, 2018; Мезенцева и др., 2019; Обзор состояния…, 2019).
Уровень кислотосодержащих веществ в атмосферных осадках Дальнего Востока России в настоящее время гораздо ниже, чем в промышленно более развитых странах Восточной Азии и индустриальных районах Европы (Duan et al., 2016; Chang et al., 2017; Keresztesi et al., 2019; Vet et al., 2014). Тем не менее, нарастание антропогенной нагрузки, привнос кислотосодержащих и загрязняющих веществ с атмосферными осадками, несомненно, влияют на биогеохимический баланс лесных экосистем и создают угрозу подкисления естественных биотических комплексов (Кожевникова, Болдескул, 2014; Кожевникова и др., 2017; Скирина и др., 2015; Du et al., 2017; Zhang et al., 2020). В связи с этим, изучение ионного состава и кислотности осадков в удаленных от основных источников загрязнения районах с сохранившимися естественными лесами, является актуальным. Подобные исследования дают возможность получить фоновые показатели состава и кислотности атмосферных выпадений в горных лесных бассейнах для дальнейшей индикации техногенного воздействия при условии нарастания уровня кислотной нагрузки в регионе. Целью настоящих исследований является изучение внутрисезонной и межгодовой изменчивости ионного состава и кислотности дождевых осадков в лесном бассейне Сихотэ-Алинской горной области и определение источников их формирования. Поскольку дождевые события регистрировались на репрезентативном водосборе в контрастные по климатическим показателям и количеству осадков сезоны, то настоящие исследования вполне могут отражать химические характеристики дождевых вод Центрального Сихотэ-Алиня.
МАТЕРИАЛЫ И МЕТОДЫ
Район исследования
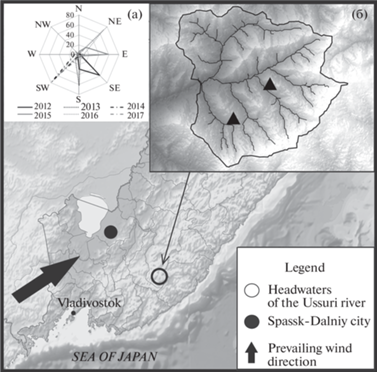
Объекты наших исследований расположены в континентальной части Приморского края, на Уссури-ханкайском (западном) макросклоне Сихотэ-Алинской горной области. Различные по возрасту и составу леса занимают более 80% его площади и играют первостепенную роль в регулировании водного режима, а также оказывают существенное влияние на изменение количества атмосферных осадков и их химического состава (Жильцов, 2008; Кожевникова, Дюкарев, 2011; Кожевникова, Болдескул, 2014). На распределение осадков большое влияние оказывают горный рельеф и характер циклонической активности. Мониторинговые площадки для изучения химического состава дождевых вод установлены на Верхнеуссурийском лесном стационаре (ВУС), принадлежащем Федеральному научному центру биоразнообразия ДВО РАН. ВУС (43.6°–44.3° с.ш.; 133.5°–134.5° в.д.) относится к бассейну Верхней Уссури и представляет собой ограниченный четкими водоразделами участок биосферы (рис. 1б). Исследуемая территория закрыта горными хребтами и удалена на ~400 км от морского побережья и более чем на 20 км от крупных транспортных магистралей и населенных пунктов. По природным характеристикам ландшафты ВУС типичны для среднегорного пояса Южного Сихотэ-Алиня и представлены наиболее сохранившимися в регионе хвойно-широколиственными лесами. Климат района исследований влажный умеренно-холодный. Средняя многолетняя температура воздуха с мая по октябрь составляет 11.8°C. В этот же период выпадает от 330 до 1079 мм осадков, около 70% из них – в июне–сентябре (Кожевникова, 2009). Различная интенсивность циклонической деятельности определяет внутригодовое распределение и многолетние колебания суммарного количества осадков. В летне-осенний период отклонения могут составлять 40–170% от нормы. Среднее число дней с осадками различной величины в год составляет 125–190.
Отбор проб и химический анализ дождевых вод
Дождевые воды на химический анализ отбирались систематически с мая по октябрь на 2-х участках, расположенных на высотах 560 и 670 м над уровнем моря. Метеорологические данные определялись здесь же автоматической станцией типа WS GP1 Delta-T (Великобритания), которая с 15‑минутным разрешением регистрировала температуру и влажность воздуха, осадки, направление и скорость ветра в течение всего периода наблюдений. Пробы дождя собирали с использованием полиэтиленовых конусообразных коллекторов, соединенных с пластиковой бутылкой объемом 2–5 л. Коллекторы были установлены на полянах в 3–4 м от деревьев и построек и на 100–150 см выше поверхности почвы. Каждый месяц было опробовано не менее трех дождей с количеством осадков от 3 мм. Если продолжительность дождя составляла более суток, то отбирались две порции: в начале и конце события. Коллекторы закрывались капроновой сеткой, предотвращающей попадание в пробу крупных насекомых и органических остатков, очищались после каждого дождя. Несмотря на защиту, в пробах присутствовали минеральные аэрозольные выпадения, мелкая пыльца и т.д. Всего было отобрано и проанализировано 94 пробы дождевых вод, которые интерпретируются нами как сумма влажных и сухих выпадений.
В пробах атмосферных осадков в день отбора измеряли pH и потенциометрическим титрованием по стандартной методике (Руководство…, 1977) определяли щелочность. Для дальнейшего анализа полученные пробы фильтровали через предварительно взвешенные мембранные фильтры с диаметром пор 0.45 мкм. Аликвоту для определения катионов подкисляли азотной кислотой до pH ~ 2. Образцы хранили в холодильнике и в течение одной–двух недель доставляли в Центр ландшафтной экодиагностики и ГИС-технологий ТИГ ДВО РАН, где выполнялись основные виды анализов. Содержание анионов (Cl–, ${\text{NO}}_{3}^{ - },$ ${\text{SO}}_{4}^{{2 - }}$) определялось на жидкостном хроматографе Shimadzu LC 10Avp; катионов (Ca2+, Mg2+ – методом атомной абсорбции; K+, Na+ – методом эмиссионной спектрометрии) – на спектрофотометре Shimadzu AA 6800. Определение содержания растворенного органического углерода (РОУ) в воде проводилось в форме NPOC (невыдуваемый органический углерод) с помощью ТОС-анализатора Shimadzu TOC-VCPN.
Для проверки полноты и качества аналитических данных был применен метод ионного баланса. Баланс катионов и анионов был оценен по уравнению R1 = 100%(K – A)/(K + A), где K и А – сумма основных катионов и анионов в мк-экв/л. Критерием надежности измеренных данных для вод с суммарной минерализацией менее 50 мк-экв/л определена величина R1 < ±30% (Network Center …, 2010). Отклонение от данной величины на 10–25% наблюдается в отдельных измеренных дождях ежегодно. В силу аналитических ограничений, нами не определялись катион N${\text{H}}_{4}^{ + }$ и органические кислоты. Дисбаланс чаще всего был связан с превышением анионов над катионами, так как в балансе не учтена концентрация иона аммония. Согласно литературным источникам его доля в дождях исследуемого региона может варьировать от 10 до 45% от суммы катионов (Обзор состояния …, 2016, 2019).
Анализ данных
База данных для вычисления и проведения статистического анализа группировалась по временным промежуткам. Концентрации макрокомпонентов определялись как средневзвешенные по объему выпавших за теплый сезон осадков. В ходе обсуждения кислотно-основных свойств дождевых вод был использован метод фракционной кислотности (Balasubramanian et al., 2001; Walna, 2013; Keresztesi et al., 2019). Фракционную кислотность FA (формула 1) использовали для оценки степени нейтрализации кислотности выпадающих дождей, вызванной азотной и серной кислотами. Чем ближе значение FA к единице, тем ниже процент нейтрализованной щелочными компонентами кислотности.
Формулы (1)–(2) были составлены на основе того факта, что ключевыми подкисляющими ионами в осадках были приняты ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }.$ Сумму этих анионов часто обозначают как кислотный потенциал, а сумму основных катионов – как нейтрализующий потенциал (Safai et al., 2004; Zhao et al., 2013; Zhang et al., 2014). Баланс между основными катионами и подкисляющими анионами оценивали посредством соотношения, нейтрализующего (ΣК) и подкисляющего (ΣAСК) потенциалов (Zhao et al., 2013):
(2)
$\frac{{\Sigma {\text{К}}}}{{\Sigma {\text{ACК}}}} = \frac{{{\text{C}}{{{\text{a}}}^{{2 + }}} + {\text{M}}{{{\text{g}}}^{{2 + }}} + {{{\text{K}}}^{ + }}}}{{{\text{SO}}_{4}^{{2 - }} + {\text{NO}}_{8}^{ - }}}.$Кроме того, роль каждого из катионов (Ki) в процессах нейтрализации кислот была объяснена посредством расчета фактора нейтрализации NF (Zhang et al., 2014; Keresztesi et al., 2019):
(3)
${\text{NF}} = {{{\text{K}}}_{{\text{i}}}}/({\text{SO}}_{4}^{{ - 2}} + {\text{NO}}_{3}^{{ - {\text{\;}}}}).~$Концентрация ионов в формулах выражена в мк-экв/л.
Для сравнительного анализа была проведена статистическая обработка данных с использованием программного пакета Statistica 10 (StatSoft). Доверительным принят 95-процентный интервал (р < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метеорологическая обстановка
Температура и влажность воздуха, характер выпадения осадков, сила и направление ветра ‒ основные показатели, оказывающие влияние на формирование химического состава осадков. Метеопараметры изучали в непосредственной близости от места отбора проб. Их анализ показал, что май‒октябрь в 2012‒2018 гг. был умеренно-влажным, маловетреным и жарким (табл. 1). Температура воздуха превысила среднемноголетние значения на 5‒12%. Согласно розе ветров (рис. 1а), преобладали ветра юго-восточных и юго-западных направлений. Скорость ветра редко превышала 2 м/с. Исключением были 2016 и 2018 гг., когда максимальная скорость во время прохождения тропических циклонов достигала 6–10 м/с.
Таблица 1.
Средние значения метеорологических параметров и химических компонентов за теплый период 2012–2018 гг.
| Метеорологические параметры |
2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2012–2014 | 2015–2018 |
|---|---|---|---|---|---|---|---|---|---|
| Температура, °С | 16.3 | 16.3 | 16.1 | 16.0 | 15.8 | 15.2 | 15.7 | 16.3 | 15.7 |
| Влажность, % | 80 | 87 | 83 | 87 | 90 | 69 | 88 | 83 | 84 |
| $\frac{{{\text{Осадки, мм}}}}{{{\text{\% }}\,{\text{от}}\,{\text{нормы}}}}$ | $\frac{{510}}{{114}}$ | $\frac{{438}}{{98}}$ | $\frac{{517}}{{116}}$ | $\frac{{334}}{{75}}$ | $\frac{{723}}{{162}}$ | $\frac{{382}}{{86}}$ | $\frac{{872}}{{196}}$ | $\frac{{489}}{{102}}$ | $\frac{{578}}{{121}}$ |
| Химические компоненты | Средневзвешенные значения, мк-экв/л | ||||||||
| ${\text{HCO}}_{3}^{ - }$ | 9.50 | 2.89 | 2.63 | 15.8 | 24.7 | 30.8 | 20.2 | 5.00 | 22.9 |
| Cl‒ | 25.5 | 5.95 | 10.6 | 17.3 | 6.80 | 4.98 | 8.45 | 14.0 | 9.38 |
| ${\text{SO}}_{4}^{{2 - }}$ | 31.2 | 28.6 | 30.5 | 17.5 | 25.3 | 22.7 | 5.33 | 30.1 | 17.7 |
| N${\text{O}}_{3}^{ - }$ | 21.0 | 14.6 | 16.0 | 17.6 | 20.3 | 18.2 | 5.14 | 17.2 | 15.3 |
| Ca2+ | 22.3 | 7.58 | 17.0 | 8.89 | 21.6 | 23.8 | 13.5 | 15.6 | 16.9 |
| Mg2+ | 6.19 | 2.17 | 3.79 | 1.87 | 4.35 | 4.51 | 2.95 | 4.05 | 3.42 |
| K+ | 31.2 | 4.67 | 7.32 | 4.27 | 9.91 | 11.2 | 3.52 | 14.4 | 7.23 |
| Na+ | 5.27 | 2.63 | 6.89 | 1.67 | 5.37 | 5.96 | 1.27 | 4.93 | 3.57 |
| H+ | 16.4 | 17.4 | 9.36 | 17.0 | 9.11 | 6.37 | 9.01 | 14.4 | 10.4 |
| М*, мг/л | 6.15 | 3.09 | 3.82 | 3.92 | 5.22 | 5.38 | 2.58 | 4.35 | 4.27 |
| РОУ, мг/л | 2.69 | 1.34 | 1.85 | 1.29 | 2.27 | 2.52 | 1.18 | 1.96 | 1.82 |
Большая часть исследуемых лет характеризовалась неравномерностью выпадения осадков и длительными сухими периодами между ними. Часто влага поступала на водосбор в виде непродолжительных дождей, сформированных в результате циркуляции местных воздушных потоков. Повторяемость осадков в количестве до 10 мм возрастала в наиболее сухие годы и составляла около 80% от всех дождевых событий. Основной объем осадков формировался во время прохождения циклонов. Осадки интенсивностью более 50 мм/сут наблюдались ежегодно, за исключением 2015 г. Суммарные осадки в 2012–2014 гг. были в пределах климатической нормы. Летне-осенний период 2015–2018 гг. отмечен чередованием сухих и чрезвычайно влажных лет (табл. 1). Количество осадков в июле–сентябре 2015 и 2017 гг. было на 15–25% ниже нормы, а в 2016 и 2018 гг. превысило среднемноголетнюю величину в 1.6–2 раза.
Ионный состав дождевых вод
Основные сведения о концентрациях макрокомпонентов в дождевых водах ВУС приведены в табл. 1. Для исследуемых дождей характерны значительные колебания концентраций большинства ионов, когда их максимальные значения в отдельных выпадениях могут в 5–10 раз превышать средние за теплый период. Подобная изменчивость связана с количеством, частотой и продолжительностью осадков, циркуляцией воздушных масс, температурным фоном и влажностью воздуха. Как отмечено в работе (Walna, 2013), высокая вариабельность концентраций ионов отражается на экологических свойствах растений и может стать причиной нестабильности экосистемы.
Минерализация дождевых вод на ВУС большинства образцов находилась в интервале от 3 до 15 мг/л. Ее средняя величина составила 4.81 ± ± 4.30 мг/л. Эти показатели соответствуют региональному фону (Чудаева и др., 2008), и близки к значениям, полученным для заповедных территорий Российской Федерации (Свистов и др., 2015; Обзор состояния…, 2019). Максимальная изменчивость суммарного содержания ионов наблюдалась в осадках объемом до 10 мм. Среднее значение минерализации в них составило 7.10 ± ± 6.43 мг/л. В сезон вегетации на состав осадков, особенно внутримассовых, большое влияние оказывает активизация биогенных процессов (Аржанова, Елпатьевский, 2005). В этот период были отобраны достаточно концентрированные воды с минерализацией более 10 мг/л и содержанием в них РОУ от 4 до 14 мг/л. Частота дождей с минерализацией выше среднемноголетней величины составила более 47%, причем, в их балансе, чаще всего, преобладали анионы сильных кислот (Болдескул и др., 2014). В дождях объемом более 10 мм диапазон величины минерализации сокращался от 11 до 0.5 мг/л, а ее среднее значение ‒ до 3.46 ± 2.55 мг/л, что в большей мере связано с эффектом разбавления. Повторяемость дождей более 10 мм с минерализацией выше среднемноголетней величины составила 22%, но только в 2-х образцах минерализация превысила величину 10 мг/л. Дискретные пробы воды, собранные в конце длительных интенсивных осадков, имели минерализацию ниже единицы.
Таблица 2.
Матрица коэффициентов корреляции Пирсона (n = 92, р < 0.05) основных химических компонентов дождевых вод Верхнеуссурийского стационара
| Компоненты | РОУ | НС${\text{O}}_{3}^{ - }$ | Cl– | ${\text{SO}}_{4}^{{2 - }}$ | N${\text{O}}_{3}^{ - }$ | Ca2+ | Mg2+ | K+ | Na+ | H+ |
|---|---|---|---|---|---|---|---|---|---|---|
| РОУ | 1.00 | |||||||||
| HCO3 | ‒ | 1.00 | ||||||||
| Cl | 0.61 | ‒ | 1.00 | |||||||
| SO4 | 0.47 | –0.31 | 0.21 | 1.00 | ||||||
| NO3 | 0.48 | ‒ | 0.30 | 0.80 | 1.00 | |||||
| Ca | 0.53 | ‒ | 0.35 | 0.69 | 0.64 | 1.00 | ||||
| Mg | 0.67 | ‒ | 0.49 | 0.43 | 0.67 | 0.81 | 1.00 | |||
| K | 0.69 | ‒ | 0.81 | 0.24 | 0.41 | 0.62 | 0.70 | 1.00 | ||
| Na | 0.44 | ‒ | 0.46 | 0.29 | 0.32 | 0.43 | 0.42 | 0.46 | 1.00 | |
| H+ | 0.21 | –0.49 | ‒ | 0.68 | 0.42 | 0.35 | 0.39 | ‒ | ‒ | 1.00 |
| М | 0.70 | ‒ | 0.57 | 0.78 | 0.80 | 0.70 | 0.62 | 0.62 | 0.45 | 0.28 |
Межгодовая вариабельность основных ионов в дождях на ВУС (табл. 1) может быть следствием активности выходящих на Приморский край различных типов циклонов. Из общей выборки данных выделяются 2 группы лет (табл. 1). В 2012–2014 годах основное количество осадков проступало на ВУС с континентальными циклонами, воздушные массы которых были обогащены терригенной примесью и кислотосодержащими веществами (Мезенцева и др., 2019). В анионном составе этих дождей преобладали сульфаты и нитраты. В циклональных осадках отмечены также высокие концентрации основных катионов, особенно кальция. Но сумма основных катионов в 70% образцов была меньше суммы анионов сильных кислот (табл. 3). Формула дождевых вод (соотношение основных ионов в %-эквивалентах) по М.Г. Курлову (Посохов, 1975) для этого периода имеет вид:
(4)
${{M}_{{ < 0.01}}}\frac{{{\text{SO}}_{4}^{{2 - }}45{\text{NO}}_{8}^{ - }24{\text{C}}{{{\text{l}}}^{ - }}19{\text{HCO}}_{8}^{ - }12}}{{{{{\text{H}}}^{ + }}41{\text{C}}{{{\text{a}}}^{{2 + }}}27{{{\text{K}}}^{ + }}16{\text{N}}{{{\text{a}}}^{ + }}9{\text{M}}{{{\text{g}}}^{{2 + }}}7}}{\text{pH}}\,{\text{3}}{\text{.8}} - {\text{5}}{\text{.7}}{\text{.}}$Таблица 3.
Медианы кислотности (pH) и соотношений эквивалента главных ионов в дождевых водах ВУС и сельских станций мониторинга EANET за июнь–сентябрь 2012–2017 гг.
| Пункт | Страна | pH | SO4/NO3 | ∑K/ ∑AСК |
SO4 + NO3, мк-экв/л | FA | NF Ca2+ |
NF K+ |
NF Mg2+ |
NF N${\text{H}}_{4}^{ + }$ |
|---|---|---|---|---|---|---|---|---|---|---|
| ВУС (настоящие исследования) | Россия | 4.80 | 1.26 | 0.67 | 30.1 | 0.49 | 0.53 | 0.15 | 0.10 | ‒ |
| Листвянка | Россия | 4.76 | 3.32 | 0.46 | 38.0 | 0.39 | 0.30 | 0.04 | 0.07 | 0.31 |
| Монды | 5.28 | 1.45 | 0.76 | 12.9 | 0.37 | 0.68 | 0.11 | 0.13 | 0.48 | |
| Приморская | 5.23 | 2.04 | 0.69 | 54.3 | 0.09 | 0.38 | 0.08 | 0.13 | 0.44 | |
| Цзиньюньшань | Китай | 4.73 | 2.74 | 0.54 | 95.8 | 0.12 | 0.45 | 0.03 | 0.06 | 0.45 |
| Сяопин | 4.77 | 1.51 | 0.64 | 56.8 | 0.17 | 0.42 | 0.04 | 0.10 | 0.49 | |
| Оки | Япония | 4.84 | 2.08 | 0.75 | 39.3 | 0.40 | 0.15 | 0.07 | 0.41 | 0.22 |
| Юсухара | 4.90 | 2.97 | 0.36 | 17.8 | 0.79 | 0.10 | 0.03 | 0.17 | 0.24 | |
| Имсил | Южная Корея |
5.52 | 1.12 | 0.63 | 40.0 | 0.05 | 0.08 | 0.12 | 0.03 | 0.73 |
| Канхва | 4.65 | 1.17 | 0.41 | 65.6 | 0.25 | 0.09 | 0.09 | 0.03 | 0.83 | |
| Ханчанабури | Таиланд | 5.78 | 1.58 | 1.16 | 6.96 | 0.15 | 0.94 | 0.11 | 0.36 | 0.88 |
| Сакаерат | 5.35 | 1.06 | 0.76 | 18.4 | 0.20 | 0.63 | 0.04 | 0.09 | 1.00 |
Примечания. Коэффициенты рассчитаны по формулам (1)–(3); прочерк означает отсутствие данных. Исходные данные получены из открытых источников сети мониторинга EANET (https://monitoring.eanet.asia/document/public/index).
Стоит также отметить характерную для теплого сезона 2012–2014 гг. невысокую продолжительность дождей и длительные (до 7–14 дней) интервалы между их выпадением. После бездождевых периодов собирались достаточно концентрированные растворы с повышенным содержанием калия и хлорид-ионов континентального происхождения (Кожевникова и др., 2017). Аналогичный рост K+ в летний период был зарегистрирован в дождевых осадках других залесенных территорий (Елпатьевский, 1993; Stallard, Edmond, 1981; Likens et al., 1994; Berger et al., 2008). По мнению авторов, высокое содержание K+ было вызвано его поступлением с аэрозолями, несущими минеральные и биогенные соединения.
Активные меры китайского правительства по сокращению эмиссии SO2 (Zheng et al., 2018), а также усиление частоты выхода южных циклонов (Мезенцева и др., 2019), вероятнее всего, определили снижение в дождевых водах 2015–2018 гг. концентрации основных кислотных агентов. Это в значительной мере сказалось на их содержании в составе анионов (формула 5). По данным Zhang et al., (2020) в атмосферных осадках, выпадающих в высокогорной залесенной местности Китая в 2017–2019 годы, установлено снижение в 3 раза концентрации сульфатов и возрастание на ~9% концентрации нитратов по сравнению с предыдущими исследованиями. Как отмечают авторы, кислотность осадков снизилась, но pH более 46% образцов был меньше значения 5.6. Роль тайфунов в снижении концентрации сульфатов и возрастании кальция в дождевых водах была отмечена в работе (Mkadam et al., 2008).
В исследуемых на ВУС дождях 2015‒2018 гг. отмечены рост концентрации нитратов по отношению к сульфатам, увеличение более чем в 2 раза гидрокарбонатов и ~1.5 раза кальция. Концентрация гидрокарбонатов в летне-осенних осадках была на 14‒28% выше, чем в аналогичный период 2012‒2014 гг. (табл. 1). Эквивалентное содержание ${\text{HCO}}_{3}^{ - }$ в составе анионов, по сравнению с 2012‒2014 гг., на 10‒20%, а в период прохождения тайфунов более чем на 50%, превысило величину сульфатов, что определило гидрокарбонатный тип дождевых вод. Формула химического состава применительно к 2015–2018 гг. имеет следующий вид:
(5)
${{М}_{{ < 0.01}}}\frac{{{\text{HCO}}_{3}^{ - }{\text{\;}}44{\text{\;SO}}_{4}^{{2 - }}24{\text{\;NO}}_{3}^{{ - {\text{\;}}}}20{\text{\;C}}{{{\text{l}}}^{ - }}12}}{{{\text{C}}{{{\text{a}}}^{{2 + }}}39{\text{\;}}{{{\text{H}}}^{ + }}35{\text{\;}}{{{\text{K}}}^{ + }}12{\text{\;N}}{{{\text{a}}}^{ + }}9{\text{\;M}}{{{\text{g}}}^{{2 + }}}6}}{\kern 1pt} {\text{pH\;}}4.3 - 6.1.$В эту группу лет входят очень влажные годы с длительными интенсивными дождями (табл. 1). Увеличение частоты осадков с количеством более 20 мм/сут стало, вероятнее всего, причиной снижения концентрации основных ионов в 2015–2018 гг. по сравнению с предыдущим периодом. Среднее соотношение сумм основных катионов и анионов сильных кислот было выше единицы в половине анализируемых вод. Как следствие, усилился нейтрализующий эффект и увеличилась частота поступления осадков с концентрацией свободных ионов H+ менее 5 мкг/л.
Кислотность дождевых вод
Как правило, атмосферные осадки имеют малую буферную емкость (Елпатьевский, 1993). Основными подкисляющими компонентами осадков являются серная и азотная кислоты. На кислотность дождевых вод влияют дальний перенос веществ и специфические природные условия, в которых они формируются. В частности, выпадению более кислых осадков способствует повышенная влажность воздуха (Свистов и др., 2015), величина которой на ВУС в июне–сентябре стабильно высокая и чаще всего сохраняется в диапазоне 75–90% (табл. 1).
Биотические компоненты района исследований также могут быть источником природных эмиссий диоксидов углерода и серы, оксида азота, органических кислот. Вклад CO2 в кислотность осадков фоновых районов составляет около 80%, а природные концентрации SO2, при малом содержании щелочных агентов, обеспечивают повышение кислотности дождевых вод до pH 4.5 (Израэль и др., 1989). Водорастворимые низкомолекулярные органические кислоты могут играть важную роль в подкислении осадков (Keene, Galloway, 1984; Sun et al., 2016). Исследователями (Likens et al., 1987; Huo et al., 2010; Keene et al., 2015; Conradie et al., 2016; Niu et al., 2018) установлено, что вклад органических анионов в потенциальную кислотность дождевых вод фоновых районов может составлять 10–69%, а их источником в период вегетации является растительность. Изотопный анализ углерода показал, что из биогенных источников происходит более 80% муравьиной и уксусной кислот (Glasius et al., 2001). Эти органические кислоты являются значимым фактором подкисления в удаленных от антропогенных источников районах (Millet, 2012; Niu et al., 2018; Stavrakou et al., 2012).
Концентрации РОУ в дождях ВУС варьировали от 0.3 до 6.7 мг/л, что сравнимо с суммой минеральных элементов. Его средневзвешенные значения (табл. 1) согласуются с данными 86 мониторинговых участков по всему мира (Iavorivska et al., 2016). Содержание РОУ увеличивалось в период активной вегетации и повышенного температурного фона, что может свидетельствовать о том, что биогенные выбросы растительности могут быть важным источником органических соединений в дождевой воде. Некоторая часть РОУ в циклональных осадках, формирующихся над индустриальными центрами и юго-восточными морями, может быть связана с антропогенными и/или морскими источниками (Sun et al., 2016).
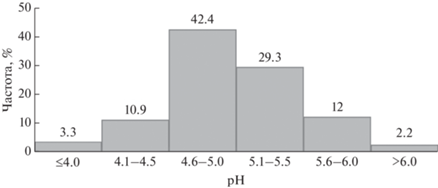
За период наблюдений значение pH на ВУС варьировало от 3.82 до 6.10 и в среднем составило 4.90 ± 0.51. Если осадки с pH ≤ 5.0 обозначить как кислые, то можно констатировать, что к этой категории относится более половины анализируемых вод (рис. 2). Около 14% дождей были очень кислыми (pH ≤ 4.5), а 3% из них имели pH менее 4.0. Осадки с pH ≥ 5.6 зафиксированы в 14% анализируемых проб. Сравнение показателей кислотности на ВУС и в залесенном бассейне на юге Китая (Huang et al., 2012) показало аналогичную частоту поступления осадков с pH более 5.5. Однако, кислотных дождей (pH < 4.5) на юге Китая выпадает больше, а с диапазоном pH от 4.5 до 5.5 – на 28% меньше, чем на ВУС. Такие различия в распределение кислотности вызваны более высокой концентрацией в Китае, как кислотных анионов, так и нейтрализующих кислоту катионов (Du et al., 2018).
Закисление осадков в течение летне-осеннего периода 2012–2017 гг. отмечено на большинстве сельских станций сети мониторинга EANET (табл. 3). Следует обозначить, что среднее значение pH в дождевых водах ВУС ниже величин, измеренных для расположенной в исследуемом регионе сельской станции EANET “Приморская”, хотя суммарное содержание (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$) на данной станции в ~2 раза выше. Этот факт можно объяснить более высокими концентрациями в дождях станции нейтрализующих катионов (табл. 3).
Межгодовая и внутрисезонная кислотность дождей на ВУС связана с вариабельностью концентраций главных компонентов, определяющих катионно-анионный баланс. Средний за сезон показатель pH редко превышал значение 5.3. Наименьшие вариации pH зафиксированы в период 2012–2014 гг. Водородный показатель более 70% образцов дождевой воды не превышал величину 5, а среднее значение pH за сезон в этот период составило 4.85. В 2015–2018 гг. повторяемость дождей с pH < 5 снизилась до 49%. Средняя величина pH выросла и составила 5.18.
Усиление кислотности дождей в исследуемые годы происходило пропорционально увеличению концентрации сульфатов, нитратов и органического углерода (табл. 2). Как видно из таблицы, основной вклад в подкисление дождевых вод вносят ионы ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }.$ Их эквивалентная доля в составе анионов варьировала в диапазоне 3‒72% и 3‒48% соответственно. Средний уровень ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ можно охарактеризовать, как фоновый (Обзор состояния…, 2019), хотя в отдельных дождях их содержание достигало 3‒14 и 1–10 мг/л соответственно. Согласно оценкам качественного изменения окружающей среды, такие концентрации кислотопродуцирующих анионов превышают экологическую норму (Свистов и др., 2010). В связи с этим, при обсуждении источников формирования кислотности, концентрации более 3 мг ${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {\text{л}}}} \right. \kern-0em} {\text{л}}}$ и 1 мг ${{{\text{NO}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{NO}}_{3}^{ - }} {\text{л}}}} \right. \kern-0em} {\text{л}}}$ были приняты нами, как повышенные. Достаточно высокая корреляция между ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ указывает на их происхождение из аналогичных источников. Низкие значения коэффициента корреляции между Н+ и анионами ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ можно объяснить тем, что кислотность контролируется не только этими ионами, а является результатом их взаимодействия в воде с другими компонентами (Huang et al., 2008). Дожди с повышенным содержанием ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ в одном и том же районе могут быть, как щелочными, так и кислыми (Anatolaki, Tsitouridou, 2009). Авторы аргументированно показывают, что основным фактором, контролирующим pH осадков в районе их исследований, является содержание в воде кальция. Кроме того, влияние на кислотность дождей может оказывать динамика анионного состава. Так, в районе наших исследований в 2012–2014 гг. сульфаты преобладали в суммарном солевом балансе (формула 4). Сопряженный анализ величины pH и содержания ${\text{SO}}_{4}^{{2 - }}$ в дождях этих лет показывает наличие близкой к линейной связи между этими показателями (r = –0.75, p < 0.05). В 2015‒2018 гг. корреляция между pH и содержанием анионов сильных кислот отсутствует. Вероятная причина – увеличение концентраций гидрокарбонатов и кальция (формула 5). Слабая, но значимая на уровне p < 0.05 корреляция между Н+ и РОУ связана, как это будет показано ниже, с наличием обратной зависимости между этими компонентами в менее кислых дождях. Исходя из вышесказанного следует отметить, что для многолетнего массива данных необходим более подробный анализ зависимостей между химическими компонентами при различных диапазонах кислотности.
Анализ факторов формирования кислотности дождевых вод
Чтобы оценить относительный вклад различных кислотных и нейтрализующих соединений в дождевой воде по формулам (1)–(3) были рассчитаны фракционная кислотность и нейтрализующая способность катионов. Дополнительно было определено соотношение эквивалентов ${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}},$ которое является мерой относительного вклада серы и азота в общую кислотность дождевых вод (Migliavacca et al., 2005).
В среднем за 7 лет соотношение ${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}$ на ВУС составило 1.73 ± 1.65, что согласуется с данными сельских станций сети мониторинга EANET (табл. 3) и дает основание считать серу основным подкисляющим элементом. В 2012–2014 гг. частота дождей с доминированием сульфатов над нитратами превышала 85%. В 2015–2018 гг. концентрация сульфатов уменьшилась (табл. 1), а вклад нитратов увеличился в 37% исследуемых образцов. Уменьшение, как концентрации, так и эквивалентного содержания сульфатов в составе анионов, вероятно, стало одним из факторов снижения кислотности дождей в 2015–2018 гг. по сравнению с предыдущим периодом.
Расчет фракционной кислотности (формула (1)) показал, что для исследуемых дождевых вод коэффициент FA варьировал от 0.02 до 2.12 и в среднем составил 0.60 ± 0.52. Величина FA выше, чем на большинстве сельских станций мониторинга EANET (табл. 3) указывает на то, что кислотность, вызванная ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - },$ была только частично (около 40%) нейтрализована основными катионами. Иные условия нейтрализации кислых компонентов в дождевых водах наблюдались в горно-лесных бассейнах Болгарии (Caggiano et al., 2014), сельских районах Китая (Zhao et al., 2013; Niu et al., 2017) и Европы (Keresztesi et al., 2019; Szep et al., 2018). Нагрузка сильных кислот в дождях выше указанных регионов почти на порядок превышала измеренные на ВУС, а эффект их нейтрализации составил 60‒98% (FA = 0.01–0.40). Подобный факт исследователи связывают с высоким содержанием в атмосферных осадках данных регионов кальция. На высокогорном фоновом участке среднее значение FA составило 1.16 ± ± 0.89 (Khan et al., 2018). Кислую природу дождевых вод (pH 4.98) авторы объясняют более низкой концентрацией поступающих катионов по отношению к анионам сильных кислот. Важная роль Ca2+ в нейтрализации кислотности атмосферных осадков очевидна и была отмечена многими исследователями (Смоляков и др., 2006; Conradie et al., 2016; Safai et al., 2004). Исследователи (Zhao et al., 2013) констатируют, что закисление дождевой воды меньше, когда долевое участие кальция в составе катионов выше, чем аммония, так как гидроксид кальция является более сильным основанием. Расчет коэффициента нейтрализации NF (форм. 3) подтверждает, что в исследуемом бассейне основным катионом, регулирующим кислотность, вызванную ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - },$ также был кальций (табл. 3). Удаленность от морского побережья определила очень низкие, по сравнению с дождевыми водами типично прибрежных районов (Чудаева, 2008; Huang et al., 2008), концентрации магния и натрия. В 80% анализируемых проб они были меньше 0.1 мг/л (табл. 1). Средние концентрации калия были существенно выше, и он определен вторым по степени нейтрализации кислоты катионом (табл. 3). Анализ концентраций Ca2+ и K+ показал, что чаще всего данные ионы наблюдались в диапазоне 0.1–0.5 мг/л. Пробы с содержанием Ca2+ и K+ более 1 мг/л встречались в 7–8% анализируемых дождей. Долевой вклад калия в катионный баланс увеличивался в более сухие годы, кальция и магния – во влажные.
Таким образом, суммарная концентрация Ca2+, K+ и Mg2+ была принята в качестве нейтрализующего потенциала (∑К в форм. 2). В ~59% анализируемых образцов ∑К была меньше кислотного потенциала (∑АСК в форм. 2). Поскольку кислотность определяется балансом между катионами и анионами, то дефицит основных катионов в дождях может быть значимым фактором их закисления.
Для более подробного анализа зависимостей между кислотностью и макрокомпонентами массив данных дождевых вод ранжировали по величине фракционной кислотности FA. Внутри каждого массива “FA” данные дополнительно разделили на дожди с pH меньше и больше 5.0 (табл. 4). Как уже отмечалось выше, если кислотность в дождевой воде вызвана азотной и серной кислотами и она не нейтрализована, то значение фракционной кислотности FA будет равно единице (Keresztesi et al., 2019). Чем меньше величина FA, тем выше степень нейтрализации кислотных анионов. В связи с этим, блок данных “FA < 0.5” обозначили, как дожди с высокой степенью нейтрализации, “FA > 0.5” – с низкой степенью нейтрализации. В отдельную группу были выделены дожди, в которых протонная нагрузка превысила содержание основных кислотосодержащих анионов (FA > 1). Разделение кислотности в табл. 4 основывали на том факте, что величину pH равную 5.0 в фоновых залесенных районах часто принимают как нижнюю границу естественного закисления осадков (Galloway et al., 1982; Аржанова, Елпатьевский, 2005).
Таблица 4.
Медианные значения концентрации макрокомпонентов и минерализации (мг/л) в дождевых водах с различными вариациями фракционной кислотности (FA) и pH
| Компоненты | FA < 0. 5 | FA > 0.5 | FA > 1.0 | ||
|---|---|---|---|---|---|
| pH < 5.0 | pH ≥ 5.0 | pH < 5.0 | pH ≥ 5.0 | ||
| HC${\text{O}}_{3}^{ - }$ | 0.18 | 1.46 | 0.05 | 1.70 | 0.98 |
| Cl‒ | 0.48 | 0.287 | 0.20 | 0.10 | 0.10 |
| ${\text{SO}}_{4}^{{2 - }}$ + N${\text{O}}_{3}^{ - }$ | 3.09 | 1.95 | 2.54 | 0.51 | 0.40 |
| ∑K | 1.37 | 0.67 | 0.70 | 0.24 | 0.27 |
| М | 5.48 | 4.40 | 3.55 | 2.37 | 1.89 |
| РОУ | 3.54 | 1.20 | 2.14 | 0.75 | 0.50 |
Дожди с высокой степенью нейтрализации серной и азотной кислот (FA < 0.5) составили 51% от общего количества анализируемых проб. Их воды более концентрированные относительно других дождей (табл. 4), с широким диапазоном кислотности – от 4.0 до 6.1 ед. Несмотря на высокую степень нейтрализации, дожди с pH меньше 5.0 составили 60% от массива “FA < 0.5”. Кислотность этих дождей тесно коррелировала с содержанием сульфатов и нитратов (табл. 5), доля которых от суммы анионов превышала 40%-эквивалентов в большинстве проб. Нейтрализация сильных кислот в среднем составила 65% и была связана, в основном, с повышенным содержанием кальция. Судя по корреляции (r = 0.83), Ca2+ имел с сульфатами один источник формирования. Его концентрация в этих дождях превышала в 1.5–4 раза среднее за годы наблюдений значение. Вероятно, такой концентрации Ca2+ при низком вкладе других катионов оказалось недостаточно для полной нейтрализации кислот, что привело к закислению дождевых вод. Так как высокие концентрации ${\text{SO}}_{4}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$ и Ca2+ были зафиксированы в циклональных осадках, поступающих в Приморский край из экономически развитых районов юго-восточной Азии, то можно говорить об их дальнем переносе и техногенном загрязнении (Кондратьев и др., 2017).
Таблица 5.
Корреляция между pH и основными макрокомпонентами, а также отношением сумм основных катионов и анионов сильных кислот (∑К/∑АСК) в дождевых водах ВУС с различными вариациями фракционной кислотности (FA) и pH
| Компоненты | FA < 0. 5 | FA > 0.5 | FA > 1.0 | ||
|---|---|---|---|---|---|
| pH < 5.0 | pH ≥ 5.0 | pH < 5.0 | pH ≥ 5.0 | ||
| HC${\text{O}}_{3}^{ - }$ | 0.48 | 0.64 | 0.74 | 0.40 | ‒ |
| Cl‒ | ‒ | ‒ | ‒ | ‒0.55 | ‒0.60 |
| ${\text{SO}}_{4}^{{2 - }}$ | ‒0.72 | ‒ | ‒0.92 | ‒0.63 | ‒0.48 |
| N${\text{O}}_{3}^{ - }$ | ‒0.65 | ‒ | ‒0.89 | ‒0.88 | ‒0.66 |
| РОУ | ‒ | 0.70 | ‒0.74 | ‒0.47 | ‒0.78 |
| ∑К/∑АСК | 0.35 | 0.33 | 0.64 | 0.95 | ‒ |
При уровне кислотности осадков до 10 мкг/л (pH > 5.0) нейтрализация сильных кислот усиливается и составляет более 80%. Такой высокий нейтрализующий эффект основывается на превышении основных катионов над (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$) в 70% анализируемых образцов. Дожди сульфатно-гидрокарбонатные, с содержанием РОУ, преимущественно, от 2 до 7 мг/л. В данную группу входят самые минерализованные осадки с pH, близким к равновесному значению 5.6. В этих дождях отмечена практически полная (75‒98%) нейтрализация кислотного потенциала. Для осадков с pH > 5.0 выявлена прямая зависимость между pH и РОУ (рис. 3a). Это может указывать на то, что в данных условиях органические вещества могут выступать одним из факторов, нейтрализующих анионы сильных кислот.
Рис. 3.
Зависимость кислотности осадков от содержания в них РОУ: (а) ‒ для дождей с FA < 0.5 (pH > 5.0); (б) ‒ для дождей с FA > 0.5.
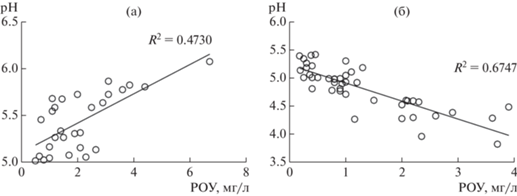
Регрессионный анализ для массива дождей с фракционной кислотностью FA от 0.5 до 3.2 показал наличие отрицательной линейной зависимости между pH и РОУ (рис. 3б). Диапазон pH дождей с низкой степенью нейтрализации (FA > 0.5) составил 3.8–5.4. Вариабельность суммарной минерализации, концентрации ионов и соотношения ∑К/∑АСК в осадках была существенной. В интервале pH от 3.8 до 4.9 зафиксированы максимальные концентрации, как сильных кислот, так и основных катионов (табл. 4). Минерализация при этом чаще всего находилась в интервале 3–7 мг/л. Эквивалентное содержание (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$) от суммы всех ионов в половине дождевых случаев отмечалось в диапазоне 50–76%, а доля основных катионов не опускалась ниже 20%-эквивалентов. Роль нейтрализующего потенциала (∑К) была весомой (табл. 5), но совместное влияние сильных кислот (∑АСК) и органических компонентов (рис. 3б) стало, по-видимому, определяющим фактором подкисления дождей. Маломинерализованные воды (М < 3 мг/л) с кислотностью до 10 мкг Н+/л поступали из промытой частыми дождями атмосферы. Концентрации сильных кислот в этих пробах находились в диапазоне фоновых значений (0.1–0.7 мг/л), а содержание гидрокарбонатов возросло до 63%-эквивалентов. Определяющую роль в нейтрализации сильных анионов играли кальций и калий, но их концентрации были в 2–3 раза ниже, чем в дождях с pH меньше 5.0. Более половины дождей поступало с тропическими циклонами, траектории которых, как правило, проходят над территорией Японии (Мезенцева и др., 2019). В выбросах этой страны доминируют окислы азота (Kim et al., 2004), что отразилось на соотношении ${{{\text{SO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{SO}}_{4}^{{2 - }}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}$ в исследуемых дождевых водах. Основным донором ионов водорода выявлена азотная кислота. Низкая степень нейтрализации дождей с pH > 5.0 могла быть вызвана поступлением ионов водорода с хлоридами и органическими компонентами (табл. 5; рис. 3б). Таким образом, закисление осадков с низкой степенью нейтрализации является следствием совместного влияния техногенных и природных источников с явным доминированием последних.
Образцы воды с FA > 1 соответствовали периодам продолжительных осадков в количестве не менее 25 мм и составили около 16% от всех анализируемых дождей. Коэффициент фракционной кислотности FA составил 1.1–3.2. Дожди слабокислые, низкоминерализованные. Величина pH изменялась от 4.6 до 5.3, минерализация дождей не превышала величину 2.8 мг/л. Корреляционный анализ показал наличие тесной значимой связи между pH, нитратами и хлоридами (табл. 5). Вероятно, с хлоридами поступали дополнительные протоны, что может объяснять увеличение порогового значения FA и подкисление дождей до pH ниже 5. Фоновые значения сульфатов и нитратов, доминирование гидрокарбонатов в составе анионов, малая минерализация (табл. 4) предполагают естественное закисление осадков с FA > 1.
Источники формирования кислотности
Выполненный в предыдущей главе анализ ионного баланса дождей показал наличие природных и антропогенно-обусловленных факторов формирования их кислотности. Основными критериями для выделения источников подкисления дождевых вод в горно-лесном бассейне можно определить: 1) концентрацию (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$); 2) эквивалентное содержание HCO3– по отношению к (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$); 3) соотношение нейтрализующего и кислотного потенциалов (∑К/∑АСК).
Об определяющей роли природных источников подкисления свидетельствует фоновая (<1 мг/л) концентрация основных кислотных анионов, повышенное содержание в воде гидрокарбонатов (${\text{HCO}}_{3}^{ - }$ > ${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$) и основных катионов (табл. 6). Минерализация 95% таких дождей находится в пределах 1‒3.5 мг/л. К ним отнесены все пробы с FA > 1. Донорами ионов водорода в этих водах определены анионы сильных и, возможно, слабых кислот. Концентрации основных катионов, хлоридов и нитратов в воде тесно взаимосвязаны с содержанием РОУ. Объединяющим их источником поступления в атмосферу может быть биогеоценоз. В остальных низкоминерализованных дождях естественное закисление вод происходит пропорционально снижению суммарной минерализации (rpH-M = 0.79, p < 0.05). При этом, чем выше долевой вклад катионов, тем меньше кислотность выпадающих дождей.
Таблица 6.
Фракционная кислотность (FA), минерализация и содержание макрокомпонентов в дождях с различными источниками формирования их химического состава
| Источники формирования |
n | FA | pH | % от суммы анионов | % от суммы катионов | М, мг/л |
РОУ, мг/л |
||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ${\text{HCO}}_{3}^{ - }$ | Cl– | ${\text{SO}}_{4}^{{2 - }}$ | ${\text{NO}}_{3}^{ - }$ | Ca2+ | H+ | ||||||
| Природные | 40 | 0.99 | 5.09 | 58.7 | 11.1 | 15.3 | 13.0 | 28.8 | 46.8 | 2.31 | 0.90 |
| Смешанные | 32 | 0.24 | 5.21 | 36.2 | 11.8 | 28.8 | 22.9 | 35.7 | 19.6 | 4.16 | 1.90 |
| Антропогенные | 20 | 0.24 | 4.79 | 2.62 | 7.51 | 49.7 | 30.5 | 34.7 | 32.6 | 6.87 | 2.30 |
В дождевых водах с суммарной концентрацией ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ от 1 до 3 мг/л формирование кислотности обусловлено комплексным воздействием природных и антропогенных факторов. Содержание ${\text{HCO}}_{3}^{ - }$ в составе анионов возрастает, но все еще меньше (${\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$) в 65% случаев (табл. 6). Величина pH изменяется от 4.3 до 6.1. В водах сохраняется тесная положительная связь pH с минерализацией (rpH-M = 0.72, p < 0.05), а гидрокарбонаты и органические анионы могут выступать в качестве нейтрализующих компонентов.
Обязательным условием выделения антропогенных факторов подкисления дождевых вод было суммарное содержание ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ более 3 мг/л (Свистов и др., 2010). По сравнению с другими осадками, их воды более минерализованные, с явным доминированием кислотного потенциала в анионном балансе (${\text{HCO}}_{3}^{ - } \ll {\text{SO}}_{4}^{{2 - }}$ + ${\text{NO}}_{3}^{ - }$). Суммарная концентрация основных катионов выше среднемноголетних значений. Хотя их сумма существенно уступала содержанию сильных кислот (табл. 6), эффект нейтрализации в большинстве образцов составил 76‒91%. Величина pH при этом изменялась от 4.37 до 5.07. Отмеченное уменьшение кислотности до pH > 5.5 было вызвано превышением основного нейтрализующего катиона Ca2+ над сульфатами (Ca/SO4 > 1.1). Коэффициент корреляции между pH и Ca/SO4 составил 0.74 (p < 0.05).
ЗАКЛЮЧЕНИЕ
Результаты мониторинга дождевых осадков на ВУС показали значительную сезонную и межгодовую вариабельность концентраций основных ионов. Полученные нами сведения о составе дождевых вод в целом не противоречат данным ЕANET. Средняя величина минерализации (4.70 ± 3.02 мг/л) соответствует региональному фону и близка к полученной для заповедных территорий Российской Федерации.
Выявлена смена состава сульфатно-кальциевых дождей (2012–2014 гг.) на гидрокарбонатно-кальциевые (2015‒2018 гг.), что связано с уменьшением количества циклонов, формирующихся над индустриальными центрами Китая. Отмечена тенденция постепенного увеличения средней величины pH. Одним из вероятных факторов снижения кислотности дождей в 2015–2018 гг. можно назвать уменьшение, как концентрации, так и доли сульфатов в составе анионов.
Для многолетнего массива данных была определена связь кислотности дождей с макрокомпонентами в различных диапазонах фракционной кислотности и величины pH. В ходе этого анализа корреляционные зависимости между химическими компонентами более тесные и достоверные, чем в целом за многолетний период, что позволяет выделить основные факторы формирования кислотности дождевых вод.
Установлено, что природное закисление происходит в низкоминерализованных осадках пропорционально снижению суммарной минерализации, и чем выше долевой вклад основных катионов, тем меньше кислотность выпадающих дождей. РОУ при этом проявляет буферные свойства. В более минерализованных дождях эффективная нейтрализация кислотности происходит за счет повышения концентрации кальция. РОУ в данных условиях может выступать одним из факторов, нейтрализующих анионы сильных кислот. Поскольку ионы ${\text{SO}}_{4}^{{2 - }}$ играют более значимую роль в формировании антропогенно-обусловленной кислотности, то соотношение Ca/SO4 может быть определяющим критерием степени нейтрализации дождевых вод с максимальной кислотной нагрузкой.
Таким образом, семилетний мониторинг химического состава осадков теплого сезона в районе с хорошо сохранившимися естественными лесами, позволил выделить роль природных и антропогенных источников в подкислении дождевых вод. В целом, полученные результаты указывают на преобладание природных факторов формирования ионного баланса и кислотности дождей. Однако, даже незначительное усиление антропогенной нагрузки в периоды циклональной активности, ведет к повышению кислотности атмосферных выпадений до критических величин. Механизм формирования кислотных дождей определяется взаимным влиянием природных и техногенных источников. Поскольку горные лесные экосистемы края чувствительны к кислотным выпадениям, то геохимическому мониторингу атмосферных осадков в таких районах следует уделять особое внимание.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 20-05-00812).
Список литературы
Аржанова В.С., Елпатьевский П.В. (2005) Геохимия, функционирование и динамика горных геосистем Сихотэ-Алиня (юг Дальнего Востока России). Владивосток: Дальнаука. 253 с.
Баранов Д.Ю., Моисеенко Т.И., Дину М.И. (2020) Геохимические закономерности формирования атмосферных выпадений в условно фоновом районе Валдайского национального парка. Геохимия. 65(10), 1025-1040.
Baranov D.Y., Moiseenko T.I., Dinu M.I. (2020) Geochemical trends in the formation of atmospheric precipitation in the conditionally background area of the Valdai national park. Geochem. Int. 58(10), 1159-1173.
Болдескул А.Г., Шамов В.В., Гарцман Б.И., Кожевникова Н.К. (2014) Ионный состав генетических типов вод малого речного бассейна: стационарные исследования в Центральном Сихотэ-Алине. Тихоокеанская геология. 33(2), 90-101.
Бримблкумб П. (1988) Состав и химия атмосферы. М.: Мир, 351 с.
Елпатьевский П.В. (1993) Геохимия миграционных потоков в природных и природно-техногенных геосистемах. М.: Наука, 254 с.
Жильцов А.С. (2008) Гидрологическая роль горных хвойно-широколиственных лесов Южного Приморья. Владивосток: Дальнаука, 331 с.
Израэль Ю.А., Назаров И.М., Прессман А.Я., Ровинский Ф.Я. (1989) Кислотные дожди. М.: Гидрометиздат, 243 с.
Кожевникова Н.К. (2009) Динамика погодно-климатических характеристик и экологические функции малого лесного бассейна. Сибирский экологический журн. (5), 693-703.
Кожевникова Н.К., Дюкарев В.Н. (2011) Эколого-защитные свойства лесного покрова верхнего пояса гор. Проблемы региональной экологии. (4), 31-38.
Кожевникова Н.К., Болдескул А.Г. (2014) Преобразование химического состава атмосферных осадков пологом коренных и производных хвойно-широколиственных лесов. Проблемы региональной экологии. (3), 29-35.
Кожевникова Н.К., Луценко Т.Н., Болдескул А.Г., Лупаков С.Ю., Шамов В.В. (2017) Водная миграция макроэлементов в хвойно-широколиственных лесах Сихотэ-Алиня. Сибирский лесной журн. (3), 60-73.
Кондратьев И.И. (2018) Межгодовая и сезонная изменчивость трансграничного потока техногенных загрязняющих веществ в Дальневосточном регионе. Вестник ДВО РАН. 2(198), 110-118.
Кондратьев И.И., Кубай Б.В., Семыкина Г.И., Качур А.Н. (2013) Влияние трансграничного и природного факторов на химический состав осадков в Дальневосточном регионе России. Метеорология и гидрологии. (10), 45-54.
Кондратьев И.И., Муха Д.Э., Болдескул А.Г., Юрченко С.Г., Луценко Т.Н. (2017). О химическом составе атмосферных осадков и снежного покрова в Приморском крае. Метеорология и гидрология. (1), 91-100.
Мезенцева Л.И., Гришина М.А., Кондратьев И.И. (2019). Траектории и глубина циклонов, выходящих на территорию Приморского края. Вестник ДВО РАН. 4(206), 29-38.
Муха Д.Э., Кондратьев И.И., Мезенцева Л.И. (2012) Трансграничный перенос кислотных осадков циклонами восточной Азии на юг Дальнего Востока России. География и природные ресурсы. (2), 21-26.
Обзор состояния и загрязнения окружающей среды в Российской Федерации за 2015 г. (2016) М.: Росгидромет, 204 с.
Обзор состояния и загрязнения окружающей среды в Российской Федерации за 2018 г. (2019) М.: Росгидромет, 225 с.
Оболкин В.А., Нецветаева О.Г., Голобокова Л.П., Потемкин В.Л., Зимник Е.А., Филлипова У.Г., Ходжер Т.В. (2013) Результаты многолетних исследований кислотных выпадений в районе Южного Байкала. Географ. и природные ресурсы. (2), 66-73.
Посохов Е.В. (1975) Общая гидрогеохимия. Л.: Недра, 208 с.
Руководство по химическому анализу поверхностных вод суши (1977) Л.: Гидрометеоиздат, 542 с.
Свистов П.Ф. (2015) Атмосферные осадки: химический состав и кислотность. Природа. (6), 28-36.
Свистов П.Ф., Полищук А.И., Першина Н.А. (2010) Качественная оценка загрязнения окружающей среды (по данным о химическом составе атмосферных осадков). Труды ГГО. (2), 4-17.
Скирина И.Ф., Родникова И.М., Скирин Ф.В. (2015) Лишайники Дальневосточного морского заповедника. включённые в Красные книги России и Приморского края. Biodiversity and Environment of Far East Reserves. (3), 125-137.
Смоляков Б.С., Шинкоренко М.П., Павлюк Л.А., Филимонова С.Н. (2006) Ионный состав и кислотность атмосферных осадков в Новосибирской области в 2000–2005 гг. Оптика атмосферы и океана. 19(6), 504-512.
Хорват Л. (1990) Кислотный дождь. М.: Стройиздат, 79 с.
Чудаева В.А., Чудаев О.В., Юрченко С.Г. (2008) Особенности химического состава атмосферных осадков на юге Дальнего Востока. Водные ресурсы. 35(1), 60-71.
Anatolaki C., Tsitouridou R. (2009) Relationship between acidity and ionic composition of wet precipitation. A two years study at an urban site, Thessaloniki, Greece. Atmos. Res. 92, 100-113.
Balasubramanian R., Victor T., Chun N. (2001) Chemical and statistical analysis of precipitation in Singapore. Water, Air & Soil Pollut. (130), 451-456.
Berger T.W., Untersteiner H., Schume H., Jost G. (2008) Throughfall fluxes in a secondary spruce (Picea abies), a beech (Fagus sylvatica) and a mixed spruce-beech stand. Forest Ecol. and Man. 255, 605-618.
Caggiano R., Fikova R., Trippetta S., Bratanova–Doncheva S., Ignatova N., Telesca L. (2014) An assessment of rainfall modification in mountainous ecosystems dominated by Fagus sylvatica L. and Picea abies (L.) Karst (Western Balkans, Bulgaria) by multivariate analyses. Eur. J. For. Res. 133(4), 699-711.
Chang C.T., Wang C.P., Chuan J.H., Wang L.J., Liu C.P., Lin T.C. (2017) Trends of two decadal precipitation chemistry in a subtropical rainforest in East Asia. Science of the Total Environment. 605–606(15), 88-98.
Conradie E.H., Van Zyl P.G., Pienaar J.J., Beukes J.P., Galy-Lacaux C., Venter A.D., Mkhatshwa G.V. (2016) The chemical composition and fluxes of atmospheric wet deposition at four sites in South Africa. Atmos. Environ. 146, 113-131.
Du E., de Vries W., McNulty S., Fenn M.E. (2018) Bulk deposition of base cationic nutrients in China’s forests: annual rates and spatial characteristics. Atmos. Environ. 184, 121-128.
Du E.Z, Dong D., Zeng X.T., Sun Z.Z., Jiang X.F., de Vries W. (2017) Direct effect of acid rain on leaf chlorophyll content of terrestrial plants in China. Sci. Total Environ. 605, 764-769.
Duan L., Yu Q., Zhang Q., Wang Z., Pan Y., Larssen T., Tang J., Mulder J. (2016) Acid deposition in Asia: emissions, deposition, and ecosystem effects. Atmos. Environ. 146, 55-69.
Galloway J.N., Likens G.E., Kneen W.C., Miller J.M. (1982) The composition of precipitation in remote areas of the world. J. Geophys. Res. 87(11), 8771-8786.
Glasius M., Boel C., Bruun N., Easa L.M., Hornung P., Klausen H.S., Klitgaard K.C., Lindeskov C., Moller C.K., Nissen H., Petersen A.P.F., Kleefeld S., Boaretto E., Hansen T.S., Heinemeier J., Lohse C. (2001) Relative contribution of biogenic and anthropogenic sources to formic and acetic acids in the atmospheric boundary layer. J. Geophys. Res.-Atmos. 106, 7415-7426.
Huang K., Zhuang G., Xu C., Wang Y., Tang A. (2008) The chemistry of the severe acidic precipitation in Shanghai, China. Atmospheric Research. 89(1–2), 149-160.
Huang L.M., Yang J.L., Zhang G.L. (2012) Chemistry and source identification of wet precipitation in a rural watershed of subtropical China. Chin. J. Geochem. 31(4), 347-354.
Huang Y., Wang Y., Zhang L., (2008) Long-term trend of chemical composition of wet atmospheric precipitation during 1986–2006 at Shenzhen City, China. Atmos. Environ. 42, 3740-3750.
Huo M.Q., Sun Q., Bai Y.H., Xie P., Liu Z.R., Li J.L., Wang X.S., Lu S.H. (2010) Chemical character of precipitation and related particles and trace gases in the North and South of China. J. Atmos. Chem. 67, 29-43.
Iavorivska L., Boyer E.W., De Walle D.R. (2016) Atmospheric deposition of organic carbon via precipitation. Atmos. Environ. 146, 153-163.
Keene W.C., Galloway J.N. (1984) Organic acidity in precipitation of North America. Atmos. Environ. 18, 2491-2497.
Keene W.C., Galloway J.N., Likens G.E., Deviney F.A., Mikkelsen K.N., Moody J.L., Maben J.R. (2015) Atmospheric wet deposition in remote regions: benchmarks for environmental change. J. Atmos. Sci. 72(8), 2947-2978.
Keresztesi Á., Birsan M.-V., Nita I.-A., Bodor Z., Szép R. (2019) Assessing the neutralisation, wet deposition and source contributions of the precipitation chemistry over Europe during 2000–2017. Environ Sci Eur. 31, 50-15.
Khan M.F., Nizam K., Maulud A.K.N., Latif M.T., Chung J.X., Amil N., Alia A., Nadzir M.S.M., Sahani M., Mohammad M., Jahaya M.F., Hassan H., Jeba F., Tahir N.M., Abdullah S.M.S. (2018) Physicochemical factors and their potential sources inferred from long-term rainfall measurements at an urban and a remote rural site in tropical areas. Sci. Total Environ. 613–614, 1401-1416.
Kim S.-T., Maeda Y., Tsujino Y. (2004) Assessment of the effect of air pollution on material damages in Northeast Asia. Atmos. Environ. 38(1), 37-48.
Likens G.E., Driscoll C.T., Buso D.C., Siccama T.G., Johnson C.E., Lovett G.M., Ryan D.F., Fahey T., Reiners W.A. (1994) The biogeochemistry of potassium at Hubbard Brook. Biogeochemistry. 25(2), 61-125.
Likens G.E., Keene W.C., Miller J.M., Galloway J.N. (1987) Chemistry of precipitation from a remote, terrestrial site in Australia. J. Geophys. Res. 92, 13299-13314.
Migliavacca D., Teixeira E. C., Wiegand F., Machado A.C.M., Sanchez J. (2005) Atmospheric precipitation and chemical composition of an urban site, Guaíba Hydrographic Basin, Brazil. Atmos. Environ. 39, 1829-1844.
Millet D. (2012) Atmospheric Chemistry: Natural atmospheric acidity. Nature Geosci. 5(1), 8-9.
Mkadam K.M., Ali S.M., Tokuyama A. (2008) A comparison of bulk precipitation chemistry during normal and typhoon events on subtropical Okinawa Island (Japan). Atmos. Res. 88, 108-115.
Network Center for EANET (2010) Technical Manual for Inland Aquatic Environment Monitoring in East Asia-2010. Network Center for EANET Press, Niigata.
Niu Y., Li X., Huang Z., Zhu C. (2017) Chemical characteristics and possible causes of acid rain at a regional atmospheric background site in eastern China. Air Qual Atmos Health. 10(8), 971-980.
Niu Y., Li X., Pu J., Huang Z. (2018) Organic acids contribute to rainwater acidity at a rural site in eastern China. Air Qual Atmos Health. 11(4), 459-469.
Safai P.D., Rao P.S.P., Momin G.A., Ali K., Chate D.M., Praveen P.S. (2004) Chemical composition of precipitation during 1984–2002 at Pune, India. Atmos. Environ. 38(12), 1705-1714.
Stallard R.F., Edmond J.M. (1981) Geochemistry of the Amazon: 1. Precipitation chemistry and the marine contribution to the dissolved load at the time of peak discharge. J. Geophys. Res. 86, 9844-9858.
Stavrakou T., Muller J.F., Peeters J., Razavi A., Clarisse L., Clerbaux C., Coheur P.F., Hurtmans D., De Maziere M., Vigouroux C., Deutscher N.M., Griffith D.W.T., Jones N., Paton-Walsh C. (2012) Satellite Evidence for a Large Source of Formic Acid from Boreal and Tropical Forests. Nature Geoscience. 5, 26-30.
Sun X., Wang Y., Li H., Yang X., Sun L., Wang X., Wang T., Wang W. (2016) Organic acids in cloud water and rainwater at a mountain site in acid rain areas of South China. Environ. Sci. Pollut. Res. 23, 9529-9539.
Szep R., Mateescu E., Nita I.-A., Birsan M.-V., Bodor Z., Keresztesi A. (2018) Effects of the Eastern Carpathians on atmospheric circulations and precipitation chemistry from 2006 to 2016 at four monitoring stations (Eastern Carpathians, Romania). Atmos. Res. 214, 311-328.
Vet R., Artz R.S., Carou S., Shaw M., Ro C.U., Aas W., Baker A., Bowersox V.C., Dentener F., Galy L.C., Hou A., Pienaar J.J., Gillett R., Forti M.C., Gromov S., Hara H., Khodzherm T., Mahowald N.M., Nickovic S., Rao P.S., Reid N.W. (2014) A global assessment of precipitation chemistry and deposition of sulfur, nitrogen, sea salt, base cations, organic acids, acidity and pH and phosphorus. Atmos. Environ. 93, 3-100.
Walna B. (2013) Interdisciplinary study of post–agricultural pollution in the Wielkopolski National Park (Poland). J. Integrative Environ. Sci. (10), 17-38.
Zhang N., Cao J., He Y., Xiao S. (2014) Chemical composition of rainwater at Lijiang on the Southeast Tibetan Plateau: influences from various air mass sources. J. Atmos. Chem. 71, 157-174.
Zhang Y., Cao Y., Qiao X., Tang Y., Zeng Y., Ying Q., Hopke P.K., Xu X., Xia Z. (2020) Wet deposition of sulfur and nitrogen at mt. Emei in the west China rain zone, southwestern China: status, inter-annual changes, and sources. Sci. Total Environ. 713, 136676.
Zhao M., Li L., Liu Z., Chen B., Huang J., Cai J., Deng S. (2013) Chemical Composition and Sources of Rainwater Collected at a Semi-Rural Site in Ya’an, Southwestern China. Atmospheric and Climate Sciences. 3(4), 486-496.
Zheng B., Tong D., Li, M., Liu F., Hong C.P., Geng G.N., Li H.Y., Li X., Peng L.Q., Qi J., Yan L., Zhang Y.X., Zhao H.Y., Zheng Y.X., He K.B., Zhang Q. (2018) Trends in China’santhropogenic emissions since 2010 as the consequence of clean air actions. Atmos.Chem. Phys. 18, 14 095-14 111.
Дополнительные материалы отсутствуют.