Геохимия, 2022, T. 67, № 2, стр. 191-202
Биогеохимическая миграция и аккумуляция химических элементов растениями в аквасистеме сбросного канала Кольской АЭС
И. Р. Елизарова a, *, Д. С. Бернадская a, **, Д. Б. Денисов a, А. В. Разумовская a
a Институт проблем промышленной экологии севера КНЦ РАН
184209 Апатиты, Мурманская обл., Россия
* E-mail: elizarir@yandex.ru
** E-mail: daria.tskp@mail.ru
Поступила в редакцию 08.03.2020
После доработки 11.10.2020
Принята к публикации 03.11.2020
- EDN: LWQUJD
- DOI: 10.31857/S0016752522020030
Аннотация
Методом масс-спектрометрии с индуктивно связанной плазмой определен максимально полный химический состав воды и тканей некоторых представителей высшей водной растительности в сбросном канале Кольской АЭС. Проведена оценка качества вод и рассчитаны коэффициенты биологического поглощения химических элементов в водных растениях. Определяющим фактором при накоплении в растениях химических элементов может являться их поглощение в виде гуматных комплексов, гидроксидных и карбонат-ионов. Установлено, что накопление катионов металлов, в том числе редкоземельных элементов (РЗЭ), в тканях растений коррелирует с константой стойкости гуминовых комплексов этих металлов. Наиболее активно происходит аккумуляция растениями Al, Ti, Fe, Ce, V, Y, Pr и La. Интенсивность бионакопления элементов в условиях влияния подогретых вод КАЭС на порядки выше, чем в озерах с естественным температурным режимом. Впервые для изучения миграции РЗЭ из водной среды в ткани растений было использовано нормирование на состав хондрита С1, которое позволило выявить приоритетное биопоглощение легких РЗЭ.
ВВЕДЕНИЕ
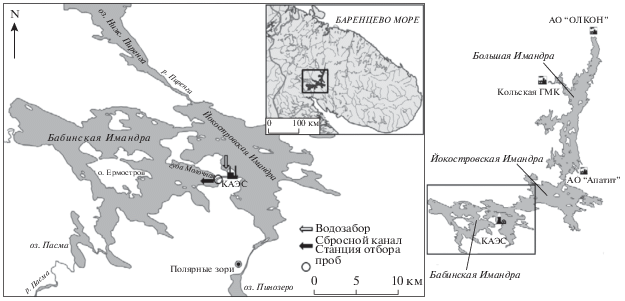
Кольский полуостров входит в арктическую зону России и является уникальной территорией, где наряду с мощным горнопромышленным комплексом сосредоточены объекты энергетики, что обуславливает значительное влияние на биогеохимические процессы в окружающей природной среде. Распространенность в водных экосистемах, миграционные свойства и биогеохимические особенности поведения химических элементов, в том числе тяжелых металлов (ТМ) и РЗЭ, представляют собой значительный научный интерес и требуют детального изучения. Реакторы Кольской АЭС (КАЭС), введенной в эксплуатацию в 1974 году, охлаждаются посредством прямоточной системы перекачки вод из одного плеса озера Имандра в другой (рис. 1). Поступление подогретых вод в значительной степени изменили температурный режим приустьевого участка акватории, кроме того, перекачка вод из сравнительно более загрязненного плеса негативно сказалась на качестве вод (Моисеенко и др., 2002). В то же время, сбросной канал КАЭС представляет собой уникальный тепловодный модельный объект, позволяющий анализировать процессы преобразования экосистем арктических водоемов в условиях современного потепления климата Арктики. Изучение биогеохимических процессов в арктических экосистемах, подверженных интенсивному промышленному загрязнению является актуальной научной задачей. Знание темпов биоаккумуляции различных химических элементов водными организмами необходимо для адекватной региональной оценки качества среды и уровня загрязнения токсичными соединениями, а также для разработки эффективных способов биологической очистки сточных вод. Количественные данные о содержании ТМ и РЗЭ в водных организмах могут послужить научной базой для нормирования антропогенной нагрузки на водоемы промышленного, рыбохозяйственного и питьевого назначения в АЗРФ.
Исследование химического состава водных растений является важным направлением современной аналитической химии и экологии. Определение элементного состава с целью выявления у растений аккумуляционных способностей производится при помощи таких высокотехнологичных методов анализа, как масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС) (Ефремов и др., 2017; Колесников и др., 2014; Васильева и др., 2014), атомно-эмиссионный анализ с индуктивно связанной плазмой (ИСП-АЭС) и атомно-абсорбционная спектрометрия (ААС) (Комулайнен, Морозов, 2010; Ткаченко, 2015), ИСП-МС анализ растений также является рабочим инструментом для биологов, которые исследуют свойства и физиологические особенности растений (Елисеева, Елисеев, 2011; Колесников, 2014) и экологов – для мониторинга окружающей среды (Бражная, 2012; Сорокина, 2012; Кузьминова, 2015).
Возрастание роли редкоземельных элементов (РЗЭ) в создании новых функциональных материалов, в развитии электроники, металлургии спецсплавов, магнитных материалов и т.д., а также активный рост цен на рынке редкоземельных металлов (РЗМ) приводят к увеличению добычи этих металлов (Баренбойм, Авандеева, 2014). Это позволяет рассматривать группу РЗЭ (Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu) как модельную для оценки антропогенного влияния на экосистемы, а изучение их распределения использовать для выявления путей и механизма миграции токсичных, тяжелых металлов.
Таким образом, распространенность в водных экосистемах, миграционные свойства, токсикологические и биогеохимические особенности редкоземельных элементов представляют собой значительный научный интерес и требуют детального изучения, особенно для арктических регионов и Кольского полуострова, где расположены крупнейшие месторождения редких, тяжелых и редкоземельных металлов.
Цель работы – изучение биогеохимической миграции и аккумуляции химических элементов высшими водными растениями экосистемы сбросного канала КАЭС.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Химическое поведение ионов РЗЭ обусловлено сходством их свойств из-за того, что они находятся в одной группе периодической системы, в природных средах имеют степень окисления +3, за исключением церия с его частичным окислением до +4 и европия с восстановлением до +2. Индивидуальные свойства РЗЭ постепенно меняются в пределах группы. Добавление электронов в 4f-оболочке приводит к увеличению заряда ядра, ионный радиус уменьшается на 0.02 нм от La к Lu (“лантаноидное сжатие”) (Щукарев, 1970–1974), происходит увеличение прочности связи металл–лиганд из-за уменьшения её длины и увеличения ковалентности в ряду РЗЭ. Такие физико-химические особенности РЗЭ приводят к их фракционированию в системах природные воды–водные растения–грунты и донные отложения, содержащие техногенные соединения РЗЭ. Кроме того, растворенные формы РЗЭ в природных водах находятся в контакте с растворенным коллоидным органическим веществом, гидроксидами, глинистыми минералами и неорганическими лигандами (Tang, Johannesson, 2003). Исследования авторов работы (Волков, 2016) подтверждают, что коллоидная фракция (от 1 нм до 0.45 мкм) воды рек и ручьев преобладает среди форм состояния РЗЭ.
Взаимодействие лантанидов (Ln) с гумусными кислотами (ГК) исследовали с помощью метода ИСП-МС в (Волков, 2016). Количественно описано связывание всех 13 редкоземельных элементов, а также Sc, Y, La речными и почвенными ГК в природных условиях. Авторами были установлены условные константы комплексообразования комплексов (Kc) в пределах 8.9 < lg Kc < 16.5 в зависимости от условий. Отмечено постепенное увеличение Kc от La к Lu на 2–3 порядка, что связано с уменьшением ионного радиуса Ln. Установлено, что ГК являются сильными комплексообразователями по отношению к Ln.
Авторы (Luo, Byrne, 2004) утверждают, что гидроксидные и карбонат-ионы являются основными неорганическими комплексообразователями РЗЭ. Тем не менее, комплексообразование с участием органических лигандов, особенно с ГК часто не принимают во внимание при расчeтах химического состояния ионов. Исследователи, изучающие органические комплексы РЗЭ в речных водах (Tang, Johannesson, 2003), предполагают, что гуматные комплексы являются основной формой РЗЭ в “среднемировой речной воде” при рН от 5 до 8, в то время как неорганические карбонатные формы ионов преобладают в грунтовых водах. Эти прогнозы подтверждают результаты работы (Sonke, 2006).
Авторы (Балашов, 1976; Дубинин, 2006) считают РЗЭ слабо и средне распространенными в гидросфере и не рассматривают их в качестве загрязнителей водных экосистем, а автор (Иванов, 1997) считает РЗЭ и их соединения в природных водах токсичными. До 2014 г. полагали, что роль РЗЭ в процессах жизнедеятельности живых многоклеточных организмов не установлена (Баренбойм, Авандеева, 2014). В то же время нормативные документы ГН 2.1.5.1315-03 (Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. От 15.06.2003, с изменениями на 13.07.2017 г.) и Приказ от 13 декабря 2016 г. № 552 (Министерство сельского хозяйства Российской Федерации. Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения. Ред. от 12.10.2018) не содержат сведений для РЗЭ по предельно допустимым концентрациям (ПДК) в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования и в водах водных объектов рыбохозяйственного значения. Однако, авторы работы (Chua, 1998) отмечают, что растворимые формы РЗЭ в природных водоемах, накапливаясь в макрофитах, которые могут употребляться на корм скоту, далее попадают в пищевую цепь человека, а это потенциально опасно для здоровья.
Исследование биогеохимических особенностей накопления РЗЭ макрофитами Иваньковского водохранилища проведено авторами (Гришанцева и др., 2017) с использованием метода ИСП-МС. Работа приводит коэффициенты биологического поглощения (Kб) РЗЭ в макрофитах относительно воды. Авторами показано, что макрофиты накапливают большое количество РЗЭ. Установлена ассоциация РЗЭ с Fe и Al. Предположено, что процессы сорбции и соосаждения РЗЭ на оксигидроксидах железа, а также образование ассоциированных с Fe и Al и органоминеральных коллоидов и соединений играют важную роль в миграции РЗЭ в водных экосистемах, в результате чего РЗЭ активно участвуют в биохимических процессах у высших водных растений. В работе (Фомина и др., 2016) исследовано содержание тяжелых металлов в двух видах рдеста и в урути, показано, что эти водные растения целесообразно применять в качестве индикаторов загрязнения водных объектов. Также установлено, что накопление тяжелых металлов растениями уменьшается в следующем ряду: Fe2, 3+ > Cu2+ > > Zn2+ > Co2+ > Cd2+.
Сбросной канал КАЭС является объектом многолетнего комплексного экологического мониторинга, осуществляемого Институтом проблем промышленной экологии Севера КНЦ РАН. За более чем 30-летний период исследований изучены особенности термического загрязнения единственного в мире природного водоема-охладителя, расположенного в арктической зоне – оз. Имандра (Моисеенко, 2002; Денисов и др., 2017; Сандимиров и др., 2017).
Специфический температурный режим сбросного канала определяет интенсивность развития макрофитов, активность поглощения ими химических элементов из водной среды. Повышение температуры воды начинается с конца апреля (около +12.2°С); наиболее высокие температуры наблюдаются обычно в конце июля и в первой половине августа. Так, в третьей декаде июля 2011 г. температура подогретых вод в канале держалась в пределах +26.9°С, тогда как на остальной акватории озера температура поверхностных слоев воды составляла +16.0…+21.3°С. Понижение температуры воды начинается в конце августа (+20.7°С) и продолжается до образования ледового покрова в озере (III декада октября–I декада ноября). Вероятно, аккумуляция растениями элементов, в том числе и тяжелых металлов, в зоне влияния подогретых вод КАЭС, происходит интенсивнее, чем в условиях естественного температурного режима (Fritioff, 2005).
Многочисленные гидрохимические и биогеохимические исследования оз. Имандра в зоне воздействия подогретых вод КАЭС были посвящены, преимущественно, накоплению тяжелых металлов в донных отложениях (Даувальтер, Кашулин, 2015) и организмах рыб (Даувальтер, Терентьев, 2018). При этом информация о процессах аккумуляции химических элементов (включая РЗЭ) водными растениями практически отсутствует. Высшая водная растительность, представленная сообществами рдеста злаколистного и урути очередноцветковой, обильно развивается в сбросном канале КАЭС в силу благоприятного температурного режима, и является важнейшим компонентом экосистемы, участвующим в биогеохимических циклах.
МЕТОДИКА
Подогретые воды Кольской АЭС поступают в губу Молочная плеса Бабинская Имандра, что значительно изменяет температурный режим на расстоянии 20–50 м от устья сбросного канала (рис. 1). Температура вод зимой 10–15°С, летом – до 26°С, что определяет не типичный для региона продолжительный вегетационный сезон (Денисов и др., 2017). В незамерзающей зоне теплого потока расположено рыбоводческое хозяйство, являющееся источником биогенных элементов. Эти обстоятельства позволяют активно развиваться высшей водной растительности, максимальная биомасса которой формируется в приустьевом участке сбросного канала. Специфические условия привели к формированию не типичной для холодноводных водоемов экосистемы, отличающейся присутствием гидробионтов, характерных для низких широт (Денисов и др., 2017), а также усиленной роли макрофитов в процессах первичного продуцирования.
Отбор проб для гидрохимического анализа осуществлялся в период с 2011 по 2016 гг. в районе водозабора и приустьевом участке сбросного канала из поверхностного слоя воды. Химический состав воды определяли в центре коллективного пользования ИППЭС КНЦ РАН по единым методикам Standard method for examination for water and wastewater (14-th edition, ALHA-AWWA-WPCF Washington, American Public Health Association. 1975. 1195 p.) и (Моисеенко, 2002). В качестве условно фоновых, использовали усредненные гидрохимические показатели озер тундровой и северо-таежной зоны Мурманской области, удаленных от промышленных предприятий (Моисеенко, Яковлев, 1990; Kashulin et al., 2017).
Пробы воды и фитомассы водных растений отбирали 27.03.2019 г. в литоральной зоне приустьевого участка сбросного канала КАЭС на глубине примерно 20 см от поверхности воды (рис. 1). Материал был помещен в пластиковые контейнеры с герметичной крышкой, предварительно подготовленные в соответствии с ГОСТ 31861-2012. При помощи навигатора “Garmin 78s” определены координаты места отбора: 67.461667°, 32.434444°.
Пробы воды консервировали добавлением перегнанной HNO3 (конц.) из расчета 10 мл кислоты на 1 л воды непосредственно после доставки в лабораторию, примерно через один час. Далее пробы воды и фитомассы (рдеста злаколистного – Potamogeton gramineus L., урути очередноцветковой – Myriophyllum alterniflorum DC. и водного мха фонтиналиса – Fontinalis antipyretica Hedw.) хранили в соответствии с ГОСТ 31861-2012 в пластиковых контейнерах при температуре 4°С.
Растения при подготовке воздушно-сухой пробы сначала промывали деионированной водой, затем двухступенчато сушили до постоянной массы при 65 и 105°С, перетирали в агатовой ступке и упаковывали в пакеты из кальки, которые хранили в сухом, защищенном от света месте.
Навески проб растений 40–80 мг помещали в полипропиленовые пробирки с завинчивающимися крышками, добавляли смесь из перегнанных концентрированных азотной и соляной кислот в соотношении 1 : 1 (суммарный объем кислот 30 мл) и выдерживали 15 ч на водяной бане при 95°С. Затем добавляли 1 мл перегнанной фторводородной кислоты и продолжали разложение при этой же температуре в течение 3–5 ч. После полного растворения проб добавляли 5 капель пероксида водорода для комплексообразования и подавления гидролиза поливалентных металлов.
ИСП-МС анализ воды сбросного канала КАС водных растений проводили на масс-спектрометре “ELAN 9000” (PerkinElmer, США) в Центре коллективного пользования физико-химических методов анализа природных сред и биологических объектов Института проблем промышленной экологии Севера КНЦ РАН. Настройками масс-спектрометра устанавливали уровень оксидных и двухзарядных ионов не более 2.6–2.8%, что существенно снижало полиатомные и изобарные спектральные помехи. Дополнительно для корректировки изобарных спектральных наложений использовали математическую коррекцию с учетом природной распространенности изотопов, так, как это описано в инструкции пользователя масс-спектрометра, прилагаемой к прибору.
Для построения градуировочных зависимостей использовали стандартные мультиэлементные растворы “Multi-element ICP-MS Calibration Std” (PerkinElmer, США) 68А Solution A, содержащий Ni, Cu, Cr, Sr, Zn, Pb, Mn, Cd, Co, Al, Li, B, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y, Ba, As, V, Cs, Bi, Be, Rb, Mg, Na, K в концентрации 10 мг · дм–3 и 68А Solution В, содержащий Sb, Sn, и Ti в концентрации 10 мг · дм–3, моноэлементные растворы Fe и Ca с концентрацией 50 мг · дм–3, приготовленные из ГСО 7835-2000 и ГСО 7682-99 соответственно. При построении градуировочной зависимости для определения фосфора использовали ГСО 7018-93 фосфат-ионов. Аликвоты отбирали автоматическими дозаторами “BIOHIT” с использованием одноразовых наконечников.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анализ воды проводили, руководствуясь ГОСТ Р 56219-2014 (ИСО 17294-2:2003) “Вода. Определение содержания 62 элементов методом масс-спектрометрии с индуктивно связанной плазмой”. Пробы воды анализировали на микрокомпоненты без разбавления, учитывая аналитический сигнал, полученный при пропускании через систему ввода образца высокочистого аргона в качестве контрольной (холостой) пробы. Для определения макрокомпонентов пробу воды разбавляли в соотношении 1 : 50–1 : 5 2% перегнанной азотной кислотой, которая являлась контрольной пробой. Рабочие растворы проб водных растений после разложения разбавляли 2% перегнанной азотной кислотой (ос. ч.) в соотношении 1 : 50–1 : 15. Контрольная проба в этом случае – раствор кислот разложения, прошедших такую же процедуру пробоподготовки, как и пробы растений, разбавленный в таком же соотношении 2% перегнанной азотной кислотой (ос. ч.), как и пробы растений. Для контроля качества количественного элементного анализа использовали стандартный образец состава элодеи канадской ГСО 8921-2007 (ЭК-1, СО КООМЕТ 0065-2008-RU), прошедший процедуру разложения и разбавления одновременно с исследуемыми образцами водной растительности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предыдущими исследованиями (Моисеенко и др., 2002; Сандимиров и др., 2017; Денисов и др., 2017) показано, что качество вод сбросного канала КАЭС во многом определяется перекачкой вод из более загрязненного плеса Йокостровская Имандра, которая после технологического цикла АЭС сбрасывается в губу Молочную (Денисов и др., 2017). Воды канала характеризуются слабощелочными значениями pH, содержание органического вещества менее фоновых показателей. Последствия антропогенного загрязнения выражаются в повышенных концентрациях сульфатов, хлоридов и биогенных элементов – фосфатов и общего азота, которые поступают в составе сбросов промышленных предприятий в плесы Большая и Йокостровская Имандра (табл. 1).
Таблица 1.
Некоторые гидрохимические характеристики вод сбросного канала КАЭС (2011–2016 гг.) в сравнении с региональными “фоновыми” значениями
| Показатель | Гидрохимические характеристики | “Фоновые” гидрохимические характеристики | |
|---|---|---|---|
| водозабор | сбросной канал | ||
| pH | 7.12–7.39 | 7.25–7.45 | 6.80 |
| Щелочность, мэкв · дм–3 | 296–309 | 299–328 | 307 |
| Общий органический углерод (ТОС), мг · дм–3 | 3.4–4.1 | 3.6–4.1 | 5.00 |
| Перманганатная окисляемость (COD Mn), мг · дм–3 | 2.49–3.32 | 2.74–2.87 | 4.50 |
| P${\text{O}}_{4}^{{3 - }}$, мкг · дм–3 | 1–3 | 1–4 | 0.80 |
| N общ, мкг · дм–3 | 117–181 | 156–205 | 130.0 |
| Цветность, ° (Pt-Со) | 8–11 | 8–16 | 21 |
| S${\text{O}}_{4}^{{2 - }}$, мг · дм–3 | 8.7–11.9 | 8.0–12.5 | 2.0 |
| Cl–, мг · дм–3 | 1.8–2.9 | 1.7–3.2 | 1.60 |
Впервые сделан подробный элементный анализ водной растительности сбросного канала КАЭС (43 элемента). Полученные результаты позволили проследить, какие элементы наиболее активно усваиваются растениями, а к каким они относительно толерантны. Результаты ИСП-МС анализа представлены в табл. 2 и 3.
Таблица 2.
Соответствие проб воды сбросного канала КАЭС региональным “фоновым” показателям
| Элемент | Концентрация, мкг · дм–3 | “Фон”, мкг · дм–3 | Элемент | Концентрация, мкг · дм–3 | “Фон”, мкг · дм–3 |
|---|---|---|---|---|---|
| Ni | 3.36 | <1 | Tm | 0.0010 | – |
| Cu | 3.15 | <1 | Yb | 0.0076 | – |
| Cr общ. | 2.90 | <2.5 | Lu | 0.0012 | – |
| Sr | 46.9 | 18 | Y | 0.012 | – |
| Zn | 3.49 | 2 | Ba | 7.28 | – |
| Pb | 0.077 | <0.001 | Sb | 0.063 | – |
| Mn | 3.20 | 1.7 | Sn | 1.13 | – |
| Cd | 0.10 | <0.5 | As | 10 | <0.001 |
| Co | 0.038 | <2 | V | 0.18 | – |
| Li | 0.67 | – | Cs | 0.010 | – |
| B | 12.9 | – | Bi | <0.050 | – |
| La | 0.017 | – | Be | 0.031 | – |
| Pr | 0.0039 | – | Rb | 2.04 | – |
| Nd | 0.023 | – | Al | 8.22 | 5 |
| Sm | 0.0082 | – | Fe общ. | 17.9 | 197 |
| Eu | 0.0020 | – | Ti | 0.72 | – |
| Gd | 0.0091 | – | Ca | 6020 | 1750 |
| Tb | 0.0016 | – | Mg | 1420 | 640 |
| Dy | 0.0086 | – | Na | 7650 | 2650 |
| Ho | 0.0020 | – | K | 1470 | 460 |
| Er | 0.0055 | – | P общ. | <50 | 6 |
Таблица 3.
Результаты ИСП-МС анализа проб водной растительности сбросного канала КАЭС
| Элемент | Концентрация, мг/кг | ||
|---|---|---|---|
| фонтиналис | уруть | рдест | |
| Ni | 38.9 ± 1.1 | 23.3 ± 0.7 | 23.7 ± 0.7 |
| Cu | 46.8 ± 0.8 | 69.5 ± 1.2 | 78.3 ± 1.4 |
| Cr общ. | 67.8 ± 3.7 | 37.9 ± 2.1 | 20.7 ± 1.1 |
| Sr | 199 ± 5 | 144 ± 3 | 132 ± 3 |
| Zn | 49.8 ± 1.4 | 58.6 ± 1.7 | 55.7 ± 1.6 |
| Pb | 5.53 ± 0.53 | 4.16 ± 0.40 | 2.50 ± 0.20 |
| Mn | 434 ± 17 | 383 ± 15 | 358 ± 14 |
| Cd | 0.225 ± 0.023 | 0.288 ± 0.029 | 0.252 ± 0.025 |
| Co | 6.99 ± 0.45 | 4.42 ± 0.29 | 2.71 ± 0.18 |
| Li | 6.14 ± 0.40 | 3.77 ± 0.25 | 1.90 ± 0.12 |
| B | 4.20 ± 0.10 | 14.8 ± 0.5 | 14.4 ± 0.5 |
| La | 7.17 ± 0.11 | 5.37 ± 0.08 | 5.00 ± 0.10 |
| Ce | 12.4 ± 0.5 | 7.83 ± 0.34 | 7.09 ± 0.31 |
| Pr | 1.81 ± 0.08 | 1.20 ± 0.10 | 1.15 ± 0.05 |
| Nd | 6.66 ± 0.22 | 4.50 ± 0.10 | 4.11 ± 0.14 |
| Sm | 1.30 ± 0.10 | 0.856 ± 0.021 | 0.814 ± 0.020 |
| Eu | 0.392 ± 0.021 | 0.265 ± 0.014 | 0.200 ± 0.011 |
| Gd | 1.47 ± 0.11 | 0.993 ± 0.074 | 0.872 ± 0.065 |
| Tb | 0.198 ± 0.028 | 0.114 ± 0.016 | 0.122 ± 0.018 |
| Dy | 1.14 ± 0.090 | 0.754 ± 0.060 | 0.642 ± 0.051 |
| Ho | 0.245 ± 0.015 | 0.157 ± 0.010 | 0.144 ± 0.009 |
| Er | 0.686 ± 0.037 | 0.438 ± 0.022 | 0.340 ± 0.020 |
| Tm | 0.122 ± 0.015 | 0.0752 ± 0.0094 | 0.0568 ± 0.0071 |
| Yb | 0.682 ± 0.018 | 0.466 ± 0.012 | 0.304 ± 0.008 |
| Lu | 0.112 ± 0.012 | 0.082 ± 0.008 | 0.0547 ± 0.006 |
| Y | 6.52 ± 0.28 | 4.11 ± 0.17 | 2.76 ± 0.12 |
| Ba | 196 ± 4 | 122 ± 2 | 68.2 ± 1.4 |
| Sb | 0.157 ± 0.027 | 0.153 ± 0.026 | 0.202 ± 0.041 |
| Sn | 0.997 ± 0.057 | 0.952 ± 0.050 | 0.905 ± 0.045 |
| As | 14.7 ± 0.4 | 24.2 ± 0.6 | 35.3 ± 0.9 |
| Cs | 0.425 ± 0.039 | 0.287 ± 0.026 | 0.181 ± 0.017 |
| Bi | 0.0336 ± 0.0034 | 0.0195 ± 0.0020 | 0.0527 ± 0.0053 |
| Be | 1.01 ± 0.13 | 0.100 ± 0.013 | 0.384 ± 0.048 |
| Rb | 31.8 ± 0.7 | 14,0 ± 0.3 | 15.4 ± 0.3 |
| V | 101 ± 5 | 133 ± 7 | 195 ± 9 |
| г/кг | |||
| Al | 27.5 ± 0.3 | 14.7 ± 0.1 | 7.48 ± 0.07 |
| Fe общ. | 20.7 ± 0.2 | 11.5 ± 0.1 | 8.36 ± 0.06 |
| Ti | 1.24 ± 0.05 | 0.776 ± 0.032 | 0.274 ± 0.011 |
| Ca | 19.1 ± 1.0 | 13.1 ± 0.5 | 11.6 ± 0.4 |
| Mg | 6.01 ± 0.10 | 4.46 ± 0.07 | 3.13 ± 0.05 |
| Na | 13.4 ± 0.4 | 9.42 ± 0.27 | 3.89 ± 0.11 |
| K | 21.6 ± 0.1 | 4.77 ± 0.03 | 21.7 ± 0.1 |
| P общ. | 1.23 ± 0.06 | 2.42 ± 0.12 | 2.30 ± 0.11 |
Элементный состав воды сбросного канала КАЭС по результатам ИСП-МС анализа удовлетворял требованиям по уровню ПДК в водных объектах хозяйственно-питьевого и культурно-бытового водопользования, для водных объектов рыбохозяйственного значения исключение составляла концентрация меди (превышение в 3 раза), что объясняется относительной близостью к АО “Кольской ГМК” и перекачиванием в канал вод из “грязного” плеса.
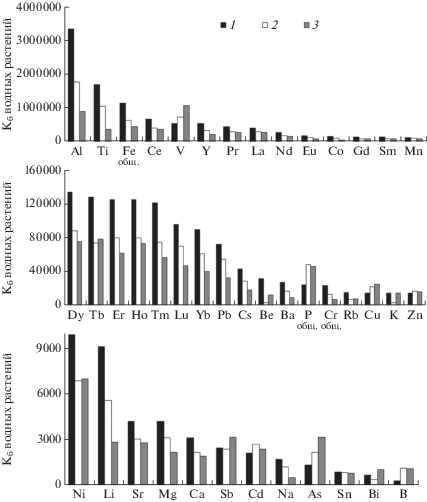
Химический состав растений был нормирован на состав воды, в которой они росли, и которая была их основной питательной средой, на рис. 2 приведены гистограммы нормированного состава.
Рис. 2.
Kб растений сбросного канала КАЭС в порядке убывания концентрации элементов. 1 – фонтиналис, 2 – уруть, 3 – рдест.
Отношение концентрации элемента в растении к его концентрации в воде определял КБП (Kб):
(1)
${{{\text{К}}}_{{\text{б}}}} = {{{\text{С}}}_{{{\text{растение}}}}}/{{{\text{С}}}_{{{\text{вода}}}}},$Определено, что абсолютным лидером по концентрированию из воды в ткани растений является группа Al, Ti, Fe, Ce. Наибольшая концентрация среди аналитов в воде была у Na, Ca, K и Mg. Однако, эти элементы, наряду с B, Sn, Cd, As аккумулировались растениями в меньшей степени. Концентрация этих элементов в растениях достигала значений на два-три порядка больше, чем в воде, тогда как у Al, Fe, Ti, Ce – на пять–шесть порядков.
Способность растений аккумулировать одни элементы лучше, а другие хуже, можно объяснить физиологическими особенностями погружено-водных макрофитов, связанными с превалирующей над корневым питанием, долей их поглощения ассимиляционной поверхностью, проходящего по безбарьерному типу (Лычагина и др., 1998; Куриленко, Осмоловская, 2007), и дальнейшей утилизацией/иммобилизацией их во внутриклеточных комплексах или апопласте. При этом накопление катионов металлов в тканях растений находится в корреляции с константой стойкости гуминовых комплексов этих металлов, что может свидетельствовать в пользу их “гуматного” пути поступления в растение, описанного в качестве ведущего для более эвтрофных регионов (Моисеенко, Яковлев, 1990). Однако, в условиях дефицита стока гуминовых кислот в воды оз. Имандры, выражающемся с пониженном содержании органических соединений, характерном для субарктических регионов, возможны также иные пути поступления микроэлементов и тяжелых металлов в ткани растения, например, в виде гидроксидных и карбонат-ионов (Моисеенко и др., 2013).
Полученные результаты могут быть полезны для оценки физиологических особенностей жизнедеятельности изученных водных растений и оценки эффективности очистки растениями воды сбросного канала. Так, увеличенный, по сравнению с другими видами, Кб многих элементов (Al, Ti, Fe, РЗЭ, Pb, Cs, Be, Ba, Cr, Rb, Ni, Li, Sr, Mg, Ca) у фонтиналиса связан с гораздо большим сроком жизни филлома этого зимнезеленого мха, и следовательно, с гораздо большим сроком накопления. Для очистки пресных вод от меди и других тяжелых металлов результате их биоконцентрирования в растительных тканях наиболее перспективны рдест и уруть, в меньшей степени – фонтиналис. Это имеет региональное значение при работах по индикации и биоочистке загрязнений предприятиями Кольской ГМК водного бассейна оз. Имандра и других водных объектов.
Сравнение результатов (Фомина и др., 2016) с данными, полученными в результате наших исследований (табл. 4), показало, что в сбросном канале КАЭС содержание железа на 3 порядка, цветных металлов и цинка на 2 порядка, кадмия на 1 порядок больше, чем в Волгоградском водохранилище.
Таблица 4.
Сопоставление полученных результатов состава урути и рдеста с литературными данными
| Элемент | Концентрация, мг/кг | |||
|---|---|---|---|---|
| Уруть | Рдест | |||
| волгоградское водохранилище, с. Квасниковка, 2015 г.* | сбросной канал КАЭС, 2019 г. | волгоградское водохранилище, с. Квасниковка, 2015 г.* | сбросной канал КАЭС, 2019 г. | |
| Fe | 38 ± 2.5 | 11.5 × 103 ± 0.1 × 103 | 30 ± 1.5 | 8.36 × 103 ± 0.06 × 103 |
| Cu | 0.72 ± 0.062 | 69.5 ± 1.2 | 0.76 ± 0.088 | 78.3 ± 1.4 |
| Zn | 0.57 ± 0.038 | 58.6 ± 1.7 | 0.58 ± 0.055 | 55.7 ± 1.6 |
| Co | 0.063 ± 0.006 | 4.42 ± 0.29 | 0.068 ± 0.004 | 2.71 ± 0.18 |
| Cd | 0.052 ± 0.005 | 0.288 ± 0.029 | 0.087 ± 0.006 | 0.252 ± 0.025 |
Это может быть связано с деятельностью АО Кольской ГМК и поступлением загрязненных вод в водный бассейн озера Имандра, к которому относится канал КАЭС. Результаты анализа макрофитов канала КАЭС подтвердили предложенный авторами (Фомина и др., 2016) ряд уменьшения накопления в водных растениях тяжелых металлов Fe2, 3+ > Cu2+ > Zn2+ > Co2+ > Cd2+.
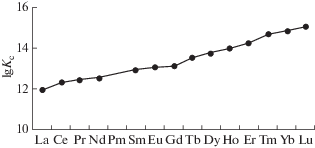
Работа (Волков, 2016) приводит сведения по изменению величины константы устойчивости гуминовых комплексов РЗЭ при увеличении их порядкового номера (рис. 3). Видно, что устойчивость комплексов тяжелых РЗЭ существенно превышает устойчивость комплексов легких РЗЭ.
На рис. 4 показано изменение Kб в ряду РЗЭ, определенных в макрофитах сбросного канала КАЭС. Видно, что неоспоримое преимущество в накоплении РЗЭ в растениях имеет их легкая группа, что соответствует изменению константы комплексообразования РЗЭ с ГК и, соответственно, с устойчивостью комплексов. Наличие максимума у церия и европия может быть объяснено геоэкологическими процессами фракционирования РЗЭ в результате изоморфного замещения Si(IV)–Ce(IV) и Ca(II)–Eu(II)в тканях и клетках растений.
Рис. 4.
Kб растений сбросного канала КАЭС в порядке убывания ионного радиуса РЗЭ. 1 – фонтиналис, 2 – уруть, 3 – рдест.
Результаты, свидетельствующие о накоплении в водных растениях лантана, церия и празеодима хорошо согласуются с литературными данными для макрофитов Иваньковского водохранилища (Гришанцева и др., 2017), где авторы описали накопление этих элементов в маннике водном и рдесте пронзеннолистном. Отличие в том, что Kб в сбросном канале КАЭС на несколько порядков больше. Это подтверждает распространение потока из плеса Большая Имандра, куда поступают стоки апатитового производства с повышенным содержанием редких земель. Кроме того, тепловодная среда сбросного канала в период более длительной инсоляции в полярных широтах стимулирует активную элементную биоаккумуляцию, что может быть отмечено, как модельная особенность поведения водных растений в условиях потепления арктического климата.
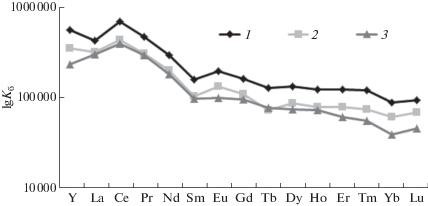
Опубликован ряд работ по оценке распространения и геохимическому фракционирования РЗЭ в природных водах (Luo, Byrne, 2004; Дубинин, 2006). Таких данных по водным экосистемам Кольского севера крайне мало (Моисеенко 2002: Моисеенко и др., 2013). Полученные нами данные восполняют этот пробел. На рис. 5 показано распределение РЗЭ в воде сбросного канала КАЭС и в произрастающей в нем урути, рдесте и фонтиналисе, нормированном на состав хондрита С1 (McDonough, Sun, 1995).
Рис. 5.
Распределение РЗЭ, нормированное на состав хондрита С1 в порядке убывания ионного радиуса. 1 – фонтиналис, 2 – уруть, 3 – рдест, 4 – вода КАЭС, 5 – ГСО 8921-2007 (ЭК-1, СО КООМЕТ 0065-2008-RU).
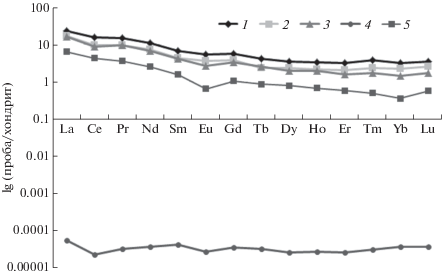
Видно, что распределение РЗЭ в воде имеет тренд, близкий к хондритовому, но имеются незначительные цериевая и европиевая отрицательные аномалии. Эти аномалии заметны у рдеста и сглажены у урути и фонтиналиса. В силу меньшей константы устойчивости комплексных форм легких РЗЭ по сравнению с тяжелыми, содержание легких РЗЭ в исследованных нами водных растениях характеризуется более значительным наклоном распределения в области от La до Sm. Для тяжелых РЗЭ от Dy до Lu тренд распределения приближается к водному. Здесь же, на рисунке, приведено распределение РЗЭ, полученное по результатам анализа ГСО 8921-2007 (ЭК-1) элодеи канадской. Видно, что это распределение так же имеет наклон и концентрация легких РЗЭ преобладает над тяжелыми. Общий тренд нормированных на хондрит РЗЭ-распределений в исследованных водных растениях и в ГСО элодеи канадской очень схожи, основное отличие в более значительной концентрации РЗЭ в макрофитах сбросного канала КАЭС по сравнению с элодеей. Распределение РЗЭ у элодеи имеет заметную отрицательную европиевую аномалию, а цериевая практически отсутствует. Данные по распределению РЗЭ, нормированному на состав хондрита водных растениях и их сравнение с распределением в водах ранее в литературе не приводились, поэтому приведенные результаты могут быть положены в основу нового направления исследований по геоэкологической оценке фракционирования РЗЭ в аквасистемах. Такие распределения используют в геохимической практике для изучения миграции РЗЭ и протекания обменных процессов, например, между минералами, между корой и мантией, в гидрогеохимии – для оценки фракционирования РЗЭ вследствие дифференциации веществ в вводе в целом, а построение такого распределения для объекта живой природы – высших водных растений, подчеркивает тесную взаимосвязь живой и неживой природы.
Оценка качества проведенного ИСП-МС анализа исследованных растений проведена по результатам анализа стандартного образца состава элодеи канадской ГСО 8921-2007 (ЭК-1, СО КООМЕТ 0065-2008-RU), табл. 5.
Таблица 5.
Результаты анализа и аттестованные значения элементного состава стандартного образца элодеи канадской ГСО 8921-2007 (ЭК-1, СО КООМЕТ 0065-2008-RU)
| Элемент | Массовая доля, мг/кг | |||
|---|---|---|---|---|
| найдено | абс. откл. результата анализа | аттестовано | абс. откл, по сертификату ГСО | |
| Ba | 74.7 | 1.5 | 78 | 7 |
| Ce | 3.46 | 0.15 | 3.4 | 0.3 |
| Co | 1.54 | 0.10 | 1.5 | 0.1 |
| Cr | 5.43 | 0.30 | 5.1 | 0.5 |
| Cs | 0.109 | 0.010 | 0.108 | 0.008 |
| Cu | 11.5 | 0.2 | 11.2 | 0.4 |
| Eu | 0.048 | 0.005 | 0.047 | 0.008 |
| La | 1.98 | 0.03 | 2.05 | 0.14 |
| Li | 1.53 | 0.10 | 1.44 | 0.18 |
| Lu | 0.0185 | 0.0010 | 0.019 | 0.003 |
| Nd | 1.51 | 0.05 | 1.59 | 0.17 |
| Ni | 3.41 | 0.10 | 3.7 | 0.4 |
| Rb | 3.22 | 0.07 | 3.5 | 0.3 |
| Sm | 0.31 | 0.08 | 0.31 | 0.03 |
| Sr | 174 | 4 | 174 | 9 |
| Tb | 0.041 | 0.003 | 0.041 | 0.005 |
| Ti | 77.6 | 3.2 | 77 | 14 |
| V | 4.1 | 0.2 | 3.8 | 0.4 |
| Yb | 0.074 | 0.001 | 0.074 | 0.006 |
| Zn | 21.0 | 0.6 | 20.6 | 1.4 |
| Массовая доля, % | ||||
| Al | 0.110 | 0.001 | 0.099 | 0.012 |
| Ca | 2.89 | 0.10 | 2.80 | 0.17 |
| Fe | 0.26 | 0.002 | 0.26 | 0.01 |
| K | 3.30 | 0.02 | 3.22 | 0.16 |
| Mg | 0.31 | 0.005 | 0.32 | 0.02 |
| Mn | 0.051 | 0.002 | 0.052 | 0.003 |
| Na | 0.71 | 0.02 | 0.69 | 0.05 |
| P | 0.21 | 0.01 | 0.24 | 0.03 |
| B | 32.0 | 1.0 | 33 | 10 |
| Be | 0.08 | 0.01 | 0.07 | – |
| Bi | 0.030 | 0.003 | 0.023 | – |
| Cd | 0.10 | 0.01 | 0.10 | 0.02 |
| Dy | 0.25 | 0.02 | 0.36 | 0.13 |
| Er | 0.12 | 0.01 | 0.13 | 0.02 |
| Gd | 0.27 | 0.02 | 0.35 | 0.08 |
| Ho | 0.049 | 0.003 | 0.047 | 0.008 |
| Массовая доля, мг/кг | ||||
| найдено | абс. откл. результата анализа | ориентировочное значение по сертификату на ГСО | абс. откл, ориентиро-вочного значения | |
| Pb | 1.04 | 0.10 | 1.1 | 0.1 |
| Pr | 0.44 | 0.02 | 0.42 | – |
| Sb | 0.10 | 0.03 | 0.08 | 0.02 |
| Sn | 0.19 | 0.03 | 0.12 | – |
| Tm | 0.016 | 0.002 | 0.021 | 0.007 |
| Y | 1.18 | 0.05 | 1.3 | – |
Отклонения полученных результатов от аттестованных значений характеризовали погрешность определений и находились в допустимом диапазоне по уровню погрешностей, приведенных в аттестате СО.
Данные по распределению РЗЭ в воде сбросного канала КАЭС могут быть использованы для установления регионального геохимического фона РЗЭ в компонентах аквальной экосистемы озера Имандра, гидросферного объекта Арктической климатической зоны, а так же для мониторингового прослеживания изменения химического состава природных водных сред Кольского полуострова в связи с повышенной антропогенной нагрузкой.
ВЫВОДЫ
1. Определен максимально полный элементный состав воды и водной растительности сбросного канала КАЭС. Состав воды удовлетворял требованиям по уровню ПДК в водах водных объектов рыбохозяйственного значения, кроме концентрации меди, выявлено соответствие требованиям по уровню ПДК в водных объектах хозяйственно-питьевого и культурно-бытового водопользования.
2. Установлен коэффициент биологического поглощения химических элементов для урути, рдеста и фонтиналиса. Больше всего исследованные водные растения концентрируют Al, Ti, Fe, Ce, V, Y, Pr и La. В тепловодных водах сбросного канала элементная биоаккумуляция протекает существенно активнее, Kб на порядки превышает данные для обычных природных водоемов.
3. Показана корреляция накопления катионов металлов в тканях растений с константой стойкости гуминовых комплексов этих металлов. Предположено, что определяющим фактором при накоплении в растениях химических элементов является их поглощение в виде гуматных комплексов. Возможны другие пути поступления микроэлементов и тяжелых металлов в ткани растения, например, в виде гидроксидных и карбонат-ионов.
4. Впервые геохимические распределения РЗЭ, нормированные на состав хондрита, получены для урути, рдеста и фонтиналиса. Проведено их сравнение с распределением в воде произрастания растений. Результаты могут быть положены в основу нового направления исследований по геоэкологической оценке фракционирования РЗЭ в аквасистеме оз. Имандра.
Работа выполнена в рамках темы НИР № 0226-2019-0045 и частично поддержана из средств грантов РФФИ №№ 18-05-60125 и 18-05-00142.
Список литературы
Балашов Ю.А. (1976) Геохимия редкоземельных элементов. М.: Наука, 267 с.
Баренбойм Г.М., Авандеева О.П. (2014) Редкоземельные элементы в водных объектах (экологические аспекты). Вода: химия и экология. 71(5), 42-55.
Бражная И.Э. (2012) Исследование безопасности и минерального состава дикорастущего сырья Кольского полуострова. Вестник МГТУ. 15(1), 11-14.
Васильева Е.И., Шабанова Е.В., Суслопарова В.Е., Манохина С.Н. (2014) Оценивание согласованности китайских и российских стандартных образцов растений по данным масс-спектрометрии с индуктивно связанной плазмой. Современные методы анализа веществ и материалов. Масс-спектрометрия. 3, 24-32.
Волков И.В. (2016) Реакции микроэлементов с гуминовыми кислотами как основа сорбционной дезактивации и очистки техногенных отходов. Дис. … канд. химических наук. Екатеринбург. ФГБУН Институт химии твердого тела УрОРАН, 164 с.
Гришанцева Е.С., Бычков А.Ю., Шурупова С.А., Федорова Л.П. (2017) Биогеохимические особенности накопления редкоземельных элементов макрофитами Иваньковского водохранилища. Гидробиология. Труды Карельского научного центра РАН. 3, 55-64.
Даувальтер В.А., Кашулин Н.А. (2015) Изменение концентраций никеля и меди в поверхностных слоях донных отложений оз. Имандра за последние полвека. Вестник МГТУ. 18(2), 307-321.
Даувальтер В.А., Терентьев П.М. (2018) Аккумуляция тяжелых металлов в донных отложениях и органах и тканях сига (Coregonus lavaretus) озера Имандра. Труды Ферсмановской научной сессии ГИ КНЦ РАН. 15, 445-448.
Денисов Д.Б., Валькова С.А., Терентьев П.М., Сандимиров С.С., Вандыш О.И. (2017) Современное состояние экосистемы оз. Имандра в зоне влияния Кольской АЭС (Мурманская область). Вода: химия и экология. 6, 41-51.
Дубинин А.В. (2006) Геохимия редкоземельных элементов в океане. М.: Наука, 360 с.
Елисеева О.В., Елисеев А.Ф. (2011) Содержание некоторых микроэлементов в вегетативных органах редьки (raphanussativus l.). Известия ТСХА. 2, 59-68.
Ефремов А.Н., Иминова Д.Е., Алехина Е.А., Дюсембаев С.Т. (2017) Содержание химических элементов в фитомассе некоторых представителей семейства hydrocharitaceae. Химия растительного сырья. 1, 107-111.
Иванов В.В. (1997) Экологическая геохимия элементов: в 6 кн., справочник / Ред. Э. К. Буренков. М.: Недра, 607 с.
Колесников Л.Е., Павлова М.Н., Колесникова Ю.Р. (2014) Биохимический состав зерна у устойчивых и восприимчивых к бурой ржавчине сортов яровой мягкой пшеницы. Известия СПбГАУ. 36, 46-49.
Колесников Л.Е. (2014) Внутривидовая изменчивость элементного состава яровой мягкой пшеницы и ее связь с урожайностью и повреждением листьев вредителями. Биосфера. 6(4), 359-364.
Комулайнен С.Ф., Морозов А.К. (2010) Динамика тяжелых металлов в фитоперифитоне малых рек Кольского полуострова. Водные ресурсы. 37(6), 752-756.
Кузьминова О.В. (2015) Оценка степени загрязнения тяжёлыми металлами компонентов природной среды г. Свирска (Иркутская область). Известия Иркутского государственного университета Серия “Биология. Экология”. 11, 81-92.
Куриленко В.В., Осмоловская Н.Г. (2007) Биоиндикаторная роль высших растений при диагностике загрязнений водных экосистем на примере малых водоемов г. Санкт-Петербурга. Водные ресурсы. 34(6), 757-764.
Лычагина Н.Ю., Касимов Н.С., Лычагин М.Ю. (1998) Биогеохимия макрофитов дельты Волги. Геология Прикаспия. 4, 83 с.
Моисеенко Т.И., Яковлев В.А. (1990) Антропогенные преобразования водных экосистем Кольского Севера. Л.: Наука, 221 с.
Моисеенко Т.И. (2002) Антропогенные модификации экосистемы озера Имандра. М.: Наука, 403 с.
Моисеенко Т.И., Дину М.И., Гашкина Н.А., Кремлева Т.А. (2013) Формы нахождения металлов в природных водах в зависимости от их химического состава. Водные ресурсы. 4, 375-385.
Сандимиров С.С., Кудрявцева Л.П., Петрова О.В. (2017) Современное состояние гидрохимических показателей южных плесов озера Имандра. Вода: химия и экология. 2, 9-19.
Сорокина И.О. (2012) Свинец в ландшавтах г. Улан-Батор (Монголия). Аридные экосистемы. 18(1), 81-89.
Ткаченко А.В. (2015) Определение тяжелых металлов в фитомассе и метод ее утилизации. Научный журн. КубГАУ. 106(02), 57-69.
Фомина А.А., Тихомирова Е.И., Кораблева А.И. (2016) Анализ содержания тяжелых металлов в высших водных растениях Волгоградского водохранилища. Известия Самарского научного центра РАН. 18(2), 822-826.
Щукарев А.С. (1970–1974) Неорганическая химия. Л.: Высшая школа, 360 с.
Chua H. (1998) Bio-accumulation of environmental residues of rare earth elements in aquatic flora Eichhornia crassipes (Mart.) Solms in Guangdong Province of China. The Science of the Total Environment. 214, 79-85.
Fritioff Å., Kautsky L., Greger M. (2005) Influence of temperature and salinity on heavy metal uptake by submersed plants. Environmental Pollution. 133(2), 265-274.
Kashulin N.A., Dauvalter V.A., Denisov D.B., Valkova S.A., Vandysh O.I., Terentjev P.M., Kashulin A.N. (2017) Selected aspects of the current state of freshwater resources in the Murmansk Region, Russia. Science and Health. 52(9), 921-929.
Luo, Y.-R., Byrne R.H. (2004) Carbonate complexation of yttrium and the rare earth elements in natural rivers. Geochim. Cosmochim. Acta. 68, 691-699.
McDonough W.F., Sun S.-S. (1995) The composition of the Earth. Chem. Geol. 120, 223-253.
Sonke J.E. (2006) Lanthanide-humic substances complexation. II. Calibration of humic ion-binding model V. Environmental Science & Technology. 40, 7481-7487.
Sonke J.E., Salters J.M. (2006) Lanthanide–humic substances complexation. I. Experimental evidence for a lanthanide contraction effect. Geochim. Cosmochim. Acta. 70, 1495-1506.
Tang J., Johannesson K.H. (2003) Speciation of rare earth elements in natural terrestrial waters: assessing the role of dissolved organic matter from the modeling approach. Geochim. Cosmochim. Acta. 67, 2321-2339.
Дополнительные материалы отсутствуют.