Геохимия, 2022, T. 67, № 2, стр. 119-135
Роль микроэлементов в адаптации метаболизма рыб к снижению загрязнения (на примере субарктического оз. Имандра)
Н. А. Гашкина a, *, Т. И. Моисеенко a, Л. А. Шуман b, И. М. Королева c
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b Тюменский Государственный Университет
625000 г. Тюмень, ул. Ленина, д. 25, Россия
c Институт проблем промышленной экологии Севера Кольского научного центра Российской академии наук
184209 Апатиты, Академгородок, 14а, Россия
* E-mail: ngashkina@gmail.com
Поступила в редакцию 13.05.2021
После доработки 02.06.2021
Принята к публикации 20.06.2021
- EDN: JXROVN
- DOI: 10.31857/S0016752522020054
Аннотация
Изучены механизмы адаптации рыб к выживанию в исторически загрязненном озере Имандра, которые позволили установить роль микроэлементов в защитных функциях организма и их значение в процессах ре-адаптации организмов к улучшению среды обитания. В качестве объекта исследований был выбран озерный сиг (Coregonus lavaretus L.), который не совершает больших миграций. Изучены показатели красной крови, как индикатора гомеостаза рыб, а также роль клеток белой крови в активации иммунной системы. Даны объяснения причин возникновения гистопатологий органов и тканей. Приведены данные об аккумуляции микроэлементов в организме рыб из данного водоема. Принципиальным отличием в биоаккумуляции элементов является интенсивный метаболизм Se. Повышенное отношение S к Se указывает на высокий антиоксидантный статус рыб из исторически загрязненной части озера, тогда как повышенная аккумуляция Fe, Cu и Se может служить маркером патологий печени, Zn и Co – патологий почек.
Загрязнение окружающей среды приобрело глобальные масштабы к середине прошлого века. Было выполнено много исследований о негативных последствиях влияния загрязняющих веществ, включая токсичные элементы, на здоровье животных и человека, которые дали понимание физиологическим нарушениями и развитию патологий. Например, избыточное накопление микроэлементов в организме вызывало заболевания, специфичные для микроэлементов: известно, что ртуть влияет на нервную систему, свинец, как известно, вызывает определенные виды рака, кадмий вызывает гипертонию и влияет на сердечно-сосудистую систему, никель является канцерогенным и оказывает токсическое действие на репродуктивную систему (Handbook on the Toxicology of Metals, 2007; Sakamoto et al., 2013; Moiseenko et al., 2018). В исследованиях А.П. Виноградова (1963), В.В. Ковальского (1963, 1974) и В.В. Ермакова (1995) был дан анализ биогеохимических провинций и обозначены основные патологии животных и человека, связанные с избыточным содержанием или недостатком тех или иных микроэлементов.
Водная среда является конечным аккумулятором загрязнений. Содержание элементов в воде отражает распространение элементов, поступающих в составе стоков, диффузных потоков, а также переносимых воздушным путем. Жизнь в водоемах, в отличие от обитания на суше, характеризуется более сильной связью между водными организмами и факторами окружающей среды из-за высокой роли метаболизма в водных экосистемах и подвижности загрязняющих веществ в воде. Многочисленные публикации подтверждают, что рыба (in situ) является хорошим индикатором состояния водной среды, биодоступности элементов и нарушений метаболизма животных, связанных с избытков микроэлементов, механизмов адаптации в условиях высоких доз микроэлементов (Whitfield, Elliott, 2002; Yeom, Adams, 2007).
Данные о физиологических механизмах адаптации животных в исторически загрязненных водоeмах к снижению доз загрязнения крайне редки. Таким примером является озеро Имандра. Это большое (площадью 880 км2) субарктическое озеро в Мурманской области (рис. 1). Северная часть озера (Большая Имандра) испытывала многолетнее загрязнение вследствие деятельности горно-металлургических предприятий. Интенсивное загрязнение оз. Имандры началось в 1940-х гг., а с 1990-х гг. наметилась тенденция значительного снижения антропогенной нагрузки на водоем, как результат реконструкции и спада производства ООО “Североникель” (Moiseenko, Sharov, 2019). В период интенсивного загрязнения озера наряду с патологиями массового характера (липоидная дегенерация и цирроз печени, фиброэластоз почек) у сигов появилось специфическое заболевание – нефрокальцитоз, связанное с аккумуляцией никеля в почке рыб (Moiseenko, Kudryavtseva, 2001; Моисеенко и др., 2009). В период снижения токсичной нагрузки на водоем наблюдалось улучшение физиологического состояния сигов: с 1996 г. по 2003 г. снижается их заболеваемость и в 2003 г. не были встречены особи с нефрокальцитозом, сколиозом, миопатией (Моисеенко и др., 2009). В 2006–2007 гг. сиги из загрязненной части озера показали более низкие содержания металлов в органах и тканях и лучшее физиологическое состояние по сравнению с сигами из незагрязненных частей озера (Gashkina et al., 2020).
Целью исследования было:
• выявить физиологические механизмы реакций рыб, как биоиндикаторов восприимчивости, в зависимости от содержаний и особенностей метаболизма элементов в различных органах;
• определить гематологические и гистопатологические ответные реакции организма в условиях загрязнения вод металлами;
• объяснить адаптацию иммунных функций организма на примере реакции сига из исторически загрязненной Большой Имандры.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В основу работы легли данные, полученные в 2018 г., обследования сигов в исследуемых районах оз. Имандра (рис. 1). В данном исследовании в рассмотрение вошли 15 особей (5 из зоны влияния ООО “Североникель” (плавильный комплекс по переработке сульфидных медно-никелевых руд) и 4 из зоны влияния ООО “Апатит” (добыча и переработка апатит-нефелиновых руд) Большой Имандры, а также 3 из незагрязненных Йокостровской и 3 из Бабинской Имандры), у которых оценивалось физиологическое состояние, определялось содержание элементом в органах и тканях, гематологические параметры, а также гистопатология органов.
Пробы воды, взятые из озера Имандра в местах отлова рыб, отбирались в полиэтиленовые бутыли фирмы Nalgene®, которые сразу же помещались в темные контейнеры, охлаждались до приблизительно 4°C и транспортировались в лабораторию. Аналитическая программа работ включала определение рН, электропроводности, основных ионов минерализации, биогенных элементов, а также микроэлементов. Содержание органического вещества определяли по перманганатной окисляемости.
Отлов рыб на обследование сопровождался с одновременным отбором проб воды в местах отлова. Обработку материала проводили по общепринятым в ихтиологии методикам (Правдин, 1966). Следует отметить, что озерный обыкновенный сиг (Coregonus lavaretus L.) бентофаг не мигрирует на большие расстояния и может использоваться как хороший локальный биоиндикатор водной среды (Moiseenko, Kudryavtseva, 2001; Moiseenko et al., 2018). Чтобы минимизировать сезонные и возрастные вариации обследование рыб проводилось в преднерестовый период (август-сентябрь) и выборка рыб была того же возрастного состава (4+–6+). Биологические образцы высушивали до постоянного веса при 105°С, определяли влажность образца на основе влажного и сухого веса. На анализ содержания элементов отбирались жабры, печень, почка, мышцы и скелет. Подготовка проб осуществлялась методом мокрого разложения в концентрированной азотной кислоте с добавлением перекиси водорода.
Определение концентраций элементов в пробах воды и биологических образцах проводилось методом масс-спектрометрии с индуктивно-связанной плазмой (Х-7, Thermo Scientific, США). Контроль качества определения элементов в биологических пробах велся с помощью сертифицированных образцов DORM-3 и DORM-4 (Fish protein certified reference material for trace metals, National Research Council Canada, Canada).
Соотношения сера : селен (S : Se) рассчитывали на основе концентраций серы и селена в органах и их молекулярных масс. Считается, что меньшие соотношения показывают увеличение содержаний селенометионина (SeMet) и дозо-зависимую замену серы селеном в метионине, тогда как большие соотношения показывают увеличение содержания незаменимого селеноцистеина (SeCys) (Gashkina, Moiseenko, 2020).
Гематологический анализ проводили сразу после отлова только на живой рыбе по методике (Крылов, 1980). Кровь брали из хвостовой артерии. Концентрацию гемоглобина в крови определяли портативным гемометром гемиглобинцианидным методом. Часть крови объемом 20 мкл разбавляли в 4 мл физиологического раствора для подсчета эритроцитов в камере Горяева. Каплю крови использовали для приготовления мазка крови. После сушки мазки крови фиксировали в этиловом спирте и окрашивали по Романовскому-Гимза. Было подсчитано не менее 500 клеток крови и рассчитаны проценты отдельно по формам красной и белой крови.
На гистологический анализ пробы целевых органов (жабры, печень и туловищной почки) фиксировали в смеси Буэна. Кусочки органов проводили через спирты и хлороформ, заливали в парафиновые блоки. Тонкие (5 мкм толщиной) срезы органов приготавливали при помощи микротома и монтировали на предметные стекла. Срезы депарафинировали в спиртах, окрашивались азаном по Гейденгайну. После окраски препараты заключались в проводящую среду и под покровное стекло. Срезы анализировали при помощи светового микроскопа (Axio A1). Гистологические изменения и некоторые морфометрические параметры измеряли, по меньшей мере, на 5 слайдах каждого органа каждой рыбы с использованием программного обеспечения микроскопа AxioVision. На пяти участках филаментов жабр у каждой рыбы измеряли ширину вторичных ламелл в проксимальных, медиальных и дистальных областях и оценивали выборочное среднее. Также рассчитывали количество слоев вставочного эпителия и слизистых клеток на 1 мм2.
Гистапологический индекс органа оценивали с использованием адаптированного метода, предложенного Bernet et al. (1999). Точная измеренная площадь каждого изменения была использована вместо балльной оценки (0–6) в зависимости от процента ткани демонстрирующей это изменение. Таким образом, индекс патологии органа рассчитывался как:
Iорг = Σ((Sпатi/Sорг)wi),
где Sпатi – площадь патологии, Sорг – площадь исследованной зоны ткани, wi – фактор значимости. Идентификация гистопатологических изменений и их факторов важности была основана на Bernet et al. (1999) и Agamy (2012). Коэффициент значимости (1–3) присваивали каждой патологии в зависимости от ее опасности для здоровья рыбы (3 – дегенеративные изменения (некроз); 2 – большинство пролиферативных и структурных изменений, а также серьезные циркуляционные нарушения; 1 – воспалительные, циркуляционные, цитоплазматические изменения, связанные в основном с измененным метаболическим статусом рыб).
Статистическая обработка данных выполнена с использованием программ Statistica и SPSS. Из-за ограниченного количества выборок групповые различия были проверены с использованием непараметрического U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
Условия среды обитания
Для понимания изменений условий среды обитания в последние десятилетия проанализируем изменения основных гидрохимических параметров. В 2018 г. величины рН, содержание органических веществ и электропроводности воды были в пределах 7.2–7.3, 3.1–3.7 мгС/л и 107–128 мкСм/см соответственно для Большой Имандры и 7.1–7.3, 2.8–4.5 мгС/л и 54–110 мкСм/см соответственно для Йокостровской и Бабинской Имандры. За исключением Cu, концентрации всех элементов (табл. 1, 2) не превышали их установленные токсикологические пороги для водоемов рыбохозяйственного назначения (Нормативы…, 2011). Параметры среды обитания, а также концентрации основных загрязнителей (Ni и Cu) остаются прежними, как и в 2006–2007 гг. (Gashkina et al., 2020), тогда как в период интенсивного загрязнения (1986–1992 гг.) концентрации могли достигать 290 и 28 мкг/л для Ni и Cu соответственно (Моисеенко и др., 2002). Помимо Ni и Cu, концентрации Al, B, Tl, W, V, Zr и лантаноидов, а также Na, Mg, S были больше в воде Большой Имандры в отличие от таковых Йокостровской и Бабинской Имандры (табл. 1, 2).
Таблица 1.
Средние значения и стандартные ошибки концентраций эссенциальных и условно-эссенциальных элементов в воде и органах сигов, выловленных из Большой Имандры (числитель) и из Йокостровской и Бабинской Имандры (знаменатель)
| Элемент | ПДК | Вода | Жабры | Печень | Почка |
|---|---|---|---|---|---|
| мкг/л | мкг/л | мкг/г сухого веса | |||
| Ca | – | $\frac{{4083 \pm 68}}{{4098 \pm 96}}$ | $\frac{{46{\kern 1pt} 072 \pm 17{\kern 1pt} 162}}{{32{\kern 1pt} 353 \pm 1767}}$ | $\frac{{564 \pm 256}}{{537 \pm 150}}$ | $\frac{{744 \pm 100}}{{1549 \pm 491}}$ |
| Mg | – | $\frac{{{\mathbf{1085}} \pm 15}}{{{\mathbf{1020}} \pm 13}}$ | $\frac{{1162 \pm 196}}{{1080 \pm 52}}$ | $\frac{{727 \pm 30}}{{820 \pm 60}}$ | $\frac{{{\mathbf{693}} \pm 31}}{{{\mathbf{1074}} \pm 177}}$ |
| Na | – | $\frac{{{\mathbf{17}}{\kern 1pt} {\mathbf{740}} \pm 464}}{{{\mathbf{13}}{\kern 1pt} {\mathbf{094}} \pm 1195}}$ | $\frac{{{\mathbf{7291}} \pm 471}}{{{\mathbf{6052}} \pm 255}}$ | $\frac{{{\mathbf{3435}} \pm 240}}{{{\mathbf{5006}} \pm 522}}$ | $\frac{{7392 \pm 505}}{{9168 \pm 602}}$ |
| K | – | $\frac{{2481 \pm 113}}{{2343 \pm 175}}$ | $\frac{{9598 \pm 571}}{{9000 \pm 706}}$ | $\frac{{12{\kern 1pt} 220 \pm 605}}{{12{\kern 1pt} 340 \pm 1036}}$ | $\frac{{10{\kern 1pt} 362 \pm 611}}{{11{\kern 1pt} 164 \pm 946}}$ |
| S | – | $\frac{{{\mathbf{7835}} \pm 148}}{{{\mathbf{5872}} \pm 523}}$ | $\frac{{10356 \pm 382}}{{10{\kern 1pt} 019 \pm 418}}$ | $\frac{{11{\kern 1pt} 365 \pm 507}}{{11{\kern 1pt} 627 \pm 439}}$ | $\frac{{9908 \pm 529}}{{10{\kern 1pt} 515 \pm 607}}$ |
| P | – | $\frac{{0.36 \pm 0.06}}{{0.33 \pm 0.07}}$ | $\frac{{32{\kern 1pt} 882 \pm 8834}}{{25{\kern 1pt} 659 \pm 897}}$ | $\frac{{15{\kern 1pt} 601 \pm 599}}{{16{\kern 1pt} 833 \pm 1108}}$ | $\frac{{13{\kern 1pt} 055 \pm 601}}{{14{\kern 1pt} 864 \pm 1065}}$ |
| Fe | 100 | $\frac{{19.1 \pm 3.5}}{{13.4 \pm 2.1}}$ | $\frac{{195 \pm 37}}{{237 \pm 71}}$ | $\frac{{142 \pm 12}}{{170 \pm 25}}$ | $\frac{{314 \pm 22}}{{294 \pm 34}}$ |
| Zn | 10 | $\frac{{1.35 \pm 0.23}}{{1.82 \pm 1.08}}$ | $\frac{{541 \pm 141}}{{522 \pm 87}}$ | $\frac{{284 \pm 32}}{{344 \pm 85}}$ | $\frac{{204 \pm 23}}{{207 \pm 21}}$ |
| Cu | 1 | $\frac{{{\mathbf{4}}{\mathbf{.81}} \pm 0.41}}{{{\mathbf{3}}.{\mathbf{17}} \pm 0.31}}$ | $\frac{{2.92 \pm 0.42}}{{2.47 \pm 0.21}}$ | $\frac{{57.3 \pm 12.2}}{{170 \pm 89}}$ | $\frac{{8.19 \pm 0.96}}{{10.5 \pm 2.2}}$ |
| Mn | 10 | $\frac{{10.8 \pm 1.3}}{{6.9 \pm 1.4}}$ | $\frac{{22.7 \pm 3.5}}{{17.7 \pm 2.5}}$ | $\frac{{7.85 \pm 0.51}}{{7.63 \pm 0.47}}$ | $\frac{{2.50 \pm 0.24}}{{3.34 \pm 0.40}}$ |
| Co | 10 | $\frac{{ < 0.1}}{{ < 0.1}}$ | $\frac{{0.11 \pm 0.03}}{{0.05 \pm 0.02}}$ | $\frac{{0.13 \pm 0.02}}{{0.13 \pm 0.02}}$ | $\frac{{1.12 \pm 0.22}}{{0.61 \pm 0.14}}$ |
| Se | 2 | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{{\mathbf{3}}{\mathbf{.59}} \pm 0.30}}{{{\mathbf{5}}.{\mathbf{18}} \pm 0.57}}$ | $\frac{{{\mathbf{7}}{\mathbf{.96}} \pm 0.49}}{{{\mathbf{12}}.{\mathbf{05}} \pm 1.14}}$ | $\frac{{{\mathbf{7}}{\mathbf{.02}} \pm 0.55}}{{{\mathbf{9}}.{\mathbf{71}} \pm 0.82}}$ |
| Mo | 1 | $\frac{{2.63 \pm 0.17}}{{2.23 \pm 0.26}}$ | $\frac{{0.12 \pm 0.02}}{{0.11 \pm 0.03}}$ | $\frac{{0.59 \pm 0.03}}{{0.60 \pm 0.06}}$ | $\frac{{0.43 \pm 0.05}}{{0.64 \pm 0.16}}$ |
| B | 500 | $\frac{{{\mathbf{40}}{\mathbf{.5}} \pm 1.4}}{{{\mathbf{25}}.{\mathbf{8}} \pm 3.1}}$ | $\frac{{1.13 \pm 0.57}}{{0.92 \pm 0.41}}$ | $\frac{{0.32 \pm 0.28}}{{0.93 \pm 0.46}}$ | $\frac{{0.69 \pm 0.29}}{{1.12 \pm 0.56}}$ |
| Br | 1350 | $\frac{{ < 8}}{{ < 8}}$ | $\frac{{80.9 \pm 28.5}}{{48.6 \pm 4.7}}$ | $\frac{{49.5 \pm 9.7}}{{40.7 \pm 9.8}}$ | $\frac{{58.1 \pm 12.4}}{{75.9 \pm 21.1}}$ |
| Cr | 20 | $\frac{{ < 0.5}}{{ < 0.5}}$ | $\frac{{0.19 \pm 0.08}}{{0.48 \pm 0.17}}$ | $\frac{{ < 0.3}}{{ < 0.3}}$ | $\frac{{ < 0.3}}{{ < 0.3}}$ |
| Ni | 10 | $\frac{{{\mathbf{7}}{\mathbf{.50}} \pm 0.59}}{{{\mathbf{3}}.{\mathbf{30}} \pm 0.36}}$ | $\frac{{1.99 \pm 0.55}}{{1.21 \pm 0.31}}$ | $\frac{{0.44 \pm 0.10}}{{0.78 \pm 0.24}}$ | $\frac{{5.10 \pm 0.99}}{{5.83 \pm 1.28}}$ |
| Si | – | $\frac{{0.34 \pm 0.02}}{{0.39 \pm 0.16}}$ | $\frac{{92.7 \pm 34.8}}{{142 \pm 59}}$ | $\frac{{15.3 \pm 2.0}}{{11.6 \pm 1.5}}$ | $\frac{{34.2 \pm 4.7}}{{54.2 \pm 7.1}}$ |
| Li | 80 | $\frac{{0.50 \pm 0.01}}{{0.52 \pm 0.04}}$ | $\frac{{0.026 \pm 0.007}}{{0.047 \pm 0.017}}$ | $\frac{{0.016 \pm 0.006}}{{ < 0.003(0.009)}}$ | $\frac{{0.006 \pm 0.002}}{{0.010 \pm 0.002}}$ |
Таблица 2.
Средние значения и стандартные ошибки концентраций элементов (установленной и неизвестной токсичности) в воде и органах сигов, выловленных из Большой Имандры (числитель) и из Йокостровской и Бабинской Имандры (знаменатель)
| Элемент | ПДК | Вода | Жабры | Печень | Почка |
|---|---|---|---|---|---|
| мкг/л | мкг/л | мкг/г сухого веса | |||
| Hg | 0.01 | $\frac{{ < 0.01}}{{ < 0.01}}$ | $\frac{{0.060 \pm 0.009}}{{0.070 \pm 0.010}}$ | $\frac{{0.163 \pm 0.035}}{{0.152 \pm 0.029}}$ | $\frac{{0.184 \pm 0.036}}{{0.192 \pm 0.025}}$ |
| Tl | – | $\frac{{{\mathbf{0}}{\mathbf{.003}} \pm 0.000}}{{{\mathbf{0}}.{\mathbf{002}} \pm 0.000}}$ | $\frac{{0.033 \pm 0.008}}{{0.029 \pm 0.005}}$ | $\frac{{0.417 \pm 0.094}}{{0.317 \pm 0.068}}$ | $\frac{{0.074 \pm 0.015}}{{0.087 \pm 0.023}}$ |
| Cd | 5 | $\frac{{ < 0.004}}{{ < 0.004\left( {0.010} \right)}}$ | $\frac{{0.07 \pm 0.02}}{{0.07 \pm 0.02}}$ | $\frac{{{\mathbf{0}}{\mathbf{.11}} \pm 0.02}}{{{\mathbf{0}}.{\mathbf{24}} \pm 0.02}}$ | $\frac{{2.25 \pm 0.55}}{{2.70 \pm 0.52}}$ |
| Pb | 6 | $\frac{{0.58 \pm 0.32}}{{0.94 \pm 0.33}}$ | $\frac{{0.73 \pm 0.25}}{{0.20 \pm 0.06}}$ | $\frac{{0.04 \pm 0.00}}{{0.05 \pm 0.01}}$ | $\frac{{0.07 \pm 0.02}}{{0.06 \pm 0.01}}$ |
| Ag | – | $\frac{{ < 0.005}}{{ < 0.005}}$ | $\frac{{0.007 \pm 0.002}}{{0.003 \pm 0.002}}$ | $\frac{{0.147 \pm 0.066}}{{0.314 \pm 0.166}}$ | $\frac{{0.008 \pm 0.005}}{{0.006 \pm 0.002}}$ |
| W | 0.8 | $\frac{{{\mathbf{0}}{\mathbf{.24}} \pm 0.03}}{{{\mathbf{0}}.{\mathbf{13}} \pm 0.02}}$ | $\frac{{0.069 \pm 0.029}}{{0.052 \pm 0.032}}$ | $\frac{{0.003 \pm 0.001}}{{0.009 \pm 0.006}}$ | $\frac{{0.041 \pm 0.016}}{{0.200 \pm 0.149}}$ |
| V | 1 | $\frac{{{\mathbf{0}}{\mathbf{.41}} \pm 0.03}}{{{\mathbf{0}}.{\mathbf{24}} \pm 0.04}}$ | $\frac{{0.15 \pm 0.10}}{{0.29 \pm 0.21}}$ | $\frac{{0.09 \pm 0.10}}{{0.09 \pm 0.09}}$ | $\frac{{0.27 \pm 0.14}}{{0.59 \pm 0.22}}$ |
| Sb | – | $\frac{{0.094 \pm 0.004}}{{0.083 \pm 0.008}}$ | $\frac{{0.003 \pm 0.001}}{{0.006 \pm 0.002}}$ | $\frac{{{\mathbf{ < }}{\mathbf{0}}{\mathbf{.002}}\left( {0.009} \right)}}{{{\mathbf{0}}.{\mathbf{003}} \pm 0.001}}$ | $\frac{{0.002 \pm 0.001}}{{0.005 \pm 0.001}}$ |
| As | 50 | $\frac{{0.14 \pm 0.02}}{{0.10 \pm 0.02}}$ | $\frac{{0.59 \pm 0.16}}{{0.25 \pm 0.25}}$ | $\frac{{0.14 \pm 0.08}}{{0.12 \pm 0.12}}$ | $\frac{{0.58 \pm 0.25}}{{0.25 \pm 0.25}}$ |
| Sr | 400 | $\frac{{54.3 \pm 2.0}}{{50.2 \pm 2.3}}$ | $\frac{{394 \pm 212}}{{168 \pm 6.5}}$ | $\frac{{4.54 \pm 2.49}}{{2.85 \pm 0.59}}$ | $\frac{{6.10 \pm 1.18}}{{8.65 \pm 2.34}}$ |
| Al | 40 | $\frac{{{\mathbf{36}}{\mathbf{.6}} \pm 8.0}}{{{\mathbf{16}}.{\mathbf{5}} \pm 1.5}}$ | $\frac{{32.9 \pm 15.6}}{{92.5 \pm 45.4}}$ | $\frac{{9.43 \pm 4.14}}{{14.1 \pm 3.3}}$ | $\frac{{{\mathbf{7}}{\mathbf{.80}} \pm 1.27}}{{{\mathbf{18}}.{\mathbf{7}} \pm 3.1}}$ |
| Rb | 100 | $\frac{{3.99 \pm 0.19}}{{3.59 \pm 0.33}}$ | $\frac{{{\mathbf{25}}{\mathbf{.8}} \pm 1.7}}{{{\mathbf{18}}.{\mathbf{3}} \pm 2.4}}$ | $\frac{{38.3 \pm 3.5}}{{28.7 \pm 4.8}}$ | $\frac{{28.3 \pm 2.4}}{{22.7 \pm 3.1}}$ |
| Y | – | $\frac{{{\mathbf{0}}{\mathbf{.042}} \pm 0.010}}{{{\mathbf{0}}.{\mathbf{017}} \pm 0.002}}$ | $\frac{{0.031 \pm 0.015}}{{0.060 \pm 0.030}}$ | $\frac{{0.006 \pm 0.004}}{{0.004 \pm 0.001}}$ | $\frac{{0.007 \pm 0.002}}{{0.012 \pm 0.002}}$ |
| Zr | – | $\frac{{0.039 \pm 0.014}}{{{\mathbf{0}}.{\mathbf{010}} \pm 0.002}}$ | $\frac{{0.15 \pm 0.06}}{{0.07 \pm 0.01}}$ | $\frac{{0.05 \pm 0.02}}{{0.02 \pm 0.01}}$ | $\frac{{0.07 \pm 0.01}}{{0.09 \pm 0.01}}$ |
| Cs | 1000 | $\frac{{0.049 \pm 0.016}}{{0.033 \pm 0.007}}$ | $\frac{{0.137 \pm 0.019}}{{0.130 \pm 0.035}}$ | $\frac{{0.097 \pm 0.015}}{{0.107 \pm 0.038}}$ | $\frac{{0.152 \pm 0.023}}{{0.283 \pm 0.122}}$ |
| U | – | $\frac{{{\mathbf{0}}{\mathbf{.057}} \pm 0.006}}{{{\mathbf{0}}.{\mathbf{034}} \pm 0.002}}$ | $\frac{{0.024 \pm 0.004}}{{0.028 \pm 0.006}}$ | $\frac{{0.005 \pm 0.001}}{{0.007 \pm 0.002}}$ | $\frac{{0.017 \pm 0.002}}{{0.026 \pm 0.007}}$ |
| Th | – | $\frac{{0.002 \pm 0.001}}{{0.002 \pm 0.000}}$ | $\frac{{0.006 \pm 0.003}}{{0.004 \pm 0.002}}$ | $\frac{{ < 0.001}}{{0.001 \pm 0.000}}$ | $\frac{{{\mathbf{0}}{\mathbf{.002}} \pm 0.001}}{{{\mathbf{0}}.{\mathbf{003}} \pm 0.000}}$ |
| La | – | $\frac{{{\mathbf{0}}{\mathbf{.160}} \pm 0.046}}{{{\mathbf{0}}.{\mathbf{047}} \pm 0.006}}$ | $\frac{{0.137 \pm 0.056}}{{0.053 \pm 0.011}}$ | $\frac{{0.047 \pm 0.012}}{{0.078 \pm 0.014}}$ | $\frac{{0.031 \pm 0.007}}{{0.046 \pm 0.012}}$ |
| Ce | – | $\frac{{{\mathbf{0}}{\mathbf{.224}} \pm 0.071}}{{{\mathbf{0}}.{\mathbf{057}} \pm 0.009}}$ | $\frac{{0.214 \pm 0.096}}{{0.081 \pm 0.025}}$ | $\frac{{0.037 \pm 0.008}}{{0.069 \pm 0.013}}$ | $\frac{{{\mathbf{0}}{\mathbf{.043}} \pm 0.011}}{{{\mathbf{0}}.{\mathbf{080}} \pm 0.012}}$ |
| Pr | – | $\frac{{{\mathbf{0}}{\mathbf{.027}} \pm 0.007}}{{{\mathbf{0}}.{\mathbf{009}} \pm 0.001}}$ | $\frac{{0.025 \pm 0.010}}{{0.011 \pm 0.003}}$ | $\frac{{{\mathbf{0}}{\mathbf{.004}} \pm 0.001}}{{{\mathbf{0}}{\mathbf{.008}} \pm 0.001}}$ | $\frac{{0.006 \pm 0.001}}{{0.008 \pm 0.001}}$ |
| Nd | – | $\frac{{{\mathbf{0}}{\mathbf{.094}} \pm 0.026}}{{{\mathbf{0}}.{\mathbf{032}} \pm 0.004}}$ | $\frac{{0.096 \pm 0.038}}{{0.050 \pm 0.013}}$ | $\frac{{0.023 \pm 0.006}}{{0.028 \pm 0.005}}$ | $\frac{{0.021 \pm 0.006}}{{0.032 \pm 0.005}}$ |
| Sm | – | $\frac{{{\mathbf{0}}{\mathbf{.013}} \pm 0.004}}{{{\mathbf{0}}.{\mathbf{004}} \pm 0.000}}$ | $\frac{{0.015 \pm 0.006}}{{0.011 \pm 0.004}}$ | $\frac{{{\mathbf{0}}{\mathbf{.002}} \pm 0.000}}{{{\mathbf{0}}.{\mathbf{003}} \pm 0.000}}$ | $\frac{{0.004 \pm 0.001}}{{0.005 \pm 0.001}}$ |
Содержание микроэлементов и их физиологическая роль в метаболизме
Микроэлементный состав организма отражает эволюционно-выработанные механизмы регуляции обменных процессов в организме. Концентрации элементов у сигов из исторически загрязненной и незагрязненной частей озера не сильно различались, за исключением Se, который аккумулировался меньше во всех органах, а также Na, концентрации которого были больше в жабрах, но меньше в печени и почке сигов из Большой Имандры (табл. 1). Большая концентрация Rb наблюдалась в жабрах, но меньшие концентрации Cd, Sb, Pr и Sm были в печени, а Mg, Al и Ce в почке сигов из Большой Имандры в отличие от таковых Йокостровской и Бабинской Имандры (табл. 1, 2).
Принципиальным отличием в содержание элементов является интенсивный метаболизм Na и Se у сигов из Большой Имандры. Повышенные концентрации Na в жабрах и пониженные в печени и почке, а также пониженные концентрации Se и повышенные молярные соотношения S : Se во всех органах и тканях наблюдались у сигов, подверженных тепловому загрязнению, вследствие высокой дыхательной активности и интенсивного метаболизма (Гашкина, Моисеенко, 2020). Транспорт Na+ связан с транспортом Н+. Следующие транспортные системы находятся на апикальной мембране ионоцитов: Na+/H+–обменник (NHE) транспортирует H+ через апикальную мембрану в обмен на Na+, H+–АТФаза (VHA) транспортирует H+ через апикальную мембрану, создавая электрохимический градиент для Na+, чтобы диффундировать сквозь апикальную мембрану через Na+–канал, тогда как вдоль базолатеральной мембраны находятся VHA, Na+/K+–АТФаза (NKA), Na+/${\text{HCO}}_{3}^{ - }$–котранспортер (NBC) помогает поддерживать очень низкую концентрацию Na в цитозоле, а также удаляет ${\text{HCO}}_{3}^{ - }$ из клеток (Griffith, 2017). Частота дыхания создает предпосылки для большего поступления Na+ в обмен на H+, а также необходимости выводить излишки Na, что отразилось на концентрациях в жабрах и почке (табл. 1).
Металлы с переменной валентностью инициируют образование свободных радикалов за счет электрона, тогда как тяжелые металлы способны образовывать ковалентные связи с белками и ингибировать активность ферментов, в том числе антиоксидантных, что может вызывать окислительный стресс при снижении содержания глутатиона (Fish Physiology…, 2012; Wang et al., 2004). В отличие от большинства основных микроэлементов, Se не образует координационных связей с белками, а ковалентно включается в виде остатка SeCys; группы селеноферментов представляют собой помимо йодтиронин дейодиназы и селенофосфатсинтетазы, антиоксидантные ферменты: глутатионпероксидазы (которые выполняют функцию восстановления гидропероксидов до соответствующих спиртов за счет глутатиона), тиоредоксинредуктазы (которые поддерживают окислительно-восстановительный статус клеток за счет снижения уровня цистеина) (Fish Physiology…, 2012). Пониженная аккумуляция Se во всех органах наблюдалась у сигов из Большой Имандры по сравнению с токовой у сигов из Йокостровской и Бабинской Имандры (табл. 1). Притом молярные соотношения S : Se во всех органах были больше у сигов из Большой Имандры (рис. 2). Можно предположить, что Se в большей мере включен в незаменимые SeCys у сигов из Большой Имандры, тогда как запасной пул SeMet формируется у сигов из Йокостровской и Бабинской Имандры. Активный метаболизм Se может указывать на стимуляцию антиоксидантных ферментов у сигов из исторически загрязненной части озера. Например, активность глутатион-S-трансферазы повышалась в жабрах рыб, подвергшихся хроническому воздействию Се (один из самых распространенных редкоземельных металлов, обладающий редокс свойствами) при концентрациях повышенного регионального уровня (Correia et al., 2019).
Рис. 2.
Молярные отношения серы к селену (S : Se) в органах и тканях сигов из Большой Имандры (1) и Йокостровской и Бабинской Имандры (2).
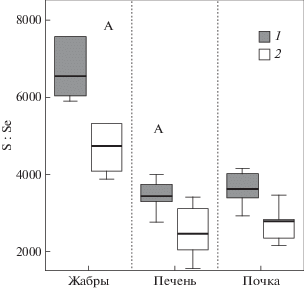
В период высокой токсичности, по-видимому, одной из главных эволюционных задач было сохранять эффективность работы антиоксидантных систем организма.
Адаптация кровеносной системы
Гематологические характеристики, включая клеточные компоненты крови, являются эффективными и чувствительными показателями физиологических изменений, состояния здоровья, приспособляемости рыб к окружающей среде и токсикологических симптомов, в том числе иммунных реакций, связанных с патологическими процессами (da Silva et al., 2011).
Красная кровь. Хотя количество клеток красной крови при сходных соотношениях зрелых и незрелых форм достоверно не отличалось, концентрация гемоглобина в крови (Hb) была низкая у многих рыб (табл. 3). Hb у сигов в условиях экологического оптимума находится в пределах 80–130 г/л (Моисеенко и др., 2002). Гомеостаз рыб, во многом, определяется Hb. Эритропоэз жестко регулируется гормоном эритропоэтином (EPO), а также цитокинами, факторами транскрипции, и микроэлементами (Fe, Cu, Co); гипоксия – главный регулятор уровня EPO; тогда как цитокины также же могут взаимодействовать с EPO, чтобы стимулировать более незрелые предшественники эритроидов (Nogueira-Pedro et al., 2016).
Таблица 3.
Средние значения и стандартные ошибки физиологического состояния и гематологических показателей рыб
| Параметры физиологического состояния и гематологические показатели | Размерность | Большая Имандра | Йокостровская и Бабинская Имандра |
|---|---|---|---|
| Вес рыбы | г | 618 ± 51 | 512 ± 52 |
| Промысловая длина | см | 33.5 ± 0.9 | 31.3 ± 0.9 |
| Концентрация гемоглобина (Hb) | г/л | 81 ± 9 | 75 ± 13 |
| Среднее количество гемоглобина в эритроците (MCH) | пг | 155 ± 23 | 113 ± 23 |
| Эритроциты | 106 клеток/мм3 | 0.56 ± 0.07 | 0.73 ± 0.11 |
| Зрелые эритроциты | 106 клеток/мм3 | 0.52 ± 0.07 | 0.70 ± 0.11 |
| % | 94.8 ± 1.4 | 96.1 ± 0.8 | |
| Незрелые эритроциты | 106 клеток/мм3 | 0.028 ± 0.008 | 0.029 ± 0.006 |
| % | 5.2 ± 1.4 | 4.0 ± 0.8 | |
| Включая: | |||
| Базофильные эритробласты | 106 клеток/мм3 | 0.010 ± 0.005 | 0.012 ± 0.003 |
| % | 2.0 ± 1.0 | 1.7 ± 0.3 | |
| Полихроматофильные эритробласты | 106 клеток/мм3 | 0.018 ± 0.006 | 0.017 ± 0.005 |
| % | 3.3 ± 1.0 | 2.3 ± 0.6 | |
| Лейкоциты | 103 клеток/мм3 | 10.6 ± 2.1 | 16.4 ± 3.5 |
| Лимфоциты | 103 клеток/мм3 | 7.1 ± 1.3 | 14.6 ± 3.2 |
| % | 67.9 ± 3.4 | 85.8 ± 4.2 | |
| Моноциты | 103 клеток/мм3 | 1.18 ± 0.27 | 0.41 ± 0.16 |
| % | 11.2 ± 1.6 | 3.5 ± 1.3 | |
| Макрофаги | 103 клеток/мм3 | 0.54 ± 0.19 | 0.28 ± 0.17 |
| % | 5.5 ± 1.9 | 2.1 ± 1.0 | |
| Бласты | 103 клеток/мм3 | 0.23 ± 0.09 | 0.33 ± 0.13 |
| % | 3.0 ± 1.2 | 3.1 ± 1.2 | |
| Нейтрофилы | 103 клеток/мм3 | 1.51 ± 0.60 | 0.76 ± 0.20 |
| % | 12.5 ± 3.0 | 5.6 ± 1.3 | |
| Включая: | |||
| Палочкоядерные нейтрофилы | 103 клеток/мм3 | 0.77 ± 0.37 | 0.47 ± 0.17 |
| % | 6.0 ± 1.9 | 3.1 ± 1.0 | |
| Сегментоядерные нейтрофилы | 103 клеток/мм3 | 0.74 ± 0.25 | 0.29 ± 0.09 |
| % | 6.5 ± 1.7 | 2.5 ± 0.8 | |
Сложная модуляция стимулов, регулирующих эритропоэз, отражается на гематологических параметрах, которые чутко реагируют на внутренние и внешние факторы, и даже, по-видимому, предопределяют возможности метаболических и физиологических реакций рыб. Гематологические отклики зависят от остроты и продолжительности воздействия неблагоприятных факторов. Могут наблюдаться как активация эритропоэза (Elahee, Bhagwant, 2007), так и кратковременная (Clark et al., 2018) и более продолжительная супрессия (Talukdar et al., 2017). Несмотря на значительные вариации в физиологическом состоянии, если сопоставить средние величины, то среднее количество гемоглобина в эритроците было больше при меньшем количестве эритроцитов у сигов из Большой Имандры в сравнение с таковыми из Йокостровской и Бабинской Имандры (табл. 3). Например, вопреки значительно увеличенной активности дегидратазы d-аминолевулиновой кислоты (участвующей в синтезе гемоглобина и других порфириновых соединений, таких как цитохромы и пероксидазы) в эритроцитах у рыб в загрязненных участках по сравнению с контрольными, среднее количество гемоглобина в эритроците или было повышено или понижено у разных видов рыб при различной активности эритропоэза (Elahee, Bhagwant, 2007). В период интенсивного загрязнения (1978–1997) средние значения Нb были 80 и 107 г/л, количество эритроцитов – 0.80 и 1.02 × 106 клеток/мм3 и среднее количество гемоглобина в эритроците – 101 и 105 пг у сигов из загрязненных и реферативных частей озера соответственно (Моисеенко и др., 2002). Синтез гема, по-видимому, был смещен в сторону увеличения гемоглобина от синтеза менее востребованных других ферментов, использующих гемовое железо, что может быть наиболее вероятным объяснением повышения среднего количества гемоглобина в эритроците у сигов из Большой Имандры. Таким образом, спад токсичности выявил активацию адаптационных механизмов, которые были направлены на повышение эффективности эритропоэза путем увеличения количества гемоглобина в созревающих эритроцитах.
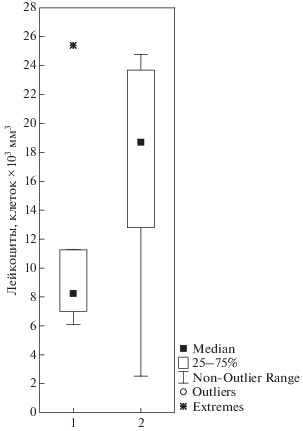
Белая кровь. Хотя общее количество лейкоцитов достоверно не различалось у сигов из загрязненных и незагрязненных частях озера (табл. 3), оно было в диапазон 6–12 × 103 клеток/мм3 у сигов из Большой Имандры (за исключением одной особи с экстремально большим количеством лейкоцитов) и диапазон 12–24 × 103 клеток/мм3 у сигов из Йокостровской и Бабинской Имандры (за исключением одной особи с экстремально малым количеством клеток) (рис. 3). Основная роль иммунной системы – это первая линия защиты хозяина в противодействии патогенным организмам и борьба с любыми чужеродными материалами (Whyte, 2007). В период интенсивного загрязнения (1978–1997) средние количество лейкоцитов было 27 и 20 × 103 клеток/мм3 у сигов из загрязненных и реферативных частей озера соответственно (Моисеенко и др., 2002). В 2018 г. если общее количество лейкоцитов сохранялось на прежнем уровне у большинства сигов из Йокостровской и Бабинской Имандры как и в прошлом, то оно значительно понизилось у большинства сигов из Большой Имандры. Пониженный уровень лейкоцитов у сигов из исторически загрязненной части озера может означать не столько супрессию иммунной системы, сколько измененный путь иммунного ответа, чему может способствовать гибкость и чрезмерная избыточность иммунной системы.
Рис. 3.
Количество лейкоцитов в крови сигов из Большой Имандры (1) и Йокостровской и Бабинской Имандры (2).
Среди лимфоцитов семейство В-клеток отвечает за выработку иммуноглобулина, а семейство Т-клеток помогает обеспечивать стимул, естественные киллеры (NK) составляют лишь около 10% популяции лимфоцитов; лимфоцитоз связан с инфекцией или стрессом в большинстве случаев (Hematology…, 2018). Превалирующее относительное и общее количество лимфоцитов наблюдалось у сигов из незагрязненной части озера (табл. 3), и развитие специфического иммунного ответа было характерно для них.
С другой стороны, лимфопения и нейтрофилия являются классической универсальной реакцией иммунной системы на токсичное (Заботкина и др., 2009) или инфекционное воздействие (Palikova et al., 2017). Лимфопения и нейтрофилия также присуща сигам из Большой Имандры (табл. 3), тогда как нейтрофильный лейкоцитоз был типичен в период интенсивного загрязнения (Моисеенко и др., 2002). Однако в современный период защитные реакции сигов из исторически загрязненной части озера осуществляются больше через активацию и мгновенным откликом системы врожденного иммунитета.
Нейтрофилы были единственными положительными на миелопероксидазу (образование супероксидных радикалов и реактивных галогеновых соединений) и металлопротеиназы 2 и 9 (Ca2+ и Zn2+-зависимых протеиназ, участвующих в деградации компонентов внеклеточного матрикса) (da Silva et al., 2011). Pijanowski и др. (2020) продемонстрировали, что хемокин CXCb1 индуцирует в нейтрофилах карпа образование внеклеточных ловушек нейтрофилов, происходящих из туловищной почки, и требует активности НАДФН-оксидазы в отличие от CXCR. Например, увеличение уровня респираторного взрыва фагоцитов наблюдали как при токсичном воздействии (Kaya et al., 2016), так и на протяжении пика инфекции (Palikova et al., 2017). Следует заметить, что сдвиг в сторону преобладания более зрелых сегментоядерных нейтрофилов выражен у сигов из Большой Имандры, тогда как палочкоядерные нейтрофилы, относящиеся к незрелым циркулирующим клеткам, преобладают у сигов из незагрязненной части озера (табл. 3). Таким образом, нейтрофилы обладают повышенной способностью выделять активные формы кислорода у сигов из Большой Имандры. Например, в случае дефицита глутатионредуктазы респираторный взрыв прекращается преждевременно из-за токсического воздействия накопления перекиси водорода на НАДФН-оксидазу; при дефиците глутатионсинтетазы респираторный взрыв протекает нормально, но перемежающая нейтропения (возможно, вызванная метаболическим ацидозом), а также гемолиз, вызванный оксидантами, также характерны, как и в первом случае (Hematology…, 2018). Смещение отношения S : Se в сторону увеличения у сигов из Большой Имандры (рис. 2) указывает на преобладание SeCys над SeMet и активацию селеноферментов в том числе антиоксидантных, что имеет решающее значение в защите как миелоидных и эритроидных клеток, так и других клеток и тканей. Существует значительная избыточность в антимикробном механизме фагоцитов, что позволяет одной системе компенсировать дефект в другой, поскольку используются как окислительные, так и неокислительные системы (Hematology…, 2018). Таким образом, защитный механизм сигов из исторически загрязненной части озера активно использует окислительные системы неспецифического иммунитета, тогда как этот выбор у сигов из незагрязненной части озера реализуется в пользу неокислительного пути, используя адаптивный специфический иммунитет.
Гистопатология органов
Гистопатологический анализ является эффективным и чувствительным инструментом для оценки здоровья рыб и загрязнения окружающей среды в естественных водоемах (Stentiford et al., 2003; van der Oost et al., 2003). Более того гистопатология – это ответ более высокого уровня, отражающий предшествующее изменение физиологической и биохимической функций, они представляют собой совокупность физиологических и химических изменений (Hinton et al., 2017).
Жабры. Деликатный эпителий жабр постоянно находиться в тесном контакте с окружающей средой, токсинами, твердыми частицами и организмами (паразиты, вирусы и бактерий), а также неинфекционными организмами (некоторые виды фитопланктон и зоопланктона), что определяет комплексную многофакторную этиологию заболевания жабр (Herrero et al., 2018). Гистопатология жабр сигов была представлена множественными деформациями жаберного эпителия и достигала наибольших значений индекса патологичности в отличие от других органов (табл. 4).
Таблица 4.
Средние значения и стандартные ошибки патологий жабр, печени и почек рыб, а также некоторые морфометрические параметры жабр
| Гистологические и морфологические параметры | Большая Имандра | Йокостровская и Бабинская Имандра |
|---|---|---|
| Жабры | ||
| Влажность жабр (%) | 79.6 ± 0.5 | 83.2 ± 1.4 |
| Ширина вторичных ламелл | 32.7 ± 1.2 | 44.5 ± 3.5 |
| Число слоeв вставочного эпителия | 4.3 ± 0.3 | 5.1 ± 0.1 |
| Количество слизистых клеток 1 мм2 | 324 ± 31 | 252 ± 91 |
| Патологии жабр (%): | ||
| Цитолиз, плазмолиз, гиперплазия (w = 1) | 16.0 ± 3.1 | 28.2 ± 9.7 |
| Утолщение на концах ламелл (w = 1) | 1.39 ± 0.88 | 0.28 ± 0.20 |
| Аневризма (w = 2) | 0.97 ± 0.57 | 0 |
| Слияние ламелл (w = 2) | 4.79 ± 1.37 | 1.35 ± 0.76 |
| Десквамация ламелл (w = 3) | 2.68 ± 1.33 | 4.32 ± 2.02 |
| Разрушение ламелл (w = 3) | 3.11 ± 1.48 | 0 |
| Сумма патологий (%) | 29.0 ± 3.8 | 34.2 ± 11.0 |
| Гистапологический индекс жабр (Iжабры) | 0.46 ± 0.08 | 0.44 ± 0.14 |
| Печень | ||
| Влажность печени (%) | 74.3 ± 0.4 | 77.8 ± 1.4 |
| Патологии печени(%): | ||
| Фиброз кровеносных сосудов (w = 2) | 0.09 ± 0.05 | 0.38 ± 0.12 |
| Фиброз желчных протоков (w = 2) | 0.03 ± 0.02 | 0.05 ± 0.03 |
| Некроз (w = 3) | 0.45 ± 0.12 | 2.32 ± 0.89 |
| Сумма патологий (%) | 0.58 ± 0.13 | 2.77 ± 1.01 |
| Гистапологический индекс печени (Iпечень) | 0.016 ± 0.004 | 0.078 ± 0.029 |
| Почка | ||
| Влажность почек (%) | 78.6 ± 0.6 | 80.3 ± 0.8 |
| Патологии почек (%): | ||
| Мелано-макрофагальные центры (ММЦ) (w = 1) | 0.82 ± 0.24 | 1.66 ± 0.64 |
| Нефрокальцитоз (w = 2) | 2.2 × 10–6 ± 1.4 × 10–6 | 2.6 × 10–6 ± 2.4 × 10–6 |
| Фиброэластоз извилистых канальцев (w = 2) | 1.00 ± 0.61 | 0.23 ± 0.18 |
| Фиброэластоз кровеносных сосудов (w = 2) | 0.16 ± 0.08 | 0.11 ± 0.03 |
| Кровотечения (w = 2) | 0.44 ± 0.19 | 0.30 ± 0.13 |
| Некроз (w = 3) | 2.52 ± 1.92 | 1.41 ± 0.38 |
| Сумма патологий (%) | 4.92 ± 2.14 | 3.71 ± 0.92 |
| Гистапологический индекс почек (Iпочка) | 0.120 ± 0.060 | 0.075 ± 0.016 |
Цитолиз, плазмолиз и гиперплазию можно рассматривать как первые реакции на внешние факторы. Цитоплазматические изменения сопровождались увеличением влажности жабр (табл. 5), чему могут способствовать гипотонические пресные воды. Главное, ширина вторичных ламелл коррелировала со степенью развития этих реакций (r = 0.766, p < 0.001). Nero и др. (2006) показали, что морфометрические данные жабр могут дать доказательства возможных респираторных нарушений: увеличение ширины вторичных ламелл значительно сокращает межламеллярное расстояние, и как результат, доля вторичных ламелл, доступных для газообмена, также значительно сокращается. Плохое поглощение кислорода компенсировалась усилением эритропоэза и высвобождением как зрелых, так и незрелых эритроцитов в общую циркуляцию крови (табл. 5). Следует заметить, что эти реакции были более характерны для сигов из незагрязненной части озера, демонстрирующие также увеличение лейкоцитов при росте числа лимфоцитов и снижении моноцитов, нейтрофилов и особенно более зрелых сегментоядерных нейтрофилов (табл. 3, 5).
Таблица 5.
Коэффициенты корреляции морфометрических параметров и гистопатологических изменений жабр в зависимости от гематологических параметров и физиологического состояния, а также биоаккумуляции элементов в жабрах сигов
| Параметры | Ширина вторичных ламелл | Количество слизистых клеток | Цитолиз, плазмолиз, гиперплазия | Аневризма | Структурные нарушения | Iжабры |
|---|---|---|---|---|---|---|
| Влажность жабр | 0.753*** | – | 0.669** | – | – | |
| Зрелые эритроциты | 0.748*** | –0.711** | 0.608* | – | – | 0.715** |
| Незрелые эритроциты | 0.783*** | –0.707** | 0.669** | – | – | |
| Базофильные эритробласты | 0.947*** | –0.616* | – | – | 0.748** | 0.785*** |
| Полихроматофильные эритробласты | 0.627* | –0.770*** | 0.786*** | – | – | – |
| Лейкоциты | 0.812*** | –0.803*** | – | – | 0.682** | 0.866*** |
| Лимфоциты | 0.787*** | –0.779*** | – | – | – | – |
| Моноциты | –0.622* | – | – | – | 0.792*** | – |
| Макрофаги | – | – | – | 0.816*** | – | – |
| Нейтрофилы | –0.620* | – | – | – | 0.833*** | – |
| Сегментоядерные нейтрофилы | –0.684** | – | – | – | 0.782*** | – |
| Zn | – | – | – | 0.604* | – | – |
| Co | – | 0.698** | – | – | – | – |
| Se | 0.674** | – | – | – | – | – |
| B | – | – | – | 0.745*** | – | 0.596* |
| Ni | – | 0.665** | – | – | – | – |
| Hg | 0.636** | – | – | – | 0.617* | 0.671** |
| Cd | – | – | – | 0.598* | – | – |
| Ag | – | – | – | 0.695** | – | – |
| La | – | 0.642** | – | – | 0.782*** | – |
| Ce | – | 0.619* | – | – | 0.685** | – |
| Pr | – | – | – | 0.645** | – |
Жабры рыб являются регулятором “осмореспираторного компромисса”: большая функциональная площадь поверхности респираторного эпителия и небольшое расстояние способствуют абсорбции O2, тогда как функциональная небольшая площадь поверхности и диффузия на большие расстояния способствуют осмо/ионной регуляции; механизмы регулирования включают перераспределение кровотока и/или обратимое ремоделирование структуры (Wood, Eom, 2021). Пролиферативное увеличение клеточной массы эпителия не только во вторичных ламеллах, но и в межламеллярном пространстве (увеличивая число слоев вставочного эпителия) наблюдалось у сигов из незагрязненной части озера (табл. 4). Морфометрические изменения жабр щук (разрастание эпителия ламелл и образование многослойного эпителия филаментов) наблюдались как адаптивные реакции на обще-рассеянное загрязнение низовий р. Волги (Клишин, 2014). Прогрессирующее увеличение пролиферации филаментного эпителия может соответствовать хронической реакцией на стрессовые условия (Monteiro et al., 2008), может выполнять защитные функции от загрязнителей, активных форм O2, паразитов, а также обеспечивать структурную поддержку (Wood, Eom, 2021).
Серьезные циркуляционные нарушения (аневризма) наблюдались только у сигов из исторически загрязненной части озера (табл. 4). Аневризма может быть вызвана прямым действием токсичных веществ, что было продемонстрировано в случаях острой токсичности металлов (Ahmed et al., 2013; Correia et al., 2020), в том числе Cu (Monteiro et al., 2008). Острая токсичность Cu связана с нарушением осморегуляции (Fish Physiology…, 2012), ингибирование NKA в жабрах и потеря Na+ и Cl– в плазме наблюдались в экспериментах (Monteiro et al., 2005), что привод к гипертонической сердечно-сосудистой недостаточности (уменьшение объема плазмы и набухание клеток крови повышает гематокрит, вязкость крови и сопротивление сосудов) (Fish Physiology…, 2012), отеки и аневризмы были быстро развивающимися поражениями (Monteiro et al., 2008). Острая токсичность Cu была в прошлом, и сейчас Cu находится под гомеостатическим контролем. Например, у рыб из исторически загрязненного Cu участка ручья ключевую роль в регуляции накопления проявили жабры в реакции увеличения экспрессии генов металлотионеина (MT) и мембранных белков транспортеров ATP7A и CTR1 (Abril et al., 2018).
Формирование аневризмы связано с повреждением столбчатых клеток и нарушением целостности сосудов с выделением большого количества крови, которая выталкивает ламеллярный эпителий наружу (Ahmed et al., 2013; Martinez et al., 2004). Обнаруженная взаимосвязь увеличения числа макрофагов в крови с развитием аневризмы в респираторных ламеллах (табл. 5) может указывать на прогрессирующие воспалительные реакции. Заметное влияние соединения 48/80 (мощный высвобождающий гистамин агент) на резистентность перфузируемого жаберного сосудистого русла радужной форели указывает на то, что вещества, высвобождаемые при дегрануляции гранулоцитов, могут вызывать вазомоторные реакции (Reite, Evensen, 2006). Иммуногистохимические методы идентифицировали присутствие химических медиаторов, таких как триптаза (вовлеченная в репарации эпителия, деградации тканей, привлечении гранулоцитов) и химаза (вазоактивный пептид, участвующий в ремоделировании тканей, разрушающий белки внеклеточного матрикса) в цитоплазматических гранулах тучных клеток Centropomus parallelus (da Silva et al., 2017). С другой стороны, истончение стенок сосудов также могло вызывать миграцию фагоцитарных клеток в орган. Так или иначе, повышенная фагоцитарная активность, по-видимому, могла быть провоцирующим стимулом развития аневризмы у сигов из Большой Имандры.
Слизистые клетки жабр обеспечивают жизненно важную защиту тонкой структуры и эпителия жабр и действуют как первичная ловушка для экзогенных веществ (Costa et al., 2009). Тучные клетки рыб участвуют в индукции воспалительных реакций не только через пролиферацию и рекрутирование лейкоцитов, увеличение проницаемости сосудов, но и производство слизи бокаловидными клетками (Galindo-Villegas et al., 2016). Количество слизистых клеток в жабрах сигов из Большой Имандры было несколько больше, хотя достоверных отличий не было обнаружено, что может быть связано и с их большими серьезными структурными повреждениями (табл. 4). Регрессия слизистых клеток жабр, связанная со структурными повреждениями, такими как слияние и деформация ламелл, наблюдалась у ювенильных особей Solea senegalensis, подвергшихся воздействию загрязненных отложений (Costa et al., 2009). Структурные повреждения жабр провоцировали рост незрелых базофильных эритробластов, лейкоцитов, в особенности фагоцитов (моноцитов и нейтрофилов), а также способствовали проникновению и аккумуляции Hg и лантаноидов (табл. 5).
Таким образом, если защитные реакции сигов из незагрязненной части озера связаны с пролиферативными изменениями, обеспечивая структурную поддержку, но ухудшая газообмен, то адаптивная стратегия сигов из исторически загрязненной части озера направлена на снижение компенсаторной пролиферации тем самым улучшая газообмен, даже если это чревато их структурными повреждениями.
Печень участвует в метаболизме загрязняющих веществ, что делает ее и мишенью, и органом, который защищает себя (Hinton et al., 2017). Если гистопатологические отклонения печени сигов из незагрязненной части озера были более значительны, то они были ничтожны у сигов из исторически загрязненной части озера (табл. 4). Наиболее частыми поражениями ткани печени были фиброз и некроз. Эти поражения, а также общий показатель гистопатологии печени (Iпечень) коррелируют с биоаккумуляцией Fe, Cu, Se, Ni, и W (табл. 6).
Таблица 6.
Коэффициенты корреляции гистопатологических изменений печени и почки в зависимости от гематологических параметров, а также биоаккумуляции элементов в органах сигов
| Параметры | Печень | Почка | ||||||
|---|---|---|---|---|---|---|---|---|
| фиброз кровеносных сосудов | некроз | Iпечень | ММЦ | кровотечения | фиброэластоз | некроз | Iпочка | |
| Незрелые эритроциты | – | – | – | – | – | 0.590* | – | 0.607* |
| Базофильные эритробласты | – | – | – | – | – | 0.613* | – | – |
| Полихроматофильные эритробласты | – | – | – | – | –0.602* | – | 0.752*** | 0.679** |
| Нейтрофилы | – | – | – | – | 0.675** | – | – | – |
| Палочкоядерные нейтрофилы | – | – | – | – | 0.646** | – | – | – |
| Сегментоядерные нейтрофилы | – | – | – | – | 0.619* | – | – | – |
| Са | – | – | – | 0.771*** | – | – | – | – |
| Fe | 0.751** | 0.633** | 0.649** | – | – | – | – | – |
| Zn | – | – | – | – | – | 0.719** | 0.707** | 0.686** |
| Cu | 0.726** | 0.639** | 0.654** | 0.759*** | – | – | – | – |
| Co | – | – | – | – | – | 0.626* | 0.781*** | 0.716** |
| Se | – | 0.697** | 0.692** | – | – | – | – | – |
| Ni | 0.638** | 0.741** | 0.742** | – | – | – | – | – |
| Ag | 0.602* | – | – | – | 0.688** | – | – | – |
| W | 0.664** | 0.739** | 0.744** | 0.828*** | – | – | – | – |
| Sb | – | – | – | 0.637** | – | – | – | – |
| Bi | – | – | – | – | 0.701** | – | – | – |
| Sr | – | – | – | 0.650** | – | – | – | – |
Готовность к эндоцитозу и фагоцитозу поддерживается антиоксидантным статусом рыб (взаимосвязь нейтрофилов (r = 0.627, p < 0.01), сегментоядерных нейтрофилов (r = 0.654, p < 0.005) и моноцитов в крови (r = 0.699, p < 0.001) с отношением S : Se в печени рыб). Следует заметить, что биоаккумуляция Ni и W наблюдается, наоборот, с понижением антиоксидантного статуса (r = –0.649, p < 0.005 и r = –0.613, p < 0.01 соответственно), и их биоаккумуляция напрямую связана с поражениями печени. Парадоксально, что токсичное воздействие Ni проявилось в нетипичном органе, а именно в печени, тогда как в период интенсивного загрязнения его токсичное воздействие было связано с значительными патологиями почек (нефрокальцитоз, фиброэластоз) (Moiseenko, Kudryavtseva, 2001).
Следует также учитывать что, фагоцитарная активность приносит не только разрушение и воспалительные реакции, но и положительные эффекты, запускающие репаративные реакции. Например, стимуляция фагоцитов карпа in vitro и in vivo увеличивала экспрессию гена металлопротеиназы 9 (MMP-9), более того двухфазный профиль экспрессии мРНК MMP-9 указывал на участие во время начальной фазы воспаления и во время более поздней фазы ремоделирования ткани (Chadzinska et al., 2008).
Метаболизм и хранение таких эссенциальных металлов как Fe, Cu и Se в основном осуществляется в печени. Если они активно используются у сигов из исторически загрязненной части озера, то они, по-видимому, запасаются и захораниваются в ферритине и гемосидерине для Fe, церулоплазмине и MT для Cu и SeMet для Se, что может составлять как запасной пул, так и вероятную причину токсичности у сигов из незагрязненной части озера. Таким образом, тонкая грань между эссенциальностью и токсичностью Fe, Cu и Se проявилась у сигов из исторически загрязненной и незагрязненной частей озера.
Почки. Значительная часть зажаберной крови проходит через почки рыб и, следовательно, поражения почек могут являться индикатором интоксикации организма (Mishra, Mohanty, 2008; Ortiz et al., 2003). С другой стороны общая интоксикация, по-видимому, может налагать дополнительную нагрузку на почки в выведении не только токсичных веществ, но и эндогенных отходов. Хотя достоверных отличий в патологиях почек не было обнаружено (табл. 4), но механизмы, вовлеченные в процессы детоксикации и утилизации, могут сильно различаться (рис. 4).
Рис. 4.
Процентное количество мелано-макрофагальные центров (ММЦ) в почках, фагоцитов (моноцитов и макрофагов) в периферической крови у сигов с уровнем лейкоцитов <12 × 103 клеток/мм3 из Большой Имандры (1) и у сига с уровнем лейкоцитов >12 × 103 клеток/мм3 из Йокостровской и Бабинской Имандры (2).
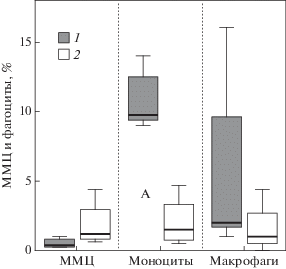
Аутофагия – важный эволюционный механизм для поддержания гомеостаза и достижения клеточного обновления, а также важный регуляторный механизмам адаптации к внутренней и внешней среде (Xia et al., 2019). Мононуклеарные фагоциты (моноциты и макрофаги) влияют на эффективность процессов эндоцитоза и деградации (Whyte, 2007). С другой стороны, функции мелано-макрофагальных центров (ММЦ) – иммунные; хранение, разрушение и детоксикация экзогенных и эндогенных веществ; рециркуляция Fe (Заботкина, 2017). Большое количество моноцитов, циркулирующих в периферической крови у сигов из Большой Имандры (табл. 4), предполагает и большее количество резидентных клеток, включая макрофагов. Помимо нейтрофилов другие фагоциты (макрофаги), заселяют в большей степени почку рыб среди всех иммунных органов в условиях загрязнения (Лапирова, Заботкина, 2010). Если увеличение числа и площади ММЦ при снижении моноцитов и макрофагов наблюдалось у сигов из незагрязненной части озера, то наоборот снижение ММЦ при увеличении моноцитов и макрофагов было у сигов из исторически загрязненной части озера (рис. 4). Увеличение ММЦ, по-видимому, является следствием того, что мононуклеарные фагоциты не справляются с утилизаций экзогенных и эндогенных веществ. Различия у сигов из исторически загрязненной и незагрязненной частей озера могут быть следствием долгосрочных проявлений в реакциях активации и потенциала эндо- и фагоцитоза. Более значительная эффективность эндо- и фагоцитоза была по прошествии 10 лет спада токсичной нагрузки (2006–2007 гг.), когда накопление Cu, Al, Sr, Cr, Pb и Hg в почках было вдвое меньше, а Cd – в 10 раз меньше у сигов из загрязненной части озера (Gashkina et al., 2020). ММЦ могут накапливать в гранулах меланина большой спектр металлов (Заботкина, 2017), наблюдается большая аккумуляция Ca, Cu, W, Sb и Sr (табл. 6).
Циркуляционные нарушения, такие как кровотечение, наблюдались у сигов из всех плесов озера (табл. 4), и были связаны с воспалительными процессами и увеличением нейтрофилов в крови, а также с биоаккумуляцией Ag и Bi (табл. 6).
Фиброэластоз и некроз, а также гистопатологический индекс почки (Iпочка) ассоциированы с биоаккумуляцией Zn и Co (табл. 6). Цинк действует как межклеточное, так и внутриклеточное сигнальное вещество как вторичный мессенджер (через активацию фактора транскрипции металлов (MTF-1)); цитозольная концентрация Zn должна поддерживаться на очень низком уровне из-за его способности влиять на активность большого числа молекул в клетках (регуляция пролиферации клеток, инсулино-миметические воздействие, продукция цитокинов в моноцитах, дегрануляция тучных клеток, апоптоз лимфоцитов и др.); в цитозоле Zn связывается MT и глутатионом с последующей транслокацией в глубокие места хранения (Fish Physiology…, 2012). Ratn et al. (2018) показали, что Zn накапливается в почке рыб больше, чем в печени, и нарушения равновесной динамики нормального окислительного метаболизма (когда запущенная активация антиоксидантной системы превышает потенциал нейтрализации антиоксидантов (снижение содержания глутатиона)) приводят к последующим повреждениям ДНК и белков и вызывает дегенеративные изменения клубочков. Кобальт при любых экзогенных и эндогенных условиях перераспределяется в почку рыб (Гашкина, 2017). Если Со, как хорошо известно, является ключевым компонентом кобаламина (витамина B12) и также кофактором различных ферментов, то недавно было показано, что он является имитатором гипоксии и сигналом накопления поврежденных реактивными видами кислорода протеинов в почке рыб (Kubrak et al., 2011). Таким образом, повышенная аккумуляция Zn и Co в почке рыб может служить маркером переизбытка накопления клеточного мусора и признаком того, что фагоцитарная система не справляется с их утилизацией.
ЗАКЛЮЧЕНИЕ
Озеро Имандра, в прошлом интенсивно загрязняемый водоем тяжелыми металлами, является уникальной моделью для исследования физиологических ре-адаптаций рыб к улучшению условий после снижения поступления металлов. Адаптация рыб на примере сигов из исторически загрязненного озера Имандра позволила выявить направленность защитных реакций и особенности метаболизма микроэлементов в период снижения загрязнения. Продолжительное воздействие металлов в период высокой токсичности на популяцию обитающих здесь сигов сформировало у них механизмы контроля гомеостаза металлов в организме, а также компенсаторные реакции на нарушенные функции, позволяя рыбам выжить и выдерживать воздействия высоких концентраций. Доказано повышение эффективности работы антиоксидантной системы организма, как основного эволюционного механизма защиты организма. Смещение отношения S : Se в сторону увеличения у сигов из Большой Имандры указывает на преобладание селеноцистеина над селенометионином и активацию селеноферментов в том числе антиоксидантных, что имеет решающее значение в защите как миелоидных и эритроидных клеток, так и других клеток и тканей. Притом защитный механизм сигов из исторически загрязненной части озера активно использует окислительные системы неспецифического иммунитета, тогда как этот выбор у сигов из незагрязненной части озера реализуется в пользу неокислительного пути, используя адаптивный специфический иммунитет. Выявлена роль микроэлементов в развитии патологических процессов: повышенная аккумуляция Fe, Cu и Se в печени рыб может служить маркером патологических отклонений печени, тогда как повышенная аккумуляция Zn и Co в почке указывает на то, что фагоцитарная система не справляется с утилизацией экзогенных и эндогенных веществ, способствуя дегенеративным изменениям почки.
Исследования выполнены в рамках Госзадания ГЕОХИ РАН № 0137-2019-0008.
Список литературы
Виноградов А.П. (1963) Биогеохимические провинции и их роль в органической эволюции. Геохимия. (3), 199-242.
Гашкина Н.А. (2017) Эссенциальные элементы в органах и тканях рыб в зависимости от токсичности среды обитания и физиологического состояния. Геохимия. 55(10), 934-941.
Gashkina N.A. (2017) Essential elements in the organs and tissues of fish depending on the freshwater toxicity and physiological state. Geochem. Int. 55(10), 927-934.
Гашкина Н.А., Моисеенко Т.И. (2020) Адаптация метаболизма рыб к тепловому загрязнению АЭС субарктического оз. Имандра. Геохимия. 65(10), 969-983.
Gashkina N.A., Moiseenko T.I. (2020) Adaptation of Fish Metabolism to Thermal Pollution of Subarctic Lake Imandra. Geochem. Int. 58(10), 1110-1122.
Ермаков В.В.(1995) Биогеохимические провинции: концепция, классификация и экологическая оценка. Основные направления геохимии. К 100-летию со дня рождения академика А.П. Виноградова. М.: Наука, 183-196.
Заботкина Е.А. (2017) Влияние токсикантов органической и неорганической природы на структуру мелано-макрофагальных центров у костистых рыб (обзор). Труды ИБВВ РАН. 77(80), 20-32.
Заботкина Е.А., Лапирова Т.Б., Назарова Е.А. (2009) Влияние ионов кадмия на морфофункциональные и иммунофиологические показатели сеголеток речного окуня Perca Fluviatilis (Perciformes, Percidae). Вопросы ихтиологии. 49(1), 117-124.
Клишин А.Ю. (2014) Морфункциональные изменения ламелл и филаментов жабр щуки (Esox lucius). Общество и цивилизация в ХХI в.: тенденции и перспективы развития. Воронеж: Научно-исследовательские публикации, 25-29.
Ковальский В.В. (1963). Возникновение и эволюция биосферы. Успехи совр. биолог. 55(1), 45-67.
Ковальский В.В. (1974) Геохимическая экология. М.: Наука, 299 с.
Крылов О.Н. (1980) Пособие по профилактике и диагностике отравлений рыб вредными веществами. М., 80с.
Лапирова Т.Б., Заботкина Е.А. (2010) Сравнительный анализ показателей иммунофизиолоческого состояние леща Abramis Brama (L.) из различных по степени загрязнения участков Рыбинского водохранилища. Биология внутренних вод. 3(2), 86-91.
Моисеенко Т.И., Гашкина Н.А., Шаров А.Н., Вандыш О.И., Кудрявцева Л.П. (2009) Антропогенная трансформация арктической экосистемы озера Имандра: тенденции к востановлению после длительного периода загрязнения. Водные ресурсы. 36 (3), 312-325.
Моисеенко Т.И., Даувальтер В.А, Лукин А.А., Кудрявцева Л.П., Ильящук Б.П., Ильящук Л.И., Сандимиров С.С., Каган Л.Я., Вандыш О.И., Шаров А.Н., Шарова Ю.Н., Королева И.Н. (2002) Антропогенные модификации экосистемы озера Имандра. М.: Наука, 476 с.
Нормативы качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения. (2011) М.: ВНИРО, 257 с.
Правдин И.Ф. (1966) Руководство по изучению рыб. М.: Пищевая промышленность, 376 с.
Abril S.I.M., Dalmolin C., Costa P.G., Bianchini A. (2018) Expression of genes related to metal metabolism in the freshwater fish Hyphessobrycon luetkenii living in a historically contaminated area associated with copper mining. Environ. Toxicol. Pharmacol. 60, 146-156.
Agamy E. (2012) Histopathological liver alterations in juvenile rabbit fish (Siganus canaliculatus) exposed to light Arabian crude oil, dispersed oil and dispersant. Ecotoxicol. Environ. Saf. 75, 171-179.
Ahmed M.K., Al-Mamun M.H., Parvin E., Akter M.S., Khan M.S. (2013) Arsenic induced toxicity and histopathological changes in gill and liver tissue of freshwater fish, tilapia (Oreochromis mossambicus). Exp. Tox. Pathol. 65(6), 903-909.
Bernet D., Schmidt H., Meier W., Burkhardt-Holm P., Wahli T. (1999) Histopathology in fish: proposal for a protocol to assess aquatic pollution. J. Fish Dis. 22, 25-34.
Chadzinska M., Baginski P., Kolaczkowska E., Savelkoul H.F.J., Kemenade B.M.L.V. (2008) Expression profiles of matrix metalloproteinase 9 in teleost fish provide evidence for its active role in initiation and resolution of inflammation. Immunology. 125, 601-610.
Clark N.J., Shaw B.J., Handy R.D. (2018) Low hazard of silver nanoparticles and silver nitrate to the haematopoietic system of rainbow trout. Ecotoxicol. Environ. Saf. 152, 121-131.
Correia A.T., Rebelo D., Marques J., Nunes B. (2019) Effects of the chronic exposure to cerium dioxide nanoparticles in Oncorhynchus mykiss: Assessment of oxidative stress, neurotoxicity and histological alterations. Environ. Toxicol. Phar. 68, 27-36.
Correia, A.T., Rodrigues, S., Ferreira-Martins, D., Nunes, A.C., Ribeiro, M.I., Antunes, S.C. (2020) Multi-biomarker approach to assess the acute effects of cerium dioxide nanoparticles in gills, liver and kidney of Oncorhynchus mykiss, Comp. Biochem. Physiol. C: Pharmacol. Toxicol. 238, 108842.
Costa P.M., Diniz M.S., Caeiro S., Lobo J., Martins M., Ferreira A.M., Caetano M., Vale C., DelValls T.Á., Costa M.H. (2009) Histological biomarkers in liver and gills of juvenile Solea senegalensis exposed o contaminated estuarine sediments: A weighted indices approach. Aquat. Toxicol. 92, 202-212.
da Silva W.F., Egami M.I., Santos A.A., Antoniazzi M.A., Silva M., Gutierre R.C., Paiva M.J.R. (2011) Cytochemical, immunocytochemical and ultrastructural observations on leukocytes and thrombocytes of fat snook (Centropomus parallelus). Fish Shellfish Immunol. 31, 571-577.
da Silva W.F., Simões M.J., Gutierre R.C., Egami M.I., Santos A.A., Antoniazzi M.M., Sasso G.R., Ranzani-Paiva M.J.T. (2017). Special dyeing, histochemistry, immunohistochemistry and ultrastructure: A study of mast cells/eosinophilic granules cells (MCs/EGC) from Centropomus parallelus intestine. Fish Shellfish Immunol. 60, 502-508.
Elahee K.B., Bhagwant S. (2007) Hematological and gill histopathological parameters of three tropical fish species from a polluted lagoon on the west coast of Mauritius. Ecotoxicol. Environ. Saf. 68, 361-371.
Fish Physiology: Homeostasis and Toxicology of Essential Metals. (2012) (Eds. Wood C.M., Farrell A.P., Brauner C.J.) London: Academic Press. V. 31A, 520 p.
Galindo-Villegas J., Garcia-Garcia E., Mulero V. (2016) Role of histamine in the regulation of intestinal immunity in fish. Dev. Comp. Immunol. 64, 178-186.
Gashkina N.A., Moiseenko T.I. 2020. Influence of Thermal Pollution on the Physiological Conditions and Bioaccumulation of Metals, Metalloids, and Trace Metals in Whitefish (Coregonus lavaretus L.). Int. J. Mol. Sci. 12, 4343.
Gashkina N.A., Moiseenko T.I., Kudryavtseva L.P. (2020) Fish response of metal bioaccumulation to reduced toxic load on long-term contaminated Lake Imandra. Ecotoxicol. Environ. Saf. 191, 110205.
Griffith M.B. (2017) Toxicological perspective on the osmoregulation and ionoregulation physiology of major ions by freshwater animals: Teleost fish, crustacea, aquatic insects, and Mollusca. Environ. Toxicol. Chem. 36(3), 576-600.
Handbook on the Toxicology of Metals. (2007) 3th edition. Hardcover, Amsterdam, Boston: Academic Press. 1024 p.
Hematology: Basic Principles and Practice. (2018) (Eds. Hoffman R., Benz E.J., Silberstein L.E., Heslop H.E., Weitz J.I., Anastasi J., Salama M.E., Abutalib S.A.), 7th ed. Philadelphia: Elsevier. 2408 p.
Herrero A., Thompson K.D., Ashby A., Rodger H.D., Dagleish M.P. (2018) Complex Gill Disease: an Emerging Syndrome in Farmed Atlantic Salmon (Salmo salar L.). J. Comp. Path. 163, 23-28.
Hinton D.E., Baumann P.C., Gardner G.C., Hawkins W.E., Hendricks J.D., Murchelano R.A., Okihiro M.S. (2017) Histopathologic biomarkers. In Biomarkers: Biochemical, Physiological and Histological Markers of Anthropogenic Stress, (Eds. Huggett R.J., Kimerly R.A., Mehrle P.M., Bergman H.L.) Boca Raton, London, N.Y.: CRC Press. pp. 155-210.
Kaya H., Aydın F., Gürkan M., Yılmaz S., Ates M., Demir V., Arslan Z. (2016) A comparative toxicity study between small and large size zinc oxide nanoparticles in tilapia (Oreochromis niloticus): Organ pathologies, osmoregulatory responses and immunological parameters. Chemosphere. 144, 571-582.
Kubrak O.I., Husak V.V., Rovenko B.M., Storey J.M., Storey K.B., Lushchak V.I. (2011) Cobalt-induced oxidative stress in brain, liver and kidney of goldfish Carassius auratus. Chemosphere. 85, 983-989. 8
Martinez C.B., Nagae M.Y., Zaia C.T.B., Zaia D.M.A. (2004) Morphological and physiological acute effects of lead in the neotropical fish Prochilodus lineatus. Brazil. J. Biol. 64, 797-807.
Mishra A.K., Mohanty B. (2008) Acute toxicity impacts of hexavalent chromium on behavior and histopathology of gill, kidney and liver of the freshwater fish, Channa punctatus (Bloch). Environ. Toxicol. Pharmacol. 26, 136-141.
Moiseenko T., Sharov A. (2019) Large Russian Lakes Ladoga, Onega, and Imandra under Strong Pollution and in the Period of Revitalization: A Review. Geosciences. 9(12), 492.
Moiseenko T.I. Kudryavtseva L.P. (2001) Trace metals accumulation and fish pathologies in areas affected by mining and metallurgical enterprises in the Kola Region, Russia. Environ. Pollut. 114(2), 285-297.
Moiseenko T.I., Morgunov B.A., Gashkina N.A., Megorskiy V.V., Pesiakova A.A. (2018) Ecosystem and human health assessment in relation to aquatic environment pollution by heavy metals: case study of northwest of the Russian arctic, Kola peninsula. Environ. Res. Lett. 13, 065005.
Monteiro S.M., Mancera J.M., Fontaínhas-Fernandes A., Sousa M. (2005) Copper induced alterations of biochemical parameters in the gill and plasma of Oreochromis niloticus. Comp. Biochem. Physiol. C: Pharmacol. Toxicol. 141, 375-383.
Monteiro S.M., Rocha E., Fontaínhas-Fernandes A., Sousa M. (2008). Quantitative histopathology of Oreochromis niloticus gills after copper exposure. J. Fish Biol. 73, 1376-1392.
Nero N., Farwell A., Lister A., van Der Kraak G., Lee L.E.J., van Meer T., MacKinnon M.D., Dixon D.G. (2006) Gill and liver histopathological changes in yellow perch (Perca flavescens) and goldfish (Carassius auratus) exposed to oil sands process-affected water. Ecotoxicol. Environ. Saf. 63, 365-377
Nogueira-Pedro A., dos Santos G.G., Oliveira D.C., Hastreiter A.A., Fock R.A. (2016) Erythropoiesis in vertebrates: from ontogeny to clinical relevance. Frontiers in Bioscience, Elite. 8, 100-112.
Ortiz J.B., De Canales M.L.G., Sarasquete C. (2003) Histopathological changes induced by lindane (γ-HCH) in various organs of fishes. Sci. Mar. 67(1), 53-61.
Palikova M., Papezikova I., Markova Z., Navratil S., Mares J., Mares L., Vojtek L., Hyrsl P., Jelinkova E., Schmidt-Posthaus H. (2017). Proliferative kidney disease in rainbow trout (Oncorhynchus mykiss) under intensive breeding conditions: Pathogenesis and haematological and immune parameters. Vet. Parasitol. 238, 5-16.
Pijanowski L., Verburg-van Kemenade B.M., Chadzinska M. (2020) Chemokine CXCb1 stimulates formation of NETs in trunk kidney neutrophils of common carp. Dev. Comp. Immunol. 103, 103521.
Ratn A., Prasad R., Awasthi Y., Kumar M., Misra A., Trivedi S.P. (2018) Zn2+ induced molecular responses associated with oxidative stress, DNA damage and histopathological lesions in liver and kidney of the fish, Channa punctatus (Bloch, 1793). Ecotoxicol. Environ. Saf. 151, 10-20.
Reite O.B., Evensen Ø. (2006) Inflammatory cells of teleostean fish: A review focusing on mast cells/eosinophilic granule cells and rodlet cells. Fish Shellfish Immunol. 20, 192-208.
Sakamoto M., Yasutake A., Domingo J., Chan H.M., Kubota M., Murata K. (2013) Relationships between trace elements concentration in chorionic tissue of placenta and umbilical cord tissue: Potential use as indicators for prenatal exposure Environ. Intern. 60, 106-111.
Stentiford G.D., Longshaw M., Lyons B.P, Jones G., Green M., Feist S.W. (2003) Histopathological biomarkers in estuarine fish species for the assessment of biological effects of contaminants. Mar. Environ. Res. 55, 137-159.
Talukdar B., Kalita H.K., Basumatary S., Saikia D.J., Sarma D. (2017) Cytotoxic and genotoxic affects of acid mine drainage on fish Channa punctata (Bloch). Ecotoxicol. Environ. Saf. 144, 72-78.
van der Oost R., Beyer J., Vermeulen N.P.E. (2003) Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environ. Toxicol. Pharmacol. 13, 57-149.
Wang Y., Fang J., Leonard S.S., Rao K.M. (2004) Cadmium inhibits the electron transfer chain and induces reactive oxygen species. Free Radic. Biol. Med. 36, 1434-1443.
Whitfield A.K., Elliott M. (2002) Fish as indicators of environmental and ecological changes within estuaries: a review of progress and some suggestions for the future. J. Fish Biol. 61, 229-250.
Whyte S.K. (2007) The innate immune response of finfish – A review of current knowledge. Fish Shellfish Immunol. 23, 1127-1151.
Wood C.M., Eom J. (2021). The osmorespiratory compromise in the fish gill. Comp. Biochem. Physiol. A: Physiol. 254, 110 895.
Xia X., Wang X., Qin W., Jiang J., Cheng L. (2019) Emerging regulatory mechanisms and functions of autophagy in fish. Aquaculture 511, 734212.
Yeom D.-H., Adams S.M. (2007) Assessing effects of stress across levels of biological organization using an aquatic ecosystem health index. Ecotoxicol. Environ. Saf. 67, 286-295.
Дополнительные материалы отсутствуют.