Геохимия, 2022, T. 67, № 3, стр. 274-287
Роль бриофитов в миграции урана, радия-226 и щелочноземельных элементов в таежных водных и наземных экосистемах
Л. М. Шапошникова a, *, Н. Г. Рачкова a, **
a Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: shaposhnikova.l.m@ib.komisc.ru
** E-mail: rachkova@ib.komisc.ru
Поступила в редакцию 09.03.2020
После доработки 16.09.2020
Принята к публикации 03.11.2020
- EDN: FUWOLE
- DOI: 10.31857/S0016752522030074
Аннотация
Статья посвящена исследованию закономерностей включения компонентов техногенных загрязнений в биомассу бриофитов. В работе представлены результаты химического фракционирования образцов водных (Calliergon giganteum) и наземных (Sphagnum girgensohnii, Pleurozium schreberi) мхов северотаежных экосистем, нарушенных в результате добычи радия, с целью оценки барьерной роли бриофитов в миграции радионуклидов U, 226Ra и его элементов-аналогов Са, Mg, Sr и Ва в загрязненных природных комплексах. Результаты исследования показали, что во фракциях, экстрагируемых из свежей биомассы мхов растворами 1 M CH3COONH4 (рН 7) и 0.1 М H2SO4, доля U составила 4–41% от его общего содержания в бриофитах. Во фракциях, выделяемых в результате разложения образцов мха 30%-ной Н2О2, обнаруживалось 46–55% его общего содержания. В отличие от урана, аккумулирующая способность бриофитов в отношении щелочноземельных элементов преимущественно связана с катионным обменом. Это подтверждается повышенным содержанием элементов II группы во мхах, произрастающих на почвах с высоким содержанием обменных оснований, а также более значительным их содержанием в “обменных” фракциях, экстрагируемых из бриофитов раствором 1 M CH3COONH4. Среди щелочноземельных элементов менее всего извлекался из образцов бриофитов Ва. Суммарное его содержание во фракциях 1 M CH3COONH4 и 0.1 М H2SO4 составило 26–47% от общего содержания элемента во мхах. Суммарная доля Са, Mg и Sr в этих экстрактах была выше и составила 66–88%, доля 226Ra варьировала от 40 до 74%. Таким образом, интенсивность включения в биомассу мхов U, 226Ra, Ba, Са, Mg и Sr из загрязненных сред различается. Биогеохимически наименее подвижны U и Ва, что свидетельствует о значимой барьерной роли бриофитов по отношению к ним. Щелочноземельные элементы по возрастанию биогеохимической подвижности в изученных системах можно расположить в ряд Ba < 226Ra < Sr < Ca < Mg, что подтверждается значениями их коэффициентов накопления мхами и не противоречит основным закономерностям ионного обмена в почвах.
ВВЕДЕНИЕ
Мхи являются важным структурным элементом напочвенного покрова лесных и болотных экосистем. В силу экологических, анатомических и морфофизиологических характеристик им принадлежит существенная роль в аккумуляции из атмосферы, почвы и природных вод загрязняющих веществ, в том числе радионуклидов (Титаева, Таскаев, 1983; Sert et al., 2011; Borylo et al., 2017; Demkova et al., 2019; Zhong et al., 2019). На основе этих свойств в первой половине прошлого века бриофиты успешно использовались в качестве фильтрационного материала при выделении смешанных осадков бария и радия (Кичигин, Таскаев, 2004). В работе (Носкова и др., 2010) была показана значительная аккумуляция радия мхами. Кратность превышения его содержания в золе растений над соответствующим значением показателя в почве достигала 57 раз для плеврозиума Шребери и более чем стократной величины (в 131 раз) – для сфагнума.
В природных экосистемах медленное нарастание и отмирание биомассы мхов, ее высокая удельная поверхность, сорбционная емкость и влагоудерживающая способность, сомкнутость мохового покрова и отсутствие листового опада способствуют общему замедлению биологического круговорота химических элементов (Куликов и др., 1990; Кочева и др., 2002; Сергеева, Мельникова, 2012; Grdoviс S. et al., 2010). Скорость их возврата в миграционные циклы может зависеть от климатических особенностей зоны произрастания мхов, интенсивности поглощения химических элементов биомассой, а также скорости ее разложения.
Особенно велико экологическое значение бриофитов в бореальных и субарктических растительных сообществах, что обусловлено широким ареалом распространения этой группы организмов и их устойчивостью к неблагоприятным климатическим факторам. В последние десятилетия из-за увеличения количества атмосферных осадков и среднегодовой температуры отмечается заметное возрастание участия мхов в напочвенном покрове зоны тайги, изменяются соотношения доминирующих видов мохообразных (Антропогенные …, 2006; Москаленко, 2011). Предполагается, что экологическая роль бриофитов как многофункционального барьера миграции загрязнителей в дальнейшем будет только увеличиваться.
С учетом сказанного возрастает актуальность выявления качественных и количественных показателей поглощения бриофитами поллютантов и связи этих характеристик с компонентами их среды обитания. Для оценки интенсивности процессов поглощения радионуклидов биомассой растений, в том числе мхов, используются метод радиографии (Ding et al., 2012), лабораторные инструментальные исследования структуры растительного материала после его насыщения радионуклидами (Рачкова, Шуктомова, 2006), а также экстракционные методы (Кочева и др., 2002; Броварова и др., 2004; Бондарева, Субботин, 2016; Пучкова и др., 2017). Все методы, как правило, дополняют друг друга. Цель настоящей работы заключалась в выявлении закономерностей поступления из почвы и сравнительном анализе подвижности радионуклидов U, 226Ra, а также его элементов-аналогов Са, Ва, Sr и Mg в биомассе бриофитов радиоактивно загрязненных северотаежных водных и наземных экосистем (Республика Коми) для оценки барьерной роли мхов в миграционных циклах вышеуказанных радионуклидов и щелочноземельных элементов на основе данных химического фракционирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
МАТЕРИАЛЫ И МЕТОДЫ
Образцы мхов собирали в районе расположения бывших заводов по производству радия (рис. 1). Наземные виды – сфагнум Гиргензона (Sphagnum girgensohnii Russow) и плеврозиум Шребера (Pleurozium schreberi (Brid.) Mitt.) – были отобраны в 2017–2018 гг. Мхи доминировали в напочвенном покрове экспериментального участка, занятого смешанным лесом, составленным елью, сосной, ольхой, осиной, березой, рябиной и ивой. Его почвенный покров представлен глее-сильноподзолистой почвой (Русанова, 1972). Коренными являются преимущественно метаморфические породы, в основном глинистые сланцы. Почвообразующие породы представлены зандровыми песками и супесями, залегающими на моренных суглинках. Бриофиты произрастали в 2 локальных зонах участка, отличающихся уровнем радиоактивного загрязнения и мощностью эквивалентной дозы (МЭД) в приземном слое воздуха. В зоне с повышенной МЭД (1.70–3.87 мкЗв/ч) поверхность почвы была загрязнена небольшим слоем производственных отвалов (7–23 см) радиохимического предприятия. Время радиоактивного загрязнения приурочивалось к периоду 1931–1956 гг. (Кичигин, Таскаев, 2004). Вторая зона отбора мхов непосредственно примыкала к загрязненной отвалами части участка. Значения МЭД здесь были приближены к фоновым показателям и составили 0.10–0.15 мкЗв/ч.
Рис. 1.
Схема района исследований и расположения точек пробоотбора (на основании работы (Кичигин, Таскаев, 2004)).
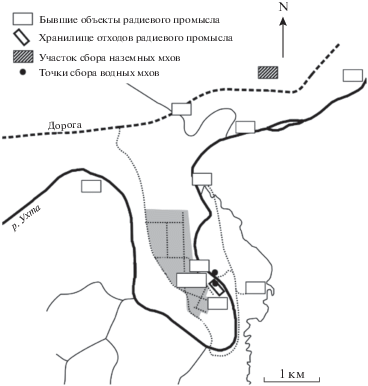
Внесение радиоактивных отходов обусловило изменения физико-химических свойств глее-сильноподзолистой почвы в загрязненной части участка – возросли рН среды, содержание органического вещества (ОВ), поглощенных оснований и подвижной фосфорной кислоты (Русанова, 1972). В настоящее время отвалы покрыты слоем А0 мощностью до 4 см, а незагрязненная отвалами почва, как и ранее, характеризуется меньшей кислотностью (табл. 1). По содержанию подвижного фосфора, органического вещества и обменного Mg2+ почвы радиоактивно загрязненной и фоновой зон не различаются. Содержание поглощенных катионов Сa2+, Ba2+, Sr2+ в зоне загрязнения выше фонового показателя. Отбор почв на физико-химический анализ и определение содержания радионуклидов осуществляли в местах произрастания наземных мхов методом “конверта” до глубины 20 см.
Таблица 1.
Физико-химические характеристики образцов верхних слоев исследуемых почв
| Физико-химический показатель | Зона с условиями, близкими к фоновым (0.10–0.15 мкЗв/ч) | Зона с повышенным радиационным фоном (1.70–3.87 мкЗв/ч) |
|---|---|---|
| рН (сол) | 3.55 ± 0.23 | 4.93 ± 0.18 |
| Р (подв), мг/кг | 209 ± 40 | 192 ± 61 |
| К (подв), мг/кг | 302 ± 70 | 168 ± 42 |
| ГК, ммоль/100 г | 17.1 ± 4.58 | 7.47 ± 2.11 |
| Сa2+, ммоль/100 г | 2.73 ± 0.15 | 14.2 ± 2.25 |
| Mg2+, ммоль/100 г | 0.63 ± 0.02 | 0.60 ± 0.03 |
| Ba2+, ммоль/100 г | 0.02 ± 0.003 | 0.16 ± 0.04 |
| Sr2+, ммоль/100 г | 0.006 ± 0.001 | 0.009 ± 0.001 |
| N, % | 0.15 ± 0.04 | 0.22 ± 0.07 |
| C, % | 5.74 ± 1.13 | 3.92 ± 1.23 |
| ОВ, % | 7.02 ± 1.81 | 6.77 ± 2.03 |
Примечание. Приведены средние значения и их стандартные отклонения; рН (сол)– водородный показатель; Р (подв) – подвижные формы фосфора, в пересчете на P2O5; К (подв) – подвижные формы калия, в пересчете на K2O; ГК – гидролитическая кислотность; Сa2+, Mg2+, Ba2+ Sr2+ содержание обменных катионов, N – общее содержание азота; С – общее содержание углерода; ОВ – содержание органического вещества.
Образцы водных мхов собирали в 2012–2015 гг. на участке русла реки Ухта (приток второго порядка в бассейне р. Печора), расположенном ниже по течению от производственных объектов радиевого промысла, а также на территории приповерхностного хранилища твердых радиоактивных отходов предприятия (рис. 1), включающей пойму р. Ухта, подножие и склон I надпойменной террасы, склон и II надпойменную террасу. Площадка I надпойменной террасы большей частью заболочена. В гидрологическом отношении для района характерны близкое залегание грунтовых вод и водовмещающие породы, сложенные песками различной зернистости, гравием и галькой. В местах пробоотбора на территории хранилища радиационный фон не превышал 0.8 мкЗв/ч, на прибрежном мелководье – 0.14 мкЗв/ч. Таким образом, бриофиты водных экосистем существенно отличались по местам обитания. На мелководье в реке встречались фонтиналис противопожарный (Fontinalis antipyretica Hedw.) и дрепанокладус крючковатый (Drepanocladus aduncus (Hedw.) Warnst.), в болоте и мелких водотоках I надпойменной террасы территории хранилища отходов, через которую осуществлялся транзитный сток радиоактивно загрязненных поверхностных вод в речную сеть, был широко распространен каллиергон гигантский (Calliergon giganteum (Schimp.) Kindb.). На местообитаниях водных мхов отбирали также воду из поверхностной толщи временных водоемов или с глубины 20–50 см речного потока (р. Ухта) в створе производственных объектов бывшего радиевого промысла. В этих же пунктах наблюдения штанговым пробоотборником осуществляли сбор донного материала из толщ (0–10 см) и (10–20 см) (рис. 1). После отбора воду фильтровали через бумажный фильтр “белая лента” (размер пор 3.5 мкм), измеряли ее удельную электропроводность и определяли валовое содержание U и 226Ra. Донные отложения высушивали при 25°С, просеивали их через сито 1 мм и также проводили радиохимический анализ.
Для оценки подвижности U, 226Ra, Са, Mg, Sr и Ba, содержащихся в биомассе исследуемых мхов, использовали метод химического фракционирования (Bolsunovsky et al., 2005). Для каждого радионуклида 100 г сырой массы мха последовательно обрабатывали 500 мл химических реагентов. После каждой обработки биомассу отделяли фильтрованием. В экстрактах определяли содержания радионуклидов и щелочноземельных элементов, оставшуюся биомассу заливали следующим раствором. Для наземных мхов фракционирование проводили с предварительным выделением “водорастворимой” фракции путем перемешивания навески биомассы в течение 1 часа с дистиллированной водой при комнатной температуре. Для водных мхов эту стадию пропускали. “Обменную” фракцию химических элементов экстрагировали раствором 1 М CH3COONH4 (рН 7) (перемешивание 1 час при комнатной температуре), “адсорбционную” – 0.1 М H2SO4 (20 мин в тех же условиях). Считалось, что химические элементы, удерживаемые биомассой после этих этапов фракционирования, тесно связаны с клеточными компонентами растений (Bolsunovsky et al., 2005). На последнем этапе химические элементы, связанные органическими соединениями и минеральными остатками растительной биомассы, были отделены в результате нагревания при 80°С с 30% H2O2 (с добавлением HNO3 до рН 2). Процесс был длительным и предполагал разрушение клеточных структур растений. Его окончание отмечали по обесцвечиванию биомассы. Полученную жидкую фракцию условно называли “органическое вещество”. Фактическая масса мха при таком разложении значительно снижалась. Остаток биомассы, не подвергшийся деструкции, считали нерастворимым. Его высушивали, взвешивали и отправляли на дальнейшее определение содержания радионуклидов и щелочноземельных элементов. Таким способом было проанализировано десять образцов мхов.
Химическое фракционирование почв проводили по модифицированной схеме Tessier (Tessier et al., 1979; Klemt et al., 2002). Почву высушивали при 25°С, просеивали через сито 1 мм, после чего из образцов последовательно экстрагировали фракции геохимически подвижных групп соединений: “обменная” (1M CH3COONH4, рН 7); “карбонаты” (1M СН3СOONH4, рН 5); “полуторные оксиды и гидроксиды” (0.1 M NH2OH·HCl + + 25% CH3COOH); “органическое вещество” (30% H2O2 + HNO3 до рН 2); “аморфные силикаты” (0.2 M NaOH). Твердый остаток после проведения экстракции считали нерастворимым. Из почв перед процедурой экстракции дополнительно выделяли фракцию “водорастворимая” (перемешивание с H2Oдист в течение 24 ч). Вклад любой фракции в валовое содержание радионуклидов рассчитывали как долю от суммы их содержаний в образцах.
Удельную активность (УА) 226Ra в химических фракциях и природных водах, в золе мхов, донных отложений и почв определяли эманационным методом на приборе “Альфа-1” с чувствительностью 0.07 Бк/г и ошибкой измерений ±15% (Старик, 1969). Содержание U в образцах оценивали по люминесценции перлов с NaF на фотометре “ЛЮФ-57” (Добролюбская, 1962). Чувствительность метода составляет 0.03 мкг/г при ошибке измерений ±20%. Физико-химические параметры почвы и растений исследовали в лаборатории “Экоаналит” ИБ Коми НЦ УрО РАН. Массовую долю Са, Ва, Sr, Mg в объектах исследования определяли на атомно-эмиссионном спектрометре Spectro CirosCCD. Для построения градуировочных функций использовали государственные стандартные образцы ионов металлов. При подготовке растворов экстрагентов или для разбавления химических фракций в ходе определения содержания щелочноземельных элементов брали одни и те же реактивы. Предел обнаружения для Ba, Ca, Mg составлял 5.0 мг/кг, для Sr – 0.10 мг/кг при ошибке измерений не более 10%. Количество обменных катионов Сa2+, Mg2+, Ba2+, Sr2+ в почвах оценивали по их содержанию в вытяжках 1 М CH3COONH4 (pH 7) при времени воздействия 24 ч. Органическое вещество, общее содержание углерода и азота в почвах определяли газохроматографически, подвижные формы фосфора и калия в пересчете на Р2О5 и K2О – фотометрически.
В качестве показателей, характеризующих поступление радионуклидов и щелочноземельных элементов в биомассу мхов, использовали коэффициенты накопления (КН), рассчитанные как отношение их валовых содержаний в воздушно-сухих (в.-с.) образцах мхов и в среде обитания (почве или природных водах в случае водных экосистем). Для характеристики барьерной функции мхов, а также биогеохимической подвижности химических элементов использовали коэффициенты накопления их необменных и обменных форм (КНн и КНоб соответственно). Расшифровка и способ расчета этих вариантов коэффициентов накопления приведены в тексте. Статистическая связь между показателями оценивалась на основе коэффициентов корреляции Пирсона. Описательная статистика была рассчитана при доверительном интервале 95%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Содержание и подвижность урана и радия в почве, воде и биомассе наземных и водных мхов
Анализ содержания 226Ra и U в образцах почв и мхов наземных местообитаний показал его существенные отличия для участков отбора с разным уровнем МЭД (табл. 2). Отметим, что средние значения УА 226Ra в исследуемых почвенных образцах значительно превышали соответствующие фоновые характеристики для подзолистых почв Республики Коми. По данным В.А. Безносикова с соавторами (2017), в них содержалось не более 13 мБк/г 226Ra. В исследованных нами почвенных образцах УА радионуклида варьировала в диапазоне значений 0.03–6.02 Бк/г, что выше указанных фоновых показателей. В то же время содержание U в образцах почв с низким уровнем радиоактивности, напротив, соответствовало или незначительно превышало его концентрации в незагрязненных подзолистых почвах (Баранов, Морозова, 1971). В зоне с повышенной МЭД грунты содержали U примерно в 50 раз больше соответствующих фоновых значений.
Таблица 2.
Удельная активность 226Ra, содержание U и щелочноземельных элементов в сопряженных воздушно-сухих образцах почвы и мхов, а также коэффициенты накопления (КН) указанных элементов мхами
| Химические элементы |
Зона с условиями, близкими к фоновым (0.10–0.15 мкЗв/ч) | Зона с повышенным радиационным фоном (1.70–3.87 мкЗв/ч) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| S. girgensohnii | P. schreberi | P. schreberi | |||||||
| почва | растение | КН | почва | растение | КН | почва | растение | КН | |
| 226Ra, Бк/г | 0.30 ± 0.01 | 0.06 ± 0.01 | 0.20 ± 0.04 | 0.06 ± 0.02 | 0.05 ± 0.001 | 0.82 ± 0.16 | 6.03 ± 1.97 | 0.53 ± 0.17 | 0.09 ± 0.02 |
| U, мкг/г | 0.67 ± 0.14 | 0.016 ± 0.004 | 0.03 ± 0.005 | 0.44 ± 0.12 | 0.006 ± 0.001 | 0.01 ± 0.003 | 27.5 ± 12.6 | 0.24 ± 0.08 | 0.009 ± 0.003 |
| Са, г/кг | 1.36 ± 0.54 | 7.70 ± 1.13 | 5.66 ± 1.52 | 1.46 ± 0.49 | 9.40 ± 1.20 | 6.47 ± 1.37 | 7.53 ± 2.98 | 15.0 ± 2.20 | 1.99 ± 0.47 |
| Mg, г/кг | 0.88 ± 0.10 | 1.50 ± 0.2 | 1.71 ± 0.42 | 1.52 ± 0.10 | 1.30 ± 0.11 | 0.86 ± 0.21 | 1.41 ± 0.13 | 1.60 ± 0.09 | 1.13 ± 0.23 |
| Ba, г/кг | 0.05 ± 0.01 | 0.05 ± 0.01 | 1.00 ± 0.24 | 0.05 ± 0.01 | 0.06 ± 0.01 | 1.21 ± 0.30 | 1.87 ± 0.56 | 0.29 ± 0.006 | 0.16 ± 0.03 |
| Sr, г/кг | 0.01 ± 0.003 | 0.03 ± 0.01 | 2.50 ± 0.60 | 0.01 ± 0.003 | 0.02 ± 0.005 | 2.00 ± 0.41 | 0.02 ± 0.008 | 0.04 ± 0.01 | 1.61 ± 0.41 |
Подобная характеристика может быть принята и для местообитаний водных мхов. Так, содержание U в речных водах импактной зоны было несколько ниже показателей, установленных ранее для рек Печорского бассейна (Рачкова, Шуктомова, 2013), а УА 226Ra соответствовала их диапазону варьирования в фоновой акватории (Рачкова и др., 2016; Шуктомова и др., 2018). В местах произрастания бриофитов поверхностные воды территории хранилища радиоактивных отходов содержали 226Ra до 150 мБк/л (табл. 3), что было в 10 раз больше фоновых значений показателя (12 ± ± 8 мБк/л). По концентрации U эти образцы превышали соответствующий фон района (0.5 ± ± 0.1 мкг/л) до 200 раз.
Таблица 3.
Содержание 226Ra и U в поверхностных водах и показатели поступления радионуклидов в биомассу водных мхов (в расчете на воздушно-сухое вещество)
| Название мха, место отбора |
МЭД, мкЗв/ч |
УА 226Ra | Содержание U | КН, n × 103 л/кг | |||
|---|---|---|---|---|---|---|---|
| вода, мБк/л | мох, мБк/г | вода, мкг/л | мох, мкг/г | 226Ra | U | ||
| Прибрежная полоса речной импактной зоны | |||||||
| D. aduncus | 0.14 | 21.0 | 85.4 | 0.4 | 0.2 | 4.07 | 0.5 |
| D. aduncus | 19.0 | 293.0 | 0.4 | 2.0 | 15.4 | 5.0 | |
| I надпойменная терраса на территории хранилища радиоактивных отходов | |||||||
| C. giganteum, водоем | 0.4–0.8 | 86.0 | 548.6 | 107.0 | 33.9 | 6.38 | 0.32 |
| C. giganteum, ручей | 7.0 | 63.1 | 44.0 | 32.2 | 9.01 | 0.73 | |
| C. giganteum, ручей | 30.0 | 93.0 | 44.4 | 2.6 | 3.1 | 0.06 | |
| D. aduncus, болото | 98.0 | 243.9 | 19.5 | 2.7 | 2.49 | 0.14 | |
| D. aduncus, болото | 150.0 | 116.5 | 30.0 | 31.1 | 0.78 | 1.04 | |
Донные отложения прибрежной полосы реки в импактной зоне промысла содержали примерно столько U и 226Ra, сколько обнаруживалось в образцах из участка речной акватории вне промышленного воздействия (0.5–1.2 мкг/г и 0.03–0.06 Бк/г соответственно). В то же время пробы с площадки хранилища радиоактивных отходов превосходили фоновые показатели по U до 9000 (4300 мкг/г), 226Ra – до 100 раз (6 Бк/г).
Из-за локального произрастания наземных мхов вариабельность содержания радионуклидов в их биомассе из зон с разными значениями МЭД была незначительна. При этом образцы бриофитов из местообитаний с более высоким радиационным фоном характеризовались содержанием 226Ra и U, превосходящим их концентрации во мхах площадки с низкими показателями МЭД в 8–10 и 15–40 раз соответственно (табл. 2).
Наблюдалось значительное варьирование содержания радиоактивных элементов в биомассе бриофитов водных местообитаний (табл. 3). Не всегда соблюдалась закономерность “чем больше радионуклида в среде обитания, тем выше его содержание во мхах”. Такая интенсивность поступления 226Ra и U в бриофиты может обусловливаться не только различными содержаниями радионуклидов в природных водах и конкурентным биологическим поглощением из них макрокомпонентов, но и распределением радиоактивных элементов между собственно водой (дисперсионной средой) и взвесями, переносимыми водным потоком. Водные мхи, отобранные на территории хранилища радиоактивных отходов с высокоминерализованными (удельная электропроводность 1000–3200 мкСм/см) поверхностными водами, демонстрировали КН 226Ra, варьирующие в широком диапазоне значений от 780 до 9010. В импактных водах р. Ухта с более низкой минерализацией (удельная электропроводность до 480 мкСм/см) КН достигал максимальной величины, равной 15 400.
Объяснение вариабельности показателей накопления 226Ra водными мхами можно найти в опубликованных ранее (Рачкова и др., 2016) результатах его распределения в водном потоке между дисперсионной средой и взвесями (размер частиц свыше 0.45 мкм). Согласно полученным данным, в минерализованных водах участка хранения радиоактивных отходов доля УА 226Ra в водорастворимой форме выше, чем в водах реки, имеющих небольшую минерализацию. Наряду с увеличением содержания радионуклида в биологически доступной форме, для минерализованных водных сред, как правило, характерна дискриминация биологического поглощения 226Ra по сравнению с его химическими макроаналогами Са и Mg. По нашему мнению, именно разнонаправленное влияние этих явлений на поглощение 226Ra биомассой мхов приводит к варьированию показателей накопления радионуклида бриофитами из минерализованных вод. Значительные КН 226Ra мхами, отобранными в реке, мы связываем, в первую очередь, с барьерной функцией бриофлоры как природного фильтра, задерживающего взвеси.
Эти предположения подтверждаются при сравнении данных биологического поглощения 226Ra и U. Так, по нашим ранним данным (Рачкова, Шапошникова, 2019), уран представлен во всех водах исследуемого района в водорастворимой форме нахождения (более 90% содержания) при минимальной доле во взвешенной фракции. Именно поэтому, на наш взгляд, в случае U наблюдается прямая пропорциональная связь между содержанием радиоактивного элемента в растении и его концентрацией в природной воде: все выявленные показатели биопоглощения у мхов речной акватории ниже, чем у бриофлоры территории хранения радиоактивных отходов. В целом, показатели биологического поглощения U ниже, чем 226Ra, что подтверждает данные о высокой интенсивности поступления последнего в организмы (Алексахин и др., 1990).
Исследование форм нахождения 226Ra и U в образцах почвы местообитаний наземных мхов, проведенное методом химического фракционирования, показало, что меньше всего из почвенных образцов они извлекались дистиллированной водой и 0.2 М NaOH (фракция “аморфные силикаты”), а максимальное их содержание наблюдалось в нерастворимых остатках (рис. 2).
Рис. 2.
Долевое распределение 226Ra и U (% от общего содержания) между фракциями, экстрагированными из почв.
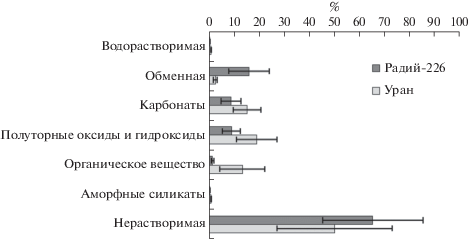
Наибольшие доли подвижных форм 226Ra были приурочены к фракциям “обменная”, “карбонатная” и “полуторные оксиды и гидроксиды”. Последняя считается ассоциированной с оксидами и гидроксидами железа и марганца (Tessier et al., 1979). При этом “обменные” фракции характеризовались наибольшим содержанием радионуклида. Это свидетельствует о его высокой миграционной способности и позволяет предполагать существенное влияние ионного состава водной фазы на экстракцию радия из почв.
В отличие от радия, уран более всего выделялся во фракции “карбонаты”, “полуторные оксиды и гидроксиды” и “органическое вещество”. Полученный результат согласуется с данными по фракционированию донных отложений зоны влияния Радиевого промысла (Рачкова, Шапошникова, 2019). Несмотря на более высокую долю неэкстрагируемого урана в илах, по сравнению с почвой, наибольшие содержания подвижного радионуклида наблюдались также во фракциях “полуторные оксиды и гидроксиды” и “органическое вещество”. Последнее подтверждается и данными литературы (Bednar et al., 2007). Наиболее вероятно, что уран включается в структуру глинистых минералов, которые в кислых средах активно участвуют в ионном обмене, либо соосаждается с фосфатами кальция, малорастворимыми и более устойчивыми в кислых средах, чем карбонаты (Путилина и др., 2014; Рачкова, Шапошникова, 2019; Newsome et al., 2014). Сходные закономерности по урану были выявлены для донных отложений р. Енисей в зоне влияния Горно-химического комбината (Болсуновский, Дегерменджи, 2013).
В целом, по долевому содержанию радионуклидов в извлекаемых водой и растворами 1 M CH3COONH4 (рН 7 и 5 последовательно) фракциях, можно сделать вывод, что в почве 226Ra находится в более подвижном и биологически доступном, по сравнению с U, состоянии. На долю содержания 226Ra в этих фракциях приходится в среднем 24.6% от его общего содержания, в то же время доля содержания U в них ниже и составляет 17.9%. Это согласуется и с различиями в аккумуляции радионуклидов мхами. Так, значения КН для U варьировались в диапазоне 0.009–0.03, для 226Ra – 0.09–0.82 (табл. 2), что подтверждает его более значительное поглощение мхами.
Извлечение 226Ra из биомассы наземных мхов показало, что в водную вытяжку переходит минимальное его количество (рис. 3а). Оно составило 0.5–2.9% от общего содержания радионуклида. В целом, распределение 226Ra по химическим фракциям в случае мхов из зоны с низким радиационным фоном было сходным и относительно равномерным. От 15.3 до 29.3% радионуклида извлекалось из биомассы раствором 1М CH3COONH4, 29.9–30.3% – раствором 0.1М H2SO4 и 13.7–28.0–30%-ным раствором H2O2. После всех стадий обработки в нерастворимых остатках сохранялось около 25% от общего содержания 226Ra. Для P. shreberi, произрастающего в условиях более высокого уровня радиоактивности, распределение радионуклида по фракциям отличалось. Доля радия в нерастворимом остатке здесь была выше, в среднем она составила 57.3%. Наибольшее количество радионуклида извлекалось раствором 1 М CH3COONH4, в то время как воздействие 0.1 М раствором H2SO4, а также 30%-ным раствором H2O2 не показало значительного выхода радионуклида.
Рис. 3.
Долевое распределение 226Ra (а) и U (б) (% от их общих содержаний) между фракциями, экстрагированными из биомассы наземных и водных видов мхов.
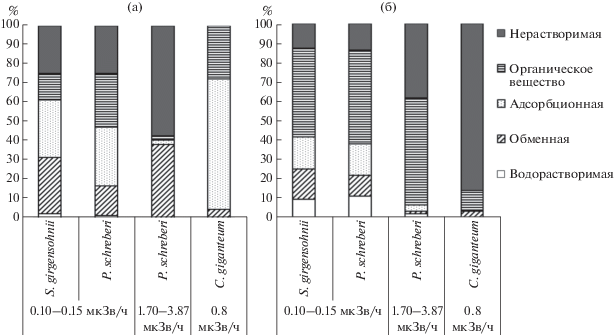
Распределение U по фракциям у изучаемых мхов отличалось от соответствующих данных по 226Ra (рис. 3б). Меньшими долями характеризовались “водорастворимая”, “обменная” и “адсорбционная” фракции, где радионуклид присутствует в наиболее подвижных формах, и составляли, соответственно, 2.0–10.9 и 1.2–15.7 и 3.4–16.4% от общего содержания радионуклида. В нерастворимом остатке доля урана составила 12.5–38.3%, что ниже по сравнению с радием. Так же, как и в предыдущем случае, во мхах с большим содержанием радиоактивного элемента она была выше. Максимум долевого распределения урана приходился на фракцию, выделяемую в результате разложения образцов мха перекисью водорода (46.0–55.0%). Учитывая продолжительный цикл вегетации и низкую скорость разложения, которая в случае сфагновых мхов составляет не более 32% за два года (Головацкая, Никонова, 2013), следует ожидать долговременное депонирование радионуклида в биомассе наземных бриофитов.
В целом, на наиболее подвижные формы у наземных мхов приходилось 7–41% от общего содержания U и 40–61% от общего содержания 226Ra. Таким образом, уран, по сравнению с радием, прочнее поглощен исследуемой биомассой. При этом наблюдалось некоторое сходство с распределением радионуклидов по химическим фракциям почв. В обоих случаях 226Ra был более растворимым, значительная его часть находилась в обменном состоянии. Что касается U, то его высокая доля во фракциях, полученных после действия концентрированной перекисью водорода, свидетельствует о прочной связи радиоактивного элемента с органическими веществами почв и живой материи. Таким образом, результаты исследования еще раз подтверждают более высокую, по сравнению с ураном, биогеохимическую подвижность радия.
Результаты химического фракционирования радионуклидов из биомассы C. giganteum, местообитание которого приурочивалось к заболоченной территории хранилища радиоактивных отходов, свидетельствовали о важной роли этого водного мха в распределении поллютантов в экосистеме. При значительном поступлении 226Ra в биомассу каллиергона (табл. 3) основное его количество (до 74%) характеризовалось высокой подвижностью и извлекалось из растительной ткани экстракцией растворами 1 М CH3COONH4 и 0.1 М H2SO4 (рис. 3а). Наибольшая доля радионуклида (67.9%) была сосредоточена в составе “обменной” фракции, наименьшая – “адсорбционной” (4.4%), что, в целом, свидетельствует о непрочном его поглощении биомассой мха. Если судить по содержанию 226Ra во фракции, полученной при разложении концентрированной перекисью водорода, то, в клеточные структуры проникает около 28% его количества.
Депонирование 226Ra в нерастворимом остатке биомассы каллиергона не выявлено. Этот факт заметно контрастирует с данными по доле урана в этой фракции, а также с показателями его химического фракционирования в случае мхов наземных местообитаний. Так, в общем количестве U, обнаруживаемого в каллиергоне, превалирует доля радиоактивного элемента в составе нерастворимого остатка (86%), и только около 10% его валового содержания в биомассе освобождается при ее разложении перекисью водорода (рис. 3б). Полученные данные свидетельствуют о том, что концентрирование в биомассе каллиергона существенно ограничивает рассеяние поллютанта за пределы территории хранения радиоактивных отходов. Лишь очень небольшая часть урана обнаруживается в экстрактах “обменная” и “адсорбционная” (0.5 и 3.3%, соответственно). В целом, феномен, заключающийся в сравнительно меньшей доле урана в этих фракциях, характерен для всех исследованных бриофитов. Однако в случае мхов наземных экосистем суммарная доля слабосвязанных в растительной ткани фракций урана (“обменная” и “адсорбционная”) может быть выше. В максимуме она достигала 40% общего содержания радиоактивного элемента.
Формы нахождения щелочноземельных элементов в биомассе наземных мхов
Известно, что радий, находясь в почве в ультрамикроконцентрациях, следует за своими стабильными носителями, поэтому его биологическое поглощение функционально связано с поступлением в растения других щелочноземельных элементов, что обусловлено законами ионного обмена и конкуренцией элементов-аналогов (Шутов, 1982; Алексахин и др., 1990; Chao, Chuang, 2011). С целью выявления сходства или различия в миграции 226Ra и этих элементов в системе почва-растение, нами было изучено содержание и формы нахождения Ca, Mg, Sr и Ba в биомассе наземных видов мхов.
Согласно полученным результатам, для сред произрастания мхов, приуроченных к зонам с разным уровнем МЭД, наблюдается значительное варьирование содержания щелочноземельных элементов (табл. 2). Так, в верхних слоях незагрязненной отвалами глее-сильноподзолистой почвы кальция содержалось 0.5–4, загрязненной – 2.4–13 г/кг. Подобная картина наблюдалась и в отношении бария, концентрации которого в соответствующих почвах составили 0.02–0.13 и 0.4–3.6 г/кг. Вариабельность содержаний магния и стронция в случае загрязненных и незагрязненных почв была менее существенной. Полученные различия могут быть связаны как с исходно повышенным содержанием химических элементов в отходах производства, представляющих собой природные сорбенты, так и с особенностями физико-химических характеристик исследуемых почв.
В частности, в технологии добычи радия (Кичигин, Таскаев, 2004), барий использовался в качестве его соосадителя. Логично предположить, что подобно радию, он не полностью выщелачивался из сорбирующего материала и в повышенном количестве оставался в составе отвалов. В свою очередь, исходно высокая кислотность почвы на участке, характерная для зоны с низким уровнем загрязнения (табл. 1), способствовала выщелачиванию и вертикальной миграции щелочноземельных элементов и, в целом, приводила к обеднению ими верхних горизонтов почвы. Явление выноса кальция промывными водами в нижние иллювиальные горизонты и даже за пределы почвенного профиля подзолистых почв хорошо известно (Русанова, Верховская, 1972; Литвинович и др., 2015). Именно с ним может быть связано низкое содержание щелочноземельных элементов в верхних слоях исследуемой глее-сильноподзолистой почвы в сравнении со среднемировыми значениями (Асылбаев, Хабиров, 2016; Ермаков и др., 2017).
В то же время содержание щелочноземельных элементов, выявленное нами в биомассе бриофитов, соответствовало или немного превышало данные литературы, согласно которым количество кальция во мхах, в том числе рода гипновых и сфагновых, отвечает диапазону 2.5–13 г/кг (Артемкина, 2017; Сухарева, 2018; Lequy et al., 2017; Lazo et al., 2019). Во мхах, произрастающих на исследованной нами почве, оно составило 7.70–15.0 г/кг. В образцах бриофитов, произраставших в условиях высокой концентрации кальция, его содержание было также больше (табл. 2). По сравнению с кальцием магний содержался во мхах в меньших количествах. Однако его концентрации не только мало отличались у бриофитов местообитаний с разным уровнем МЭД, но и были сопоставимы с данными в указанных выше источниках литературы. Анализ коэффициентов накопления показал, что из ряда щелочноземельных элементов в наибольшей степени мхами аккумулируется Са, его КН варьировали в диапазоне 1.99–6.47 (табл. 2). В случае Mg они изменялись от 0.86 до 1.71, для Ва и Sr составили 0.16–1.21 и 1.61–2.50, соответственно. В сравнении с ними, 226Ra поглощался мхами слабее, его КН составили 0.09–0.82.
Известно, что превалирующим механизмом распределения щелочноземельных элементов в системе почва-раствор является ионный обмен (Шутов, 1982). При этом большую часть минеральных элементов питания растения также усваивают в ионной форме (Шутов, 1982; Протасова, Беляев, 2001). Мхи, которые в отличие от высших растений лишены проводящей системы и корней, поглощают химические элементы всей своей поверхностью, обладающей значительной способностью к ионному обмену (Ruhling, Tyler, 1970; Gjengedal, Steinnes, 1990; Сухарева, 2018). Если сравнить содержание обменных форм щелочноземельных элементов в почвах (табл. 1), то можно увидеть, что при более высоких его значениях содержание элементов во мхах в целом возрастает. КН при этом снижаются (табл. 2). Подобная закономерность наблюдалась нами и ранее. В работе (Носкова и др., 2010) для разных видов растений, в том числе мхов, была показана отрицательная корреляция между показателями концентрации урана и радия в почве и их коэффициентами накопления растениями, что связывалось с более интенсивным, по сравнению с обменными формами, увеличением содержания необменных форм радионуклидов в почве. В большинстве случаев функциональная связь между содержанием радионуклидов в почве и КН описывалась убывающей степенной функцией, в соответствии с чем, накопление радионуклидов растениями достигало некоего предельного значения. В случае мхов он может определяться емкостью их катионного обмена, значения которого видоспецифичны (Подтероб, 2008).
Для сравнительной оценки интенсивности поглощения элементов мхами более показателен коэффициент накопления, вычисленный в расчете на обменные формы элементов в почве (KНоб) (табл. 4). По сути он отражает коэффициент биогеохимической подвижности, предложенный Н.С. Касимовым (Перельман, Касимов, 1998). В этом случае можно заметить, что наиболее интенсивно мхи накапливают Mg, Ca и Sr, меньше – Ва и 226Ra. Данное условие соблюдалось для обоих видов мхов и обеих зон их произрастания. При этом для P. schreberi, произрастающего в разных радиоэкологических условиях, при сохранении представленной выше общей картины, значения характеристик накопления щелочноземельных элементов изменяются. Так, интенсивность поглощения магния мхами в зоне с повышенным радиационным фоном, несмотря на сопоставимое содержание обменного элемента в почве, характеризуется большими показателями. Коэффициенты накопления стронция практически не изменяются, а кальция, бария и радия-226 снижаются, что может быть результатом конкурирующего взаимодействия между элементами-аналогами. В целом, представленный выше ряд интенсивности биологического поглощения щелочноземельных элементов, соответствует последовательности, выявленной Шутовым В.Н. (1982). В его исследованиях показано, что термодинамика процесса биопоглощения определяется свойствами конкурирующих ионов: зарядом ядра, ионным радиусом, коэффициентом поляризации и др. Как правило, с их увеличением КН элементов снижаются, поэтому Ва и 226Ra, имеющие наибольшие значения этих показателей, в меньшей степени поглощаются мхами. Помимо этого, 226Ra в почве представлен в предельно низких концентрациях (10–12–10–10 г/г), поэтому в присутствии других щелочноземельных элементов, содержание которых в почве значительно выше, его поглощение также может подавляться.
Таблица 4.
Коэффициенты накопления КНоб и КНн щелочноземельных элементов мхами
| Химические элементы |
Зона с условиями, близкими к фоновым (0.10–0.15 мкЗв/ч) |
Зона с повышенным радиационным фоном (1.70–3.87 мкЗв/ч) | ||||
|---|---|---|---|---|---|---|
| S. girgensohnii | P. schreberi | P. schreberi | ||||
| КНоб | КНн | КНоб | КНн | КНоб | КНн | |
| 226Ra | 0.66 | 0.05 | 2.5 | 0.33 | 2.05 | 0.05 |
| Ca | 14.2 | 0.81 | 17.0 | 1.35 | 6.26 | 0.65 |
| Mg | 18.8 | 0.18 | 16.2 | 0.18 | 22.8 | 0.29 |
| Ba | 3.57 | 0.54 | 4.28 | 0.88 | 2.63 | 0.12 |
| Sr | 10.0 | 0.70 | 6.6 | 0.67 | 10.0 | 0.60 |
Примечание. КНоб – отношение валовых содержаний химических элементов во мхах и соответствующих обменных форм в почвах; КНн – отношение суммарной концентрации химических элементов во фракциях “органическое вещество” и “нерастворимая”, выделенных из биомассы мхов, и валового содержания элементов в почвах. Содержания элементов и их различных форм во мхах и почвах были представлены при расчете коэффициентов накопления в одинаковых единицах измерения.
Распределение щелочноземельных элементов между химическими фракциями и нерастворимым остатком в образцах мхов было специфичным (рис. 4). Минимальной долей в биомассе характеризовались водорастворимые формы. Максимальное их содержание (3.1%) наблюдалось в случае Mg. Весомая часть общего содержания каждого из этих элементов (44.8–68.2%) переходила в “обменные” фракции. Доли элементов, экстрагируемых 0.1 М H2SO4, были ниже и достигали 30.9%.
Рис. 4.
Долевое распределение Са, Mg, Sr и Ba между фракциями, экстрагированными из биомассы наземных мхов (% от общего содержания).
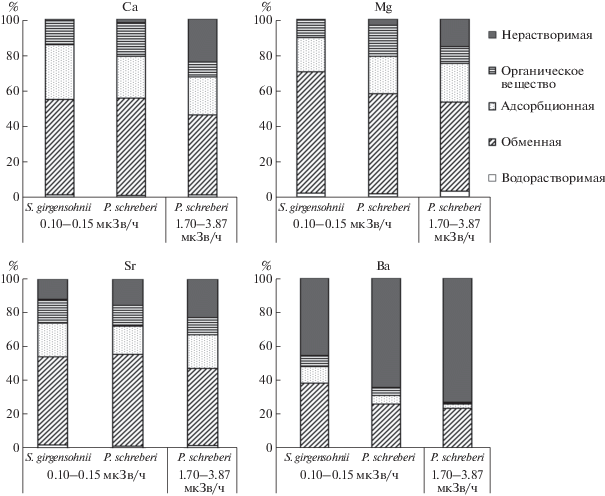
В составе фракции, полученной при разложении биомассы 30%-ной Н2О2, находилось от 8.4 до 18.7%, в нерастворимом остатке – 0.6–24.0% от общего содержания Са, Mg и Sr. По отношению к биогеохимическому циклу миграции это будет та часть химических элементов, которую бриофиты способны на длительный период времени вывести из биологического круговорота. Значения коэффициентов накопления, пересчитанные на необменные формы элементов (КНн), ниже исходных КН для Mg в 3.9–9.5 раз, для Са – в 3.1–7.0 раз, для Sr – в 2.7–3.6 раза (табл. 4), что в целом указывает на высокую подвижность исследуемых элементов в системе “почва–моховый покров”. Наиболее слабо из биомассы мхов экстрагировался барий. Содержание его в водорастворимой фракции, извлеченной из исследованных мхов, было ниже предела обнаружения. Суммарно в легкоподвижные фракции экстрагировалось от 25.7 до 47.9% бария. При этом наибольшая его доля также извлекалась раствором 1 М CH3COONH4. В нерастворимом остатке сохранялось от 45.5 до 73.2% от общего содержания элемента. КНн бария были ниже исходных КН всего в 1.3–1.9 раз, что также свидетельствовало в пользу прочного поглощения элемента мхами.
Долевое распределение 226Ra и щелочноземельных элементов по химическим фракциям биомассы мхов было сходным. Наибольшее сходство наблюдалось в распределении 226Ra и Ва. Отношения КН/КНн для 226Ra составили 1.8–4.0 и были также ближе к Ва. Однако сравнение численных значений этого соотношения говорило о более высокой подвижности радиоактивного элемента.
После всех стадий химического фракционирования масса нерастворимых остатков мхов составила 30–45% (в пересчете на в.-с.) от исходной. Она включала в себя весомую часть Ва и 226Ra. В сравнении с ними относительное содержание Са, Mg и Sr было меньше. При этом во мхах с большим содержанием щелочноземельных элементов их доля в остатках была на 2.4–32.3% выше. Согласно методике проведения эксперимента, нерастворимая фракция биомассы бриофитов должна быть представлена устойчивыми к окислению органическими и минеральными соединениями, в частности, продуктами неполной окислительной деградации лигнина и других полисахаридов. Так, из литературы известно, что в биомассу мхов, в зависимости от вида, возраста и органов может входить 2–18% лигнина (лигниноподобных веществ) и 30–50% целлюлозы (Кочева и др., 2002; Артемкина, 2017). Каждый из названных биополимеров обладает способностью к разнообразной по механизмам сорбции тяжелых естественных радионуклидов, что показано нами ранее (Рачкова, Шуктомова, 2006). В частности, на основе анализа ИК-спектров лигноцеллюлозных материалов установлено, что концентрирование радионуклидов ими связано с поверхностным катионным обменом с функциональными группами сорбентов, имеющими кислотный характер. В контексте нынешней нашей работы это подтверждается высоким содержанием щелочноземельных элементов в обменных химических фракциях биомассы бриофитов, что в целом свидетельствует о мобильности в системе “субстрат-мох” элементов II группы, в том числе 226Ra.
ЗАКЛЮЧЕНИЕ
Мхи являются важным экологическим звеном в миграционных циклах химических элементов в таежных водных и наземных экосистемах. Согласно полученным данным, бриофиты обладают аккумулирующими способностями в отношении U, 226Ra, Ba, Са, Mg и Sr, но интенсивность их включения в биомассу мхов различается. В частности, щелочноземельные элементы биогеохимически более подвижны, чем U. Методом химического фракционирования мы выявили, что существенная часть поглощенного мхами 226Ra (40–61% у наземных и до 74% у водных) подвергается экстракции растворами 1 M CH3COONH4 (рН 7) и 0.1 М H2SO4. Доля U в этих подвижных фракциях оказалась ниже (7–41% у наземных и до 3.8% у водных мхов). Оставшаяся часть радионуклидов выделялась при разложении биомассы бриофитов 30%-ной Н2О2, а также сохранялась в ее нерастворимом остатке. На основе этих данных можно прогнозировать, что U будет меньше, чем 226Ra, вымываться природными поверхностными водами и атмосферными осадками из биомассы изученных мхов. Этому будут способствовать низкая скорость разложения и длительный период вегетации бриофитов.
По долевому распределению между химическими фракциями, выделенными из биомассы наземных мхов, все исследованные щелочноземельные элементы, включая 226Ra, проявляют большое сходство. Оно основано на том, что аккумулирующая способность бриофитов в отношении элементов II группы главным образом связана с катионным обменом. Это подтверждается не только повышенным их содержанием во мхах, произрастающих на почвах с более высоким содержанием обменных оснований, но и более значительным содержанием щелочноземельных элементов в “обменных” фракциях мхов, в составе которых находилось от 44.8 до 68.2% от общего содержания Са, Mg и Sr. В составе экстракта, выделенного путем разложения биомассы 30%-ной Н2О2, обнаруживалось от 8.4 до 18.7%, в нерастворимом остатке 0.6–24.0% от общего содержания этих элементов. В наименьшей степени из всего ряда щелочноземельных элементов извлекался из бриофитов барий. В составе фракций “водорастворимая”, “обменная” и “адсорбционная” суммарно находилось от 25.7 до 47.9%, а в нерастворимом остатке – 45.5–73.2% его общего содержания. При этом показатели экстракции Ва из биомассы были наиболее близки к соответствующим характеристикам распределения 226Ra, что связано с подобием их химических свойств как элементов одной группы наиболее близких друг другу по размерам ионных радиусов. В целом, по биогеохимической подвижности в изученных системах щелочноземельные элементы можно расположить в возрастающий ряд Ba < 226Ra < Sr < Ca < < Mg, что соответствует основным закономерностям ионного обмена и подтверждается значениями их КН бриофитами.
Мы благодарим к. б. н. Татьяну Павловну Шубину, ученого секретаря, старшего научного сотрудника Института биологии ФИЦ Коми НЦ УрО РАН, за помощь в определении видов мхов.
Исследования выполнены в рамках Госзадания Института биологии Коми НЦ УрО РАН.
Список литературы
Алексахин Р.М., Архипов Н.П., Бархударов Р.М., Василенко И.Я., Дричко В.Ф., Иванов Ю.А., Маслов В.И., Маслова К.И., Никифоров В.С., Поликарпов Г.Г., Попова О.Н., Сироткин А.Н., Таскаев А.И., Тестов Б.В., Титаева Н.А., Февралева Л.Т. (1990) Тяжелые естественные радионуклиды в биосфере: Миграция и биологическое действие на популяции и биогеоценозы. М.: Наука, 368 с.
Антропогенные изменения экосистем Западно-Сибирской газоносной провинции (Под ред. Н.Г. Москаленко) (2006). М., Изд-во Ин-та криосферы Земли СО РАН, 358 с.
Артемкина Н.А. (2017) Химический состав мхов Мурманской области. Труды Ферсмановской научной сессии ГИ КНЦ РАН. 14, 382-385.
Асылбаев И.Г., Хабиров И.К. (2016) Содержание щелочных и щелочноземельных металлов в почвах Южного Предуралья. Почвоведение. (1), 29-38.
Баранов В.И., Морозова Н.Г. (1971) Поведение естественных радионуклидов в почвах. Современные проблемы радиобиологии. М.: Атомиздат, 13-40.
Безносиков В.А., Лодыгин Е.Д., Шуктомова И.И. (2017) Искусственные и естественные радионуклиды в почвах южно- и среднетаежных подзон Республики Коми. Почвоведение. (7), 824-829.
Бондарева Л.Г., Субботин М.А. (2016) Процессы ассимиляции трития водными растениями Elodea canadensis и Lemna minor./ Радиационная биология. Радиоэкология. 56(4), 440-446.
Болсуновский А.Я., Дегерменджи А.Г. (2013) Сравнение миграционной способности урана и техногенных радионуклидов в донных отложениях реки Енисей. ДАН. 5(448), 571-575.
Броварова О.В., Кочева Л.С., Карманов А.П., Шуктомова И.И., Рачкова Н.Г. (2004) Исследование физико-химических свойств сорбентов на основе растительного сырья. ИВУЗ, Лесной журнал. (4), 112-121.
Головацкая Е.А., Никонова (Абзалимова) Л.Г. (2013) Разложение растительных остатков в торфяных почвах олиготрофных болот. Вестник Томского государственного университета. Биология. 3(23), 137-151.
Добролюбская Т.С. (1962) Люминесцентный метод. Аналитичческая химия урана. М.: Наука, 143-165.
Ермаков В.В., Гуляева У.А., Тютиков С.Ф., Кузьмина Т.Г., Сафонов В.А. (2017) Биогеохимия кальция и стронция в ландшафтах Восточного Забайкалья Геохимия. (12), 1115-1127.
Ermakov V.V., Gulyaeva U.A., Tyutikov S.F., Kuz’mina T.G., Safonov V.A. (2017) Biogeochemistry of calcium and strontium in the landscapes of eastern Transbaikalia. Geochem. Int. 55(12), 1105-1117.
Кичигин А.И., Таскаев А.И. (2004) “Водный промысел”: история производства радия в Республике Коми (1931–1956 гг.). Вопросы истории естествознания и техники. (4), 3-30.
Кочева Л.С., Карманов А.П., Шуктомова И.И. и др. (2002) Новые сорбенты растительного происхождения. Экология северных территорий России: проблемы, прогноз ситуации, пути развития, решения: Материалы международной конференции. Архангельск: Изд-во “Правда Севера”, 429-432.
Куликов Н.В., Молчанова И.В., Караваева Е.Н. (1990) Радиоэкология почвенно-растительного покрова. Свердловск: УрО АН СССР, 170 с.
Литвинович А.В., Лаврищев А.В., Буре В.М., Павлова О.Ю. (2015) Интенсивность миграции кальция из дерново-подзолистой супесчаной почвы, произвесткованной различными дозами мелиоранта (по данным модельного опыта). Агрохимия. (6), 84-89.
Москаленко Н.Г. (2011) Динамика лесных экосистем Западно-сибирской газоносной провинции. Освоение Севера и проблемы природовосстановления: Сборник докладов VIII Всероссийской научной конференции. Сыктывкар: Изд-во Коми НЦ УрО РАН, 192 с.
Носкова Л.М., Шуктомова И.И., Симакова Ю.С. (2010) Моделирование процессов биологического поглощения урана и радия в условиях техногенного загрязнения. Экология. (5), 365-371.
Перельман А.И., Касимов Н.С. (1998) Геохимия ландшафта. М., 1998. 596 с
Подтероб А.П. (2008) Определение катионообменной емкости некоторых видов растительного сырья и материалов на его основе. Вестник БГУ. Серия (2. 3), 76-81.
Протасова Н.А., Беляев А.Б. (2001) Химические элементы в жизни растений. Соросовский образовательный журн. 7 (3), 25-32.
Путилина В.С., Галицкая И.В., Юганова Т.И. (2014) Сорбционные процессы при загрязнении подземных вод тяжелыми металлами и радиоактивными элементами. Уран. Экология. Серия аналитических обзоров мировой литературы. 103, 1-127.
Пучкова E.В., Еремин В.В., Богданова О.Г., Гимельбрант Д.Е., Cтепанчикова И.С. (2017) Распределение полония-210 в талломах лишайников. Радиохимия. 59(2), 189-192.
Рачкова Н.Г., Шапошникова Л.М. (2019) Формы нахождения урана в почве, поверхностных водах и донных отложениях района бывшего радиевого промысла. Успехи современного естествознания. (10), 107-112.
Рачкова Н.Г., Шуктомова И.И. (2006) Роль сорбентов в процессах трансформации соединений урана, радия и тория в подзолистой почве. СПб.: Наука, 146 с.
Рачкова Н.Г., Шуктомова И.И. (2013) Сравнительный анализ миграционной способности и концентрирования природного урана в экосистемах рек Печорского бассейна. Радиационная биология. Радиоэкология. 53(1), 84-94.
Рачкова Н.Г., Шуктомова И.И., Карманов А.П. (2016) Фазовое распределение радия-226 в поверхностных водах района расположения бывшего радий добывающего предприятия. Бутлеровские сообщения. 45(3), 60-67.
Русанова Г.В. (1972) Содержание радия в некоторых почвах района повышенной радиации и влияние удобрений на его подвижность. Радиоэкологические исследования в природных биогеоценозах. М.: Наука, 22-32.
Русанова Г.В., Верховская И.Н. (1972) Распределение и миграция кальция как представителя щелочноземельных элементов в почвах подзолистого типа. Радиоэкологические исследования в природных биогеоценозах. М.: Наука, 23-41.
Сергеева В.В., Мельникова Е.В. (2012) Мхи как индикаторы содержания техногенных веществ в окружающей среде г. Краснодара. Известия Кубанского государственного университета. Естественные науки. (1), 60-66.
Старик И.Е. (1969) Основы радиохимии. Л.: Наука, 247 с.
Сухарева Т.А. (2017) Элементный состав зеленых мхов фоновых и техногенно нарушенных территорий. Ученые записки Петрозаводского государственного университета. 3(172), 89-96.
Титаева Н.А., Таскаев А.И. (1983) Миграция тяжелых естественных радионуклидов в условиях гумидной зоны. Л.: Наука, 232 с.
Шуктомова И.И., Шапошникова Л.М., Рачкова Н.Г. (2018) Природные радионуклиды в водотоках бассейна р. Печора. Результаты Комплексной Печорской экспедиции РГО-2016. Известия Респ. отдела РГО. 2(18), 39-45.
Шутов В.Н. (1982) Ионный обмен и миграция щелочноземельных элементов в системе почва-растение. Автореф. Дис. … канд. биол. наук. Ленинград, 24 с.
Bednar A.J., Medina V.F., Ulmer-Scholle D.S., Frey B.A., Johnson B.L., Brostoff W.N., Larson S.L. (2007) Effects of organic matter on the distribution of uranium in soil and plant matrices. Chemosphere. 70(2), 237-247.
Bolsunovsky A., Zotina T., Bondareva L. (2005) Accumulation and release of Am вy a macrophyte of the Yenisei River (Elodea canadensis). J. Environ. Radioact. 81, 33-46.
Borylo A., Roman G., Skwarzec B. (2017) Lichens and mosses as polonium and uranium biomonitors on Sobieszewo Island. J. Radioanal. Nucl. Chem. 311, 859-869.
Chao J.H., Chuang C.Y. (2011) Accumulation of radium in relation to some chemical analogues in Dicranopteris linearis. Appl. Radiat. Isot. 69, 261-267.
Demkova L., Bobulsk L., Arvay J., Jezn T., Ducsay L. (2017) Biomonitoring of heavy metals contamination by mosses and lichens around Slovinky tailing pond (Slovakia) J. Environ. Sci. Heal. A. 52(1), 30-36.
Ding D.X., Liu X.T., Hu N., Li G.Y., Wang Y.D. (2012) Removal and recovery of uranium from aqueous solution by tea waste. J. Radioanal. Nucl. Chem. 293, 735-741.
Gjengedal E., Steinnes E. (1990) Uptake of metal ions in moss from artificial precipitation. Environ. Monit. Assess. 14, 77-87.
Grdovic S., Vitorovic G., Mitrovic B. et al. (2010) Natural and anthropogenic radioactivity of feedstuffs, mosses and soil in the Belgrade environment, Serbia. Arch. Biol. Sci. 62(2), 301-307.
Klemt E., Spasova Y., Zibold G. (2002) Deposition of artificial radionuclides in sediments of the River Yenisei. Environmental Radioactivity in the Arctic and Antarctic. S.Petersburg, 67-70.
Lazo P., Stafilov T., Qarri F., Allajbeu S., Bekteshi L., Frontasyeva M., Harmens H. (2019) Spatial distribution and temporal trend of airborne trace metal deposition in Albania studied by moss biomonitoring. Ecological Indicators. 101, 1007-1017.
Lequy E., Dubos N., Witt I., Pascaud A., Sauvage S., Leblond S. (2017) Assessing temporal trends of trace metal concentrations in mosses over France between 1996 and 2011: A flexible and robust method to account for heterogeneous sampling strategies. Environmental Pollution. 220, 828-836.
Newsome L., Morris K., Lloyd J.R. (2014) The biochemistry and bioremediation of uranium and other priority radionuclides. Chemical geology. 363, 164-184.
Ruhling A., Tyler G. (1970) Sorption and retention of heavy metals in the woodland moss Hylocomium splendens. Oikos. 21, 92-97.
Sert E., Ugur A., Ozden B., Sac M.M., Camgoz B. (2011) Biomonitoring of 210Po and 210Pb using lichens and mosses around coal-fired power plants in Western Turkey. J. Environ. Radioact. 6(102), 535-542.
Tessier A., Campbell P.G.C., Bisson M. (1979) Sequential extraction procedure for the speciation of particulate trace metals. Anal. Chem. 51(7), 844-851.
Zhong Q., Du J., Puigcorbe V., Wang J., Wang Q., Deng B., Zhang F. (2019) Accumulation of natural and anthropogenic radionuclides in body profiles of Bryidae, a subgroup of mosses. Environ. Sci. Pollut. Res. 26(27), 27872-27887.
Дополнительные материалы отсутствуют.


