Геохимия, 2022, T. 67, № 6, стр. 559-575
Биогеохимические особенности функционирования малых арктических озер хибинского горного массива в условиях изменения климата и окружающей среды
В. А. Даувальтер a, *, Д. Б. Денисов a, М. И. Дину b, **, З. И. Слуковский a, c
a Институт проблем промышленной экологии Севера Кольского научного центра РАН
184209 Мурманская область, Апатиты, Академгородок, 14а, Россия
b Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
c Институт геологии Карельского научного центра РАН
185910 Петрозаводск, ул. Пушкинская, 11, Республика Карелия, Россия
* E-mail: v.dauvalter@ksc.ru
** E-mail: marinadinu999@gmail.com
Поступила в редакцию 23.09.2020
После доработки 23.09.2020
Принята к публикации 14.01.2021
- EDN: NAZMZZ
- DOI: 10.31857/S0016752522050053
Аннотация
Для горных арктических озер Хибинского щелочного массива установлены природные и антропогенные факторы формирования химического состава вод и донных отложений, дана оценка воздействия глобальных изменений климата и окружающей среды на функционирование первичных продуцентов – фитопланктона. Дана характеристика геохимических, климатических и морфометрических особенностей водосборной территории и водоемов, а также антропогенной нагрузки. Установлено, что воды Хибинских озер характеризуются гидрокарбонатно-натриевым составом, нейтральными и слабокислыми значениями pH, низкой минерализацией и концентрацией микроэлементов, относительным повышенным содержанием катиона K+ в ионной композиции вод. Крайне малые содержания биогенных элементов и фитопланктона характеризуют озера как олиготрофные. Металлы в основном находятся в ионных формах вследствие низкого содержания органического вещества. Фитопланктон представлен типичными арктическими видами и характеризуется бедным видовым составом и низкими количественными показателями. Выявлена тенденция снижения величины pH, минерализации, содержания главных ионов и микроэлементов, количественных показателей фитопланктона, увеличения доли сульфатов в анионом составе с увеличением высоты озер Хибинского массива над уровнем моря. Влияние атмосферных выбросов близ расположенных предприятий “Североникель” и АО “Апатит” сказывается в увеличении содержания Cu, Ni, Zn и Sr, а также соединений азота в воде озер. Увеличение содержания тяжелых металлов (Ni, Cu, Pb, Cd, Hg) в поверхностном слое донных отложений горных озер отражает антропогенную нагрузку со стороны локальных производств и трансграничного переноса загрязняющих веществ в высоких слоях атмосферы. Наряду с накоплением тяжелых металлов в донных отложениях наблюдается увеличение численности и изменение видового разнообразия диатомовых водорослей, которое, возможно, отражает увеличение периода открытой воды, вызванное современными изменениями климата Арктики.
ВВЕДЕНИЕ
Горные озера являются чувствительными регистраторами глобальных изменений окружающей среды и трансграничных переносов загрязняющих веществ в атмосфере благодаря их удаленности и малой доступности (Моисеенко и др., 2000; Catalan et al., 2013). Кроме того, резкие климатические и экологические градиенты, характерные для горных районов, оказывают влияние на факторы формирования химического состава воды и экологическое состояние горных озер. Например, равнинные озера обычно характеризуются более высокими концентрациями главных ионов и растворенного органического углерода (Cорг.), чем горные озера, что связано с более широким распространением почвенно-растительного покрова на более низких участках и большим количеством осадков на более высоких отметках.
Малые горные арктические водоемы являются уникальным источником экологической информации о состоянии окружающей природной среды, антропогенном загрязнении, условиях формирования качества вод и широко используются в комплексном экологическом мониторинге и палеоэкологических исследованиях (Моисеенко и др., 1997, 2000, 2012; Денисов, 2012; Денисов и др., 2015а). Эти озера представляют собой модельные объекты для оценки экологического состояния и степени антропогенного влияния на определенную территорию, потому что они характеризуются малой площадью водосбора, преобладанием атмосферного питания и коротким периодом открытой воды. На водосборе горных озер практически не происходят преобразования химического состава атмосферных осадков из-за отсутствия прямых источников загрязнения и слабого развития или отсутствия почвенно-растительного покрова (Моисеенко и др., 1997, 2012) и хорошей фильтрационной способности обломочного материала, залегающего на водосборе озер. Поэтому горные озера наилучшим образом отражают глобальные и локальные изменения состояния окружающей среды. Преимуществом исследований малых горных водоемов является возможность получения репрезентативных данных даже в результате однократного отбора и исследования колонок донных отложений (Моисеенко и др., 2000, 2012). Горные озера часто располагаются в охраняемых природных зонах, и эта особенность ведет к тому, что они становятся индикаторами глобальных изменений окружающей среды (Moser et al., 2019). На территории Хибинского горного массива в феврале 2018 г. создан национальный парк “Хибины” для охраны уникальных экосистем горных тундр.
Цель работы – выявить влияние природных и антропогенных факторов на формирование химического состава вод и донных отложений, особенности структурно-функциональной организации фитопланктона, оценить воздействие глобальных изменений климата и окружающей среды на биогеохимическое функционирование арктических горных озер.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследованиям гидрохимических и гидробиологических особенностей озер Хибинского горного массива посвящено довольно большое количество публикаций (Моисеенко и др., 1997, 2000, 2012; Денисов, 2005, 2012; Денисов и др., 2006, 2015а; Кашулин и др., 2008, Сулименко и др., 2017; Чукаева, Матвеева, 2018; Павлова и др., 2019; Слуковский и др., 2019; Югай и др., 2013), но результаты исследований отдельно по высокогорным озерам до этого не рассматривались. В пределах Хибин выражена четкая высотная поясность, в соответствие с которой выделяются лесной, лесотундровый и тундровый пояса. К высокогорным озерам отнесены озера с абсолютными отметками выше 400 м, находящиеся в пределах тундрового пояса, характеризующегося слабым развитием почвенно-растительного слоя.
В статье рассматриваются результаты изучения химического состава воды и донных отложений (ДО) семи горных альпийских озер, расположенных на различных абсолютных отметках от 412 до 830 м на территории Хибинского щелочного горного массива и национального парка “Хибины” (рис. 1, табл. 1). Питание исследуемых водоемов осуществляется за счет атмосферных осадков, за долгую зиму (8–9 мес.) накапливающихся в виде снежников, иногда присутствующих на водосборе озер в течение всего года, например, на водосборе оз. Академическое. Хибинский щелочной массив представляет собой сложное интрузивное тело палеозойского возраста, застывшее около 300 млн лет назад, сложенное нефелин-сиенитовыми породами, породообразующими минералами которых являются калиево-натриевые полевые шпаты, эгирин NaFe3+(Si2O6) и нефелин (Na,K)AlSiO4 (Природные условия…, 1986). В результате выветривания этих горных пород, залегающих на территории водосборов, нефелин разрушается скорее полевых шпатов, и в исследуемые озера в повышенных концентрациях поступают щелочные металлы Na и K. Почвенный покров на водосборах исследуемых озер выражен слабо. Растительность характеризуется преобладанием лишайников рода Certaria, встречаются представители семейств Vacciniaceae, Cyperaceae и другие типичные растения высокогорной тундры. Склоны берегов озер крутые, с каменными осыпями, скальными выступами, трещинами. Литоральная зона водоемов каменистая, которая часто переходит в чашу озера с крутыми уклонами. Вода озер характеризуется малым содержанием растворенных и взвешенных веществ, высокой прозрачностью и голубым цветом. Летом в озерах устанавливается температурная стратификация.
Рис. 1.
Расположение исследованных озер Хибинского горного массива: 1 – Партомъявр, 2 – Академическое, 3 – Сердцевидное, 4 – Длинное, 5 – Тахтаръявр, 6 – Каровое, 7 – Ловчорр. Номера станций на этом и рисунках 2–4 соответствуют порядковым номерам станций в таблицах 1–4 и 6.
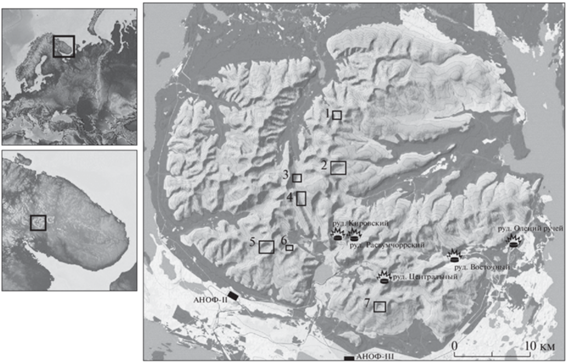
Таблица 1.
Координаты (DD) и морфометрические показатели исследуемых озер
| №№ озер | Озеро | Широта, N | Долгота, E | Площадь водосбора, км2 | Площадь озера, км2 | Отношение площадей водосбор/озеро | Высота над уровнем моря, м |
|---|---|---|---|---|---|---|---|
| 1 | Партомъявр | 67.802508 | 33.714200 | 0.81 | 0.01 | 81.0 | 483.9 |
| 2 | Академическое | 67.744986 | 33.718200 | 2.04 | 0.31 | 6.6 | 759.4 |
| 3 | Сердцевидное | 67.734403 | 33.600300 | 2.84 | 0.03 | 94.7 | 412.0 |
| 4 | Длинное | 67.713314 | 33.609925 | 2.25 | 0.05 | 45.0 | 475.0 |
| 5 | Тахтаръявр | 67.660278 | 33.513611 | 1.22 | 0.11 | 11.1 | 812.0 |
| 6 | Каровое | 67.652086 | 33.607669 | 1.28 | 0.01 | 128.0 | 522.0 |
| 7 | Ловчорр | 67.595586 | 33.833350 | 0.76 | 0.10 | 7.6 | 830.0 |
Прямое антропогенное воздействие на исследуемые водоемы не оказывается, рекреационная нагрузка незначительна. Атмосферное питание озер определяет зависимость химического состава вод и ДО от природных особенностей водосбора и аэротехногенного загрязнения горнодобывающих и металлургических предприятий (АО “Апатит” и Кольская горно-металлургическая компания), а также трансграничных переносов загрязняющих веществ в атмосфере. Выбросы пыли расположенных в нескольких километрах от исследуемых озер рудников и обогатительных фабрик АО “Апатит”, содержащие главным образом нефелин и апатит Ca5(PO4)3(F, OH, Cl), достигают водосборы озер и обогащают их воды Na, K, Ca, P, Al, Sr, F и другими элементами, входящими в состав апатитонефелиновой руды и продуктов их переработки. Хибинские месторождения представлены в основном фторапатитом, но присутствуют также и другие его разновидности. Апатит содержит также примеси Mn, Fe, Th, редкоземельных элементов, карбоната кальция CaCO3 (карбонат-апатит) и другие примеси (Ферсман, 1924, 1968; Волошин, Майстерман, 1983).
Пробы воды с поверхностного слоя (1 м от поверхности) озер отбирались 2-х литровым пластиковым батометром. Химический состав воды определяли в центре коллективного пользования ИППЭС Кольского НЦ РАН по единым методикам (Моисеенко и др., 2002; Standard method…, 1999). Донные отложения были отобраны только из трех озер Академическое, Сердцевидное и Тахтаръявр, потому что в других озерах не было возможности отобрать образцы из-за каменистости дна. Мощность изученных колонок ДО составила 11, 14 и 20 см для озер Академическое, Сердцевидное и Тахтаръявр соответственно. Отбор проб ДО был произведен отборником колонок гравитационного типа из наиболее глубоких частей озер. При отборе соблюдалась ненарушенность отобранных колонок. Колонки ДО были разделены на слои по 1 см, помещены в полиэтиленовые контейнеры и отправлены в лабораторию для анализа, где они хранились при температуре 4°С до анализа. Первичная обработка проб ДО и определение содержания химических элементов методом атомно-абсорбционной спектрофотометрии проводились в лабораториях ИППЭС КНЦ РАН. Контроль точности определения содержания химических элементов проводилось анализом стандартного образца L6M (проба ДО, Центр окружающей среды Финляндия (SYKE) 06/2008), а также участием в сравнительных испытаниях в рамках международной интеркалибрации (Intercomparison…, 2016). Методика отбора и химического анализа проб ДО подробно описана ранее (Даувальтер, 2012; Методы…, 2019).
Формы нахождения элементов в водных пробах рассчитывались с помощью разработанной компьютерной программы в Mathcad (ACIDFORMMET № 2 015 617 036) (Дину, 2012, 2017; Моисеенко и др., 2013). В основе расчетов лежат моделирование уравнений материального баланса, математическое выражение констант равновесий, уравнения электронейтральности, уравнения протонных равновесий, протекание конкурирующих реакций. Доминирующими реакциями в водной среде рассматривались комплексообразование металлов с органическими веществами, а также неорганические комплексы сульфат-, хлорид-, карбонат (-гидрокарбонат), гидроксогруппа и т.д. Для каждого металла (Ca, Mg, Sr, Fe, Al, Zn, Cd, Pb, Cu, Ni, Co, Cr, Mn) моделировались наиболее характерные реакции, протекающие в конкурентной среде.
Предложенный алгоритм расчета содержал следующие стадии:
1. Расчет констант кислотно-основного равновесия для органических веществ гумусовой природы на основе экспериментальных работ с выделенными из вод региона образцами. Данный этап необходим для последующего расчета констант равновесия металлов с органическим веществом. Возможный механизм диссоциации органических кислот: L – различные функциональные группы, Rn–Rm – ядро гумусовых кислот, Hk – возможное число степеней диссоциации кислот:
L–Rn–Rm–Hk → kH+ + L–Rn–Rm–.
2. Расчет условных констант устойчивости комплексов металлов с органическими веществами был проведен с использованием экспериментальных результатов оценки кислотно-основного и комплексообразующего равновесий и литературных данных (для применения констант устойчивости металлов с неорганическими лигандами как конкурентных процессов). Особое внимание уделялось оценки конкурентного связывания Cu, Ni, Co с органическими лигандами в присутствии других катионов и неорганических анионов. Применялись спектрофотометрические и электрохимические экспериментальные методы для расчета условных констант устойчивости комплексов.
3. Расчет степени связывания иона металла с характерными для него анионами неорганического типа и органического в условиях присутствия других катионов и анионов в системе завершал компьютерную программу. Схематично система выглядела следующим образом:
M1 + R1–R2 + M2 + ${{{\text{A}}}_{{{{{{\text{(neorg)}}}}^{ - }}}}}$ → Me1–R1–R2–M2 + + M1–${{{\text{A}}}_{{{{{{\text{(neorg)}}}}^{ - }}}}}$ + R1–R2–M2 ,
где М – ионы металлов, R1–R2 – органические лиганды, ${{{\text{A}}}_{{{{{{\text{(neorg)}}}}^{ - }}}}}$ – неорганические лиганды.
Исследования фитопланктона проводили стандартными общепринятыми в гидробиологической практике методами, описанными ранее (Кашулин и др., 2008; Методы…, 2019). Дополнительно оценивалась концентрация хлорофилла “a” в планктоне (Минеева, 2004; Determination, 1996, Методы…, 2019). Трофический статус вод определяли по шкале, предложенной С.П. Китаевым (2007). На основе таксономического состава фитопланктона была произведена оценка качества вод с определением класса согласно (ГОСТ, 2010) на основе индекса сапробности (S) методом Пантле и Букк в модификации Сладечека (Pantle, Buck, 1955; Сладечек, 1967). Диатомовый анализ колонок ДО был выполнен для трех водоемов, в которых были отобраны ДО, по стандартной общепринятой методике (Диатомовый анализ, 1949; Давыдова, 1985), описанной в предыдущих работах (Денисов и др., 2006; Денисов и др., 2015б). Видовое разнообразие диатомовых комплексов (ДК) оценивалось индексом Шеннона–Уивера (Shannon, Weaver, 1949). Названия таксонов представителей фитопланктона и диатомей из ДО приведены в соответствии с альгологической базой данных (Guiry, Guiry, 2020); экологические характеристики выявленных таксонов были взяты из работ авторов (Баринова и др., 2006; Каган, 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенности химического состава горных озер
Величины pH исследуемых озер близки к нейтральным значениям (табл. 2), что нетипично для озер Хибинского массива, воды которых находятся в тесном контакте с коренными щелочными горными породами (Кашулин и др., 2008), и относятся к слабощелочным и щелочным по классификации О.А. Алекина (1970). Воды озер Каровое и Ловчорр по величине pH относятся к слабокислым, что характерно для вод атмосферных осадков (Даувальтер и др., 2008). Для исследуемых озер Хибинского массива установлена тенденция снижения величины pH с увеличением высоты озера над уровнем моря – озера ниже отметки 500 м имеют pH > 7, а выше 500 м до 5.9 (оз. Каровое). Подобная тенденция была отмечена для горных Мультинских озер особо охраняемой территории Горного Алтая (величина pH снижается с 6.2 до 5.3, Бородина, Бородина, 2019), а также национального парка Абиску, Швеция, расположенного севернее полярного круга, где, несмотря на наличие карбонатных горных пород (известняков), в озерах выше 1000 м отмечались значения pH < 6 (Nauwerck, 1994).
Таблица 2.
Средние значения величины pH, электропроводности (χ, мкСм/см), содержания главных ионов и минерализации (М) в воде исследуемых озер (мг/л)
| №№ озер | Озеро | pH | χ | Ca2+ | Mg2+ | Na+ | K+ | ${\text{HCO}}_{3}^{ - }$ | ${\text{SO}}_{4}^{{2 - }}$ | Cl– | М |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Партомъявр | 6.97 | 33 | 0.40 | 0.13 | 6.11 | 0.99 | 9.1 | 6.0 | 1.2 | 23.9 |
| 2 | Академическое | 6.86 | 13 | 0.20 | 0.03 | 2.50 | 0.60 | 4.9 | 1.4 | 0.5 | 10.1 |
| 3 | Сердцевидное | 7.28 | 34 | 0.56 | 0.07 | 6.33 | 1.74 | 15.5 | 3.1 | 0.6 | 27.9 |
| 4 | Длинное | 7.07 | 26 | 0.47 | 0.07 | 4.45 | 1.35 | 10.6 | 2.6 | 0.7 | 20.3 |
| 5 | Тахтаръявр | 6.86 | 16 | 0.36 | 0.04 | 2.77 | 0.64 | 6.3 | 1.3 | 0.6 | 11.9 |
| 6 | Каровое | 5.91 | 7 | 0.15 | 0.03 | 0.82 | 0.25 | 0.5 | 1.5 | 0.4 | 3.7 |
| 7 | Ловчорр | 6.40 | 13 | 0.27 | 0.04 | 1.82 | 0.55 | 3.2 | 1.6 | 0.5 | 8.0 |
Для природных вод Кольского Севера характерна низкая минерализация 20–30 мг/л и следующий порядок распределения главных ионов: ${\text{HCO}}_{3}^{ - }$ > ${\text{SO}}_{4}^{{2 - }}$ > Cl–; Ca2+ > Na+ > Mg2+ > K+ (Моисеенко и др., 1996). Качество вод Хибинских малых горных озер соответствует естественно-природным водоемам Мурманской области, с низкими концентрациями биогенных элементов, общей минерализации и высоким содержанием кислорода (Кашулин и др., 2008).
Минерализация исследованных озер на высотах более 500 м очень низкая (<12 мг/л, а оз. Каровое 3.7 мг/л, табл. 2), а ниже – сопоставима со средней минерализацией озер, находящихся вдали от влияния выбросов промышленных предприятий Мурманской области (>20 мг/л). В целом отмечается тенденция уменьшения минерализации с увеличением абсолютных отметок уреза воды в озерах (r = –0.65, p < 0.05). Установлена также отрицательная корреляция между морфометрическими показателями исследуемых озер – высотой над уровнем моря и отношением площадей водосбор/озеро (r = –0.82, p < 0.05). С увеличением высоты озера увеличивается время периода с отрицательными температурами (накопления снега), а также соотношение площадей водосбора и озера, т.е. талая вода, поступающая в период снеготаяния в озера на больших абсолютных отметках, практически не подвергается преобразованию химического состава на территории водосбора и в неизменном виде пополняет запасы озерных вод. С уменьшением площади горных озер природного парка “Ергаки” (Западный Саян) происходит уменьшение минерализации воды с 23 до 7.2 (Анищенко и др., 2015). С увеличением высоты озера зафиксировано снижение минерализации с 60 до 38 мг/л в Мультинских озерах Горного Алтая (Бородина, Бородина, 2019), а также национального парка Абиску, Швеция, где происходит снижение величины электропроводности со 140 до 6 мкСм/см (Nauwerck, 1994), наименьшие значения сопоставимы с величинами электропроводности в озерах Каровое, Ловчорр и Академическое (табл. 2).
Воды исследованных озер относятся к гидрокарбонатному классу (кроме оз. Каровое) и натриевой группе (рис. 2). Водоемы (за исключением озер Каровое и Ловчорр) способны противостоять кислотным выпадениям благодаря щелочному составу подстилающих горных пород, сравнительно высокой буферной емкости (больше критического значения 50 мкг-экв/л) и значительным глубинам. Это подтверждается невысокими концентрациями анионов сильных кислот ${\text{SO}}_{4}^{{2 - }}$, Cl–, ${\text{NO}}_{3}^{ - }$ и нейтральными значениями pH (табл. 2 и 3). В озерах Каровое, Ловчорр и Партомъявр отношение эквивалентных концентраций [${\text{HCO}}_{3}^{ - }$]/[${\text{SO}}_{4}^{{2 - }}$] равно 0.3, 1.6 и 1.2 соответственно, в то время как в других озерах оно выше 3. Примерно равное соотношение главных анионов [${\text{HCO}}_{3}^{ - }$] и [${\text{SO}}_{4}^{{2 - }}$] в воде оз. Партомъявр свидетельствует о поступлении сернистых соединений на водосбор озера с выбросами комбината “Североникель”. Соотношение главных анионов в воде оз. Каровое отличается от всех исследуемых озер – ${\text{SO}}_{4}^{{2 - }}$ > Cl– > > ${\text{HCO}}_{3}^{ - }$. По химическому составу воды озер Каровое и Ловчорр близки к составу атмосферных осадков (Даувальтер и др., 2008). Можно сделать вывод, что основное участие в питании этих озер принимают атмосферные осадки, главным образом, в твердом виде (снежники), которые не подверглись преобразованию химического состава на территории водосбора. Гидрокарбонатных класс воды отмечается в горных озерах других регионов Евразии (Бородина, Бородина, 2019; Nauwerck, 1994; Camarero et al., 2009a; Tornimbeni et al., 2012). С увеличением высоты озер национального парка Абиску фиксируется увеличение доли сульфатов и хлоридов в анионном составе (Nauwerck, 1994).
Рис. 2.
Распределение (в %–экв) главных анионов (а) и катионов (б) в воде исследуемых озер (1–7, см. рис. 1).
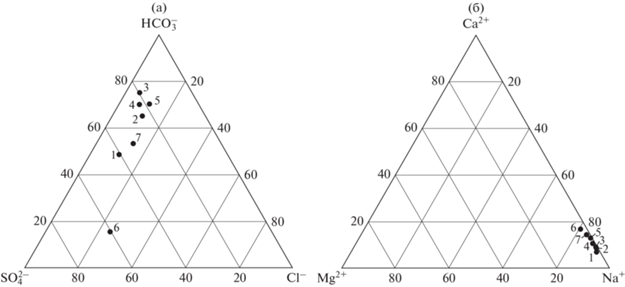
Таблица 3.
Средние содержания соединений N и P (мкг/л), цветности (°Pt), химического потребления O, органического C и Si (мг/л) в воде исследуемых озер
| №№ озер | Озеро | ${\text{NH}}_{4}^{ + }$ | ${\text{NO}}_{3}^{ - }$ | Nобщ | ${\text{PO}}_{4}^{{3 - }}$ | Pобщ | Цветн. | ХПКMn | Cорг | Si |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Партомъявр | 26 | 161 | 277 | 2 | 5 | 5 | 0.3 | 1.8 | 2.31 |
| 2 | Академическое | 4 | 44 | 93 | н.о. | 3 | 5 | 0.6 | 2.0 | 1.30 |
| 3 | Сердцевидное | 11 | 87 | 203 | 1 | 4 | 5 | 0.4 | 1.9 | 2.38 |
| 4 | Длинное | 11 | 65 | 172 | 1 | 4 | 7 | 0.5 | 2.0 | 1.45 |
| 5 | Тахтаръявр | 7 | 90 | 236 | 2 | 6 | 4 | 0.5 | 1.9 | 1.66 |
| 6 | Каровое | 6 | 2 | 152 | 1 | 3 | 5 | 0.6 | 2.0 | 0.37 |
| 7 | Ловчорр | 10 | 129 | 175 | 2 | 5 | 5 | 0.8 | 2.2 | 1.38 |
Для исследуемых озер вследствие влияния геохимического состава подстилающих щелочных горных пород выявлен следующий порядок распределения главных катионов: Na+ > K+ > Ca2+ > > Mg2+. Особенностью химического состава воды исследуемых озер является повышенное относительное содержание катиона K+ (в пересчете на эквивалентную концентрацию), который находится на втором месте после иона Na+, за исключением озер Тахтаръявр и Каровое, в которых Ca2+ незначительно превышает K+. Равнинные озера Мурманской области, не получающие прямых стоков промышленных предприятий, характеризуются гидрокарбонатным классом и кальциевой группой, и катион K+ стоит, как правило, на последнем месте среди основных катионов (Кашулин и др., 2008). Соотношение суммы ионов щелочноземельных металлов к сумме ионов щелочных металлов в воде исследуемых озер находится в пределах от 0.09 до 0.21, в то время как в озерах Мурманской области соотношение [Ca2+ + + Mg2+]/[Na+ + K+] в среднем близко к единице (Кашулин и др., 2008). Пресноводные горные озера других регионов характеризуются, как правило, кальциевой группой (Анищенко и др., 2015; Бородина, Бородина, 2019; Nauwerck, 1994; Camarero et al., 2009a; Tornimbeni et al., 2012).
По содержанию биогенных элементов исследуемые водоемы относятся к олиготрофным с признаками мезотрофного (табл. 3). Содержание общего фосфора (Pобщ) соответствует олиготрофному статусу, а общего азота (Nобщ) в воде озер Тахтаръявр и Партомъявр – нижней границе мезотрофного (Романенко и др., 1990). Подобное содержание Pобщ зафиксировано в горных озерах национального парка Абиску (от 4 до 12 мкг/л, Nauwerck, 1994) и Западного Саяна (от 7 до 9 мкг/л, Анищенко и др., 2015), а также Норвегии (от 1 до 6 мкг/л, Camarero et al., 2009b). Медианные значения для ${\text{NH}}_{4}^{ + }$, ${\text{NO}}_{3}^{ - }$ и Nобщ в фоновых озерах северо-восточной части Мурманской области водосбора Баренцева моря равны 10, 2 и 188 мкгN/л (Кашулин и др., 2008), что сопоставимо с содержаниями в воде исследуемых озер, кроме нитрат-иона, которого в Хибинских озерах значительно больше (за исключением оз. Каровое). Повышенные содержания соединений азота в озерах связаны, скорее всего, с близким расположением рудников АО “Апатит” и выбросами в атмосферу продуктов взрывов при добыче апатитонефелиновых руд и с их поступлением с производственной пылью Второй апатитонефелиновой обогатительной фабрики (АНОФ-II) и его хвостохранилища (оз. Тахтаръявр находится на расстоянии 7 км от АНОФ-II). Меньшее содержание ${\text{NO}}_{3}^{ - }$ отмечено в горных озерах национального парка Абиску (от 5.9 до 8.1 мкг/л, Nauwerck, 1994) и большее – в озерах Западного Саяна (от 115 до 375 мкг/л, Анищенко и др., 2015).
Содержание органических веществ в воде исследуемых горных озер (табл. 3) меньше, чем средние показатели в озерах северо-восточной части Мурманской области водосбора Баренцева моря (Кашулин и др., 2010) – 62 Pt°, 9.5 мг/л и 7.7 мгC/л для цветности, ХПКMn и Cорг соответственно. Вероятно, это связано с тем, что водные массы исследуемых озер формируются за счет поверхностного стока с территории водосборов, в меньшей степени покрытой почвенно-растительным слоем по сравнению с условиями на более низких абсолютных отметках, что уменьшает поступление аллохтонного органического материала. В пользу этого предположения говорит отрицательная корреляция уреза воды озер над уровнем моря и цветности (r = –0.78, p < 0.05). Низкое содержание Cорг (до 1–2 мгC/л) зафиксировано также в Альпийских горных озерах, а также Норвегии (Camarero et al., 2009a).
В исследуемых озерах концентрации тяжелых металлов (ТМ) меньше средних значений для малых озер восточной (фоновой) части Мурманской области (Kashulin et al., 2017). Максимальные содержания Cu, Ni и Zn отмечены в воде оз. Партомъявр, находящегося ближе всех из исследуемых озер к комбинату “Североникель” (40 км), выбросы которого беспрепятственно достигают водосбора озера. Хибинский горный массив является препятствием для атмосферных выбросов металлургического комбината, и они с трудом достигают водосборов исследуемых озер. Поэтому в воде озер, расположенных в центре Хибин (например, оз. Академическое), зафиксированы наименьшие содержания ТМ (табл. 4). Подобное содержание ТМ зафиксировано в воде Альпийских озер севера Италии – диапазон 0.2–2.4, 0.1–1.2 и 1.1–7.2 мкг/л для Cu, Ni и Zn соответственно (Tornimbeni et al., 2012).
Таблица 4.
Средние содержания микроэлементов в воде исследуемых озер (мкг/л)
| №№ озер | Озеро | Al | Fe | Cu | Ni | Co | Zn | Mn | Sr | Pb |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Партомъявр | 35 | 18 | 3.4 | 2.3 | 0.2 | 3.6 | 2 | 29 | 0.30 |
| 2 | Академическое | 19 | 5 | 0.7 | 0.5 | 0.1 | 0.9 | 0.6 | 3 | н.о. |
| 3 | Сердцевидное | 56 | 10 | 0.4 | 0.5 | 0.2 | 1.9 | н.о. | 71 | 0.30 |
| 4 | Длинное | 45 | 9 | 0.9 | 0.5 | 0.2 | 2.2 | 1 | 64 | 0.28 |
| 5 | Тахтаръявр | 24 | 7 | 0.6 | 0.6 | 0.3 | 1.8 | 5 | 43 | 0.10 |
| 6 | Каровое | 133 | 28 | 0.2 | 0.6 | 0.3 | 2.3 | 3 | 32 | 0.30 |
| 7 | Ловчорр | 41 | 4 | 0.3 | 0.3 | 0.2 | 1.1 | 1.1 | 64 | н.о. |
Характерной особенностью химического состава поверхностных вод Арктической зоны и Севера России является повышенные концентрации Fe, Al, Mn вследствие гумификации водосборов (Моисеенко и др., 2013). Но вследствие малого содержания органического материала в воде исследуемых озер, содержания этих металлов невысокие по сравнению с равнинными озерами (медианные концентрации 81, 44 и 3 мкг/л для Fe, Al и Mn соответственно, Кашулин и др., 2010). Концентрация элементов, поступающих в озера в результате деятельности апатитонефелинового производства (Al и Sr), находится в пределах диапазона значений, характерных для других малых озер Хибинского горного массива, куда не поступают стоки рудников (Кашулин и др., 2008). Наибольшие содержания Al и Fe зафиксированы в оз. Каровое, что связано с низкими величинами pH в воде, при которых эти металлы приобретают большую миграционную способность (Никаноров, 2001). Это подтверждает также отрицательные значения коэффициента корреляции величин pH с содержаниями Al и Fe (r = –0.70 и –0.55 соответственно). Наибольшие содержания Sr (также как и соединений азота) отмечены в воде озер, близко расположенных к предприятиям АО “Апатит”, – Сердцевидное, Ловчорр, Длинное и Тахтаръявр.
Распределение элементов по формам нахождения в воде
Характеристика распределения элементов по формам может быть представлена балансом лабильных и нелабильных содержаний элемента. Лабильными формами нахождения элементов принимаются аква-ионные, связанные в неорганические (в том числе смешенные) комплексные соединения металлов, а также слабо связанные с органическим веществом (с низкой условной константой устойчивости). К нелабильным формам условно относятся прочно связанные соединения металлов с органическим веществом, преимущественно гумусовой природы (Родюшкин, 1995). Первостепенным параметром для оценки менее активных форм являются содержания органических веществ. В зависимости от условных констант устойчивости комплексов металлом с различными лигандами в условиях конкурентной среды и общего (валового) содержания элемента (принцип Ле-Шателье) равновесие может смещаться в сторону лабильных или нелабильных форм нахождения.
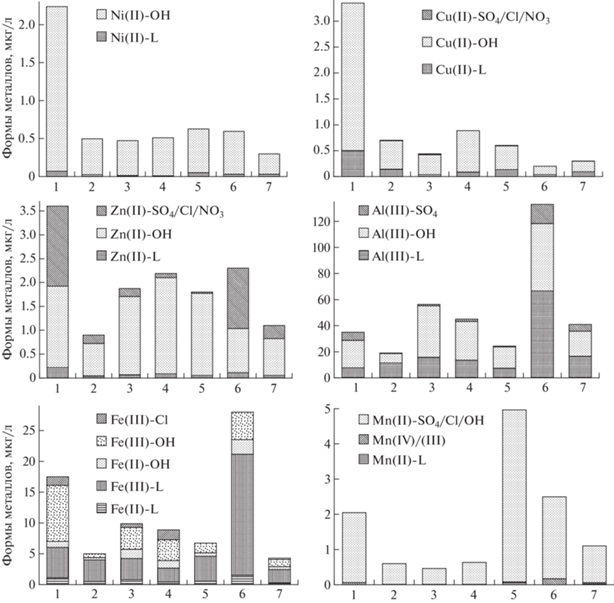
Озера Хибинского щелочного массива характеризуются меньшей минерализацией и содержанием органических веществ в химическом составе по сравнению с водами равнинных озер Мурманской области (Базова, 2017; Даувальтер, 2020). Содержание главных ионов и некоторых ТМ (Fe, Mn, Cu и Ni) в воде озер в зоне влияния арктического железорудного предприятия (АО “Олкон”, г. Оленегорск) до 10 раз выше, чем в Хибинских озерах (Даувальтер, 2020). В водах Хибинских озер концентрация органического вещества (ХПКMn, табл. 3) не превышает 1 мгО/л, при относительно большом суммарном содержании конкурентных неорганических анионов (гидрокарботаны, хлориды, сульфаты). Низкое содержание органических веществ способствует связыванию в нелабильные комплексы в первую очередь ионов металлов, обладающих наибольшими условными константами устойчивости органических комплексов с ними, – Al и Fe, в среднем 37 и 55% соответственно (рис. 3), что ниже, чем для вод озер Оленегорского района для этих же металлов (от 60 до 91%). Оставшаяся часть ионов Al и Fe образует связь с гидроксогруппами –OH (в среднем 55 и 40% соответственно). Доля гидроксогрупп Al(III)–OH и Fe(III)–OH больше в озерах, в которых значение pH ≥ 7, что подтверждается отрицательной корреляцией содержания гидроксогрупп этих металлов с величиной pH (r = –0.81 и –0.77 соответственно). Отмечена также отрицательная корреляция Fe(III)–OH и содержания органического материала (ХПКMn и Cорг) в воде озер (r = –0.70). Для всех форм нахождения Al и Fe в воде Хибинских озер установлена тесная корреляция с отношением площадей водосбор/озеро (r = 0.66–0.93) и отрицательная связь с высотой озера над уровнем моря (r = 0.68–0.72), что говорит о влиянии времени контакта горных пород и атмосферных осадков на территории водосбора озер на содержание этих металлов в воде. Соединения Fe(II) в Хибинских озерах, характеризующихся высоким содержанием растворенного кислорода в воде, находятся в меньших концентрациях, чем Fe(III) (рис. 3).
Ионы других металлов в озерах Хибинских озер из-за дефицита органических лигандов для образования комплексов (процент нелабильных соединений значительно ниже) связываются в неорганические комплексные соединения согласно тем же правилам – в соответствие со значениями констант устойчивости комплексов и конкурентным содержанием металлов, т.е. равновесие смещается в сторону образования лабильных форм нахождения элементов. Для ионов Ni(II) и Cu(II) – это возможность преимущественно образовывать гидроксо-комплексы (в среднем 94 и 82%) и в меньшей степени комплексы с органическими лигандами (в среднем 5 и 18%); для ионов Zn(II), содержание которых выше, чем Ni(II) и Cu(II) в Хибинских озерах (табл. 4) – равновесие смещается в сторону образования гидроксо-комплексов (в среднем 73%) и неорганических сульфатно-хлоридно-нитратных комплексов (в среднем 23%). В воде озер Оленегорского района основными формами нахождения Zn(II) являются связанные с органическими веществами и гидроксо-комплексами (Даувальтер, 2020). Из-за очень низких содержаний и низкого сродства к органическим веществам в водах Хибинских и Оленегорских озер, ионы Co(II) представлены только лабильными гидроксоформами Co(II)–OH. Ионы Mn(II), также как и Pb(II), в Хибинских и Оленегорских озерах находятся в виде смешанных неорганических комплексов и ионных/аква-ионных соединений Mn(II)–SO4/Cl/OH (рис. 3) и Pb(II)–SO4/Cl/OH (в среднем 97%).
Исследованиями (Родюшкин, 1995) получен следующий ряд способности металлов к комплексобразованию с органическими лигандами в поверхностных водах Кольского Севера – Fe(99%) > Cu(65%) > Al(30%) > Ni(25%) > > Zn(10%) > Mn(<1%) > Sr(<1%), где в скобках указан % форм, закомплексованных с органическим веществом, от общего содержания металла. Сходный ряд активности металлов в процессах комплексобразования для поверхностных вод Кольского Севера был получен исследованиями (Дину, 2012, 2017). Высокой способностью к комплексобразованию обладает Fe, что определяется его физико-химическими свойствами (радиусом ионов и зарядами, конфигурационными свойствами) (Моисеенко, 2015). По сравнению с равнинными озерами Мурманской области в воде Хибинских озер получен другой ряд с гораздо меньшей долей закомплексованности с органическими лигандами вследствие их дефицита в горных озерах – Fe(55%) > Al(37%) > Cu(18%) > > Ni(5%) = Zn(5%) > Mn(1%) = Pb(1%) > Co(0%). В воде озер в зоне влияния арктического железорудного предприятия (АО “Олкон”, г. Оленегорск), в которых содержание органического материала на порядок выше, чем в Хибинских озерах, получен следующий ряд комплексобразования металлов с органическими лигандами – Cu(77%) > > Fe(53%) > Ni(30%) > Al(27%) > Zn(23%) > Co(8%) > > Mn(2%) (Даувальтер, 2020), т.е. здесь на первое место выходит Cu.
Химический состав донных отложений озер и оценка степени антропогенной нагрузки
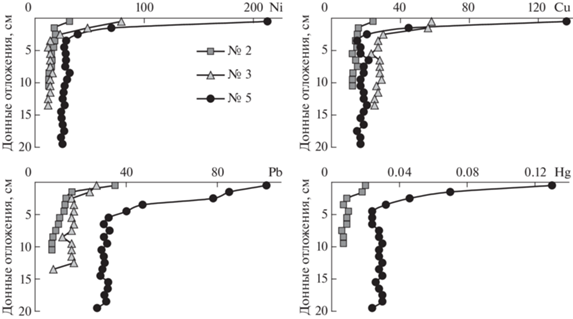
Характер распределения содержания ТМ в ДО свидетельствует о крайне низких скоростях осадконакопления в озерах (рис. 2). С учетом данных (Денисов, 2012; Даувальтер и др., 2015), особенностей рельефа и малой площади водосбора, а также в связи с незначительным поступлением аллохтонного вещества с территории водосборов, скорость накопления ДО составляет доли мм в год. Аккумуляция некоторых ТМ (Сu, Ni, Hg и особенно Pb) наблюдается начиная с верхних слоев ДО (3–5 см) озер Татхтаръявр и Сердцевидное, что объясняется глобальным загрязнением атмосферы северо-запада Европы этими элементами в XIX–XX вв (Norton et al., 1992). Резкое увеличение содержания ТМ в поверхностном слое 0–2 см является результатом деятельности крупных металлургических комбинатов в Мурманской области в XX в. (Даувальтер и др., 2010, 2015). В оз. Академическое заметное увеличение содержаний ТМ отмечается только в поверхностном 1-см слое ДО, что говорит о незначительной скорости осадконакопления.
Заметный рост концентраций Pb в датируемых ДО озер Севера Фенноскандии зафиксирован в середине XVIII в., что может быть связано с развитием индустриальной революции в Европейских странах (Даувальтер и др., 2015). С этого времени происходит постоянное увеличение содержания Pb вследствие усиления металлургического производства, в том числе и Pb. Поэтому увеличение содержания Pb в ДО оз. Татхтаръявр, характеризующееся большей скоростью осадконакопления, отмечено на большей глубине (5 см), чем других ТМ (рис. 4). Особенно заметно увеличение содержания Pb в ДО озер Севера Фенноскандии произошло в середине прошлого века, и связано это с интенсивным развитием промышленности в целом после Второй мировой войны, в том числе с усиливающимся использованием этилированного бензина, и возобновлением металлургического производства в регионе (Даувальтер и др., 2015). В это время происходит также увеличение концентраций, характерных для Мурманской области загрязняющих ТМ Ni и Сu.
Рис. 4.
Вертикальное распределение ТМ в ДО исследуемых озер (мкг/г сухого веса, 2, 3, 5, см. рис. 1).
Коэффициенты загрязнения (Cf – отношение концентрации элемента в поверхностном 1-см слое ДО к содержанию этого элемента в самой нижней части колонки, определяемого как фоновое, Håkanson, 1980) для Cu и Ni наибольшие в оз. Тахтаръявр и они относятся к высоким по классификации Л. Хокансона. В этом озере зафиксировано также максимальное загрязнение для Hg, значительное по классификации Л. Хокансона. Максимальная величина Cf по Pb (значительное по классификации Л. Хокансона) отмечена в оз. Академическое, хотя максимальная концентрация этого высокотоксичного ТМ зафиксирована в оз. Тахтаръявр (рис. 2, табл. 5). Наибольшее значение степени загрязнения Cd (пограничное между значительным и высоким по классификации Л. Хокансона), рассчитанной как сумма коэффициентов загрязнения восьми ТМ (Cu, Ni, Co, Zn, Cd, Pb, Hg и As), отмечено в оз. Тахтаръявр, расположенном на юго-западном склоне Хибинского массива, до которого беспрепятственно доходит аэротехногенное загрязнение комбината “Североникель” и АНОФ-II. Озера Академическое и Сердцевидное также подвержены загрязнению, но меньшему, чем оз. Тахтаръявр, о чем свидетельствуют значения степени загрязнения, находящиеся на границе между умеренным и значительным согласно классификации Л. Хокансона.
Таблица 5.
Концентрации ТМ в поверхностных (0–1 см) и фоновых слоях (вторая строка) ДО, значения коэффициентов (Cf) и степени (Cd) загрязнения исследуемых озер
| Озеро | Слой, см | ППП | Cu | Ni | Zn | Co | Cd | Pb | As | Hg | Cd |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Академическое | 0–1 | 24.68 | 24.1 | 31.6 | 103 | 5.44 | 0.94 | 35.1 | 3.32 | 0.020 | – |
| 19–20 | 24.97 | 12.0 | 12.5 | 51 | 5.16 | 0.58 | 7.3 | 2.37 | 0.007 | – | |
| Cf | – | 2.0 | 2.5 | 2.0 | 1.1 | 1.6 | 4.8 | 1.4 | 2.9 | 18.3 | |
| Сердцевидное | 0–1 | 22.90 | 58 | 79 | 122 | 7.0 | 1.19 | 27 | – | – | – |
| 13–14 | 16.70 | 25 | 12 | 121 | 5.0 | 1.19 | 8 | – | – | – | |
| Cf | – | 2.3 | 6.6 | 1.0 | 1.4 | 1.0 | 3.4 | – | – | 15.7 | |
| Тахтаръявр | 0–1 | 15.16 | 136 | 213 | 270 | 19.8 | 0.506 | 102 | 11.6 | 0.130 | – |
| 19–20 | 16.89 | 17 | 25 | 390 | 16.6 | 0.196 | 27 | 9.62 | 0.024 | – | |
| Cf | – | 8.1 | 8.4 | 0.7 | 1.2 | 2.6 | 3.7 | 1.2 | 5.4 | 31.4 |
Структура фитопланктона и оценка трофического статуса озер
Альгоценозы планктона исследованных водоемов характеризуются сравнительно бедным видовым составом (от 6 до 27 таксонов рангом ниже рода) и низкими количественными показателями, что объясняется малым периодом открытой воды и неблагоприятным температурным режимом (табл. 6). Подобными низкими количественными показателями фитопланктона (содержание хлорофилла “a” от 0.15 до 1.88 мг/м3 и биомасса от 0.03 до 0.84 г/м3) характеризуются горные озер национального парка Абиску (Nauwerck, 1994). В составе сообществ преобладали диатомовые и золотистые водоросли, также встречались харовые (десмидиевые) и зеленые водоросли (Денисов и др., 2015а). Концентрация биогенных элементов определяет, вероятно, не столько биомассу фитопланктона, сколько его таксономическое разнообразие. Так, максимальные показатели видового разнообразия характерны для фитопланктона оз. Тахтаръявр, где выявлено самое высокое содержание общего фосфора (табл. 3). Здесь были обнаружены представители зеленых водорослей и цианопрокариот, характерных для мезотрофных водоемов (Pandorina charkowiensis Korsch; Microcystis sp.). Не исключено, что за короткое гидробиологическое лето (3–4 месяца) уровень развития фитопланктона оказывается недостаточным для утилизации доступных биогенных элементов, включая востребованный фотосинтезирующими организмами нитрат-ион. По уровню содержания Сhl “a” и средней летней биомассе фитопланктона все водоемы соответствуют α-олиготрофному трофическому статусу, за исключением оз. Сердцевидное, воды которого относятся к β-олиготрофному. Рассчитать индекс сапробности S для некоторых озер (Ловчорр, Академическое, Каровое) оказалось невозможным в силу отсутствия достаточного количества водорослей-сапробионтов. Для прочих S соответствует I и II классу качества вод – “очень чистые” и “чистые” (ГОСТ, 2010). Достоверных связей показателей фитопланктона с микроэлементами-загрязнителями не установлено. Очевидно, роль фитопланктона в круговоротах веществ в экосистемах исследованных водоемов не высока.
Таблица 6.
Некоторые средние показатели фитопланктона в исследованных озерах (N – количество проб, B – биомасса фитопланктона, Chl a – содержание хлорофилла “a”, S – индекс сапробности, Wq – класс качества вод, T – трофический статус вод (α-о – α-олиготрофный; β-о – β-олиготрофный), H' – индекс видового разнообразия
| №№ озер | Озеро | N, шт. | B, г/м3 | Chl a, мг/м3 | S | Wq | T | H', бит/экз. |
|---|---|---|---|---|---|---|---|---|
| 1 | Партомъявр | 2 | 0.11 | 0.32 | 1.28 | II | α-о | 1.5 |
| 2 | Академическое | 4 | 0.24 | 0.86 | – | – | α-о | 1.1 |
| 3 | Сердцевидное | 8 | 0.79 | 1.14 | 1.22 | II | β-о | 1.9 |
| 4 | Длинное | 8 | 0.06 | 0.72 | 0.72 | I | α-о | 1.6 |
| 5 | Тахтаръявр | 4 | 0.04 | 0.18 | 1.35 | II | α-о | 2.7 |
| 6 | Каровое | 8 | 0.18 | 0.40 | – | – | α-о | 0.8 |
| 7 | Ловчорр | 2 | 0.03 | 0.22 | – | – | α-о | 1.2 |
На развитие альгоценозов оказывает влияние не столько аэротехногенное загрязнение, сколько естественно-природные факторы. Так, малый период открытой воды и высокий снежный покров весной, очевидно, затрудняют подледную вегетацию, а низкий уровень развития фитопланктона в течение короткого гидробиологическое лета не позволяет водорослям использовать доступные биогенные элементы. Озера с относительно высоким содержанием соединений фосфора и азота отличаются более высоким таксономическим богатством фитопланктона, в составе сообществ отмечено присутствие таксонов, характерных для мезотрофных вод. Предыдущими исследованиями (Денисов, 2010) было показано, что в сравнительно крупных водоемах Хибинского массива на свободных ото льда участках обильно развивается фитоперифитон, участвующий в утилизации биогенных элементов. В исследованной группе малых горных озер поверхностный сток либо не выражен, либо озера не освобождаются ото льда и снега в весенний период, поэтому этот путь утилизации биогенов не реализуется. Использование индекса сапробности S для оценки качества вод водоемов этого типа ограничено ввиду бедного видового состава и малого количества водорослей – сапробионтов.
Диатомовые комплексы донных отложений и оценка влияния температурного фактора
Видовой состав и структура ДК в ДО изученных озер существенно отличаются (рис. 5). В оз. Сердцевидное до начала интенсивной аккумуляции ТМ в ДО развивались диатомеи, характерные для олиготрофных озер со значениями pH, близкими к нейтральным (рис. 5а): Aulacoseira alpigena (Grun.) Kramm.; Aulacoseira subborealis (Nygaard) Denys, Muylaert & Kramm., а также алкалибионт – Cyclotella radiosa (Grun.) Lemm., предпочитающий pH > 7.0. Начиная со слоя 7 см вверх по разрезу происходит постепенное обогащение ДК диатомеями-ацидофилами, предпочитающими pH < 7.0 (Frustulia saxonica Rabenh.), C. radiosa сменяет другой массовый вид-алкалифил – Cyclotella kuetzingiana var. planetophora Fricke. Наиболее яркие изменения в ДК произошли с началом поступления загрязнителей в водоем, начиная со слоя 4 см. В этот период увеличилась доля ацидобионтов (предпочитают pH ≤ 6.0) – Eunotia spp., как результат поступления кислотообразующих соединений антропогенного происхождения (Моисеенко и др., 1997; Денисов, 2005; Каган, 2012). В этом же интервале ДО отмечено резкое увеличение численности диатомей (в 8 раз) наряду с сокращением видового разнообразия (с 2.7 до 1.8 бит/экз.), как реакция на поступление биогенных элементов. В настоящее время в озере в летний и осенний период сохраняются нейтральные значения pH (табл. 2). Можно предположить, что увеличение доли ацидобионтов в верхних слоях ДО является реакцией на кратковременное весеннее снижение pH, наблюдаемое в Хибинах во время снеготаяния (период так называемого “pH-шока”, Моисеенко, 1991).
Рис. 5.
Изменение массовых и индикаторных таксонов ДК в ДО исследованных озер в различные периоды осадконакопления (а – Сердцевидное; б – Академическое; в – Тахтаръявр).
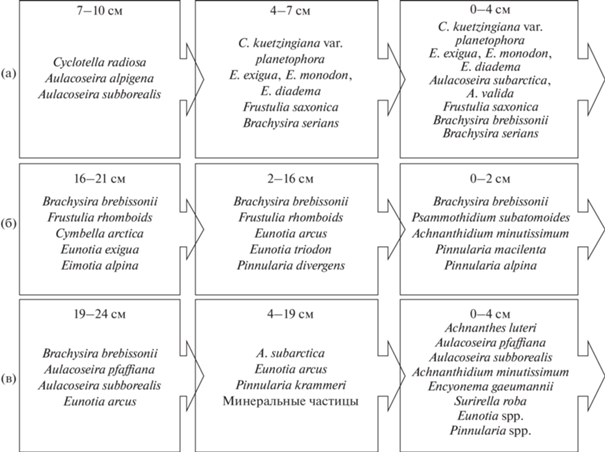
В оз. Академическое ДК во всей изученной толще ДО характеризуются бедным видовым составом (29 таксонов рангом ниже рода) и представлены преимущественно видами-индикаторами олиготрофных условий, развивающихся при малом содержании биогенных элементов (рис. 5б). В самых древних слоях (24–19 см) доминировали ацидофилы Brachysira brebissonii (Grun. in Van Heurck) Ross, Frustulia rhomboides (Ehrb.) De Toni и ацидобионты – Eunotia exigua (Bréb. ex Kütz.) Rabenh, Eunotia alpina (Näg.) Hust. В средней части колонки ДО (16–2 см) были выявлены некоторые изменения таксономического состава ДК связанные с сокращением доли ацидобионтов и замене их ацидофилами. Это свидетельствует о пониженных значениях pH в озере до начала аэротехногенного загрязнения (Денисов, 2012). Значимые изменения в ДК произошли в верхних слоях ДО (2–0 см) – появились диатомеи – алкалифилы, не встречающиеся в более древних слоях: Psammothidium subatomoides (Hust.) Bukhtiyarova & Round и Achnanthidium minutissimum (Kütz.) Czarnecki, при этом из состава ДК исчезли некоторые представители ацидобионтов – Eunotia spp. Видовое разнообразие снизилось с 2.3 до 1.9 бит/экз. Вероятно, основным модулятором этих изменений выступило поступление загрязнителей с атмосферными осадками с последующей трансформацией условий формирования качества вод.
Причиной пониженных значений pH в озере, находящемся в щелочном горном массиве, очевидно, следует считать наличие в озере большого количества водных мохообразных (сем. Marchantiophyta), способных уменьшать pH в ходе своей жизнедеятельности (Ильяшук, 1999). Многие виды диатомей, входящие в комплекс доминантов, используют мхи в качестве субстрата и таким образом развиваются в условиях пониженных значений pH. Вероятно, сообщества обрастателей, сформированные мохообразными и диатомеями, существовали совместно в водоеме на протяжении всего исследованного периода. Антропогенные кислотообразующие соединения не привели к снижению pH в озере, напротив, наблюдается рост значений pH (Денисов, 2012). Это может быть вызвано сокращением площади мохообразных, а также интенсификацией эрозионных процессов на водосборе и увеличением водообмена. Роль диатомовых водорослей в круговоротах элементов в озере, очевидно, была незначительной на протяжении всего исследованного периода. Основным утилизатором биогенных элементов являлись водные мохообразные.
ДК оз. Тахтаръявр в нижней части исследованных ДО (19–24 см) отличаются невысоким таксономическим богатством – 17 таксонов рангом ниже рода, H' = 1.6 бит/экз. Доминировали диатомеи, характерные для олиготрофных холодноводных водоемов, предпочитающие нейтральные и слабокислые значения pH: Aulacoseira pfaffiana (Reinsch) Kramm., Brachysira brebissonii, Eunotia arcus Ehrb.; встречались алкалифилы – Aulacoseira subborealis (рис. 5в). В средней части колонки (4–19 см) произошло обеднение таксономического богатства диатомей (до 13 таксонов рангом ниже рода), встречались практически “немые” слои. В пробах присутствует значительное количество минеральных частиц, предположительно, короткостолбчатые и гексагональные кристаллы нефелина и(или) апатита (рис. 6). Они служат маркером интенсивности эрозионных процессов и свидетельствуют о многочисленных осыпях склонов ледникового цирка, которым ограничен водосбор озера в период накопления этого интервала ДО. Характер распределения ТМ показал, что условия седиментации при этом не были нарушены (рис. 4). Таким образом, каменные осыпи в чашу водоема приводили к появлению большого количества взвешенных частиц, самые тонкодисперсные из которых осаждались в зоне аккумуляции – на глубине 25 м. Поверхностные слои ДО (0-4 см) соответствуют периоду, когда началось аэротехногенное загрязнение озера. Поступление биогенных элементов вызвало резкое увеличение численности и таксономического разнообразия диатомей, всего в этом интервале ДО было выявлено 53 таксона диатомей рангом ниже рода. В ДК доминируют диатомеи, предпочитающие pH < 7.0 – Aulacoseira pfaffiana и Platessa lutheri (Hust.) Potapova. Появилось множество обрастателей и бентосных диатомей, не встречавшихся в более древних слоях ДО: Surirella roba Leclercq, Encyonema gaeumannii (Meister) Kramm., Achnanthidium minutissimum виды рода Eunotia и др. Причиной увеличения численности и видового богатства диатомей, наряду с биогенными элементами, также может быть увеличение периода открытой воды, вызванное современным потеплением климата Арктики (Демин и др., 2015). Современная диатомовая флора соответствует холодноводному олиготрофному озеру. Можно констатировать увеличение роли водорослей в круговороте элементов на современном этапе.
Рис. 6.
Минеральные частицы – кристаллы нефелина и (или) апатита из ДО оз. Тахтаръявр (линейка – 10 мкм).

Основные изменения в ДК исследованных озер произошли в период, когда началась интенсивная аккумуляция ТМ в ДО, что говорит об изменении геохимических условий формирования качества вод в результате аэротехногенного загрязнения. Сообщества диатомей оказались наиболее чувствительны к изменению величины pH. Исследованные озера проявляют устойчивость к кислотообразующим выпадениям, благодаря щелочным подстилающим породам. Так, в оз. Академическое, которое защищено горами от атмосферных выпадений, ДК отражают увеличение pH в период накопления самого верхнего слоя ДО. В оз. Тахтаръявр развиваются диатомеи, предпочитающие нейтральные и слабокислые условия. Мелководное озеро Сердцевидное оказалось наиболее уязвимо к аэротехногенному закислению, о чем говорит увеличение доли диатомей, предпочитающих pH < 7.0 в поверхностных слоях ДО; при этом интенсивного закисления воды в настоящее время не происходит. Для всех озер отмечен рост численности створок диатомей в современных слоях ДО, что может быть следствием увеличения концентрации соединений азота и фосфора в воде на фоне увеличения периода открытой воды в результате потепления климата Арктики. Минеральные частицы, обнаруженные в ДО оз. Тахтаръявр служат маркером интенсивности эррозионных процессов, протекающих на склонах ледникового цирка, где расположено озеро. Исходя из распределения ТМ в ДО, наиболее активно склоны разрушались до начала развития промышленности в Европе и Мурманской области.
ЗАКЛЮЧЕНИЕ
Геохимические и климатические особенности водосборной территории и морфометрическая характеристика водоемов влияют на их химический состав воды и донных отложений (Håkanson, 2005). В последние десятилетия все большее влияние на процессы формирования качества озер оказывает антропогенная деятельность. Хибинский массив сложен щелочными нефелин-сиенитовыми породами, в которых, помимо щелочных металлов Na и K, в больших количествах содержатся Ca, P, Al, Si, Sr, F, Mn, Fe, Th, редкоземельные элементы. Хибинские озера на высотах более 400 м характеризуются малой площадью водосбора, преобладанием атмосферного питания и коротким периодом (3–4 мес.) открытой воды. С увеличением высоты над уровнем моря озера увеличивается время периода с отрицательными температурами и накопления атмосферных осадков в твердом виде, и талая вода, поступающая в период снеготаяния в озера на больших абсолютных отметках, практически не подвергается преобразованию химического состава на территории водосбора и в неизменном виде пополняет запасы озерных вод. Незначительная мощность или отсутствие почвенно-растительного слоя, его обедненность органическими остатками, недостаточное время контакта вод поверхностного стока с подстилающими породами не способствует их активному выщелачиванию и поступлению макро- и микроэлементов в Хибинские горные озера. Вышеперечисленные особенности водосборов и самих озер способствуют формированию уникальных гидрохимических и гидробиологических особенностей Хибинских горных озер: воды озер относятся к гидрокарбонатному классу и натриевой группе, они характеризуются нейтральными и слабокислыми значениями pH, низким содержанием главных ионов, биогенных элементов, органических веществ и микроэлементов, олиготрофным статусом, меньшей долей закомплексованности металлов с органическими лигандами, повышенным относительным содержанием катиона K+, низкими скоростями осадконакопления в озерах, бедным видовым составом и низкими количественными показателями фитопланктона, представленным типичными арктическими олиготрофными видами. Наибольшее содержание Al и Fe зафиксировано в озерах с минимальными значениями pH в воде, при которых эти металлы приобретают большую миграционную активность. С увеличением высоты озер Хибинского массива над уровнем моря установлена тенденция снижения величины pH, минерализации, содержания главных ионов и микроэлементов, количественных показателей фитопланктона, увеличения доли сульфатов в анионом составе.
Антропогенная деятельность сказывается в незначительном увеличении содержания микроэлементов в воде озер, находящихся ближе к комбинату “Североникель” (Cu, Ni и Zn) и АО “Апатит” (Sr), а также соединений азота в воде близлежащих к АО “Апатит” озер. В результате трансграничных переносов загрязняющих веществ в атмосфере и деятельности крупных металлургических комбинатов в Мурманской области в XX в. увеличивается содержания ТМ в поверхностном слое 0–5 см ДО. С началом поступления загрязнителей в Хибинские озера происходит резкая перестройка диатомовых комплексов ДО: увеличивается численность диатомей и доля ацидобионтов (реакция на кратковременное весеннее снижение pH во время снеготаяния) наряду с сокращением (в озерах Сердцевидное и Академическое) либо увеличением (в оз. Тахтаръявр) видового разнообразия. Причиной увеличения численности и видового богатства диатомей в оз. Тахтаръявр, наряду с ростом содержания биогенных элементов, может быть увеличение периода открытой воды, вызванное современным потеплением климата Арктики. Наиболее уязвимым к аэротехногенному закислению и загрязнению оказалось мелководное озеро Сердцевидное, о чем говорит увеличение доли ацидобионтов в поверхностных слоях ДО; при этом интенсивного закисления воды в настоящее время не происходит. Несмотря на невысокое содержание ТМ в воде исследуемых озер, в ДО зафиксированы высокие (для Ni и Cu) и значительные (для Pb и Hg) величины коэффициента загрязнения (Cf). Исследуемые Хибинские горные озера характеризуются значительными (по классификации Л. Хокансона) величинами степени загрязнения (Cd). Установлено, что геохимический состав и диатомовые комплексы ДО горных озер являются лучшими индикаторами процессов региональных и глобальных изменений окружающей среды и трансграничных переносов загрязняющих веществ в атмосфере по сравнению с гидрохимическими показателями.
Работа выполнена в рамках темы НИР № 0226-2019-0045 (полевые работы) и поддержана из средств грантов РФФИ № 18-05-60125 (химический и диатомовый анализ) и РНФ № 19-77-10007 (определение форм нахождения металлов).
Список литературы
Алекин О.А. (1970) Основы гидрохимии. Л.: Гидрометеоиздат, 444 с.
Анищенко О.В., Глущенко Л.А., Дубовская О.П., Зуев И.В., Агеев А.В., Иванова Е.А. (2015) Морфометрические характеристики и содержание металлов в воде и донных отложениях горных озер природного парка “Ергаки” (Западный Саян). Водные ресурсы 42(5). 522-535.
Базова М.М. (2017) Особенности формирования элементного состава вод Кольского Севера в условиях функционирования горнорудных производств. Геохимия (1), 92-106.
Bazova M.M. (2017) Specifics of the elemental composition of waters in environments with operating mining and ore-processing plants in the Kola North. Geochem. Int. 55(1), 131-143.
Баринова С.С., Медведева Л.А., Анисимова О.В. (2006) Биоразнообразие водорослей-индикаторов окружающей среды. Тель-Авив: PiliesStudio.
Бородина Е.В., Бородина У.О. (2019) Формирование химического состава озерных вод особо охраняемых территории Горного Алтая на примере бассейна р. Мульты. Водные ресурсы 46(4), 405-416.
Волошин А.В., Майстерман С.А. (1983) Минералы Кольского полуострова. Мурманск: Мурманское книжное издательство, 110 с.
ГОСТ 17.1.3.07–82. (2010) Охрана природы. Гидросфера. Правила контроля качества воды водоемов и водотоков. Контроль качества воды: Сб. ГОСТов. М.: Стандартинформ.
Даувальтер В.А. (2012) Геоэкология донных отложений озер. Мурманск: Изд-во Мурманского гос. техн. ун-та, 242 с.
Даувальтер В.А. (2020) Геохимия озер в зоне влияния Арктического железорудного предприятия. Геохимия 65(8), 797-810.
Dauvalter V.A. (2020) Geochemistry of lakes in a zone impacted by an Arctic iron-producing enterprise. Geochem. Int. 58(8), 933-946.
Даувальтер В.А., Даувальтер М.В., Салтан Н.В., Семенов Е.Н. (2008) Химический состав атмосферных выпадений в зоне влияния комбината “Североникель”. Геохимия (10), 1131-1136.
Dauvalter V.A., Dauvalter M.V., Saltan N.V., Semenov E.N. (2008) Chemical composition of atmospheric precipitates within the Influence zone of the Severonikel smelter. Geochem. Int. 46(10), 1053-1058.
Даувальтер В.А., Даувальтер М.В., Кашулин Н.А., Сандимиров С.С. (2010) Химический состав донных отложений озер в зоне влияния атмосферных выбросов комбината “Североникель”. Геохимия (11), С. 1224-1229.
Dauvalter V.A., Dauvalter M.V., Kashulin N.A., Sandimirov S.S. (2010) Chemical composition of bottom sedimentary deposits in lakes in the zone impacted by atmospheric emissions from the Severonickel Plant. Geochem. Int. 48(11), 1148-1153.
Даувальтер В.А., Кашулин Н.А., Денисов Д.Б. (2015) Тенденции изменения содержания тяжелых металлов в донных отложениях озер Севера Фенноскандии в последние столетия. Труды Карельского научного центра РАН (9), 62-75.
Демин В.И., Анциферова А.Р., Мокротоварова О.И. (2015) Изменения температуры воздуха в Мурманске с начала XIX века. Вестник Кольского научного центра РАН (1), 113-125.
Денисов Д.Б. (2005) Изменения комплексов диатомовых водорослей под влиянием природных и антропогенных факторов в озерно-речных системах Хибинского горного массива (Кольский полуостров). Автореф. дис. канд. биол. наук. С.-Петербург: Ин-т озероведения РАН, 27 с.
Денисов Д.Б. (2010) Экологические особенности водорослевых сообществ разнотипных субарктических водоемов. Вестник Кольского научного центра РАН (1), 48-55.
Денисов Д.Б. (2012) Реконструкция развития экосистемы малого горного субарктического водоема за последние 900 лет (на примере оз. Академическое, Хибины, Кольский полуостров). Труды Кольского научного центра РАН (3), 127-148.
Денисов Д.Б., Даувальтер В.А., Кашулин Н.А., Каган Л.Я. (2006) Долговременные изменения состояния субарктических водоемов в условиях антропогенной нагрузки (по данным диатомового анализа). Биология внутренних вод (1), 24-30.
Денисов Д.Б., Валькова С.А., Терентьев П.М., Черепанов А.А. (2015а) Экологические особенности малых ледниковых субарктических озер (Хибинский горный массив, Кольский полуостров). Труды Карельского научного центра РАН (2), 40-52.
Денисов Д.Б., Кашулин Н.А., Даувальтер В.А. (2015б) Диатомовые комплексы донных отложений озера Имандра в зоне влияния подогретых вод Кольской АЭС. Труды Карельского научного центра РАН (9), 10-24.
Диатомовый анализ (1949). В 2 кн. Л.: ГИГЛ, кн. 1., 240 с., кн. 2., 238 с.
Давыдова Н.Н. (1985) Диатомовые водоросли – индикаторы природных условий водоемов в голоцене. Л.: Наука, 244 с.
Дину М.И. (2012) Влияние функциональных особенностей гумусовых веществ на формы нахождения металлов в природных водах. Тюмень: Изд-во ТюмГУ, 167 с.
Дину М.И. (2017) Формирование органических веществ гумусовой природы и их биосферные функции. Геохимия (10), 917-933.
Dinu M.I. (2017) Formation of organic substances of humus nature and their biospheric properties. Geochem. Int. 55(10), 911-926.
Ильяшук Б.П. (1999) Сравнительное изучение роста и продукции водных мхов в закисленных озерах южной Карелии. Экология (6), 421-425.
Каган Л.Я. (2012) Диатомовые водоросли Евро-Арктического региона. Аннотированная коллекция (древние и современные морские и пресноводные). Апатиты: Изд-во Кольского научного центра РАН, 209 с.
Кашулин Н.А., Денисов Д.Б., Сандимиров С.С., Даувальтер В.А., Кашулина Т.Г., Малиновский Д.Н., Вандыш О.И., Ильяшук Б.П., Кудрявцева Л.П. (2008) Антропогенные изменения водных систем Хибинского горного массива (Мурманская область). В 2 ч. Апатиты: Изд-во Кольского научного центра РАН, ч. 1. 250 с., ч. 2. 282 с.
Кашулин Н.А., Сандимиров С.С., Даувальтер В.А., Кудрявцева Л.П., Терентьев П.М., Денисов Д.Б., Валькова С.А. (2010) Аннотированный экологический каталог озер Мурманской области (Восточная часть. Бассейн Баренцева моря). В 2 ч. Апатиты: Изд-во Кольского научного центра РАН, ч. 1. 249 с., ч. 2. 128 с.
Китаев С.П. (2007) Основы лимнологии для гидробиологов и ихтиологов. Петрозаводск: Изд-во Карельского научного центра РАН, 394 с.
Методы экологических исследований водоемов Арктики. (2019). Мурманск: Изд-во Мурманского гос. техн. ун-та, 180 с.
Минеева Н.М. (2004) Растительные пигменты в воде волжских водохранилищ. М.: Наука, 156 с.
Моисеенко Т.И. (1991) Закисление и загрязнение тяжелыми металлами поверхностных вод Кольского Севера. Апатиты: Изд-во Кольского научного центра РАН, 47 с.
Моисеенко Т.И. (2015) Влияние геохимических факторов водной среды на биоаккумуляцию металлов в организме рыб. Геохимия (3), 222-233.
Moiseenko T.I. (2015) Impact of geochemical factors of aquatic environment on the metal bioaccumulation in fish. Geochem. Int. 53(3), 213-223.
Моисеенко Т.И., Родюшкин И.В., Даувальтер В.А., Кудрявцева Л.П. (1996) Формирование качества вод и донных отложений в условиях антропогенных нагрузок на водоемы арктического бассейна (на примере Кольского Севера). Апатиты: Изд-во Кольского научного центра РАН; 263 с.
Моисеенко Т.И., Даувальтер В.А., Каган Л.Я. (1997) Горные озера как индикаторы загрязнения воздуха. Водные ресурсы 24(5), 600-608.
Моисеенко Т.И., Даувальтер В.А., Ильяшук Б.П., Каган Л.Я., Ильяшук Е.А. (2000) Палеоэкологическая реконструкция антропогенной нагрузки. ДАН 370(1), 115-118.
Моисеенко Т.И., Даувальтер В.А., Лукин А.А., Кудрявцева Л.П., Ильяшук Б.П., Ильяшук Е.А., Сандимиров С.С., Каган Л.Я., Вандыш О.И., Шаров А.Н., Шарова Ю.Н., Королева И.М. (2002) Антропогенные модификации экосистемы озера Имандра. М: Наука, 487 с.
Моисеенко Т.И., Разумовский Л.В., Гашкина Н.А., Шевченко А.В., Разумовский В.Л., Машуков А.С., Хорошавин В.Ю. (2012) Палеоэкологические исследования горных озер. Водные ресурсы 39(5), 543-557.
Моисеенко Т.И., Дину М.И., Гашкина Н.А., Кремлева Т.А. (2013) Формы нахождения металлов в природных водах в зависимости от их химического состава. Водные ресурсы 40(4), 375-385.
Никаноров А.М. (2001) Гидрохимия. СПб.: Гидрометеиздат, 444 с.
Павлова А.С., Кашулин Н.А., Денисов Д.Б., Терентьев П.М., Кашулина Т.Г., Даувальтер В.А. (2019) Распределение химических элементов между компонентами экосистемы арктического озера Большой Вудъявр (Хибины, Мурманская область). Сибирский экологический журн. (3), 348-366.
Природные условия Хибинского учебного полигона (1986) Под. ред. С.М. Мягкова. М.: Изд-во МГУ, 170 с.
Родюшкин И.В. (1995) Основные закономерности распределения металлов по формам в поверхностных водах Кольского Севере. Дис. канд. геогр. наук. С.-Петербург: Ин-т Озероведения, 161 с.
Романенко В.Д., Оксиюк О.П., Жукинский В.Н., Стольберг Ф.В., Лаврик В.И. (1990) Экологическая оценка воздействия гидротехнического строительства на водные объекты. Киев: Наук. думка, 256 с.
Сладечек В. (1967) Общая биологическая схема качества воды. Санитарная и техническая гидробиология. М.: Наука.
Слуковский З.И., Мицуков А.С., Даувальтер В.А. (2019) Молибден в донных отложениях озера Большой Вудъявр, Мурманская область: вертикальное распределение и формы нахождения. Труды Ферсмановской научной сессии ГИ КНЦ РАН (16), 534-538.
Сулименко Л.П., Кошкина Л.Б., Мингалева Т.А., Светлов А.В., Некипелов Д.А., Макаров Д.В., Маслобоев В.А. 2017. Молибден в зоне гипергенеза Хибинского горного массива. Мурманск: Изд-во МГТУ, 148 с.
Ферсман А.Е. (1924) К вопросу о содержании редких земель в апатитах. Доклады РАН (2), 42-45.
Ферсман А.Е. (1968) Наш апатит. М.: Наука, 136 с.
Чукаева М.А., Матвеева В.А. (2018) Современное гидрохимическое состояние гидроэкосистем, находящихся под техническим влиянием АО “Апатит”. Водные ресурсы 45(6), 685-690.
Югай В.С., Даувальтер В.А., Кашулин Н.А. (2013) Содержание биодоступных форм соединений металлов в донных отложениях водоемов и коэффициент накопления (Kd) как показатели экологической обстановки водоемов (на примере озер Мурманской области). Вестник МГТУ 16(3), 591-600.
Camarero L., Rogora M., Mosello R., Anderson N.J. et al. (2009a) Regionalization of chemical variability in European mountain lakes. Freshwater Biol. 54(12), 2452-2469.
Camarero L., Botev I., Muri G., Psenner R., Rose N., Stuchlik E. (2009b) Trace elements in alpine and arctic lake sediments as a record of diffuse atmospheric contamination across Europe. Freshwater Biol. 54(12), 2518-2532.
Catalan J., Bartons M., Camarero L., Grimalt J.O. (2013) Mountain waters as witnesses of global pollution. In: Living with Water: Targeting Quality in a Dynamic World (Eds. Pechan P., de Vries G.E.). New York: Springer, 31-67.
Determination of photosynthetic pigments in sea water (1966). Report of SCOP-UNESCO Working Group 17. Paris: UNESCO, 18 p.
Guiry M.D., Guiry G.M. (2020) Algae Base. World-wide electronic publication. Galway: National University of Ireland, http://www.algaebase.org
Håkanson L. (1980) An ecological risk index for aquatic pollution control – a sedimentological approach. Water Res. (14), 975-1001.
Håkanson L. (2005) The importance of lake morphometry and catchment characteristics in limnology – ranking based on statistical analysis. Hydrobiologia 541(1), 117-137.
Intercomparison–2016 (2016) 1630: pH, Conductivity, Alkalinity, NO3-N, Cl, SO4, Ca, Mg, Na, K, TOC, Al, Fe, Mn, Cd, Pb, Cu, Ni and Zn. ICP Waters report 129/2016. Oslo: Norwegian Institute for Water Research, Report No. 7081, 72 p.
Kashulin N.A., Dauvalter V.A., Denisov D.B., Valkova S.A., Vandysh O.I., Terentjev P.M., Kashulin A.N. (2017) Selected aspects of the current state of freshwater resources in the Murmansk Region, Russia. J. Environ. Science and Health, Part A 52(9), 921-929.
Moser K.A., Baron J.S., Brahney J., Oleksy I.A. et al. (2019) Mountain lakes: Eyes on global environmental change. Global and Planetary Change 178, 77-95.
Nauwerck A. (1994) A survey on water chemistry and plankton in high mountain lakes in northern Swedish Lapland. Hydrobiologia 274, 91-100.
Norton S.A., Bienert R.W.J., Binford M.W., Kahl J.S. (1992) Stratigraphy of total metals in RIPLA sediment cores. Paleolimnology (7), 191-214.
Pantle R, Buck H. (1955) Die biologische Überwachung der Gewässer und die Darstellung der Ergebnisse. Gas- und Wasserbach. 96(18), 604.
Shannon C.E., Weaver W. (1949) The Mathematical Theory of Communication. Urbana, IL: The University of Illinois Press, 117 p.
Standard method for examination for water and wastewater (1999). 20-th Edition (Eds. Clescerl L.S., Greenberg A.E., Eaton A.D.). Washington: American Public Health Association USA, 2671 p.
Tornimbeni O., Rogora M. (2012) An evaluation of trace metals in high altitude lakes of the Central Alps. Present levels, origins and possible speciation in relation to pH values. Water Air and Soil Poll. 223(7), 1895-1909.
Дополнительные материалы отсутствуют.