Геохимия, 2022, T. 67, № 6, стр. 590-596
Энтальпии образования алунита и натроалунита (по калориметрическим данным)
Л. П. Огородова a, *, Ю. Д. Гриценко a, b, М. Ф. Вигасина a, Л. В. Мельчакова a, Д. А. Ксенофонтов a
a Московский Государственный Университет имени М.В. Ломоносова, Геологический факультет
119991 Москва, Ленинские Горы, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
* E-mail: logor48@mail.ru
Поступила в редакцию 05.03.2021
После доработки 28.07.2021
Принята к публикации 04.10.2021
- EDN: TVIRCT
- DOI: 10.31857/S001675252206005X
Аннотация
Методами порошковой рентгенографии, инфракрасной спектроскопии, электронно-микрозондового и термического анализов проведено исследование природного образца алунита состава K0.6Na0.4Al3(SO4)2(OH)6. Методом расплавной калориметрии растворения на микрокалориметре Кальве “Setaram” (Франция) определена энтальпия образования изученного алунита из элементов ∆fH0(298.15 K) = –5149 ± 13 кДж/моль. Рассчитаны энтальпии и энергии Гиббса образования конечных членов ряда алунит KAl3(SO4)2(OH)6 – натроалунит NaAl3(SO4)2(OH)6: –5164 ± 13 и –4651 ± 13, –5127 ± 13 и –4615 ± 13 кДж/моль соответственно.
ВВЕДЕНИЕ
Алунит в соответсвии с предложенной в (Bayliss et al., 2010) номенклатурой является членом алунитовой надгруппы с общей формулой $D{{G}_{3}}{{(T{{X}_{4}})}_{2}}X_{6}^{'}$, где D – четырех-, трех-, двух-, одновалентный катион или вакансия; G – трехвалентный катион; T – шести- или пятивалентный катион; X и X' – O, (OH), возможно, F или H2O. В собственно алуните позицию D занимает K, позицию G – Al, позиции TX4 и X' – анион ${\text{SO}}_{4}^{{2 - }}$ и ОН-группа соответственно. Замещение алюминия трехвалентным железом приводит к образованию непрерывной серии твердых растворов алунит KAl3(SO4)2(OH)6 – ярозит ${\text{KFe}}_{3}^{{3 + }}$(SO4)2(OH)6; Na-K изоморфизм (ряд натроалунит NaAl3(SO4)2(OH)6 – алунит KAl3(SO4)2(OH)6) ограничен из-за значительного различия размеров катионов калия и натрия (радиусы соответственно 1.33 и 0.95 Å), однако, как показано в работе (Stoffregen et al., 2000) синтез при температурах выше 350°С приводит к полной смесимоcти в ряду алунит – натроалунит, с понижением температуры можно ожидать явлений распада. Диаграмма составов природного алунита, представленная в (Lerouge et al., 2006), демонстрирует отсутствие в природе образцов алунита с содержанием менее ≈25% калиевого компонента. Алунит кристаллизуется в тригональной сингонии, пространственная группа R3m, Z = 3. В кристаллической структуре алунита K имеет координационное число 12 и окружен шестью атомами кислорода и шестью гидроксильными группами, Al находится в октаэдрической координации и окружен четырьмя гидроксил-ионами и двумя атомами кислорода из сульфатных групп.
Алунит образуется в близповерхностных условиях в интервале температур 15–400°С в низкотемпературном гидротермальном процессе, под воздействием на глиноземистые породы сернокислых вод, полученных при разложении пирита, или сольфатарной деятельности в вулканических областях. Также алунит характерен для зоны окисления сульфидных месторождений.
Алунитовые руды, содержащие алюминий, серу и щелочные металлы, используются для извлечения из них всех полезных составляющих. В некоторых странах эти руды перерабатываются на квасцы и сульфат калия. В России добыча алунита ведется в Забайкалье, Амурской области, на Урале. Месторождения алунитовой породы обнаружены в Азербайджане, Казахстане, Узбекистане, Украине, США, Италии, Испании, Франции, Австралии, Китае.
Залежи белой глины и алунита с помощью орбитального спутника “Марс Экспресс” были обнаружены на Марсе, эти данные в соответствии с условиями образования земного алунита могут указывать на возможное существование в прошлом богатых алюминием кислых соленых марсианских вод (Carr, 1996; Benison, 2016; Ehlmann et al., 2016). Изучение геологической истории нашей соседней планеты возможно с применением термодинамического моделирования условий минералообразования, что, в свою очередь, требует надежных термодинамических констант минералов, обнаруженных на марсианской поверхности, в том числе минералов группы алунита (алунита, натроалунита, ярозита, натроярозита и др.).
Основная масса проведенных физико-химических исследований алунита посвящена изучению его синтетических аналогов. В работах (Brophy et al., 1962; Parker, 1962; Serna et al., 1986; Stoffregen, Alpers, 1992; Stoffregen et al., 2000; Frost et al., 2006a; Küçük, Yildiz, 2006; Majzlan et al., 2006; Toumi, Tlili, 2008; Murphy et al., 2009; Jones, 2017) представлены результаты рентгенографического изучения; в работах (Serna et al., 1986; Bishop, Murad, 2005; Frost et al., 2006b; Frost, Wain, 2008a; Toumi, Tlili, 2008; Murphy et al., 2009; Maubec et al., 2012; Henry et al., 2013; Сергеева, 2019) – результаты КР- и ИК-спектроскопии. Термические и термогравиметрические исследования выполнены авторами публикаций (Arazi, Krenkel, 1970; Bohmhammel et al., 1987; Küçük, Yildiz, 2006; Frost et al., 2006b; Frost, Wain, 2008b; Zema et al., 2012). Информация же о термодинамических свойствах алунита весьма немногочисленна. Имеется единственная экспериментальная калориметрическая работа, в которой в 1947 году методом растворения в 0.2N растворе KOH получена величина энтальпии образования синтетического основного сульфата калия и алюминия из элементов (–5169.7 ± 1.9 кДж/моль (Kelley et al., 1947)). Впоследствии эти данные были пересчитаны Хемингуэем и Роби (Hemingway, Robie, 1995) и включены в созданный ими справочник по термодинамическим свойствам минералов (–5176.5 ± 2.4 кДж/моль (Robie, Hemingway, 1995)). Рассчитанная по измеренной на калориметре энтальпии реакции разложения синтетического образца алунита в работе (Bohmhammel et al., 1987) величина ∆fH(298.15 K), равная –5026.24 ± ± 30 кДж/моль, значительно отличается от приведенных выше значений. В работах (Gaboreau, Vieillard, 2004; Valero et al., 2012) представлены оцененные значения энтальпии и энергии Гиббса образования алунита. Авторами (Kelley et al., 1947; Hemingway, Robie, 1995) была измерена низкотемпературная теплоемкость синтетического алунита и рассчитано значение стандартной энтропии.
В настоящей работе представлены результаты калориметрического изучения природного образца алунита с целью определения его энтальпии образования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика образца
Для исследований был выбран алунит (месторождение Заглик, Азербайджан) из коллекции кафедры минералогии геологического факультета МГУ имени М.В. Ломоносова. Образец представлен плотным однородным скрытокристаллическим агрегатом алунита светло-бежевого цвета с тусклым матовым блеском.
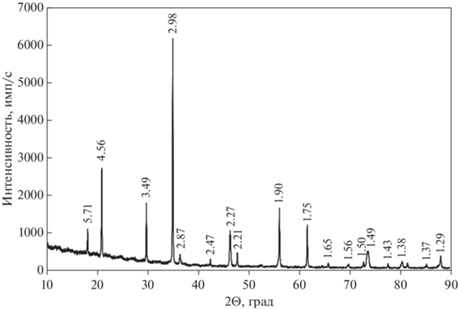
Рентгенографическое изучение было выполнено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлялся в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора, угол захвата которого составлял 5° по углу 2Θ с шириной канала 0.02°. Рентгендифракционный спектр образца (рис. 1) соответствует спектру алунита согласно базам данных ICDD (The International Centre for Diffraction Data, 2013; карточка № 01.072.1630), RRUFF (Database of Raman spectroscopy, X-ray diffraction and chemistry of minerals; карточка № R070448) и MINCRYST (Crystallographic and Crystallochemica Database for Minerals and their Structural Analogues, карточка № 7140).
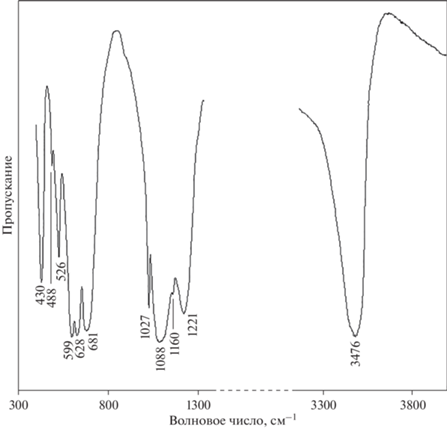
ИК-спектроскопические исследования (FTIR) были выполнены на Фурье-спектрометре “ФСМ 1201” (Россия) в режиме пропускания на воздухе при комнатной температуре в диапазоне волновых чисел от 400 до 4000 см–1 с точностью ±2 см–1. Образцы были приготовлены в виде суспензий порошка минерала (3–5 мг) в вазелиновом масле и наносились на пластинку из бромида калия, в качестве образца сравнения использовалась та же пластинка из KBr до нанесения на нее минеральной суспензии.
Описание спектра исследованного образца алунита (рис. 2) может быть выполнено на основании результатов работ (Toumi, Tlili,2008; Сергеева, 2019), в которых представлены ИК-спектры, схожие со спектром, полученным в настоящей работе. Полосы поглощения алунита группируются в трех спектральных диапазонах с примерными границами: 3200–3600, 900–1300 и 400–750 см–1. В высокочастотной спектральной области зарегистрирована одна очень интенсивная симметричная полоса поглощения с максимумом при 3476 см–1, относящаяся к валентным колебаниям гидроксильных групп. Отсутствие дополнительных компонент у этой полосы указывает на то, что ОН-группы занимают эквивалентные кристаллографические позиции. Спектральный диапазон 900–1300 см–1 содержит широкую интенсивную полосу с четырьмя компонентами, которым можно дать следующие отнесения: интенсивные полосы при 1221 и 1088 см–1 приписываются трижды вырожденным антисимметричным валентным колебаниям ν3 аниона ${\text{SO}}_{4}^{{2 - }}$; слабоинтенсивное плечо при 1160 см–1 относят к обертону либрационных колебаний гидроксильных групп 2γ(ОН); узкая полоса средней интенсивности при 1027 см–1 приписывается симметричным валентным колебаниям ν1 аниона ${\text{SO}}_{4}^{{2 - }}$. Особенность спектральной области 400–750 см–1 заключается в том, что здесь проявляются полосы поглощения, соответствующие валентным и деформационным колебаниям AlO6-октаэдров, деформационным и валентным колебаниям SO4-тетраэдров и либрационным колебаниям гидроксильных групп. Перекрывание полос создает трудности при точном отнесении полос поглощения. С учетом этого факта отнесение полос может быть следующим: интенсивная полоса с максимумом при 681 см–1 приписывается деформационной моде ν4 аниона ${\text{SO}}_{4}^{{2 - }}$ и трижды вырожденной деформационной моде ν3 AlO6-октаэдра; полосу поглощения при 628 см–1 связывают также с деформационной модой ν4 аниона ${\text{SO}}_{4}^{{2 - }}$ и трижды вырожденной деформационной модой ν3 AlO6-октаэдра; полоса при 599 см–1 приписывается колебанию ν3 AlO6-октаэдра, и приблизительно здесь же находится полоса, отвечающая либрационным колебаниям гидроксильных групп γ(ОН); узкая полоса поглощения средней интенсивности с максимумом около 526 см–1 связывается с полносимметричным валентным колебанием ν1 AlO6-октаэдров; слабоинтенсивную полосу при 488 см–1 приписывают трижды вырожденному деформационному колебанию ν4 AlO6-октаэдров, а интенсивную узкую полосу при 430 см–1 – дважды вырожденному деформационному колебанию ν2 аниона ${\text{SO}}_{4}^{{2 - }}$.
Термическое поведение алунита было изучено на дериватографе “Q-1500D” (Венгрия) в интервале температур от комнатной до 1273 K со скоростью нагрева 20 K/мин, масса образца составляла 210 мг. Полученная картина ТГ, ДТГ и ДТА кривых согласуется с результатами предшествующих исследований (Arazi, Krenkel, 1970; Иванова и др., 1974; Bohmhammel et al., 1987; Küçük, Yildiz, 2006). В образце отсутствует адсорбированная вода, потеря массы, происходящая в интервале 500–650°С (tmax = 590°C), соответствует процессу дегидроксилизации. Согласно данным (Иванова и др.,1974; Küçük, Yildiz, 2006) при этом образуется аморфный глинозем и сульфаты калия, натрия и алюминия, которые при дальнейшем нагревании выше 700°С (tmax = 870°C), подвергаются разложению с потерей оксида серы.
Химический анализ был выполнен на электронном микрозондовом анализаторе “CAMEBAX SX-50” (Франция), ускоряющее напряжение 15 кВ, ток пучка 30 нА. Изученный образец имеет следующий состав (мас. %): Na2O 2.77; K2O 6.81; MgO 0.01; CaO 0.02; Fe2O3 1.08; Al2O3 37.50; SO3 38.71; H2O 13.4 (количество воды получено по данным термогравиметрии). Химическая формула, рассчитанная на 10 зарядов, имеет вид (K0.58Na0.38)(${\text{A}}{{{\text{l}}}_{{2.96}}}{\text{Fe}}_{{0.04}}^{{3 + }}$)(SO4)1.97(OH)6.02 и упрощенно: K0.6Na0.4Al3(SO4)2(OH)6. Изучаемый образец представляет собой промежуточный член изоморфной серии алунит – натроалунит.
Термохимическое исследование
Термохимическое исследование алунита было проведено на высокотемпературном теплопроводящем микрокалориметре Тиана–Кальве “Setaram” (Франция) методом калориметрии растворения. В качестве растворителя был использован расплав состава 2PbO ⋅ B2O3, приготовленный сплавлением стехиометрических количеств оксида свинца и борной кислоты при 1073 К. Растворение проводили на воздухе методом “сброса”: фрагменты образца алунита массой 5–12.5 (±2 × × 10–3) мг сбрасывали от комнатной температуры в калориметр с расплавом, находящимся при T = = 973 К; измеряемое значение теплового эффекта представляло собой сумму приращения энтальпии образца [(H0(973 K) – H0(298.15 K)] и энтальпии его растворения ΔраствH0(973 K). При использовании 30–35 г растворителя и проведении 6–8 экспериментов соотношение растворенное вещество – растворитель можно было отнести к бесконечно разбавленному раствору с пренебрежимо малой энтальпией смешения. Калибровку прибора осуществляли измерением приращения энтальпии эталонного вещества – платины, проводимым в условиях экспериментов по растворению. Необходимые данные по [(H0(973 K) – H0(298.15 K)] для Pt были взяты из (Robie, Hemingway, 1995).
Среднее значение измеренной величины [H0(973 K) – H0(298.15 K) + ΔраствH0(973 K)]. Из 6 определений, выполненных на микрокалориметре Кальве, составило 1371.1 ± 17.9 Дж/г = 559.1 ± ± 7.3 кДж/моль (М = 407.77 г/моль), погрешности определены с вероятностью 95%.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Энтальпия образования из элементов
На основании полученных калориметрических данных и термохимического цикла, включающего растворение минерала и составляющих его компонентов, была рассчитана энтальпия образования алунита состава K0.6Na0.4Al3(SO4)2(OH)6. Расчет проводили с использованием реакции (1) и уравнений (2) и (3).
(1)
$\begin{gathered} 0.3{{{\text{K}}}_{{\text{2}}}}{\text{O}} + 0.2{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + 2{\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + 2{\text{CaS}}{{{\text{O}}}_{4}} + \\ + \,\,0.5{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} = 2{\text{CaO}} + {{{\text{K}}}_{{{\text{0}}{\text{.6}}}}}{\text{N}}{{{\text{a}}}_{{{\text{0}}{\text{.4}}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{{\text{6}}}}, \\ \end{gathered} $(2)
$\begin{gathered} {{\Delta }_{{{\text{р - ции}}}}}_{{\left( 1 \right)}}{{H}^{0}}(298.15{\text{ K}}) = 0.3\Delta H{{{\text{K}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,0.2\Delta H{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + 2\Delta H{\text{Al(OH}}{{{\text{)}}}_{3}} + 2\Delta H{\text{CaS}}{{{\text{O}}}_{{\text{4}}}} + \\ + \,\,0.5\Delta H{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} - 2\Delta H{\text{CaO}} - \\ - \,\,\Delta H{{{\text{K}}}_{{{\text{0}}{\text{.6}}}}}{\text{N}}{{{\text{a}}}_{{{\text{0}}{\text{.4}}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{6}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){{{\text{K}}}_{{{\text{0}}{\text{.6}}}}}{\text{N}}{{{\text{a}}}_{{{\text{0}}{\text{.4}}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}}{{{\text{(S}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{{{\text{(OH}})}_{6}} = \\ = {{\Delta }_{{{\text{р - ции}}}}}_{{(1)}}{{H}^{0}}(298.15{\text{ K}}) + 0.3{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K)}}{{{\text{K}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,0.2{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + \\ + \,\,2{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{Al(OH}}{{)}_{3}} + \\ + \,\,2{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{CaS}}{{{\text{O}}}_{4}} + \\ + \,\,0.5{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} - 2{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{CaO}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпии образования алунита и натроалунита (кДж/моль)
| Компонент | H0(973 K) – H0(298.15 K) + ΔраствH0(973 K) | – ΔfH0(298.15 K) а |
|---|---|---|
| Na2O(к.) | –111.8 ± 0.8б | 414.8 ± 0.3 |
| K2O(к.) | –193.7 ± 1.1б | 363.2 ± 2.1 |
| CaO(к.) | –21.78 ± 0.29в | 635.1 ± 0.9 |
| Al2O3(корунд) | 107.38 ± 0.59г | 1675.7 ± 1.3 |
| СaSO4(ангидрит) | 131.3 ± 1.6д | 1434.4 ± 4.2 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9ж | 1293.1 ± 1.2 |
Примечания. а Справочные данные (Robie, Hemingway, 1995). б По данным (Kiseleva et al., 2001). в–д Рассчитано с использованием справочных данных по [H0(973 K) – H0(298.15)] (Robie, Hemingway, 1995) и экспериментальных данных по растворению ΔраствH0(973 К): в (Киселева и др., 1979); г (Ogorodova et al., 2003); д (Котельников и др., 2000). ж По данным (Огородова и др., 2011).
Таблица 2.
Термодинамические свойства минералов группы алунита, полученные в настоящей работе
| Минерал | –∆fH0(298.15 K), кДж/моль |
S0(298.15 K), Дж/(мольK) |
–∆fG0(298.15 K)а, кДж/моль |
|---|---|---|---|
| Изученный алунит K0.6Na0.4Al3(SO4)2(OH)6 M = 407.77 г/моль |
5149 ± 13б | 317.2 ± 5.2в | 4637 ± 13 |
| Алунит KAl3(SO4)2(OH)6 M = 414.22 г/моль |
5164 ± 13г | 321.0 ± 5.0д | 4651 ± 13 |
| Натроалунит Na4Al3(SO4)2(OH)6 M = 398.11 г/моль |
5127 ± 13г | 311.6 ± 5.9в | 4615 ± 13 |
Примечания. а Рассчитано по формуле ∆fG0 = ∆fH0 – T∆fS0. б Получено в настоящей работе методом расплавной калориметрии растворения. в Рассчитано с использованием данных по S0(298.15 K) алунита KAl3(SO4)2(OH)6 (Robie, Hemingway, 1995). г Рассчитано с использованием калориметрических данных по растворению алунита состава K0.6Na0.4Al3(SO4)2(OH)6.д Данные (Robie, Hemingway, 1995).
Калориметрические данные по растворению природного образца алунита позволили рассчитать энтальпии образования из элементов конечных членов ряда алунит – натроалунит. Пересчитанные на их составы экспериментальные значения [H0(973 K)–H0(298.15 K) + ΔраствH0(973 K)] были использованы для расчета ΔfH0(298.15 K) по уравнениям, аналогичным (1), (2) и (3). Рассчитанные энтальпии образования алунита KAl3(SO4)2(OH)6 и натроалунита NaAl3(SO4)2(OH)6 приведены в табл. 2. Полученное в настоящей работе значение ΔfH0(298.15 K) алунита согласуется в пределах погрешностей с результатами единственной калориметрической работы, выполненной методом растворения (–5169.7 ± 1.9 кДж/моль) (Kelley et al., 1947) и с приведенной в справочном издании (Robie, Hemingway, 1995) величиной (–5176.5 ± 2.4 кДж/моль). Такое согласование полученных разными методами значений подтверждает достоверность полученных результатов. Энтальпия образования натроалунита согласуется с рассчитанной в (Stoffregen, Cygan, 1990) из обменных равновесий в водных сульфатных растворах величиной (–5131.97 кДж/моль), приведенной в работе без погрешности.
Энергия Гиббса образования из элементов
Значение ∆fG0(298.15 K) алунита KAl3(SO4)2(OH)6 (табл. 2) было рассчитано с использованием величин полученной нами энтальпии образования и стандартной энтропии по данным (Robie, Hemingway, 1995). Для расчета значений ∆fG0(298.15 K) изученного алунита и натроалунита были оценены их стандартные энтропии (табл. 2). Расчет проводился с использованием реакций (4) и (5) и значения энтропии S0(298.15 K) = 321 ± 5 Дж/(моль K) для алунита (Robie, Hemingway, 1995).
(4)
$\begin{gathered} {{{\text{K}}}_{{{\text{0}}{\text{.6}}}}}{\text{N}}{{{\text{a}}}_{{{\text{0}}{\text{.4}}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{{\text{6}}}} + 0.2{{{\text{K}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{KA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{6}} + 0.2{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(5)
$\begin{gathered} {\text{NaA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{{\text{6}}}} + 0.5{{{\text{K}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{KA}}{{{\text{l}}}_{{\text{3}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{OH}}} \right)}_{6}} + 0.5{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Полученные значения ∆fG0(298.15 K) приведены в табл. 2.
Таким образом, в результате проведенного калориметрического изучения природного образца алунита промежуточного состава изоморфной серии алунит – натроалунит получены новые данные по энтальпиям образования конечных членов этого ряда и рассчитаны энергии Гиббса их образования.
Порошковый дифрактометр “STOE-STADI MP”, инфракрасный Фурье-спектрометр “ФСМ-1201”, дериватограф “Q-1500D” и микрокалориметр Тиана–Кальве “Setaram” установлены на геологическом факультете МГУ имени М.В. Ломоносова.
Список литературы
Иванова В.П., Касатов Б.К., Красавина Т.Н., Розинова Е.Л. (1974) Термический анализ минералов и горных пород. Ленинград: Недра, 400 с.
Киселева И.А., Огородова Л.П., Топор Н.Д., Чигарева О.Г. (1979) Термохимическое исследование системы СаО–MgO–SiO2. Геохимия (12), 1811-1825.
Котельников А.Р., Кабалов Ю.К., Зезюля Т.Н., Мельчакова Л.В., Огородова Л.П. (2000) Экспериментальное изучение твердого раствора целестин-барит. Геохимия (12), 1286-1293.
Kotel’nikov A.R., Kabalov Yu K., Zezyulya T.N., Mel’chakova L.V., Ogorodova L.P. (2000) Experimental study of celestine -barite solid solution. Geochem. Int. 38(12), 1181-1187.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ (9), 1609-1611.
Сергеева А.В. (2019) Инфракрасные спектры минералов группы алунита, сформированных на термальных полях. Журнал прикл. спектр. 86(3), 333-340).
Arazi S.C., Krenkel T.G. (1970) Dehydroxylation heat of alunite. Am. Mineral. 55, 1329-1337.
Bayliss P., Kolitsch U., Nickel E.H., Pring A. (2010) Alunite supergroup: recommended nomenclature. Mineral. Mag. 74(5), 919-927.
Benison K.C. (2016) Alunite on Mars. Am. Mineral. 101(7), 1499-1500/
Bohmhammel K., Naumann R., Paulik F. (1987) Thermoanalytical and calorimetric investigations of the formation and decomposition of some alunites. Thermochim. Acta 121, 109-119.
Brophy G.P., Scott E.S., Snellgrove R.A. (1962) Sulfate studies II. Solid solution between alunite and jarosite. Am. Mineral. 47, 112-126.
Carr MH (1996) Water on Mars. Oxford University Press, New York, 229 p.
Ehlmann B.L., Swayze G.A., Milliken R.E., Wray J.J., Mustard J.F., Breit G.N., Clark R.N., Gondet B., Poulet F., Carter J. Calvin W. M., Benzel W.M.; Seelos K.D. (2016) Discovery of alunite in Cross Crater, Terra Sirenum, Mars: Evidence for precipitation from acidic, sulfurous groundwaters on the margin of a paleolake. Am. Mineral. 101, 1527-1542.
Frost R.L., Wain D.L., Wills R.-A., Musemeci A., Martens W. (2006a) A thermogravimetric study of heat of alunitethe alunites of sodium, potassium and ammonium. Thermochim. Acta 443, 56-61.
Frost R.L., Wills R.-A., Weier M.L., Martens W., Kloprogge J.T. (2006b) A Raman spectroscopic study of alunites. J. Mol. Struct. 785(1–3), 123-132.
Frost R. L., Wain D.L. (2008a) Near-infrared spectroscopy of natural alunites. Spectrochim. Acta Part A 71, 490-495.
Frost R.L., Wain D.L. (2008b). A thermogravimetric and infrared emission spectroscopic study of alunite. J. Therm. Anal. Calorim. 91, 267-274.
Gaboreau S., Vieillard P. (2004) Prediction of Gibbs free energies of formation of minerals of the alunite supergroup. Geochim. Cosmochim. Acta 68(16), 3307-3316.
Hemingway B.S., Robie R.A., (1995) Heat capacity and enthalpy of formation of synthetic alunite. U.S. Geol. Surv. Open-file Report 94–688, 8 p.
Henry J.S., Llew R., Maxim A., Wayde N.M. (2013) The crystal structure and vibrational spectroscopy of jarosite and alunite minerals. Am. Mineral. 98, 1633-1643
Jones F. (2017) Crystallization of jarosite with variable Al3+ content: the transition to alunite. Minerals 7(6), 90-105.
Kelley K.K., Shomate C.H., Young F.E., Naylor B.F., Salo A.E., Huffman E.H. (1947) Thermodynamic properties of ammonium and potassium alums and related substances, with reference to extraction of alumina from clay and alunite. U.S. Bureau Mines Tech. Paper 688, 104 p.
Kiseleva I.A., Navrotsky A., Belitsky I.A., Fursenko B.A. (2001) Thermochemical study of calcium zeolites – heulandite and stilbite. Am. Mineral. 86, 448-455.
Küçük F., Yildiz K. (2006) The decomposition kinetics of mechanically activated alunite ore in air atmosphere by thermogravimetry. Thermochim. Acta 448, 107-110.
Lerouge C., Kunov A., Fléhoc C., Georgieva S., Hikov A., Lescuyer J.L., Petrunov R., Velinova N. (2006) Constraints of stable isotopes on the origin of alunite from advanced argillic alteration systems in Bulgaria. J. Geochem. Explor. 90(3), 166-182.
Majzlan J., Speziale S., Duffy T.S., Burns P.C. (2006) Single-crystal elastic properties of alunite, KAl3(SO4)2(OH)6. Phys. Chem. Miner. 33, 567-573.
Maubec N., Lahfid A., Lerouge C., Wille G., Michel K. (2012) Characterization of alunite supergroup mineralsby Raman spectroscopy. Spectrochim. Acta Part A 96, 925-939.
Murphy P.J., Smith A.M.L., Hudson-Edwards K.A., Dubbin W.E., Wright K. (2009) Raman and spectroscopic studies of alunite-supergroup compounds containing Al, Cr3+, Fe3+ and V3+ at the B site. Can. Mineral. 47, 663-681.
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta 403, 251-256.
Parker R.L. (1962) Isomorphous substitution in natural and synthetic alunite. Am. Mineral. 47, 127-136.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U.S. Geol. Surv. Bull. 2131, 461 p.
Serna C.J., Cortina C.P., Ramos J.V.G. (1986) Infrared and Raman study of alunite-jarosite compounds. Spectrochim. Acta Part A 42, 729-734.
Stoffregen R.E., Cygan G.L. (1990) An experimental study of Na-K exchange between alunite and aqueous sulfate solutions. Am. Mineral. 75, 209-220.
Stoffregen R.E., Alpers C.N. (1992) Observations on the unit-cell dimensions, H2O contents, and δD values of natural and synthetic alunite. Am. Mineral. 77, 1092-1098.
Stoffregen R.E., Alpers C.N., Jambor J.L. (2000) Alunite-jarosite crystallography, thermodynamics and geochronology. Mineral. Geochem. 40, 453-479.
Toumi M, Tlili A. (2008) Rietveld refinement and vibrational spectroscopic study of alunite from El Gnater, Central Tunisia. Russ. J. Inorg. Chem. 53(12), 1845-1853.
Valero A., Valero A., Vieillard P. (2012) The thermodynamic properties of the upper continental crust: Exergy, Gibbs free energy and enthalpy. Energy 41(1), 121-127.
Zema M., Callegari A. M., Tarantino C., Gasparini E., Ghigna P. (2012) Thermal expansion of alunite up to dehydroxylation and collapse of the crystal structure. Mineral. Mag. 76(3), 613-623.
Дополнительные материалы отсутствуют.