Геохимия, 2022, T. 67, № 7, стр. 686-695
Кадмий в восточной части Финского залива: содержание и воздействие на моллюсков Limecola balthica
А. Н. Шаров a, b, *, Н. А. Березина c, И. Куприянов d, С. В. Сладкова a, e, Н. Н. Камардин a, Т. Д. Шигаева a, В. А. Кудрявцева a, С. В. Холодкевич a, e
a Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН – обособленное структурное подразделение ФГБУН “Санкт-Петербургский Федеральный исследовательский центр РАН”
197110 Санкт-Петербург, Корпусная ул., дом 18, Россия
b Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 пос. Борок, Некоузского района, Ярославская обл., Россия
c Зоологический институт РАН
199034 г. Санкт-Петербург, Университетская наб., дом 1, Россия
d Таллиннский технический университет
19086 г. Таллинн, Эхитаджате (Ehitajate tee) 5, Эстония
e Санкт-Петербургский государственный Университет
199034 г. Санкт-Петербург, Университетская наб., д. 7–9, Россия
* E-mail: sharov_an@mail.ru
Поступила в редакцию 22.04.2021
После доработки 20.05.2021
Принята к публикации 23.06.2021
- EDN: FKBEXP
- DOI: 10.31857/S0016752522060073
Аннотация
Определение природных концентраций кадмия (Cd), оценка его эффектов на биоту и поиск новых биоиндикаторов для мониторинга окружающей среды является актуальной задачей. Целью данной работы была оценка содержания Cd в воде, донных осадках и донных животных (моллюсках, полихетах, ракообразных) в восточной части Финского залива (Балтийского моря) и экспериментальное изучение влияния разных концентраций Cd в воде (от 0.1 до 5 мг/л) на физиологическое состояние балтийских моллюсков Limecola balthica и уровень накопления этого металла в пищеварительной железе. По данным 2019–2020 гг. на 31 станции акватории Финского залива, содержание Cd варьировало в воде от 0.003 до 0.058 мкг/л, а в донных отложениях от 0.1 до 3.4 мг/кг. Содержание Cd в тканях водных животных в глубоководной части Финского залива было ниже порога определения, в то время как в прибрежных районах оно достигало от 1 до 50 мкг/кг влажной массы животных. Экспериментальные данные свидетельствуют о том, что Cd влияет на поведение и интенсивность аэробного метаболизма моллюсков. Скорость потребления кислорода моллюсками при 10 сут воздействии 0.1 мг/л Cd и при 48 ч воздействии 0.5 мг/л Cd значительно снижалась по сравнению с контролем. При 5 мг/л Cd наблюдались токсические эффекты на состояние моллюсков, такие как снижение интенсивности дыхания, аномальное поведение и высокий уровень смертности (>50%). В ходе экспериментов аккумуляция Cd в пищеварительной железе моллюсков возрастала от 12 до 99 мкг/кг со временем экспозиции и концентрации Cd в воде. На большинстве станций концентрации Cd в донных отложениях не превышали порогового значения хорошего экологического статуса. Таким образом, в настоящее время проблема загрязнения Cd не является острой для восточной части Финского залива, однако, полученные данные свидетельствуют, что содержания Cd > 0.1 мг/л в воде может приводить к угнетению популяций водных животных.
ВВЕДЕНИЕ
Металлы являются естественными составляющими элементами донных осадков, где они обычно содержатся в малых количествах. Однако антропогенная деятельность приводит к повышению их концентрации в морской среде, особенно в прибрежных районах и устьевых акваториях рек (Синюков, 1993). В моря в составе континентальной пыли с суши и, отчасти, с морскими аэрозолями, поступает большой “букет” микроэлементов, в том числе токсичных металлов (Израэль, Цыбань, 1989; Shevchenko, 2003). Кадмий (Cd) – это высокотоксичный для водных организмов металл, даже при низких концентрациях (Neuberger-Cywiak et al., 2007; Ogunola, 2017). Накапливаясь в организмах, Cd может вызывать морфологические, физиологические и биохимические нарушения у водных организмов (Lei et al., 2011; Sfakianakis et al., 2015; Huo et al., 2017). На сегодняшний день загрязнение природных экосистем кадмием остается одной из серьезных экологических проблем во всем мире (Моисеенко, 2019).
Источниками поступления кадмия в Балтийское море являются в основном атмосферные осадки и поступления со стоком рек (Remeikaitė-Nikienėa et al., 2018). При этом поступление Cd с речным стоком в среднем примерно в четыре раза превышает атмосферные осаждения (Bartnicki et al., 2017; HELCOM, 2018a). Концентрации Cd в воде, донных отложениях и биоте предложены Хельсинкской комиссией по Балтийскому морю (ХЕЛКОМ) в качестве основных показателей и широко используются для оценки состояния моря (HELCOM, 2018b). В Плане действий по Балтийскому морю ХЕЛКОМ была подчеркнута также острая необходимость оценки токсических эффектов Cd на местную фауну и поиска новых биоиндикаторов для мониторинга окружающей среды.
Моллюски и другие бентосные беспозвоночные часто используются в качестве биоиндикаторов при оценке состояния окружающей среды (Salánki, 2003; Ogunola, 2017). Моллюски Limecola balthica (Linnaeus, 1758) широко распространены в Балтийском море, особенно в его заливах (Гусев 2010; Berezina et al., 2019). Эти моллюски обитают в верхнем слое донных осадков и могут быть использованы в качестве индикаторов для оценки состояния местообитаний. Одной из характеристик для выявления эффекта потенциальной токсичности донных отложений может быть скорость аэробного метаболизма моллюска (обычно определяемая по уровню потребления кислорода). Этот показатель чувствителен к изменению многих факторов среды, в том числе, к повышенным концентрациям металлов (Depledge, 1984). Ранее показано, что уровень потребления кислорода водными животными часто снижается во время острого воздействия на них металлов, в том числе Cd (Cheung, Cheung, 1995; Sobrino-Figueroa et al., 2014; Capparelli et al., 2016).
Целью настоящего исследования была оценка содержания Cd в воде, донных отложениях и морских животных (моллюсках, полихетах и ракообразных) в акватории восточной части Финского залива, и изучение реакции моллюсков L. balthica по поведению и дыхательной активности на присутствие разных концентраций Cd в среде.
МАТЕРИАЛЫ И МЕТОДЫ
Расположение станций и отбор проб
Исследования были проведены в ходе научно-исследовательских рейсов в августе 2019 г. и сентябре 2020 г. на судах “Мария”, “СН-1303 (Росприроднадзор)" и в конце января 2020 г. на судне “Salme” (Эстония). Всего обследовано 22 глубоководных и 9 прибрежных станций (рис. 1, табл. 1). Пробы воды были отобраны батометром в придонном 1 м слое. Сразу после отбора, пробы воды химически фиксировались путем подкисления HNO3. Отбор грунта и донных животных проводили дночерпателем Ван-Вина площадью захвата 0.025 м2. Для анализа Cd в донных осадках использовали 3–5 см поверхностный слой. Анализ биоконцентраций проводили в тканях моллюсков L. balthica, полихет Marenzelleria sp., ракообразных Monoporeia affinis (Lindström, 1855) на глубоководных станциях и в основном в теле моллюсков унионид (Unio sp., Anodonta sp.).
Рис. 1.
Карта-схема расположения станций для отбора проб донных отложений, воды и биоты в восточной части Финского залива (2019–2020 гг.). Ст. 1 расположена в районе г. Приморска, ст. 2–7, 11–15, 19 и 24 – во внутренней части эстуария р. Невы (относятся к акватории г. Санкт-Петербурга), ст. 8, 20, 21, 23 и 26 – в Копорской губе (район г. Сосновый Бор), ст. 9 и 25 – в Лужской губе, ст. 16–18 и 22 – в открытой части внешнего эстуария р. Невы, ст. 28–30 – в эстуарии р. Нарвы и ст. 31 – район г. Кунда.
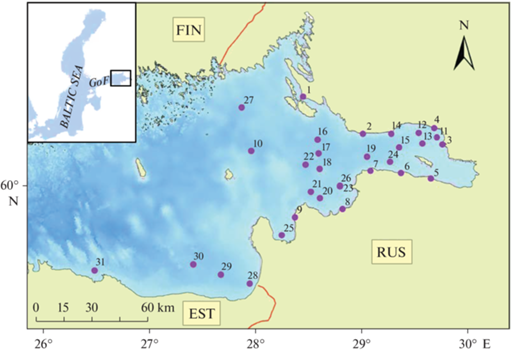
Таблица 1.
Содержание Cd в воде (мкг/л), донных отложениях (ДО, мг/кг сухого вещества) и тканях моллюсков и других животных (мг/кг влажного вещества), глубина (H), соленость(S) и названия станций отбора проб согласно сетке регионального мониторинга. ТОС – общее содержание органического углерода (%)
| Станция отбора | Н, м | S, ‰ | ТОС | Cd | |||
|---|---|---|---|---|---|---|---|
| № | Название | Вода | ДО | Биота | |||
| 1 | Приморск | 1 | 2.1–2.2 | 0.4 | 0.024–0.038 | 0.30–0.38 | 0.003 |
| 2 | Мыс Флотский | 1 | 1.6–2.4 | 0.3 | 0.039 | 0.05–0.42 | 0.005 |
| 3 | Парк Дубки | 1 | 0.2–0.3 | 0.1 | 0.003–0.033 | 0.19–0.51 | 0.002 |
| 4 | Репино | 1 | 0.2–0.4 | 0.5 | 0.008–0.034 | 0.09–0.45 | 0.005 |
| 5 | Ломоносов | 1–4 | 0.2–0.3 | 2.7 | 0.011–0.030 | 0.11–0.45 | 0.002 |
| 6 | Лебяжье | 1 | 0.4–2.4 | 0.5 | 0.011–0.053 | 0.07 | 0.001 |
| 7 | Графская бухта | 1 | 2.4 | 0.5 | 0.028–0.058 | 0.14 | 0.002 |
| 8 | Систо-Палкино | 1 | 2.2–2.8 | 0.5 | 0.005 | 0.10 | – |
| 9 | Лужская губа | 1 | 3.0–3.2 | 0.5 | 0.010–0.033 | 0.05 | – |
| 10 | 17F | 52 | 3.0–3.6 | 7.0 | – | 1.4–1.86 | <0.001 |
| 11 | 19 | 10 | 0.7-2.9 | 3.4 | – | 0.19–0.31 | <0.001 |
| 12 | 20 | 12 | 0.8-3.0 | 3.0 | – | 2.4–2.5 | <0.001 |
| 13 | 21 | 14 | 0.8–0.9 | 2.4 | – | 0.9–1.0 | <0.001 |
| 14 | 22 | 19 | 1.5-5.0 | 2.0 | – | 1.2 | <0.001 |
| 15 | 2F | 23 | 1.1–2.0 | 2.6 | – | 0.4–0.52 | <0.001 |
| 16 | 2F5 | 38 | 3.8-4.0 | 2.0 | – | 0.56–0.8 | <0.001 |
| 17 | 2UGMS | 36 | 2.1–2.6 | 4.3 | – | 1.05–3.4 | <0.001 |
| 18 | 3F5 | 25 | 2.9–3.2 | 0.5 | – | 0.25–0.8 | <0.001 |
| 19 | 4F | 28 | 1.2–2.3 | 0.52 | – | 0.69–1.0 | <0.001 |
| 20 | 6K | 26 | 2.5–2.7 | 4.6 | – | 0.6–0.75 | <0.001 |
| 21 | 8F | 30 | 2.7-5.3 | 5.3 | – | 2.1–2.2 | <0.001 |
| 22 | 9F | 35 | 2.2–3.0 | 5.9 | – | 1.0–3.04 | <0.001 |
| 23 | 1K | 15 | 2.5–2.7 | 4.8 | – | 0.1–0.31 | 0.013* |
| 24 | 3F | 24 | 1.3–1.4 | 0.65 | – | 0.28–0.44 | <0.001 |
| 25 | 18L | 10 | 2.8–2.9 | 5.3 | – | 0.1–0.2 | <0.001 |
| 26 | 1L | 27 | 3.1–3.4 | 5.6 | – | 0.32–0.7 | <0.001 |
| 27 | 20F | 47 | 1.1–2.5 | 7.0 | – | 0–0.08 | <0.001 |
| 28 | N8 | 16 | 5.0 | 0.3 | <0.02 | <0.1 | 0.023* |
| 29 | N | 36 | 5.0–5.1 | 2.4 | – | 0.19 | 0.050* |
| 30 | N12 | 36 | 4.9–5.1 | 0.4 | – | <0.1 | 0.015* |
| 31 | KU | 21 | 5.5 | 0.1 | – | <0.1 | 0.021* |
* Содержание Cd в пищеварительной железе моллюсков, а в остальных случаях – во всем теле. Нумерация станций соответствует отметкам на карте схеме (рис. 1).
Аналитические методы определения содержания кадмия
Содержание растворенного в воде Cd идентифицировали на масс-спектрометре с индуктивно связанной плазмой ICP-MS 7500 Agilent (Япония) согласно официальной рекомендации № 480-Х “Определение элементного состава природных и питьевых вод методом ICP-MS” (1998 г.) и ПНДФ 14.1:2:4.140-98. Концентрацию Cd определяли с помощью программы ICP-MS “Mass Hunter” (ICP-MS MassHunter Software, США) (со стандартным отклонением между образцами <5%), рассчитывая среднее по пяти измерениям. Калибровку проводили стандартным раствором для МС-анализа с массовой долей Cd 10 мг/мл. Общая концентрация кадмия из образцов грунта и воды, собранные в территориальных водах Эстонии, была определенна с использованием индуктивно связанной плазменной масс-спектрометрии (ICP-MS) лабораторией GBA (Германия, Gesellschaft für Bioanalytik mbH) используя аккредитованные аналитические методы по стандарту DIN EN 16171: 2017-01 (грунт, предел обнаружения 0.1 мг/кг) и DIN EN ISO 17294-2: 2017-01 (вода, предел обнаружения 0.00005 мг/л).
Для определения Cd в донных осадках образцы сушили в печи при 30°C и просеивали через пластиковое сито с диаметром пор 1 мм. Полученную фракцию измельчали в агатовой ступке и расщепляли в смеси сверхчистых кислот HCl : HF : HNO3 (1 : 1 : 1) в микроволновой печи Mars 5 (CEM, США). Продукты разложения переносили в полипропиленовые флаконы, разбавляли деионизированной водой до объема 50 мл (согласно ISO 3696). Образцы анализировали методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) на масс-спектрометре Agilent 7500x (Япония) по методике М-МВИ 80-2008. Точность измерений (<5% извлечения) контролировали с помощью сертифицированного стандарта (CRM 5365-90).
Содержание Cd определяли в ткани пищеварительной железы (гепатопанкреаса), в случае моллюсков из Копорской и Нарвской губы, и в целом теле моллюсков (и ракообразных) в остальных случаях после криофиксации органа при температуре – 23°С в течение 2–3 нед. Размороженные и осушенные фильтровальной бумагой образцы тканей взвешивали на аналитических весах “OHAUS Pionеer” PA214C (OHAUS Corporation, Китай) с точностью до 0.1 мг. Затем образцы помещали в мерные пробирки и добавляли 2 мл 70% азотную кислоту (HNO3 “ос. ч.”, ГОСТ 30178-96). Пробирки с образцами нагревали в сушильном шкафу до температуры 90°С до их полной минерализации. После остывания пробы доводили до объемов 2 или 5 мл деионизированной водой, полученной с помощью системы очистки воды “Milli-Q A10” производства “Merck” (Германия). Измерение концентрации металла осуществляли на атомно-абсорбционном спектрофотометре “SHIMADZU A-7000” (Япония), оснащенном термоатомизатором и микродозатором проб. Калибровочная кривая с использованием мультикомпонентного стандарта “MERCK” в 0.1 N HNO3 создавалась перед началом измерений кадмия. Содержание Cd в ткани выражали в микрограммах на грамм влажного веса моллюска (мкг/г в.в.).
Определение скорости потребления кислорода
Интенсивность аэробного метаболизма моллюсков L. balthica измеряли экспериментально по скорости потребления кислорода (VО2), наблюдая при этом за поведением моллюсков. В первой серии экспериментов изучали острое действие Cd высокой концентрации в воде (5.0 мг/л) на моллюсков, измеряя величины VО2 при их спонтанной фильтрационной активности, а во второй серии – действие сублетальных концентраций Cd (0.1 и 0.5 мг/л) на величину VО2 моллюсков при активном движении, т.е. зарывании в грунт, требующем максимальных затрат энергии. Такой подход, состоящий в измерении величин VО2 при максимальной нагрузке, широко применяется для оценки функциональных возможностей кардиореспираторной системы животных (Dlugosz et al., 2013). Длительность экспозиции в обеих сериях экспериментов составила 10 сут.
В первой серии экспериментов моллюски L. balthica длиной раковины (14.2 ± 1.3 мм), помещались в пластиковые контейнеры с морской водой и концентрацией Cd 5.0 мг/л. Морская вода из местообитания моллюсков использовалась в качестве контрольной среды. Величины ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ и уровень накопление Cd в тканях моллюсков измеряли в начале, через 48 ч (2 сут) и на 6 сут экспозиции, а за подвижностью сифонов и степенью открытия раковин наблюдали ежедневно на протяжении всего времени экспозиции.
Для измерения величины ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ семь моллюсков осторожно перемещали из контейнеров в пластиковую прозрачную измерительную камеру объемом 250 мл, заполненную профильтрованной и аэрированной морской водой без пузырей (насыщение кислородом не менее 90%). На дно камеры опускался сердечник магнитной мешалки для перемешивания жидкости (рис. 2). Камеру герметично закрывали крышкой с вставленным в нее полярографическим электродом и лопастью для механического перемешивания воды (рис. 2). Электрод был соединен с оксиметром. Грунт в опытах первой серии не использовали. Моллюски содержались в камере 4 ч, при этом ежечасно в трех повторах измеряли концентрацию кислорода в воде.
Во второй серии экспериментов использовали моллюсков L. balthica длиной раковины 16 ± 1.6 мм, собранных в Нарвской губе (станция N8, табл. 1). Моллюсков помещали в пластиковые контейнеры с искусственной морской водой соленостью 5‰ и концентрацией в ней Cd: 0, 0.5 и 0.1 мг/л. Измеренная концентрация Cd в воде экспериментальных аквариумов примерно соответствовала расчетным значениям, и составляла 0.09, 0.49 и 4.87 мг/л соответственно для расчетных концентраций 0.1, 0.5 и 5 мг/л после 2 сут и 0.08, 0.46 и 4.75 мг/л после 6 сут.
Для измерения величин ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ (через 48 ч, 6 и 10 сут) использовался тот же способ, что и в первой серии экспериментов, но в измерительную камеру был добавлен грунт (промытый и прокаленный мелкозернистый песок). Интенсивность зарывания в грунт многих видов морских моллюсков, в том числе моллюсков рода Limecola (Macoma), используется как биомаркер при оценке токсичности донных отложений (McGreer, 1979).
Концентрацию кислорода в воде в обеих сериях экспериментов измеряли портативным оксиметром HI 9142 (Hanna Instruments, Германия) с автоматической температурной компенсацией и погрешностью измерения ±2.5%. В момент измерения проводили перемешивание воды примерно 2 мин при помощи магнитной мешалки, это позволило равномерно распределять растворенный кислород в камере и способствовало стабилизации показаний оксиметра. Для измерения фонового изменения концентрации кислорода, не связанного с моллюсками (например, за счет микробного потребления), проводили измерения его концентрации в контроле, т.е. воде без моллюсков.
Интенсивность потребления кислорода моллюсками определялась по формуле:
${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ = 60 [C(t1) – C(t2)]v/(t1 – t2)ww,
где ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ – скорость потребления кислорода (мгО2/г ч), t1, t2 – время начала и конца измерительного интервала (мин), C(t) – концентрация кислорода в среде в момент времени t (мг/л), v – объем сосуда (л), ww – влажный вес моллюска (г). C(t2) – корректируется на величину фона, если изменение концентрации кислорода фона >5%.
Статистическая обработка результатов
Средние арифметические значения и ошибки средних (SE) были рассчитаны для концентраций Cd и ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ моллюсков. Анализ различий между средними проводился по методу Вилкоксона, а также с использованием t-теста и критерия F. Все анализы проводили с помощью программ Статистика 6.0 (StatSoft Inc., USA) и GraphPad Prism 5.0 (GraphPad Software, USA), за статистически значимые принимались различия значений при уровне р ≤ 0.05.
РЕЗУЛЬТАТЫ
Содержание Cd в различных средах
В воде исследованной акватории концентрация Cd в среднем составила 0.021 ± 0.015 мкг/л. Максимальные его концентрации (0.05–0.06 мкг/л Cd) в воде были обнаружены в прибрежной зоне южной части залива, в районе впадения р. Лебяжья и в Графской бухте у г. Сосновый Бор (ст. 6 и 7, табл. 1).
Средние концентрации Cd в донных отложениях на исследованных прибрежных и глубоководных станций в Финском заливе (российская часть) составляли 0.22 ± 0.05 и 0.98 ± 0.15 мг/кг, соответственно. На нескольких глубоководных станциях во внутренней и внешней части эстуария р. Невы (ст. 12, 17, 21 и 22), они были >2 мг/кг с.в. (табл. 1).
Содержание Cd в тканях водных животных в глубоководной части Финского залива было ниже порога определения, в то время как в прибрежных районах оно варьировало от 1 до 50 мкг/кг влажной массы животных (т.е. примерно 5–250 мкг/кг с.в.).
Экспериментальные результаты
При воздействии Cd высокой концентрации (5.0 мг/л) наблюдалось аномальное поведение моллюсков уже через 24 ч. Створки моллюсков были приоткрыты, а сифоны выставлены наружу (рис. 3). При этом моллюски были неподвижны и никак не реагировали на движение воды, их сифоны пассивно двигались вместе с током воды. В то же время, у моллюсков сохранялась реакция (ретракции сифонов) в ответ на механическое прикосновение. Такое поведения они демонстрировали вплоть до своей гибели (>50% моллюсков погибли на 10 сут). При воздействии концентрацией Cd 0.5 мг/л подобное поведение у моллюсков началось только к концу экспозиции (на 10 сут), тогда как в контроле и при концентрации Cd 0.1 мг/л моллюски вели себя обычным способом – периодически открывали раковину, выдвигали наружу сифоны (для дыхания) и ногу, медленно передвигаясь по дну контейнера, но большую часть периода наблюдений оставались в покое с закрытыми створками раковины.
Рис. 3.
Вид моллюска Limecola balthica в контроле (а) и при воздействии кадмия (б) и скорость потребления ими кислорода (в). (а) – моллюск с закрытыми створками в контроле, (б) – моллюск с выдвинутыми сифонами и ногой в растворе Cd концентрацией 5.0 мг/л. (в) – скорость потребление кислорода моллюсками через 2 и 6 сут. Значок * указывает на статистически значимое снижение по сравнению с контролем.
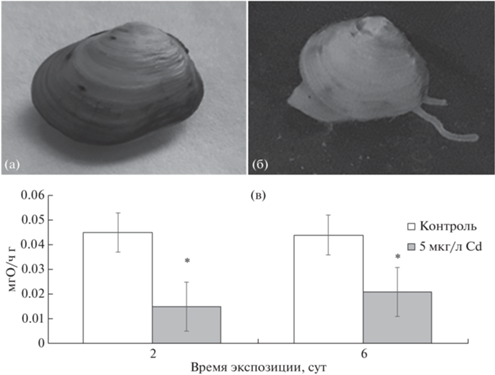
В контроле через 2 и 6 сут наблюдений потребление моллюсками кислорода из воды не зарегистрировано (потребление кислорода равно фоновому). Изредка они демонстрировали респираторную активность (${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ = 0.045 ± 0.008 мгО2/ч г в.в., рис. 3). При воздействия Cd в концентрации 5.0 мг/л моллюски с приоткрытой раковиной дышали постоянно, однако величина ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ была значительно ниже (0.015 ± 0.01 мгО2/ч), чем контроле (р < 0.05). После 6 сут экспозиции характер дыхания оставался тем же, и его уровень низким (рис. 3).
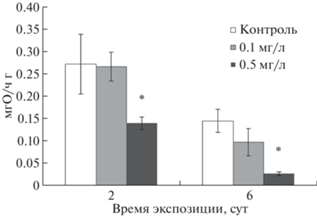
Дыхание у моллюска L. balthica при зарывании в грунт (двигательной активности) было постоянным, без периодов покоя животного, когда потребление кислорода равно нулю. Величина ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ моллюсков в контроле второй серии опытов была примерно в 6 раз выше (0.27 ± 0.07 мгО2/ч), чем в контроле первой серии опытов (рис. 3). После кратковременной экспозиции (48 ч) при 0.5 мг/л кадмия у зарывающихся моллюсков наблюдали значимое почти вдвое снижение величины ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ (0.14 ± 0.01 мгО2/ч) по сравнению с контролем (рис. 4). После 6 и 10 сут воздействия Cd концентрацией 0.5 мг/л моллюски перестали активно двигаться, не было обнаружено особей в вертикальном положении на ребре раковины, что считается стартовым положением при закапывании. При этом величина ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ (0.03 ± 0.004 мгО2/ч) была в 5 раза ниже, чем в контроле (0.15 ± ± 0.03 мгО2/ч) и практически не отличается от величины ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ у моллюсков при концентрации 5.0 мг/л (рис. 3 и 4). В растворе 0.1 мг/л в течение всей экспозиции не отмечали значимых различий в величинах ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ по сравнению с контролем (рис. 4).
Рис. 4.
Влияние сублетальных концентраций Cd на скорость потребление кислорода при зарывании в грунт моллюсками Limecola balthica в период экспозиции. Значок * указывает на статистически значимое снижение по сравнению с контролем.
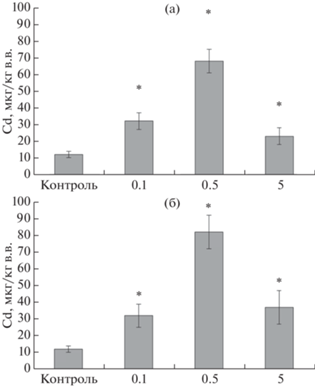
Средние значения содержания кадмия в пищеварительной железе моллюсков, собранных в Нарвской губе на ст. N8 (15 мкг/кг в.в.) и в Копорской губе ст. K1 (13 мкг/кг) достоверно не отличалось (р = 0.45). В ходе экспериментов концентрации Cd в гепатопанкреасе моллюсков возрастали по мере увеличения времени экспозиции и концентрации Cd в растворах (рис. 5). У моллюсков через 2 дня пребывания в растворе Сd концентрацией 0.1 мг/л наблюдается увеличение содержания Сd в гепатопанкреасе до 24.3 ± ± 3.5 мкг/кг (р = 0.005), а через 6 суток до 35.6 ± ± 5.7 мкг/кг (р = 0.011). При большей концентрации Cd в воде (0.5 мг/л) накопление металла в моллюсках идет еще быстрее и через 2 сут экспозиции достигло 71.3 ± 4.4 мкг/кг (р = 0.002), а 6 сут – 99.25 ± 4.4 мкг/кг (р = 0.002). Различия в уровне накопления Cd в пищеварительной железе после 2-х и 6-ти сут экспозиции статистически значимы (р = 0.005). У моллюсков, после экспозиции в растворе Сd концентрацией 5.0 мг/л, его содержание в пищеварительной железе увеличилось по сравнению с контролем через 2 сут (р = 0.029) и 6 сут (р = 0.028, рис. 5).
ОБСУЖДЕНИЕ
На изученной акватории содержание Cd в воде в среднем было 0.02 мкг/л. Среднее содержание Cd в водоемах России (Моисеенко, Гашкина, 2018) и Скандинавии (Skjelkvale et al., 2002) составляет также около 0.02 мкг/л. В России применяются единые нормативы (Предельно допустимые концентрации, ПДК): ПДК по Cd для питьевого водоснабжения составляет 1 мкг/л; для рыбохозяйственных водоемов – 5 мкг/л (Перечень…, 1999). В соответствии со стандартом качества окружающей среды Хелком для Балтийского моря порог хорошего экологического статуса составляет 0.2 мкг/л Cd в воде (HELCOM, 2018b). Таким образом, обнаруженное содержание Cd в воде в воде Финского залива, которое было не выше 0.06 мкг/л, не превышало этих нормативов, и по этому показателю статус акватории может быть определен как хороший.
В период исследований 2019–2020 гг. концентрации Cd в донных осадках варьировали от 0.1 до 3.1 мг/кг, в то время как ранее в 2005–2018 гг. на некоторых станциях отмечались и более высокие значения (Kuprijanov et al., 2021). Тем не менее, в большинстве районов Финского залива в настоящее время, как и в предыдущие годы (Vallius, 2014; The Gulf of Finland…, 2016), содержание Cd в донных отложениях не превышает 2 мг/кг. Для сравнения, средняя концентрация Cd в Ботническом заливе, наиболее чистой северной части Балтики, – наименьшая, варьируя от 0.2 до 0.4 мг/кг (HELCOM, 2018b).
Среднее содержание Cd в пищеварительной железе моллюсков-маком L. baltica, собранных в Копорской губе Финского залива, не превышало 13 мкг/кг в.в., соответственно. В пищеварительной железе маком из эстонской части залива определялись несколько большие концентрации Cd (от 15 до 50 мкг/кг). На большинстве же участков в тканях моллюсков и других беспозвоночных оно было <5 мкг/кг. Существующий порог хорошего экологического статуса по стандарту качества окружающей среды Хелком для Балтийского моря был определен по содержанию Cd в мидиях и составляет 137.3 мкг/кг в.в. (HELCOM, 2018b). Таким образом, можно рассматривать статус исследованной акватории хорошим по уровню биоконцентрации Cd.
Присутствие Cd в экспериментальной среде вызывает патологические нарушения в моллюсках из-за прямого ингибирования клеточного дыхания и вмешательства в различные дыхательные процессы морских животных (Depledge, 1984). Увеличение внутритканевого содержания Cd у изученных моллюсков L. baltica сопровождалось уменьшением интенсивности аэробного дыхания. Ранее показано угнетающее воздействие Cd на скорость потребления кислорода разными видами двустворчатых моллюсков (Devi, 1996; Neuberger-Cywiak et al., 2005; Chandurvelan et al., 2013, 2015). Также во многих работах (Salánki, 2003; Neuberger-Cywiak et al., 2003; 2007), выявлено, что сублетальные концентрации токсикантов, в том числе Cd, приводили к снижению фильтрационной активности моллюска и увеличению периодов покоя с закрытыми створками, что рассматривается как защитный механизм от негативного воздействия.
При воздействии Cd концентрацией 0.1 мг/л в течение 10 дней не выявлено отличий в поведении моллюсков, и скорость потребления кислорода не изменилась по сравнению с контролем (рис. 4). Очевидно, эта концентрация является пороговой (границей хорошего качества среды), выше которой могут наблюдаться негативные эффекты на водных животных. Действительно, воздействие Cd концентрацией 0.5 мг/л приводило к снижению величины ${{V}_{{{{{\text{О}}}_{{\text{2}}}}}}}$ и изменению поведения моллюсков с наиболее выраженным эффектом на 10-е сут экспозиции. При концентрации в воде Cd 5 мг/л наблюдали токсические эффекты: снижение интенсивности дыхания, аномальное поведение и высокий уровень смертности (>50% на 10-е сут). Похожие эффекты отмечали и для двустворчатых моллюсков Donax trunculus (Linnaeus, 1758) при концентрации Cd 10 мг/л в воде (Neuberger-Cywiak et al., 2005).
Аккумуляция Cd в пищеварительной железе моллюсков на фоне описанных выше патологических нарушений в их дыхании и поведении связана с токсическим действием Cd на организм на молекулярном уровне, в том числе, на белки, поддерживающие структуру цитоскелета и движения сифонов (Chora et al., 2009). Также, одним из возможных механизмов воздействия Cd на двигательную активность маком (т.е. движение створок, сифонов и способность закапываться в грунт) является его блокирующее действие на кальциевые токи в нейронах и мышцах моллюсков (Kits, Mansvelder, 1996).
Загрязнение Cd ингибирует группы ферментов, участвующих в транспорте кислорода, что приводит к глубокой перестройке метаболизма организма в целом (Naimo, 1995; Lowe et al., 1995; Molnar, Fong, 2012). Под воздействием Cd в схожих концентрациях 0.1; 1.0 и 10.0 мг/л выявлены нарушения энергетического обмена у моллюсков, в том числе ингибирование активности цитокромоксидазы (Mizrahi, Achituv 1989). Считается, что Сd воздействует непосредственно на дыхательную систему водных животных на всех уровнях организации, включая само клеточное дыхание (Spicer, Weber,1991).
ЗАКЛЮЧЕНИЕ
По данным о концентрациях Cd в воде, донных отложениях и биоте в 2019–2020 гг. проблема загрязнения этим металлом не является острой для изученной акватории восточной части Финского залива. Полученные нами данные свидетельствуют о том, что воздействие Cd на функциональное состояние моллюсков L. balthica носит дозозависимый характер и накапливается со временем. При содержании Cd > 0.1 мг/л в воде может приводить к угнетению популяций местных видов.
Работа была выполнена с использованием оборудования Ресурсного центра “Обсерватория экологической безопасности” Научного парка Санкт-Петербургского Государственного университета.
Содержание этой публикации является исключительной ответственностью Санкт-Петербургского научно-исследовательского центра экологической безопасности РАН и ни в коей мере не отражает позицию стран-участниц Программы и Европейского Союза.
Работа выполнена при финансовой поддержке проекта ER90 HAZLESS Программы приграничного сотрудничества “Россия-Эстония” на период 2014–2020 гг. и Министерства науки и высшего образования Российской Федерации (1021051403065-4 и FFZF-2022-0011).
Список литературы
Гусев А.А. (2010) Влияние факторов среды на распределение Macoma balthica (Linnaeus 1758) и Mytilus edulis (Linnaeus 1758) в юго-восточной части Балтийского моря. Вестник Балтийского федерального университета им. И. Канта. Серия: Естественные и медицинские науки. (7), 34-39.
Даувальтер В.А. (2006) Халькофильные элементы (Hg, Cd, Pb, As) в донных отложениях водных объектов водосбора Белого моря в пределах Кольского полуострова. Геохимия. (2), 237-240.
Dauvalter V.A. (2006) Chalcophile Elements (Hg, Cd, Pb, and As) in Bottom Sediments of Water Bodies of the White Sea Catchment Area on the Kola Peninsula. Geochem. Int. 44(2), 205-208.
Израэль Ю.А., Цыбань А.В. (1989) Антропогенная экология океана. Л.: Гидрометеоиздат, 528 с.
Моисеенко Т.И. (2019) Биодоступность и экотоксичность металлов в водных системах: критические уровни загрязнения. Геохимия. 64(7), 675-688.
Moiseenko T.I. (2019) Bioavailability and Ecotoxicity of Metals in Aquatic Systems: Critical Levels of Pollution. Geochem. Int. 57(7), 675-688.
Моисеенко Т.И., Гашкина Н.А. (2018) Биогеохимия кадмия: антропогенное рассеивание, биоаккумуляция и экотоксичность. Геохимия. (8), 759-773.
Moiseenko T.I., Gashkina N.A. (2018) Biogeochemistry of cadmium: anthropogenic dispersion, bioaccumulation, and ecotoxicity. Geochem. Int. 56(8), 798-811.
Перечень рыбохозяйственных нормативов: предельно допустимых концентраций (ПДК) и ориентировочно безопасных уровней воздействия (ОБУВ) вредных веществ для воды водных объектов, имеющих рыбохозяйственное значение (1999) М.: Изд-во ВНИРО, 304 с.
Синюков В.В. (1993) Развитие морских гидрохимических исследований. Черное, Азовское и арктические моря. М.: Наука, 225 с.
Bartnicki J., Gusev A.W. Aas, Gauss M., Jonson J.E. (2017) Atmospheric supply of nitrogen, cadmium, mercury, lead, and PCDD/Fs to the Baltic Sea in 2015. EMEP report to HELCOM. https://www.emep.int/publ/helcom/2017/index.html
Berezina N.A., Maximov A.A., Vladimirova O.M. (2019) Influence of benthic invertebrates on phosphorus flux at the sediment-water interface in the easternmost Baltic Sea. Mar Ecol Prog Ser. 608, 33-43.
Capparelli M.V., Abessa D.M., McNamara J.C. (2016) Effects of metal contamination in situ on osmoregulation and oxygen consumption in the mudflat fiddler crab Uca rapax (Ocypodidae, Brachyura). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 185–186, 102-111.
Chandurvelan R., Marsden I.D., Gaw S., Glover C.N. (2013) Biochemical biomarker responses of green-lipped mussel, Perna canaliculus, to acute and subchronic waterborne cadmium toxicity. Aquat Toxicol. 140–141, 303-313.
Chandurvelan R., Marsden I.D., Glover C.N., Gaw S. (2015) Assessment of a mussel as a metal bioindicator of coastal contamination: relationships between metal bioaccumulation and multiple biomarker responses. Sci Total Environ. 511, 633-675.
Cheung S.G., Cheung R Y.H. (1995) Effects of heavy metals on oxygen consumption and ammonia excretion in green-lipped mussels (Perna viridis), Marine Pollution Bulletin, 31(4–12), 381-386.
Chora S., Starita-Geribaldi M., Guigonis J.M., Samson M., Roméo M., Bebianno M.J. (2009) Effect of cadmium in the clam Ruditapes decussatus assessed by proteomic analysis. Aquat Toxicol. 94(4), 300-308.
Depledge M.H. (1984) Disruption of circulatory and respiratory activity in shore crabs (Carcinus maenas) exposed to heavy metal pollution. Comp. Biochem. Physiol. C, 78, 445-459.
Devi V.U. (1996) Bioaccumulation and metabolic effects of cadmium on marine fouling dressinid bivalve, Mytilopsis sallei (recluz). Arch. Environ. Contam. Toxicol. 31, 47-53
Dlugosz E.M., Chappell M.A., Meek T.H., Szafrañska P., Zub K., Konarzewski M., Jones J.H., Bicudo J.E. P.W., Careau V., Garland T. Jr. (2013) Phylogenetic analysis of mammalian maximal oxygen consumption during exercise. J. Exp. Biol. 216(24), 4712-4721.
HELCOM (2018a) Inputs of hazardous substances to the Baltic Sea. Baltic Sea Environment Proceedings. 161. Online [14.01.2021] [https://helcom.fi/media/publications/BSEP162.pdf]
HELCOM (2018b) Metals (lead, cadmium and mercury). HELCOM core indicator report. Online. [08.09.2020], [https://helcom.fi/wp-content/uploads/2019/08/Metals-HELCOM-core-indicator-2018.pdf]
Huo J.F., Dong A.G., Yan J.J., Wang L., Ma C.G., Lee S.C. (2017) Cadmium toxicokinetics in the freshwater turtle, Chinemys reevesii. Chemosphere 182, 392-398.
Kits K.S., Mansvelder H.D. (1996) Voltage gated calcium channels in molluscs: classification, Ca2+ dependent inactivation, modulation and functional roles. Invert. Neurosci. 2, 241-250.
Kuprijanov I., Väli G., Sharov A., Berezina N., Liblik T., Lips U., Kolesova N., Maanio J., Junttila V., Lips I. (2021) Hazardous substances in the sediments and their pathways from potential sources in the eastern Gulf of Finland. Marine Pollution Bulletin (in press).
Lei W.W., Wang L., Liu D.M., Xu T., Luo J.X. (2011) Histopathological and biochemical alternations of the heart induced by acute cadmium exposure in the freshwater crab Sinopotamon yangtsekiense. Chemosphere. 84, 689-694.
Lowe D.M., Fossato V.U., Depledge M.H. (1995) Contaminant induced lysosomal membrane damage in blood cells of mussels Mytilus galloprovincialis from the Venice Lagoon: an in vitro study. Marine Ecology Progress Series. 129, 189-196.
McGreer E.R. (1979) Sublethal effects of heavy metal contaminated sediments on the bivalve Macoma balthica(L.). Marine Pollution Bulletin. 10, 259-262.
Mizrahi L., Achituv Y. (1989) Effect of heavy metals ions on enzyme activity in the mediterranean mussel, Donax trunculus. Bull. Environ. Contam. Toxicol. 42, 854-859.
Molnar N., Fong P.P. (2012) Toxic effects of copper, cadmium, and methoxychlor shown by neutral red retention assay in two species of freshwater mollusks. The Open Environmental Pollution and Toxicology Journal. 3, 65-71.
Naimo T.J. (1995) A review of the effects of heavy metals on freshwater mussels. Ecotoxicology. 4, 341-362.
Neuberger-Cywiak L., Achituv Y., Garcia E.M. (2003) Effects of zinc and cadmium on the burrowing behavior, LC50 and LT50 on Donax trunculus Linnaeus (Bivalvia: Donacidae). Bull Environ. Contam. Toxicol. 70, 713-722.
Neuberger-Cywiak L., Achituv Y., Garcia E. (2005) Sublethal effects of Zn++ and Cd++ on respiration rate, ammonia excretion, and O:Nratio of Donax trunculus (Bivalvia; Donacidae). Bull EnvironContam Toxicol. 75, 505-51.
Neuberger-Cywiak L., Achituv Y., Garcia E.M. (2007) Effects of sublethal Zn++and Cd++concentrations on filtration rate, absorption efficiency and scope for growth in Donax trunculus (Bivalvia; Donacidae). Bull Environ Contam Toxicol. 79, 622-627.
Ogunola O.S. (2017) Physiological, Immunological, Genotoxic and Histopathological Biomarker Responses of Molluscs to Heavy Metal and Water-Quality Parameter Exposures: A Critical Review. J Oceanogr Mar Res. 5, 158.
Remeikaitė-Nikienėa N., Garnaga-Budrėa G., Lujanienėb G., Jokšas K., Stankevičius A., Malejevas V., Barisevičiūtė R. (2018) Distribution of metals and extent of contamination in sediments from the south-eastern Baltic Sea (Lithuanian zone). Oceanologia 60(2), 193-206.
Salánki J., Farkas A., Kamardina T., Rózsa K.S. (2003) Molluscs in biological monitoring of water quality. Toxicol Let. 140–141, 403-410.
Sfakianakis D.G., Renieri E., Kentouri M., Tsatsakis A.M. (2015) Effect of heavy metals on fish larvae deformities: a review. Environ. Res. 137, 246-255.
Shevchenko V. (2003) The influence of aerosols on the oceanic sedimentation and environmental conditions in the Arctic. Berichtezur Polar- und Meeresforschung. 464. 149 p.
Skjelkvale B.L., Andersen T., Fjeld E., Mannio J., Wilander A., Johansson K., Jensen J.P., Moiseenko T., Vuorenmaa J., Royseth O. (2002) Heavy Metals in Nordic Lakes; Concentrations, Geografical Patterns and Relation to Critical Limits. AMBIO 30(1), 2-10.
Sobrino-Figueroa A.S., Cáceres-Martinez C. (2014) Evaluation of the effects of the metals Cd, Cr, Pb and their mixture on the filtration and oxygen consumption rates in catarina scallop, Argopecten ventricosus juveniles. J Environ Biol. 35(1), 1-8.
Spicer J.I., Weber R.E. (1991) Respiratory impairment in crustaceans and molluscs due to exposure to heavy metals. Comp.Biochem.Physiol.C.100(3), 339-342.
The Gulf of Finland Assessment (2016) Ed.: M.Raateoja and O.Setala. Reports of the Finnish Environment Institute 27/2016. Finnish Environment Institute (SYKE). 368 p.
Vallius, H. (2014) Heavy metal concentrations in sediment cores from the northern Baltic Sea: Declines over the last two decades. Marine Pollution Bulletin, 79(1–2), 359-364.
Дополнительные материалы отсутствуют.