Геохимия, 2022, T. 67, № 7, стр. 603-620
Сопряженные реакции окисления–восстановления и карбонатизации–декарбонатизации при взаимодействии перидотитов с карбонатизированными метаосадками и метабазитами: эксперименты в системах без железа при 10 ГПа
А. В. Гирнис a, b, *, А. Б. Вудланд b, В. К. Булатов b, c, Г. П. Брай b, Х. Е. Хёфер b
a Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Староменетный пер., 35, Россия
b Institut für Geowissenschaften, Goethe-Universität Frankfurt am Main
60438 Frankfurt am Main, Altenhöferallee 1, Germany
c Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: girnis@igem.ru
Поступила в редакцию 04.08.2021
После доработки 08.11.2021
Принята к публикации 10.11.2021
- EDN: CMNUUP
- DOI: 10.31857/S0016752522070032
Аннотация
Гипотеза “окислительно-восстановительного застывания” (redox freezing, далее ROF) основана на предположении, что увеличение давления способствует стабилизации в перидотитовой мантии Fe–Ni металлической фазы и может служить восстановителем карбонатно-силикатных расплавов. Восстановление ${\text{CO}}_{3}^{{2 - }}$ с выделением элементарного C (графит или алмаз) приводит к повышению температуры солидуса и кристаллизации расплава. Термодинамические расчеты показывают, что равновесные фугитивности кислорода в перидотите, содержащем углерод и магнезит, существенно ниже, чем значения, буферируемые минеральными ассоциациями метаосадков (гранат–кианит–SiO2–арагонит–элементарный углерод) или эклогитов (пироксен–гранат–магнезит–элементарный углерод). Следовательно, окислительно-восстановительные взаимодействия могут происходить между углеродсодержащими перидотитами и метаосадками или эклогитами в отсутствии металла и даже в системе, не содержащей железо. Для проверки этого предположения проведены эксперименты по взаимодействию форстерита (как модели перидотита) с синтетическими смесями, моделирующими карбонатсодержащие метаосадок (SiO2 + CaCO3 + Al2O3) и эклогит (SiO2 + MgCO3 ± Al2O3 ± CaO) при 10 ГПa и 1200–1500°C. Для уменьшения переноса основных компонентов смеси были разделены графитовым диском, который также служил источником С. Взаимодействие проявлялось в декарбонатизации карбонатизированного метаосадка или эклогита с образованием алмаза на поверхности графитового диска. На контакте с перидотитом графитовый диск растворялся, и развивалась метасоматическая зональность. Пироксен и магнезит с незначительным содержанием Са появились в фронтальной метасоматической зоне. С приближением к графитовому диску содержание Са в новообразованном пироксене и карбонате возрастает, и наблюдается образование высококальциевого пироксена и граната в тыловой метасоматической зоне. Эти результаты указывают на протекание сопряженных окислительно-восстановительных реакции в перидотите и метаосадке (или эклогите): Mg2SiO4 + C + O2 = = MgSiO3 + MgCO3 и CaCO3 + 1/3Al2SiO5 + 2/3SiO2 = 1/3Ca3Al2Si3O12 + C + O2, соответственно. Реакции осуществляются за счет диффузии кислорода вдоль межзерновых каналов, заполненных карбонатно-силикатным расплавом. Взаимодействие включает также перенос основных катионов и приводит к образованию карбонатизированного лерцолита и алмазсодержащей эклогитовой ассоциации. Такой процесс может происходить и в природе, на контакте карбонатизированного метаосадка или эклогита с перидотитом. Полученные результаты показывают, что присутствие Fe–Ni металла не является необходимым для протекания ROF. Рассмотренные процессы могут объяснять существование богатых алмазом эклогитов и низкое содержание алмазов в перидотитовых ксенолитах.
ВВЕДЕНИЕ
Глубинный круговорот углерода включает как окисленные (твердые карбонаты, карбонатный расплав, двуокись углерода) так и восстановленные (элементарный углерод, карбиды, метан) формы (Dasgupta, Hirschmann, 2010). Об этом свидетельствует присутствие этих соединений в ксенолитах мантийных перидотитов и коровых пород, погружающихся на мантийные глубины в зонах субдукции. Переход между окисленной и восстановленной формами углерода может оказывать существенное влияние на мантийные процессы, включая плавление (Eguchi, Dasgupta, 2017) и образование алмазов (Shirey et al., 2013). Кристаллические карбонаты и карбонатные расплавы являются важными источниками мантийных алмазов (Pal’yanov et al., 2002; Arima et al., 2002), хотя механизмы их образования могут быть различными (Stachel, Luth, 2015).
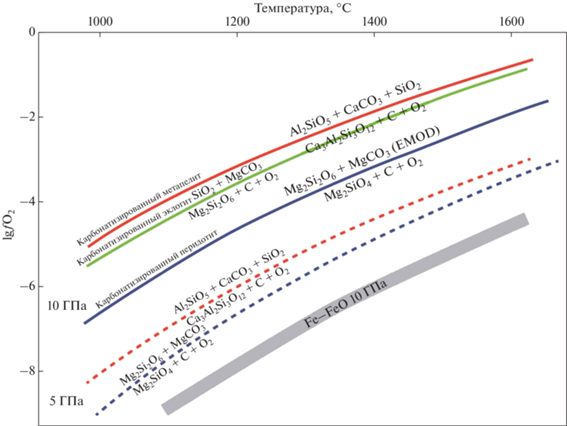
В последнее десятилетие гипотеза кристаллизации карбонатно-силикатных расплавов под воздействием окислительно-восстановительных реакций (“redox freezing”, Rohrbach, Schmidt, 2011; далее ROF) часто привлекается для объяснения поведения углерода в мантии (Shirey et al., 2013; Burnham et al. 2016; и др.). Она базируется на предположении о гетерогенности мантии Земли, состоящей из преобладающих перидотитов и рециклированных эклогитовых и пироксенитовых блоков. Экспериментально и теоретически было показано, что в мантийных перидотитах окислительный потенциал снижается за счет стабилизации Fe3+ компонентов твердых растворов, и на глубине ~250 км по мнению ряда исследователей может происходить выделение Fe–Ni металлической фазы (Ballhaus, 1995; Frost et al., 2004; Rohrbach et al., 2007). Присутствие карбонатов в мантийных породах указывает на то, что мантия локально более окислена (Ryabchikov et al., 1981). Максимальная фугитивность кислорода (${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$) в углеродсодержащих мантийных перидотитах соответствует буферным равновесиям EMOG(D) (энстатит–магнезит–оливин–графит/алмаз) или GEDOD (графит–энстатит–диопсид–оливин–доломит) (Eggler, Baker, 1982). Карбонатно-силикатные расплавы, образующиеся из карбонатизированных метаосадков, метабазитов или перидотитов, могут взаимодействовать с восстановленными зонами мантии, содержащими металлические фазы, что приводит к восстановлению карбонатов, образованию алмазов и кристаллизации расплавов согласно схематической реакции (Rohrbach, Schmidt, 2011)
(1)
$\begin{gathered} ~{\text{MgC}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{расплав}}} \right) + 2({\text{Fe,Ni) }}\left( {{\text{метал}}} \right) = \\ = 3({\text{Fe,Ni,Mg)O}}\,\,\left( {{\text{силикаты}}} \right) + {\text{C}}\,\,\left( {{\text{алмаз}}} \right). \\ \end{gathered} $Этот процесс воспроизводился в экспериментах. Пальянов и др. (Palyanov et al., 2013) и Мартиросян и др. (Martirosyan et al., 2015, 2016, 2019) изучали взаимодействие Mg–Ca карбонатов и металлического железа при 4–16 ГПа и 650–1600°С и наблюдали образование карбидов железа, графита и магнезиовюстита. Эксперименты с магнезитом и железом при 12–40 ГПа (Zhu et al., 2019) показали, что карбиды железа могут быть промежуточными метастабильными продуктами, и равновесная ассоциация включает только алмаз и ферропериклаз.
Восстановление карбонатов (твердых или компонентов расплавов) может происходить и без участия Fe–Ni металлической фазы в результате реакции с силикатными минералами перидотитов. Пальянов и др. (Pal’yanov et al., 2005) моделировали образование алмаза в результате взаимодействия карбонатов (магнезита и доломита) с SiO2 и Al2O3, используя водород в качестве восстановителя. Шарыгин и др. (Sharygin et al., 2018) изучили взаимодействие богатого Са карбонатитового расплава (возможного продукта плавления карбонатизированного эклогита или метаосадка) с перидотитом при 3.1 и 6.5 ГПа. Продуктом взаимодействия явилась ассоциация мервинит–оливин–алмаз. Эксперименты по декарбонатизации Fe-содержащего доломита в присутствии коэсита и металлического Мо при 4.25–6.0 ГПа (Martin, Hammouda, 2011) привели к образованию графит по реакции
(2)
$\begin{gathered} {\text{CaMg(C}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}\left( {{\text{доломит}}} \right) + {\text{ }}2{\text{Si}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{коэсит}}} \right) = \\ = {\text{CaMgS}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}}\left( {{\text{диопсид}}} \right) + 2{\text{C}} + 2{{{\text{O}}}_{2}}. \\ \end{gathered} $Эти авторы указали, что восстановление доломита на контакте с мантийным перидотитом в зонах субдукции может привести к образованию графита или алмаза. Розенталь и др. (Rosenthal et al., 2014) изучали плавление эклогита при 3–5 ГПа и эклогит–перидотитовое взаимодействие в присутствии небольших количеств воды и углекислоты. Они предположили, что реакции окислительно-восстановительного плавления и кристаллизации могут происходить как в перидотитах, так и в эклогитах, что приводит к образованию зональности на границе эклогит–перидотит и кристаллизации алмаза и/или карбоната. Сун и Дасгупта (Sun, Dasgupta, 2019) рассматривали различные аспекты карбонатизации, окислительно-восстановительного плавления и взаимодействия карбонатных расплавов с мантийными перидотитами в глубинных зонах субдукции.
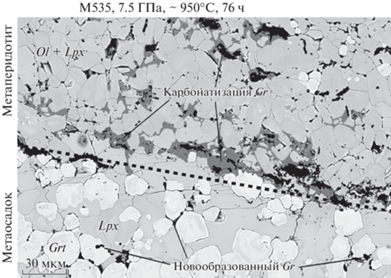
В наших экспериментах по взаимодействию карбонат- и водо-содержащих метаосадков близких по составу к GLOSS (Plank, Langmuir, 1998) с графитсодержащим гарцбургитом (Woodland et al., 2018) наблюдалось образование обогащенной графитом реакционной зоны на контакте между двумя материалами (рис. 1). При этом в исходной перидотитовой смеси графит замещается магнезитом, а в метаосадке исчезает карбонат, и кристаллизуется графит. Реакции карбонатизации и декарбонатизации на контакте контрастных материалов происходят одновременно. Эти соотношения были отмечены, но детально не обсуждались в нашей работе (Woodland et al., 2018). В настоящей статье мы приводим результаты изучения сопряженных окислительно-восстановительные реакций в простых синтетических смесях, моделирующих перидотит и метаосадок или эклогит. Используя новые экспериментальные данные, мы обсуждаем некоторые аспекты мантийного метасоматоза и образования природного алмаза.
Рис. 1.
Изображение в отраженных электронах контактной зоны эксперимента М535 (Woodland et al., 2018) по взаимодействию карбонатизированного осадка (внизу) и графит-содержащего гарцбургита (вверху) при 7.5 ГПа, температуре контакта 958°С и продолжительности 76 ч. Контакт двух материалов показан пунктирной линией. Во время эксперимента карбонат в осадке исчезал, и кристаллизовался графит. В перидотите графит растворялся и замещался магнезитом.
ТЕОРЕТИЧЕСКИЕ ПРЕДПОСЫЛКИ
Обычно считается, что ROF является реакцией карбонатно-силикатного расплава на взаимодействие с металлической фазой в перидотите (Rohrbach, Schmidt, 2011). Предполагалось также, что Fe–Ni сульфиды также могут служить в качестве восстановителя (Jacob et al., 2016). Мы покажем, что присутствие металла или сульфида не обязательно. Более того, окислительно-восстановительные реакции, сопровождающиеся плавлением и кристаллизацией расплава, могут проходить в системах без Fe и содержащих восстановленный и окисленный углерод в форме алмаза (графита) и карбоната (твердого или компонента карбонатно-силикатного расплава). Лут (Luth, 1993, 1999) показал, что максимальная ${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ в карбонат-содержащем перидотите, буферируемая реакцией EMOD,
(3)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{4}}}}\,{\text{(oливин)}} + {\text{C}}\left( {{\text{алмаз}}} \right) + {{{\text{O}}}_{2}} = \\ = {\text{MgSi}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{пироксен}}} \right) + {\text{MgC}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{магнезит}}} \right) \\ \end{gathered} $(4)
$\begin{gathered} {\text{CaMgS}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}}\left( {{\text{пироксен}}} \right) + 2{\text{C}}\left( {{\text{алмаз}}} \right) + 2{{{\text{O}}}_{2}} = \\ = {\text{CaMg(C}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}\left( {{\text{доломит}}} \right) + 2{\text{Si}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Реакция (4) контролирует потенциал кислорода в карбонатизированном эклогите. Лут предположил, что это может объяснить сосуществование в мантии перидотитов без алмаза с алмазоносными эклогитами и пироксенитами.
Расчеты с использованием термодинамических данных Холланда и Пауэлла (Holland, Powell, 2011) показали, что другие возможные реакции с участием углерода и карбонатов в метаосадках и метабазитах также происходят при фугитивности кислорода значительно превышающий уровень EMOD, и это различие немного возрастает с ростом давления (рис. 2). Следовательно, окислительно-восстановительные взаимодействия должны протекать между углеродсодержащими перидотитами и метаосадками или эклогитами независимо от содержания Fe3+ в контактирующих минералах. Наиболее очевидным результатом должна быть декарбонатизация метаосадка или эклогита, сопряженная с карбонатизацией перидотита. Алмаз или графит будет расти в метаосадке или эклогите и окисляться (если присутствовал изначально) в перидотите. Если начальные P–T условия были достаточны для частичного плавления карбонатизированного метаосадка или эклогита, то восстановление образующегося карбонатно-силикатного расплава может приводить к образованию элементарного углерода и кристаллизации расплава. С другой стороны, карбонатизация понижает солидус перидотита, что может привести к его частичному плавлению. Таким образом, возможен альтернативный механизм ROF, не связанный с наличием металлической фазы. Для оценки этого предположения мы провели экспериментальное исследование сопряженных окислительно-восстановительных реакций на контакте модельных перидотита, метаосадка и эклогита в присутствии элементарного углерода и карбонатов. Для того чтобы исключить влияние окислительно-восстановительных процессов с участием соединений Fe0, Fe2+ и Fe3+, наши исследования проводились в системах, не содержащих железо.
ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Экспериментальные исследования последних лет показали, что на контакте перидотитов с метаосадками и эклогитами происходят сложные взаимодействия, связанные с диффузионными и инфильтрационными потоками вещества (Bulatov et al., 2014, Woodland et al., 2018; Perchuk et al., 2018, 2019; Förster et al., 2021). В данной работе мы не стремились воспроизвести всю сложность природного процесса, а исследовали только один аспект взаимодействия, связанный с градиентом потенциала кислорода. Поэтому мы проводили опыты в простых системах при условиях далеких от тех, которые могут существовать в субдукционных каналах. Наиболее важным критерием при планировании и проведении экспериментов было протекание окислительно-восстановительных реакций с участием карбонатов и углерода.
Опыты проводились при давлении 10 ГПа, что обеспечивало образование алмаза при восстановлении карбонатов. Для достижения высоких скоростей взаимодействия и образования подвижных фаз (расплав или флюид) в ходе экспериментов температура в большинстве экспериментов составляла 1500°С. Эксперименты при 1200–1300°С показали, что снижение температуры не меняет принципиально характер взаимодействия. Составы исходных смесей также заметно отличались от природных пород, поскольку главным критерием была возможность протекания окислительно-восстановительных реакций карбонатизации и декарбонатизации. Все опыты проводили в системе SiO2–MgO–CaO–Al2O3–C–O. Главной реакцией для перидотита была карбонатизация оливина, поэтому в качестве модельного аналога перидотита использовался чистый форстерит. Для метабазитовых составов важны реакции карбонатизации низко- и высококальциевых пироксенов. Исходя из этого, задавались составы исходных смесей, которые мы условно называем “эклогитовыми”. Наиболее простая смесь предназначалась для моделирования карбонатизации энстатита и состояла из MgСO3 и SiO2 при избытке последнего. Для моделирования реакций с участием высококальциевого пироксена и/или пиропового граната использовались более сложные “эклогитовые” смеси, включающие также CaCO3 и Al2O3. Моделью метаосадочного материала служила смесь CaCO3, Al2O3 и SiO2 в пропорциях, обеспечивающих присутствие кальциевого граната, кианита и SiO2 в продуктах опытов.
Для замедления взаимодействия смесей вследствие инфильтрационного и диффузионного переноса главных нелетучих компонентов (SiO2, MgO, CaO, Al2O3) перидотитовая смесь отделялась от метаосадочной или “эклогитовой” смеси графитовым диском, который служил также источником углерода для реакций карбонатизации.
Исходные материалы готовились из синтетического форстерита, природных магнезита и кальцита и химических реагентов SiO2 и Al2O3. Компоненты истирали до величины зерна <20 мкм в агатовой ступке под этанолом, высушивали и смешивали в пропорциях, обеспечивающих присутствие реагирующих фаз. Исходные смеси загружали в платиновые капсулы (1.6 мм внешний диаметр, длина 1.5–2.0 мм) в следующей последовательности (снизу вверх): метаосадок или эклогит, графитовый диск толщиной ~0.6 мм, форстерит. Эксперименты проводили в Университете им. Гете (Франкфурт-на-Майне, Германия) на многопуансонном аппарате с использованием ячейки М-14, состоящей из 95%MgO + 5%Cr2O3 октаэдров, втулок из ZrO2, нагревателя из Re фольги и MgO втулки вокруг образца. Давление калибровали по равновесиям форстерит–вадслеит при 1200°C и 13.6 ГПа (Morishima et al., 1994), коэсит–стишовит при 1650°C и 10.6 ГПа (Zhang et al., 1996) и CaGeO3 гранат–перовскит при 1200°C и 5.6 ГПa (Ross et al., 1986). Методика эксперимента детально описана в нашей предыдущей статье (Brey et al., 2008). Неопределенность в оценке давления составляла ±0.3 ГПа. Температуру измеряли W95Re5–W74Re26 термопарой. Колебания температуры во время эксперимента не превышали ±3°C.
Продолжительность экспериментов составляла от 1/4 до 72 ч (табл. 1). После проведения опыта капсулы заливали эпоксидной смолой, шлифовали и полировали с использованием алмазных паст на масляной основе. Продукты анализировали на электронном микрозонде Jeol JXA-8530F Plus Hyper Probe. Съемка проводилась при ускоряющем напряжении 15 кв, токе 20 на и времени набора сигнала 20–40 с. Минералы анализировали пучком, сфокусированным до диаметра 1–3 мкм. Алмазы в продуктах опытов были идентифицированы в отраженных электронах (BSE) и в катодолюминесцентном изображении (CL) (Girnis et al., 2018).
Таблица 1.
Условия экспериментов и фазовый состав продуктов
| Исходная конфигурация | Продукты опытов | Толщина Gr слоя, мкм** | Толщина | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Опыт | T, °C | Длитель-ность, час | Пери-дотит | Метаосадок/Эклогит | Перидотит* | Метаосадок/Эклогит* | Dia слоя, мкм** | Dia около Pt | |
| Только метаосадок | |||||||||
| M805 | 1200 | 24 | – | CaCO3 + Al2O3 + SiO2 | – | Grt+ Ky+ Arg+ Sti | 450 | 0 | Нет |
| Перидотит-метаосадок | |||||||||
| M802 | 1200 | 72 | Fo | CaCO3 + Al2O3 + SiO2 | Lpx+ Hpx+ Grt+ Mst/Ol | Grt+ Ky+ Arg | 230 | 90 | Да |
| M801 | 1300 | 1 | Fo | CaCO3 + Al2O3 + SiO2 | Ol | Grt+ Ky/Grt+ Ky+ Arg | 400 | 0 | Нет |
| M817 | 1300 | 72 | Fo | CaCO3 + Al2O3 + SiO2 | Lpx+ Hpx+ Mst+ Grt/Ol+ + Lpx+ Mst/Ol | Grt+ Ky+ Arg+ Sti | 440 | 0 | Да |
| M797 | 1500 | 1 | Fo | CaCO3 + Al2O3 + SiO2 | Lpx+ Hpx/Lpx+ Mst/Ol | Grt+ Ky+ Arg+ Cd | 200 | 90 | Да |
| M807 | 1500 | 1 | Fo | CaCO3 + Al2O3 + SiO2 | Ol+ Lpx+ Mst/Ol | Grt+ Ky+ Arg+ Sti | 375 | 15 | Да |
| M818 | 1500 | 0.25 | Fo | CaCO3 + Al2O3 + SiO2 | Lpx+ Mst/Ol | Ky+ Sti+ Arg+ Ca-Al silicate | 470 | 0 | Да |
| M819 | 1500 | 5 | Fo | CaCO3 + Al2O3 + SiO2 | Ol+ Lpx+ Mst+ Hpx/Ol+ + Lpx+ Mst/Ol | Melt/Grt+ Ky+ Sti | 420 | 0 | Да |
| Перидотит-эклогит | |||||||||
| M809 | 1500 | 1 | Fo | MgCO3 + SiO2 | Ol | Mst+ Sti | 325 | 0 | Нет |
| M810 | 1500 | 1 | Fo | MgCO3 + SiO2 + Al2O3 | Opx+ Mst+ Grt/Ol+ Lpx+ + Mst/Ol | Ky+ Mst+ Sti | 350 | 100 | Да |
| M820 | 1500 | 1 | Fo | MgO+ Al2O3 + CaCO3 + SiO2 | Lpx+ Mst/Ol | Grt+ Mst+ Sti+ Hpx | 400 | 0 | Да |
Все эксперименты проведены при давлении 10 ГПа. * Фазовый состав метасоматических зон (разделены знаком /), начиная от тыловой зоны около графитового диска. ** Исходный графитовый диск толщиной 600 мкм был частично замещен мономинеральным алмазным слоем на границе с карбонат-содержашей смесью, графит сохраняется на контакте с перидотитовой смесью. Символы минералов: Arg – арагонит, Dia – алмаз, Gr – графит, Grt – гранат, Hpx – высоко-Ca клинопироксен, Ky – кианит, Lpx – низко-Ca клинопироксен, Mst – магнезит, Sti – стишовит.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
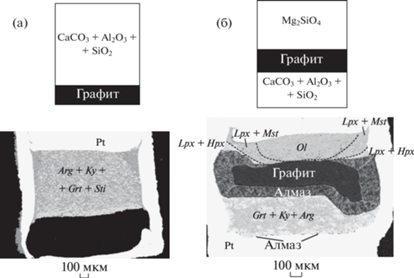
Условия и результаты опытов представлены в таблице 1. В опыте М805 при 1200°С в платиновую капсулу загрузили только метаосадок и графитовый диск (рис. 3а). Через 24 часа исходная смесь перекристаллизовалась в ассоциацию гранат + кианит + стишовит + арагонит. Пропорции фаз и величины зерен варьировали, что характерно для экспериментов в присутствии небольшого температурного градиента. Никакого взаимодействия между метаосадком и графитом не наблюдалось. Это указывает на то, что ассоциация арагонита и (метастабильного) графита стабильна в условиях эксперимента.
Рис. 3.
Конфигурация и результаты экспериментов. (а) Контрольный эксперимент (М805, 10 ГПа, 1200°С, 24 ч) с метаосадочной смесью (SiO2–Al2O3–CaCO3) и графитом в Pt капсуле. Продукт опыта – агрегат арагонита, кианита, граната и стишовита. Взаимодействия с графитом не наблюдается. (б) Эксперимент (М797, 10 ГПа, 1500°С, 1 ч) с метаосадочной смесью, графитовым диском и форстеритом (модельный перидотит). Количество арагонита в метаосадочной смеси существенно меньше, чем в контрольном эксперименте. В перидотитовом слое наблюдается кристаллизация высококальциевого клинопироксена вблизи графитового диска и карбонатизация оливина с образованием низкокальциевого пироксена и магнезита на удалении от графита. На контакте с метаосадочной смесью графит трансформировался в слой мономинерального алмаза.
Добавление форстерита, отделенного графитовым диском, кардинальным образом меняет фазовые соотношения и инициирует ряд минеральных реакций (рис. 3б). Несколько экспериментов, проведенных при различных температурах и длительностях (табл. 1) позволяют реконструировать последовательность процессов, происходивших в капсуле. В начале взаимодействия в форстеритовом слое появляется небольшое количество магнезита и низкокальциевого пироксена вблизи контакта с графитом и стенками платиновой ампулы. Одновременно карбонат исчезает в тонкой зоне метаосадка, примыкающей к графитовому диску. При этом кальций расходуется на образование Ca-граната или выносится карбонатно-силикатным расплавом. Зоны карбонатизации и декарбонатизации в исходных материалах расширяются при дальнейшем взаимодействии. В конце концов, реакционная зона с оливином, низкокальциевым пироксеном, магнезитом, гранатом и высококальциевым пироксеном формируется на дне перидотитового слоя вблизи контакта с платиновой капсулой (рис. 3б). Отмечается образование алмазов в метаосадочном слое, главным образом на дне и у стенки платиновой капсулы. Сплошной мономинеральный слой алмаза быстро формируется вдоль нижней поверхности графитового диска (рис. 3б). Для оценки степени растворения графита и кристаллизации алмаза, в нескольких опытах поверхность графитового диска была покрыта порошком Re. Наблюдаемое распределение частиц Re в продуктах опытов указывает на то, что графит растворялся на верхней поверхности графитового диска вблизи контакта с форстеритом (рис. 4). Однако присутствие Re, по-видимому, препятствовало нуклеации алмаза; поверхность диска остается покрытой порошком Re, а алмаз формируется только на стенках и дне платиновой капсулы.
Рис. 4.
Изображения в отраженных электронах продуктов экспериментов. Поверхность графита в этих опытах была покрыта порошком Re с целью контроля растворения и роста графита. (а) Контакт графита с перидотитовым материалом (опыт М818, 10 ГПа 1500°С, 1/4 ч). Развитие магнезита между графитом и Re указывает на растворение графита. (б) Контакт графита с метаосадочным материалом (опыт М819, 10 ГПа, 1500°С, 5 ч). Карбонатно-силикатный расплав в этом опыте сегрегировался под графитом. Re порошок во многих местах остается в контакте с графитовым диском, что указывает на отсутствие растворения графита. В то же время, кристаллизация новообразованного графита наблюдается в карбонатно-силикатном расплаве.

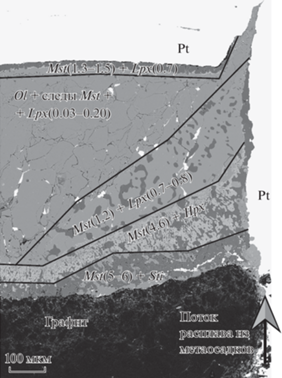
Помимо изменения минеральных ассоциаций, взаимодействие проявляется в закономерных изменениях содержаний СаO в минералах в перидотитовом слое (рис. 5). Наибольшие содержания СаО как в магнезите, так и в низкокальциевом пироксене наблюдались вдоль контакта перидотитового слоя с Pt и графитом, где можно ожидать максимальную инфильтрацию расплава. Гранат в слое метаосадка богат СаO, но содержит значительное количество MgO, особенно в высокотемпературных экспериментах (например, ~10 вес. % MgO в опыте M797 при 1500°C).
Рис. 5.
Изображение в отраженных электронах, показывающее детали метасоматической зональности в перидотитовом слое (опыт М817, 10 ГПа, 1300°С, 72 ч). Метасоматические зоны различаются минеральными ассоциациями и содержанием СаО в пироксене и магнезите (мас. %, в скобках). Границы между зонами резкие, и содержания СаО в минералах скачкообразно изменяются на границах зон.
В экспериментах с эклогитовыми исходными смесями (магнезит + SiO2, магнезит + SiO2 + Al2O3 и кальцит + MgO + SiO2 + Al2O3) происходят похожие реакции, но степень взаимодействия обычно ниже, чем в экспериментах с метаосадочной смесью. В опыте M809 со смесью SiO2 + MgCO3 (1500°C, 1 ч), реакции карбонатизации или декарбонатизации не установлены, хотя, судя по диаграмме (рис. 2), ассоциация магнезита и SiO2 должна быть неустойчивой. Возможно, это связано с субсолидусными условиями и отсутствием флюида или расплава (табл. 1). Графитовый диск не изменен, и алмазы не обнаружены. Добавление Al2O3 приводит к слабому взаимодействию между минералами. В перидотитовом слое вблизи графитового диска и Pt появлялось небольшое количество магнезита и низкокальциевого пироксена. Как и в экспериментах с метаосадочной смесью, существуют две реакционные зоны. В тыловой зоне вблизи контакта с графитовым диском и платиной оливин замещен низкокальциевым пироксеном, магнезитом и небольшим количеством граната. На удалении от этой зоны, наблюдались зерна низкокальциевого пироксена и магнезита в преобладающем форстерите. Интересно, что несмотря на слабое взаимодействие и слабую декарбонатизацию, толстый слой алмаза образовался на нижней поверхности графитового диска (опыт М-810, 1500°C, 1 ч, тaбл. 1). Добавление Са к эклогитовой смеси усиливает взаимодействие, но оно остается намного слабее, чем в экспериментах с метаосадочной смесью.
ОБСУЖДЕНИЕ
Свидетельства переноса кислорода в форме O2, CO или(и) H2O
Взаимодействие между химически контрастными материалами включает несколько процессов. Контрольный эксперимент с осадочной смесью и графитом (без форстеритового слоя) и один субсолидусный эксперимент с форстеритом и максимально упрощенной эклогитовой смесью (SiO2 + MgCO3) показали, что карбонатные минералы не взаимодействуют с графитом или алмазом при условиях и продолжительности экспериментов (квазиравновесное состояние). Необходимым условием для химических и окислительно-восстановительных взаимодействий является присутствие расплава или флюидной фазы. Количество расплава в наших экспериментах было обычно очень небольшим, закаленный карбонатный расплав наблюдался только в одном опыте (М-819). Присутствие расплава в других опытах косвенно доказывается быстрой перекристаллизацией минералов и образованием метасоматических зон в перидотитовом материале. Карбонатный расплав быстро проникает вдоль контактов минеральных зерен и формирует сеть сообщающихся каналов (Hammouda, Laporte, 2000; Gardes et al., 2020). После формирования сети каналов дальнейшее взаимодействие происходит в основном за счет диффузии в расплаве главных оксидов и кислорода вследствие градиентов химических потенциалов. Это проявляется в развитии метасоматической зональности в перидотитовом материале. Фронтальная метасоматическая зона характеризуется присутствием магнезита и низкокальциевого пироксена, образующихся в результате реакции карбонатизации оливина (3) при незначительном переносе компонентов, исключая C и O. Это доказывается низким содержанием CaO в новообразованных низкокальциевом пироксене и магнезите (рис. 5). Вблизи графитового диска наблюдалось более интенсивное взаимодействие благодаря инфильтрации расплава из метаосадочной смеси. В этой зоне формировались обогащенные CaO низкокальциевый пироксен и магнезит (рис. 5). Одновременный перенос MgO в осадочный материал приводит к образованию граната со значительным содержанием пиропового компонента (исходная метаосадочная смесь не содержала MgO).
Реакция карбонатизации форстерита сопровождается постепенной резорбцией карбонатов в осадочном слое. Карбонатизация и декарбонатизация могут происходить одновременно при постоянной фугитивности кислорода благодаря только переносу СО2. Но в нашем случае контрастное распределение потенциале кислорода, связанное с буферирующим влиянием минеральных ассоциаций, приводит к участию графита в реакциях. Это проявляется в растворении графита на контакте с перидотитом и осаждении графита или алмаза на границе графит–метаосадок (рис. 4). Образование алмаза на стенках и дне платиновой капсулы было очевидно связано с восстановлением карбоната. Формирование непрерывного мономинерального слоя алмаза в основании графитового диска было связано, по крайней мере, частично с перекристаллизацией графита. На это указывает образование слоя алмаза в экспериментах с минимальной степенью карбонатизации (опыт М810 с эклогитовой смесью). Важно, что алмаз не был обнаружен на контакте графита с метасоматизированным перидотитом. Это значит, что в этой области образца происходит только растворение графита. Растворение графита и кристаллизация алмаза происходит на контакте с метаосадочным материалом. Причиной этого является более высокая растворимость метастабильного графита в расплаве по сравнению с растворимостью стабильного алмаза.
Таким образом, взаимодействие между карбонатным расплавом, образующимся в метаосадке, и оливином приводит к образованию зоны карбонатизации оливина без существенного переноса Si, Ca и Mg. Фронт начальной карбонатизации оливина (область Ol + следы Mst + Lpx на рис. 5) опережает продвижение обогащенной СаO зоны в перидотитовом материале (области Mst + Lpx и Mst + Hpx на рис. 5). Карбонатизация оливина связана с переносом СО2, но растворение графита в основании перидотитовой зоны возможно только при переносе свободного кислорода по межзерновым каналам, заполненным расплавом, поскольку наша система не содержит железа и других элементов переменной валентности (за исключением C).
Перенос кислорода может быть связан в наших опытах с присутствием небольшого количества Н2О в опытах, что может быть связано с вероятным присутствием следов воды в исходных материалах и проникновением водорода через стенки Pt капсулы. Диффузия воды в силикатных расплавах во много раз быстрее, чем самодиффузия кислорода (Behrens et al., 2007). Уотсон (Watson, 1991) наблюдал очень быструю диффузию Fe в дуните, содержащем ~5% Na-карбонатного расплава. Эффективный коэффициент диффузии Fe был не менее 10–6–10–7 см2/с при 1300°C. Диффузия молекулярного О2 в силикатных расплавах на 5–9 порядков быстрее, чем самодиффузия кислорода (Zhang, Ni, 2010). Но поскольку содержание молекулярного О2 в расплавах (включая карбонат-силикатные расплавы) очень низка, вклад свободного О2 в перенос кислорода должен быть незначительным и меньше переноса с Н2О или оксидами Fe (Zhang, Ni, 2010). Другой возможный механизм окисления/восстановления в наших экспериментах связан с реакцией
и переносом растворенного СО. Вклад этого механизма нельзя оценить, поскольку отсутствуют данные о содержании и диффузии СО в карбонатно-силикатных расплавах.Влияние состава минералов на окислительно-восстановительные равновесия
Фугитивность кислорода в природных перидотитах, эклогитах или метаосадках может существенно отличаться от значений ${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ в наших смесях без железа. Минеральные реакции, буферирующие фугитивность O2 или СО2 могут смещаться благодаря изменениям активностей миналов твердых растворов. Стагно и Фрост (Stagno, Frost, 2010) и Стагно и др. (Stagno et al., 2015) экспериментально определили ${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ в перидотитовой и эклогитовой ассоциациях в равновесии с графитом или алмазом и карбонатом при 3–11 ГПа. Они установили, что равновесные значения ${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ в обеих ассоциациях сходны и лежат на или немного ниже (менее одного порядка) равновесия EMOG(D). В наших экспериментах упрощенная эклогитовая ассоциация более окислена, чем EMOD, что устанавливается расчетами с использованием термодинамической базы данных (Holland, Powell, 2011) (рис. 2). Сравнения с природными системами требует учета сложных составов природных фаз.
Для природных мантийных равновесий коррекция на дополнительные компоненты не значительная, что можно показать, используя составы природных минералов и условие термодинамического равновесия
где ΔGP,T – изменение энергии Гиббса для реальных минеральных составов, $\Delta G_{{P,T}}^{0}$ – изменение энергии Гиббса для чистых миналов, Kr – константа равновесия реакции. Для реакции (3)(7)
$\Delta {{G}_{P}}_{{,T}} = \Delta G_{{P,T}}^{0} + RT\ln ({{a}_{{{\text{MgC}}{{{\text{O}}}_{{\text{3}}}}}}}*{{a}_{{{\text{MgSi}}{{{\text{O}}}_{{\text{3}}}}}}}/{{a}_{{{\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{4}}}}}}})$(8)
$\begin{gathered} \lg {{f}_{{{{{\text{O}}}_{2}}}}} = \lg {{f}_{{{{{\text{O}}}_{2}}}}}\left( {{\text{EMOD/G}}} \right) + \hfill \\ + \,\,\lg ({{a}_{{{\text{MgC}}{{{\text{O}}}_{{\text{3}}}}}}}*{{a}_{{{\text{MgSi}}{{{\text{O}}}_{{\text{3}}}}}}}/{{a}_{{{\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{4}}}}}}}), \hfill \\ \end{gathered} $Влияние состава граната на равновесную ${{f}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ для реакции в метаосадке
(9)
$\begin{gathered} {\text{1/3C}}{{{\text{a}}}_{{\text{3}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{12}}}}}\left( {{\text{гранат}}} \right){\text{ + }}\,{\text{C}}\left( {{\text{алмаз}}} \right){\text{ + }}\,{{{\text{O}}}_{{\text{2}}}}\,{\text{ = }} \\ {\text{ = }}\,\,{\text{CaC}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{арагонит}}} \right){\text{ + 1/3A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{5}}}}\left( {{\text{кианит}}} \right){\text{ + }} \\ {\text{ + }}\,\,{\text{2/3Si}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{стишовит/коэсит}}} \right) \\ \end{gathered} $(10)
$\lg {{f}_{{{{{\text{O}}}_{2}}}}} = \lg {{f}_{{{{{\text{O}}}_{2}}}}}|{{a}_{{{\text{Gros}}}}} = 1 - 1{\text{/}}3\lg ({{a}_{{{\text{Gros}}}}}),$(11)
$\begin{gathered} \lg ({{a}_{{{\text{Gros}}}}}) = - 3.78\left( {0.2} \right) + P({\text{ГПа}}) \times 0.0794\left( {0.009} \right) + \\ + {\text{ }}3403.1\left( {165} \right){\text{/}}\left( {T + 273} \right){\text{ }}(1\sigma = 0.08), \\ \end{gathered} $Возможный сценарий взаимодействия метаосадка с перидотитом
Наиболее важным результатом наших экспериментов является установление одновременного протекания карбонатизации перидотита и декарбонатизации метаосадка или метабазита. Алмаз или графит (если первоначально присутствует) резорбируется в перидотите в процессе карбонатизации и кристаллизуется в метаосадке. Важно, что зоны карбонатизации и декарбонатизации в опытах существенно больше, чем зоны химического взаимодействия, связанные с переносом нелетучих компонентов (СаО, MgO, SiO2 и Al2O3) карбонатно-силикатным расплавом. Основываясь на этих наблюдениях, мы предполагаем следующий сценарий взаимодействия перидотита с карбонатизированным метаосадком или перидотита с карбонатизированным эклогитом (рис. 6).
Рис. 6.
Предполагаемая последовательность процессов метасоматического взаимодействия между алмазоносными перидотитами и карбонатизированными осадками.
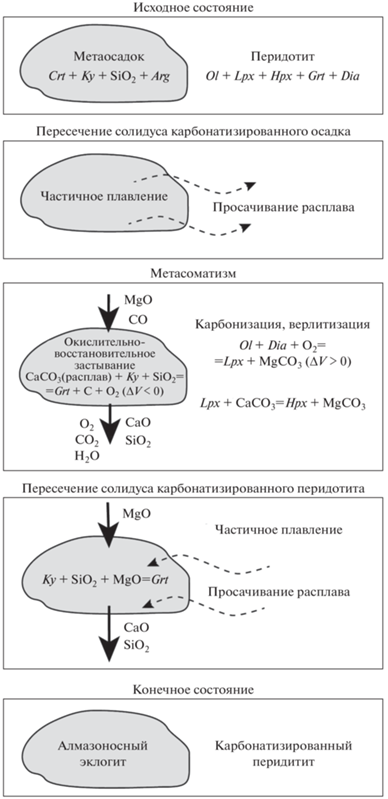
В процессе субдукции метаморфизованные осадки и базиты дегидратируются при относительно низких давлениях (Kerrick, Connolly, 1998), а карбонаты могут сохраняться до значительно более высоких давлений, вплоть до условий нижней мантии (Canil, Scarfe, 1990; Biellmann et al., 1993; Yaxley, Green, 1994; Isshiki et al., 2004; Drewitt et al., 2019; Santos et al., 2019). Даже в присутствии воды, которая способствует распаду карбонатов, значительные количества карбонатов в эклогитах могут быть транспортированы на большие глубины (Gorce et al., 2019). Поэтому мы рассматриваем безводные карбонатсодержащие материалы.
Развитие субдукционных каналов включает образование зон меланжа (Bebout, Barton, 1993; Bebout, 2007), где перидотиты захватывают блоки коровых пород размером от километров до сантиметров. Рассмотрим для примера включение карбонатизированного метаосадка в перидотитовой матрице (рис. 6). При высоких давлениях и температурах, перидотитовая ассоциация представлена оливином, пироксеном и гранатом. Графит или алмаз являются главными углеродсодержащими фазами в верхней мантии по крайней мере до 6 ГПа, после чего роль метана может также быть значительной (Frost, McCammon, 2008). Повышение давления смещает реакцию (3) в сторону образования элементарного углерода. Поэтому в мантийном перидотите магнезит стабилен только при низких давлениях или в локальных окисленных зонах. Метаосадочная ассоциация включает SiO2, гранат, кианит и арагонит (Poli, 2015). Термодинамические данные (Holland, Powell, 2011) указывают на сильное влияние температуры на давление перехода кальцит–арагонит при температурах выше 1000°С. Согласно модели кальцит стабилен при 8 ГПа и температуре выше 1600°С. Экспериментально установлено (Zhao et al., 2019), что кальцит–арагонитовый переход практически линеен до кривой плавления, и кальцит не может быть стабилен при давлении более 4.5 ГПа. Фазовая ассоциация карбонатизированного габбро при давлениях 4–5 ГПа и температурах выше стабильности лавсонита представлена преимущественно арагонитом, кианитом, клинопироксеном, гранатом и SiO2 (Poli, 2015).
Интенсивное взаимодействие начинается после достижения солидуса карбонатизированного метаосадка и появления расплава. Первоначальный существенно карбонатный расплав быстро просачивается в перидотит. Недавно опубликованные эксперименты (Gardes et al., 2020) показали, что связанная межзерновая система каналов с расплавом формируется в перидотите при степени плавления много ниже 1%. Высокий градиент химических потенциалов между метаосадком и перидотитом вызывает диффузионный поток компонентов по межзерновым каналам. Летучие компоненты (CO2, O2, CO и др.) диффундируют наиболее быстро, что приводит к реакциям карбонатизации и резорбции алмаза в перидотите и декарбонатизации и кристаллизации алмаза в метаосадке без значительного переноса главных нелетучих компонентов (SiO2, MgO и др.). Декарбонатизация повышает температуру солидуса и может приводить к исчезновению расплава. С другой стороны, карбонатизация перидотита понижает его солидус, и плавление может начаться в перидотите. Эти процессы ограничивают перенос главных элементов из осадка в перидотит. Снижению интенсивности инфильтрации расплава из метаосадка в перидотит способствуют также положительный объемный эффект карбонатизации и отрицательный объемный эффект восстановления углерода с образованием алмаза (рис. 6). Возникающий градиент давления благоприятен для инфильтрации расплава из перидотита в метаосадок.
Взаимодействие контрастных материалов за счет инфильтрации расплава и диффузии компонентов приводит к развитию зон с градиентами концентраций главных и редких элементов. Эти процессы были нами изучены в изотермических условиях (Bulatov et al., 2014) и при наличии температурного градиента (Woodland et al., 2018). Метаосадок обогащается при этом MgO и FeO, и его состав приближается к богатому MgO эклогиту (Bulatov et al., 2014). Одновременно образуется карбонатизированный перидотит, обогащенный низко-Ca пироксеном.
Таким образом, ассоциации алмазсодержащих эклогитов и эклогитоподобных пород с карбонатизированными перидотитами, не содержащими алмазов, являются стабильными в субдукционном меланже. Количество алмаза в метаосадочном и метабазитовом материале зависит от исходного содержания карбоната, поэтому существование обогащенных алмазом метаосадков и эклогитов не является неожиданным. Содержание алмаза, образующегося в перидотите по механизму ROF (Rohrbach, Schmidt, 2011) контролируется восстановительной емкостью перидотита. Примитивная мантия содержит 6.3 мас. % Fe (Palme, O’Neill, 2014). Даже если все железо изначально содержится в металлической форме и полностью переходит в FeO за счет реакции восстановления СО2, образуется не более 0.7 мас. % алмаза. Очевидно, эта оценка сильно завешена, поскольку только небольшая доля мантийного железа может находиться в металлическом состоянии.
Вполне вероятно, что описанные выше процессы могут происходить в природе. С другой стороны, нет прямых свидетельств окислительно-восстановительного взаимодействия метаосадок–перидотит в глубинных субдукционных зонах. Но имеются природные наблюдения, косвенно указывающие на то, что миграция расплава, сопровождающаяся окислительно-восстановительными реакциями между перидотитовыми и метаосадочными (эклогитовыми) материалами, имеет место в мантии.
А. Карбонаты эпизодически присутствуют в мантийных перидотитах и коровых породах, погруженных на мантийные глубины
(1) Субдуцированные осадки содержат переменные и иногда очень высокие содержания CaC-O3 (Plank, Langmuir, 1998; Li, Schoonmaker, 2003; Plank, Manning, 2019). Карбонаты – распространенный продукт низкотемпературных изменений океанических базальтов (Staudigel et al., 1989; Alt, Teagle, 1999).
(2) Карбонатизация серпентинизированных перидотитов, сопровождающаяся декарбонатизацией метаосадочных пород при относительно низких давлениях и температурах (~1 ГПа и 320–390°C), наблюдалась в субдукционных комплексах Западных Альп и Гималаев (Debret et al., 2018). Этот процесс ограничивает транспортировку карбонатов на большие глубины с метаосадочными породами в субдукционных системах. Однако оцененные для этих комплексов P–T условия соответствуют максимуму температуры на поверхности плиты (Syracuse et al., 2010). В более холодных зонах карбонатизированные метаосадки могут погружаться на большие глубины.
(3) Кальцит является обычным минералом субдуцированных метаосадков и сохраняется до давлений >2.5 ГПa (Busigny et al., 2003). Имеются природные наблюдения сохранения карбонатов в серпентинитах при давлениях ~1.7 ГПa (Menzel et al., 2019). CaCO3 присутствует в алмаз- и/или коэсит-содержащих породах, интерпретируемых как коровый материал, погруженный на мантийные глубины (напр., Korsakov, Hermann, 2006; Mukherjee et al., 2003). Карбонаты эпизодически встречаются в эклогитах (Messiga et al., 1999; Zhang et al., 2002; Zhu et al., 2020). Доломит и магнезит были описаны в мантийных перидотитах из Западного Гнейсового Региона (Норвегия), которые были предположительно метасоматизированы C–O–H флюидом при давлении до 7 ГПа (Scambelluri et al., 2010). Карбонатсодержащие метаперидотиты были также обнаружены в других метаморфических комплексах, содержащих алмазоносные метаосадки (Mposkos et al., 2010). Известны находки вторичных гранатовых перидотитов с магнезитом (Cannao et al., 2020). Изотопный состав C и N в этих породах свидетельствует о том, что источником флюида были, вероятно, метаосадки.
Б. Существуют значительные вариаций летучести кислорода в мантии
(4) Имеются свидетельства о значительных вариациях окислительного состояния верхней мантии в результате взаимодействия расплав–порода и флюид–порода (Ali et al., 2020; Brounce et al., 2014).
(5) Окисленная океаническая кора (с высокими отношениями Fe3+/Fetot в осадках и измененных базальтах) погружается в субдукционной зоне без заметного восстановления, несмотря на образование окисленных магм (Brounce et al., 2019). Этот процесс может быть главным фактором, определяющим высокую степень окисления магм океанических островов, связанных с мантийными плюмами (Moussalam et al., 2019).
(6) Восстановление субдуцированного мафического материала в результате потери летучих установлено на основе химической и изотопной зональности в гранате из комплекса Сифнос в Греции (Gerrits et al., 2019). Гальвес и др. (Galvez et al., 2013) описали образование графита в метаосадке на контакте с серпентинизированным перидотитом в результате реакции восстановления CaCO3.
В. Вариации окислительно-восстановительных условий в мантии могут быть связаны с мантийным метосоматозом
(7) Окисление мантийных перидотитов в результате скрытого метасоматоза, предположительно связанного с карбонатитовымим или карбонатно-силикатными расплавами, было описано в ряде природных образцов (Uenver-Thiele et al., 2014, 2017; Yaxley et al., 2017).
Г. Природные наблюдения указывают на связь образования и растворения алмазов с перемещением карбонатно-силикатных расплавов и флюидов
(8) Резорбция алмазов в мантии является распространенным явлением, и ее характерные признаки соответствуют экспериментально установленным форам растворения алмазов в карбонатно-силикатных расплавах (Fedortchouk et al., 2019). Многие из этих форм характерны для растворения алмаза в кимберлитовой магме, но некоторые из них интерпретируются как индикаторы мантийного метасоматоза под действием флюида или расплава (Fedortchouk, Zhang, 2011; Zhang, Fedortchouk, 2012; Fedortchouk, 2019).
(9) Сублитосферные алмазы с легким изотопным составом углерода были описаны в трубке Ягерсфонтейн (Южная Африка) (Tappert et al., 2005). Предполагается, что источником углерода для этих алмазов являлся органический материал субдуцированных осадков.
(10) Изотопная систематика и распределение N в алмазах из эклогитиов Зимми (Zimmi, Западно-Африканский кратон) указывают на то, что алмазы могли образоваться при окислении мантийных С–О–Н флюидов в эклогитах (Smit et al., 2019).
(11) Изотопные свидетельства участия флюидов, связанных с субдукционным материалом, были получены для древних (3.2–3.8 млрд лет) алмазов из россыпей Витватерсранда (Smart et al., 2016), Орапы (Chinn et al., 2018) и Аргайла (Timmerman et al. 2019). Предполагается, что алмазы кристаллизовались при восстановлении окисленных флюидов или расплавов.
(12) Алмазы с очень низкими значениями δ13C, указывающими на осадочный источник углерода, были обнаружены во Французской Гвиане (Smith et al., 2016). Авторы пришли к выводу, что эти алмазы кристаллизовались из флюидов, ремобилизованных из серпентинитов на поверхности мантийного клина на глубине 200–250 км.
(13) Известны многочисленные находки карбонатных флюидных и расплавных включений в волокнистых и монокристаллических алмазах, свидетельствующие об образовании алмазов из богатых карбонатом расплавов или высокоплотных флюидов (Navon et al., 1988; Kopylova et al., 2010; Petts et al., 2016; Skuzovatov, Zedgenizov, 2019; и др.) Кристаллизация алмазов из карбонатных расплавов, образующихся при плавлении осадков, обосновывалась Логвиновой и др. (Logvinova et al., 2019) на основе анализа карбонатных включений в ювелирных алмазах из Сытыканской кимберлитовой трубки в Якутии.
(14) Богатые алмазом породы (алмазиты) были описаны в кимберлитах Орапы (Ботсвана) (Mikhail et al., 2019). Составы сосуществующих гранатов и изотопный состав алмазов указывают на коровый (осадочный) источник алмазообразующих флюидов.
(15) Смарт и др. (Smart et al., 2009) исследовали уникальный эклогит с алмазом из кимберлитов трубки Иерихон (Канада). Они предположили, что необычные геохимические и изотопные характеристики и чрезвычайно высокое содержание алмазов (до 20%) являются результатом метасоматоза между эклогитом и мантийным перидотитом.
Эти наблюдения не доказывают протекание сопряженных окислительных и восстановительных реакций на контакте перидотитов с метабазитами и метаосадками, но они показывают, что возможные геохимические и минералогические предпосылки и следствия таких процессов широко распространены в мантийных породах.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
Важной особенностью экспериментов, описанных в данной статье, является то, что окислительно-восстановительные реакции проходили в системах, содержащих только один элемент с переменной валентностью – углерод. Предыдущие исследования окислительно-восстановительным взаимодействий при мантийных условиях проводились в железосодержащих системах (Palyanov et al., 2013; Martirosyan et al., 2019) или при участии восстановленных флюидов (Pal’yanov et al., 2005). Наши результаты показывают, что концепция ROF (Rohrbach, Schmidt, 2011) может быть распространена на системы без железа.
Механизм ROF и окислительно-восстановительного плавления может реализоваться за счет разницы в величинах фугитивности кислорода, буферируемых минеральными ассоциациями карбонатизированных метаосадков (или эклогитов) и перидотитов. Это согласуется с аргументами Лута и Штахеля (Luth, Stachel, 2014) о том, что окисление железа в природном перидотите является недостаточно эффективным механизмом образования алмазов. Наши исследования предполагают существование дополнительных возможностей образования алмазов, не связанных с вариациями значений Fe3+/Fe2+ в минералах и расплавах.
Количество алмазов, образующихся при восстановлении метаосадков ограничено только исходным содержанием карбонатов, которое существенно варьирует и может быть очень высоким. Это может быть причиной образования эклогитов с очень высоким содержанием алмазов. Вероятность образования богатых алмазом перидотитов мала, поскольку их образование ограничено небольшим содержанием углерода: 16–30 ppm C в источнике MORB (Dasgupta, Hirschmann, 2010), 100 ppm в примитивной мантии Земли (Palme, O’Neill, 2014), и ~260 ppm в источнике базальтов океанических островов (Anderson, Poland, 2017). Алмаз мог образоваться в перидотите в результате восстановления метасоматизирующего карбонатного расплава (флюида) в присутствии локального восстановителя (металлическое железо или бедный Fe3+ гранат) (Matjuschkin et al., 2020). Но количество такого алмаза не может быть высоким, поскольку содержания восстановителей и карбонатного расплава в перидотите небольшое (Gardes et al., 2020).
Систематика стабильных изотопов (С, N, О) в алмазах и включениях в них противоречива (Cartigny et al., 2014). Несмотря на широкий интервал значений δ13C в алмазах из эклогитов, эклогитовые и перидотитовые алмазы имеют сходные значения δ13C, близкие к значениям астеносферной мантии (–5‰). За исключением некоторых случаев (эклогитовые алмазы Аргайла и Ягерсфонтейна), изотопы С не указывают на коровое происхождение. Напротив, признаки корового происхождения установлены в силикатных включениях из эклогитовых алмазов. Наиболее благоприятная среда для формирования богатых алмазами эклогитов – перидотитовая матрица с относительно небольшими включениями карбонатизированных коровых пород. В таких системах расплав появляется первоначально в метабазите или метаосадке, но, благодаря окислительно-восстановительным реакциям, зона плавления перемещается в перидотит. Противоположные объемные эффекты реакций декарбонатизации метаосадка или метабазита и карбонатизации перидотита препятствуют инфильтрации расплава в перидотит. Наоборот, частичный расплав из карбонатизированного перидотита будет легко мигрировать в восстановленный метаосадок или метабазит. Возможно достижение изотопного равновесия между доминирующим перидотитом и включением метаосадка или метабазита. Это может быть объяснением мантийных значений δ13C в эклогитовых алмазах.
Проявление механизмов окислительно-восстановительной эволюции, описанных в этой статье, не исключает протекания ROF за счет окисления металлической фазы в мантийном перидотите (Rohrbach, Schmidt, 2011) или FeO в силикатных минералах. Мы только подчеркиваем, что оба механизма должны рассматриваться при анализе окислительно-восстановительных процессов и круговорота углерода в мантии.
Авторы признательны Томасу Каутцу за помощь в проведении экспериментов, а также А.Л. Перчуку (МГУ) и О.Г. Сафонову (ИЭМ РАН) за внимательный анализ рукописи и ценные замечания и предложения.
Работа выполнена при финансовой поддержке Немецкого научного общества (Deutsche Forschungsgemeinschaft) и в рамках тем Государственного задания ИГЕМ РАН и ГЕОХИ РАН (0137-2019-0014).
Список литературы
Ali R.A.M., Maurice A.E., Pitcairn I.K., Ahmed A.H., Azer M.K., Boskabadi A., Bakhit B.R., Shahien M.G. (2020) Neoproterozoic and Cretaceous mantle oxidation states: Controls and heterogeneity through time. Lithos. 356–357, 105 375.
Alt J.C., Teagle D.A.H. (1999) The uptake of carbon during alteration of ocean crust. Geochim. Cosmochim. Acta. 63, 1527-1535.
Anderson K.R., Poland M.P. (2017) Abundant carbon in the mantle beneath Hawai‘i. Nature Geosci. 10, 704-708.
Arima M., Kozai Y., Akaishi M. (2002) Diamond nucleation and growth by reduction of carbonate melts under high-pressure and high-temperature conditions. Geology. 30, 691-694.
Ballhaus C. (1995) Is the upper mantle metal-saturated? Earth Planet. Sci. Lett. 132, 75-86.
Bebout G.E. (2007) Metamorphic chemical geodynamics of subduction zones. Earth Planet. Sci. Lett. 260, 373-393.
Bebout G.E., Barton M.D. (1993) Metasomatism during subduction: products and possible paths in the Catalina Schist, California. Chem. Geol. 108, 61-92.
Behrens H., Zhang Y., Leschik M., Wiedenbeck M., Heide G., Frischat G.H. (2007) Molecular H2O as carrier for oxygen diffusion in hydrous silicate melts. Earth Planet. Sci. Lett. 254, 69-76.
Berman R.G. (1990) Mixing properties of Ca–Mg–Fe–Mn garnets. Am. Mineral. 75, 328-344.
Biellmann C., Gillet P., Peyronneau J. (1993) Experimental evidence for carbonate stability in the Earth’s lower mantle. Earth Planet. Sci. Lett. 118, 31-41.
Brey G.P., Bulatov V.K., Girnis A.V., Lahaye Y. (2008) Experimental melting of carbonated peridotite at 6–10 GPa. J. Petrol. 49, 797-821.
Brey G.P., Girnis A.V., Bulatov V.K., Hofer H.E., Gerdes A., Woodland A.B. (2015) Reduced sediment melting at 7.5–12 GPa: phase relations, geochemical signals and diamond nucleation. Contrib. Mineral. Petrol. 170, 18.
Brounce M.N., Kelley K.A., Cottrell E. (2014) Variations in Fe3+/ΣFe of Mariana Arc Basalts and Mantle Wedge fO2. J. Petrol. 55, 2513-2536.
Brounce M., Cottrell E., Kelley K.A. (2019) The redox budget of the Mariana subduction zone. Earth Planet. Sci. Lett. 528, 115859.
Bulatov V.K., Brey G.P., Girnis A.V., Gerdes A., Höfer H.E. (2014) Carbonated sediment–peridotite interaction and melting at 7.5–12 GPa. Lithos. 200–201, 368-385.
Burnham A.D., Bulanova G.P., Smith C.B., Whitehead S.C., Kohn S.C., Gobbo L., Walter M.J. (2016) Diamonds from the Machado River alluvial deposit, Rondônia, Brazil, derived from both lithospheric and sublithospheric mantle. Lithos. 265, 199-213.
Busigny V., Cartigny P., Philippot P., Ader M., Javoy M. (2003) Massive recycling of nitrogen and other fluid-mobile elements (K, Rb, Cs, H) in a cold slab environment: evidence from HP to UHP oceanic metasediments of the Schistes Lustres nappe (western Alps, Europe). Earth Planet. Sci. Lett. 215, 27-42.
Canil D., Scarfe C.M. (1990) Phase relations in peridotite + + CO2 systems to 12 GPa: implications for the origin of kimberlite and carbonate stability in the Earth’s upper mantle. J. Geophys. Res. Solid Earth. 95, 15805-15816.
Cannao E., Tiepolo M., Bebout G.E., Scambelluri M. (2020) Into the deep and beyond: Carbon and nitrogen subduction recycling in secondary peridotites. Earth Planet. Sci. Lett. 543, 116328.
Cartigny P., Palot M., Thomassot E., Harris J.W. (2014) Diamond formation: A stable isotope perspective. Annu. Rev. Earth Planet. Sci. 42, 699-732.
Chinn I.L., Perritt S.H., Stiefenhofer J., Stern R.A. (2018) Diamonds from Orapa Mine show a clear subduction signature in SIMS stable isotope data. Mineral. Petrol. 112 (Suppl. 1): S197-S207.
Dalton J.A., Wood B.J. (1993) The partitioning of Fe and Mg between olivine and carbonate and the stability of carbonate under mantle conditions. Contrib. Mineral. Petrol. 114, 501-509.
Dasgupta R., Hirschmann M.M. (2010) The deep carbon cycle and melting in Earth’s interior. Earth Planet. Sci. Lett. 298, 1-13.
Debret B., Bouilhol P., Pons M.L., Williams H. (2018) Carbonate transfer during the onset of slab devolatilization: new insights from Fe and Zn stable isotopes. J. Petrol. 59, 1145-1166.
Drewitt J.W.E., Walter M.J., Zhang H., McMahon S.C., Edwards D., Heinen B.J., Lord O.T., Anzellini S., Kleppe A.K. (2019) The fate of carbonate in oceanic crust subducted into Earth’s lower mantle. Earth Planet. Sci. Lett. 511, 213-222.
Eggler D.H., Baker D.R. (1982) Reduced volatiles in the system C–O–H: implications to mantle melting, fluid formation, and diamond genesis. In High-Pressure Research in Geophysics (Eds. Akimoto S., Manghnani M.H.). Tokyo, 237-250.
Eguchi J., Dasgupta R. (2017) CO2 content of andesitic melts at graphite-saturated upper mantle conditions with implications for redox state of oceanic basalt source regions and remobilization of reduced carbon from subducted eclogite. Contrib. Mineral. Petrol. 172, 12.
Fedortchouk Y. (2019) A new approach to understanding diamond surface features based on a review of experimental and natural diamond studies. Earth-Sci. Rev. 193, 45-65.
Fedortchouk Y., Zhang Z. (2011) Diamond resorption: link to metasomatic events in the mantle or record of magmatic fluid in kimberlitic magma? Can. Mineral. 49, 707-719.
Fedortchouk Y., Liebske C., McCammon C. (2019) Diamond destruction and growth during mantle metasomatism: An experimental study of diamond resorption features. Earth Planet. Sci. Lett. 506, 493-506.
Förster M.W., Bussweiler Y., Prelevic D., Daczko N.R., Buhre S., Mertz-Kraus R., Foley S.F. (2021) Sediment-peridotite reaction controls fore-arc metasomatism and arc magma geochemical signatures. Geosci., 11, 372.
Frost D.J., McCammon C.A. (2008) The redox state of Earth’s mantle. Annu. Rev. Earth Planet. Sci. 36, 389-420.
Frost D.J., Liebske C., Langenhorst F., McCammon C.A., Trønnes R.G., Rubie D.C. (2004) Experimental evidence for the existence of iron-rich metal in the Earth’s lower mantle. Nature 428, 409-412.
Galvez M.E., Beyssac O., Martinez I., Benzerara K., Chaduteau K., Malvoisin B., Malavieille J. (2013) Graphite formation by carbonate reduction during subduction. Nature Geosci. 6, 473-477.
Gardes E., Laumonier M., Massuyeau M., Gaillard F. (2020) Unravelling partial melt distribution in the oceanic low velocity zone. Earth Planet. Sci. Lett. 540, 116242.
Gerrits A.R., Inglis E.C., Dragovic B., Starr P.G., Baxter E.F., Burton K.W. (2019) Release of oxidizing fluids in subduction zones recorded by iron isotope zonation in garnet. Nature Geosci. 12, 1029-1033.
Girnis A.V., Brey G.P., Bulatov V.K., Höfer H.E., Woodland A.B. (2018) Graphite to diamond transformation during sediment–peridotite interaction at 7.5 and 10.5 GPa. Lithos. 310–311, 302-313.
Gorce J.S., Caddick M.J., Bodnar R.J. (2019) Thermodynamic constraints on carbonate stability and carbon volatility during subduction. Earth Planet. Sci. Lett. 519, 213-222.
Hammouda T., Laporte D. (2000) Ultrafast mantle impregnation by carbonatite melts. Geology. 28, 283-285.
Holland T.J.B., Powell R. (2011) An improved and extended internally consistent thermodynamic dataset for phases of petrological interest, involving a new equation of state for solids. J. Metamor. Geol. 29, 333-383.
Isshiki M., Irifune T., Hirose K., Ono S., Ohishi Y., Watanuki T., Nishibori E., Takata M., Sakata M. (2004) Stability of magnesite and its high-pressure form in the lowermost mantle. Nature. 427, 60-63.
Jacob D.E., Piazolo S., Schreiber A., Trimby P. (2016) Redox-freezing and nucleation of diamond via magnetite formation in the Earth’s mantle. Nature Commun. 7, 11891.
Kerrick D.M., Connolly J. (1998) Subduction of ophicarbonates and recycling of CO2 and H2O. Geology. 26, 375-378.
Kopylova M., Navon O., Dubrovinsky L., Khachatryan G. (2010) Carbonatitic mineralogy of natural diamond-forming fluids. Earth Planet. Sci. Lett., 291, 126-137.
Korsakov A.V., Hermann J. (2006) Silicate and carbonate melt inclusions associated with diamonds in deeply subducted carbonate rocks. Earth Planet. Sci. Lett. 241, 104-118.
Li Y.-H., Schoonmaker J.E. (2003) Chemical composition and mineralogy of marine sediments. In Treatise on Geochemistry 7, 1-35.
Logvinova A.M., Shatskiy A., Wirth R., Tomilenko A.A., Ugap’eva S.S., Sobolev N.V. (2019) Carbonatite melt in type Ia gem diamond. Lithos. 342–343, 463-467.
Luth R.W. (1993) Diamonds eclogites, and the oxidation state of the Earth’s mantle. Science. 261, 66-68.
Luth R.W. (1999) Carbon and carbonates in the mantle. In Mantle Petrology: Field Observations and High Pressure Experimentation: A Tribute to Francis R. (Joe) Boyd (Eds. Fei Y., Bertka C.M., Mysen, B.O.). The Geochemical Society. 297-316
Luth R.W., Stachel T. (2014) The buffering capacity of lithospheric mantle: implications for diamond formation. Contrib. Mineral. Petrol. 168, 1083.
Martin A.M., Hammouda T. (2011) Role of iron and reducing conditions on the stability of dolomite + coesite between 4.25 and 6 GPa – a potential mechanism for diamond formation during subduction. Eur. J. Mineral. 23, 5-16.
Martirosyan N.S., Litasov K.D., Shatskiy A., Ohtani E. (2015) Reactions of iron with calcium carbonate at 6 GPa and 1273–1873 K: implications for carbonate reduction in the deep mantle. Russ. Geol. Geophys. 56, 1322-1331.
Martirosyan N.S., Yoshino T., Shatskiy A., Chanyshev A., Litasov K. (2016) The CaCO3–Fe interaction: Kinetic approach for carbonate subduction to the deep Earth’s mantle. Phys. Earth Planet. Int. 259, 1-9.
Martirosyan N.S., Shatskiy A., Chanyshev A.D., Litasov K.D., Podborodnikov I.V., Yoshino T. (2019) Effect of water on the magnesite–iron interaction, with implications for the fate of carbonates in the deep mantle. Lithos. 326–327, 435-445.
Matjuschkin V., Woodland A.B., Frost D., Yaxley G.M. (2020) Reduced methane-bearing fluids as a source for diamond. Sci. Rep. 10, 6961.
Menzel M.D., Garrido C.J., Sanchez-Vizcaino V.L., Hidas K., Marchesi C. (2019) Subduction metamorphism of serpentinite-hosted carbonates beyond antigorite–serpentinite dehydration (Nevado–Filabride Complex, Spain). J. Metamorph. Geol. 37, 681-715.
Messiga B., Kienast J.R., Rebay G., Riccardi M.P., Tribuzio R. (1999) Cr-rich magnesiochloritoid eclogites from the Monviso ophiolites (Western Alps, Italy). J. Metamorph. Geol. 17, 287-299.
Mikhail S., McCubbin F.M., Jenner F.E., Shirey S.B., Rumble D., Bowden R. (2019) Diamondites: evidence for a distinct tectono-thermal diamond‑forming event beneath the Kaapvaal craton. Contrib. Mineral. Petrol. 174, 71.
Morishima H., Kato T., Suto M., Ohtani E., Urakawa S., Utsumi W., Shimomura O., Kikegawa T. (1994) The phase boundary between α- and ß-Mg2SiO4 determined by in situ X-ray observation. Science. 265, 1202-1203.
Moussallam Y., Longpré M.-A., McCammon C., Gomez-Ulla A., Rose-Koga E.F., Scaillet B., Peters N., Gennaro E., Paris R., Oppenheimer C. (2019) Mantle plumes are oxidised. Earth Planet. Sci. Lett. 527, 115 798.
Mposkos E., Baziotis I., Proyer A. (2010) Metamorphic reprocessing of a serpentinized carbonate-bearing peridotite after detachment from the mantle wedge: A P–T path constrained from textures and phase diagrams in the system CaO–MgO–Al2O3–SiO2–CO2–H2O. Lithos. 118, 349-364.
Mukherjee B.K., Sachan H.K., Ogasawara Y., Muko A., Yoshioka N. (2003) Carbonate-bearing UHPM rocks from the Tso-Morari region, Ladakh, India: petrological implications. Int. Geol. Rev. 45, 49-69.
Navon O., Hutcheon I.D., Rossman G.R., Wasserburg G.J. (1988) Mantle-derived fluids in diamond micro-inclusions. Nature 335, 784-789.
Palme H., O’Neill H.St.C. (2014) Cosmochemical estimates of mantle composition. In Treatise on Geochemistry. 2nd Ed. Elsevier. 3, 1-39.
Pal’yanov Y.N., Sokol A.G., Borzdov Y.M., Khokhryakov A.F. (2002) Fluid-bearing alkaline–carbonate melts as the medium for the formation of diamonds in the Earth’s mantle: an experimental study. Lithos. 60, 145-159.
Pal’yanov Y.N., Sokol A.G., Tomilenko A.A., Sobolev N.V. (2005) Conditions of diamond formation through carbonate-silicate interaction. Eur. J. Mineral. 17, 207-214.
Palyanov Y.N., Bataleva Y.V., Sokol A.G., Borzdov Y.M., Kupriyanov I.N., Reutsky V.N., Sobolev N.V. (2013) Mantle–slab interaction and redox mechanism of diamond formation. Proc. Nat. Acad. Sci. 11, 20408-20413.
Perchuk A.L., Yapaskurt V.O., Griffin W.L., Shur M.Y. Gain S.E.M. (2018) Three types of element fluxes from metabasite into peridotite in analogue experiments: Insights into subduction-zone processes. Lithos, 302, 203-223.
Perchuk A.L., Serdyuk A.A., Zinovieva N.G. (2019) Subduction sediment-lherzolite interaction at 2.9 GPa: Effects of metasomatism and partial melting. Petrology, 27, 467-488.
Petts D.C., Stachel T., Stern R.A., Hunt L., Fomradas G. (2016) Multiple carbon and nitrogen sources associated with the parental mantle fluids of fibrous diamonds from Diavik, Canada, revealed by SIMS microanalysis. Contrib. Mineral. Petrol. 171, 17.
Plank T., Langmuir C.H. (1998) The chemical composition of subducting sediment and its consequences for the crust and mantle. Chem. Geol. 145, 325-394.
Plank T., Manning C.E. (2019) Subducting carbon. Nature. 574, 343-352.
Poli S. (2015) Carbon mobilized at shallow depths in subduction zones by carbonatitic liquids. Nature Geosci. 8, 633-636.
Rohrbach A., Schmidt M.W. (2011) Redox freezing and melting in the Earth’s deep mantle resulting from carbon–iron redox coupling. Nature. 472, 209-212.
Rohrbach A., Ballhaus C., Golla-Schindler U., Ulmer P., Kamenetsky V.S., Kuzmin D.V. (2007) Metal saturation in the upper mantle. Nature. 449, 456-458.
Rosenthal A., Yaxley G.M., Green D.H., Hermann J., Kovács I., Spandler C. (2014) Continuous eclogite melting and variable refertilisation in upwelling heterogeneous mantle. Sci. Rep. 4, 6099.
Ross N.L., Akaogi M., Navrotsky A., Susaki J., McMillan P. (1986) Phase transitions among the CaGeO3 polymorphs (wollastonite, garnet, and perovskite structures): studies by high-pressure synthesis, high-temperature calorimetry, and vibrational spectroscopy and calculation. J. Geophys. Res. 91, 4685-4696.
Ryabchikov I.D., Green D.H., Wall V.J., Brey G. (1981) The oxidation state of carbon in the environment of the reduced-velocity zone. Geochem. Int. 18, 148-158.
Santos S.S.M., Marcondes M.L., Justo J.F., Assali L.V.C. (2019) Stability of calcium and magnesium carbonates at Earth’s lower mantle thermodynamic conditions. Earth Planet. Sci. Lett. 506, 1-7.
Scambelluri M., Van Roermund H.L.M., Pettke T. (2010) Mantle wedge peridotites: Fossil reservoirs of deep subduction zone processes Inferences from high and ultrahigh-pressure rocks from Bardane (Western Norway) and Ulten (Italian Alps). Lithos. 120, 186-201.
Sharygin I.S., Shatskiy A., Litasov K.D., Golovin A.D., Ohtani E., Pokhilenko N.P. (2018) Interaction of peridotite with Ca-rich carbonatite melt at 3.1 and 6.5 GPa: Implication for merwinite formation in upper mantle, and for the metasomatic origin of sublithospheric diamonds with Ca-rich suite of inclusions. Contrib. Mineral. Petrol. 173, 22.
Shirey S.B., Cartigny P., Frost D.G., Keshav S., Nestola F., Nimis P., Pearson D.G., Sobolev N.V., Walter M.J. (2013) Diamonds and the geology of mantle carbon. Rev. Mineral. Geochem. 75, 355-421.
Skuzovatov S.Y., Zedgenizov D.A. (2019) Protracted fluid-metasomatism of the Siberian diamondiferous subcontinental lithospheric mantle as recorded in coated, cloudy and monocrystalline diamonds. Mineral. Petrol. 113, 285-306.
Smart K.A., Heaman L.M., Chacko T., Simonetti A., Kopylova M., Mah D., Daniels D. (2009) The origin of high-MgO diamond eclogites from the Jericho Kimberlite, Canada. Earth Planet. Sci. Lett. 284, 527-537.
Smart K.A., Tappe S., Stern R.A., Webb S.J., Ashwal L.D. (2016) Early Archaean tectonics and mantle redox recorded in Witwatersrand diamonds. Nature Geosci. 9, 255-259.
Smith C.B., Walter M.J., Bulanova G.P., Mikhail S., Burnham A.D., Gobbo L., Kohn S.C. (2016) Diamonds from Dachine, French Guiana: a unique record of early Proterozoic subduction. Lithos. 265, 82-95.
Smit K.V., Stachel T., Luth R.W., Stern R.A. (2019) Evaluating mechanisms for eclogitic diamond growth: An example from Zimmi Neoproterozoic diamonds (West African craton). Chem. Geol. 520, 21-32.
Stachel T., Luth R.W. (2015) Diamond formation – Where, when and how? Lithos. 220–223, 200-220.
Stagno V., Frost D.J. (2010) Carbon speciation in the asthenosphere: Experimental measurements of the redox conditions at which carbonate-bearing melts coexist with graphite or diamond in peridotite assemblages. Earth Planet. Sci. Lett. 300, 72-84.
Stagno V., Frost D.J., McCammon C.A., Mohseni H., Fei Y. (2015) The oxygen fugacity at which graphite or diamond forms from carbonate-bearing melts in eclogitic rocks. Contrib. Mineral. Petrol. 169, 16.
Staudigel H., Hart S.R., Schmincke H.-U., Smith B.M. (1989) Cretaceous ocean crust at DSDP Sites 417 and 418: Carbon uptake from weathering versus loss by magmatic outgassing. Geochim. Cosmochim. Acta. 53, 3091-3094.
Sun C., Dasgupta R. (2019) Slab–mantle interaction, carbon transport, and kimberlite generation in the deep upper mantle. Earth Planet. Sci. Lett. 506, 38-52.
Syracuse E.M., van Keken P.E., Abers G.A. (2010) The global range of subduction zone thermal models. Phys. Earth. Planet. Int. 183, 73-90.
Tappert R., Stachel T., Harris J.W., Muehlenbachs K., Ludwig T., Brey G.P. (2005) Diamonds from Jagersfontein (South Africa): messengers from the sublithospheric mantle. Contrib. Mineral. Petrol. 150, 505-522.
Timmerman S., Honda M., Zhang X., Jaques A.L., Bulanova G., Smith C.B., Burnham A.D. (2019) Contrasting noble gas compositions of peridotitic and eclogitic monocrystalline diamonds from the Argyle lamproite, Western Australia. Lithos. 344–345, 193-206.
Uenver-Thiele L., Woodland A.B., Downes H., Altherr R. (2014) Oxidation state of the lithospheric mantle below the Massif Central, France. J. Petrol. 55, 2457-2479.
Uenver-Thiele L., Woodland A.B., Seitz H.-M., Downes H., Altherr R. (2017) Metasomatic processes revealed by trace element and redox signatures of the lithospheric mantle beneath the Massif Central, France. J. Petrol. 58, 395-422.
von Seckendorff V., O’Neill H.St.C. (1993) An experimental study of Fe–Mg partitioning between olivine and orthopyroxene at 1173, 1273 and 1423 K and 1.6 GPa. Contrib. Mineral. Petrol. 113, 196-207.
Watson E.B. (1991) Diffusion in fluid-bearing and slightly-melted rocks: experimental and numerical approaches illustrated by iron transport in dunite. Contrib. Mineral. Petrol. 107, 417–434.
Wiser N.M., Wood B.J. (1991) Experimental determination of activities in Fe–Mg olivine at 1400 K. Contrib. Mineral. Petrol. 108, 146-153.
Wood B.J., Bryndzia L.T., Johnson K.E. (1990) Mantle oxidation state and its relationship to tectonic environment and fluid speciation. Science. 248, 337-345.
Woodland A.B., Bulatov V.K., Brey G.P., Girnis A.V., Höfer H.E., Gerdes A. (2018) Subduction factory in an ampoule: Experiments on sediment–peridotite interaction under temperature gradient conditions. Geochim. Cosmochim. Acta. 223, 319-349.
Yaxley G.M., Green D.H. (1994) Experimental demonstration of refractory carbonate-bearing eclogite and siliceous melt in the subduction regime. Earth Planet. Sci. Lett. 128, 313-325.
Yaxley G.M., Berry A.J., Rosenthal A., Woodland A.B., Paterson D., (2017) Redox preconditioning deep cratonic lithosphere for kimberlite genesis – evidence from the central Slave Craton. Nature Sci. Rep. 7, 30.
Zhang J., Li B., Utsumi W., Liebermann R.C. (1996) In situ X-ray observations of the coesite–stishovite transition: reversed phase boundary and kinetics. Phys. Chem. Miner. 23, 1-10.
Zhang L., Ellis D.J., Williams S., Jiang W. (2002) Ultra-high pressure metamorphism in western Tianshan, China: Part II. Evidence from magnesite in eclogite. Am. Mineral. 87, 861-866.
Zhang Y., Ni H. (2010) Diffusion of H, C, and O components in silicate melts. Rev. Mineral. Geoch. 72, 171-255.
Zhang Z., Fedortchouk Y. (2012) Records of mantle metasomatism in the morphology of diamonds from the Slave craton. Eur. J. Mineral. 24, 619-632.
Zhao S., Schettino E., Merlini M., Poli S. (2019) The stability and melting of aragonite: An experimental and thermodynamic model for carbonated eclogites in the mantle. Lithos. 324–325, 105-114.
Zhu F., Li J., Liu J., Lai X., Chen B., Meng Y. (2019) Kinetic control on the depth distribution of superdeep diamonds. Geophys. Res. Lett. 46, 1984-1992.
Zhu J., Zhang L., Tao R., Fei Y. (2020) The formation of graphite-rich eclogite vein in S.W. Tianshan (China) and its implication for deep carbon cycling in subduction zone. Chem. Geol. 533, 119430.
Дополнительные материалы отсутствуют.