Геохимия, 2022, T. 67, № 9, стр. 881-895
Оценка потоков биогенных веществ на границе раздела вода–дно в мелководных бассейнах залива Петра Великого (Японское море)
П. Я. Тищенко a, *, Г. В. Борисенко b, Ю. А. Барабанщиков a, Г. Ю. Павлова a, А. А. Рюмина a, С. Г. Сагалаев a, П. Ю. Семкин a, П. П. Тищенко a, О. А. Уланова a, М. Г. Швецова a, Е. М. Шкирникова a
a Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, ул. Балтийская, 43, Россия
b Институт океанологии им. П.П. Ширшова
Москва, Россия
* E-mail: tpavel@poi.dvo.ru
Поступила в редакцию 18.05.2021
После доработки 06.08.2021
Принята к публикации 17.08.2021
- EDN: ILJBJX
- DOI: 10.31857/S0016752522090084
Аннотация
В сентябре–октябре 2019 г. проведены геохимические исследования трех мелководных бассейнов залива Петра Великого: б. Воевода, б. Новгородская, зал. Угловой. На двух станциях каждого бассейна были выполнены: отбор проб воды в 10 см от дна с последующим измерением гидрохимических параметров, анализ состава поровой воды в кернах, а также процентное содержание органического углерода (ОУ), гуминовых, фульвовых кислот, хлорофилла а в твердой фазе осадков. Коэффициенты биотурбации были оценены из данных о концентрации хлорофилла в донных осадках. Проведены модельные расчеты потоков биогенных веществ (аммония, общего азота, фосфора, общего фосфора, кремния) и растворенного органического углерода (РОУ). Установлено, что потоки биогенных веществ и РОУ из донных осадков в морскую воду, оцененные с учетом биотурбации, примерно на порядок больше потоков, рассчитанных по закону Фика. Наибольшие концентрации ОУ в твердой фазе осадка, 6.5 и 5.5%, соответствовали верхнему слою в кернах, отобранных в местах, покрытых зостерой морской в б. Воевода и Новгородская, соответственно. Самые высокие потоки биогенных веществ и РОУ на границе раздела вода–дно были получены для станции в б. Новгородская, где содержание ОУ в верхнем слое осадка составляло 2.8%. Величины годовых потоков биогенных веществ на границе раздела вода–дно были соизмеримы со средними годовыми потоками этих соединений, приходящимися на единицу площади Амурского залива от суммарных стоков реки Раздольной и коммунальных впусков г. Владивостока.
ВВЕДЕНИЕ
В 70-х годах прошлого века в результате выполнения международной программы глубоководного бурения (Deep-Sea Drilling Project) было установлено, что донные осадки морей и океанов пропитаны морской водой, химический состав которой отличается от химического состава морской воды (Gieskes, 1975). Как правило, поровая вода донных осадков обогащена ионами натрия, кальция, щелочным резервом и обеднена ионами магния и калия по отношению к морской воде (Sayles, 1979). Процессы, приводящие к изменению химического состава поровой воды, были названы диагенезом донных осадков (Berner, 1980). Движущей силой химических преобразований в поровой и морской водах является органическое вещество (ОВ), которое образуется в эвфотическом слое, а затем через пищевую цепь в форме детрита поступает в донные осадки морских бассейнов (de la Rocha, 2006). Результатом диагенеза ОВ является не только изменение макрокомпонентного состава поровой воды, но и ее обогащение биогенными веществами (растворенными формами азота, фосфора, кремния, углерода) (Lerman, 1978; Emersen, Hedges, 2006). Различия в химических составах поровой и морской вод формируют разнонаправленные потоки растворенных веществ на границе раздела вода–дно. Величина этих потоков зависит от многих факторов, однако наиболее важным из них, является интенсивность диагенеза ОВ, которая, в свою очередь, зависит от величины потока взвешенной формы ОВ из эвфотического слоя в донные осадки. Для глубоководных бассейнов (более 1000 м) 90% от общей биомассы ОВ, синтезированного в эвфотическом слое, окисляется в водной толще в процессе осаждения детрита, и лишь небольшая его доля достигает дна, где происходит захоронение с последующим его разложением (Волков, 1979; Emersen, Hedges, 2006). Для шельфовых вод ситуация противоположная: 80–90% синтезированной в эвфотическом слое биомассы ОВ достигает дна и обогащает собой осадки. В настоящее время проводятся широкомасштабные исследования по изучению обменных процессов на границе раздела вода-дно для открытых морей, океанов и шельфа (например, Вершинин, 1999; Лейн и др., 2007; Романкевич и др., 2009; Rullkotter, 2006; Shults, 2006). Гораздо меньше внимания уделено мелководным бассейнам, в которых фотосинтетически активная радиация (ФАР) достигает дна. В этом случае поток продуктов диагенеза ОВ – биогенных веществ можно рассматриваться как эвтрофикация бассейна, поскольку в присутствии ФАР этот поток будет интенсифицировать первичную продукцию. Именно этот случай исследуется в данной работе. Другая важная особенность донных осадков мелководных бассейнов состоит в том, что они содержат в себе высокую плотность живых организмов (двустворчатые моллюски, полихеты, офиуры и т.д.). Жизнедеятельность инфауны обеспечивает перемешивание донных осадков (биотурбацию) и закачивает придонную воду во внутрь осадков (ирригацию), тем самым увеличивает обменные процессы на границе раздела вода-дно (Berner, 1980; Boudreau, 1997).
Цель данной статьи – оценка потоков биогенных веществ на границе раздела вода–дно и установление их возможного влияния на экосистемы мелководных бассейнов.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бухта Воевода и залив Угловой являются мелководными бассейнами второго порядка Амурского залива, а б. Новгородская – бассейн второго порядка залива Посьета (рис. 1). Площадь исследуемых бассейнов равна 4, 31 и 42 км2 для бухт Воевода, Новгородская и залива Угловой, соответственно. Глубины большей части акваторий бухт менее 5 м, для залива Угловой максимальная глубина 3.6 м поэтому работы проводились на резиновой лодке. Краткое географическое описание исследуемых бассейнов дано в Лоции (1996), а более подробное можно найти в работах (Блиновская, 2001; Барабанщиков и др., 2015; Тищенко и др., 2021). Бухты Воевода и Новгородская частично покрыты зарослями зостеры морской (Zostera marina L.), в заливе Угловой морские травы отсутствуют. На все бассейны оказывается сильное антропогенное воздействие. Бухты являются местом развития марикультур (выращивание мидий, гребешка, трепанга) (Барабанщиков и др., 2018; Гаврилова, Кондратьева, 2018), а залив Угловой подвергается сбросу коммунальных стоков (Тищенко и др., 2021). Гидролого-гидрохимические наблюдения проводились 11–12 сентября, 24 сентября и 1–3 октября 2019 г. в б. Воевода, б. Новгородская и зал. Угловой, соответственно.
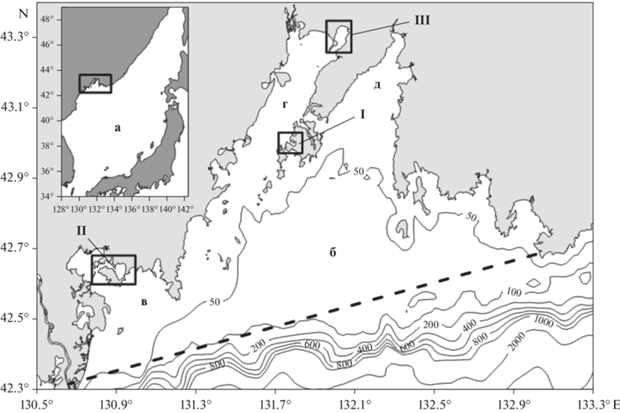
Рис. 1.
Географическое положение изучаемого района: а – Японское море; б – залив Петра Великого; в – залив Посьета; г – Амурский залив; д – Уссурийский залив. I – бухта Воевода; II – бухта Новгородская; III – залив Угловой. Пунктирная линия указывает внешнюю границу залива.
Для общей характеристики состояния экосистем изучали распределение биогенных веществ (аммоний, общий азот, растворенный фосфор, общий фосфор, растворенный кремний) в поверхностных и придонных горизонтах в – бухтах Воевода, Новгородская и заливе Угловой. Для каждого бассейна отбирали керны донных осадков, в которых изучали вертикальное распределение биогенных веществ. Из вертикального распределения гидрохимических параметров поровой воды и придонной воды оценивали потоки биогенных веществ из донных осадков в придонную воду.
На каждой станции осуществляли зондирование воды зондом Sea-Bird-19 plus V2, и измеряли глубину видимости диска Секки. Отбор проб поверхностной воды производили батометром Нискина, с придонного горизонта с помощью насоса на расстоянии 10 см от дна. Следующие анализы в образцах воды были выполнены: содержание хлорофилла а, концентрации растворенного органического углерода (РОУ) и биогенных веществ (фосфаты, силикаты, ион аммония, общий азот и фосфор). Также вели подводное фотографирование дна. Для каждого из бассейнов, отбор донных осадков осуществляли прямоточной геологической трубкой (1 м) в двух местах: в зарослях травы и в ее отсутствии для бухт Воевода и Новгородская, в северной части залива Угловой, где раньше росла трава (Тищенко и др., 2021), и в южной части залива, где травы ранее не наблюдалось. Точные координаты геохимических станций, дата отбора кернов, глубина места, длина керна и наличие морской травы приведены в таблице 1. На каждой станции отбирали два параллельных керна. Один из кернов использовали для анализа влажности осадка. После поднятия керны во вкладышах помещали в теплоизоляционные тубусы и доставляли в лабораторию, где керны фотографировали, делили на горизонты, с интервалом 10 см. Осадок каждого горизонта отжимали в прессе для получения поровой воды. В поровой воде измеряли, концентрации главных биогенных веществ (фосфаты, силикаты, нитриты, аммоний, общий азот и общий фосфор), РОУ. В твердой фазе осадков определяли процентное содержание ОУ, концентрации гуминовых и фульвовых кислот и хлорофилла а. Описание методов анализа дано в работе (Тищенко и др., 2020).
Таблица 1.
Координаты геохимических станций и дата отбора донных осадков, выполненных в бухтах Воевода (I), Новгородская (II) и заливе Угловой (III)
| № бассейна | № керна | Дата | Широта; долгота | Глубина места, м | Длина керна, см | Зостера | Цвет осадка |
|---|---|---|---|---|---|---|---|
| I | 1 | 16/09/2019 | 43°00.434′ с.ш., 131°47.149′ в.д. | 4.6 | 68 | Да | Черный |
| I | 2 | 18/09/2019 | 42°59°.882′с.ш., 131°47.558′ в.д. | 5.5 | 73 | Нет | Черный |
| II | 3 | 30/09/2019 | 42°38.132′ с.ш., 130°55.334′ в.д. | 4.4 | 87 | Да | Черно-серый |
| II | 4 | 25/09/2019 | 42°39.323′ с.ш., 130°52.326′ в.д. | 5.4 | 83 | Нет | Черно-серый |
| III | 5 | 07/10/2019 | 43°18.744′ с.ш., 132°00.902′ в.д. | 1.7 | 80 | Нет | Серый |
| III | 6 | 10/10/2019 | 43°14.621′ с.ш., 131°58.650′ в.д. | 3.3 | 83.5 | Нет | Серый |
Потоки биогенных веществ через границу раздела вода–дно, обусловленные молекулярной диффузией и осадконакоплением рассчитывали по уравнению (Sayles, 1979):
(1)
${{J}_{i}} = \frac{{C_{i}^{o}{{J}_{s}}}}{{{{\rho }_{s}}}}\left( {\frac{{{{\phi }_{\infty }}}}{{1 - {{\phi }_{\infty }}}}} \right) - {{\phi }_{x}}{{D}_{{ix}}}{{\left. {\frac{{\partial ({{C}_{i}})}}{{\partial x}}} \right|}_{{x = {\text{0}}}}}.$Первый член в соотношении (1) учитывает поток растворенных веществ из придонной воды в осадок в результате осадконакопления, второй член является уравнением Фика. Обозначения в уравнении (1): х – вертикальная координата с положительным направлением “вниз” (м); $C_{i}^{o}$ – концентрация i-го вещества на границе раздела вода-дно мг/м3; ${{J}_{{\text{s}}}}$ – поток твердой фазы в осадок (мг/(м2 год)); ${{\rho }_{s}}$ – плотность влажного осадка (мг/м3); ${{\phi }_{x}},{{\phi }_{\infty }}$ – пористость осадка на горизонте x и при максимальном уплотнении, соответственно; ${{D}_{{ix}}}$ – эффективный коэффициент диффузии вещества i в донном осадке на горизонте х, (м2/c); ${{\partial {{C}_{i}}} \mathord{\left/ {\vphantom {{\partial {{C}_{i}}} {\partial x}}} \right. \kern-0em} {\partial x}}$ – вертикальный градиент концентраций через границу раздела вода–дно (мг/м4). Пористость донных осадков рассчитывали из измерений влажности, ${{w}_{{\text{w}}}},$ по уравнению (Behrens, 1980):
(2)
$\phi = {{{{w}_{{\text{w}}}}{{\rho }_{{{\text{sd}}}}}} \mathord{\left/ {\vphantom {{{{w}_{{\text{w}}}}{{\rho }_{{{\text{sd}}}}}} {({{w}_{{{\text{wd}}}}}{{\rho }_{{{\text{sd}}}}} + {{w}_{{{\text{sd}}}}}{{\rho }_{{\text{w}}}})}}} \right. \kern-0em} {({{w}_{{{\text{wd}}}}}{{\rho }_{{{\text{sd}}}}} + {{w}_{{{\text{sd}}}}}{{\rho }_{{\text{w}}}})}}.$Потоки растворенного фосфора, аммония и кремния из поровой воды в морскую придонную воду были рассчитаны с помощью второго члена уравнения (1). Градиенты концентраций на границе раздела вода–дно рассчитывали с использованием эмпирической зависимости вида:
(3)
$\Delta {{C}_{i}} = {{a}_{1}} + {{a}_{2}}x + {{a}_{3}}{{x}^{2}} + {{a}_{4}}{{x}^{3}} + {{a}_{5}}{{x}^{4}}.$Оценка потоков растворенных веществ в осадках, подвергнутых биотурбации, может быть проведена с помощью дополнительного члена в уравнении (1) (Berner, 1980):
(4)
${{J}_{i}} = \frac{{C_{i}^{o}{{J}_{s}}}}{{{{\rho }_{s}}}}\left( {\frac{{{{\phi }_{\infty }}}}{{1 - {{\phi }_{\infty }}}}} \right) - {{\phi }_{x}}{{D}_{{ix}}}{{\left. {\frac{{\partial ({{C}_{i}})}}{{\partial x}}} \right|}_{{x = {\text{0}}}}} - {{D}_{{\text{B}}}}\frac{{\partial (\varphi {{C}_{i}})}}{{\partial x}},$(5)
$С = ({{С}_{o}} - {{С}_{\infty }})\exp ( - x\sqrt {{{{{k}_{d}}} \mathord{\left/ {\vphantom {{{{k}_{d}}} {{{D}_{{\text{B}}}}}}} \right. \kern-0em} {{{D}_{{\text{B}}}}}})} + {{C}_{\infty }},$РЕЗУЛЬТАТЫ
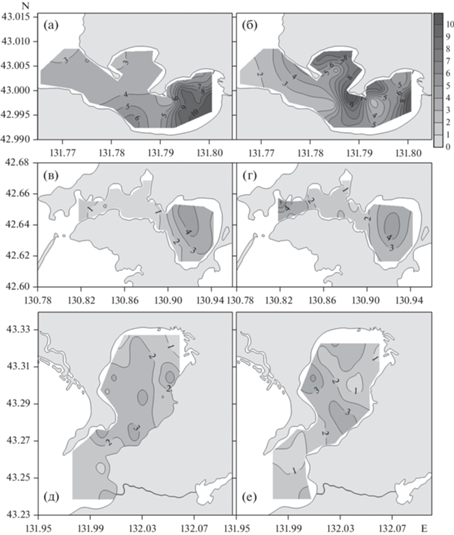
В б. Воевода, б. Новгородская и зал. Угловой было выполнено 28, 20 и 41 гидрохимических станций, соответственно, где было определено содержание биогенных веществ (фосфаты, силикаты, ион аммония, общий азот, общий фосфор) и РОУ. Распределение концентрации общего фосфора в поверхностных и придонных горизонтах исследуемых бассейнов показано на рис. 2. В табл. 2 приведены осредненные гидрохимические характеристики исследуемых бассейнов. Из рис. 2 и табл. 2 видны две тенденции: во-первых, концентрации биогенных веществ в придонных горизонтах, как правило, выше, чем в поверхностных; во-вторых, средние концентрации биогенных веществ, как правило, возрастают в бассейнах в ряду I, II, III (табл. 2). В табл. 2 приведены результаты измерений мутности (FTU – Formazin Turbidity Unit) датчиком для горизонтов, при которых были отобраны пробы воды. Для характеристики глубины фотического слоя бассейнов приведена глубина видимости диска Секки (м). Глубина фотического слоя примерно равна утроенной величине глубины видимости диска Секки (Pilgrim, 1987). Почти для всех станций исследуемых бассейнов глубина фотического слоя превышает глубину бассейна, т.е. интенсивность фотосинтетически активной радиации (ФАР) на дне бассейнов не является параметром, ограничивающим фотосинтез. Концентрации биогенных веществ также не ограничивают фотосинтез в исследуемых бассейнах (табл. 2), что подтверждается достаточно высокой концентрацией хлорофилла а, как в поверхностных, так и придонных горизонтах (рис. 3).
Рис. 2.
Распределение концентрации растворенного общего фосфора (мкмоль/л). В б. Воевода (а, б), б. Новгородская (в, г), зал. Угловой (д, е) (залив Петра Великого, Японское море). Левая панель соответствует поверхностному слою бассейнов, правая панель – придонному слою. Точки соответствуют положению гидрохимических станций. Сентябрь, октябрь, 2019 г.
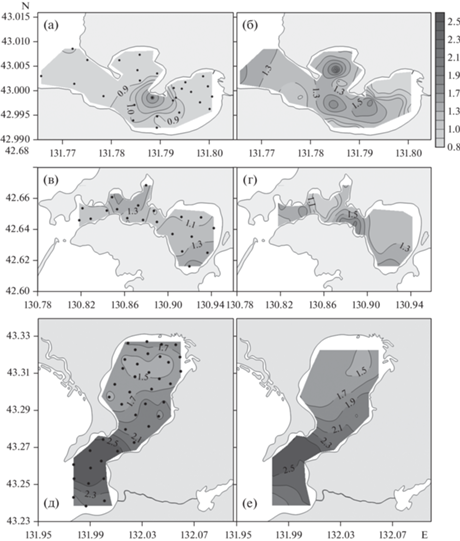
Таблица 2.
Средние концентрации биогенных веществ (растворенный неорганический фосфор – DIP, растворенный общий фосфор – Ptot, растворенный неорганический азот – DIN, растворенный общий азот – Ntot, растворенный кремний – DISi) (мкмоль/л); растворенный органический углерод – РОУ (мгС/л), хлорофилла-а – Chl-a (мкг/л), мутности – Turb (FTU – Formazin Turbidity Unit), глубина видимости диска Секки (м) в бухтах Воевода (I), Новгородская (II) и заливе Угловой (III)
| № бассейна | Горизонт | DIP | Ptot | DIN | Ntot | DISi | РОУ | Сhl-а | Turb | Секки |
|---|---|---|---|---|---|---|---|---|---|---|
| I | Пов-ть | 0.14 | 0.92 | 2.35 | 14.9 | 60 | 3.39 | 5.80 | 228 | 2.5 |
| I | Дно | 0.40 | 1.17 | 2.48 | 12.4 | 43 | 2.43 | 5.65 | 234 | – |
| II | Пов-ть | 0.31 | 1.21 | 0.55 | 15.0 | 30 | 2.67 | 1.78 | 100 | 3.9 |
| II | Дно | 0.51 | 1.30 | 1.16 | 15.6 | 30 | 2.36 | 2.52 | 171 | – |
| III | Пов-ть | 1.11 | 1.92 | 3.52 | 20.5 | 98 | 3.41 | 1.87 | 798 | 1.0 |
| III | Дно | 1.13 | 1.98 | 3.38 | 20.2 | 97 | 3.38 | 1.77 | 867 | – |
Рис. 3.
Распределение концентрации хлорофилла а (мкг/л). В б. Воевода (а, б), б. Новгородская (в, г), зал. Угловой (д, е) (залив Петра Великого, Японское море). Левая панель соответствует поверхностному слою бассейнов, правая панель – придонному слою. Сентябрь, октябрь, 2019 г.
В связи с оценкой потоков биогенных веществ на границе раздела вода–дно, особое внимание уделяется разнице в концентрациях растворенных веществ в поровой воде верхнего горизонта керна (5 см) и придонного горизонта морской воды (10 см от границы раздела). В табл. 3 приведены эти результаты, из которых видно, что концентрации продуктов диагенеза в поровой воде превышают их содержание в придонной воде. Различия в концентрациях могут быть превышены более чем в 80 раз (ст. 1, Ntot). Диагенетические преобразования органического углерода в донных осадках формируют градиент концентрации на границе раздела вода–дно и являются причиной потока растворенных биогенных веществ из поровой воды донных осадков в придонную морскую воду (Berner, 1980). Влажность осадков, как правило, уменьшалась с глубиной колонки, минимальная величина была равна 0.37. Предельным значением влажности была принята величина 0.35. С помощью уравнения (2) рассчитали значение ${{\varphi }_{\infty }},$ равное 0.58. Скорость осадконакопления в акватории Амурского залива (залив Петра Великого), оцененная с помощью радиоизотопа 210Pb, равна 7.2 мм/год (Аникиев и др., 1996). В выполненных нами расчетах была принята скорость 1 см/год. Для оценки потока растворенных веществ в донные осадки (первый член уравнения (1)) были приняты концентрации биогенных веществ морской воды, отобранной в 10 см от дна. Результаты расчетов потоков, $J_{i}^{s},$ обусловленных потоком взвеси, представлены в таблице (4). Градиенты концентраций биогенных веществ, рассчитанные дифференцированием уравнения (3), приведены в табл. 4. Эффективные коэффициенты диффузии, ${{D}_{{ix}}},$ растворенных форм фосфора (анион ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }$ принимался в качестве доминирующего компонента анионов фосфорной кислоты для области рН морской воды), аммония и кремния (ортокремниевая кислота, ${{{\text{H}}}_{{\text{4}}}}{\text{Si}}{{{\text{O}}}_{{\text{4}}}}$) рассчитывали, используя соотношение (Shults, 2006):
(6)
${{D}_{{ix}}} = {{D_{i}^{{{\text{sw}}}}} \mathord{\left/ {\vphantom {{D_{i}^{{{\text{sw}}}}} {{{\theta }^{2}}}}} \right. \kern-0em} {{{\theta }^{2}}}}.$Таблица 3.
Концентрации растворенных веществ в придонной морской воде – мв (10 см от дна) и поровой воде – пв, верхнего горизонта керна (5 см) – DIP (мкмоль/л), Ptot (мкмоль/л), ${\text{NH}}_{{\text{4}}}^{ + }$ (мкмоль/л), Ntot (мкмоль/л), DISi (мкмоль/л), РОУ (мгС/л), а также отношения (R) этих концентраций в поровой воде к придонной морской воде в бухтах Воевода (ст. 1, 2), Новгородская (ст. 3, 4) и заливе Угловой (ст. 5, 6)
| № ст. | Тип воды | DIP | Ptot | ${\text{NH}}_{{\text{4}}}^{ + }$ | Ntot | DISi | РОУ | RDIP | RPtot | RNH4 | RNtot | RSi | RРОУ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | мв | 0.38 | 1.07 | 1.38 | 6.82 | 38.64 | 2.88 | 18 | 25 | 58 | 89 | 14 | 14 |
| 1 | пв | 6.72 | 26.98 | 80.16 | 603.7 | 539.2 | 40.04 | ||||||
| 2 | мв | 0.84 | 1.75 | 3.23 | 9.84 | 46.74 | 1.01 | 8 | 10 | 16 | 28 | 7 | 14 |
| 2 | пв | 6.69 | 16.83 | 49.99 | 278.3 | 303.8 | 13.83 | ||||||
| 3 | мв | 1.90 | 3.18 | 4.92 | 26.74 | 39.49 | 2.28 | 4 | 6 | 19 | 23 | 7 | 12 |
| 3 | пв | 7.56 | 18.22 | 92.13 | 617.2 | 257.4 | 27.93 | ||||||
| 4 | мв | 1.15 | 1.73 | 1.45 | 13.92 | 30.54 | 1.81 | 4 | 7 | 51 | 22 | 10 | 13 |
| 4 | пв | 4.49 | 12.47 | 73.22 | 313.1 | 299.37 | 23.52 | ||||||
| 5 | мв | 1.50 | 2.13 | 2.93 | 17.90 | 99.7 | 3.90 | 1.4 | 3 | 25 | 12 | 2 | 4 |
| 5 | пв | 2.08 | 5.56 | 74.23 | 217.6 | 213.1 | 16.91 | ||||||
| 6 | мв | 1.66 | 2.40 | 3.32 | 15.90 | 50.8 | 1.58 | 3 | 4 | 18 | 15 | 3 | 11 |
| 6 | пв | 5.00 | 9.88 | 59.54 | 238.8 | 147.6 | 17.54 |
Таблица 4.
Характеристики верхнего слоя донных отложений станций 1–6 (влажность – ${{w}_{{\text{w}}}},$ пористость – $\varphi ,$ квадрат извилистости осадка – ${{\theta }^{2}},$ коэффициент биотурбации – ${{D}_{{\text{B}}}},$ см2/сутки); потоки растворенных веществ в донные осадки, обусловленные потоком взвеси ($J_{i}^{s},$ ${\text{мг/(}}{{{\text{м}}}^{{\text{2}}}}\,{\text{год)}}$); градиенты (grad) концентраций на границе раздела “вода–дно”: для РОУ – г/м4, для остальных веществ – ммоль/м4; потоки растворенных веществ из донных осадков в воду, рассчитанные по закону Фика (${{J}_{i}}$) и на основе биотурбации (${{F}_{i}}$), размерность – ${\text{г/(}}{{{\text{м}}}^{{\text{2}}}}\,{\text{год)}}$
| Ст. № |
${{w}_{{\text{w}}}}$ | $\varphi $ | ${{\theta }^{2}}$ | ${{D}_{{\text{B}}}}$ | $J_{{{\text{РОУ}}}}^{{\text{s}}}$ | $J_{{{\text{DIP}}}}^{{\text{s}}}$ | $J_{{{{{\text{P}}}_{{{\text{tot}}}}}}}^{{\text{s}}}$ | $J_{{{\text{NH}}_{{\text{4}}}^{ + }}}^{{\text{s}}}$ | $J_{{{{{\text{N}}}_{{{\text{tot}}}}}}}^{{\text{s}}}$ | grad РОУ |
grad DIP |
grad ${\text{[}}{{{\text{P}}}_{{{\text{tot}}}}}]$ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.72 | 0.87 | 1.28 | 17.67 | 9.59 | 0.04 | 0.11 | 0.06 | 0.32 | 3.61 | 246 | 40 |
| 2 | 0.52 | 0.74 | 1.6 | 6.55 | 3.36 | 0.09 | 0.18 | 0.15 | 0.46 | 4.36 | 59 | 57 |
| 3 | 0.71 | 0.86 | 1.3 | 12.99 | 7.61 | 0.2 | 0.33 | 0.23 | 1.25 | 3.69 | 75 | 20 |
| 4 | 0.6 | 0.79 | 1.48 | 56.22 | 6.02 | 0.12 | 0.18 | 0.07 | 0.65 | 2.85 | 82 | 137 |
| 5 | 0.61 | 0.8 | 1.45 | 8.04 | 12.99 | 0.15 | 0.22 | 0.14 | 0.84 | 9.31 | 49 | 16 |
| 6 | 0.62 | 0.81 | 1.43 | 4.75 | 5.27 | 0.17 | 0.25 | 0.15 | 0.74 | 4.74 | 61 | 41 |
| Ст. № | grad ${\text{[NH}}_{{\text{4}}}^{ + }]$ |
grad ${\text{[}}{{{\text{N}}}_{{{\text{tot}}}}}]$ |
grad ${\text{[Si]}}$ |
$ - {{J}_{{{\text{DIP}}}}}$ | $ - {{J}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ | $ - {{J}_{{{\text{Si}}}}}$ | $ - {{F}_{{{\text{РОУ}}}}}$ | $ - {{F}_{{{\text{DIP}}}}}$ | $ - {{F}_{{{{{\text{P}}}_{{{\text{tot}}}}}}}}$ | $ - {{F}_{{{\text{NH}}_{{\text{4}}}^{ + }}}}$ | $ - {{F}_{{{{{\text{N}}}_{{{\text{tot}}}}}}}}$ | $ - {{F}_{{{\text{Si}}}}}$ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 92 | 316 | 2013 | 0.021 | 0.16 | 1.29 | 137.5 | 0.69 | 1.84 | 2.85 | 18.18 | 43.56 |
| 2 | 103 | 202 | 1219 | 0.02 | 0.07 | 0.56 | 10.4 | 0.31 | 0.76 | 0.68 | 4.08 | 10.39 |
| 3 | 40 | 154 | 1543 | 0.01 | 0.07 | 0.67 | 30.6 | 0.25 | 0.59 | 1.02 | 10.24 | 17.1 |
| 4 | 172 | 382 | 1831 | 0.057 | 0.15 | 0.7 | 133.1 | 6.89 | 10.94 | 10.97 | 52.6 | 95.55 |
| 5 | 29 | 344 | 825 | 0.007 | 0.14 | 0.29 | 11.5 | 0.12 | 0.26 | 1.41 | 3.39 | 5.46 |
| 6 | 62 | 365 | 899 | 0.018 | 0.15 | 0.28 | 8.6 | 0.18 | 0.33 | 0.89 | 2.18 | 3.03 |
Из полученных результатов следует, что потоки биогенных веществ из придонной воды в донные осадки, обусловленные осадконакоплением, более чем на порядок меньше потоков, обусловленных градиентом концентрации на границе раздела вода–дно (второй член уравнения (1)), что согласуется с ранее полученными результатами (Sayles, 1979). Поэтому во многих случаях вкладом первого члена уравнения (1) можно пренебречь, тем более что в наших оценках была взята максимальная скорость осадконакопления.
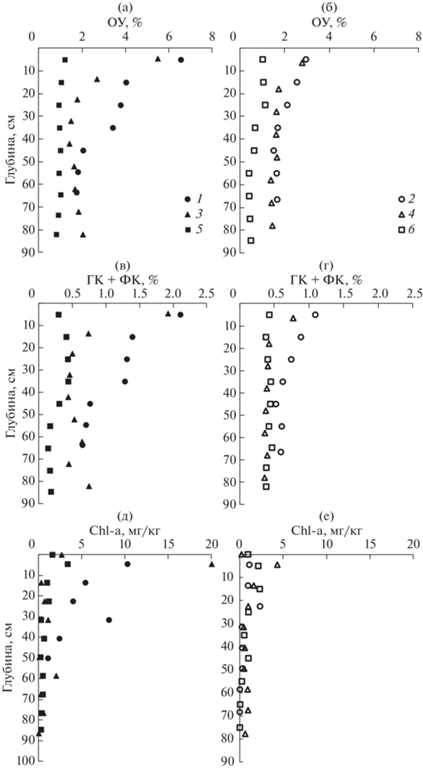
Наличие хлорофилла а в донных осадках на горизонтах 20–60 см (рис. 4д, 4е) указывает на проявление биотурбации, ирригации, т.е. в результате вертикального перемешивания частиц осадка под действием живых организмов (двустворчатых моллюсков, червей и т.д.), что ранее обсуждалось (Sun et al., 1991; Levin et al., 1997). Из соотношения (5) были получены коэффициенты биотурбации для всех исследованных станций, которые представлены в табл. 4. Потоки ${{F}_{i}},$ рассчитанные с помощью третьего члена уравнения (4), представлены в табл. 4. Они, как правило, на порядок больше (по абсолютной величине) в сравнении с потоками, рассчитанными из закона Фика.
Рис. 4.
Профили содержания разных форм органического вещества в твердой фазе донных отложений в б. Воевода (1, 2), б. Новгородская (3, 4), зал. Угловой (5, 6): процентное содержание органического углерода (а, б); процентное содержание органического углерода, обусловленного суммой фульвовых и гуминовых кислот (в, г); концентрация хлорофилла а (д, е). Донные отложения (1, 3) покрыты зостерой морской. Сентябрь, октябрь, 2019 г.
ОБСУЖДЕНИЕ
В результате диагенеза ОВ уменьшается концентрация ОУ в твердой фазе осадков (рис. 4), и увеличивается концентрации биогенных веществ и РОУ в поровой воде донных осадков (рис. 5, 6). Этот факт подтверждает ранее высказанную точку зрения, что именно ОВ является энергетической основой диагенетических преобразований донных осадков (Богданов и др., 1979; Rullkotter, 2006). Деятельность микроорганизмов является одним из основных процессов, который приводит к изменению химического состава поровой воды донных отложений (Иванов, 1979). Основным процессом микробиологической минерализации ОВ в мелководных бассейнах залива Петра Великого служит сульфатредукция (Тищенко и др., 2020). Используя стехиометрию Редфилда (Redfield et al., 1963) для ОВ, этот процесс формально можно представить следующей схемой (Emerson, Hedges, 2006):
(7)
$\begin{gathered} {{\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)}_{{{\text{106}}}}}{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{{{\text{16}}}}}{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + {\text{53SO}}_{{\text{4}}}^{{{\text{2}} - }} \to \\ \to {\text{38}}{{{\text{H}}}_{{\text{2}}}}{\text{S}}\, + \,{\text{16NH}}_{{\text{4}}}^{ + }\, + \,{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{4}}}^{ - }\, + \,{\text{106HCO}}_{{\text{3}}}^{ - }\, + \,{\text{15H}}{{{\text{S}}}^{ - }}. \\ \end{gathered} $Рис. 5.
Профили концентраций биогенных веществ в поровой воде донных отложений в б. Воевода (1, 2), б. Новгородская (3, 4), зал. Угловой (5, 6), DIP (а, б), Ptot (в, г), кремния (д, е). Донные отложения (1, 3) покрыты зостерой морской. Сентябрь, октябрь, 2019 г.
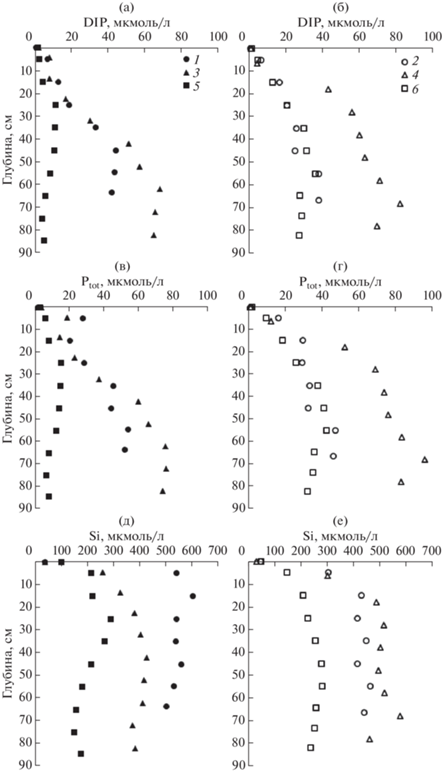
Рис. 6.
Профили концентраций иона аммония (а, б), общего растворенного азота (Ntot) (в, г), РОУ (д, е) в поровой воде донных отложений в б. Воевода (1, 2), б. Новгородская (3, 4), зал. Угловой (5, 6). Донные отложения (1, 3) покрыты зостерой морской. Сентябрь, октябрь, 2019 г.
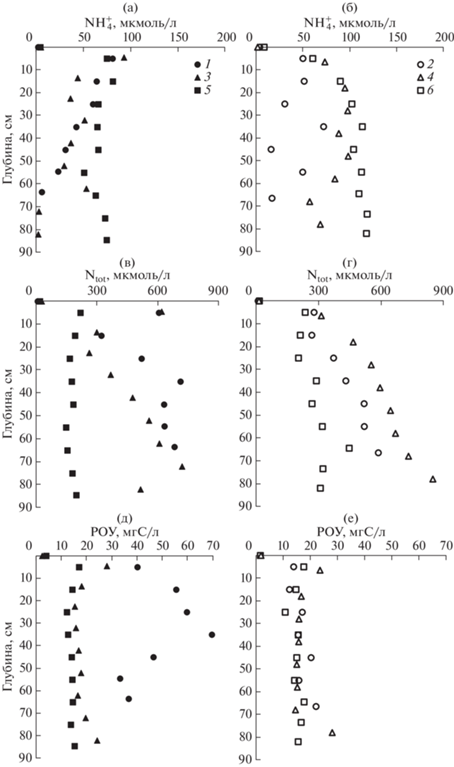
Из рис. 4 видно, что чем больше концентрация ОУ в твердой фазе, тем большее уменьшение этого параметра наблюдается в верхнем 40 см слое донных осадков. В этом случае следует ожидать больших градиентов продуктов диагенеза на границе раздела вода–дно и, соответственно, потоков этих веществ из поровой воды в лежащую над дном морскую воду.
Оценка диффузионных потоков биогенных веществ из поровой воды в придонную воду проводилась по уравнению (1). Этот расчет содержит две наиболее важные неопределенности. Одна из них, теоретическая, состоит в том, что ионы не могут независимо друг от друга диффундировать, т.к. должен выполняться принцип электронейтральности (Boudreau et al., 2004). Поскольку миграционные способности (коэффициенты диффузии) ионов разные, их диффузия индуцирует диффузионный потенциал, который замедляет быстро движущиеся ионы и ускоряет медленно движущиеся ионы. Авторы работы (Boudreau et al., 2004), применив принцип электронейтральности для расчета потоков сульфат- и гидрокарбонат-ионов, вызванных сульфатредукцией, установили незначительность вклада кулоновских сил в потоки этих ионов и пришли к выводу, что для многих диагенетических моделей этим вкладом можно пренебречь. Другая неопределенность расчета диффузионного потока на границе раздела вода–осадок, на наш взгляд, связана с оценкой градиента концентраций на данной границе. Для глубоководных бассейнов с идеальной горизонтальной границей раздела вода–осадок, толщина диффузионного слоя оценивается в 1 мм (Berner, 1980). Очевидно, что диффузионный поток через такую границу можно регистрировать только с помощью датчиков in situ (Wang et al., 2012), либо с помощью “боксовых” экспериментов (Вершинин, 1999). Для донных отложений на шельфе, обогащенных органическим веществом (наш случай), в переносе продуктов диагенеза через границу раздела вода–осадок важную роль играют морские организмы (двустворчатые моллюски, полихеты и др.) (Berner, 1980). Благодаря деятельности инфауны происходит перемешивание верхнего слоя донных отложений, которое называется биотурбацией. Под биотурбацией понимается любое физическое нарушение седиментационного слоя донных осадков, вызванное жизнедеятельностью инфауны (Kristensen et al., 2012). Обычно эти нарушения обусловлены физическим вертикальным и горизонтальным перемещением частиц, образованием отверстий, поеданием органосодержащих частиц и экскрецией продуктов метаболизма. Биотурбация затрагивает несколько десятков сантиметров верхнего слоя (Berner, 1980). Именно биотурбацией объясняется проникновение хлорофилла в донные осадки (Sun et al., 1991; Levin et al., 1997). В нашем случае такое проникновение достигает 40, 50 и 60 см для зал. Угловой, бухт Воевода и Новгородская, соответственно (рис. 4д). Отдельно выделяется биоирригация – закачивание придонной воды вглубь осадков, что приводит к одновременному выталкиванию поровой воды к границе раздела вода–осадок. Обычно механизм движения воды связывают либо с работой организма по принципу перистальтического насоса или движением ресничек, например у полихет, детальное описание разных вариантов биоирригации можно найти (Kristensen et al., 2012). Биотурбация и особенно биоирригация могут увеличивать на порядок потоки обмена на границе раздела вода–осадок в сравнении с молекулярной диффузией (Berner, 1980). В некоторых случаях существенное оказывает влияние “пассивная биотурбация”, под которой подразумевается роль приливов и нагонных волн на проникновение придонной воды вглубь донных осадков через отверстия сделанные в осадке морскими организмами (Kristensen et al., 2012). Очень сложно установить роль каждого механизма в интенсификации обменных процессов на границе раздела вода–дно. Существуют разные методы моделирования процессов биотурбации и ирригации, обзоры которых можно найти в работах (Berner, 1980; Boudreau, 1997). Наипростейший путь – моделирование в форме уравнений диффузии, как это используется при описании конвекции и турбулентности жидких сред. Основной аргумент в пользу этого подхода состоит в том, что процессы биотурбации и ирригации направлены на сглаживание (уничтожение) градиентов концентраций (Boudreau, 1997). Тем не менее, эти процессы нельзя рассматривать как диффузию, т.к. их интенсивность зависит от содержания ОУ в твердой фазе (питание для инфауны), сезона и локальной заселенности донных отложений инфауной (Berner, 1980). Указанные выше особенности проявления биотурбации согласуются с полученными нами коэффициентами биотурбации (табл. 4), которые для исследованных бассейнов находились в пределах 56.2 (ст. 4) – 4.8 см2/сут (ст. 6) и, как правило, более высокие значения ${{D}_{B}}$ соответствовали более высоким значениям концентраций ОУ. Очевидно, что высокое содержание ОУ оказывает важное влияние на интенсивность подвижной деятельности инфауны. Ранее нами были получены коэффициенты биотурбации 107.6, 14.5 и 3.0 см2/сут для бухт Воевода, Экспедиция и зал. Угловой, соответственно (Тищенко и др., 2020). В сравнении с другими литературными данными (Green et al., 2002), коэффициенты биотурбации, полученные нами, как правило, в 10 раз выше. Однако, в этой же работе приводятся “экстремально высокие значения”, полученные на основе изотопа 234Th – 3.6, 72.6 см2/сут, которые соизмеримы с нашими результатами. Натурные эксперименты по изучению скорости биотурбации в области гипоксии в Северном море с использованием бромид-иона в качестве трассера дали такой же порядок коэффициента биотурбации, как и наши результаты для ст. 3 (б. Новгородская) – 13 см2/сут (Forster et al., 1995).
Также интенсивность деятельности инфауны оказывает влияние на значения градиентов концентраций в верхнем слое осадков (Berner, 1980). Градиенты концентраций на границе раздела вода–дно рассчитывали с использованием эмпирических уравнений (3). Производная уравнения (3) при значении х = 0 соответствует градиенту концентрации на границе раздела вода–дно. Подобный путь использовался ранее (Sayles, 1979), однако градиенты концентраций в работе (Sayles, 1979) рассчитывались для глубины осадка 5 см (исследовались осадки открытого Атлантического океана). В нашем случае, расчет для глубины осадка в 5 см приводит к уменьшению градиента концентрации в 1.2–2 раза.
Потоки, ${{F}_{i}},$ рассчитанные с помощью третьего члена уравнения (4) представлены в табл. 4. Они, как правило, на порядок больше (по абсолютной величине) в сравнении с потоками, рассчитанными из закона Фика. В литературе опубликовано много результатов измерения потоков на шельфе с помощью “боксовых” экспериментов (Вершинин, 1999). Эти результаты хорошо согласуются с рассчитанными нами с помощью третьего члена уравнения (4). Например, для шельфа Балтийского моря (Пуцкий залив), для двух станций А.В. Вершининым были получены потоки DIP – dissolved inorganic phosphorus: –8.8 и –2.4 г/(м2 год); ${\text{NH}}_{{\text{4}}}^{ + }{\text{:}}$ –1.0 и –1.5 г/(м2 год); Si: –17.6 и –21.5 г/(м2 год) (Вершинин, 1999). Тот же порядок потоков был получен для эстуарной акватории р. Потомак, DIP: –0.2…–3.4 г/(м2 год); ${\text{NH}}_{{\text{4}}}^{ + }{\text{:}}$ –1.1…–33.2 г/(м2 год); Si: –20.4…–194.2 г/(м2 год) (Callender et al., 1982). В последней работе авторы объясняют высокие значения потоков ирригационными способностями инфауны. Мы также полагаем, что биотурбационные и ирригационные способности инфауны играют важную роль в обмене веществом между поровой и придонной водой. В этой связи следовало бы ожидать более интенсивных потоков в осадках с высоким содержанием ОУ. В какой-то мере такая тенденция соблюдается. Однако максимальные потоки биогенных веществ, обусловленные биотурбацией, были получены для ст. 4, где верхний слой осадка содержал только 2.78% ОУ, что более чем в два раза меньше в сравнении с кернами для ст. 1, 3. Следует также отметить, что минеральные формы биогенных веществ поглощаются корнями зостеры для ее роста (Romero et al., 2006; Touchette Burkholder, 2000), что приводит к уменьшению градиентов концентраций между поровой и придонной водой на ст. 1 и 3 (табл. 4). Таким образом, на ст. 4, где отсутствуют поля зостеры получены самые высокие потоки биогенных веществ, поскольку для этой станции характерен высокий коэффициент биотурбации и высокие градиенты концентраций.
Известно, что Амурский залив является эвтрофированной акваторией. Основными источниками биогенных веществ для Амурского залива служат река Раздольная и сточные воды города Владивостока (Звалинский и др., 2013). Потоки биогенных веществ от этих источников приводят к сезонной гипоксии Амурского залива (Тищенко и др., 2011). Суммарные годовые потоки биогенных веществ в Амурский залив в среднем составляют 0.22, 0.59, 2.5 и 5.35 ${\text{г/(}}{{{\text{м}}}^{{\text{2}}}}\,{\text{год)}}$ для DIP, Ptot, DIN (dissolved inorganic nitrogen) и Ntot, соответственно (Звалинский и др. 2013). В расчетах потоков была принята общая площадь Амурского залива, равная 1000 км2. Из табл. 4 следует, что потоки DIP и Ptot на границе раздела вода–дно для ст. 1 – 4, ${\text{NH}}_{{\text{4}}}^{ + }$ и Ntot для ст. 1 и 4 выше, в сравнении с потоками этих биогенных веществ в Амурский залив, обусловленных суммой потоков от р. Раздольной и от канализационных стоков г. Владивостока. Для остальных исследуемых станций значения потоков на границе раздела вода–дно соизмеримы с суммарными потоками азота и фосфора, приходящимися на единицу площади залива и обуславливающими эвтрофикацию Амурского залива. Однако существуют особенности в потоках биогенных веществ, обусловленных рекой и на границе раздела вода–дно, которые влияют на состояние экосистемы. Потоки биогенных веществ, обусловленные стоком р. Раздольной, характеризуются чрезвычайной временной неравномерностью (более чем на два порядка). Эта временная неравномерность обусловлена муссонным климатом, который приводит к неравномерности стока воды реки Раздольной (Михайлик и др., 2011). В период паводка, речные воды покрывают поверхностный слой акватории Амурского залива. Сочетание высоких концентраций биогенных веществ в эвфотическом слое с ФАР приводит к высокой интенсивности продукции фитопланктона, основным видом которого являются диатомеи (Коновалова, 1972). Осевший на дно залива фитопланктон подвергается микробиологической деструкции. В глубокой части залива, в центральной котловине, куда не проникает ФАР, микробиологической деструкции диатомей приводит к гипоксии придонных вол (Тищенко, 2013). Таким образом, продукция в верхнем эвфотическом слое и деструкция на дне залива, куда не проникает ФАР дистанционно разделены. В этом случае эвтрофикация залива речными водами приводит к гипоксии придонных вод залива.
Эвтрофикация мелководных бассейнов (наш случай), обусловленная потоками биогенных веществ на границе вода–дно, в большинстве случаев не приводит к формированию гипоксии, поскольку из-за малых глубин ФАР проникает до дна бассейна. Продукты деструкции – минеральные формы биогенных веществ тут же начинают участвовать в образовании биомассы ОВ через их потребление корнями и листьями зостеры (Romero et al., 2006), а также фитопланктона. Образование биомассы ОВ посредством фотосинтеза генерирует кислород, что предотвращает образование гипоксии/аноксии. Концентрации DIP в мелководных морских бассейнах, покрытых лугами морских трав, обычно находятся в диапазоне 0.1–1.7 и 0.3–20 мкмоль/л в морской и поровой воде, соответственно (Touchette Burkholder, 2000). Для ионов аммония диапазон концентраций в морской и поровой водах составляет 0–3.2 и 1–180 мкмоль/л. Эти значения сравнимы с результатами, полученными нами как для морской воды (табл. 2), так и для поровой воды (рис. 5, 6). Из полученных нами концентраций неорганических форм биогенных веществ и общих форм растворенного фосфора и азота (табл. 2, рис. 2), а также глубины фотического слоя, следует, что лимитирующим фактором фотосинтеза исследуемых акваторий является вторичное звено пищевой цепи. Оценка эвтрофного статуса мелководных бассейнов, содержащих морские травы, является сложной задачей и не может быть установлена посредством прямых измерений концентраций биогенных веществ (Burkholder et al., 2007). В этом случае используется косвенный признак – увеличение доли фитопланктона в первичной продукции в сравнении с зостерой (Burkholder et al., 2007; Ralph et al., 2006). На рис. 3 показаны высокие концентрации хлорофилла в исследуемых бассейнах. Подводным фотографированием установлено существенное покрытие листьев зостеры охристыми нитями диатомей (эпифитон). Эти факты, а также высокая мутность биологического происхождения исследуемых бассейнов в условиях малых полусуточных приливов, 20–50 см (Супранович, Якунин, 1976), указывают на то, что заросли зостеры в бухтах Воевода и Новгородская находятся в стадии деградации, а в зал. Угловой зостера практически исчезла. Основная причина этого – человеческая деятельность. По нашим оценкам, не менее 50% акватории б. Воевода занято аквакультурой (разведение мидии, гребешка, трепангов, устриц). Также ведется добыча лечебной грязи. В б. Новгородской проводится разведение трепанга, гребешка и мидии (Гаврилова, Кондратьева, 2018). На наш взгляд, для исследуемых бухт существует вероятность повторения судьбы зал. Угловой, в котором подводным фотографированием не были установлены луга морских трав, хотя в 1980 г. они были в северной и, частично, центральной частях залива (Тищенко и др., 2021). Основная причина деградации экосистемы зал. Угловой – эвтрофикация. Эвтрофикация обусловлена ослаблением водообмена между Амурским заливом и зал. Угловой в результате строительства в южной части залива дюкера для канализационных стоков и низководного моста на полуостров Де-Фриз. Вторая причина – усиление стока канализационных вод в связи с развитием жилищного строительства на северном побережье залива (Тищенко и др., 2021).
ВЫВОДЫ
На основе данных о концентрациях биогенных веществ в придонной и поровой водах рассчитаны потоки биогенных веществ на границе раздела вода–дно на шести станциях в трех мелководных бассейнах зал. Петра Великого: б. Воевода, б. Новгородская, зал. Угловой, осадки которых содержат высокие концентрации ОУ. Найдено, что потоки биогенных веществ из донных осадков в морскую воду, оцененные с учетом биотурбации, примерно на порядок больше потоков, рассчитанных по закону Фика. Установлено, что самые высокие концентрации ОУ – 6.5, 5.5% соответствуют верхним горизонтам донных отложений, отобранных в местах, покрытых зостерой морской в бухтах Воевода и Новгородская, соответственно. Самые высокие потоки на границе раздела вода–дно получены для станции в б. Новгородская, где содержание ОУ в верхнем слое осадка составляло 2.8%. Величины годовых потоков биогенных веществ на границе раздела вода-дно соизмеримы с суммарными годовыми потоками от р. Раздольной и коммунальных стоков г. Владивостока в Амурский залив, приходящимися на 1 м2. Зостера морская находится в угнетенном состоянии в бухтах Воевода и Новгородская и практически исчезла в зал. Угловой.
Работа была выполнена по инициативе д. г. н. Петра Николаевича Маккавеева.
Работа была выполнена при финансовой поддержке грантов РФФИ, № 19-35-50042 ”мол_нр”, № 20-05-00381-a.
Список литературы
Аникеев В.В., Дударев О.В., Касаткина А.П., Колесов Г.М. (1996) Влияние терригенных и биогенных факторов на формирование седиментационных потоков химических элементов в прибрежной зоне Японского моря. Геохимия, (1), 59-72.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю., Михайлик Т.А., Косьяненко А.А. (2018) Условия образования лечебных грязей в бухте Воевода (Амурский залив, Японское море). Известия ТИНРО. 192, 167-176.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю., Волкова Т.И., Звалинский В.И., Михайлик Т.А., Сагалаев С.Г., Сергеев А.Ф., Тищенко П.П., Швецова М.Г., Шкирникова Е.М. (2015) Сезонные гидролого-гидрохимические исследования бухты Воевода (Амурский залив, Японское море). Известия ТИНРО. 180, 161-178.
Богданов Ю.А., Гурвич Е.Г., Лисицын А.П. (1979) Модель накопления органического углерода в донных осадках Тихого океана. Геохимия. (6), 918-927.
Блиновская Я.Ю. (2001) Ландшафтная характеристика и оптимизация природопользования в прибрежно-морской зоне залива Посьета. Дис. … канд. геогр. наук. Владивосток: Тихоокеанский институт географии, 225 с.
Вершинин А.В. (1999) Химический обмен на границе раздела придонная вода – морское дно (Проблемы теории и методов исследования). Дис … докт. хим. наук. М.: Институт ГЕОХИ им. В.И. Вернадского, 381 с.
Волков И.И. (1979) Окислительно-восстановительные процессы диагенеза осадков. Химия океана. М.: Наука, 2, 363-413.
Гаврилова Г.С., Кондратьева Е.С. (2018) Результаты хозяйственной деятельности и проблемы развития марикультуры залива Посьета (Японское море) в 2000–2015 гг. Известия ТИНРО. 195, 229-243.
Звалинский В.И., Тищенко П.П., Михайлик Т.А., Тищенко П.Я. (2013) Эвтрофикация зал. Петра Великого. Океанологические исследования дальневосточных морей и северо-западной части Тихого океана. Владивосток: Дальнаука. 1, 260-293.
Иванов М.В. (1979) Распространение и геохимическая деятельность бактерий в осадках океана. Химия океана. М.: Наука, 2, 363-413.
Коновалова Г.В. (1972) Сезонная характеристика фитопланктона в Амурском заливе Японского моря. Океанология. 12, 123-128.
Лейн А.Ю., Саввичев А.С., Русанов И.И., Павлова Г.А., Беляев Н.А., Крейн К., Пименов Н.А., Иванов М.А. (2007) Биогеохимические процессы в Чукотском море. Литология и полезные ископаемые. (3), 247-266.
Лоция северо-западного берега Японского моря (1996) СПб.: ГУНИО МО, 354 с.
Михайлик Т.А., Тищенко П.Я., Колтунов А.М., Тищенко П.П., Швецова М.Г. (2011) Влияние реки Раздольной на экологическое состояние вод Амурского залива (Японское море). Водные ресурсы. 38, 474-484.
Романкевич Е.А., Ветров А.А. Пересыпкин В.И. (2009) Органическое вещество мирового океана. Геология и геофизика. 50, 401-411.
Супранович Т.И., Якунин Л.П. (1976) Гидрология залива Петра Великого. Ленинград: Гидрометеоиздат. 198 с.
Тищенко П.П. Сезонная гипоксия Амурского залива: автореф. дис. … канд. геогр. наук. Владивосток, 2013. 16 с.
Тищенко П.Я., Лобанов В.Б., Звалинский В.И., Сергеев А.Ф., Волкова Т.И., Колтунов А.М., Михайлик Т.А., Сагалаев С.Г., Тищенко П.П., Швецова М.Г. (2011) Сезонная гипоксия Амурского Залива (Японское море). Известия ТИНРО. 165, 108-129.
Тищенко П.Я., Барабанщиков Ю.А., Павлова Г.Ю., Рюмина А.А., Сагалаев С.Г., Семкин П.Ю., Тищенко П.П., Уланова О.А., Швецова М.Г. Шкирникова Е.М., Тибенко Е.Ю. (2021) Гидрохимическое состояние залива Угловой (Амурский залив) в разные сезоны. Известия ТИНРО. 201, 138-157.
Тищенко П.Я., Медведев Е.В., Барабанщиков Ю.А., Павлова Г.Ю., Сагалаев С.Г., Тищенко П.П., Швецова М.Г., Шкирникова Е.М., Уланова О.А., Тибенко Е.Ю., Орехова Н.А. (2020) Органический углерод и карбонатная система в донных отложениях мелководных бухт залива Петра Великого (Японское море). Геохимия. 65, 583-598.
Tishchenko P.Ya., Medvedev E.V., Barabanshchikov Yu.A., Pavlova G.Yu., Sagalaev S.G., Tishchenko P.P., Shvetsova M.G., Shkirnikova E.M., Ulanova O.A., Tibenko E.A., Orekhova N.A. (2020) Organic Carbon and Carbonate System in the Bottom Sediments of Shallow Bights of the Peter the Great Bay (Sea of Japan). Geochem. Int. 58, 704-718.
Behrens E.W. (1980) On sedimentation rates and porosity. Marine Geology 35, M11-M16.
Berner R.A. (1980) Early Diagenesis. A Theoretical Approach. Princeton, N.J.: Princeton University Press, 241 p.
Boudreaua B.P., Meysman F.J.R., Jack J. (2004) Middelburg Multicomponent ionic diffusion in porewaters: Coulombic effects revisited. Earth Planetary Science Letters. 222, 653-666.
Boudreaua B.P. (1997) Diagenetic models and their implementation. Modelling transport and reactions in aquatic sediments. Berlin: Springer-Verlag, 414 p.
Burkholder J.M., Tomasko D.A., Touchette B.W. (2007) Seagrasses and eutrophication. J. Exp. Mar. Biol. Ecol. 350, 46-72.
Callender E., Hammond D.E. (1982) Nutrient Exchange across the Sediment-water Interface in the Potomac River Estuary. Estuarine, Coastal Shelf Science. 15, 395-413.
De La Rocha C.L. (2006) The biological pump. Treatise on Geochemistry Amsterdam: Elsevier. 6, 83-111.
Emerson S., Hedges J. (2006) Sediment Diagenesis and Benthic Flux. Treatise on Geochemistry. Amsterdam: Elsevier. 6, 293-319.
Forster S., Graf G., Kitlar J., Powilleit M. (1995) Effects of bioturbation in anoxic and hypoxic conditions: a microcosm experiment with a North Sea sediment community. Mar. Ecol. Prog. Ser. 116, 153-161.
Gieskes J.M. (1975) Chemistry of Interstitial Waters of Marine Sediments. Annual Review Earth Planetary Sciences. 3, 433-453.
Green M.A., Aller R.C., Cochran J.K., Lee C., Aller J.Y. (2002) Bioturbation in shelf/slope sediments off Cape Hatteras, North Carolina: the use of 234Th, Chl-a, and Br to evaluate rates of particle and solute transport. Deep-Sea Res. II. 49, 4627-4644.
Kristensen E., Penha-Lopes G., Delefosse M., Valdemarsen M., Quintana C.O., Banta G.T. (2012) What is bioturbation? The need for a precise definition for fauna in aquatic sciences. Mar. Ecol. Prog. Ser. 446, 285-302.
Lerman A. (1978) Chemical exchange across sediment – water interface. Ann. Rev. Earth Planet. 6, 281-303.
Levin L., Blair N., DeMaster D., Plaia G., Fornes W., Martin C., Thomas C. (1997) Rapid subduction of organic matter by maldanid polychaetes on the North Carolina slope. J. Mar. Res. 55, 595-611
Middelburg J.J. and Levin L.A. (2009) Coastal hypoxia and sediment biogeochemistry Biogeosciences. 6, 1273-1293.
Pilgrim D.A. (1987) Measurement and estimation of the extinction coefficient in turbid estuarine waters. Cont. Shelf Res. 7, 1425-1428.
Redfield A.C., Ketchum B.H., Richards F.A. (1963) The influence of organisms on the composition of seawater. The Sea (Ed. Hill. M.N.) N.Y.: Interscience. 2, 26-77.
Romero J., Lee K.-S., Pérez M., Mateo M.A., Alcoverro T. (2006) Nutrient dynamics in seagrass ecosystems. Seagrasses: Biology, Ecology Conservation. Netherlands: Springer, 227-254.
Ralph, P.J., Tomasko, D., Moore, K., Seddon S., Macinnis-Ng C.M.O. (2006) Human impacts on seagrasses: eutrophication, sedimentation, and contamination. Seagrasses: Biology, Ecology Conservation. Netherlands: Springer, 567-593.
Rullkotter J.G. (2006) Organic Matter: The Driving Force for Early Diagenesis. Marine Geochemistry. Horst D. Schulz, Matthias Zabel Eds, 2-nd edition, Berlin Heidelberg, N.Y.: Springer-Verlag, 125-168.
Sayles F.L. (1979) The composition and diagenesis of interstitial solutions-I. Fluxes across the seawater-sediment interface in the Atlantic Ocean. Geochim. Cosmochim. Acta. 43. 527-549.
Schults H.D. (2006) Quantification of Early Diagenesis: Dissolved Constituents in Marine Pore Water. Marine Geochemistry/ Horst D. Schulz, Matthias Zabel Eds, 2-nd edition / Berlin Heidelberg, N.Y.: Springer-Verlag, 75-124.
Sun M., Aller R.C., Lee C. (1991) Early diagenesis of chlorophyll-a in Long Island Sound sediments: A measure of carbon flux and particle reworking. J. Mar. Res. 49, 379-401.
Touchette B.W., Burkholder J.M. (2000) Review of nitrogen and phosphorus metabolism in seagrasses. J. Exp. Marine Bio. Ecol. 250, 133-167.
Wang J.N., Zhao L., Wei H. (2012) Variable diffusion boundary layer and diffusion flux at sediment-water interface in response to dynamic forcing over an intertidal mudflat. Chin. Sci. Bull. 57, 1568-1577.
Дополнительные материалы отсутствуют.


