Геохимия, 2023, T. 68, № 1, стр. 83-89
Термодинамические свойства пектолита
Л. П. Огородова a, *, Ю. Д. Гриценко a, b, **, М. Ф. Вигасина a, Д. А. Ксенофонтов a, Л. В. Мельчакова a
a Московский государственный университет им. М.В. Ломоносова, геологический факультет
119991 Москва, Ленинские Горы, 1, Россия
b Минералогический музей им. А.Е. Ферсмана РАН
119692 Москва, Ленинский пр., 18, Россия
* E-mail: logor48@mail.ru
** E-mail: ygritsenko@rambler.ru
Поступила в редакцию 23.03.2022
После доработки 04.04.2022
Принята к публикации 12.05.2022
- EDN: IALNIT
- DOI: 10.31857/S0016752523010053
Аннотация
Исследование пектолита H1.00Na0.96Ca2.00(Mn2+)0.02Si3.00O9 из нефелин-полевошпатовых жил Ковдорского массива (Кольский полуостров, Россия) проведено методами порошковой рентгенографии, ИК и КР спектроскопии, электронно-микрозондового и термического анализов. Методом расплавной калориметрии растворения на микрокалориметре Кальве “Setaram” (Франция) определена энтальпия образования пектолита HNaCa2Si3O9 из элементов ∆fH° (298.15 K) = –4651.0 ± 4.3 кДж/моль. Оценена энтальпия образования марганцевого конечного члена изоморфной серии пектолит – серандит HNaMn2Si3O9 ∆fH° (298.15 K) = –4052.6 ± 4.4 кДж/моль. Рассчитаны значения абсолютных энтропий и энергий Гиббса пектолита и серандита.
ВВЕДЕНИЕ
Пектолит HNaCa2Si3O9 – распространенный цепочечный силикат, встречающийся в качестве основного минерала в нефелиновых сиенитах, в гидротермальных полостях базальтов и диабазов, а также в серпентинитах в ассоциации с цеолитами, датолитом, пренитом, кальцитом и серпентином, и образующий изоморфную серию с серандитом HNaMn2Si3O9. Кристаллическая структура и параметры элементарной ячейки пектолита были определены, а затем уточнены в работах (Buerger, 1956; Prewitt, 1967) для природных образцов. Кристаллическая структура пектолита и серандита (структурный тип волластонита) состоит из цепочек кремнекислородных тетраэдров [SiO3]∞, параллельных оси b и соединенных между собой двойными столбцами (структурные позиции M1 и M2) реберно сочлененных октаэдров CaO6 или MnO6 соответственно, которые также расположены вдоль оси b. Атомы Na в восьмивершинной полиэдрической координации соединяют колонки октаэдров. В работе (Rozhdestwenskaya, Vasilieva, 2014) при изучении упорядоченности катионов кальция и марганца по структурным позициям M1 и M2 в природных образцах серии пектолит – серандит методом монокристальной рентгеновской дифракции было установлено, что при изоморфном замещении Mn2+ → Ca в процессе преобразования пектолита в серандит катионы Mn2+ первоначально заселяют преимущественно структурную позицию M2, при этом происходит уменьшение параметров элементарной ячейки. В работе (Origlieri et al., 2021) было также установлено, что катионы кальция и марганца в промежуточном члене серии маршалсуссманите NaCaMnSi3O8(OH) (IMA2013-067) упорядоченно распределены по позициям M1 (Ca) и M2 (Mn). Минералы кристаллизуются в триклинной сингонии с пространственной группой Pī (Z = 2). Вопрос о локализации протона в структуре пектолита и серандита подробно рассмотрен в обзорной статье Н.В. Чуканова и И.В. Пекова (Чуканов, Пеков, 2012), в которой на основании анализа результатов ИК-спектроскопических исследований этих минералов (Hammer et al., 1998; Чуканов, Пеков, 2012) и экспериментов по дифракции нейтронов (Jacobsen et al., 2000) было обосновано отсутствие в них силанольных групп Si–OH и прочных водородных связей и установлено, что водород в структурах пектолита и серандита находится в форме изолированного катиона H+, локализованного между близкими атомами кислорода (позиции O(3) и O(4)) в силикатной цепи структуры минерала.
ИК и КР спектроскопические исследования пектолита, членов группы пектолит – серандит и их синтетических аналогов выполнены в работах (Frost et al., 2015; Mitchell et al., 2015; Zhang et al., 2019; Origlieri et al., 2021). Результаты термического изучения пектолита представлены в (Correcher et al., 2006).
Такие характеристики пектолита, как высокая пористость и теплоизоляционные свойства, находят применение в строительной индустрии для производства цементов, гипсокартона, армированных органических полимерных материалов; в качестве адсорбента тяжелых металлов (Frost et al., 2015). Синтезированная в гидротермальных условиях при 220°С наноразмерная пектолитовая проволока и полученный на ее основе композитный материал используются в качестве анодных материалов в литий-ионных батареях (Zhang et al., 2019).
Представляемая работа посвящена определению отсутствующих к настояшему времени фундаментальных термодинамических констант пектолита – энтальпии и энергии Гиббса образования из элементов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика образца
Был исследован пектолит из Ковдорского щелочно-ультраосновного карбонатитового массива (Кольский полуостров, Россия). Пектолит широко распространен в фенитах экзоконтактовой зоны массива; также крупные кристаллы пектолита обнаружены в скарноподобных породах в ассоциации с андрадитом, везувианом и кальцитом (Иванюк, Яковенчук, 1997). Наиболее представительные образцы пектолита описаны в эгирин-нефелин-полевошпатовых жилах, секущих породы флогопитового комплекса, совместно с канкринитом и вишневитом. В настоящей работе изучен образец пектолита из нефелин-полевошпатовых жил верхних горизонтов Флогопитового карьера. Образец представлен пластинчатыми прозрачными бесцветными кристаллами размерами до 5 см по удлинению, с совершенной спайностью и невысокой твердостью, имеющими стеклянный блеск в направлении поперек удлинения кристаллов и перламутровый блеск на плоскостях спайности.
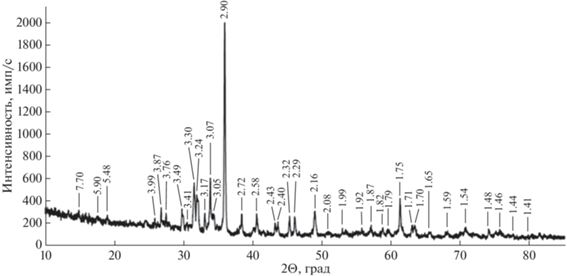
Рентгенографическое исследование проведено на порошковом дифрактометре “STOE-STADI MP” (Германия) с изогнутым Ge (III) монохроматором, обеспечивающим строго монохроматическое CoKα1-излучение (λ = 0.178897 Å). Сбор данных осуществлён в режиме поэтапного перекрывания областей сканирования с помощью позиционно-чувствительного линейного детектора с углом захвата 5° по углу 2Θ с шириной канала 0.02°. Коррекция положения линий проведена по внутреннему стандарту – кварцу. Определение фазового состава проводилось с помощью программного комплекса WinXPow (WinXPow Software-STOE & CIE GmbH 2002.1) и программы Match! (Match! Software-Crystal Impact GbR 2016) и связанной с ними порошковой базы данных PDF-2 (ICDD-2013). Полученный рентгендифракционный спектр (рис. 1) соответствует спектру пектолита политипа 1А согласно базе данных ICDD (The International Centre for Diffraction Data, 2013; карточка № 01-074-1109).
Термическое поведение минерала было изучено на дериватографе “Q-1500D” (Венгрия) в интервале температур от комнатной до 1000°С, скорость нагрева составляла 20 град./мин, масса образца – 104.6 мг. Термогравиметрическая кривая (ТГ) показала потерю массы в интервале 700–785°С равную 2.7%, на кривой ДТА был зафиксирован эндотермический эффект, соответствующий процессу дегидратации пектолита.
Химический состав определен на сканирующем электронном микроскопе “JSM-6480LV” (Jeol Ltd., Japan) с вольфрамовым термоэмиссионным катодом с энергодисперсионным спектрометром “X-Max-50” (Oxford Instruments Ltd., GB) при ускоряющем напряжении 20 кВ, силе тока 10.05 ± ± 0.05 нА. Обработка данных производилась в программе INCA (Oxford Instruments, v. 22). Был получен следующий состав минерала (мас. %): Na2O 8.69; CaO 32.70; MnO 0.31; SiO2 52.70; H2O 2.7 (содержание воды определено термогравиметрическим методом). Рассчитанная на 18 зарядов химическая формула H1.00Na0.96Ca2.00(Mn2+)0.02Si3.00O9 близка к теоретической HNaCa2Si3O9. Все расчеты полученных в работе термодинамических констант выполнены для теоретической формулы.
КР-спектроскопическое изучение проведено на рамановском микроскопе “EnSpectr R532” (Россия). Длина волны лазерного излучения равнялась 532 нм, выходная мощность луча составляла около 7 мВт, голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение равнялось 6 см–1, диаметр фокального пятна составлял 20 мкм при увеличении 40×. Спектр был получен в интервале от 100 до 4000 см–1 на неориентированном образце в режиме накопления сигнала в течение 1 секунды при усреднении по 300 экспозициям. Калибровка прибора проводилась по линии кристаллического кремния 520 см–1.
Полученные спектры комбинационного рассеяния изученного пектолита (рис. 2а, 2б) согласуются с представленными в электронной базе данных RRUFF (Database of Raman spectroscopy, X-ray diffraction and chemistry of minerals) спектрами образцов пектолита из щелочных массивов Канады (Jeffrey Quarry, Asbestos, Quebec) и США (West Patterson, New Jersey) – образцы № R050396 и № R060101 соответственно.
Рис. 2.
Спектры комбинационного рассеяния пектолита (Ковдор), (а) – с люминесценцией, (б) – после корректировки люминесцентного фона.
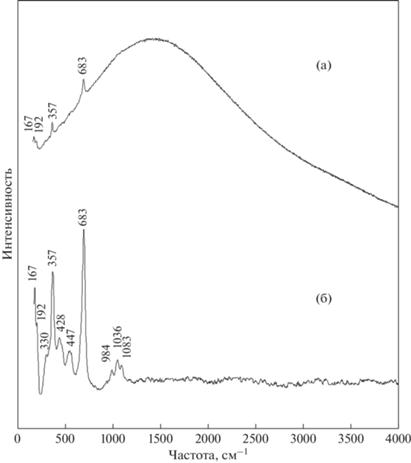
При регистрации спектров КР нами был зарегистрирован обусловленный присутствием катионов марганца высокий уровень люминесценции изучаемого образца (рис. 2а). На фоне люминесценции была зафиксирована линия рассеяния с частотой 683 см–1, соответствующая колебаниям фрагментов Si–O–Si, связывающих тетраэдры через общие “мостиковые” кислородные атомы; линия рассеяния при 357 см–1 приписывается деформационным колебаниям тетраэдров SiO4, а линии при 192 и 167 см–1 относятся к трансляционным колебаниям катионов. После коррекции уровня люминесценции в спектре (рис. 2б) проявились менее интенсивные линии валентных колебаний кремнекислородных тетраэдров с частотами 1083, 1036, 984 см–1, а также дополнительные менее интенсивные линии деформационных колебаний с частотами около 447, 428, и 330 см–1.
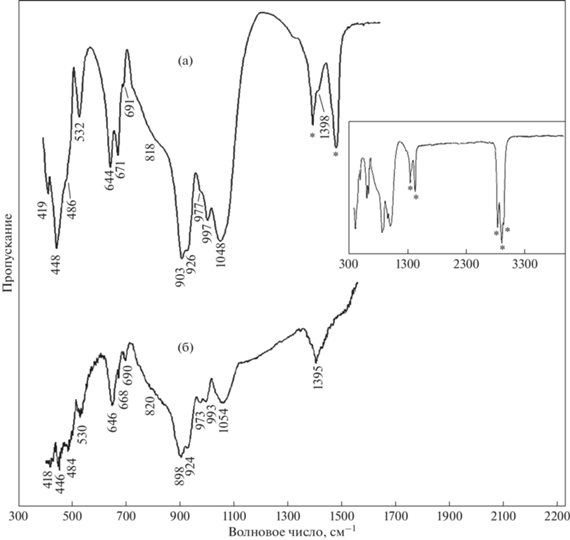
ИК-спектроскопическое исследование выполнено на Фурье-спектрометре “ФСМ-1201” (Россия) в режиме пропускания на воздухе при комнатной температуре в диапазоне волновых чисел от 400 до 4000 см–1. Исследование проводилось с использованием двух способов подготовки образца. В первом случае образец готовился в виде суспензии порошка минерала (3–5 мг) в вазелиновом масле, которая затем наносилась на пластинку из бромида калия; в качестве образца сравнения использовалась та же пластинка из KBr до нанесения на нее минеральной суспензии; накопление сигнала осуществлялось в течение 20 сканов при спектральном разрешении 4 см–1. Во втором случае образец готовился в виде спрессованной таблетки из порошка минерала (~4 мг) с бромидом калия (250 мг); в качестве образца сравнения использовалась таблетка только из KBr; накопление сигнала осуществлялось в течение 100 сканов при спектральном разрешении 4 см–1.
Полученные спектры ИК-поглощения изученного пектолита (рис. 3а, 3б) согласуются со спектрами образцов пектолита из выше упомянутых щелочных массивов Канады и США, а также со спектром образца из Ковдорского щелочного массива, представленным в (Чуканов, Пеков, 2012). Спектр изучаемого образца, приготовленного в вазелиновом масле (рис. 3, врезка), демонстрирует полное отсутствие полос поглощения в спектральных областях, соответствующих валентным колебаниям ОН-групп (выше 3200 см–1) и деформационным колебаниям молекул воды (около 1630 см–1). “Плечо” около 1398 см–1 (рис. 3а) на полосе поглощения вазелинового масла, а также полоса при 1395 см–1 (рис. 3б) в соответствии с представлениями о локализации протона в структуре пектолита (Чуканов, Пеков, 2012) могут быть отнесены к колебаниям катиона Н+ между позициями O(3) и O(4) в перпендикулярном оси в направлении (Hammer et al., 1998). Полосы поглощения в диапазоне от 880 до 1070 см–1 относятся к валентным колебаниям кремнекислородных тетраэдров. Широкое “плечо” с максимумом поглощения примерно около 818–820 см–1 приписывается колебаниям катиона Н+ вдоль оси в кристалла (Hammer et al., 1998; Чуканов, Пеков, 2012). К деформационным колебаниям фрагментов Si–O–Si в цепочках тетраэдров SiO4 относятся полосы поглощения в диапазоне от 600 до 700 см–1. В спектральной области ниже 500 см–1 зарегистрированы полосы поглощения, относящиеся к внутренним деформационным колебаниям тетраэдров SiO4 (Накамото, 1991; Origlieri et al., 2021).
Термохимическое изучение
Термохимическое изучение пектолита выполнено на высокотемпературном теплопроводящем микрокалориметре Тиана–Кальве (Setaram, Франция) методом расплавной калориметрии растворения. В экспериментах по растворению образцы массой 4–13 (±2 ×10–3) мг сбрасывались от комнатной температуры в расплав-растворитель состава 2PbO⋅B2O3, находящийся в калориметре при Т = = 973 К; при этом измеренная величина теплового эффекта включала приращение энтальпии, связанное с теплопоглощением пектолита [H0(973 K) – – H0(298.15 K)], и энтальпию его растворения ΔраствH0(973 K). При проведении 6–8 опытов по растворению вещества в 30–35 г расплава соотношение растворенное вещество – растворитель может быть отнесено к бесконечно разбавленному раствору с близкой к нулю энтальпией смешения. Микрокалориметр калибровался по приращению энтальпии [H0(973 K) – H0(298.15 K)] эталонного вещества – платины (Robie and Hemingway, 1995). Полученное значение [H0(973 K) – H0(298.15 K) + + ΔраствH0(973 K)] для изученного пектолита, среднее из семи определений, составило 1047.09 ± ± 6.44 Дж/г = 348.06 ± 2.14 кДж/моль (М = = 332.41 г/моль); погрешность определена с вероятностью 95%.
Порошковый дифрактометр “STOE-STADI MP”, инфракрасный Фурье-спектрометр “ФСМ-1201”, рамановский микроскоп “EnSpectr R532”, дериватограф “Q-1500D” и микрокалориметр Тиана-Кальве “Setaram” установлены на геологическом факультете МГУ имени М.В. Ломоносова.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Термодинамические свойства пектолита
На основании термохимического цикла, включающего растворение минерала и составляющих его компонентов, и полученных калориметрических данных была рассчитана энтальпия образования пектолита HNaCa2Si3O9 с использованием реакции (1) и уравнений (2) и (3).
(1)
$\begin{gathered} {\text{0}}{\text{.5N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + 2{\text{CaO}} + 3{\text{Si}}{{{\text{O}}}_{2}} + 1/3{\text{Al}}{{\left( {{\text{OH}}} \right)}_{3}} = \\ = {\text{HNaC}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{9}} + 1/6{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $(2)
$\begin{gathered} {{\Delta }_{{{\text{р - ции}}\left( {\text{1}} \right)}}}{{H}^{0}}(298.15{\text{ K}}) = 0.5\Delta H{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + 2\Delta H{\text{CaO}} + \\ + \,\,3\Delta H{\text{Si}}{{{\text{O}}}_{2}} + 1{\text{/}}3\Delta H{\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} - \\ - \,\,\Delta H{\text{HNaC}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{9}}}} - {\text{ }}1{\text{/}}6\Delta H{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $(3)
$\begin{gathered} {{\Delta }_{f}}{{H}^{0}}(298.15\,{\text{K}}){\text{HNaC}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{9}} = \\ = {{\Delta }_{{{\text{р - ции(1)}}}}}{{H}^{0}}(298.15{\text{ K}})\, + \,0.5{{\Delta }_{{\text{f}}}}{{H}^{0}}(298.15\,{\text{K}}){\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}}\, + \\ {\text{ + }}\,\,2{{\Delta }_{f}}{{H}^{0}}(298.15\,{\text{K}}){\text{CaO}} + \\ + \,\,3{{\Delta }_{f}}{{H}^{0}}(298.15\,{\text{K}}){\text{Si}}{{{\text{O}}}_{2}} + \\ + \,\,{\text{1/3}}{{\Delta }_{f}}{{H}^{0}}(298.15\,{\text{K}}){\text{Al}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} - \\ - \,\,1{\text{/}}6{{\Delta }_{f}}{{H}^{0}}(298.15\,{\text{K}}){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}}, \\ \end{gathered} $Таблица 1.
Термохимические данные, использованные в расчетах энтальпии образования пектолита и серандита (кДж/моль)
| Компонент | H0(973 K) – H0(298.15 K) + ΔраствH0(973 K) | – ΔfH0(298.15 K)а |
|---|---|---|
| Na2O(к.) | –111.8 ± 0.8б | 414.8 ± 0.3 |
| MnO(к.) | 43.1 ± 0.8в | 385.2 ± 0.5 |
| CaO(к.) | –21.78 ± 0.29г | 635.1 ± 0.9 |
| Al2O3(корунд) | 107.38 ± 0.59д | 1675.7 ± 1.3 |
| SiO2(кварц) | 39.43 ± 0.21г | 910.7 ± 1.0 |
| Al(OH)3(гиббсит) | 172.6 ± 1.9е | 1293.1 ± 1.2 |
Таблица 2.
Термодинамические свойства пектолита и серандита, полученные в настоящей работе
| Минерал | –∆fH0(298.15 K), кДж/моль |
S0(298.15 K)а, Дж/(мольK) |
–∆fS0(298.15 K)б, Дж/(моль K) |
–∆fG0(298.15 K)в, кДж/моль |
|---|---|---|---|---|
| Пектолит Серандит |
4651.0 ± 4.3г 4052.6 ± 4.4д |
266.1 ± 1.6 306.5 ± 2.0 |
916.1 ± 1.6 853.9 ± 2.0 |
4377.9 ± 4.4 3798.0 ± 4.5 |
Необходимое для расчета энергии Гиббса образования пектолита значение его абсолютной энтропии было оценено по реакциям (4) и (5) с участием близких пектолиту по составу и структуре волластонита CaSiO3 и розенханита Ca3Si3O8(OH)2. Данные по S0(298.15 K) для компонентов этих реакций были заимствованы из (Robie, Hemingway, 1995).
(4)
$2{\text{CaSi}}{{{\text{O}}}_{{\text{3}}}} + {\text{NaOH}} + {\text{Si}}{{{\text{O}}}_{2}} = {\text{HNaC}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{9}}}}{\text{,}}$(5)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{3}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{8}}}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}}{\text{ + NaOH}} = \\ = {\text{HNaC}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{9}} + {\text{Ca}}{{\left( {{\text{OH}}} \right)}_{2}}. \\ \end{gathered} $Значение абсолютной энтропии S0(298.15 K) пектолита (табл. 2), рассчитанное как среднее из величин 269.3 ± 0.8 и 262.8 ± 3.0 Дж/(моль K), полученных по уравнениям (4) и (5) соответственно, было использовано для вычисления ΔfS0(298.15 K) и ΔfG0(298.15 K) пектолита (табл. 2).
Термодинамические свойства серандита
Термодинамические константы марганцевого конечного члена изоморфной серии пектолит – серандит были рассчитаны по схеме, использованной для пектолита. C использованием пересчитанных на состав серандита HNaMn2Si3O9 экспериментальных данных [H0(973 K) – H0(298.15 K) + ΔраствH0(973 K)] для пектолита по реакции и уравнениям, аналогичным (1), (2) и (3) была получена величина ΔfH0(298.15 K) серандита (табл. 2). По реакциям, аналогичным (5) и (6) с участием родонита MnSiO3 (вместо волластонита) и розенханита Ca3Si3O8(OH)2, были рассчитаны для серандита величины S0(298.15 K), равные 306.9 ± 2.2 и 306.0 ± 3.3 Дж/(моль K). Среднее из этих значений было использовано для вычисления ΔfS0(298.15 K) и ΔfG0(298.15 K) серандита (табл. 2).
Полученные впервые значения энтальпии и энергии Гиббса образования пектолита и серандита из элементов могут быть рекомендованы для включения их в базу данных фундаментальных термодинамических констант минералов, необходимых при проведении термодинамического моделирования процессов минералообразования в природных условиях и получения их синтетических аналогов.
Список литературы
Иванюк Г.Ю., Яковенчук В.Н. Минералы Ковдора. Кольский НЦ РАН. 1997. 118 с.
Киселева И.А., Огородова Л.П., Топор Н.Д., Чигарева О.Г. (1979) Термохимическое исследование системы СаО–MgO–SiO2. Геохимия. (12), 1811-1825.
Накамото К. (1991) ИК спектры и спектры КР неорганических и координационных соединений. М.: Мир, 504 с.
Огородова Л.П., Киселева И.А., Мельчакова Л.В., Вигасина М.Ф., Спиридонов Э.М. (2011) Калориметрическое определение энтальпии образования пирофиллита. ЖФХ. (9), 1609-1611.
Чуканов Н.В., Пеков И.В. (2012) Инфракрасная спектроскопия кислых солей. I. Минералы класса силикатов. Записки Российского Минералогического Общества. CXLI(3), 129-143.
Buerger M.J. (1956) The determination of the crystal structure of pectolite, Ca2NaHSi3O9. Z. Kristallogr. 108, 248-262.
Correcher V., Garcia-Guinea J., Castillejo M., Oujja M., Rebollar E., Lopes-Arce P. (2006) Laser-induced fluorescence and thermoluminescence response of a Na–Ca rich silicate. Radiat. Measur. 41, 971-975.
Fritsch S., Navrotsky A. (1996) Thermodynamic properties of manganese oxides. J. Am. Ceram. Soc. 79(7), 1761-1768.
Frost R.L., Lópes A., Theiss F.L., Romano A.W., Scholz R. (2015) A vibrational spectroscopic study of the silicate mineral pectolite – NaCa2Si3O8(OH). Spectrochim. Acta, Part A: Mol. Biomol. Spectrosc. 134, 58-62.
Hammer V.M.F., Libowitzky E., Rossman G. (1998) Single-crystal IR spectroscopy of very strong hydrogen bonds in pectolite, NaCa2Si3O8(OH), and serandite NaMn2Si3O8(OH). Am. Mineral. 83, 569-576.
Jacobsen S.D., Smyth J.R., Swope R.J., Sheldon R.I. (2000) Two proton position in the very strong hydrogen bond of serandite, NaMn2Si3O8(OH). Am. Mineral. 85, 745-752.
Kiseleva I.A., Navrotsky A., Belitsky I.A., Fursenko B.A. (2001) Thermochemical study of calcium zeolites – heulandite and stilbite. Am. Mineral. 86, 448-455.
Mitchell R.H., Welch M.D., Kampf A.R., Chakhmouradian A.K., Spratt J. (2015) Barrydawsonite-(Y), Na1.5Y0.5CaSi3O9H: a new pyroxenoid of the pectolite – serandite group. Miner. Mag. 79(3), 671-686
Ogorodova L.P., Melchakova L.V., Kiseleva I.A., Belitsky I.A. (2003) Thermochemical study of natural pollucite. Thermochim. Acta. 403, 251-256.
Origlieri M.J., Downs R.T., Yang H., Hoffman D.R., Ducea M.N., Post J.E. (2021) Marshallsussmanite, NaCaMnSi3O8(OH), a new pectolite-group mineral providing insight into hydrogen bonding in pyroxenoids. Miner. Mag. 85(3), 444-453.
Prewitt C.T. (1967) Refinement of the structure of pectolite, Ca2NaHSi3O9. Z. Kristallogr. 125(8), 298-316.
Robie R.A., Hemingway B.S. (1995) Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 pascals) pressure and at higher temperatures. U S Geol. Surv. Bull. 2131.
Rozhdestvenskaya I.V., Vasilieva V.A. (2014) Cation ordering and structural deformations in pectolite HNaCa2Si3O9 – serandite HNaMn2Si3O9. J. Struct Chem. 55(7), 1268-1276.
Zang S., Ci L., Mu W., Lu M. (2019) NaCa2Si3O8(OH)/PEDOT: PSS composite nanowires as anode materials for lithium-ion batteries. Chem. Phys. Lett. 715, 40-44.
Дополнительные материалы отсутствуют.