Геохимия, 2023, T. 68, № 2, стр. 163-172
Особенности распределения СН4 и СО2 в осадках арктических морей
В. С. Севастьянов a, *, В. Ю. Федулова a, О. В. Кузнецова a, С. Г. Наймушин a, Н. В. Душенко a, В. С. Федулов a, А. П. Кривенко a, А. И. Малова a, Е. А. Ткаченко a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: vsev@geokhi.ru
Поступила в редакцию 01.04.2022
После доработки 08.08.2022
Принята к публикации 24.08.2022
- EDN: CKYTGR
- DOI: 10.31857/S0016752523020085
Аннотация
Проведено исследование распределения концентраций СН4 и СО2 и других газов в осадках Карского, Лаптевых и Восточно-Сибирского морей. Установлено, что существует корреляция между СН4 и СО2 в большинстве колонок морских осадков. Коэффициент корреляции R для осадков Карского моря варьируется в диапазоне от 0.58 до 0.97 и не зависит от характера распределения газов по глубине осадка. Предположительно, в морских осадках метаногенез, сопряженный с сульфатредукцией, и гидрогенотрофный метаногенез приводят к росту концентрации СН4 на фоне высокой концентрации СО2. Наличие большой концентрации диметилсульфида в осадках свидетельствует о параллельном образовании CH4 и CO2 в результате метилотрофного метаногенеза с участием CH3SCH3. В верхних слоях осадка могут наблюдаться противоположные закономерности распределения концентраций газов СН4 и СО2. То, что коэффициенты корреляции газов СН4 и СО2 для осадков моря Лаптевых могут иметь отрицательные и положительные значения, вероятно, обусловлено тем, что в верхних слоях осадка, захваченного короткими колонками, процессы газообразования идут иначе, по сравнению с глубокими слоями.
ВВЕДЕНИЕ
Несмотря на многочисленные исследования органического вещества (ОВ) и газов осадков арктических морей (Галимов и др., 2006; Галимов, Кодина, 1982; Леин и др., 2007; Леин и др., 2012; Coffin et al., 2013; Semenov et al., 2020; Stein et al., 2003), до сих пор процессы образования газов в морских осадках остаются малоизученными. Известно, что в верхних горизонтах донных осадков протекают аэробные процессы, в нижних анаэробные. СН4 и СО2 являются конечными продуктами разложения органических веществ.
В зависимости от геохимических условий, процессы сульфат-редукции и метаногенеза могут идти как параллельно, так и замедлять друг друга. Например, при образовании СН4 путем ферментации ацетата процессы сульфат-редукции и метаногенеза идут параллельно. Конкуренция возникает, если единственным процессом, контролирующим метаногенез, является восстановление СО2 водородом, а количество сульфат-ионов достаточно для образования сероводорода (Федоров и др., 2007).
Известно, что в анаэробных условиях может происходить окисление метана консорциумом метанотрофных архей и сульфатредуцирующих бактерий (Каллистова и др., 2017; Knittel, Boetius, 2009; Hoehler et al., 1994; Boetius et al., 2000), но метаболизм данного процесса и факторы, контролирующие скорость окисления не до конца понятны.
В работе (Whelan, 1974) было показано, что распределение концентраций СН4 и СО2 в прибрежных болотных осадках южной Луизианы зависело от происходящих микробиологических процессов. На севере болот торфяные осадки покрыты пресной водой. На юге болотные осадки покрыты солоноватой водой, которая образуется в результате смешения пресной и морской воды. Наблюдалось схожее распределение концентраций СН4 и СО2 по колонке осадков на севере болот и различное на юге болот.
В ходе южнокорейской экспедиции ARA09C в 2018 г. была получена положительная корреляция концентраций СН4 и СО2 по колонке осадка станции AM01 в Чукотском море (Kim et al., 2020).
Целью данной работы являлось изучение закономерностей и зависимостей вертикального распределения концентраций газов СН4 и СО2 по колонкам осадков Карского, Лаптевых и Восточно-Сибирского морей и выявление процессов, приводящих к особенностям их распределения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В 2017–2020 гг. в рейсах 69, 72, 76 и 81 НИС “Академик Мстислав Келдыш” был осуществлен пробоотбор донных осадков в Карском, Лаптевых и Восточно-Сибирских морях. Положение станций показано на рис. 1 и 2. Станция 5602-2 находилась в Восточно-Сибирском море (рейс 69, более подробное изучение осадков Восточно-Сибирского моря приведено в работе Севастьянов и др., 2019). В табл. 1 отображена дополнительная информация по исследованным станциям.
Рис. 1.
Станции пробоотбора донных осадков 69-го, 72-го, 76-го и 81-го рейсов НИС “Академик Мстислав Келдыш” в 2017–2020 г. в Карском море. (Масштаб 1 : 10 000 000).
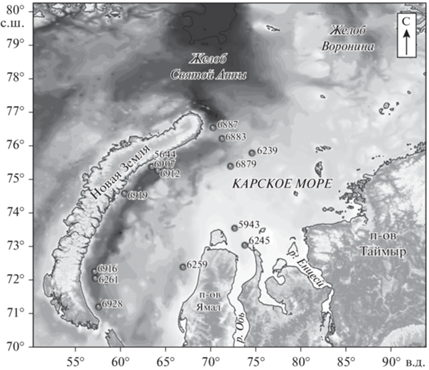
Рис. 2.
Станции пробоотбора морских осадков 72-го и 69-го рейсов НИС “Академик Мстислав Келдыш” в 2018 г. в море Лаптевых. (Масштаб 1 : 10 000 000).
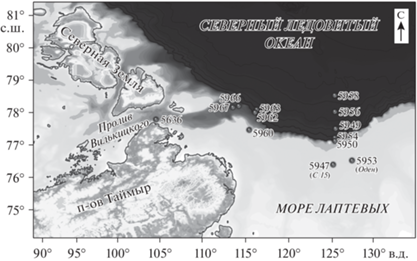
Таблица 1.
Пробоотбор донных осадков на станциях в Карском, Лаптевых и Восточно-Сибирском морях
| Станция | Расположение | № рейса | Глубина моря, м | Длина колонки, см |
|---|---|---|---|---|
| 5602-2 | Восточно-Сибирское м. | 69 | 27 | 177 |
| 5636 | прол. Вилькицкого | 69 | 225 | 419 |
| 5644 | зал. Благополучия Нов. Земли | 69 | 120 | 454 |
| 5943 | Карское м. | 72 | 31,5 | 32 |
| 5947 | м. Лаптевых, поле сипов С15 | 72 | 72,5 | 22 |
| 5949 | м. Лаптевых, Восточный разрез | 72 | 467 | 44 |
| 5950 | м. Лаптевых, Восточный разрез | 72 | 1074 | 34 |
| 5953-1 | м. Лаптевых, поле сипов Оден | 72 | 64 | 28 |
| 5953-3 | м. Лаптевых, поле сипов Оден | 72 | 63 | 24 |
| 5954 | м. Лаптевых, Восточный разрез | 72 | 1545 | 42 |
| 5956-2 | м. Лаптевых, Восточный разрез | 72 | 2348 | 44 |
| 5958 | м. Лаптевых, Восточный разрез | 72 | 2987 | 43 |
| 5960 | м. Лаптевых, Хатангский разрез | 72 | 354 | 34 |
| 5962 | м. Лаптевых, Хатангский разрез | 72 | 1090 | 24 |
| 5963 | м. Лаптевых, Хатангский разрез | 72 | 1485 | 42 |
| 5966 | прол. Вилькицкого | 72 | 415 | 32 |
| 5967 | прол. Вилькицкого | 72 | 425,2 | 47 |
| 6239 | Карское м., вблизи п-ова Ямал | 76 | 180 | 362 |
| 6245 | Карское м., эстуарий реки Оби | 76 | 28 | 213 |
| 6259 | Карское м. | 76 | 90 | 223 |
| 6261 | Карское м., Новоземельская вп. | 76 | 330 | 260 |
| 6879 | Карское м., склон желоба Святой Анны | 81 | 170 | 408 |
| 6883 | Карское м., склон желоба Святой Анны | 81 | 180 | 278 |
| 6887 | Карское м., желоб Святой Анны | 81 | 520 | 334 |
| 6907 | залив Благополучия Новой Земли | 81 | 170 | 292 |
| 6912 | Карское м., Новоземельская вп. | 81 | 310 | 319 |
| 6916 | Карское м., Новоземельская вп. | 81 | 350 | 274 |
| 6919 | Карское м., залив Русанова | 81 | 230 | 265 |
| 6928 | Карское м., Новоземельская вп. | 81 | 260 | 367 |
Районы исследований описаны в работах (Севастьянов и др., 2021; Флинт и др., 2018; Богоявленский и др., 2021; Панова и др., 2017; Baranov et al., 2020, Вержбицкий и др., 2012). Карское, Лаптевых и Восточно-Сибирское моря – это мелководные шельфовые моря арктического бассейна, находящиеся под влиянием речного стока. Наибольший объем речного стока в Карском, наименьший – в Восточно-Сибирском море. Влияние речного стока в море Лаптевых наиболее ощутимо прослеживается в восточной части моря. В отличие от Карского моря, в море Лаптевых и Восточно-Сибирском море широко распространены многолетнемерзлые породы, деградация которых приводит к локальным выбросам метана в водную толщу (метановые сипы). Кроме того, численность бактерий в водах Карского моря на порядок ниже, чем в море Лаптевых, но заметно возрастает в южной части Карского моря вблизи устьев Оби и Енисея (Саввичев и др., 2010).
Морские осадки отбирали с помощью бокс-корера (БК) и гравитационной трубы большого диаметра (ТБД). На каждой станции отбирали только одну колонку осадков. Длина колонок осадков, отобранных БК, не превышала 50 см, отобранных ТБД, не превышала 5 м. Колонки донных осадков в море Лаптевых отбирали только с помощью бокс-корера, поэтому длина колонок была небольшой. Мокрые морские осадки (300 мл) помещали в бутылки (0.5 л) с насыщенным раствором NaCl, создавали в них гелиевый пузырь объемом 10 мл, в который извлекали находящиеся в осадке газы. Для этого бутылки помещали в ультразвуковую ванну на 20 мин, затем в сушильный шкаф, нагретый до температуры 50–60°С, на 12 ч. Гелиевый пузырь с извлеченными газами с помощью шприца переносили в герметичный пенициллиновый флакон объемом 20 мл, предварительно заполненный солевым раствором. Концентрацию газов измеряли при помощи газового хроматографа “КристалЛюкс-4000М” (Йошкар-Ола, Россия) с капиллярными колонками HP-Plot Q (30 м × 0.53 мм × 40 мкм) и ZB-5 (30 м × 0.53 мм × 5 мкм). Поток газа-носителя гелия марки 6.0 составлял 10 мл/мин, температура термостата 120°С. Для анализа углеводородных газов использовали пламенно-ионизационный детектор, серосодержащих газов — пламенно-фотометрический, СО2 – детектор по теплопроводности. Среднее значение концентраций газов рассчитывали по трем измерениям.
Изотопный состав углерода СО2, выделенного из осадков, измеряли методом CF-IRMS (масс-спектрометрия изотопных отношений при постоянном потоке), используя газовый хроматограф HP 6890 (Hewllett Packard) с капиллярной колонкой PoraPlot Q (30 м × 0.32 мм × 0.25 мкм), соединенный с масс-спектрометром изотопных отношений Delta Plus (Thermo Fisher Scientific, Бремен, Германия). Концентрация остальных газов была ниже предела количественного обнаружения. Поток газа-носителя гелия марки 6.0 составлял 2 мл/мин, температура термостата 40°С. В качестве стандарта использовали СО2, аттестованный по международному стандарту TEX-843C (OZTech), имеющему значение δ13С = –40.79 ‰. Стандартное отклонение составило <±0.2‰.
РЕЗУЛЬТАТЫ И ИНТЕРПРЕТАЦИЯ
Коэффициенты корреляции R концентраций газов СН4 и СО2 по колонкам осадков в морях Российской Арктики представлены в табл. 1. Коэффициент корреляции рассчитывали для имеющихся горизонтов осадка, исключая горизонты с аномальной концентрацией, поскольку механизм газообразования в тонком поверхностном слое осадка может отличаться от механизмов в остальном осадке.
Колонки морских осадков в море Лаптевых отбирали с помощью бокс-корера, поэтому длина колонок была небольшой. Первые исследования выделенных из осадков моря Лаптевых газов представлены в работе (Севастьянов и др., 2021). Коэффициенты корреляции концентраций газов СН4 и СО2 по колонкам осадков моря Лаптевых могут быть отрицательными: R = –0.79 (станция 5960), R = –0.31 (станция 5963); положительными: R = = 0.70 (станция 5950), R = 0.59 (станция 5954), R = = 0.58 (станция 5958), R = 0.68 (станция 5962); либо иметь значение близкое к нулю R = 0.05 (станция 5949). Коэффициенты корреляции концентраций газов СН4 и СО2 в области сипов (станции 5947, 5953-1, 5953-3) варьировались в диапазоне от 0.01 до 0.58. Значения коэффициентов корреляции представлены в табл. 2.
Таблица 2.
Значения коэффициентов корреляции (R) концентраций газов СН4 и СО2 по колонкам осадков в морях Российской Арктики
| Станция | R (без учета ВСО*, см) | Станция | R (без учета ВСО*, см) |
|---|---|---|---|
| 5602-2 | 0.45 (0–12) | 5966 | 0.40 |
| 5636 | 0.97 (0–12) | 5967 | 0.57 |
| 5644 | 0.44 (0–64) | 6239 | 0.13 (0–2) |
| 5943 | 0.67 (0–1) | 6245 | 0.95 |
| 5947 | 0.58 | 6259 | 0.58 |
| 5949 | 0.05 | 6261 | 0.80 (0–30) |
| 5950 | 0.70 (0–1) | 6879 | 0.97 (0–4) |
| 5953-1 | 0.01 | 6883 | 0.93 (0–8) |
| 5953-3 | 0.39 | 6887 | 0.84 (0–8) |
| 5954 | 0.59 | 6907 | 0.97 (0–24) |
| 5956-2 | 0.16 | 6912 | 0.94 (0–20) |
| 5958 | 0.58 | 6916 | 0.81 (0–12) |
| 5960 | –0.79 | 6919 | 0.49 (0–4) |
| 5962 | 0.68 | 6928 | 0.93 (0–5) |
| 5963 | –0.31 |
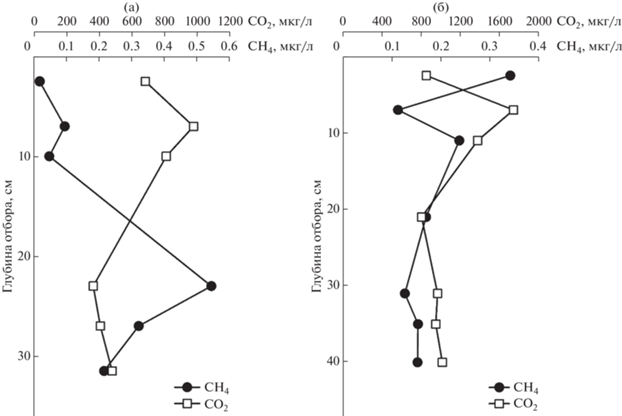
Поэтому кривые распределения концентраций газов СН4 и СО2 по колонкам осадков иногда различаются, особенно в поверхностном слое (0–15 см), т. к. процессы газообразования в морских осадках, связанные с трансформацией ОВ, могут иметь разную природу. На рис. 3 для станций 5960, 5963 видно, что в поверхностном слое колонки осадка для станции 5960 наблюдается положительная корреляция между газами СН4 и СО2, а для колонки станции 5963 она отрицательная.
Рис. 3.
Распределение концентрации газов СН4 и СО2 по колонкам осадков станций 5960 (а) и 5963 (б) в море Лаптевых.
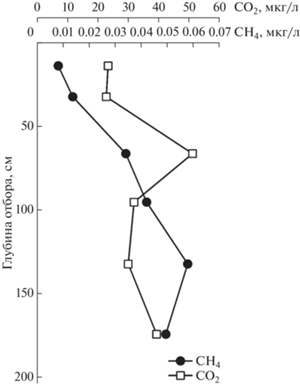
На рис. 4 представлены кривые распределения газов СН4 и СО2 в колонке осадка станции 5602-2, расположенной примерно в 250 км от устья р. Индигирка. Можно сделать вывод, что до горизонта 66.5 см концентрации газов коррелируют между собой, а для более глубоких горизонтов наблюдается обратная корреляция.
Рис. 4.
Распределение концентраций газов СН4 и СО2 по колонке осадков станции 5602-2 в Восточно-Сибирском море.
Средние концентрации газов в колонках осадков Карского моря приведены в табл. 3, для моря Лаптевых в (Севастьянов и др., 2021). Видно, что средние концентрации газов в колонке осадков в эстуарии р. Оби (станции 5943 и 6245) превышают концентрации газов в колонках осадков на других станциях. Концентрации непредельных углеводородных газов в морском осадке обычно превышают концентрации предельных углеводородных газов. При этом обычно средняя концентрация CO2 превышает среднюю концентрацию CH4 в 102–103 раз, а средняя концентрация CH4 может превышать среднюю концентрация CH3SCH3 в 2–10 раз. CH3SCH3 образуется при разложении водорослей и цианобактерий (Zhuang et al., 2017). В зоне сульфатредукции соединение CS2 окисляется с образованием COS (Bodenbender et al., 1999). Также в табл. 3 представлены сернистые газы с высокой концентрацией, которые свидетельствуют о бактериальной активности в морских осадках.
Таблица 3.
Средняя концентрация газов в осадках Карского моря
| Станции | Газы, мкг/л | |||||||
|---|---|---|---|---|---|---|---|---|
| CO2 | CH4 | C2H4 | C2H6 | C3H6 | C4H8 | COS | CH3SCH3 | |
| 6239 | 199.6 | 0.548 | 3.93 × 10–2 | н.о. | н.о. | 0.230 | 1.15 × 10–2 | 7.883 |
| 6245 | 517.6 | 1.896 | 5.03 × 10–2 | » | » | н.о. | 1.09 × 10–2 | 9.347 |
| 6259 | 384.9 | 2.066 | 5.61 × 10–2 | » | » | » | 1.81 × 10–2 | 6.932 |
| 6879 | 559.2 | 2.423 | 4.49 × 10–2 | 5.36 × 10–2 | » | 1.406 | 5.30 × 10–3 | 2.186 |
| 6883 | 639.5 | 2.715 | 4.45 × 10–1 | 4.32 × 10–2 | » | 1.404 | 5.18 × 10–3 | 1.729 |
| 6887 | 638.9 | 2.253 | 4.38 × 10–1 | 4.26 × 10–2 | » | 1.399 | 7.58 × 10–3 | 1.535 |
| 6907 | 188.4 | 2.207 | 3.50 × 10–1 | 1.16 × 10–2 | » | 1.408 | 1.49 × 10–3 | 0.624 |
| 6912 | 262.8 | 1.827 | 4.53 × 10–1 | 2.66 × 10–2 | » | 1.260 | 1.25 × 10–3 | 0.359 |
| 6916 | 663.7 | 1.872 | 4.61 × 10–1 | 4.18 × 10–2 | » | 1.441 | 1.09 × 10–2 | 0.539 |
| 6919 | 347.6 | 3.305 | н.о. | 2.63 × 10–2 | » | н.о. | 4.54 × 10–2 | 0.238 |
| 6928 | 1389.9 | 2.798 | 4.76 × 10–1 | 4.13 × 10–2 | 9.42 × 10–1 | 1.431 | 5.87 × 10–2 | 0.364 |
В эстуарии р. Оби морские осадки содержат повышенную концентрацию СН4 и органического вещества (Леин, Иванов, 2009; Саввичев и др., 2010). Коэффициент корреляции концентраций газов СН4 и СО2 для колонок станций 5943 и 6245 имеет значение 0.67 и 0.95, соответственно.
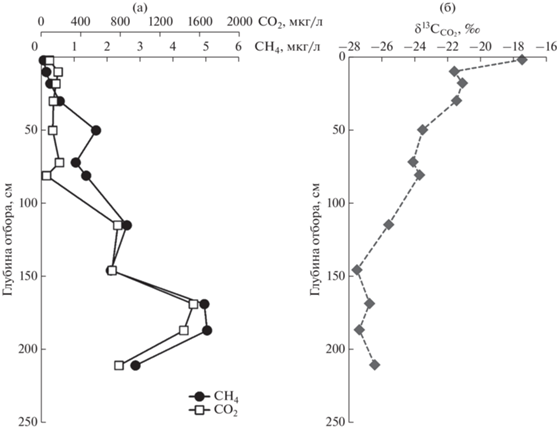
На рис. 5 видно распределение газов по колонке осадка станции 6245, расположенной в эстуарии р. Оби. Характер распределения СН4 в осадке соответствует распределению CO2. Концентрации CH4 и CO2 синхронно возрастают вглубь осадка. На горизонте 170–190 см были обнаружены максимальные концентрации CH4 и CO2. Следует отметить, что от поверхности осадка до горизонта 80 см наблюдается обратная корреляция CH4 и CO2, а затем корреляция становится положительной. Величина δ13С(CO2) изменяется с глубиной осадка станции 6245 от –17 до –27‰ (рис. 5б). Коэффициент корреляции концентрации CO2 и δ13С(CO2) имеет отрицательное значение R = –0.76. Это означает, что при увеличении содержания CO2 в осадке величина δ13С(CO2) убывает. Концентрация CH3SCH3 в колонке остается постоянной, за исключением первых 10 см колонки.
На границе эстуария р. Оби расположена станция 5943. Длина колонки отобранного осадка составила 32 см, коэффициент корреляции R = 0.67. Для этой колонки также наблюдается обратная корреляция между концентрациями газов CH4 и CO2 до горизонта 23 см, а затем корреляция становится положительной. Высокие коэффициенты корреляции получены для осадков в Новоземельской впадине R = 0.80 (ст. 6261), R = 0.81 (ст. 6916), R = 0.93 (ст. 6928), R = 0.94 (ст. 6912) и в желобе Святой Анны R = 0.84 (ст. 6887), R = 0.93 (ст. 6883), R = 0.97 (ст. 6879). Для осадков в заливе Благополучия Новой Земли коэффициент корреляции R равен 0.97 (ст. 6907) и 0.44 (ст. 5644). Только для колонок осадков станции в заливе Русанова (ст. 6919), станции 6259 вблизи полуострова Ямал и станции 6239 коэффициент корреляции газов равен 0.49, 0.58, 0.13, соответственно.
ОБСУЖДЕНИЕ
Основные реакции генерации СН4 и СО2 происходят в результате сульфат-редукции, ацетогенного метаногенеза и метилотрофного метаногенеза с участием диметилсульфида (Каллистова и др., 2017).
1. Сульфат-редукция.
(1)
$2\left[ {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right] + {\text{SO}}_{4}^{{2 - }} \to {{{\text{S}}}^{{2 - }}} + 2{\text{C}}{{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(2)
${\text{C}}{{{\text{O}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{S}}}^{{2 - }}} \to {\text{C}}{{{\text{H}}}_{4}} + {\text{SO}}_{4}^{{2 - }}.$Для того чтобы реакция (2) могла осуществиться, реакции (1) и (2) должны быть химически последовательны, чтобы энергетический выход первой мог обеспечить энергетический выход второй. В ходе процесса метанообразования баланс серы остается неизменным. Метаболизм серы в микробиологическом процессе метанообразования играет роль катализатора. Если бы CH4 образовывался исключительно за счет СО2, то рост его концентрации сопровождался бы уменьшением СО2 (Галимов, Кодина, 1982).
2. Ацетогенный метаногенез.
Метаногенные археи не используют в качестве источников питания и энергии органические соединения сложнее ацетата. Однако, они могут находиться в синтрофной ассоциации с неметаногенными микроорганизмами, способными превращать в ацетат более сложные соединения (Федоров и др., 2007).
(3)
${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{COOH}} \to {\text{C}}{{{\text{H}}}_{4}} + {\text{C}}{{{\text{O}}}_{2}}.$3. Метаногенез с участием диметилсульфида.
В процессе диагенеза морских осадков может происходить расщепление бактериями рода Pelagibacterales диметилсульфониопропианата, который входит в состав водорослей и цианобактерий, а также образование в большом количестве CH3SCH3 (Keller et al., 1989). Помимо этого, CH3SCH3 может образовываться в осадке путем метилирования H2S в анаэробных условиях. Например, метоксилированные ароматические соединения (в частности, мономеры лигнина) под действием микробов в присутствии H2S преобразуются в метантиол:
(4)
${\text{R - OC}}{{{\text{H}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{SH}} + {\text{R - OH}},$Затем, под влиянием ферментов бактерий происходит фиксация бикарбоната и метилирование метантиола с образованием CH3SCH3:
(5)
$\begin{gathered} {\text{HCO}}_{3}^{ - } + {{{\text{H}}}^{ + }} + 3{{{\text{H}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{SH}} \to \\ \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{SC}}{{{\text{H}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $В дальнейшем, при анаэробных условиях в морском осадке CH3SCH3 преобразуется в метан в соотношении 1 : 1.5:
(6)
$\begin{gathered} {\text{2(С}}{{{\text{H}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}{\text{S}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to 3{\text{C}}{{{\text{H}}}_{{\text{4}}}} + {\text{HCO}}_{3}^{ - } + 2{{{\text{H}}}_{{\text{2}}}}{\text{S}} + {{{\text{H}}}^{ + }}. \\ \end{gathered} $Таким образом, CH3SCH3 является неотъемлемым метаногенным соединением в морских осадках для сульфат-редукции (Zhuang et al., 2017).
Следует отметить, что коэффициент корреляции концентраций газов СН4 и СО2 для колонок длиной 200–400 см существенно больше, чем для колонок длиной до 50 см, что можно видеть в табл. 2. Например, для колонки осадка станции 5636, длиной 419 см, отобранной в проливе Вилькицкого, R = 0.97, для коротких колонок (до 45 см) станций 5966 и 5967 R равен 0.40 и 0.57 соответственно.
Коэффициенты корреляции концентраций газов СН4 и СО2 в колонках морских осадках в области сипов (станции 5947, 5953-1, 5953-3) имели небольшое значение. Это объясняется тем, что в области сипов по системам активных разломов и субвертикальных трещин (Богоявленский и др., 2021) происходит просачивание термогенных газов из глубинных источников в приповерхностные отложения и смешение их с бактериальным газом. Такая миграция газов приводит к нарушению корреляции концентраций СН4 и СО2. Вертикальные профили распределения газов для станций 5947, 5953-1, 5053-3 приведены в работе (Севастьянов, 2021).
То, что коэффициенты корреляции концентраций газов СН4 и СО2 для осадков моря Лаптевых могут иметь отрицательные и положительные значения, обусловлено небольшой длиной колонок осадков и более высокой микробной активностью по сравнению с осадками Карского моря (Саввичев и др., 2010). О микробной активности в морских осадках можно судить по их повышенной газовой насыщенности (табл. 2 в Севастьянов и др., 2021). В верхней части морского осадка (до 50 см) может происходить изменение характера зависимости между концентрациями СН4 и СО2 (рис. 3 в Севастьянов и др., 2021), свидетельствующее об изменении доминирующих микробиологических процессов в верхних горизонтах осадка. С увеличением глубины осадка микробиологическая активность уменьшается, а корреляция концентраций газов увеличивается.
Низкое значение коэффициента корреляции R = 0.45 для колонки осадка станции 5602-2 в Восточно-Сибирском море связано с тем, что биологические процессы, происходящие на разных горизонтах осадка, различаются (рис. 4). Для верхних горизонтов осадка (до 66.5 см) наблюдалась положительная корреляция между концентрациями газов СН4 и СО2 в результате протекания процессов (2) и (3), а на нижних горизонтах отрицательная корреляция связана с доминирующим процессом анаэробного окисления метана за счет восстановления сульфатов (Федоров и др., 2007). Поэтому, при уменьшении концентрации СН4 концентрация СО2 возрастает. Подобное распределение концентраций газов СН4 и СО2 по колонке можно видеть на рис. 3 для станции 5960, для станции 5963 (рис. 4) показано прямо противоположное распределение концентраций газов СН4 и СО2: положительная корреляция для верхних горизонтов осадка и отрицательная корреляция для нижних горизонтов. Подобное также наблюдается для станции 6245 (рис. 5) в Карском море.
Проведенные исследования показали, что в осадках Карского моря в большинстве случаев наблюдается синхронный рост и убыль концентрации газов СН4 и СО2. Значение коэффициента корреляции R варьируется от 0.58 до 0.97 и не зависит от характера распределения концентрации газов в морском осадке. Обнаруженный в осадках CH3SCH3 (табл. 2) доказывает, что в морских осадках происходит образование СН4 и СО2 в результате метилотрофного метаногенеза с участием CH3SCH3. Еще одним способом образования CO2 и CH4, являются сопряженные процессы сульфатредукции и метанообразования. Эти два процесса являются метаболически неразрывно сопряженными (Галимов, Кодина, 1982). Так как по термодинамическим расчетам сульфатредуцирующие бактерии подавляют скорость метаногенеза (Федоров и др., 2007), концентрация СО2 в осадке существенно выше концентрации СН4 (табл. 3). Вероятнее всего реакции (1), (2), а также гидрогенотрофный метаногенез идут параллельно, приводя к росту концентрации метана на фоне высокой концентрации СО2. Реакции (3) и (6) имеют меньшее значение, так как не приводят к образованию значительной концентрации СО2.
В некоторых случаях, корреляция отсутствовала, например, для осадков станций 6239 и 6919, что связано с особенностями литогенеза и притоком глубинных газов в местах пробоотбора. Станция 6919 расположена в заливе Русанова, в которой зафиксирована разломная структура в ходе 81 рейса, а станция 6239 расположена вблизи Известинской моноклинали, под которой, как предполагается, находится крупное скопление газов (Вербжицкий и др., 2012). Средняя концентрация CH4 в колонке станции 6919 равна 3.305 мкг/л и превышает среднюю концентрацию CH4 в других колонках осадков Карского моря и моря Лаптевых (Севастьянов и др., 2021). Незначительная концентрация CH3SCH3 указывает на слабую микробиологическую активности в осадке станции. В колонке станции 6239 средние значения концентраций газов (CH4, CO2, C2H4, C4H8) значительно меньше по сравнению с осадками других станций Карского моря. Также на этой станции наблюдается обратная ситуация для CH3SCH3 (табл. 3). Высокая концентрация CH3SCH3 свидетельствует о высокой микробиальной активности в этом осадке (Zhuang et al., 2017).
Для станций 5644 и 6907 в заливе Благополучия архипелага Новая Земля коэффициенты корреляции R сильно различаются (табл. 2). Это обусловлено расположением залива Благополучия в зоне субвертикальных трещин разломной структуры. Вероятно, станция 5644 находится в зоне разлома. Поэтому в осадок поступают термогенные газы из глубинных источников, которые смешиваются с биогенными газами, образованными в верхней части осадочного разреза. Вероятно, следствием этого является низкий коэффициент корреляции. Доказательством глубинного происхождения СО2 служит высокое среднее значение изотопного состава углерода CO2 δ13С = –10.46 ± 0.89‰. Для станции 6907, которая, вероятно, не имеет подобных особенностей расположения, изотопный состав углерода CO2 имеет низкое значение δ13С = –21.08 ± 1.49‰, которое свидетельствует о биогенном происхождении CO2 (Dai et al., 1996; Meister, Reyes, 2019).
В некоторых колонках (станции 5949, 5950, 6261, 6912, 6916) в поверхностном слое (0–15 см) осадков наблюдались повышенная в несколько раз концентрация СО2 по сравнению с более глубокими горизонтами. Это связано с аэробным окислением метана метанотрофами или с анаэробным окислением метана в результате восстановления сульфатов. При этом в поверхностных слоях морских осадков фиксируются значения δ13С(CO2) = –16…–14‰. В результате диффузии СО2 из осадка в водную среду происходит возрастание величины δ13С(CO2) в приповерхностных слоях осадка.
В эстуарии р. Оби морские осадки содержат повышенную концентрацию СН4 и органического вещества. Известно (Федоров и др., 2007), что наиболее высокие концентрации СН4 фиксируются в зонах смешения речных и морских вод, где наблюдается активное осаждение тонких взвешенных частиц, происходит флокуляции и коагуляции взвешенных веществ. Отрицательная корреляция концентраций газов, которая наблюдется в верхних слоях осадка станции 6245 (рис. 5), говорит об анаэробном окислении СН4 за счет сульфатов или за счет анаэробных метанотрофов (Федоров и др., 2007). В более глубоких слоях осадка наблюдается положительная корреляция, которая, возможно, является следствием процесса ацетогенного метаногенеза или метаногенеза с использованием CH3SCH3.
Неравномерное распределение газов по глубине осадка станции 6245 свидетельствует о неравномерности микробиологической активности в различных слоях. Наибольший разброс значений концентраций по глубине осадка станции имеют непредельные углеводороды (C2H4, C4H8). На данной станции не были обнаружены такие газы, как C3H6 и C3H8, а C2H6 был обнаружен не на всех горизонтах (табл. 3).
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований распределения концентраций газов СН4 и СО2 по колонкам осадков Карского моря выявлено, что существует положительная корреляция между этими газами. Коэффициент корреляции варьирует от 0.58 до 0.97 и не зависит от характера вертикального распределения СН4 и СО2 в осадке. Предположительно, метаногенез, сопряженный с сулфатредукцией, и гидрогенотрофный метаногенез приводят к росту концентрации СН4 на фоне высокой концентрации СО2. Ацетогенный метаногенез и метилотрофный метаногенез с участием CH3SCH3 имеют меньшее значение, так как не приводят к образованию значительной концентрации СО2. Наличие в осадках CH3SCH3 является доказательством протекания метилотрофного метаногенеза.
В некоторых случаях в поверхностном слое (0–15 см) осадков наблюдалась повышенная в несколько раз концентрация СО2 по сравнению с более глубокими горизонтами. Это объясняется аэробным окислением СН4 метанотрофами или анаэробным окислением СН4 в результате восстановления сульфатов. Основываясь на особенностях распределения концентрации газов СН4 и СО2 в морских осадках и содержании биогенных газов, можно предположить протекание микробиальных процессов, приводящих к образованию газов. При поступлении в осадок термогенных газов из разломов в осадочных породах происходит их смешение с биогенными газами, образованными в верхней части осадка. Это ухудшает корреляцию между концентрациями газов.
В верхних слоях осадка могут наблюдаться противоположные закономерности распределения концентраций газов СН4 и СО2. Поэтому коэффициенты корреляции газов СН4 и СО2 для осадков моря Лаптевых имели отрицательные и положительные значения, что, вероятно, обусловлено более высокой микробной активностью в верхних горизонтах осадков и тем, что в верхних слоях осадка, захваченного короткими колонками, процессы газообразования идут иначе, по сравнению с глубокими слоями.
Список литературы
Богоявленский В.И., Казанин А.Г., Кишанков А.В., Казанин Г.А. (2021) Дегазация Земли в Арктике: комплексный анализ факторов мощной эмиссии газа в море Лаптевых. Арктика: экология и экономика. 11(2), 178-194.
Вержбицкий В.Е., Косенкова Н.Н., Ананьев В.В., Малышева С.В., Васильев В.Е., Мурзин Р.Р., Комиссаров Д.К., Рослов Ю.В. (2012) Геология и углеводородный потенциал Карского моря. Oil & Gas J. Russia. (1–2), 48-54.
Галимов Э.М., Кодина Л.А. (1982) Исследование органического вещества и газов в донных толщах дна Мирового океана. М.: Наука, 228 с.
Галимов Э.М., Кодина Л.А., Степанец О.В., Коробейник Г.С. (2006) Биогеохимия Российской Арктики. Карское море. Результаты исследований по проекту SIRRO 1995–2003 гг. Геохимия. (11), 1139-1191.
Galimov E.M., Kodina L.A., Stepanets O.V., Korobeinik G.S. (2006) Biogeochemistry of the Russian Arctic. Kara sea: research results under the SIRRO project, 1995–2003. Geochem. Int. 44(11), 1053-1104.
Каллистова А.Ю., Меркель А.Ю., Тарновецкий И.Ю., Пименов Н.В. (2017) Образование и окисление метана прокариотами. Микробиология. 86(6), 661-683.
Леин А. Ю., Саввичев А.С., Русанов И.И., Павлова Г.А., Беляев Н.А., Крейн К., Пименов Н.В., Иванов М.В. (2007) Биогеохимические процессы в Чукотском море. Литология и полезные ископаемые. (3), 247-266.
Леин А.Ю., Иванов М.В. (2009) Биогеохимический цикл метана в океане. М.: Наука, 576 с.
Леин А.Ю., Кравчишина М.Д., Политова Н.В., Саввичев А.С., Веслополова Е.Ф., Мицкевич И.Н., Ульянова Н.В., Шевченко В.П., Иванов М.В. (2012) Трансформация взвешенного органического вещества на границе вода–дно в морях Российской Арктики (по изотопным и радиоизотопным данным). Литология и полезные ископаемые. (2), 115-145.
Панова Е.В., Рубан А.С., Дударев О.В., Тези Т., Бредер Л., Густафссон О., Гринько А.А., Шахова Н.Е., Гончаров И.В., Мазуров А.К., Семилетов И.П. (2017) Литологические особенности донных осадков и их влияние на распределение органического материала на территории Восточно-Сибирского шельфа. Известия Томского политехнического ун-та. Инжиниринг георесурсов. 328(8), 94-105.
Саввичев А.С., Захарова Е.Е., Веслополова Е.Ф., Русанов И.И., Леин А.Ю., Иванов М.В. (2010) Микробные процессы циклов углерода и серы в Карском море. Океанология. 50(6), 942-957.
Севастьянов В.С., Федулова В.Ю., Стенников А.В., Кузнецова О.В., Наймушин С.Г., Душенко Н.В., Кривенко А.П. (2021) Особенности распределения газов в верхнем слое осадков в системе континентальный шельф моря Лаптевых – Ледовитый океан. Океанология. 61(4), 472-487.
Федоров Ю.А., Тамбиева Н.С., Гарькуша Д.Н., Хорошевская В.О. (2007) Метан в водных экосистемах. Ростов на Дону: Ростиздат, 330 с.
Флинт М.В. Арашкевич Е.Г., Артемьев В.А., Баранов Б.В., Беззубова Е.М., Белевич Т.А., Веденин А.А., Галкин С.В., Гончаренко И.В., Демидов А.Б., Дриц А.В., Дроздова А.Н., Казеннов А.Ю., Косолапов Д.Б., Кравчишина М.Д., Лобус Н.В., Маккавеев П.Н., Мирошников А.Ю., Мишин А.В., Осадчиев А.А., Полухин А.А., Поярков С.Г., Пронин А.А., Римский-Корсаков Н.А., Романова Н.Д., Саввичев А.С., Суханова И.Н., Чернецкий А.Д., Шатравин А.В., Щука С.А. (2018) Экосистемы морей Сибирской Арктики. Материалы экспедиционных исследований 2015 и 2017 гг. М.: АПР, 232 с.
Baranov B., Galkin S., Vedenin A., Dozorova K., Gebruk A., Flint M. (2020) Methane seeps on the outer shelf of the Laptev Sea: characteristic, features, structural control, and benthic fauna Geo-Marine Letters. 40, 541-557.
Bodenbender J., Wassmann R., Papen H., Rennenberg H. (1999) Temporal and spatial variation of sulfur-gas-transfer between coastal marine sediments and the atmosphere. Atmospheric Environment. 33, 3487-3502.
Boetius A., Ravenschlag K., Schubert C.J., Rickert D., Widdel F., Gieseke A., Amann R., Jùrgensen B.B., Witte U., Pfannkuche O. (2000) A marine microbial consortium apparently mediating anaerobic oxidation of methane. Nature. 407, 623-626.
Coffin R.B., Smith J.P., Plummer R.E., Yoza B., Larsen R.K., Millholland L.C., Montgomery M.T. (2013) Spatial variation in shallow sediment methane sources and cycling on the Alaskan Beaufort Sea Shelf/Slope. Marine and Petroleum Geology. 45, 186-197.
Dai J.-X., Song Y., Dai C.-S., Wang D.-R. (1996) Geochemistry and accumulation of carbon dioxide gases in China. AAPG Bulletin. 80(10), 1615-1626.
Hoehler T.M., Alperin M.J., Albert D.B., Martens C.S. (1994) Field and laboratory studies of methane oxidation in an anoxic marine sediment: Evidence for a methanogen-sulfate reducer consortium. Global Biogeochem Cycles. 8(4), 451-463.
Keller M.D, Bellows W.K., Guillard R.R. (1989) Dimethyl sulfide production in marine phytoplankton In Biogenic sulfur in the environment. (Eds. Saltzman E.S., Cooper W.J.). Washington, D.C.: American Chemical Society, 167-182.
Kim J.-H., Hachikubo A., Kida M., Minami H., Lee D.-H., Jin Y.K., Ryu J.-S., Lee Y.M., Hur J., Park M.-H., Kim Y.-G., Kang M.-H., Park S., Chen M., Kang S.-G., Kim S. (2020) Upwarding gas source and postgenetic processes in the shallow sediments from the ARAON Mounds, Chukchi Sea. J. Natural gas Science and Engineering. 76, 103223.
Knittel K., Boetius A. (2009) Anaerobic Oxidation of Methane: Progress with an Unknown Process. Annual Review of Microbiology. 63, 311-334.
Meister P., Reyes C. (2019) The Carbon-Isotope Record of the Sub-Seafloor Biosphere. Geosciences. 9(12). 507, 1-25.
Semenov P., Portnov A., Krylov A., Egorov A., Vanshtain B. (2020) Geochemical evidence for seabed fluid flow linked to the subsea permafrost outer border in the South Kara Sea. Geochemistry. 80(3), 125509.
Stein R., Fahl K., Futterer D., Galimov E.M., Stepanets O.V. (2003) Siberian river run-off in the Kara Sea. Characterisation, quantification, variability and environmental signification. Amsterdam: Elsevier, 2003. 488 p.
Whelan T. (1974) Methane and carbon dioxide in coastal marsh sediments. In Natural gases in marine sediments (Ed. Kaplan I.R.), N.Y.: Plenum Press, 47-61.
Zhuang G.-C., Lin Yu-S., Bowles M.W., Heuer V.B., Lever M.A., Elvert M., Hinrichs K.-U. (2017) Distribution and isotopic composition of trimethylamine, dimethylsulfide and dimethylsulfonniopropionate in marine sediments. Marine Chemistry. 196, 35-46.
Дополнительные материалы отсутствуют.