Геохимия, 2023, T. 68, № 3, стр. 285-293
Формирование азотных терм в системах “вода–гранит” и “вода–порфирит”
С. Х. Павлов a, *, К. В. Чудненко b
a Институт земной коры СО РАН
664033 Иркутск, ул. Лермонтова, 128, Россия
b Институт геохимии им. А.П. Виноградова СО РАН
664033 Иркутск, ул. Фаворского, 1а, Россия
* E-mail: spavlov@crust.irk.ru
Поступила в редакцию 03.03.2022
После доработки 27.09.2022
Принята к публикации 29.09.2022
- EDN: MEANXF
- DOI: 10.31857/S0016752523030093
Аннотация
С помощью моделирования исследованы процессы эволюционного преобразования растворов в кристаллических породах разного состава в условиях формирования азотных терм. Установлено, что основополагающим фактором в формировании растворов, по составу отвечающих современным азотным термам, является присутствие во вмещающих породах в соответствующих концентрациях анионогенных элементов. Они создают характерную геохимическую обстановку, которая определяет содержание и формы нахождения их в растворах и момент появления и/или исчезновения и интенсивность образования вторичных минералов на каждом шаге изменения величины отношения порода/вода. Как у катионов, так и у анионов, четко выдерживается последовательность их присутствия в растворе в соответствии с их концентрацией в породе до момента, когда появление вторичных минералов преобразует направление изменения концентраций компонентов в растворе. Раскрыты причины низкой и очень низкой минерализации азотных терм, низких концентраций Mg, Ca, K и высоких содержаний Na и Si. Современные азотные термы не могут сформироваться в породах, содержащих анионогенные элементы в количестве, отвечающем их средним значениям. На основе выявленной высокой дискретности распространения этих элементов в пространстве и крайне слабой их изученности сделан вывод, что успешное изучение гидрогеохимических процессов невозможно без учета геологической неоднородности, являющейся ключевой проблемой гидрогеохимии, которая не учитывается при исследовании процессов взаимодействия в системе вода/порода.
ВВЕДЕНИЕ
Формирование азотных терм, относительно углекислых и метановых, с давних пор считается простым, поэтому они были определены как акро-, акрато- или простые термы, которые называют также кремнистыми. Однако, анализ существующей ситуации показывает, что процессы формирования азотных терм далеко не простые. Здесь существует достаточно представительный ряд проблемных вопросов. К ним относятся низкая и очень низкая минерализация этих растворов и повышенные и высокие концентрации таких элементов, как C, Cl, F, N, Na, S, Si. Объяснение генезиса этих элементов носит остродискуссионный характер и активно обсуждается в отечественной и особенно в зарубежной печати, где им ежегодно посвящаются десятки публикаций.
Как в отечественных, так и в зарубежных исследованиях четко выделяются два направления. Традиционное, к которому принадлежит основная масса исследователей, связано с аддитивным накоплением фактического материала, получаемого современными химико-аналитическими, физико-химическими и изотопными методами исследований, и более редкое – изучение физико-химических процессов в результате взаимодействий в системе “вода–порода–газ–органическое вещество” с помощью компьютерных технологий.
Среди большого количества современных публикаций, основанных на традиционных методах изучения азотных терм, вызывает интерес представительный ряд работ, раскрывающих различные стороны жизни гидротерм в Тихоокеанском поясе азотных термальных вод (Архипов, 2009; Кулаков, 2011, 2014; Кулаков, Сидоренко, 2017; Челноков и др., 2014; Чудаев, Чудаева, 2009) и в одной из крупнейших в мире провинций азотных терм – Байкальской рифтовой зоне (Плюснин и др., 2013; Шварцев, 2017; Шварцев и др., 2015). Следует отметить, что наиболее важными результатами перечисленных исследований являются установление в Тихоокеанском поясе азотных термальных вод зонального строения гидрогеохимического разреза и выявление экзотического HCO3–F–Na химического типа терм в Байкальской рифтовой зоне. Изучение фтора представляет особый интерес для исследователей, высокие концентрации которого в термальных водах выявлены во многих странах и поступление которого в раствор активно обсуждается и изучается также и с помощью моделирования (Chae et al., 2007; Cuccuru et al., 2020; Lottermoser et al., 2007; Chatterjee et al., 2022; Žáček et al., 2015; Zhang et al., 2015).
Процессы формирования состава модельных растворов в результате физико-химических взаимодействий воды с гранитом рассматриваются: при высоких температурах и давлениях (Dolejs, Wagner, 2008), при изучении жильного гидротермального рудообразования (Борисов и др., 2006, 2016), в зоне замедленного и активного водообмена (Крайнов, Рыженко, 1997; Dutova et al., 2017) и в условиях формирования азотных терм (Крайнов, Рыженко, 1996; Рыженко, Крайнов, 2003; Павлов, Чудненко, 2013). В последних работах показано, что растворы гранита, содержащего средние концентрации анионогенных летучих компонентов, имеют гидросиликатный натриевый состав в интервале развития системы, соответствующем характеристикам природных терм. Эти результаты убедительно подтверждаются данными изучения состава азотных термальных вод в ряде природных гидрогеохимических систем (Крайнов и др., 2012).
В представительном коллективе исследователей второго направления (Методы…, 1988), особо выделяются С.Р. Крайнов и Б.Н. Рыженко, которые в большом количестве своих работ рассмотрели не только общетеоретические вопросы физико-химических взаимодействий в системе “вода–порода”, но и процессы формирования состава подземных вод в широком интервале изменения термодинамических условий (Крайнов и др., 1983, 1996, 1997, 2004, 2012; Рыженко, 1994; Рыженко и др., 2003; и др.).
Независимо от применяемых методов исследования, выделяются два принципиально разных подхода в объяснении результатов взаимодействия воды с породой. Ряд исследователей формирование состава азотных терм тесно увязывают с составом водовмещающих пород (Басков, Судариков, 1989; Крайнов и др., 1983, 2004, 2012; Deng et al., 2011; Seelig, Bucher, 2010; и др.). Авторы данной работы именно с этих позиций рассмотрели процессы взаимодействия воды с гранитом среднего состава (Павлов, Чудненко, 2013а), с гранитом и кристаллическим сланцем, распространенными в местах проявлений гидротерм, (Павлов, Чудненко, 2013б; Павлов и др., 2018) и с порфиритом (Павлов и др., 2020). В результате был прослежен не только общий ход эволюционного преобразования растворов рассматриваемых пород, но и выявлены необходимые условия приближения состава модельных растворов к составу природных терм.
В то же время активно разрабатывается представление о том, что накопление, так называемых “избыточных” компонентов в растворе, по отношению к средним их содержаниям в породе, происходит за счет гидрогеохимических процессов в системе “вода–порода” (Замана, 2000; Плюснин и др., 2013; Шварцев, 2017; Шварцев и др., 2015; 2020; и др.). При этом авторы убеждены, что в породе эти элементы находятся именно в рассеянном состоянии, а определяющим фактором увеличения их концентрации в растворе является уменьшение объема инфильтрационных вод, питающих азотные термы в результате взаимодействия их с породами в десятки и возможно даже в сотни раз (Шварцев, 1975). Неопределенность, существующая в данном вопросе, заставляет исследователей колебаться между этими точками зрения на формирование состава азотных терм (Крайнов, Рыженко, 1996).
В данной работе предпринята попытка дать достаточно определенный ответ на дискуссионные вопросы формирования состава азотных терм в различных по составу породах с помощью количественного изучения процессов физико-химических взаимодействий в системе “вода–кристаллическая порода”.
ИСХОДНЫЕ ДАННЫЕ И МЕТОДИКА ИССЛЕДОВАНИЙ
Формирование состава азотных терм исследовано путем количественного изучения физико-химических взаимодействий в системах “вода–гранит” и “вода–порфирит” с помощью программного комплекса Cелектор (Карпов, 1981; Чудненко, 2010), в рамках системы Al–Ar–C–Ca–Cl–Mn–F–Fe–K–Mg–Na–P–S–Si–Ti–H–O. В модели представлены практически все наиболее возможные в реальных условиях компоненты водного раствора (167), газы (Аr, СО, СО2, СH4, Н2, О2, H2S, S2, SO2, SO3), в том числе растворенные, и твердые фазы (более 80 минералов), обеспеченные достаточно надежными термодинамическими данными. Необходимая термодинамическая информация взята из встроенных в программный комплекс “Селектор” баз термодинамических данных (Berman, 1988; Holland, Powell, 1990; Johnson et al., 1992; Reid et al., 1977; Robie, Hemingway, 1995; Shock et al., 1997). Кремний, один из весьма проблемных компонентов, не только при проведении аналитических работ, но и в существующих базах данных, представлен в растворе в виде кремнекислоты в форме ${\text{SiO}}_{2}^{^\circ }$ и иона метакремниевой кислоты ${\text{HSiO}}_{3}^{ - },$ взятыми из термодинамических баз данных (Johnson et al., 1992; Shock et al., 1997).
Исследование проведено по степени протекания гидрогеохимического процесса, которая задавалась путем изменения величины отношения порода/вода при этом масса воды, равная 1 кг, была постоянной, а количество породы последовательно увеличивалось от 1 × 10–6 до 1 × 100 кг. Системы “вода–гранит” и “вода–порфирит” закрыты к атмосфере и имеют постоянную температуру и давление, равные 100°С и 250 барам. Эти термодинамические условия достаточно представительны для формирования азотных терм (Барабанов, Дислер, 1968).
Достоверность модели и уровень согласованности термодинамических данных оценивались с помощью многочисленных контрольных расчетов с последующей их верификацией на фактических данных реальных проявлений азотных термальных вод.
В проведенном моделировании взаимодействия “вода–гранит” “вода–порфирит” использовалась “чистая вода”, а не природные растворы (дождевая, поверхностная или подземная вода), что позволило рассмотреть закономерности протекания процессов формирования азотных терм за счет гидролитических преобразований породы без влияния наложенных эффектов, зависящих от особенностей конкретных природных объектов.
Состав исследуемых образцов приведен в табл. 1. Как видно, состав гранита синтезирован – петрогенные элементы отвечают их средним значениям в работе (Богатиков и др., 1987), а количество анионогенных элементов, соответствует их средним величинам в работе (Виноградов, 1962). Этот прием достаточно широко применяется в гидрогеохимических работах, как традиционного направления, так и по моделированию. Химический состав образца порфирита из массива Кураминского хребта в Средней Азии, определен в работе (Козлова, Рыбалова, 1965). Важно заметить, что это крайне редкий образец. Однако, редкий он не потому, что такие концентрации вещества редко встречаются в природе, а потому, что в нем реально определены все основные анионогенные элементы. Не касаясь содержания петрогенных элементов, отметим, что количество анионогенных элементов в порфирите многократно превышает их средние концентрации в граните, за исключением хлора, содержание которого чуть ниже среднего значения.
Таблица 1.
Химический состав горных пород, использованных при моделировании, мас. %
| Компонент | Образец | |
|---|---|---|
| гранит*, ** | порфирит*** | |
| SiO2 | 71.57* | 48.4 |
| TiO2 | 0.35* | 1.4 |
| Al2O3 | 14.75* | 15.75 |
| Fe2O3 | 0.76* | 2.53 |
| FeO | 1.5* | 5.91 |
| CaO | 1.89* | 8.22 |
| MgO | 0.96* | 4.41 |
| K2O | 4.25* | 2.01 |
| Na2O | 3.12* | 4.59 |
| MnO | 0.07* | 0.69 |
| P2O5 | 0.12* | 0.71 |
| S | 0.04** | 0.17 |
| C | 0.03** | – |
| CO2 | – | 3.6 |
| Cl | 0.024** | 0.02 |
| F | 0.08** | 0.57 |
| H2O | 0.51* | 1.88 |
| Сумма | 100.02 | 100.86 |
РЕЗУЛЬТАТЫ
В результате взаимодействия воды как с гранитом, так и с порфиритом по мере увеличения степени взаимодействия происходит направленное изменение состава и состояний формирующихся растворов (рис. 1). Растет их минерализация, повышается щелочность, увеличиваются восстановительные свойства. Несмотря на сходный характер изменения этих параметров растворов, они существенно отличаются. На начальных этапах взаимодействия растворы близки по величине минерализации, но в растворе гранита количество растворенных веществ чуть выше, и он обладает меньшими восстановительными свойствами и чуть более повышенной кислотностью. С увеличением степени взаимодействия отмечается флуктуация этих характеристик и затем происходит выход на лидирующие позиции раствора порфирита по величине минерализации, а раствора гранита по интенсивности восстановительных свойств и повышенной щелочности. Преобладание минерализации раствора порфирита над раствором гранита сохраняется в представительном интервале взаимодействий и достигает почти трехкратного превышения.
Рис. 1.
Изменение величин Eh, pH и минерализации растворов в зависимости от степени взаимодействия воды с гранитом и порфиритом при T = 100°C и Р = = 250 бар. Растворы: гранита – 1, 3, 5; порфирита – 2, 4, 6; 1, 2 – Eh; 3, 4 – pH; 5, 6 – минерализация.
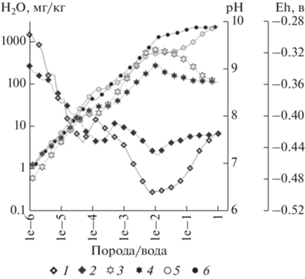
Весьма примечательным моментом развития обеих систем является то, что при достижении определенной величины отношения взаимодействующих масс различие между данными интегральными характеристиками обоих растворов начинает уменьшаться, а затем и нивелируется. Все выраженные отклонения интегральных характеристик растворов от направленного поступательного их развития, вплоть до инверсии, строго согласованы не только между собой, но и компонентами растворов, и поведением вторичных минеральных образований.
На начальных этапах взаимодействия содержание катионов в обоих растворах, независимо от их минерализации, находится в строгом соответствии с величиной их содержания в породе (рис. 2, рис. 1, табл. 1). Эта строгая зависимость сохраняется до момента появления вторичных минеральных образований, в состав которых входят рассматриваемые катионогенные элементы. В обоих растворах раньше всех прекращается накопление магния, с появлением и увеличением, по мере повышения степени взаимодействия, клинохлора в твердой фазе. Высокое содержание магния в порфирите (табл. 1), обеспечивает лишь его более высокую концентрацию в растворе по сравнению с раствором гранита, но относительно других катионов его присутствие в обоих растворах очень низкое и в масштабе данного рисунка он не представлен. Из всех катионов последним влияние перераспределения вещества между раствором и твердой фазой с момента появления альбита испытывает натрий, тем не менее, его содержание в растворах продолжает с различной интенсивностью увеличиваться до предельного значения для данных систем в исследованном интервале взаимодействий (рис. 1, 2).
Рис. 2.
Изменение содержания катионов в зависимости от степени взаимодействия воды с гранитом и порфиритом при T = 100°C и Р = 250 бар. Растворы: гранита – 1, 3, 5, порфирита – 2, 4, 6. Компоненты: 1, 2 – Ca; 3, 4 – K; 5, 6 – Na.
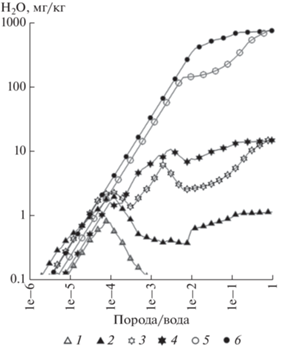
В отличие от крайних значений концентраций магния и натрия, которые в данных условиях имеют единичные вторичные образования, представительные группы минералов контролируют поведение в растворе кальция (фторапатит, маргарит, сфен, ломонтит, кальцит, флюорит) и калия (мусковит, аннит, калиевый шпат). Появление этих вторичных твердых фаз на разных этапах взаимодействия обусловливает, с одной стороны, волнообразный характер кривых концентраций кальция и калия в процессе эволюционного развития растворов гранита и порфирита, с другой – ограничивает их присутствие на низких уровнях концентраций даже несмотря на значительное превышение их содержания в породе по сравнению с лидером катионов натрием (рис. 2, табл. 1).
Если поведение катионов в обоих растворах имеет довольно сходный характер, то их анионный состав отличается ярко выраженным своеобразием. При взаимодействии воды с гранитом, формирующийся раствор, минерализация которого соответствует широко распространенным значениям минерализации природных азотных терм, имеет гидросиликатный состав с повышенным содержанием гидроксид иона (рис. 3а). Наряду с гидросиликатным ионом в растворе присутствует недиссоциированная кремниевая кислота, концентрация которой с достаточно раннего этапа взаимодействий сохраняется на одном уровне и общее содержание кремния в растворе определяется поведением гидросиликатного иона.
Рис. 3.
Изменение содержания кремниевой кислоты и анионов в зависимости от степени взаимодействия воды с гранитом (а) и порфиритом (б) при T = 100°C и Р = 250 бар. 1 – OH–; 2 – ${\text{SiO}}_{2}^{^\circ };$ 3 – ${\text{HSiO}}_{3}^{ - };$ 4 – ${\text{HCO}}_{3}^{ - };$ 5 – ${\text{CO}}_{3}^{{2 - }};$ 6 – ${\text{SO}}_{4}^{{2 - }};$ 7 – HS–; 8 – F–; 9 – Cl–.
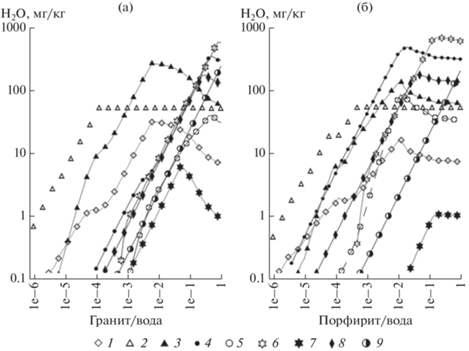
В отличие от раствора гранита раствор порфирита на этом этапе взаимодействий имеет HCO3–HSiO3 состав с представительными концентрациями фторидного, сульфатного и карбонатного ионов (рис. 3б). Присутствие гидросиликатного иона здесь значительно понижено, причем его значимость уменьшается в основном в связи с ростом фторидного, сульфатного и карбонатного ионов. Поведение недиссоциированной кремниевой кислоты идентично ее поведению в растворе гранита, а вот содержание гидроксид иона намного ниже, поскольку раствор порфирита отличается заметно меньшими щелочными свойствами (рис. 1, 3). Низкое содержание хлора в граните и порфирите обусловило подобные его концентрации в растворах. В растворе гранита представительное развитие получил гидросульфидный ион, незначительное содержание которого в растворе порфирита обозначилось лишь на заключительных стадиях взаимодействия.
При приближении, а тем более при переходе за пределы увеличения концентрации растворов, соответствующих значениям широко распространенных величин минерализации природных азотных терм, состав их становится все более смешанным и сильнее понижается значимость гидросиликатного иона (рис. 1, 3). Если в растворе гранита этот процесс растянут в значительном интервале изменения количества взаимодействующей породы от 1.3 до158 г, то в растворе порфирита он сжат от 0.8 до 10 г. В обоих растворах, несмотря на определенную завуалированность формами нахождения анионогенных элементов, как и у катионов, четко выдерживается последовательность их присутствия в растворе в соответствии с их концентрацией в породе. В растворе гранита это Si, F, S, C, Cl, а в растворе порфирита Si, C, F, S, Cl (табл. 1, рис. 3). Эти зависимости неукоснительно сохраняются до момента, когда вторичные минералы преобразуют направление изменения концентраций компонентов в растворе, представленных данными элементами или содержащими их.
ОБСУЖДЕНИЕ
Комплексный анализ растворов гранита и порфирита в ходе их эволюционного преобразования однозначно показал, что не только присутствие, но именно соответствующие концентрации анионогенных элементов в первичной породе, при прочих равных условиях, задают направленность и интенсивность физико-химических взаимодействий в системах и определяют состав и концентрации, как формирующихся растворов, так и твердых фаз. Содержание катионов и анионов в растворе на этапах взаимодействия, когда вторичного минералообразования не происходит, определяется величиной содержания в породе элементов, которые их представляют. Появление вторичных минералов замедляет, прекращает или уменьшает концентрацию элементов в растворе, несмотря на высокое их содержание в породе и увеличение массы породы, взаимодействующей с водой. Это объясняет низкие концентрации магния, высокие содержания натрия и промежуточные значения кальция и калия в составе азотных терм. Крайне важным является тот факт, что геохимическая обстановка исследованных систем является результатом комплексного взаимодействия исходных составов раствора и породы и определяет составы формирующихся растворов и вторичных минеральных фаз на каждом шаге изменения величины отношения порода/вода.
Выше, на примере сопоставления величин минерализации и концентраций гидросиликатного иона модельных растворов в интервале наиболее распространенных значений величин минерализации природных азотных терм было показано, что скорость физико-химических взаимодействий в системе вода–порфирит более чем на порядок выше, чем в системе вода–гранит. Процесс накопления элементов или их соединений в растворах активно протекает до появления вторичных минеральных образований, резко изменяющих прямолинейный характер увеличения их содержания (рис. 2, 3). В этот момент концентрации анионов в растворах достигают максимальных значений, равных (гранит/порфирит, мг/кг Н2О): OH– (32/16); ${\text{HSiO}}_{3}^{ - }$ (271/134); ${\text{HCO}}_{3}^{ - }$ (354/481); ${\text{CO}}_{3}^{{2 - }}$ (40/87); HS– (6/1); ${\text{SO}}_{4}^{{2 - }}$ (592/676); F– (177/177); Cl– (245/203). Максимальные содержания гидроксидного, гидросиликатного, гидросульфидного и хлоридного ионов в растворе гранита существенно выше, чем в растворе порфирита. Содержание гидрокарбонатных, карбонатных и сульфатных ионов, напротив, выше в растворе порфирита, а концентрации фтора идентичны в обоих растворах. Ион хлора в рассматриваемых системах не имеет вторичных минералов и не участвует в перераспределении вещества между компонентами и фазами, он проявляет только накопительные свойства, поэтому линейный характер его поведения в растворе определяется только его содержанием в первичной породе во всем исследованном интервале взаимодействий.
Таким образом, несмотря на резко различное содержание углерода, серы и фтора в исследованных образцах их максимальные содержания в растворах оказываются либо равны, либо в определенной степени сопоставимы. Однако, как хорошо видно на рис. 3, эти значения достигаются при весьма различных количествах взаимодействующей с водой породы, отличающихся друг от друга от единиц, до многих сотен граммов: (гранит/порфирит, г): OH– (6/13); ${\text{HSiO}}_{3}^{ - }$ (6/13); ${\text{HCO}}_{3}^{ - }$ (501/20); ${\text{CO}}_{3}^{{2 - }}$ (501/13); HS– (50/200); ${\text{SO}}_{4}^{{2 - }}$ (794/158); F– (316/40); Cl– (1000/1000). Наибольшие различия массы породы свойственны сере, углероду и фтору, тем элементам, содержание которых значительно отличается в образцах породы (табл. 1) и со всей очевидностью свидетельствует об определяющей роли не только присутствия, но главным образом концентрации анионогенных элементов на активность протекания гидрогеохимических процессов.
Вторичные минералы, активно образовывающиеся на ранних этапах взаимодействий в растворе порфирита, приостановили его развитие, несмотря на значительное увеличение количества породы вступающей во взаимодействие. В растворе гранита они проявились гораздо позже, и он развивался. Вначале, после приостановки развития в результате появления в твердой фазе альбита медленно, а по мере увеличения в объеме взаимодействующей породы углерода, серы, хлора и фтора процесс этот значительно активизировался. Наконец, на заключительном этапе исследованного интервала взаимодействий влияние вторичных минеральных образований в обеих системах сравнялось, и в результате выровнялись значения интегральных характеристик растворов, катионов и анионов (рис. 1–3).
Из изложенного выше очевидно, что при содержании в породе анионогенных элементов на уровне их концентраций, соответствующих средним значениям, как это предполагается в работах (Замана, 2000; Крайнов, Рыженко, 1996; Плюснин и др., 2013; Шварцев, 2017; Шварцев и др., 2015, 2020; и др.) растворы в этих породах, с минерализацией соответствующей минерализации азотных терм, могут иметь только HSiO3–Na состав. Увеличение степени взаимодействия такой породы с водой, что привлекается для объяснения формирования азотных терм упомянутыми и другими исследователями, разделяющими данный подход к проблеме, действительно, приводит к накоплению в растворе гидрокарбонатных, сульфатных и хлоридных ионов в количествах, сопоставимых с их значениями в природных термах, но при этом минерализация многократно, а содержание фтора на порядки, превышает эти величины в реальных растворах. Поэтому объяснение формирования состава азотных терм, на основе прослеживания накопления отдельных компонентов раствора в отрыве от комплексного анализа системы в целом, как показывают проведенные расчеты, не соответствует действительности.
Тем не менее, весьма своеобразный HSiO3–Na состав модельного раствора гранита, имеет свои аналоги среди природных азотных терм, которые, как установлено в ряде работ и обобщено в (Крайнов и др., 2012), при соответствующем методическом подходе проведения полевых работ, выявлены в различных регионах. Это, с большой долей уверенности, позволяет утверждать, что распространение азотных терм HSiO3–Na состава имеет более широкое развитие в кристаллических породах, чем это известно в настоящее время.
Формирующийся в весьма ограниченном интервале взаимодействий HCO3–Na состав растворов порфирита, с высоким содержанием F (25–30 мг/кг Н2О), соответствует составу терм кульдурского типа (Ломоносов, 1974), распространенным в горных сооружениях различных регионов мира (Барабанов, Дислер, 1968; Крайнов, 1973; Шпейзер, 1992; Michard, 1990; и мн. др.). Таким образом, состав формирующихся растворов, как это и предполагалось в работах (Басков, Суриков, 1989; Крайнов и др., 2012; Павлов, Чудненко, 2013а) и установлено количественными исследованиями процессов физико-химических взаимодействий в системе “вода–порода” (Павлов, Чудненко, 2013б; Павлов и др., 2018, 2020), определяется составом взаимодействующей с водой породы.
Собранная авторами коллекция составов пород на различных месторождениях и проявлениях азотных терм, анализ данных геологических съемок, а также результатов многочисленных геологических и геохимических исследований распространения анионогенных элементов в кристаллических породах, указывают на высокую степень их неоднородности как в плане, так и в разрезе (Булдыгеров, Собаченко, 2005; Бушляков, Холоднов, 1986; Коваль, 1998; Комаров, 1978; Саньков и др., 1991; Соловьев и др., 1967; Таусон, 1977; Fuge, Power, 1969; и мн. др.). Эти результаты выявили весьма неблагополучную картину. С одной стороны, представление о распространении анионогенных летучих в кристаллических породах крайне ограничено, а с другой – как правило, отсутствие совместного их определения. Их определение фрагментарно и в значительной степени имеет одиночный характер. Оказалось, что из анионогенных элементов более всего изучен фтор, менее охарактеризован углерод, слабо сера и имеются лишь единичные определения хлора. Именно это обстоятельство заставляет исследователей при изучении системы “вода–порода” использовать средние концентрации анионогенных летучих, либо прибегать к синтезу состава пород, используемых при изучении процессов физико-химических взаимодействий в системе “вода–порода”. Оба эти приема были использованы авторами данной работы в более ранних исследованиях.
ВЫВОДЫ
Комплексный анализ модельных растворов гранита и порфирита однозначно показал, что формирование состава растворов в ходе эволюционного развития системы “вода–порода” определяется не только наличием, но и концентрацией в породе анионогенных элементов. Именно это обстоятельство обусловливает создание свойственной данной системе геохимической обстановки, в которой, при прочих равных условиях, в результате взаимодействия исходных составов раствора и породы на каждом этапе изменения величины отношения порода/вода определяются концентрации и формы нахождения компонентов в растворе и его минерализация, порядок и интенсивность формирования вторичных минеральных образований.
Появление вторичных минеральных образований на определенных этапах взаимодействия замедляет, прекращает или уменьшает поступление элементов в раствор. Формирование из представительного ряда возможных вторичных минеральных фаз конкретных минералов в определенном количестве в соответствующей обстановке, объясняет низкие концентрации магния, высокие содержания натрия и промежуточные значения на низком уровне кальция и калия. Полученные результаты объясняют низкие и очень низкие значения минерализации азотных терм, высокое содержание в них кремния и возможность формирования не только кульдурского, но и других типов азотных термальных вод в достаточно ограниченном, меньшем, чем это установлено в данной работе, интервале взаимодействий при соответствующих концентрациях анионогенных элементов в породе.
Современные широко распространенные азотные термы не могут быть сформированы в породах, содержащих анионогенные элементы на уровне их средних значений. Поэтому именно неоднородность химического состава вмещающих пород в конкретных термодинамических условиях и на определенном этапе протекания физико-химического процесса обусловливает формирование химического состава современных азотных термальных вод. Решение этого вопроса связано не только с познанием формирования азотных терм, но и гидрогеохимических процессов в целом и является ключевой проблемой современной гидрогеохимии. Разработанность этой проблемы находится в начальной стадии, поэтому исследование природных гидрогеохимических процессов на количественном уровне невозможно без основательного изучения анионогенных элементов в породе.
Список литературы
Архипов Б.С. (2009) Химический состав и металлоносность термальных вод Северо-Восточного Сихотэ-Алиня (Дальний Восток). Тихоокеанская геология. 28(4), 116-122.
Барабанов Л.Н., Дислер В.Н. (1968) Азотные термы СССР. М.: Недра, 198 с.
Басков Е.А., Суриков С.Н. (1989) Гидротермы Земли. Л.: Недра, 245 с.
Богатиков О.А., Косарева Л.В., Шарков Е.В. (1987) Средние химические составы магматических горных пород: Справочник. М.: Недра, 152 с.
Борисов М.В., Бычков Д.А., Шваров Ю.В. (2006) Геохимические структуры полиметаллических жил выполнения и параметры гидротермального рудообразования. Геохимия. (11), 1218-1239.
Borisov M.V., Bychkov D.A., Shvarov Yu.V. (2006) Geochemistry structure of base-metal filling veins and parameters of hydrothermal ore formation. Geochem. Int. 44(11), 1129-1147.
Борисов М.В., Волкова М.М. Бычков Д.А. (2016) Оценка источника вещества полиметаллических жил Джимидонского месторождения (Северная Осетия, Россия) на основе распределения редкоземельных элементов в рудах и вмещающих породах. Геохимия. (4), 371-388.
Borisov M.V., Bychkov D.A., Volkova M.M. (2016) Ore sources of the base-metal veins at the Dzhimidon deposit, North Ossetia, Russia: evidence from REE distribution in the ores and host rocs. Geochem. Int. 54(4), 346-361.
Булдыгеров В.В., Собаченко В.Н., (2005) Проблемы геологии Северо-Байкальского вулкано-плутонического пояса. Иркутск: ИГУ, 184 с.
Бушляков И.Н., Холоднов В.В. (1986) Галогены в петрогенезисе и рудоносности гранитоидов. М.: Наука, 192 с.
Виноградов А.П. (1962) Средние содержания химических элементов в главных типах изверженных горных пород земной коры. Геохимия. (7), 555-571.
Замана Л.B. (2000) О происхождении сульфатного состава азотных терм Байкальской рифтовой зоны. ДАН. 372(3), 361-363.
Карпов И.К. (1981) Физико-химическое моделирование на ЭВМ в геохимии. Новосибирск: Наука, 247 с.
Коваль П.В. (1998) Региональный геохимический анализ гранитоидов. Новосибирск: Изд-во СО РАН НИЦ, ОИГГМ, 491 с.
Козлова П.С., Рыбалова Э.К. (1965) Геологическое положение и особенности петрографического и химического составов верхнепалеозойских интрузивных комплексов среднего течения р. Ангрен (Средняя Азия). Геология и геохимия гранитных пород. (Под ред. Коптева-Дворникова В.С.). М.: Наука, 82-143.
Комаров П.В. (1978) Поиски оруденения по петрогенным элементам, фтору и сере. М.: Наука. 146 с.
Крайнов С.Р. (1973) Геохимия редких элементов в подземных водах (в связи с геохимическими поисками месторождений). М.: Недра, 296 с.
Крайнов С.Р., Рыженко Б.Н. (1996) Моделирование геохимических процессов в системе гранит/вода с летучими анионогенными (Cl, S, C) компонентами в связи с дискуссионными вопросами геохимии термальных подземных вод. Геохимия. (3), 228-241.
Крайнов С.Р., Рыженко Б.Н. (1997) Анализ проблемы происхождения хлоридных подземных вод и рассолов в массивах кристаллических пород методами термодинамического моделирования геохимических процессов в системах гранит/вода. Геохимия. (10), 1035-1057.
Крайнов С.Р., Рыженко Б.Н., Соломин Г.А. (2004) Физико-химическое компьютерное моделирование качества подземных вод: Фундаментальные основы. Фтороносные воды. Геохимия. (3), 319-331.
Krainov S.R., Ryzhenko B.N., Solomin G.A., (2004) Physicochemical Computer Simulation of Groundwater Quality: Fundamentals. Fluorine-Bearing Waters. Geochem. Int. 42(3), 264-275.
Крайнов С.Р., Рыженко Б.Н. Шваров Ю.В. (1983) Возможности и ограничения физико-химического моделирования на ЭВМ взаимодействий вода–порода при решении вопросов формирования химического состава подземных вод. Геохимия. (9), 1342-1359.
Крайнов С.Р., Рыженко Б.H., Швец В.М. (2012) Геохимия подземных вод. Теоретические, прикладные и экологические аспекты. Изд. второе, дополненное. М.: ЦентрЛитНефтегаз, 672 с.
Кулаков В.В. (2011) Геохимия подземных вод Приамурья. Хабаровск: ИВЭП ДВО РАН, 254 с.
Кулаков В.В. (2014.) Геолого-структурные и геотермальные условия формирования термальных подземных вод Приамурья. Тихоокеанская геология. (5), 66-79.
Кулаков В.В., Сидоренко С.В. (2017) Минеральные, воды и лечебные грязи Приамурья. Хабаровск: Изд-во ДВМГУ, 474 с.
Ломоносов И.С. (1974) Геохимия и формирование современных гидротерм Байкальской рифтовой зоны. Новосибирск: Наука, 166 с.
Методы геохимического моделирования и прогнозирования в гидрогеологии (1988). М.: Недра, 254 с.
Павлов С.Х., Чудненко К.В. (2013а) Формирование азотных терм: моделирование физико-химических взаимодействий в системе “вода–гранит”. Геохимия. (12), 1090-1104.
Pavlov S.Kh., Chudnenko K.V., (2013) Formation of Nitrogen-Rich Hot Springs: Modeling Physicochemical Interactions in a Water-Granite System Geochem. Int. 51(12), 981-993.
Павлов С.Х., Чудненко К.В. (2013б) Физико-химические взаимодействия в системе “вода–порода” в условиях формирования азотных терм. Известия Сибирского отделения Секции наук о Земле РАЕН. Геология, поиски и разведка рудных месторождений. (82–95).
Павлов С.Х., Чудненко К.В., Голубев В.А., Оргильянов А.И., Бадминов П.С., Крюкова И.Г. (2018) Геологические факторы и физико-химические процессы формирования подземных вод Тункинской впадины Геодинамика и тектонофизика. 9(1), 221-248.
Павлов С.Х., Чудненко К.В., Хромов А.В. (2020) Моделирование формирования фторидных азотных терм в системе вода–кристаллическая порода Геодинамика и тектонофизика. 11(2), 378-396.
Плюснин А.М., Замана Л.В., Шварцев С.Л., Токаренко О.Г., Чернявский М.К. (2013) Гидрогеохимические особенности состава азотных терм Байкальской рифтовой зоны. Геология и геофизика. 54(5), 647-664.
Рыженко Б.Н. (1994) Физико-химические основы гидрогеохимических и гидротермальных процессов. Геохимия. (6), 825-835.
Рыженко Б.Н., Крайнов С.Р., Шваров Ю.В. (2003) Физико-химические факторы формирования состава поземных вод (верификация модели “порода–вода”). Геохимия. (6), 630-640.
Ryzhenko B.N., Krainov S.R., Shvarov Yu.V. (2003) Phisicochemical factors forming the composition of natural waters: verification of the rock-water model Geochem. Int. 41(6), 565-575.
Саньков В.А., Днепровский Ю.И., Коваленко С.Н., Борняков С.А., Гилева Н.Г., Горбунова Н.Г. (1991) Разломы и сейсмичность Северо-Муйского геодинамического полигона. Новосибирск: Наука, 111 с.
Соловьев А.Т., Чупров В.В., Мойжес И.Б. (1967) Геохимические особенности поведения фтора в щелочных породах Западного Забайкалья. Геохимия. (3), 321-329.
Таусон Л.В. (1977) Геохимические типы и потенциальная рудоносность гранитоидов. М.: Наука, 268 с.
Челноков, Г.А., Калитина Е.Г., Брагин И.В., Харитонова Н.А. (2014) Гидрогеохимия и генезис термальных вод источника Горячий Ключ, Приморье (Дальний Восток России). Тихоокеанская Геология. 33(6), 99-110.
Чудаев О.В., Чудаева В.А. (2009) Состав и генезис гидротермальных систем областей островодужного вулканизма. Вестник ДВО РАН. (4), 24-29
Чудненко К.В. (2010) Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Гео, 287 с.
Шварцев С.Л. (1975) О некоторых вопросах эволюции объема и состава подземных инфильтрационных вод в алюмосиликатных породах. Геохимия. (6), 905-917.
Шварцев С.Л. (2017) Механизмы концентрирования фтора в азотных термах. Известия Томского политехнического университета. Инжиниринггеоресурсов 328(12), 105-117.
Шварцев С.Л., Замана Л.В., Плюснин А.М., Токаренко О.Г. (2015) Равновесие азотных терм Байкальской рифтовой зоны с минералами водовмещающих пород как основа для выявления механизмов их формирования. Геохимия. (8), 720-733.
Shvartsev S.L., Zamana L.V., Plyusnin A.M., Tokarenko O.G. (2015) Equilibrium of Nitrogen-Rich Spring Waters of the Baikal Rift Zone with Host Rock Minerals as a Basis for Determining Mechanisms of Their Formation. Geochem. Int. 53(8), 713-725.
Шварцев С.Л., Зиппа Е.В., Борзенко С.В. (2020) Природа низкой солености и особенности состава термальных вод провинции Цзянси (Китай). Геология и геофизика. 51(2), 243-262.
Шпейзер Г.М. (1992) Гидрохимия минеральных вод горно-складчатых областей. Иркутск: ИГУ. 240 с.
Dolejs D., Wagner T. (2008) Thermodynamic Modeling of Non-Ideal Mineral–Fluid Equilibria in the System Si–Al–Fe–Mg–Ca–Na–K–H–O–Cl at Elevated Temperatures and Pressures: Implications for Hydrothermal Mass Transfer in Granitic Rocks. Geochim. Cosmochim. Acta. 72(2), 526-553.
Dutova E.M., Nikitenkov A.N., Pokrovsky V.D., Banks D., Frangstad B.S., Parnachev V.P. (2017) Modeling the Dissolution and Reprecipitation of Uranium under Oxidation Conditions in the Shallow Groundwater Circulation Zone. J. Environ. Radioact. 178–179, 63-76.
Chae G.T., Yun S.T., Mayer B., Kim K.-H., Kim S.Y., Kwon J. S., Kim K., Koh Y.-K. (2007) Fluorine geochemistry in bedrock groundwater of South Korea. Sci. Total Environ. (385), 272-283.
Cuccuru S., Deluca F., Mongelli G., Oggiano G. (2020) Granite- and andesite-hosted thermal water: geochemistry and environmental issues in northern Sardinia, Italy. Environ. Earth Sci. (79), a. n. 257.
Deng Y., Nordstrom D.K., McCleskey R.B. (2011) Fluoride geochemistry of thermal waters in Yellowstone National Park: I. Aqueous fluoride speciation. Geochim. Cosmochim. Acta. (75), 4476-4489.
Fuge R., Power G.M., (1969) Chlorine and Fluorine in Granitic Rocks from SW England. Geochim. Cosmochim. Acta. 33(7), 888-893.
Johnson J.W., Oelkers E.H., Helgeson H.C. (1992) SUPCRT92: software package for calculating the standard molal thermodynamic properties of mineral, gases, aqueous species, and reactions from 1 to 5000 bars and 0° to 1000°C. Computers Geosci. (18), 899-947.
Lottermoser B.G. and Cleverley J.S. (2007) Controls on the genesis of a high-fluoride thermal spring: Innot Hot Springs, north Queensland. Australian J. Earth Sciences. (54), 597-607.
Michard, G. (1990) Behaviour of Major Elements and Some Trace Elements (LI, Rb, Cs, Sr, Fe, Mn, W, F) in Deep Hot Waters from Granitis. Areas. Chem. Geol. (89), 117-134.
Seelig U., Bucher K. (2010) Halogens in water from the crystalline basement of the Gotthard rail base tunnel (central Alps). Geochim. Cosmochim. Acta. 74(9), 2581-2595.
Chatterjee S., Dutta A., Gupta R. K., Sinha U.K. (2022) Genesis, evolution, speciation and fluid-mineral equilibrium study of an unexplored geothermal area in Northeast Himalaya, India. Geothermics. (105), n. a., 102483.
Shock E.L., Sassani D.C., Willis M. (1997) Inorganic species in geologic fluids: Correlations among standard molal thermodynamic properties of aqueuos ions and hydroxide complexes. Geochim. Cosmochim. Acta. 61(5), 907-950.
Žáček V., Rapprich V., Šíma J., Škoda R., Laufek F., Legesa F. (2015) Kogarkoite, Na3(SO4)F, from the Shalo hot spring, Main Ethiopian Rift: implications for F-enrichment of thermal groundwater related to alkaline silicic volcanic rocks. J. Geosciences, 60, 171-179
Zhang W, Zhou1 L., Tang1 H., Li H., Song W., Chen Z. (2015) Modeling geochemical factors controlling fluoride concentration in groundwater. Arab J Geosci. (8), 9133-9147.
Дополнительные материалы отсутствуют.


