Геохимия, 2023, T. 68, № 4, стр. 409-423
Биогеохимические изменения арктических озер в условиях потепления климата: региональные особенности
Т. И. Моисеенко a, *, М. М. Базова a, Е. О. Льюмменс a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: moiseenko.ti@gmail.com
Поступила в редакцию 30.05.2022
После доработки 10.10.2022
Принята к публикации 16.10.2022
- EDN: JUWHIZ
- DOI: 10.31857/S0016752523040106
Аннотация
В статье рассматривается проблема биогеохимической миграции элементов и развитие эвтрофирования отдаленных арктических регионов, как следствие потепления климата и глобального рассеивания фосфора. На основе анализа долговременного мониторинга качества вод с 1990 по 2018 гг. (раз в 4–5 лет) получены доказательства нарастания общих форм фосфора и азота, а также органического вещества к последнему десятилетию, которые подтверждаются достоверными связями с температурными условиями. Рассчитаны потоки фосфора в озера с водосборов по модели В.В. Бульона, которые показывают их увеличения в последние десятилетия. Согласно показателю трофического статуса озер (TSI) показано, что снизилось количество олиготрофных и возросло число мезо- и эвтрофных озер даже в случаях отсутствия влияния каких-либо антропогенных факторов.
ВВЕДЕНИЕ
Увеличение продуктивности озер при их старении – естественный процесс эвтрофирования водоемов, который может развиваться в течение тысячелетий. В последние столетия неконтролируемое использование удобрений, развитие животноводства и урбанизация привели к дополнительному поступлению огромного количества биогенных и органических веществ в водные системы, следствием которого явилось развитие комплекса негативных явлений, связанных с эвтрофированием озер, рек и морских побережий систем. Интенсивное цветение сине-зеленых водорослей и зарастание водоемов макрофитами, развитие кислородного дефицита и другие негативные последствия в конечном итоге привели к повсеместному ухудшению качества вод, деградации водоемов и выводу их из хозяйственного использования. По оценкам (Lerman et al., 2004), начиная с 1900 гг. глобальные изменения количеств, включенных в оборот С, N, Р претерпели значительное увеличение. Дополнительное поступление азота и фосфора в окружающую среду изменяет биотический круговорот этих элементов и приводит к изменению трофического статуса водных систем. Изменения выражаются в трансформации олиготрофных водоемов в мезотрофные, эвтрофные и, наконец – в гипертрофные.
В настоящий период количество публикаций, посвященных изучению эвтрофирования вод, не снижается как следствие неугасающей актуальности этой проблемы, так и различных сочетаний природных особенностей (в том числе климатических), которые формируют специфику антропогенного воздействия и развитие эвтрофирования озер и рек.
В образовании органических веществ участвуют в основном фитопланктон и высшая водная растительность. В.И. Вернадский (2003) отмечал, биоценоз в значительной мере формирует химизм воды в водоеме, а качество воды – состав биоценоза. Основной характеристикой трофического статуса водоемов является соотношение скоростей продукции и деструкции органических веществ (Алимов, Голубков, 2014). В то же время можно выделить ряд общих биогеохимических критериев процесса эвтрофирования вод: возникновение и усиление контрастности послойного распределения биогеохимических процессов; различия в окислительно-восстановительных условиях для зон синтеза и минерализации органического вещества; увеличение концентрации биогенных элементов; повышение концентрации взвешенных веществ органической природы и снижение прозрачности; уменьшение концентрации растворенного кислорода в гиполимнионе; интенсивное развитие и последовательная смена популяций водорослей, а также смена фаунистического ядра в направлении доминирования видов широкой экологической валентности (Хендерсон-Селлерс, Маркленд, 1990; Жукова, 2013; Рыжаков, Сабылина, 2015; Трифонова и др., 2016; Калинкина и др., 2017; Kane et al., 2014; Lepori, Roberts, 2017; Cunha et al., 2017; Moiseenko, Sharov, 2019).
Наиболее остро проблема эвтрофирования вод обозначилась в регионах с высокой плотностью населения и развитым сельским хозяйством, включая европейскую урбанизированную часть России. На современном этапе изучаются различные аспекты эвтрофирования вод: роль внешней и внутренней нагрузки фосфора (Алимов, Голубков, 2014), скорости регенерации неорганического фосфора (Рыжаков, Сабылина, 2015; Калинкина и др., 2017), соотношение биомасс зоо- и фитопланктона как показателя активности деструкционных процессов (Трифонова и др., 2016). Достаточно много исследований посвящено проблеме эвтрофирования таких крупных озер, как Ладога, Онега и Байкал (Ладога, 2013; Драбкова, Измайлова, 2014; Румянцев и др., 2014, 2015; Белых и др., 2015), других озер и водохранилищ на Европейской части России, в особенности, Волжских водохранилищ. Достаточно остро проблема обозначилась в Китае вследствие высокой плотности населения и развитого сельского хозяйства (Huang et al., 2014, 2017), вплоть до “кризиса питьевой воды” из-за вспышек цветения цианобактерий (Liu et al., 2011), которые выделяют в воду токсины. В работе (Stoddard et al., 2016) было показано, что северные озера Америки меняют свой статус, согласно концентрации фосфора и стали повсеместно соответствовать мезотрофному статусу. Процесс эвтрофирования затронул в той или иной степени все водные системы и приобрел глобальный характер.
В отдаленных горных и северных арктических районах, незатронутых воздействием антропогенной деятельности, водные системы проявляют тенденции к эвтрофированию, т.е. повышается содержание фосфора и активность продукционных процессов. Одним из таких регионов является Кольский Север России. На территории этого региона насчитывается более 11 тысяч озер (Атлас…, 1971). Именно в арктических регионах наиболее ярко отражаются последствия потепления климата и глобального рассеяния биогенных элементов. Концептуально, малые озера в наибольшей степени отражают особенности окружающего ландшафта и биогеохимические процессы в водных системах, происходящие под влиянием глобальных и региональных изменений климата и воздушного загрязнения.
Целью работы было выявить долговременные изменения содержаний органического вещества и биогенных элементов в озерах, которые не подвержены влиянию человеческой деятельности, дать оценку влияния повышения температуры воздуха в Евро-арктическом регионе на их трофический статус.
ХАРАКТЕРИСТИКА РЕГИОНА, МАТЕРИАЛОВ И МЕТОДОВ ИССЛЕДОВАНИЙ
Кольский Север занимает собственно полуостровную часть и материковую часть на северо-западе Европейской территории России (Мурманскую область). На территории Кольского Севера выделяют три природные зоны – тундру, лесотундру и северо-таежную зону. Территория сложена разными магматическими породами: кислыми (граниты, гранодиориты), средними (диориты, сиениты) и основными (базальтоиды, габбро и др.), также гнейсовыми и сланцевыми породами метаморфического происхождения (Войткевич и др., 1990).
Наиболее уязвимым по геологическому строению является тундровая зона (I субрегион), которая занимает обширную часть Кольского региона: северо-западную часть, от Баренцева моря на севере до реки Лотта на юге и северо-восточную тундру. Геологическая структура тундровой зоны преимущественно представлена породами верхнего архея: гранитами, диоритами, гранодиоритами, плагиогранитами; почвы – тундровые иллювиально-гумусовые оподзоленные, торфяно-глеевые и торфяно-болотные со сфагновым и травяным торфом. Этот субрегион отличается минимальной залесенностью и заболоченностью.
Большая часть II субрегиона (лесотундровая зона), по геохимическим условиям формирования вод обладает более хорошей буферной способностью, геологическая структура преимущественно представлена основными породами. Тундровые возвышенности Волчьи, Чуна, Ловозерские и Хибинские тундры) чередуются с лесными массивами. На территории района хорошо развита речная сеть, территория вокруг озер большей части заболочены, почвы преимущественно иллювиально-гумусовые маломощные.
Озера северо-таежной зоны (III субрегион) расположены в юго-восточной части Кольского региона. Преобладающими типами геологической структуры юго-восточной части северной тайги являются кварцевые пески. Обогащение вод гумусовыми веществами связано распространением торфянистых и болотных почв. К особенностям данной ландшафтно-геохимической зоны можно отнести то, что водосборы озер здесь расположены на самой малой высоте над уровнем моря. По сравнению с озерами северо-восточной тундры, озера северной тайги имеют наибольшие акватории и площади водосборов.
На Кольском Севере вследствие длительного (более 75 лет) функционирования предприятий по переработке медно-никелевых руд (“Североникель” и “Печенганикель) регион испытывал существенную антропогенную нагрузку. С конца 80-х гг. до 2010 г. выпадения антропогенной серы устойчиво снизились с 3.0 год до 0.5 гS/м2 год и к 2018 г. составили 0.37 гS/м2 год в радиусе до 30 км2 (Моисеенко и др., 2022), т.е. практически до фоновых показателей. В наше рассмотрение включались озера, отдаленные от урбанизированных и промышленных областей.
Исходными материалами послужила гидрохимическая база данных по малым озерам Кольского Севера за (1990, 1995, 2000, 2010, 2014 и 2018 гг.). На рис. 1 приведена картосхема региона со схемой точек исследования. Изученные озера расположены в тундровой (n = 15), лесотундровой (n = 21) и северо-таежной зонах (n = 32). Всего было исследовано 68 озер. Данные получены на основе методов, используемых в международной практике по программе ICP-Water (Standart Methods, 1992; Mosello et al., 1996; ICP-Water report, 2007), выполнялиcь по единым методикам в лабораториях Института проблем промышленной экологии Севера КНЦ РАН (ИППЭС КНЦ РАН) согласно рекомендациям (Eaton, 1992). Аналитическая программа работ включала в себя определение рН, электропроводности (χ), катионов (Са2+, Mg2+, K+, Na+), щелочности (Alk), ${\text{SО}}_{4}^{{2 - }},$ Сl–, цветности (Color), содержание растворенного органического вещества (DOC), нитраты $\left( {{\text{NO}}_{3}^{ - }} \right),$ аммонийный азот $\left( {{\text{NH}}_{4}^{ + }} \right),$ общий азот (Ntot), фосфаты $\left( {{\text{PO}}_{4}^{{3 - }}} \right)$ и общий фосфор (Ptot). Материалы были обобщены по большим периодам: 1990–2000 гг. и 2010–2018 гг. (табл. 1). Концентрация техногенных сульфатов в воде является информативным показателем нагрузки кислотообразующих веществ на водные системы. Сульфаты техногенного происхождения $\left( {{\text{SО}}_{{\text{4}}}^{*}} \right)$ определялись по формуле, исключающей концентрацию сульфатов морского происхождения (Henriksen et al., 1992):
(1)
${\text{SО}}_{{\text{4}}}^{*} = {\text{SO}}_{{4{\text{общ}}}}^{{2 - }} - 0.103[{\text{C}}{{{\text{l}}}^{ - }}].$Рис. 1.
Карта-схема точек исследованных озер Кольского региона: I – тундровая зона, II – лесотундровая зона, III – северо-таежная зона.

Таблица 1.
Показатели химического состава вод и средняя температура приземного слоя воздуха в различных ландшафтных зонах Кольского Севера (в числителе среднее значение и среднеквадратичное отклонение, в знаменателе – пределы содержания) T-1 – среднемесячная температура приземного слоя воздуха в летне-осенний период (июнь-сентябрь); Т-2 среднегодовая температура приземного слоя воздуха; P – осадки
| Год | Т-1 | Т-2 | P | Alk | ВС | SO4* | Color | DOC | Si | Ntot | N${\text{H}}_{4}^{ + }$ | N${\text{O}}_{3}^{ - }$ | Ptot | P${\text{O}}_{4}^{{3 - }}$ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| °C | °C | мм/год | Мкм-экв/л | Мкм-экв/л | Мкм-экв/л | 0Pt–Co | мгС/л | мг/л | мкгN/л | мкгN/л | мкгN/л | мкгP/л | мкгP/л | |
| I – тундровая зона, n = 15 | ||||||||||||||
| 1990–2000 | 8.9 ± 1.9 | 0.9 ± 5.4 | 468 | 91 ± 52 | 280 ± 88 | 56 ± 35 | 26 ± 17 | 5.3 ± 2.3 | 1.5 ± 0.9 | 186 ± 75 | 13 ± 11 | 3 ± 3 | 7 ± 4 | 1 ± 1 |
| 4.0–12.3 | (–14.9)–12.3 | 396–557 | 0–251 | 144–572 | 17–184 | 2–62 | 2.8–10.9 | 0.09–3.8 | 75–470 | 0–46 | 1–12 | 2–20 | 0–4 | |
| 2010–2018 | 10.5 ± 2.1 | 2.0 ± 5.9 | 436 | 119 ± 95 | 305 ± 108 | 41 ± 26 | 26 ± 16 | 5.8 ± 1.8 | 1.3 ± 0.8 | 237 ± 90 | 25 ± 26 | 3 ± 2 | 10 ± 9 | 3 ± 2 |
| 5.3–16.6 | (–12.4)–16.6 | 381–493 | 0–580 | 87–867 | 10–139 | 4–69 | 2.7–9.9 | 0.04–3.5 | 70–503 | 1–138 | 0–15 | 2–65 | 0–9 | |
| t | +2.65 | +3.09 | – | – | – | –2.15 | – | +2.01 | – | +3.00 | +2.47 | – | +2.26 | – |
| p | <0.05 | <0.01 | – | – | – | <0.05 | – | <0.05 | – | <0.01 | <0.05 | – | <0.05 | – |
| II – лесотундровая зона, n = 21 | ||||||||||||||
| 1990–2000 | 10.5 ± 2.5 | (–0.6) ± 7.7 | 337 | 157 ± 159 | 268 ± 189 | 47 ± 25 | 31 ± 27 | 6.7 ± 5.7 | 2.3 ± 1.8 | 245 ± 122 | 17 ± 19 | 9 ± 16.5 | 10 ± 11 | 2 ± 5 |
| 2.5–15.7 | (–23.2)–15.7 | 217–419 | 0–694 | 57–1005 | 18–150 | 0–105 | 1.6–16.8 | 0.03–7.1 | 57–477 | 1–85 | 1–77 | 1–54 | 0–34 | |
| 2010–2018 | 11.6 ± 2.6 | 0.5 ± 7.9 | 593 | 150 ± 199 | 316 ± 231 | 35 ± 24 | 36 ± 30 | 6.8 ± 4.0 | 1.3 ± 1.7 | 350 ± 163 | 39 ± 44 | 7 ± 6 | 20 ± 21 | 3 ± 6 |
| 6.4–18.8 | (–21.1)–18.8 | 457–686 | 0–866 | 67–997 | 4–127 | 4–128 | 3.8–16.5 | 0.04–8.5 | 117–593 | 1–177 | 0–39 | 4–93 | 0–36 | |
| t | +2.88 | +2.67 | +4.56 | – | – | –2.4 | – | – | – | +3.22 | +3.07 | – | +2.04 | – |
| p | <0.01 | <0.05 | <0.001 | – | – | <0.05 | – | – | – | <0.01 | <0.01 | – | <0.05 | – |
| III – северо-таежная зона, n = 32 | ||||||||||||||
| 1990–2000 | 11.2 ± 2.3 | 1.0 ± 7.0 | 436 | 224 ± 158 | 328 ± 158 | 49 ± 15 | 27 ± 21 | 6.9 ± 2.1 | 2.0 ± 1.4 | 218 ± 63 | 17 ± 13 | 10 ± 12 | 8 ± 4 | 1 ± 5 |
| 4.1–16.2 | (–20.5)–16.2 | 381–493 | 0–538 | 54–629 | 13–75 | 0–71 | 2.1–14.5 | 0.1–5.2 | 70–324 | 3–49 | 0–49 | 2–20 | 0–29 | |
| 2010–2018 | 12.4 ± 2.5 | 2.1 ± 7.2 | 603 | 290 ± 180 | 389 ± 186 | 46 ± 13 | 30 ± 26 | 7.0 ± 4.1 | 1.6 ± 1.1 | 238 ± 79 | 59 ± 50 | 3 ± 5 | 11 ± 5 | 4 ± 2 |
| 7.2–17.9 | (–17.0)–17.9 | 504–712 | 0–624 | 73–661 | 4–49 | 2–127 | 2.2–17.3 | 0.04–4.1 | 110–381 | 2–167 | 0–18 | 3–26 | 0–8 | |
| t | +3.14 | +3.18 | +2.25 | +3.09 | +2.85 | – | – | – | –3.74 | +2.04 | +2.25 | – | +3.17 | –2.20 |
| p | <0.01 | <0.01 | <0.05 | <0.01 | <0.01 | – | – | – | <0.001 | <0.05 | <0.05 | – | <0.01 | <0.05 |
Для расчета потоков фосфора были выбраны 3 модельных озера в различных субрегионах, в скобках представлены координаты расположения озер (географическая широта, ° с.ш.; долгота, ° в.д.): 1 – в тундровой зоне (68.88; 34.53), 2 – озеро в лесотундровой зоне (69.10; 32.70), 3 – озеро в северо-таежной зоне (67.50; 31.27)
Статистическая обработка данных осуществлялась с использованием компьютерной программы “Statistica 10”. Для выявления тренда среднегодовой температуры приземного слоя воздуха в ландшафтных зонах был использован непараметрический тест Манна-Кендалля (SKT).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Динамика температуры в регионе за 28 лет
Для оценки климатических изменений мы использовали доступные данные по среднемесячной температуре приземного слоя воздуха за 28‑летний период наблюдений в период открытой воды (июнь, июль, август и сентябрь) по трем станциям, расположенным на севере – пос. Териберка (побережье Баренцева моря), в центральной части региона г. Апатиты (водораздел между полуостровом) и на юге Кольского п-ова г. Умба (побережье Белого моря) (Архив погоды, 2019). Климатические особенности Кольского региона напрямую связаны с его географическим положением. Северная часть находится под влиянием теплого течения Гольфстрим. Именно поэтому, Баренцево море в районе города Мурманск не замерзает, а температура воздуха зимой (январь, февраль) соответствует условиям территорий, расположенных южнее.
На рис. 2 представлены данные по среднемесячным температурам приземного слоя воздуха в летне-осенний период с 1990 по 2018 гг. Статистически значимый положительный наклон тренда температуры: SKT = +2.70, p < 0.05 свидетельствует о потеплении климата в период открытой воды в указанный период при высокой вариабельности, характерной для арктической зоны.
Рис. 2.
Среднемесячные температуры приземного слоя воздуха в летне-осенний период (июнь–сентябрь) с 1990 по 2018 гг. (построено по данным Архив погоды, 2019). SKT = +2.70, p < 0.05.

Также была проанализирована динамика среднегодовой температуры приземного слоя воздуха за 2 периода (1990–2000) и (2010–2018) в разных субрегионах, которая показала увеличение, как по медианным, так и максимальным значениям (табл. 1). В северо-западной и северо-восточной частях тундровой зоны за рассматриваемый период среднегодовая температура воздуха увеличилась на 1.1°С, по максимальным значениям на 4.3°С. Среднегодовая температура воздуха в лесотундровой зоне к 2010–2018 гг. увеличилась на 0.9°С, по максимальным на 3.1°С. В юго-восточной части северо-таежной зоны среднегодовая температура приземного слоя воздуха к 2010–2018 гг. по сравнению с 1990–2000 гг. увеличилась на 1.1°С, по максимальным значениям на 1.7°С.
Особенности химического состава вод малых озер арктического региона
В табл. 1 представлена динамика показателей химического состава вод в выделенных субрегионах (тундра, лесотундра и северная тайга) за 2 периода (1990–2000 и 2010–2018).
В воде озер, расположенных в тундровой зоне (I субрегион) к 2010–2018 гг. по сравнению с периодом 1990–2000 на фоне достоверного снижения концентраций техногенных сульфатов (t = –2.15, p < 0.05) отмечено увеличение щелочности и суммы катионов по средним и максимальным значениям, что свидетельствует о снижении поступления сульфатов и улучшении буферных свойств вод. Содержание растворенного органического вещества (DOC) достоверно увеличились по средним значениям (t = +2.01, p < 0.05) в период с 2010 по 2018 гг. Содержания Ntot (t = +3.00, p < 0.01), Ptot (t = +2.26, p < 0.05) и NH4 (t = +2.47, p < 0.05) в воде озер достоверно увеличились к 2010–2018 гг., по сравнению с периодом 1990–2000. Содержания биодоступных форм (NO3 и PO4), Color и Si находились в пределах естественного варьирования.
В озерах лесотундровой зоны (II субрегион) отмечено увеличение щелочности по максимальным значениям (с 694 до 866 Мкм-экв/л) и суммы катионов в среднем (с 268 до 316 Мкм-экв/л), содержание техногенных сульфатов $\left( {{\text{SO}}_{{\text{4}}}^{*}} \right)$ также достоверно снизились как в среднем, так и по минимальным, и максимальным значениям (t = –2.40, p < 0.05). Содержания Ntot (t = +3.22, p < 0.01) и NH4 (t = +3.07, p < 0.01) достоверно увеличились к 2010–2018 гг. Значения Color, DOC, Si, NO3 и PO4 были в пределах вариабельности.
Воды озер таежной зоны (III субрегион) отличаются высокими буферными свойствами: щелочность и сумма катионов достоверно увеличились к периоду 2010–2018. Значения Color, DOC, Ntot, NO3 были в пределах вариабельности. Содержания Si (t = –3.74, p < 0.001) и PO4 (t = –2.20, p < 0.05) достоверно снизились, концентрации NH4 (t = +2.25, p < 0.05) и Ptot (t = +3.17, p < 0.01), напротив, достоверно увеличились к 2010–2018 гг. по сравнению с периодом 1990–2000.
Долговременные тенденции изменения биогенных элементов в озерах Кольского Севера
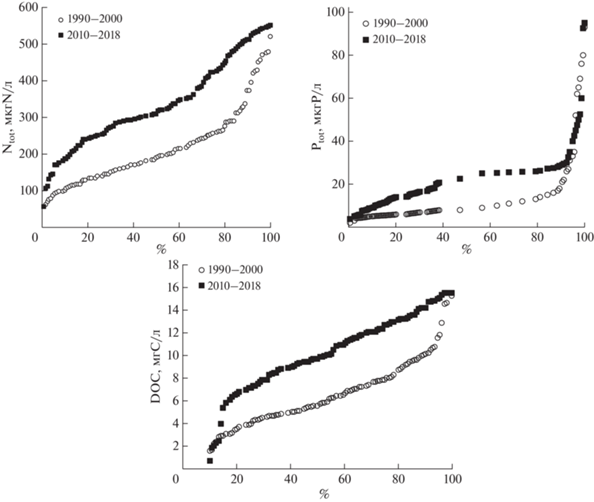
К периоду 2010–2018 гг. по сравнению с периодом 1990–2000 наметилась тенденция увеличения содержаний биогенных элементов (Ptot, Ntot) и растворенного органического вещества (DOC) (рис. 3). В 1990–2000 гг. только редкие озера имели содержания DOC выше 10 мгС/л, в период 2010–2018 гг. осталось несколько озер в области низких значений. Распределение Ptot носят сходный характер в области низких и высоких значений, медиана в 2010–2018 гг. существенно выше, чем в период 1990–2000 гг. Содержания Ntot значительно возросли к 2010–2018 гг., особенно в области высоких значений, в области низких значений они практически отсутствуют. Медианное значение в период 2010–2018 гг. почти в 2 раза выше по сравнению с периодом 1990–2000 гг.
Особенности формирования вод в условиях потепления климата
Химический состав вод озер является результатом биогеохимических процессов как на водосборе, так и внутриводоемных процессов в самом озере. При повышении температуры можно предположить развитие двух процессов. На водосборах северных территорий ускорится произрастании растительности, что неизбежно потребует поглощение эссенциальных элементов и их перехват при недостаточном насыщении водосбора биогенными элементами, необходимыми для роста растительности. С другой стороны, будет активизирована декомпозиция подстилки и органического вещества, которое приведет к повышенному стоку в озера растворенного органического вещества и, возможно, биогенных элементов.
В мировой литературе появилась информация, показывающая феномен – повсеместного увеличения в водах суши содержания органического вещества гумусовой природы(DOС) на многих континентах, которое происходило на фоне снижения содержаний техногенных сульфатов и увеличения буферной способности вод (ANC). Этот феномен наблюдался в озёрах и реках Европы и Северной Америки (Monteith et al., 2007; Moiseenko et al., 2015; Stoddard et al., 2016; Strock et al., 2014; 2017). Monteith et al. (2007) была высказана гипотеза о возврате биогеохимического статуса потоков органического вещества с водосборов к природным показателям в системе водосбор – водоем. Многие поверхностные воды показали компенсационное увеличение DOС природного происхождения в водах озер и рек в ответ на уменьшение выпадения кислоты и/или изменение климата (Monteith et al., 2007; Strock et al., 2014; Driscoll et al., 2016). Временное увеличение DOC было названо “brownification”, которое описывает окрашивание воды в желто-коричневый цвет, вызванное поступлением растворенного гумусового вещества из наземных экосистем и водно-болотных угодий, что характерно для озер с высоким содержанием DOC (Monteith et al., 2007; de Wit et al., 2016; Strock et al., 2017; SanClements et al., 2018).
Сходные закономерности были зарегистрированы и на Кольском Севере – на фоне снижения техногенных сульфатов $\left( {{\text{SO}}_{{\text{4}}}^{*}} \right)$ увеличилось содержание DOС (Моисеенко и др., 2022). В то же время, в ряде последних работ (de Wit et al., 2016; Strock et al., 2017; SanClements et al., 2018) приводятся доказательства влияния также и климатических факторов на повышения органического вещества и биогенных элементов в озерах и реках.
Можно предположить, что биодоступные формы фосфора и азота остаются низкими вследствие активного развития фитопланктона в более теплых условиях. Эти явления можно объяснить интенсификацией процесса эвтрофирования и поглощения элементов в продукционных процессах экосистем. Если посмотрим на соотношение элементов (табл. 4), видно, что несмотря на увеличение содержаний фосфора, обусловленного повышением температуры, показатели содержаний углерода снизились по отношению к биогенным элементам, т.е. нарушилось необходимое соотношение, что свидетельствует об интенсивном поглощении углерода в биопродукционных процессах наряду с биодоступными формами азота и фосфора.
На рисунке 4 показаны повышенные содержания азота и фосфора на фоне их стабильных биодоступных форм и поглощения кремния. Как известно, фаунистическое ядро озер Кольского Севера составляют диатомовые водоросли, для развития которых необходим кремний (Шаров, 2020). Его развитие в более теплых условиях приводит к повышенной утилизации этого элемента и осаждения в период его отмирания. Следует отметить, что основным поставщиком кремния являются процессы его химического выветривания.
Рис. 4.
Распределение Ptot, Ntot, DOC, Si в воде озер Кольского региона за 2 периода: 1990–2000 и 2010–2018 гг.

Результирующая природных условий на водосборах Крайнего Севера и внутриводоёмных процессов приводит к эвтрофированию вод в этих условиях. На Кольском Севере почвы маломощные и растительность слабо выражена, поэтому особенно в зоне тундры происходит наибольшее нарастание DОС за счет его поступления с водосбора, поскольку растительность развита слабо и соответственно – слабо утилизируются на водосборе.
В наших исследованиях, гипотезу о преобладающем влиянии климатического фактора на долговременные изменения химического состава вод подтверждает нарастание биогенных элементов, проявляющемся в повышении содержаний их общих форм при стабильных содержаниях биодоступных форм – нитратов и фосфатов, которые быстро утилизируются в продукционных процессах водной экосистемы.
В работе (Моисеенко и др., 2022) отмечено синхронное нарастание по годам и субрегионам содержаний DOC и общих форм биогенных элементов, которое подтверждается корреляцией между DOC и Ptot (r = 0.68, n = 29), между DOC и Ntot (r = 0.60, n = 29). Наши данные показывают достоверную зависимость содержания в воде DOC, как и общих форм азота и фосфора от температурных условий:
Потоки фосфора и их изменение при потеплении климата
Авторы взяли за основу одну из составляющих модели В.В. Бульона (2018), характеризующую первичную продукцию на водосборе и поступление фосфора с водосбора в исследуемые озера. В табл. 1 и 2 приведены морфометрические, климатические и показатели наземной растительности для расчета потоков фосфора в условиях ландшафтной зональности (в тундровой, лесотундровой и северо-таежной зонах) на примере 3 озер.
Таблица 2.
Морфометрические, климатические и показатели наземной растительности исследованных озер (1 – озеро в тундровой зоне (68.88; 34.53), 2 – озеро в лесотундровой зоне (69.10; 32.70), 3 – озеро в северо-таежной зоне (67.50; 31.27)
| Параметры | 1 | 2 | 3 |
|---|---|---|---|
| Морфометрические | |||
| Dmean, м | 6.5 | 10 | 5 |
| Tw, м/год | 1.1 | 2.1 | 1.2 |
| G | 5.9 | 4.7 | 2.8 |
| Mo, л/(с км2) | 19 | 12.0 | 15 |
| Fo, км2 | 1 | 8.75 | 1155 |
| SDA | 9.9 | 12.5 | 9.1 |
| Климатические | |||
| GS, дни | 128 | 126 | 138 |
| Наземная растительность | |||
| Bter, ккал/м2* | 93 780/103 563 | 82 809/91 822 | 87 784/96 913 |
| Vter, сут-1 | 0.00023 | 0.00023 | 0.00023 |
| Eter | 0.6 | 0.6 | 0.6 |
| Gpter, ккал/(м2 год)* | 4601/5081 | 4000/4435 | 4644/5127 |
| Pter, ккал/(м2 год)* | 2761/3049 | 2400/2661 | 2786/3076 |
Ниже представлены формулы для расчета потоков фосфора из работы В.В. Бульона (2018), адаптированные к условиям Кольского Севера:
где R – коэффициент седиментации фосфора, G – водная нагрузка на водоем, (м/год) (отношение средней глубины озера к условному числу лет, необходимому для полного водообмена в озере)(6)
${{{\text{T}}}_{{\text{w}}}} = {{{\text{D}}}_{{{\text{mean}}}}}/\left( {0.0315{\text{ Mo SDA}}} \right)),$(7)
$\begin{gathered} {\text{G}}{{{\text{P}}}_{{{\text{ter}}}}} = ({\text{IF}}\left( {{\text{Eva > Pre}}} \right){\text{ THEN}} \\ \left( {{\text{3000}}\left( {{\text{1}} - {\text{EXP}}\left( { - {\text{0}}{\text{.000664 Pre}}} \right)} \right)} \right){\text{ }} \\ {\text{ELSE }}\left( {3000/\left( {1 + {\text{EXP}}\left( {1.315 - 0.119{{{\text{T}}}_{{{\text{em}}}}}} \right)} \right)} \right) \times 4{\text{/}}0.6, \\ \end{gathered} $Vter – скорость оборота биомассы, сут–1, которая для озер северной и северо-западной частей Европейской территории России равна 0.00023 (Hakanson, Boulion, 2002)
Eter – эффективность роста, которая для озер северной и северо-западной частей Европейской территории России равна 0.6 (Hakanson, Boulion, 2002)
(9)
${{{\text{B}}}_{{{\text{ter}}}}} = {{{\text{E}}}_{{{\text{ter}}}}}{\text{G}}{{{\text{P}}}_{{{\text{ter}}}}}/\left( {{{{\text{V}}}_{{{\text{ter}}}}}{\text{GS}}} \right),$(10)
${{{\text{P}}}_{{{\text{ter}}}}} = {{{\text{B}}}_{{{\text{ter}}}}}{{{\text{V}}}_{{{\text{ter}}}}}{\text{GS}},~$(11)
$\begin{gathered} {\text{E}} = {{{\text{P}}}_{{{\text{ter}}}}} \times 0.1 \times 0.002 \times 0.02 \times \\ \times \,\,2{\text{ }}\left( {{{T}_{{{\text{em}}}}} - 12/10} \right) \times {\text{Feu}}, \\ \end{gathered} $(14)
${\text{Sed}} = \left( {{{{\text{L}}}_{{\text{a}}}} + {{{\text{L}}}_{{\text{d}}}}} \right){\text{R}},$(15)
${\text{T}}{{{\text{P}}}_{{{\text{int}}}}} = \left( {{{{\text{L}}}_{{\text{a}}}}{\text{ + }}{{{\text{L}}}_{{\text{d}}}}} \right)\left( {1 - {\text{R}}} \right){{{\text{T}}}_{{\text{w}}}},$Расчеты, выполненные по модели, показывают комплексную реакцию системы “водосбор–водоем” на повышение температурных условий. Согласно нашим расчетам, повышение среднегодовой температуры приземного слоя воздуха на 1.1°С (табл. 1) и, как следствие, повышение чистой продукции наземной растительности в среднем на 10% в 2010–2018 гг. по сравнению с периодом 1990–2000 гг. (табл. 2) стало причиной увеличения поступления фосфора с водосборной площади (Ld) в модельные озера (табл. 3). Наряду с увеличением количества атмосферных осадков и поступления в озера фосфора в их составе это привело к росту фосфорной нагрузки на водоемы в 2‒3.5 раза (табл. 3).
Таблица 3.
Потоки фосфора в озерах по В.В. Бульону (2018) (1 – озеро в тундровой зоне, 2 – озеро в лесотундровой зоне, 3 – озеро в северо-таежной зоне)
| Параметры | Потоки фосфора, г/м2 год | 1 | 2 | 3 | |||
|---|---|---|---|---|---|---|---|
| год | 1* | 2* | 1 | 2 | 1 | 2 | |
| TPint | Содержание фосфора под единицей | 0.12 | 0.26 | 0.16 | 0.56 | 0.25 | 0.86 |
| Площади акватории озера | |||||||
| Ld | Поступление фосфора в озеро | 0.24 | 0.52 | 0.03 | 0.12 | 0.09 | 0.32 |
| С водосборной площади | |||||||
| E | Коэффициент экспорта фосфора | 0.009 | 0.019 | 0.003 | 0.010 | 0.010 | 0.035 |
| С водосборной площади | |||||||
| Sed | Седиментация фосфора | 0.07 | 0.14 | 0.07 | 0.02 | 0.05 | 0.18 |
| В донные отложения | |||||||
| R | Коэффициент седиментации фосфора | 0.27 | 0.27 | 0.51 | 0.51 | 0.55 | 0.55 |
| La | Поступление фосфора в озеро | 0.007 | 0.008 | 0.003 | 0.006 | 0.006 | 0.008 |
| С атмосферными осадками | |||||||
| Out | Потеря фосфора со стоком воды | 0.34 | 0.73 | 0.08 | 0.27 | 0.21 | 0.71 |
Таблица 4.
Обеспеченность фитопланктона биогенными элементами в различных ландшафтных зонах Кольского Севера: соотношение C : N : P
| Период | Тундра | Лесотундра | Северная тайга |
|---|---|---|---|
| 1990–2000 | 124 : 32 : 1 | 127 : 36 : 1 | 110 : 34 : 1 |
| 2010–2018 | 91 : 30 : 1 | 92 : 34 : 1 | 81 : 28 : 1 |
Для озера, расположенного в северо-восточной части тундровой зоны (I субрегион) к 2010–2018 гг. отмечено увеличение фосфорной нагрузки (TPint) на 0.14 г/м2 год за счет поступление фосфора с водосборной площади (Ld), которое в свою очередь увеличилось к 2010–2018 г. по сравнению с периодом 1990–2000 в 2 раза (от 0.24 до 0.52 г/м2 год). Несмотря на отсутствие прямого антропогенного загрязнения, а именно выноса с сельскохозяйственных и урбанизированных территорий, отмечен рост коэффициента экспорта фосфора с водосборной площади (E) (с 0.009 до 0.019 г/м2 год соответственно) за счет повышения среднегодовой температуры приземного слоя воздуха на 1.1°С (табл. 1), в тоже время седиментация фосфора в донные отложения увеличилась в 2 раза (Sed).
Для озера, расположенного в лесотундровой зоне (II субрегион), к 2010–2018 гг. фосфорная нагрузка (TPint) увеличилась в 3 раза (с 0.16 до 0.56 г/м2 год), за счет увеличения среднегодовой суммы осадков с 337 до 593 мм (табл. 1) и, соответственно, поступления фосфора в озеро с атмосферными осадками (La), а также поступления фосфора с водосборной территории. Поступление фосфора с водосборной площади (Ld) увеличилось в 4 раза к 2010–2018 гг. по отношению к 1990–2000, вследствие увеличения среднегодовой температуры приземного слоя воздуха на 1.1°C (табл. 1), потеря фосфора со стоком воды (Out) увеличилась к 2010–2018 г. почти в 3.5 раза. Коэффициент экспорта фосфора с водосборной площади (E) увеличился в 3 раза (с 0.003 до 0.010 г/м2 год соответственно) вследствие повышения среднегодовой температуры приземного слоя воздуха на 1.1°С (табл. 1).
Увеличение фосфорной нагрузки с 0.25 до 0.86 г/м2 год на озеро северо-таежной зоны (III субрегион), связано с повышением среднегодовой температуры воздуха на 1.1°C, так и с увеличением среднегодовой суммы осадков к 2010–2018 гг. по отношению к 1990–2000 на 167 мм (табл. 1). Для данного озера характерны самые высокие значения коэффициента седиментации фосфора (R) и коэффициента экспорта фосфора с водосборной площади (E) (табл. 3).
Во всех рассматриваемых зонах отмечена достоверная связь содержания общего фосфора со среднегодовой температурой приземного слоя воздуха:
тундровая зона:
лесотундровая зона: таежная зона:Обеспеченность фитопланктона биогенными элементами
Зависимость эвтрофирования от концентраций в воде азота и фосфора не требует специальных доказательств и вытекает из схемы балансового уравнения образования (фотосинтеза) и разложения органических веществ, приводимого многими авторами (Одум, 1986; Бульон, 2018).
Учитывая, что водоросли могут использовать не только углерод свободной углекислоты (CO2), но и углерод бикарбонатов (HCO3), а также углерод растворенных органических веществ (Россолимо, 1977), можно считать, что этот биогенный элемент (углерод) практически всегда присутствует в воде в достаточном количестве. Принято, что лимитировать или стимулировать фотосинтез, т.е. образование первичной продукции, в первую очередь будут соединения фосфора и азота (что и получило всеобщее признание) (Неверова-Дзиопак, 2020). Имеет значение и соотношение содержания основных биогенных элементов. Международная группа ученых (Sterner et al., 2008) рассчитала среднее соотношение биогенных элементов в сестоне водных экосистем по данным более 2 тысяч наблюдений в различных озерах и морях, которое в молярном эквиваленте составило C : N : P = 166 : 20 : 1.
В озерах Кольского Севера к периоду 2010–2018 по сравнению с периодом 1990–2000 гг. отношения C : Р во всех ландшафтных зонах снизились и существенно ниже, по сравнению с “эталонным” соотношением (166 : 1) и результатами, полученными в работе (Sterner et al., 2008) (табл. 4). Отношения N : P, напротив, почти в 1.5–2 раза превышают оптимальное соотношение. Это связано с тем, что на значение N : P может оказывать влияние соотношений аллохтонного и автохтонного органического вещества. В работе Н.А. Гашкиной, Т.И. Моисеенко (2010) на примере озер Кольского Севера показано, что при соотношении C/Nорг = 12 органическое вещество (ОВ) – автохтонного происхождения, которое преобладает в олиготрофных озерах, а при C/Nорг = 47 – аллохтонного, преобладающее в эвтрофных и гипертрофных. В наших озерах в различных ландшафтных зонах соотношение C/Nорг в период с 1990 по 2018 гг. в среднем варьирует от 31 до 42, что свидетельствует о притоке азота с органическим веществом аллохтонного происхождения.
Всякое отклонение от данного соотношения меняет обеспеченность водорослей питательными веществами (Россолимо, 1977; Одум, 1986; и др.). По мнению Л.Л. Россолимо (1977) количественные соотношения между нагрузкой питательными веществами и продукцией водоемов составляют сущность проблемы эвтрофирования. Биогенные вещества наиболее часто используются в качестве показателей трофности. Как упоминалось ранее, связь эвтрофирования с биогенными веществами очевидна и хорошо изучена (Баранов, 1961; Schindler, 1971; Винберг, 1974; Россолимо, 1977; Цветкова, 1980; Бульон, 1998; Даценко, 2007; Dillon, 1974; Karydis, 2009; Neverova-Dziopak, 2010). Поэтому среди абиотических показателей трофического состояния водоемов первое место занимают биодоступные формы азота и фосфора. В наших исследованиях биодоступные формы элементов находятся в минимальных концентрациях и их увеличения в процессе потепления не наблюдается, как следствие их быстрой утилизации развивающимся фитопланктоном. Резервный фонд фосфора, в отличие от азота, находится не в атмосфере, а в земной коре. Считается, что за счет химического выветривания ежегодно в биотический круговорот поступает 1 млн т фосфора. Поэтому чаще всего, согласно закону минимума Ю. Либиха (Одум, 1996), именно фосфор регулирует процессы эвтрофирования как труднодоступный элемент. Сейчас поступление фосфора в водоемы в результате антропогенной деятельности и глобального рассеяния этого элемента сильно возросло до 8–9.5 млн т Р год. Большой вклад в рассеивание элемента вносят сточные воды вследствие применения фосфорсодержащих моющих средств и широкого внедрения биологической очистки, после которой стоки обогащаются минеральными, доступными для водорослей формами азота и фосфора (Mekonnen, Hoekstra, 2017; Bakker, 2021).
Трофический статус изученных озер
В водных экосистемах в образовании органических веществ участвуют в основном микроскопические водоросли (фитопланктон) и высшая водная растительность (макрофиты). Причем, основная роль, особенно в морских экосистемах, принадлежит фитопланктону – более 80% (Винберг, 1960). А.Ф. Алимов (2000) считал, что основной характеристикой водоемов является соотношение скоростей продукции и деструкции органических веществ, и “практически любые мероприятия по управлению в водоеме связаны с изменением соотношения между скоростями продукции и деструкции органических веществ”. Другие авторы также связывают трофность и экологическое состояние водоемов с продукционно-деструкционным балансом органических веществ (Голубков и др., 2008). Для оценки трофического статуса озер был применен интегральный индекс TSI (Carlson, 1977), модифицированный в работе (Abid, Gill, 2014), который состоит из субиндексов, включающих в себя прозрачность, содержание общего фосфора, фосфатов, хлорофилла “а” и рассчитывается с использованием следующих формул:
(20)
$\begin{gathered} {\text{TSI}} = {\text{TSI}}\left( {\text{S}} \right) + \\ + \,\,2\left[ {\frac{{{\text{TSI}}\left( {{\text{TP}}} \right) + {\text{TSI}}\left( {{\text{P}}{{{\text{O}}}_{4}}} \right) + {\text{TSI}}\left( {{\text{Chla}}} \right)}}{7}} \right], \\ \end{gathered} $(21)
$~~~~~~~~~~{\text{\;TSI}}\left( {\text{S}} \right) = 10\left( {6 - \left( {\frac{{0.64 + {\text{lnS}}}}{{{\text{ln}}2}}} \right)} \right),$(22)
${\text{TSI}}\left( {{\text{TP}}} \right) = 10\left( {6 - \left( {{\text{\;}}\frac{{{\text{ln}}\left( {\frac{{80.32}}{{{\text{TP}}}}~} \right)}}{{{\text{ln}}2}}} \right)} \right),$(23)
${\text{TSI}}\left( {{\text{P}}{{{\text{O}}}_{4}}} \right) = 10\left( {6 - \left( {\frac{{{\text{ln}}\left( {\frac{{21.67}}{{{\text{P}}{{{\text{O}}}_{4}}}}{\text{\;}}} \right)}}{{{\text{ln}}2}}} \right)} \right),$(24)
${\text{TSI}}\left( {{\text{Chla}}} \right) = 10\left( {6 - \frac{{2.04 - 0.695{\text{lnChla}}}}{{{\text{ln}}2}}} \right).$Содержание хлорофилла “а” (Chl“а”) было рассчитано по формуле, характерной для арктических озер Кольского Севера (Моисеенко, 2018):
(25)
$\begin{gathered} {\text{Chl\textquotedblleft а\textquotedblright }} = 0.92\ln {{{\text{P}}}_{{{\text{общ}}}}} - 0.45{\text{ }} \\ \left( {r = 0.82;\,\,p = 0.05} \right), \\ \end{gathered} $Прозрачность воды по диску Секки в среднем за вегетационный сезон по следующей формуле (Бульон, 2018):
(26)
${\text{Sec}} = {{10}^{{(1.26 - 0.31{\text{LOG}}10({\text{Pt}}) - 0.36{\text{LOG}}10({\text{TP}}))}}},$В тундровой зоне к 2010–2018 гг. по сравнению с 1990–2000 гг. количество олиготрофных озер сократилось на 54%, тогда как мезотрофных и эвтрофных – увеличилось на 33 и 21% соответственно (табл. 5). В лесотундровой и северо-таежной зонах к 2010–2018 гг. не осталось олиготрофных озер, сократилось количество мезотрофных озер (на 14 и 15% соответственно) и значительно возросло количество эвтрофных (на 66 и 48% соответственно).
Таблица 5.
Трофический статус озер Кольского Севера в различных ландшафтных зонах (Abid, Gill, 2014)
| Значение TSI | Количество озер, % | |||||
|---|---|---|---|---|---|---|
| I – тундровая зона, n = 15 | II – лесотундровая зона, n = 21 | III – северо-таежная зона, n = 32 | ||||
| 1* | 2* | 1 | 2 | 1 | 2 | |
| Олиготрофные (0–30) | 67 | 13 | 52 | 0 | 33 | 0 |
| Мезотрофные (30–50) | 20 | 53 | 43 | 29 | 25 | 10 |
| Эвтрофные (50–70) | 13 | 34 | 5 | 71 | 42 | 90 |
ЗАКЛЮЧЕНИЕ
В последнее столетие остро обозначилась проблема эвтрофирования водоемов вследствие неконтролируемого поступления огромного количества биогенных элементов и органических веществ в биотических круговорот. Арктические регионы располагают огромным фондом малых олиготрофных озер, не затронутых прямым влиянием человеческой деятельности. Однако влияние глобального рассеивания фосфора и потепление климата могут затронуть и отдаленные озера.
В основу оценки биогеохимических изменений озер и влияния на них потепления климата послужили результаты долговременных исследования малых озер (раз в 4–5 лет с 1990 г.), которые не были затронуты непосредственным влиянием человеческой деятельности. Доказаны изменения ряда гидрохимических показателей (BC, Alk, Si, ${\text{SO}}_{4}^{{2 - }},$ DOC, ${\text{NH}}_{4}^{ + },$ Ntot, Ptot,) к 2010–2018 гг. по сравнению с периодом 1990–2000 гг. Для всей площади водосборных бассейнов исследованных озер характерно отсутствие близлежащих крупных населенных пунктов и промышленных производств, оказывающих негативное воздействие на окружающую среду.
Исследования показали, что в последний период произошло достоверное увеличение содержаний общего фосфора и азота на фоне сохранения концентраций их биодоступных форм, что свидетельствует о быстрой утилизации последних в продукционных процессах. Наиболее отчетливо эти процессы проявились в лесных экосистемах северной тайги. Одновременно доказано нарастание органического вещества в тундровой зоне, которое показывает достоверную связь с температурой приземного слоя воздуха за вегетационный период. Наши расчеты показали, что к периоду 2010–2018 гг. по сравнению с периодом 1990–2000 гг. произошло увеличение потоков фосфора с водосборной площади в исследованные озера с разной интенсивностью: в озеро тундровой зоны – в 2 раза, лесотундровой – в 4 раза, северо-таежной – в 3.5 раза.
Для оценки изменений трофического статуса исследованной группы озер был использован интегральный индекс Р. Карлсона (TSI), который показал, что в целом на Кольском Севере значимо снизилось количество олиготрофных (на 35%) озер и возросло число эвтрофных озер (на 45%) даже в случаях отсутствия какого-либо влияния человеческой деятельности на берегах отдаленных озер.
Работа выполнения при финансовой поддержке гранта РНФ № 22-17-00061.
Список литературы
Алимов А.Ф. (2000) Элементы теории функционирования водных экосистем. СПб.: Наука. 147 с.
Алимов А.Ф., Голубков М.С. (2014) Эвтрофирование водоемов и структура сообщества гидробионтов. Биология внутренних вод. 3, 5-11.
Архив погоды: Мурманская область (2019) Справочно-информационный портал “Погода и климат” (http://www. pogodaiklimat.ru/archive.php?id=ru®ion=51).
Атлас Мурманской области (Карты) (1971) Ред. коллегия: гл. ред. канд. геогр. наук А.Г. Дуров и др. Москва, 1 атл, 33 с.
Баранов И.В. (1961) Лимнологические типы озер СССР. Л.: Гидрометеоиздат, 275 с.
Белых О.И., Гладких А.С., Сороковикова Е.Г., Тихонова И.В., Потапов С.А., Бутина Т.В. (2015) Сакситоксин-продуцирующие цианобактерии в озере Байкал. Сибирский экологический журн. 22(2), 229-237.
Бульон В.В. (1998) Имеет ли место естественное эвтрофирование озер. Водные ресурсы. 25(6), 759-764.
Бульон В.В. (2018) Биотический поток вещества и энергии в системе “озеро и его водосбор”. Успехи современной биологии. 138(5), 503-515.
Вернадский В.И. (2003) История природных вод. В.И. Вернадский; отв. ред. С.Л. Шварцев, Ф.Т. Яншина. М.: Наука, 750 с
Винберг Г.Г. (1960) Первичная продукция водоемов. Минск: Изд-во АН БССР, 329 с.
Винберг Г.Г. (1974) Эвтрофирование и охрана вод. Гидробиологический журн. 10(2), 129-135.
Войткевич Г.В., Кокин А.В., Мирошников А.Е., Прохоров В.Г. (1990) Справочник по геохимии. М.: Недра, 480 с.
Гашкина Н.А., Моисеенко Т.И. (2010) Лимитирование трофности малых озер по основным биогенным элементам. ДАН. 435(3), 394-398.
Голубков М.С., Голубков С.М., Умнова Л.П. (2008) Первичная продукция и проблемы эвтрофирования эстуарии р. Невы. В кн.: Экосистема эстуарии р. Невы. СПб.: Изд-во “Научн. центр. РАН”, 313-338.
Даценко Ю.С. (2007) Эвтрофирование водохранилищ. Гидролого-гидрохимические аспекты, 252 с.
Драбкова В.Г., Измайлова А.В. (2014) Оценка измерения состояния вод крупнейших озер и водохранилищ Российской Федерации. География и природные ресурсы. 4, 22-29.
Жукова Т.В. (2013) Многолетняя динамика фосфора в Нарочанских озерах и факторы, ее определяющие. Водные ресурсы. 40(5), 468-468.
Калинкина Н.М., Теканова Е.В., Сярки М.Т. (2017) Экосистема Онежского озера: реакция водных сообществ на антропогенные факторы и климатические изменения. Водное хозяйство России: проблемы, технологии, управление. 1, 4-18.
Ладога: монография. (2013) Под ред. В.А. Румянцева, С.А. Кондратьева. СПб.: Нестор, 468 с.
Моисеенко Т.И. (2018) Антропогенно-индуцированные процессы в водах суши арктических регионов и критерии их оценки. Водные ресурсы. 45(4), 1-12.
Моисеенко Т.И., Базова М.М., Дину М.И., Гашкина Н.А., Кудрявцева Л.П. (2022) Изменение геохимии вод суши в условиях потепления климата и снижения выпадений кислот: восстановление или эволюция озер? Геохимия. 67(6), 1-18.
Moiseenko T.I., Bazova M.M., Dinu M.I., Gashkina N.A., Kudryavtseva L.P. (2022) Changes in the geochemistry of land waters at climate warming and a decrease in acid deposition recovery of the lakes or their evolution? Geochem. Int. 60(7), 685-701.
Неверова–Дзиопак Е. (2020) Оценка трофического состояния поверхностных вод: монография. СПб: СПбГАСУ. 176 с.
Одум Ю. (1986) Экология. Т. 2. М.: Мир, 376 с.
Першина Н.П., Полищук А.И. (2008) Оценка химического состава атмосферных осадков на территории Северо-западного федерального округа России и Финляндии по результатам международного Росийско-Финско-Норвежского проекта “Экогеохимия Баренцева Региона”. Труды главной геофизической обсерватории им. А.И. Воейкова. 558, 233-251.
Россолимо Л.Л. (1977) Изменение лимнических систем под воздействием антропогенного фактора. М.: Наука, 205 с.
Румянцев В.А., Драбкова В.Г., Измайлова А.В. (2014) Крупнейшие озёра мира и перспективы их практического использования. Вестник РАН. 84(1), 41-51.
Румянцев В.А., Драбкова В.Г., Измайлова А.В. (2015) Озера европейской части России: монография. СПб.: ЛЕМ-А, 392 с.
Рыжаков А.В., Сабылина А.В. (2015) Фосфатазная активность и скорость оборота фосфора в воде Ладожского и Онежского озер. Экологическая химия. 24(2), 111-115.
Трифонова И.С., Афанасьева А.Л., Макарцева Е.С., Бардинский Д.С. (2016) Соотношение фито- и зоопланктона в разнотипных озерах Карельского перешейка. Известия Самарского научного центра Российской академии наук. 18(2-2), 515-519.
Хендерсон-Селлерс Б., Маркленд Х.Б. (1990) Умирающие озера: Причины и контроль антропогенного эвтрофирования. Л.: Гидрометеоздат, 278 с.
Цветкова Л.И. (1980) Оценка и прогноз эвтрофирования в слабоминерализованных нестратифицированных водоемах: дис. … д-ра биолог. наук. Л.: ЛИСИ, 239 с.
Шаров А.Н. (2020) Фитопланктон холодноводных озерных экосистем под влиянием природных и антропогенных факторов. Автореферат на соискание докт. Биол. Наук. https://www.sciencemag.org/content/ 286/5442/1129.long
Abid A.A., Gill S.S. (2014) Eutrophication: Causes, Consequences and Control Volume 2. Springer, Dordrecht, Heidelberg, London, N.Y., 262 p.
Bakker C.K.G. (2021) Nutrients and biota in a lake system before and after restoration; a data analysis of the Swedish eutrophication case study Växjösjön. Master thesis in Sustainable Development at Uppsala University. 24, 36 p.
Carlson R.E. (1977) A trophic state index for lakes. Limnol. Oceanogr. 22(1), 361-369.
Cunha D.G.F., Casali S.P., De Falco P.B., Thornhill I., Loiselle S.A. (2017) The contribution of volunteer-based monitoring data to the assessment of harmful phytoplankton blooms in Brazilian urban streams. Sci. Total Environ. 584, 586-594.
De Wit H.A., Valinia S., Weyhenmeyer G.A., Futter M.N., Kortelainen P., Austnes K., Hessen D.O., Räike A., Laudon H., Vuorenmaa J. (2016) Current browning of surface waters will be further promoted by wetter climate. Environ. Sci. Technol. Lett. 3(430-5).
Dillon P.J., Rigler F.H. (1974) A test of a simple nutrient budget model predicting the phosphorus concentration in lake water. J Fish Res. Board Can. 31, 1771-1778.
Driscoll C.T., Driscoll K.M., Fakhraei H., Civerolo K. (2016) Long-term temporal trends and spatial patterns in the acid-base chemistry of lakes in the Adirondack region of N.Y. in response to decreases in acidic deposition. Atmos. Environ. 146, 5-14.
Eaton A., Arnold E., Archie A.E., Rice E.W., Clesceri L.S. (1992) Standard Methods for the Examination of Water and Wastewater. 17th edn. Washington, DC: American Public Health Association (APHA).
Hakanson L., Boulion V.V. (2001) A practical approach to predict the duration of the growing season for European lakes Ecol. Model. 140, 235-245.
Hakanson L., Boulion V.V. (2002) The Lake Foodweb – modelling predation and abiotic/biotic interactions. Leiden: Backhuys Publishers, 344 p.
Henriksen A., Kämäri I., Posh M., Wilander A. (1992) Critical loads of acidity: Nordic surface waters. Ambio. 21, 356-363.
Huang C., Wang X., Yang H., Li Y., Wang Y., Chen X., Xu L. (2014) Satellite data regarding the eutrophication response to human activities in the plateau lake Dianchi in China from 1974 to 2009. Sci. Total Environ. 485–486, 1-11.
Huang J., Xu C.-C., Ridoutt B.G., Wang X.-C., Ren P.-A. (2017) Nitrogen and phosphorus losses and eutrophication potential associated with fertilizer application to cropland in China. J. Cleaner Prod. 159, 171-179.
ICP-water report: Acidification of surface water in Europe and North America (2007): Trends, biological recovery and heavy metals.
Kane D.D., Conroy J.D., Richards R.P., Baker D.B., Culver D.A. (2014) Re-eutrophication of Lake Erie: Correlations between tributary nutrient loads and phytoplankton biomass. J. Great Lakes Res. 40(3), 496-501.
Karydis M. (2009) Eutrophication, assessment of coastal waters based on indicators: a literature review. Global Nest Journal. 10(10), 20-21.
Lepori F., Roberts. J.J. (2017) Effects of internal phosphorus loadings and food-web structure on the recovery of a deep lake from eutrophication. J. Great Lakes Res. 43(2), 255-264.
Lerman A., Mackenzie F.T., May Ver L. (2004) Coupling of the perturbed C-N-P cycles in industrial time. Aquat. Geochem. 10, 3-32.
Liu Y., Chen W., Li D., Huang Z., Shen Y., Liu Y. (2011) Cyanobacteria-/cyanotoxin-contaminations and eutrophication status before Wuxi Drinking Water Crisis in Lake Taihu, China. J. Environ. Sci. 23(4), 575-581.
Mekonnen, M.M., Hoekstra, A.Y. (2018) Global anthropogenic phosphorus loads to freshwater and associated grey water footprints and water pollution levels: A high resolution global study. Water Resour. Res. 54, 345-358.
Moiseenko T.I., Dinu M.I., Bazova M.M., Heleen A. de Wit. (2015) Long-term changes in the water chemistry of subarctic lakes as a response to reduction of air pollution: case study in the Kola North, Russia. Water, Air, Soil Pollut. 226(98), 1-12.
Moiseenko T., Sharov A. (2019) Large Russian lakes Ladoga, Onega, and Imandra under strong pollution and in the period of revitalization: a review. Geosciences. 9(12), 492.
Monteith D.T., Stoddard J.L., Evans C.D., de Wit H.A., Forsius M., Hogasen T., Wilander A., Skjelkvale B.L., Jeffries D.S., Vuorenmaa J., Keller B., Kopacek J. and Vesely J. (2007) Dissolved organic carbon trends resulting from changes in atmospheric deposition chemistry. Nature. 450, 537-539.
Mosello R., Bianchi M. (1994–1997) Geiss HAQUACON-MedBas “Acid rain analysis”, 1996. Ispra.
Neverova–Dziopak E. (2010) Podstawy zarzadzania procesem eutrofizacji antropogenicznej. Krakow: AGH, 132 p.
Toledo P. Jr., Talartico M., Chinez S.J., Agudo E.G. (1983) A Aplicacao de Modelos Simplificados para a Avaliacao do Processo de Eutrofizacao em Lagos e Reservatórios Tropicais. In: Congresso Brasileiro de Engenharia Sanitária e Ambiental, 12, 34.
San Clements M.D., Fernandez I.J., Lee R.H., Roberti J.A., Adams M.B., Rue G.A., McKnight D.M. (2018) Long-Term Experimental Acidification Drives Watershed Scale Shift in Dissolved Organic Matter Composition and Flux Environ. Sci. Technol. 52, 2649-2657.
Schindler D.W. (1971) Carbon, nitrogen, phosphorus and the eutrophication of freshwater lakes. J. Phycol. 7, 321-329.
Standart methods for the examination of water and wasterwater. (1992) Wash. (D.C.): Amer, Publ, Health Assoc.
Sterner R.W., Andersen T., Elser J.J., Hessen D.O., Hood J.M., McCauley E., Urabe J. (2008) Limnol. Oceanogr. 53(3), 1169.
Stoddard J.L., Van Sickle J., Herlihy A.T., Brahney J., Paulsen S., Peck D.V., Mitchell R., Pollard A.I. (2016) Continental-scale increase in lake and stream phosphorus: Are oligotrophic systems disappearing in the United States? Environ. Sci. Technol. 50, 3409-3415.
Strock K.E, Nelson S.J., Kahl J.S., Saros J.E., Mc Dowell W.H. (2014) Decadal trends reveal recent acceleration in the rate of recovery from acidification in the northeastern U.S. Environ. Sci. Technol. 48, 4681-4689.
Strock K.E., Theodore N., Gawley W.G., Ellsworth A.C., Saros J.E. (2017) Increasing dissolved organic carbon concentrations in northern boreal lakes: implications for lake water transparency and thermal structure. J. Geophys. Res. Biogeosci. 122, 1022-35.
Дополнительные материалы отсутствуют.