Геоморфология и палеогеография, 2021, T. 52, № 3, стр. 3-23
МОРСКАЯ БИОГЕОМОРФОЛОГИЯ: БИОГЕННАЯ ТРАНСФОРМАЦИЯ МОРСКИХ ДОННЫХ ЛАНДШАФТОВ
1 Институт океанологии им. П.П. Ширшова РАН
Москва, Россия
* E-mail: vadim@ocean.ru
Поступила в редакцию 10.08.2020
После доработки 28.01.2021
Принята к публикации 09.04.2021
Аннотация
Биогенная трансформация подводных ландшафтов – один из ведущих факторов, определяющих современный облик дна. Задача морской биогеоморфологии – изучение всех аспектов биологической модификации геоморфологических процессов, т.е. описание, систематизация и количественная оценка влияния биоты на формирование донного рельефа. В обзоре систематизированы и кратко охарактеризованы основные виды воздействия морских организмов на геоморфологические процессы. Живые организмы создают биогенные структуры и материал для донных отложений, изменяют рельеф, физические и химические свойства донных отложений и коренных пород, участвуют в разрушении пород на морском дне (от илов до базальтов), переносе и перераспределении материала на дне и в придонном слое; они способны переводить растворенный в воде кальций и кремний в нерастворимые (или слабо растворимые) карбонаты и силикаты. Примером биогенных сооружений служат рифы – коралловые и созданные многощетинковыми червями, мидиевые и устричные банки. Животные создают не только положительные, но и отрицательные формы рельефа, размеры которых могут превышать десятки метров, а время существования – недели и даже месяцы: ямы, канавы, воронки на поверхности дна – следы питания самых разных животных: моржей, черепах, китов, скатов и др. Микро- и макроорганизмы формируют глубокие ниши вблизи уреза воды (биокарст). Мангры, водоросли-макрофиты и морские травы защищают дно от размыва, а породы на дне от выветривания, работают как седиментационные ловушки, в которых накапливаются тонкие фракции осадка. Рыбы переносят материал с рифа в лагуну. Водоросли-макрофиты за счет парусности могут переносить валуны и гальку на большие расстояния (“рафтинг”). Многие виды двустворчатых моллюсков и другие фильтраторы пропускают через себя большие объемы воды, отсеивая из нее минеральную взвесь. Вертикальное перемещение (биотурбация) осадков роющими грунт червеобразными животными и уплотнение грунта ими (биостабилизация) изменяют физические свойства донных осадков. Один и тот же вид часто играет противоположные роли – увеличивает прочность осадка или уменьшает ее. Многообразие и разнонаправленность биологических процессов затрудняют выявление вклада биоты в геоморфологические процессы и их количественную оценку. За некоторыми исключениями пространственный масштаб деятельности единичных организмов редко превышает первые сантиметры. Заметной становится только совокупная деятельность многих совместно обитающих организмов. Практические приложения биогеоморфологии связаны с разработкой мер для берегоукрепления и защиты берегов.
ВВЕДЕНИЕ. ОПРЕДЕЛЕНИЕ ПОНЯТИЙ И КЛАССИФИКАЦИЯ
Донные ландшафты формируются в результате взаимодействия трех групп процессов – геологических (создающих рельеф дна и определяющих характер субстрата), гидрологических (суммарная гидродинамическая нагрузка на дно волн и течений) и биотических. Структура и таксономический состав биоты определяются характером дна и гидрологическими характеристиками придонного слоя, но и биота, в свою очередь, может влиять на геоморфологические и гидрологические процессы и заметно их модифицировать. Влияние биоты на формирование структуры и рельефа дна (в том числе, и через изменение гидродинамики) является предметом биогеоморфологии (рис. 1). Географическая энциклопедия определяет эту науку как находящуюся на стыке экологии и геоморфологии область знания о влиянии живых организмов на ландшафты и их трансформацию, изучающую взаимосвязь между биотой и геоморфологическими процессами [1]. Формальное введение термина “биогеоморфология” датируется 1988 г., годом выхода монографии под таким названием [2], но начиная уже с первых экологических исследований [3], влияние различных аспектов жизнедеятельности организмов на среду обитания и ее трансформацию всегда рассматривалось как один из центральных вопросов экологии. В зоологической литературе последних десятилетий появилось понятие “экосистемные инженеры” [4–6], акцентирующее внимание на ключевой роли морской биоты в стабилизации или трансформации среды обитания для других организмов [7–10]. Одновременно классическая геоморфология обратила внимание на комплексные взаимодействия организмов и их влияние на рельеф, назвав их одной из центральных проблем современной биогеоморфологии [1], требующей для своего решения тесного сотрудничества биологов, геоморфологов и геологов в изучении сложных взаимодействий в разных пространственных и временных масштабах. В отечественной литературе к биогенным факторам рельефообразования относят: накопление рыхлого осадочного материала из скелетов различных организмов; формирование рифовых известняков и образование коралловых рифов; разрушение и разрыхление горных пород камнеточцами; переработку донных грунтов илоедами, а также седиментационную активность моллюсков и других фильтраторов [11]. В учебнике [12] подробно рассматриваются фитогенные берега (мангровые и маршевые) и биогенные берега, сформированные рифостроителями, а также различные аспекты биогенной трансформации дна.
Рис. 1.
Взаимодействие ведущих факторов формирования подводного ландшафта. Взаимодействия, выделенные жирными стрелками, составляют предмет статьи.

Задача этого обзора – систематизировать и кратко охарактеризовать основные виды воздействия морских многоклеточных организмов на геоморфологические процессы и, по возможности, количественно оценить разнонаправленные воздействия бентоса на донные отложения на разных глубинах и в различных широтных зонах. Речь будет идти, преимущественно, о макроорганизмах, за пределами рассмотрения остается огромный пласт знаний о роли микробиоты в трансформации морских и наземных ландшафтов [13]. Эта обширная тема требует специального рассмотрения и далеко выходит за возможный объем одной статьи.
При подборе литературы для цитирования предпочтение отдавалось обзорам, по спискам литературы из которых можно найти нужные факты, либо наиболее интересным частным работам, содержащим малоизвестную информацию. В последнем случае автор, как зоолог, отдавал предпочтение тем исследованиям, в которых геоморфологическая роль биоты оценивалась исходя из биологии видов. Латинские названия животных и растений приводятся в тексте так, как они приведены в цитируемых источниках, без поправки на позднейшие изменения таксономии.
Общепринятой классификации биологических процессов в морской геоморфологии не существует. В англоязычной литературе принята классификация по механизмам воздействия организмов на донные отложения и рельеф [1, 14, 15]. Чаще всего рассматриваются: биоконструкция (создание форм рельефа), биоэрозия (биогенное разрушение пород), биоаккумуляция (накопление определенных элементов или соединений живыми организмами), биоседиментация (перевод частиц из взвеси в осадок), биостабилизация (связывание и закрепление частиц донных отложений). Эта классификация достаточно условна, неопределенность в нее вносит то, что одни и те же виды одновременно участвуют в нескольких процессах, часто разнонаправленных, что мешает дать количественную оценку (и даже выяснить направление) суммарного воздействия [7]. Некоторые существенные аспекты взаимодействия биоты и ландшафта, например, сортировка или биогенный перенос материала, выпадают из этой классификации.
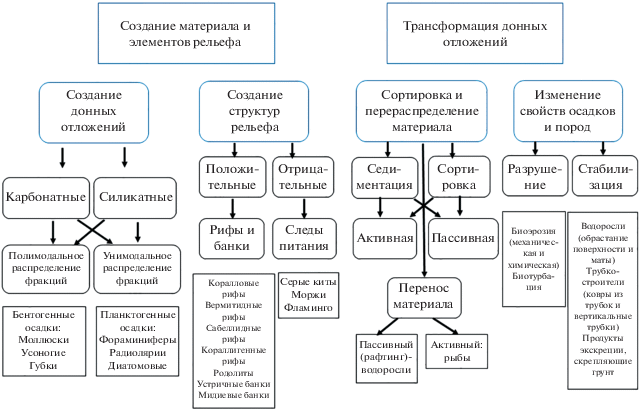
В этом обзоре принят другой подход: классификация по результату, т.е. по итоговому вкладу биоты в наблюдаемый облик донных ландшафтов. Деятельность живых организмов включает: 1) создание материала для донных отложений, 2) создание биогенных структур, изменение рельефа, 3) сортировка и перераспределение донных осадков, 4) изменение механических или физических свойств субстрата – трансформация донных отложений (рис. 2).
Рис. 2.
Классификация биологически обусловленных процессов трансформации морского дна. В квадратных рамках внизу схемы приведены примеры, подробнее описанные в тексте.
Точные количественные оценки биогеоморфологических процессов – дело будущего. Существующие данные позволяют в большинстве случаев лишь оценить порядки величин для основных процессов, для многих – на очень фрагментарных данных.
СОЗДАНИЕ МАТЕРИАЛА: БИОГЕННЫЕ ОТЛОЖЕНИЯ
Материал для донных отложений поставляют многие группы организмов. И животные, и растения способны переводить растворенный в воде кальций и кремний в нерастворимые (или слабо растворимые) карбонаты и силикаты. Создание опорных и защитных структур живых организмов может быть результатом двух процессов – секреции и агглютинации. Второй вариант относится не к созданию, а к переработке и трансформации донных отложений и будет рассмотрен ниже.
Качественный состав и количественные характеристики биогенного осадконакопления в Океане достаточно хорошо изучены и обобщены [16]. Поступление минерального биогенного материала планктона в Мировой океан оценивается в 1.82 млрд т/год, из них на долю карбонатного приходится 1.36, на долю кремнистого – 0.46 млрд т/год [16]. Карбонатные планктогенные минеральные осадки создаются отмершими раковинами или скелетами фораминифер, кокколитофорид и крылоногих моллюсков-птеропод. Бентогенные карбонатные отложения – это коралловые (кораллово-водорослевые), фораминиферовые, ракушечниковые, мшанковые, балянусовые и сложенные остатками иглокожих или трубками червей. Кремнистые отложения – это останки диатомовых водорослей, радиолярий и губок.
Планктогенные осадки глубоководных зон формируются скелетами отмерших организмов практически без переработки, размеры фракций донных отложений соответствуют размерам раковин организмов. Формирование бентогенных осадков, особенно – на шельфе, включает процессы их биогенной и абиогенной трансформации: изменение размерного состава фракций и перераспределение в пространстве.
В мелководной зоне большую роль в формировании донных осадков играют двустворчатые моллюски и усоногие раки. Так, по оценкам [17], моллюски накапливают 50–1000 г карбоната кальция на 1 м2 в год, что в пересчете обеспечивает аккумуляцию на дне слоя CaCO3 толщиной от 0.02 до 0.35 мм в год. Рекордные значения накопления CaCO3 – до 90 кг/м2 в год – принадлежат устричным банкам [17].
Накопление раковин часто приводит к полимодальному распределению фракций грунта (рис. 3). В гидродинамически активных районах формируются отложения хорошо промытой ракуши, часто – из практически целых створок и их крупных фрагментов, при полном отсутствии мелких фракций грунта. Там же, где по гидродинамическим условиям должны накапливаться только алевриты или пелиты, обломки раковин моллюсков или домиков усоногих увеличивают хрящеватость грунта, создавая второй пик в области крупных фракций, здесь наблюдается бимодальное распределение [18].
БИОГЕННЫЕ СТРУКТУРЫ В РЕЛЬЕФЕ ДНА
Самый яркий пример биогенных сооружений, меняющих весь облик дна, это коралловые рифы тропиков – результат жизнедеятельности многих видов рифостроящих (или герматипных) кораллов при участии многих других видов животных и известковых водорослей, способных к аккумуляции карбоната кальция. Конструкция рифов, их морфология, видовое разнообразие и биология видов – предмет интенсивного изучения большого числа специалистов. Большое количество доступных обзорных работ (например, [19]) позволяет не приводить здесь подробного описания. Хуже известны и меньше изучены рифы, расположенные в афотической зоне и за пределами тропиков. Строительством рифов занимаются многие организмы [20], а карбонатные постройки не ограничены тропической зоной и верхними метрами глубины [21, 22].
В отличие от мелководных, глубоководные коралловые рифы создаются небольшим числом видов. Ведущую роль, по современным представлениям, играют Lophelia pertusa, Madrepora oculata, Enallopsammia profunda, Goniocorella dumosa, Solenosmilia variabilis, Oculina varicosa и некоторые другие [23]. В Восточной Атлантике основным рифостроителем выступает Lophelia pertusa. Лофелиевые рифы изучены наиболее подробно, они известны от Норвегии до побережья Западной Африки, преимущественно на глубинах от 200 до 1000 м [23]. Эти рифы приурочены, в основном, к кромке шельфа и подводным поднятиям. В структуре рифа выделяют три основных элемента: верхнюю часть, заселенную живыми кораллами, кайму мертвых кораллов и подножие, сложенное коралловым песком и обломками [23]. Линейные размеры отдельных рифов могут исчисляться сотнями метров с превышением над дном в десятки метров. В комплексе лофелиевых рифов на гряде Сула (Норвегия) мощность этих элементов рифового комплекса составляла: для области живых кораллов – 0.5–1.5 м, зона мертвых кораллов – 5–15 м и более (большей частью перекрытая осадком), зона обломков – 3–11 м [24]. Глубоководные кораллы растут медленно, скорости процессов роста, биоэрозии, биоаккреции на один-два порядка ниже, чем на мелководных рифах. Измеренная скорость роста лофелиевого рифа варьировала от 2.4 до 35 мм в год. В экспериментах по скоростям роста годовой прирост составлял 56–67 г/м2 в год, а биоэрозия мертвых кораллов составляла 13–14 г/м2 в год, что на два порядка меньше, чем на мелководных коралловых рифах. Аккреция карбоната кальция на мертвых кораллах за счет других накапливающих CaCO3 животных может быть и несколько больше – 14–26 г/м2 в год [25]. Глубоководные рифы – объект интенсивного изучения, им посвящено несколько больших обзоров [26, 27].
Хорошо известный пример массивных биогенных структур, не связанных с деятельностью коралловых полипов, это мидиевые и устричные банки мелководной зоны морей от умеренного пояса до тропиков. И те, и другие могут формироваться как на твердом грунте, так и на илах, где субстратом выступают отмершие створки раковин предыдущих поколений.
Вермитидные рифы, широко распространенные на мелководьях Средиземного моря [28], названы так по семейству брюхоногих моллюсков-вермитид (семейство Vermitidae, Gastropoda) – главным конструкторам этих биогенных структур. Основную роль в их создании играют вермитидный моллюск Dendropoma petraeum и известковая красная водоросль Neogoniolithon brassica-florida. В постройке рифов также участвуют моллюски Vermetus triquetrus и красные водоросли Lithophyllum byssoides, Lithophyllum incrustans и Neogoniolithon mamillosum.
Еще одна группа рифостроителей – это многощетинковые черви или полихеты. Эти черви играют важную роль в различных геоморфологических процессах. Строительством прочных конструкций на дне занимаются виды, живущие в трубках разного размера и прочности и относящиеся к таксону сидячих полихет Sedentaria. В Средиземном и Северном морях достаточно подробно изучены постройки двух видов сабеллярий – Sabellaria spinulosa и S. alveolata [29]. Трубки сабеллярий состоят из сцементированных частиц мелкозернистого песка и обладают высокой прочностью [30]. Рифы, построенные сабелляриями, могут подниматься на десятки сантиметров (до 2 м) над грунтом и занимать площадь в несколько гектаров [31]. Рифоподобные структуры создают и полихеты-теребеллиды Lanice conchilega. На литорали Бельгии их плотные агрегации размером 1–10 м2 поднимаются над грунтом на 8–10 см и занимают площадь в сотни тысяч м2. Прочность таких структур зависит от плотности поселений полихет: напряжение сдвига меняется от 100 мбар (10 кПа) при плотности 1000 экз/м2 до 200 мбар (20 кПа) там, где плотность червей достигает 3500 экз/м2, что в два раза выше прочности окружающего грунта [32].
Интенсивное накопление карбоната кальция присуще известковым зеленым водорослям (семейство Halimedaceae) и красным водорослям порядка Corallinales, участвующим в создании коралловых рифов.
На глубинах 30–60 (до 120) м в субтропических широтах распространены кораллигенные рифы. Наиболее детально изучены они в Средиземном море (подробный обзор – [33]). Основными конструкторами выступают разные виды водорослей, сменяющие друг друга по глубине, в строительстве рифов участвуют также мшанки, полихеты-серпулиды, моллюски вермитиды и многие другие группы организмов. По сложности и разнообразию эти конструкции не уступают мелководным рифам, в составе средиземноморских кораллиновых сообществ зарегистрировано не менее 315 видов водорослей (до половины которых – средиземноморские эндемики), 1180 видов беспозвоночных и 110 видов рыб, причем список этот, скорее всего, далеко не полон [33].
Флористически богатые сообщества, сформированные известковыми красными водорослями, обнаружены у побережья Сирии [34]. В отличие от “кораллиновых тротуаров” западного средиземноморья [35], развивающихся на твердом субстрате, агрегации водорослей лежат здесь на илистом грунте на глубинах от 25–40 до 90 м. Толщина слоя известковых водорослей на дне достигает 10 см, а площадь – десятков квадратных километров. В образовании этих структур последовательно участвуют многие виды водорослей различных таксономических и экологических групп [36].
Своеобразные сообщества неприкрепленных красных водорослей (maerl beds или родолиты) широко распространены во всех широтах до нижней границы фотической зоны [37, 38]. Они достигают максимальной глубины, зафиксированной для донных водорослей – 268 м [39]. Диаметр родолитов может достигать 30 см, скорость роста низка – 0.5–1.5 мм/год [40]. Эти сообщества отличаются высоким видовым разнообразием сопутствующих видов [39]. Скорость накопления CaCO3 в родолитах умеренной зоны составляет от 30 до 1200 г на 1 м2 в год [39, 40], на мелководьях тропического пояса кораллиновые сообщества могут аккумулировать 10 кг CaCO3 на 1 м2 в год [41].
Животные создают не только положительные, но и отрицательные формы рельефа. Нарушения поверхности осадка – ямы, канавы, воронки, остаются на поверхности дна как следы питания самых разных животных: моржей, черепах, китов, скатов и даже фламинго. Размеры таких структур, создаваемых крупными организмами, могут превышать десятки метров, а время существования, в зависимости от интенсивности гидродинамики – недели и даже месяцы. Так, серые киты, питаясь амфиподами, оставляют на месте кормежки ямы 2.5 на 1.5 м, глубиной около 10 см, а следы питания моржей выглядят как траншеи полуметровой ширины длиной 40–50 м [42]. Свои следы на грунте оставляют все виды, питающиеся бентосом или нектобентосом, обычно эти следы быстро исчезают, но, при высокой интенсивности питания, они могут менять облик дна на длительное время. Так, стаи чилийских фламинго (Phoenicopterus chilensis) во время зимовок сотнями собираются на пляжах о-ва Чилое (Ю. Чили). Следы их питания взвесью придонного слоя на литорали (птица опускает голову в воду и медленно поворачивается вокруг своей оси, взмучивая придонный слой) выглядят как концентрические круги глубиной 10 см и диаметром около метра с возвышением по краям и холмиком в центре [43, fig. 2]. При средней плотности 14 ям на 20 м2 края соседних кругов почти смыкаются, придавая илистой литорали весьма своеобразный облик. Старые ямки смываются приливами, а новые возникают снова на каждом приливном цикле, и этот орнитогенный микрорельеф сохраняется на протяжении нескольких месяцев зимовки.
СОРТИРОВКА МАТЕРИАЛА, БИОГЕННАЯ СЕДИМЕНТАЦИЯ И ПЕРЕНОС МАТЕРИАЛА
Помимо создания форм рельефа и донных отложений, живые организмы активно участвуют в разрушении, переносе и перераспределении материала на дне и в придонном слое. Это направление биогенной трансформации дна включает несколько процессов: пассивную и активную седиментацию разных фракций донных отложений, их сортировку, разрушение твердых пород и перенос материала из одних фаций в другие.
Изменение гидродинамики придонного слоя и условий седиментации – пассивная седиментация. Два типа природных систем выступают основными объектами для изучения процессов биогенной пассивной седиментации: мангровые леса и луга морских трав, в меньшей степени изучена седиментационная роль водорослей и растительности прибрежных маршей. Механизм действия во всех случаях один – заросли растений снижают интенсивность гидродинамики в придонном слое, что приводит к накоплению более тонких фракций осадков и, часто, подъему дна и нарастанию берега в сторону моря. Простейшие модели предсказывают накопление в зарослях частиц с удельным весом более определенного критического значения. Однако возможна и более тонкая сортировка: накопление определенных фракций, размер которых ограничен и сверху, и снизу.
Самый популярный объект для изучения пассивной биоседиментации – это морские травы рода Zostera, произрастающие, преимущественно, в умеренных широтах. Плотные заросли зостеры, снижая скорость придонного течения, работают как седиментационные ловушки. Это приводит, во-первых, к накоплению тонких фракций осадка, а во-вторых, к снижению эрозии на поверхности дна, т.е. защищает дно от размыва. Так, в густых (12 000 листьев/м2) зарослях Zostera noltii на острове Зильт (Северное море) скорости придонных течений снижаются на 30–40% по сравнению с открытым дном [44]. В результате в густых зарослях возрастают устойчивость поверхности дна к размыву и доля илистых частиц в осадке.
Модификация течений и сортировка грунта в зарослях морских трав имеют достаточно сложный нелинейный характер и служат предметом многочисленных экспериментов и моделирования. Условия седиментации меняются в зависимости от плотности зарослей, скорости течения, размеров растений и других факторов. В зарослях морских трав может происходить не только заиление грунта, но, в определенных условиях, и обратный процесс, приводящий к уменьшению содержания илистой фракции. В плотных зарослях морских трав максимальная скорость течения наблюдается у поверхности дна, что вместе с возникающими вертикальными токами воды может приводить к вымыванию самых мелких частиц [45]. В серии экспериментов с трансплантацией морских трав были выявлены оба процесса – заиление и опесчанивание, приводящие к промежуточным значениям концентрации илистых частиц в зарослях [46]. Двухсторонняя сортировка осадка была показана и на моделях в условиях волнового воздействия [47]. В масштабе прибрежной зоны это двойственное влияние морских трав на донные осадки приводит к формированию сложной пространственной мозаики пятен с разным модальным диаметром частиц [48].
Разные виды морских трав отличаются плотностью куртин, длиной, шириной и плотностью листьев. Плотность зарослей и высота над дном зависят также от возраста растений, а часто – и от сезона. На условия седиментации и сортировку осадка влияют скорость течения, интенсивность волнения, а на литорали – еще и высота прилива. В совокупности эти факторы сильно затрудняют вычисление суммарного эффекта трав на дно под ними и рядом [49]. Тем не менее оценки скорости подъема поверхности дна под зарослями морских трав, выполненные в нескольких районах тропических побережий методами точного измерения уровня дна в течение нескольких лет [50], показали, что среднее превышение уровня в зарослях над чистым субстратом составляет 31 мм в год.
Большое количество исследований по седиментации донных осадков выполнено в мангровых лесах, где происходит накопление тонких фракций осадка среди корней мангров, приводящее к нарастанию берегов [51]. Механизм осадконакопления в манграх принципиально сходен с описанным для лугов морских трав, но проявляется он, как правило, в больших пространственных масштабах (рис. 4). Самый крупный сплошной массив мангрового леса – Сундарбан – занимает более 200 км побережья Индии и Бангладеш.
Рис. 4.
Вьетнам, дельта Меконга. Мангровые заросли – мощный агент биогенной седиментации. Переплетенные корни ризофор способствуют быстрому накоплению илистых фракций грунта (а), однако, в условиях интенсивной гидродинамики мангры не могут противостоять разрушительной деятельности штормов (б) и лес отступает (в).

Заросли водорослей-макрофитов тоже способны изменять гидродинамику придонного слоя [52], однако количественных характеристик этого процесса практически нет. Водорослевые маты – сезонные скопления нитчатых водорослей, образующие на дне ковры из плотно переплетенных нитей, – усиливают седиментацию, снижают волновую нагрузку на дно, изменяют редокс-потенциал подстилающего грунта, вплоть до возникновения локальных заморов [53]. Для разрушения матов необходимы скорости придонных течений, в 3–9 раз превышающие природные [9]. Даже разреженные маты Ulva intestinalis препятствуют размыванию осадка потоком [54].
Агентами пассивной седиментации могут выступать не только растения, но и животные. Плотные ковры трубок, покрывающих дно, приводят к быстрому заилению грунта. Строительство трубок свойственно многим донным животным из разных таксономических групп. Плотный покров из мелких трубок создают многие полихеты, некоторые виды амфипод и другие животные. Поскольку многие из трубкостроителей – фильтраторы, в таких поселениях может происходить одновременно и пассивная, и активная седиментация.
Перераспределение материала в пространстве. Скорость биогенного переноса осадка с рифа в лагуну составляет около двух тонн с гектара в год [55]. Биогенный перенос материала описан для нескольких видов рыб, обитающих на коралловых рифах. Рыбы-хирурги и рыбы-попугаи питаются на рифах, мощными челюстями скусывая живые кораллы вместе с известковым скелетом. Органическое вещество усваивается, а карбонат кальция, пройдя через пищеварительную систему, извергается мелкозернистым песком при дефекации. Вклад отдельных видов в перераспределение вещества зависит как от интенсивности питания, так и от поведения рыб. Два близких вида рыб-попугаев (Chlorurus sordidus и Ch. gibbus) отличаются по своему вкладу в эрозию. Для первого он составляет 23.58 кг на особь в год, для второго – 1017.66 кг. Относительный вклад этих видов в перенос материала определялся не только абсолютной величиной, но и особенностями поведения: Ch. gibbus питался в мелководной части рифа, а дефекацию производил в специально отведенных местах на глубине. Таким образом, суммарный вклад этого вида в перенос материала за пределы рифа оказался еще больше, чем у Ch. sordidus [56].
Учитывая примерное равенство скоростей роста кораллов, биоэрозии и переноса материала, можно предполагать, что биотопы кораллового песка у подножия рифов имеют почти исключительно биогенное происхождение.
Биогенный перенос крупных фракций могут осуществлять и водоросли. Водоросли-макрофиты за счет парусности способны переносить валуны и гальку на большие расстояния. Этот процесс получил название “рафтинг”. Мелкие камни, гравий и галька переносятся водорослями при скоростях течения, намного меньших, чем необходимы для перемещения такого же размера объектов только за счет потока. Так, порог начала перемещения камня диаметром 30 мм с растущей Cymanthere triplicata составлял 0.3 м/с, что на порядок меньше скорости течения, необходимой для отрыва такого камня [57]. Крупные бурые водоросли с большими пластинчатыми талломами Durvillaea antarctica у Южного острова Новой Зеландии способны переносить как мелкую гальку, так и крупные валуны весом 2–7 кг на расстояние 100–300 км и более, камень весом около 30 кг был перемещен на расстояние около 1 км [58]. Крупные Durvillaea antarctica, с листовой пластинкой от 2.5 до 11 м при сильных штормах переносят валуны весом в десятки килограммов. Наиболее крупные валуны, поднятые листовыми пластинами длиной 5–11 м после сильного шторма у берегов о-ва Маккуори, весили 130–160 кг [59]. Авторы оценивают суммарный вынос валунов с верхней литорали острова в 1561 кг с 1 км береговой линии за год, что обеспечивает скорость эрозии в 0.1 мм/год. Самый крупный перемещенный водорослями валун весил 365 кг [60].
Участие в переносе грубообломочного материала зафиксировано не менее чем для 26 родов макрофитов [61]. Первые места в списке занимают ламинарии, алярии, саргассы и фукусы, но переносить небольшие камни и гравий могут и зеленые (Codium, Ulva), и красные водоросли (Chondrus, Rhodymenia). Объем выносимого водорослями материала зависит от структуры пород, слагающих литораль и верхнюю сублитораль: вынос с консолидированных скал не превышает первых граммов с 1 м2 в год, а фрагментированный базальт может поставлять до 78 г с 1 м2 за год [61]. Водорослевый транспорт материала “работает” в обе стороны: он обеспечивает как вынос обломочного материала из нижних отделов литорали и с верхней сублиторали вниз по профилю, так и, при вдольбереговом переносе, он приводит к появлению крупных фракций грунта на песчаных пляжах. На пляжи Новой Зеландии на квадратный метр в год выносится водорослями от 0.5 до 7.5 г валунов, гальки и гравия [60].
Предполагается, что в холодные климатические эпохи и в высоких широтах основную роль в переносе крупнообломочного материала играет лед [62], объем водорослевого переноса на три порядка меньше [63]. В теплые периоды и в умеренных широтах ведущая роль в этом переносе может переходить к макрофитам [61].
Активная седиментация. Многие виды двустворчатых моллюсков – активные фильтраторы. С использованием мышечных сил они пропускают через себя большие объемы воды, отцеживая из нее пищевые частицы. Минеральная взвесь отсеивается и выводится из организма в виде псевдофекальных пеллет. При этом происходит увеличение модальных размеров частиц: моллюски отфильтровывают частицы размером 1–7 мкм и выбрасывают пеллеты по 500–3000 мкм [18]. Доля минеральной фракции достигает в пелетах 70–90%.
В обобщенном виде интенсивность фильтрации (F, л/час) связана с массой тела (W, г сухого веса) уравнением вида: F = aWb, коэффициенты a и b лежат в пределах от 3.0 до 11.6 и от 0.6 до 0.9, и зависят от видовой принадлежности и, отчасти, от метода измерения [64]. Вклад биоседиментации в процесс осаждения взвешенного вещества на дно на мидиевой банке в Балтийском море достигал в отдельные сезоны 150% (в среднем 24%), около трети массы приходилось на минеральную фракцию. В абсолютных цифрах скорость седиментации составляла 0.2–3.3 г минерального вещества на 1 м2 в сутки, скорость биоседиментации – 0.2–1.2 г/м2 в сутки [65]. В масштабах моря биоседиментация может давать весьма заметный вклад в формирование донных отложений: на акватории моря Ваттов моллюски-кардиумы осаждают до 100 000 т взвеси, а мидии – 75–100 тыс. т в сухом весе [66].
Биогенное взмучивание. Обратный процесс, ре-суспензия осадочного материала, его разрыхление и перенос в толщу воды тоже могут происходить под действием живых организмов. Многие виды-бентофаги (серые киты, моржи, каланы, морские черепахи, многие виды рыб) в поисках корма “вспахивают” донные отложения, извлекая из них съедобное [67]. Количественно оценена такая деятельность для двух видов крупных морских млекопитающих – серого кита (Eschrichtius robustus) и моржа (Odobenus rosmarus). По расчетам [42], серые киты, питаясь, ежегодно взмучивают в северо-восточной части Берингова моря 172 × 106 т осадка. Эти цифры сопоставимы с твердым стоком такой реки, как Юкон. Еще 107 × × 106 т осадка перекапывают моржи, кормящиеся в этой же части моря.
Питание мелких, менее заметных, но гораздо более массовых организмов, от рыб (линейные размеры – десятки сантиметров) до гарпактикоидных копепод (миллиметры – доли миллиметров), тоже связано с взмучиванием верхнего слоя осадка и нарушением его связности. Попытки количественно оценить этот процесс в масштабах Океана, вероятно, даже не предпринимались, однако, по отдельным наблюдениям, его последствия могут быть значительными [12, с. 347].
БИОГЕННАЯ ТРАНСФОРМАЦИЯ ДОННЫХ ОТЛОЖЕНИЙ
Изменение условий осадконакопления в грунте – не единственный путь изменения свойств осадков биотой. Живые организмы способны изменять физические и химические свойства донных отложений и коренных пород разными способами и в разных направлениях. Биогенному воздействию подвержено морское дно, сложенное любым материалом, от илов до базальтов.
Трансформация твердых субстратов. Биогенному разрушению твердых пород посвящена обширная литература, в том числе – несколько хороших обзоров, содержащих как описания процессов [68–71], так и их количественные оценки для разных природных зон и субстратов [68, 72]. Карбонатные породы наиболее подвержены биологическому разрушению, большинство количественных оценок относится именно к ним, но и все остальные породы, в той или иной степени, трансформируются и разрушаются живыми организмами [70].
Начальный этап разрушения скал – это образование сообщества микроскопических организмов на поверхности и в расщелинах субстрата. Микробиота на поверхности скал включает микроводоросли (диатомовые и цианобактерии), образующих особое сообщество литотрофов и биопленки (“biofilm”). В составе микробиоты различают эпилиты, обитающие на поверхности субстрата, и эндолиты, активно внедряющиеся в толщу осадка, либо заселяющие готовые поры и трещины [68]. Далее в процесс вступают макроорганизмы – сверлильщики и соскребыватели. Первые химически или механически разрушают породы, строя в них свои норки, вторые – соскребывают поверхность скал вместе с микробиотой, которой питаются (рис. 5). В процессе разрушения пород участвуют организмы самых разных таксономических групп: губки, моллюски, многощетинковые черви, иглокожие и рыбы. Так, сверлящая губка Cliona lampa удаляет с 1 м2 дна 6–7 кг материала за 100 дней [73], а рыбы-попугаи, питаясь живыми кораллами, сгрызают на рифах от 0.2 до 5 и более кг известковых пород в год в с 1 м2 [74]. Подробный обзор скоростей биоэрозии коралловых рифов с оценкой вклада всех участвующих организмов – от цианобактерий до рыб, приведен в работе [72]. Величины современной суммарной биоэрозии рифов – от 0.5 до 9.1 кг CaCO3 с 1 м2 в год [72], сопоставимы по порядку величин со средними значениями роста коралловых рифов: 3–5 кг CaCO3 с 1 м2 в год [75], что существенно замедляет их рост.
Рис. 5.
Участок литорали на побережье о-ва Чеджу (Южная Корея) со следами активности камнеточцев (а). Агенты биоабразии в приливно отливной зоне Желтого моря (б): двустворчатые моллюски-сверлильщики (1, видны торчащие из глубоких нор сифоны), брюхоногие моллюски-акмеиды (2) и литторины (3).

Результатом эрозионной деятельности микро- и макроорганизмов является не только разрушение твердых пород, но и формирование элементов мезорельефа, например, глубоких ниш вблизи уреза воды – явление, называемое “биокарстом”, широко распространено на берегах Средиземного моря. Сочетание ниш биокарста с кораллиновыми тротуарами создает на скалистых побережьях сложные формы рельефа из углублений, выступов и барьеров [69].
Для описания биогенного разрушения пород некоторые авторы используют термин “биовыветривание” [70]. Под ним понимается два процесса: химическое растворение пород (биохимическая эрозия) и механическое их разрушение (биоабразия). Эти процессы, при сходном воздействии на коренную породу, различаются судьбой продуктов разрушения. В первом случае это растворенные соединения, остающиеся в воде, во втором – взвесь, переходящая в осадок.
Обрастание как защита от эрозии. Водорослевый покров препятствует механической эрозии. Макроводоросли формируют защитный покров на поверхности скал, скорость абразии на обросших скалах снижается. Водорослевый покров защищает и от сверлильщиков – количество норок на обросших камнях гораздо меньше [76]. На очищенных от водорослей карбонатных платформах скорость снижения уровня дна (разрушения поверхности) была до четырех раз выше, чем на контрольных (до 4 и до 1 мм в год соответственно).
Помимо механической защиты, покров водорослей предохраняет скалы от выветривания, стабилизируя микроклимат. Плотный покров водорослей предохраняет поверхность от избыточного нагрева и высыхания во время отлива. В экспериментах с искусственным удалением фукоидов на литорали юго-восточной Англии было показано, что влажность под покровом фукусов сохраняется стабильно высокой (90–95% против 60% на открытых участках), а температура – низкой, без выраженных пиков во время дневных отливов [77]. По-видимому, покров обрастания, как растительного, так и животного происхождения, эффективно препятствует не только биологической, но и механической абразии, но количественно измерить это сложно.
Биогенная трансформация осадочных отложений – биотурбация и биостабилизация. Два процесса – биотурбация и биостабилизация, приводят к изменению физических свойств поверхности донных осадков: акустической проницаемости, температуры, связности грунта (снижение порога эрозии). Биотурбация – это процесс вертикального перемещения осадков, иногда сопряженный с их сортировкой или перемешиванием. Агенты биотурбации – роющие грунт животные многих таксономических групп: кольчатые черви, моллюски, ракообразные и многие другие. Часть из них питается органическим веществом осадка (“грунтоеды”), другие используют норки в качестве убежищ, а пищу получают из придонного слоя воды или собирают ее на поверхности дна. Разнообразие форм норок очень велико, их глубина и расположение в грунте зависят от размеров, образа жизни и морфологии животных [78]. Биотурбации подвержены донные отложения на всех глубинах, а глубина перемешиваемого слоя, в зависимости от локальных условий, составляет сантиметры – десятки сантиметров. Средние оценки для Мирового океана лежат в пределах 2–10 см, разброс значений определяется как пространственными различиями в интенсивности биологического перемешивания грунта, так и различиями в методах расчета [79].
Очевидный результат биотурбации – увеличение обводненности грунта и снижение порога эрозии. Так, измеренный порог начала эрозии был ниже в обитаемом грунте, чем в дефаунированном: 20 кПа против 50–60 кПа [80]; ниже в обитаем грунте был и уровень дна за счет размыва его поверхности.
Деятельность роющих животных может приводить и к противоположному результату – уплотнению грунта и повышению порога эрозии. Распространенный тип движения в грунте, характерный для роющих червеобразных животных, при котором с помощью гидроскелета и мышечных усилий животное раздвигает частицы грунта в стороны. Так, давление гидроскелета, передающееся на стенки норки, у приапулиды Priapulus caudatus составляет 4–10 кПа, у полихет Nereis diversicolor, Neanthes virens и Arenicola marina – от 7 до 15 кПа. В результате происходит уплотнение грунта в ближайшей окрестности норки, а суммарный эффект зависит от плотности поселений роющих видов: в плотных поселениях кольца уплотненного грунта от соседних норок перекрываются, увеличивая связность грунта на большой площади. В разреженных поселениях того же вида прочность грунта на сдвиг снижается из-за большей пористости и обводненности [67]. Морские травы стабилизируют грунт, не только снижая скорость придонных течений, но и механически закрепляя его многочисленными корнями: на Белом море суммарная протяженность погруженных в грунт корневищ взморника (Zostera marina) может достигать 300 м/м2, а на 1 м корневища приходится до 300–400 корней, уходящих в грунт на глубину до 10 см [81].
Поселения организмов-трубкостроителей на илистом или песчаном дне приводят не только к накоплению тонких фракций, но изменяют физико-химические свойства осадков. В осадках меняются содержание кислорода, окислительно-восстановительный потенциал, pH, степень обводнености и плотность грунта. Хорошим примером может служить изменение свойств осадков в противоположных направлениях в поселениях двух конкурирующих за пространство литоральных видов полихет: Arenicola marina и Fabricia sabella [82]. Пескожил A. marina – активный биотрубатор, а ковер из трубок фабриций стабилизирует осадок. Такую же пару антагонистов составляют строящий трубки рачок Corrophium volutator и роющая полихета Nereis diversicolor [83].
Организмы-трубкостроители демонстрируют огромное разнообразие размеров и форм трубок, различающихся и материалом, и механической прочностью [78]. Варианты конструкций образуют непрерывный ряд от выстланной тонким слоем слизи норки до прочной трубки, состоящей из плотно склеенных частиц песка строго определенного размера [7]. Столь же разнообразно и влияние трубок на донные осадки в ближней и дальней окрестности. Характеристики грунта могут менять знак в радиусе первых сантиметров от трубки [7, fig. 1]. Вертикально расположенные крупные трубки увеличивают прочность грунта на сдвиг, а ковер из переплетенных мелких трубок увеличивает порог эрозии и, одновременно, приводит к накоплению тонких фракций грунта. Сами трубки могут сохраняться в осадке и после смерти их хозяина, поэтому вклад каждого вида в такую трансформацию осадков больше, чем актуальная плотность его поселений.
Роль слизистых продуктов экскреции не сводится к строительству трубок и выстилке норок роющих животных. Внеклеточные биополимеры (extracellular polymeric substances – EPS) могут играть самостоятельную роль в стабилизации осадка. Пленка биополимеров, производимых бактериями и нематодами, может снижать поверхностное сопротивление потоку на границе раздела грунт–вода на 50–60% [67]. В синтезе внеклеточных биополимеров, присутствующих в донных осадках, участвуют микроорганизмы [84], диатомовые водоросли [85], нематоды, полихеты и многие другие группы (рис. 6). Химический состав выделяемой слизи включает полисахариды, белки и нуклеиновые кислоты [84, 86]. Белки выделяемой бактериями слизи увеличивают силу сцепления частиц в грунте в 2–3 раза [87].
Рис. 6.
Микрофотографии (сканирующий электронный микроскоп) верхнего сантиметра грунта на песчаной литорали Белого моря. При разных увеличениях (а, б, в) видно, что все поверхности частиц грунта покрыты слоем биогенной слизи (EPS), продуцируемой, в первую очередь, свободноживущими нематодами. Фото Е. Наймарк и В. Мокиевского.

В эксперименте было показано [88], что диатомовые водоросли увеличивают устойчивость осадков к сдвиговым нагрузкам в 2–4 раза, это хорошо коррелирует с содержанием полисахаридов в осадке. Об этом же может свидетельствовать отрицательная корреляция между содержанием хлорофилла “а” в осадке и скоростью эрозии [89]. Трехкратные сезонные изменения порога эрозии на побережье Нидерландов могут объясняться сезонным развитием диатомовых [90].
Количественных оценок объемов экстракции экзополимеров нет. Ряд авторов предполагают, что ведущая роль в стабилизации осадков внеклеточными полимерами принадлежит нематодам – самой массовой и наиболее широко распространенной группе бентосных организмов [67, 91]. Нематоды сами могут секретировать мукус, а также стимулируют рост бактерий и диатомовых [85].
Вероятно, воздействие биоты на илистые и песчаные донные отложения – один из наиболее сложных разделов биогеоморфологии. В процессах трансформации таких отложений участвуют представители многих таксономических групп с индивидуальными размерами от десятков микрон до нескольких сантиметров и более. Механизмы воздействия представлены в самом широком спектре – от биохимических до поведенческих. При этом деятельность совместно обитающих видов может либо усиливать, либо компенсировать друг друга.
ВЗАИМОДЕЙСТВИЕ ВИДОВ, РАСПРЕДЕЛЕНИЕ В ПРОСТРАНСТВЕ И СМЕНА РОЛЕЙ
Схематическое представление о смене процессов в пространстве описано на примере эстуария в Северной Англии [89]. На разрезе через осушку к берегу меняются формы воздействия биоты на донные отложения, интенсивность и знак этого воздействия. У нижней границы литорали расположены мидиевые банки, механически защищающие грунт от эрозии, выше основную роль в стабилизации осадков начинают играть микробиота и выделяемые ей продукты экскреции. В среднем горизонте, где максимальна численность крупных роющих форм макробентоса, преобладают процессы биотурбации, осадок легко размывается с поверхности. Ближе к верхнему горизонту литорали развиваются маты нитчатых водорослей, защищающие грунт от размыва. Осадки верхнего горизонта литорали и супралиторали стабилизированы зарослями высших растений. Размах колебаний эрозионной устойчивости на этом градиенте авторы оценивают в два порядка величин.
Однако один и тот же вид может играть разные, часто противоположные роли в геоморфологическом процессе. Влияние роющих и выделяющих слизь червей (и макроскопических полихет, и миниатюрных нематод) увеличивает прочность осадка на сдвиг из-за увеличения связности между склеенными слизью частицами. С другой стороны, активность этих же организмов увеличивает обводненность грунта за счет увеличения пространств ходов и капилляров, что приводит к уменьшению сдвиговой прочности.
Биогенные структуры, создаваемые одним и тем же видом, могут работать и на аккумуляцию осадка, и увеличивать эрозию грунта. Так, норки краба Neohelice granulata на побережье Аргентины служат ловушками для тонких фракций, а холмики выброшенного из норок грунта размываются приливными течениями; суммарный баланс между эрозией и аккумуляцией зависит от плотности поселений краба, интенсивности течений и наличия растительности [92]. Одни и те же водоросли могут и препятствовать эрозии осадка, и увеличивать ее. Так, неприкрепленные или слабо прикрепленные водоросли (зеленые Ulva и Chaetomorpha, красные Ceramium) могут усиливать эрозию: даже при слабых движениях воды скопления водорослей перемещаются по дну, взмучивая верхний слой осадка. В присутствии водорослей взмучивание начиналось при скоростях потока в несколько раз меньших, чем на чистом грунте [93]. Этот эффект прямо противоположен многократно описанному стабилизирующему воздействию водорослевых матов на грунт [54].
Даже в очень сходных условиях существует большая пространственная изменчивость в наборе биотических факторов, определяющих подвижность грунта [94]. На уровне ассоциаций видов их взаимодействие может и усиливать, и ослаблять эффект. Так, при раздельном содержании, плотные поселения строящих трубки рачков Corophium volutator увеличивали устойчивость грунта в три раза, почти не влияя на пористость осадка, а норки роющей полихеты Nereis diversicolor, наоборот, увеличивали пористость, но мало влияли на устойчивость к сдвигу. При совместном содержании оба эффекта гасили друг друга, и результат статистически не отличался от контроля [83].
В результате подобного наложения эффектов многие наблюдаемые в природе процессы носят нелинейный характер. Так, нелинейны связи между осадконакоплением и плотностью мидий [89], между концентрацией EPS и стабильностью грунта [84].
Дополнительную сложность создает вариабельность биологических процессов во времени. Так, порог эрозии на литорали менялся от 0.1–0.3 Н/м2 в марте, достигал максимума в апреле (0.4–0.6 Н/м2) и снова снижался до 0.1 Н/м2 в июне [95]. Это может быть связано с тем, что эффективность стабилизации грунта видоспецифична у диатомовых и различается у разных видов в несколько раз [96], а на протяжении года в сообществе диатомовых происходит неоднократная смена руководящих видов.
ПРИКЛАДНЫЕ АСПЕКТЫ БИОГЕОМОРФОЛОГИИ
Применительно к морским системам прикладная биогеоморфология – это, прежде всего, берегоукрепление во всех вариантах: закрепление дюн, маршей, создание защитных лесополос мангров, предохраняющих населенные пункты от наиболее разрушительных штормов [1]. Один из наиболее ярких примеров биологических методов защиты берегов – посадки мангров. Мангровые леса, окаймляющие побережья тропических морей, способны заметно ослабить волновую нагрузку на берег [97]. При небольшой высоте волн стометровая полоса леса, по натурным наблюдениям, снижает высоту волны в два-пять раз [98]. Наиболее эффективны леса из мангровых деревьев с развитыми опорными корнями (Rhizophora и Bruguiera). В зависимости от видового состава и структуры леса, достаточную защиту от ветрового волнения может обеспечить полоса мангрового леса шириной от 40 до 600 м [98]. Разрушительное цунами 2004 г. вызвало всплеск интереса к роли мангров в укреплении берегов и большое количество работ, посвященных описанию и моделированию защитной роли мангровых лесов [99]. Эти работы, подтверждая в целом важную роль мангров для защиты от катастрофических волн, не приводят к однозначным выводам. Разнообразие вариантов растительности, морфологии берегов и характеристик тайфунов и цунами не позволяют построить обобщенную модель, а результаты наблюдений за обычным волнением малоприменимо к прогнозу распространения катастрофических волн [100].
Растительность приморских маршей ослабляет волновую нагрузку на берег и препятствует волновой эрозии. Натурными наблюдениями и на моделях было показано, что штормовые волны теряют до 20% энергии на маршах и 60% этих потерь обеспечивается растительностью [101, 102]. При этом устойчивость к эрозии тем выше, чем выше видовое разнообразие растительности маршей [103]. Заросли морских трав тоже могут препятствовать эрозии берега и рифов. В равной мере этому способствует и диссипация энергии волн в зарослях [52], и стабилизация грунта корнями морских трав [104]. Экспериментальные посадки Zostera marina на литорали уже через год привели к заметному заилению грунта и существенному, на 4–7 мм, повышению уровня дна в зарослях [105].
В последнее время популярность приобретают решения, сочетающие технические и биологические приемы защиты берегов [106, 107]. На микроуровне это создание на защитных сооружениях рельефа, привлекательного для организмов-обрастателей, защищающих материал от механической абразии. На макроуровне – создание устричных и мидиевых банок или искусственных рифов, снижающих волновую нагрузку на берег, укрепление верхних отделов литорали и прибрежных дюн с помощью высшей растительности (посадки мангров в тропическом поясе и маршевой растительности – в умеренной зоне). На уровне ландшафтного планирования – сочетание разных элементов биологической и технической стабилизации берега [106, 108, 109].
Еще один аспект прикладной биогеоморфологии – это материаловедение, в частности, оценка устойчивости берегозащитных сооружений к биоабразии [77, 110]. Обрастание подводных конструкций может мешать их функционированию, а может и предохранять от механической абразии.
ЗАКЛЮЧЕНИЕ
Живые организмы участвуют во многих геоморфологических процессах. Они влияют на донные ландшафты в разных масштабах пространства и времени и часто – противоположным образом. Для любого процесса с участием животных или растений можно подобрать примеры с противоположным знаком влияния: живые организмы создают и положительные, и отрицательные формы рельефа, скорости биогенного накопления карбоната кальция и биоабразии известняков примерно совпадают, роющие животные могут и повышать, и снижать порог эрозии, и так далее. Группы совместно обитающих видов, а иногда одни и те же виды воздействуют на донные ландшафты противоположным образом. Такое разнообразие процессов может маскировать вклад биоты в трансформацию дна и сильно затрудняет количественную оценку этого вклада. Состояние обитаемого грунта воспринимается исследователями как “нормальное”, и только специальные эксперименты, например, с дефаунированным осадком, позволяют увидеть, какие свойства донных отложений и в какой степени определяются именно биотой, во всей ее совокупности. Другая трудность совмещения биологического и геоморфологического подходов – различие в масштабах изучаемых явлений. За некоторыми яркими исключениями пространственный масштаб деятельности отдельных организмов редко превышает первые сантиметры. Заметной для геоморфологии становится только совокупная деятельность многих совместно обитающих организмов, но здесь, на уровне сообществ бентоса, начинает проявляться маскирующий эффект разнонаправленности биологических процессов.
Список литературы
Coombes M.A. Biogeomorphology. In: Richardson D., Castree N., Goodchild M., Kobayashi A., Liu W., Marston D. (Eds.) International Encyclopedia of Geography: People, the Earth, Environment and Technology. John Wiley & Sons, Inc. 2017. 8464 p.
Biogeomorphology. Viles H. (Ed.). Oxford: Blackwell. 1988. 352 p.
Möbius K. Die Auster und die Austernwirtschaft. Wiegumdt, Hempel and Parey, Berlin. 1877. 126 s.
Jones C.G., Lawton J.H., and Shachak M. Organisms as ecosystem engineers // Oikos. 1994. Vol. 69. P. 373–86.
Jones C.G., Lawton J.H., and Shachak M. Positive and negative effects of organisms as physical ecosystem engineers // Ecology. 1997. Vol. 78. P. 1946–57.
Jones C.G. Ecosystem engineers and geomorphological signatures in landscapes // Geomorphology. 2012. Vol. 157. P. 75– 87.
Jumars P.A. and Nowell A.R.M. Effects of benthos on sediment transport: difficulties with functional grou-ping // Continental Shelf Research. 1984. Vol. 3. No. 2. P. 115–130.
Jumars P.A., Self R.F.L., and Nowell A.R.M. Mechanics of particle selection by tentaculate deposit feeders // Journal of Experimental Marine Biology and Ecology. 1982. Vol. 64. P. 47–70.
Montague C.L. Influence of Biota on Erodibility of Sediments. Mehta A.J. (Ed.) Estuarine Cohesive Sediment Dynamics. Lecture Notes on Coastal and Estuarine Studies, Vol. 14. Springer, New York, NY. 1986. P. 251–269.
Volkenborn N., Robertson D.M., and Reise K. Sediment destabilizing and stabilizing bio-engineers on tidal flats: cascading effects of experimental exclusion // Helgoland Marine Research. 2009. Vol. 63. No. 1. P. 27–35.
Леонтьев О.К., Рычагов Г.И. Общая геоморфология: Учеб. для студ. геогр. спец. вузов. 2-е изд., перераб. и доп. М.: Высш. шк., 1988. 319 с.
Сафьянов Г.А. Геоморфология морских берегов. М.: Изд-во МГУ, 1996. 400 с.
Заварзин Г.А. Лекции по природоведческой микробиологии. М.: Наука, 2003. 348 с.
Naylor L.A., Viles H.A., and Carter N.E.A. Biogeomorphology revisited: looking towards the future // Geomorphology. 2002. Vol. 47. P. 3–14.
Fei S., Phillips J., and Shouse M. Biogeomorphic Impacts of Invasive Species // Annu. Rev. Ecol. Evol. Syst. 2014. Vol. 45. P. 69–87.
Лисицин А.П. Осадкообразование в океанах. М.: Наука, 1974. 438 с.
Gutiérrez J.L., Jones C.G., Strayer D.L., and Iribarne O.O. Mollusks as ecosystem engineers: the role of shell production in aquatic habitats // Oikos. 2003. Vol. 101. No. 1. P. 79–90.
Gallardi D. Effects of Bivalve Aquaculture on the Environment and Their Possible Mitigation: A Review // Fish. Aquac. J. 2014. Vol. 5. P. 105.
Coral Reefs in the Anthropocene. Birkeland C. (Ed.). Springer, Dordrecht. 2015. 271 p.
Fox W.T. Reefs, Non-Coral. Schwartz M.L. (Ed). Encyclopedia of Coastal Science. Encyclopedia of Earth Science Series. Springer, Dordrecht. 2005. P. 795.
Nelson C.S. An introductory perspective on non-tropical shelf carbonates // Sedimentary geology. 1988. Vol. 60. No. 1–4. P. 3–12.
Pedley M., and Carannante G. Cool-water carbonate ramps: a review // Geological Society, London, Special Publications. 2006. Vol. 255. No. 1. P. 1–9.
Freiwald A., Fosså J.H., Grehan A., Koslow T., and Ro-berts J.M. Cold-water Coral Reefs. UNEP-WCMC, Cambridge, UK. 2004. 85 p.
Freiwald A., Hühnerbach V., Lindberg B., Wilson J.B., and Campbell J. The Sula reef complex, Norwegian shelf // Facies. 2002. Vol. 47. No. 1. P. 179–200.
Büscher J.V., Wisshak M., Form A.U., Titschack J., Nachtigall K., and Riebesell U. In situ growth and bioerosion rates of Lophelia pertusa in a Norwegian fjord and open shelf cold-water coral habitat // Peer J. 2019. Vol. 7. e7586.
Freiwald A. Reef-Forming Cold-Water Corals. Wefer G., Billett D., Hebbeln D., Jørgensen B.B., Schlüter M., and van Weering T.C.E. (Eds.) Ocean Margin Systems. Springer, Berlin, Heidelberg. 2002. p. 365–385.
Roberts J.M., Wheeler A., Freiwald A., and Cairns S. Cold-water corals: the biology and geology of deep-sea coral habitats. Cambridge University Press. 2009. 334 p.
Chemello R. and Silenzi S. Vermetid reefs in the Mediterranean Sea as archives of sea-level and surface temperature changes // Chemistry and Ecology. 2011. Vol. 27. No. 2. P. 121–127.
Gravina M.F., Cardone F., Bonifazi A., Bertrandino M.S., Chimienti G., Longo C., Marzano C.N., Moretti M., Lisco S., Moretti V., and Corriero G. Sabellaria spinulosa (Polychaeta, Annelida) reefs in the Mediterranean Sea: habitat mapping, dynamics and associated fauna for conservation management // Estuarine, Coastal and Shelf Science. 2018. Vol. 200. P. 248–257.
Le Cam J.-B., Fournier J., Etienne S., and Couden J. The strength of biogenic sand reefs: visco-elastic behaviour of cement secreted by the tube building polychaete Sabellaria alveolata, Linnaeus, 1767 // Estuar. Coast. Shelf Sci. 2011. Vol. 91. P. 333–339.
Jones A.G., Dubois S.F., Desroy N., and Fournier J. Interplay between abiotic factors and species assemblages mediated by the ecosystem engineer Sabellaria alveolata (Annelida: Polychaeta) // Estuarine, Coastal and Shelf Science. 2018. Vol. 200. P. 1–18.
Rabaut M., Vincx M., and Degraer S. Do Lanice conchilega (sandmason) aggregations classify as reefs? Quantifying habitat modifying effects // Helgol. Mar. Res. 2009. Vol. 63. P. 37–46.
Ballesteros E. Mediterranean coralligenous assembla-ges: a synthesis of present knowledge // Oceanogr. Mar. Biol. 2006. Vol. 44. P. 123–195.
Maximova O.V. and Fayes S. Deep-Sea Calcareous Rhodophycophyta Communities in the Levantine Sea. In The Eastern Mediterranean as a Laboratory Basin for the Assessment of Contrasting Ecosystems. Sprin-ger, Dordrecht. 1999. P. 437–440.
Pérès J.-M. The mediterranean benthos // Oceanography and Marine Biology: an annual review. 1967. Vol. 5. P. 449–533.
Максимова О.В. Сообщества морских макрофитов // Жизнь на дне. Биогеография и биоэкология бентоса. М.: КМК, 2010. С. 116–169.
Barbera C., Bordehore C., Borg J.A., Glémarec M., Grall J., Hall-Spencer J.M., De La Huz C.H., Lanfranco E., Lastra M., Moore P.G., and Mora J. Conservation and management of northeast Atlantic and Mediterranean maerl beds // Aquatic conservation: marine and freshwater ecosystems. 2003. Vol. 13. No. S1. P. S65–S76.
Hall-Spencer J.M. Conservation issues relating to maerl beds as habitats for molluscs // Journal of Conchology. Special Publication. 1998. No. 2. P. 271–286.
Чербаджи И.И., Пропп Л.Н. Содержание органического углерода, азота и фосфора у глубоководных биоценозов кораллиновых водорослей Южно-Китайского моря // Океанология. 2019. Т. 59. № 4. С. 569–578.
Bosence D. and Wilson J. Maerl growth, carbonate production rates and accumulation rate in the north-eas-tern Atlantic // Aquatic Conservation: Marine and Freshwater Ecosystems. 2003. Vol. 13. P. 21–31.
Chisholm J.R. Calcification by crustose coralline algae on the northern Great Barrier Reef, Australia // Limnology and Oceanography. 2000. Vol. 45. No. 7. P. 1476–1484.
Nelson C.H., Johnson K.R., and Barber Jr.J.H. Gray whale and walrus feeding excavation on the Bering Shelf, Alaska // Journal of Sedimentary Petrology. 1987. Vol. 57. P. 419–430.
Matthew L.R. and Mayorga-Dussarrat J. The impact of feeding by Chilean flamingos (Phoenicopterus chilensis) on the meiofaunal assemblage of a tidal flat // Marine Biology Research. 2016. Vol. 12. No. 10. P. 1039–1052.
Widdows J., Pope N.D., Brinsley M.D., Asmus H., and Asmus R.M. Effects of seagrass beds (Zostera noltii and Z. marina) on near-bed hydrodynamics and sediment resuspension // Marine Ecology Progress Series. 2008. Vol. 358. P. 125–136.
Koch E.W. Sediment resuspension in a shallow Thalassia testudinum banks ex König bed // Aquatic Botany. 1999. Vol. 65. No. 1–4. P. 269–280.
van Katwijk M.M., Bos A.R., Hermus D.C.R., and Suykerbuyk W. Sediment modification by seagrass beds: Muddification and sandification induced by plant co-ver and environmental conditions // Estuarine, Coastal and Shelf Science. 2010. Vol. 89. No. 2. P. 175–181.
Ghisalberti M. and Nepf H.M. Mixing layers and cohe-rent structures in vegetated aquatic flows // Journal of Geophysical Research: Oceans. 2002. Vol. 107. No. C2. P. 1–11.
Ward L.G., Kemp W.M., and Boynton W.R. The influence of waves and seagrass communities on suspended particulates in an estuarine embayment // Marine Geology. 1984. Vol. 59. No. 1–4. P. 85–103.
Koch E.W., Ackerman J.D., Verduin J., and van Keulen M. Fluid dynamics in seagrass ecology from molecules to ecosystems // Seagrasses: biology, ecologyand conservation. Springer, Dordrecht. 2007. P. 193–225.
Potouroglou M., Bull J.C., Krauss K.W., Kennedy H.A., Fusi M., Daffonchio D., Mangora M.M., Githaiga M.N., Diele K., and Huxham M. Measuring the role of seagrasses in regulating sediment surface elevation // Scientific reports. 2017. Vol. 7. No. 1. P. 1–11.
Ellison J.C. Biogeomorphology of mangroves. Coastal Wetlands. Elsevier. 2019. P. 687–715.
Madsen J.D., Chambers P.A., James W.F., Koch E.W., and Westlake D.F. The interaction between water movement, sediment dynamics and submersed macrophytes // Hydrobiologia. 2001. Vol. 444. No. 1–3. P. 71–84.
Gamenick I., Jahn A., Vopel K., and Giere O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonisation studies and tolerance experiments // Marine Ecology Progress Series. 1996. Vol. 144. P. 73–85.
Venier C., da Silva J.F., McLelland S.J., Duck R.W., and Lanzoni S. Experimental investigation of the impact of macroalgal mats on flow dynamics and sediment stabi-lity in shallow tidal areas // Estuarine, Coastal and Shelf Science. 2012. Vol. 112. P. 52–60.
Bardach J.E. Transport of calcareous fragments by reef fishes // Science. 1961. Vol. 133. No. 3446. P. 98–99.
Bellwood D.R. Carbonate Transport and within-Reef Patterns of Bioerosion and Sediment Release by Parrotfishes (Family Scaridae) on the Great Barrier Reef // Marine Ecology Progress Series. 1995. Vol. 117. No. 1/3. P. 127–136.
Frey S.E. and Dashtgard S.E. Seaweed-assisted, benthic gravel transport by tidal currents // Sedimentary Geo-logy. 2012. Vol. 265. P. 121–125.
Waters J.M., King T.M., Fraser C.I., and Craw D. Cros-sing the front: contrasting storm-forced dispersal dynamics revealed by biological, geological and genetic analysis of beach-cast kelp // Journal of the Royal Society Interface. 2018. Vol. 15. No. 140. P. 1–8.
Smith J.M.B. and Bayliss-Smith T.P. Kelp-plucking: coastal erosion facilitated by bull-kelp Durvillaea an-tarctica at subantarctic Macquarie Island // Antarctic Science. 1998. Vol. 10. No. 4. P. 431–438.
Garden C.J. and Smith A.M. The role of kelp in sediment transport: observations from southeast New Zealand // Marine Geology. 2011. Vol. 281. No. 1–4. P. 35–42.
Garden C.J. and Smith A.M. Voyages of seaweeds: The role of macroalgae in sediment transport // Sedimentary Geology. 2015. Vol. 318. P. 1–9.
Романенко Ф.А., Репкина Т.Ю., Ефимова Л.Е., Булочникова А.С. Динамика ледового покрова и особенности ледового переноса осадочного материала на приливных осушках Кандалакшского залива Белого моря // Океанология. 2012. Т. 52. № 5. С. 710–720.
Репкина Т.Ю., Шевченко Н.В., Ефимова Л.Е. Стационарные наблюдения за процессами ледового и биогенного морфолитогенеза на берегах Кандалакшского залива Белого моря. Геоморфологические ресурсы и геоморфологическая безопасность: от теории к практике. М.: МАКС Пресс, 2015. С. 501–504.
Riisgård H.U. On measurement of filtration rates in bivalves the stony road to reliable data: review and interpretation // Marine Ecology Progress Series. 2001. Vol. 211. P. 275–291.
Kautsky N. and Evans S. Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem // Marine Ecology Progress Series. 1987. Vol. 38. P. 201–212.
Haven D.S. and Morales-Alamo R. Aspects of biodeposition by oysters and other invertebrate filter feeders. 1 // Limnology and Oceanography. 1966. Vol. 11. No. 4. P. 487–498.
Murray J.M., Meadows A., and Meadows P.S. Biogeomorphological implications of microscale interactions between sediment geotechnics and marine benthos: a review // Geomorphology. 2002. Vol. 47. No. 1. P. 15–30.
Spencer T. Limestone coastal morphology: the biological contribution // Progress in Physical Geography. 1988. Vol. 12. No. 1. P. 66–101.
Kelletat D.H. Mediterranean coastal biogeomorphology: processes, forms and sea-level indicators // Bulletin Institut Oceanographique Monaco. 1997. Numero Special. P. 209–226.
Coombes M.A. The rock coast of the British Isles: weathering and biogenic processes // Geological Society, London, Memoirs. 2014. Vol. 40. No. 1. P. 57–76.
Naylor L.A., Coombes M.A., and Viles H.A. Reconceptualising the role of organisms in the erosion of rock coasts: a new model // Geomorphology. 2012. Vol. 157–158. P. 17–30.
Glynn P.W. and Manzello D.P. Bioerosion and coral reef growth: a dynamic balance. In Coral reefs in the Anth-ropocene. Springer, Dordrecht. 2015. P. 67–97.
Neumann A.C. Observations on coastal erosion in Bermuda and measurements of the boring rate of the sponge, Cliona lampa // Limnology and Oceanography. 1966. Vol. 11. No. 1. P. 92–108.
Kinsey D.W. Standards of performance in coral reef primary production and carbonate turnover. Barnes D.J. (Ed.) Perspectives on coral reefs. Brian Clouston, Manuka, 1983. P. 209–220.
Bellwood D.R. Direct estimate of bioerosion by two parrotfish species, Chlorurus gibbus and Ch. sordidus, on the Great Barrier Reef, Australia // Marine Biology. 1995. Vol. 121. No. 3. P. 419–429.
Moura D., Gabriel S., Gamito S., Santos R., Zugasti E., Naylor L., Gomes A., Tavares A.M., and Martins A.L. Integrated assessment of bioerosion, biocover and downwearing rates of carbonate rock shore platforms in southern Portugal // Continental Shelf Research. 2012. Vol. 38. P. 79–88.
Coombes M.A., Naylor L.A., Viles H.A., and Thompson R.C. Bioprotection and disturbance: seaweed, microclimatic stability and conditions for mechanical weathering in the intertidal zone // Geomorphology. 2013. Vol. 202. P. 4–14.
Zorn M.E., Gingras M.K., and Pemberton S.G. Variation in burrow-wall micromorphologies of select intertidal invertebrates along the Pacific Northwest coast, USA: behavioral and diagenetic implications // Palaios. 2010. Vol. 25. No. 1. P. 59–72.
Teal L.R., Bulling M.T., Parker E.R., and Solan M. Global patterns of bioturbation intensity and mixed depth of marine soft sediments // Aquatic Biology. 2008. Vol. 2. No. 3. P. 207–218.
Montserrat F., Van Colen C., Degraer S., Ysebaert T., and Herman P.M. Benthic community-mediated sediment dynamics // Marine ecology progress series. 2008. Vol. 372. P. 43–59.
Вехов В.Н. Зостера морская (Zostera marina L.) Белого моря. М.: Изд-во МГУ, 1992. 143 с.
Матвеева Т.А., Никитина Н.С., Черновская Е.Н. Причины и следствия неравномерного распределения червей Fabricia sabella и Arenicola marina на литорали // Докл. АН СССР. 1955. Т. 105. Вып. 2. С. 370–373.
Meadows P.S. and Tait J. Modification of sediment permeability and shear strength by two burrowing invertebrates // Marine Biology. 1989. Vol. 101. P. 75–82.
Decho A.W. and Gutierrez T. Microbial Extracellular Polymeric Substances (EPSs) in Ocean Systems // Front. Microbiol. 2017. Vol. 8. Art. 922. P. 1–28.
Hubas C., Sachidhanandam C., Rybarczyk H., Lubarsky H.V., Rigaux A., Moens T., and Paterson D.M. Bacterivorous nematodes stimulate microbial growth and exopolymer production in marine sediment microcosms // Marine Ecology Progress Series. 2010. Vol. 419. P. 85–94.
Wotton R.S. The utiquity and many roles of exopolymers (EPS) in aquatic systems // Scientia marina. 2004. Vol. 68. No. S1. P. 13–21.
Gerbersdorf S.U., Manz W., and Paterson D.M. The engineering potential of natural benthic bacterial assemblages in terms of the erosion resistance of sediments // FEMS Microbiol. Ecol. 2008. Vol. 66. P. 282–294.
Madsen K.N., Nilsson P., and Sundbäck K. The influence of benthic microalgae on the stability of a subtidal sediment // Journal of experimental marine biology and ecology. 1993. Vol. 170. No. 2. P. 159–177.
Widdows J. and Brinsley M. Impact of biotic and abiotic processes on sediment dynamics and the consequences to the structure and functioning of the intertidal zone // Journal of sea Research. 2002. Vol. 48. No. 2. P. 143–156.
Stal L.J. Microphytobenthos as a biogeomorphological force in intertidal sediment stabilization // Ecological Engineering. 2010. Vol. 36. No. 2. P. 236–245.
Urban-Malinga B. Meiobenthos in marine coastal se-diments // Geological Society, London, Special Publications. 2014. Vol. 388. No. 1. P. 59–78.
Escapa M., Perillo G.M., and Iribarne O. Sediment dynamics modulated by burrowing crab activities in contrasting SW Atlantic intertidal habitats // Estuarine, Coastal and Shelf Science. 2008. Vol. 80. No. 3. P. 365–373.
Canal-Vergés P., Vedel M., Valdemarsen T., Kristensen E., and Flindt M.R. Resuspension created by bedload transport of macroalgae: implications for ecosystem functioning // Hydrobiologia. 2010. Vol. 649. No. 1. P. 69–76.
Defew E.C., Tolhurst T.J., and Paterson D.M. Site-specific features influence sediment stability of intertidal flats // Hydrology and Earth System Sciences Discussions, European Geosciences Union. 2002. Vol. 6. No. 6. P. 971–982.
Kornman B.A. and de Deckere E.M.G.T. Temporal variation in sediment erodibility and suspended sediment dynamics in the Dollard Estuary. In: Black K.S., Paterson D.M., Cramp A. (Eds). Sedimentary Processes in the Intertidal Zone. Geological Society, London, 1998. Special Publications. Vol. 139. P. 231–241.
Holland A.F., Zingmark R.G., and Dean J.M. Quantitative evidence concerning the stabilization of sediments by marine benthic diatoms // Marine Biology. 1974. Vol. 27. No. 3. P. 191–196.
Mazda Y., Magi M., Kogo M., and Hong P.N. Mangroves as a coastal protection from waves in the Tong King delta, Vietnam // Mangroves and Salt marshes. 1997. Vol. 1. No. 2. P. 127–135.
Tran Quang Bao. Effect of mangrove forest structures on wave attenuation in coastal Vietnam // Oceanologia. 2011. Vol. 53. No. 3. P. 807–818.
Dahdouh-Guebas F. and Jayatissa L.P. A bibliometrical review on pre-and post-tsunami assumptions and facts about mangroves and other coastal vegetation as protective buffers // Ruhuna Journal of Science. 2009. Vol. 4. P. 28–50.
Krauss K.W. and Osland M.J. Tropical cyclones and the organization of mangrove forests: a review // Annals of Botany. 2020. Vol. 125. No. 2. P. 213–234.
Möller I., Spencer T., French J.R., Leggett D.J., and Dixon M. Wave transformation over salt marshes: a field and numerical modelling study from North Norfolk, England // Estuarine, Coastal and Shelf Science. 1999. Vol. 49. No. 3. P. 411–426.
Möller I., Kudella M., Rupprecht F., Spencer T., Paul M., Van Wesenbeeck B.K., Wolters G., Jensen K., Bouma T.J., Miranda-Lange M., and Schimmels S. Wave attenuation over coastal salt marshes under storm surge conditions // Nature Geoscience. 2014. Vol. 7. No. 10. P. 727–731.
Ford H., Garbutt A., Ladd C., Malarkey J., and Skov M.W. Soil stabilization linked to plant diversity and environmental context in coastal wetlands // Journal of vegetation science. 2016. Vol. 27. No. 2. P. 259–268.
Christianen M.J.A., van Belzen J., Herman P.M.J., van Katwijk M.M., Lamers L.P.M., van Leent P.J.M., and Bouma T.J. Low-canopy seagrass beds still provide important coastal protection services // PLoS ONE. 2013. Vol. 8. No. 5. e62413. https://doi.org/10.1371/journal.pone.0062413
Bos A.R., Bouma T.J., de Kort G.L., and van Katwijk M.M. Ecosystem engineering by annual intertidal seagrass beds: sediment accretion and modification // Estuarine, Coastal and Shelf Science. 2007. Vol. 74. No. 1–2. P. 344–348.
Borsje B.W., van Wesenbeeck B.K., Dekker F., Paalvast P., Bouma T.J., van Katwijk M.M., and de Vries M.B. How ecological engineering can serve in coastal protection // Ecological Engineering. 2011. Vol. 37. No. 2. P. 113–122.
Spalding M.D., Ruffo S., Lacambra C., Meliane I., Hale L.Z., Shepard C.C., and Beck M.W. The role of ecosystems in coastal protection: Adapting to climate change and coastal hazards // Ocean & Coastal Ma-nagement. 2014. Vol. 90. P. 50–57.
Schoonees T., Gijón Mancheño A., Scheres B., Bouma T.J., Silva R., Schlurmann T., and Schüttrumpf H. Hard Structures for Coastal Protection, Towards Greener Designs // Estuaries and Coasts. 2019. Vol. 42. P. 1709–1729.
Бадюкова Е.Н., Жиндарев Л.А., Лукьянова С.А., Соловьева Г.Д., Щербина В.В. Особенности современной динамики лагунных берегов Куршской косы, юго-восток Балтики //Литодинамика донной контактной зоны океана. М.: ГЕОС, 2009. С. 124–130.
Coombes M.A., Naylor L.A., Thompson R.C., Roast S.D., Gómez-Pujol L., and Fairhurst R.J. Colonization and weathering of engineering materials by marine microorganisms: an SEM study // Earth Surface Processes and Landforms. 2011. Vol. 36. No. 5. P. 582–593.
Дополнительные материалы отсутствуют.
Инструменты
Геоморфология и палеогеография



