Геология рудных месторождений, 2021, T. 63, № 4, стр. 311-335
Исследование поведения урана, ниобия и тантала в системе гранитный расплав – фторидный флюид при 800–950°C, 2300 бар
А. Ф. Редькин a, *, В. И. Величкин b, **, Ю. Б. Шаповалов a, ***
a Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
142432 Черноголовка, Московская область, ул. Академика Осипьяна, 4, Россия
b Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
* E-mail: redkin@iem.ac.ru
** E-mail: vel@igem.ru
*** E-mail: shap@iem.ac.ru
Поступила в редакцию 11.08.2020
После доработки 05.11.2020
Принята к публикации 26.01.2021
Аннотация
Проведены экспериментальные исследования растворимости урана, ниобия и тантала в кислых расплавах Li–F-гранитов и преимущественно фторидных флюидах при 800–950°С, 2300 бар, с целью уточнения генезиса руд уникального Mo–U Стрельцовского рудного поля (Восточное Забайкалье). Эксперименты выполнены с модельным гомогенным стеклом состава (мас. %): 72.18 SiO2, 12.19 Al2O3, 1.02 FeO, 0.2 MgO, 0.33 CaO, 4.78 Na2O, 3.82 K2O, 1.44 Li2O, 2.4 F (LiF, NaF, KF, CaF2, MgF2), синтетической двуокисью урана и природным колумбитом. Исходные растворы содержали 3.85 мас. % хлоридов и 5–30 мас. % фторидов (Na, K, Li, Al, Si). Фугитивность O2 (H2) задавалась буферами Co–CoO и Ar–H2 смесью. Растворимость Nb в F–Cl-растворах зависела от концентрации фторидов, их состава и была в интервале 10–4–10–3 моль · кг–1 H2O при 800°С и 10–3–10–2 моль · кг–1 H2O при 950°С, тогда как Ta практически не растворим в исследуемых растворах. Растворимость U составляет 10–4–10–2 моль · кг–1 H2O. Анализ продуктов опытов на электронном микроскопе позволил установить, что колумбит растворялся в гранитном расплаве инконгруэнтно с образованием U- и F-содержащих пирохлоров. Взаимодействие высоко-фторидных растворов в области флюидной несмесимости с расплавом гранита приводит к обогащению последнего щелочами, ураном и ниобием без заметного привнесения фтора.
ВВЕДЕНИЕ
Настоящие исследования являются продолжением работ по проблеме источника рудного вещества для уникальных Mo–U-месторождений (Антей, Аргунское, Красный Камень и др.) Стрельцовского рудного поля, расположенного в Восточном Забайкалье (Алешин и др., 2007; Крылова и др., 2008; Редькин и др., 2009; Редькин, Величкин, 2020). Многие исследователи предполагают генетическую связь урановых руд с магматизмом, т.е. с расплавами, с исходными высокими температурами, давлениями, а также с рудоносными растворами. По представлениям Ф.И. Вольфсона, В.И. Казанцева, Н.П. Лаверова (Вольфсон, 1974; Казанский и др., 1978), такие соотношения магматических и рудообразующих процессов свидетельствовали о том, что одним из источников гидротермальных ураноносных растворов могли служить глубинные очаги гранитной магмы в наиболее поздних стадиях их эволюции. Высокие содержания фтора в риолитах тургинской свиты (расплавные включения в кварце (Chabiron et al., 2001)), в биотитах вмещающих пород (трахибазальтах), присутствие флюорита, одновременного со стадией рудообразования и в пострудных стадиях, указывают на важную роль фтора в рудообразующем процессе (Алешин и др., 2007). Тесная ассоциация урана с фтором на рассматриваемых месторождениях определила специфику рассматриваемой системы.
Роль фтора в мобилизации урана высокотемпературными гидротермальными растворами рассматривалась ранее в ряде работ (Calas, 1979; Жариков и др., 1987; Юдинцев, 1990; Keppler, Wyllie, 1990, 1991; Peiffert et al., 1996). Было показано, что в сходных физико-химических условиях замена хлора на фтор в растворе приводила к увеличению растворимости уранинита в однофазном гидротермальном растворе примерно на один порядок. Однако увеличение концентрации фтора в растворе сопровождалось ростом содержания фтора в расплаве. Особый случай представляют многофазные водно-солевые флюиды. В области несмесимости флюидов изменение валовой концентрации соли приводит к изменению весовых долей флюидных фаз, тогда как химический потенциал фтора остается практически постоянным. Принимая во внимание, что главными солевыми компонентами флюида, равновесного с модельным расплавом, являются NaF и LiF, очевидно, что водно-солевой флюид будет вести себя как система второго типа с двумя критическими точками p и Q. Область температур до точки p (Tp < 400°C) не представляет практического интереса, ввиду низкой растворимости указанных солей и отсутствия плавления кислого Li–F-гранитного стекла. Точка Q, согласно данным Котельниковой З.А. и Котельникова А.Р. (2002, 2008), находится при температуре не ниже 710оС и давлении выше 2 кбар. В интервале Tp < T < TQ растворимость NaF в воде ограничена. При T > TQ водно-солевой раствор распадается на две флюидные фазы L1 и L2 разной плотности. В кварц-содержащей системе параметры точки Q могут несколько измениться, поскольку фаза тяжелого флюида будет представлена дополнительно существенно силикатно-водно-солевой фазой ${{{\text{L}}}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ (или HSL фазой, согласно (Смирнов, 2015)). В связи с вышесказанным для наших исследований представляет интерес область параметров Т ≥ 750°С и Р ≥ 2000 бар. Геофизические исследования в районе уникальных Mo–U месторождений Стрельцовского рудного поля указывают на то, что на глубинах 7–10 км могут располагаться кислые батолиты, которые могли служить источником тепла, высокотемпературных магм и растворов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты по растворимости U, Ta и Nb в модельном расплаве и фторидно-хлоридном растворе проводили при давлении 2300 (±50) бар, температурах 750–800оС (±5°С) на гидротермальной установке высокого давления (УВД-6М) в реакторах из нержавеющей стали марки ЭП-455, при 950°С – на установке высокого газового давления. Используемые установки позволяли в режиме реального времени контролировать и регулировать общее давление в реакторе с помощью мультипликатора. Парциальное давление кислорода (водорода) в системе задавалось металл-оксидными смесями Co–CoO, взаимодействующими с водой, и Ar–H2 смесью с X(H2) = 0.1. В опытах было использовано стекло, полученное плавлением в Pt ампулах при 1300°С тщательно перетертой смеси (мас. %) NaAlSi3O8 – 35.66, KAlSi3O8 – 28.39, SiO2 – 30.34, MgF2 – 0.077, NaF – 0.38, CaF2 – 0.28, LiF – 2.5, Fe2O3 – 1.02. Химический состав стекла соответствует составу включений риолита в кристаллах кварца (Chabiron et al., 2001) и Li–F-гранитам, широко распространенным в окрестностях Монголо-Охотской геосинклинали, к которой приурочены месторождения урана, ниобия, тантала. Силикатно-фторидная составляющая в составе стекла выбрана в соответствии с данными анализа расплавных включений в кварце риолитовой магмы, которые, согласно (Chabiron et al., 2001, 2003), могли служить прототипом магматогенного источника урана на Стельцовском рудном поле (месторождениях Стрельцовское, Тулукуевское и Красный камень). Стекло, прозрачное и гомогенное по составу (на основании микрозондового анализа), перетирали и использовали в опытах. Ввиду ограниченной растворимости некоторых фторидов (LiF, CaF2, Na3AlF6), были приготовлены при 1300°С гомогенные стекла смесей фторидов, которые затем перетирались и вводились в виде порошка в реакционную смесь. В качестве сольванта использовали раствор состава 0.373mNaCl + 0.107mKCl + 0.117mLiCl + + 0.0187mAlCl3 + 0.00667mCaCl2 + 0.018mHF, который соответствовал равновесному составу раствора, полученному в предыдущих опытах (Редькин и др., 2009; Редькин, Величкин, 2020) при 750°С и 1000 бар. Отдельно были приготовлены фторидные стекла, содержащие (в моль. %):
F1: NaF – 59.96, KF – 17.13, LiF – 18.84, AlF3 – 3.00, CaF2 – 1.07.
F2: NaF – 87.47, AlF3 – 11.03, CaF2 – 1.50.
F3: NaF – 69.48, KF – 4.63, LiF – 2.32, AlF3 – 23.16, CaF2 – 0.42.
F4: NaF – 59.81, KF – 11.93, LiF – 1.98, AlF3 – 19.94, CaF2 – 0.37, SiF4 – 5.97.
F5: NaF – 53.44, KF – 7.11, LiF – 17.27, AlF3 – 18.62, SiF4 – 3.55.
Смеси фторидов “сушили” при 650°С в течение 2 ч в полуоткрытой Pt ампуле, затем ампулу зажимали и содержимое плавили при 1100°С в течение 1 ч. Охлажденные стекла перетирали в агатовой ступке.
Варьирование мольных отношений фторидных солей имело целью найти тот состав, который при взаимодействии с модельным силикатным расплавом не изменял или слабо изменял бы состав последнего. В Pt ампулу (4–5) × 0.1 × 40 мм одновременно помещали 65 мг стекла, 5–6 мг колумбита (природного из месторождения Улуг Танзек, Восточные Саяны), 5–10 мг UO2, заданное количество стекол фторидов (примерно 5, 15, 25 и 30 мас. % от массы раствора) и 130 мг раствора. Часть опытов по растворимости синтетического уран-пирохлора (Na1.28Ca0.39U0.25)(Nb,Ta)O6.20F0.66 проведена без участия лейкогранитового расплава, но с фторидным стеклом F4, F5 и хлоридным сольвантом, имеющим pH 1 и 2. Эти растворы в наибольшей степени соответствовали составу концентрированного фторидного раствора, равновесного с расплавом лейкогранита. В экспериментах, проведенных на газовом сосуде высокого давления, брались две заваренные Pt капсулы (ампулы), которые вместе с кислородным буфером (600–700 мг) и водой (300 мг) помещались в Pt пробирку (10 × 0.2 × 50 мм). В гидротермальный реактор, с внутренним диаметром 6–8 мм, помещалась только одна Pt ампула и небольшой полуоткрытый контейнер с Co–CoO (CCO) кислородным буфером. Охлаждение ампул до комнатной температуры осуществлялось в течение 20–30 мин путем отключения нагревателя газового сосуда и сброса излишнего давления. Реакторы гидротермальной установки охлаждали с 800 до 20°С за 3–5 мин устройством воздушно-капельного охлаждения.
Мы специальных кинетических опытов для установления химического равновесия между гранитным расплавом и F–Cl-флюидом не проводили. В.Ю. Чевычелов и М.Б. Эпельбаум (1985), В.А. Жариков и др. (1987), исследуя распределение рудных и петрогенных компонентов в системе рудные компоненты – гранитный расплав – флюид, показали, что оптимальная продолжительность опытов при 750°C, 1 кбар составляет 7 сут. Х. Кеплер и Р. Вайле (1991) свои опыты выдерживали при 750°C, 2 кбар в течение 13–42 сут. Согласно (Peiffert et al., 1996), 5–7 сут может быть недостаточно для установления полного равновесия в системе оксид урана – лейкогранитный расплав – флюид при 720–770°C, 2 кбар, и авторы, основываясь на этих выводах, проводили опыты длительностью ≥14 сут. Очевидно, что повышение температуры способствует более быстрому установлению равновесия в рассматриваемой системе. Поэтому длительность опытов в наших экспериментах при 800 oC составляла 7–10 сут.
Продукты опытов извлекались из Pt ампул по методике, детально описанной нами ранее (Редькин и др., 2009). С целью уменьшить степень разбавления раствора, для ICP-анализа отбирали 4 мл раствора первого разбавления, подкисляли 0.2 мл крепкой (20%) особо чистой HNO3. ICP-AES- и ICP-MS-анализы, как правило, дают точность 5–10%. Для отдельных элементов (Si, Ca) точность анализа значительно ниже ввиду присутствия этих элементов в комнатной пыли. В процессе подготовки растворов и их последующего разбавления вносимая ошибка не превышала 2–5%.
Учитывая то, что растворы после опытов вымывали и разбавляли 0.01 моляльной соляной кислотой, определение хлора проводили дифференциально-потенциометрическим методом с помощью Cl-селективного электрода. В качестве стандартных растворов для калибровки электрода использованы растворы, содержащие различные количества исходного хлоридного раствора в 5 мл 0.01m раствора HCl, который использовался при вымывании (при первом разбавлении). Калибровка проводилась по графику “вес исходного раствора – mV”, и результаты анализа апроксимировались квадратичной функцией “веса” от потенциала электрода. Данные потенциометрических измерений проб после опытов были пересчитаны на вес раствора.
При анализе раствора на фтор, как и ранее (Редькин и др., 2009), использовались калибровочные графики с известным содержанием алюминия в растворе. Фторидные комплексы алюминия очень устойчивы, и их присутствие в растворах после опытов значительно сказывалось на результатах потенциометрического анализа на F–. Т.к. анализ на фтор проводился после ICP-AES-анализа растворов, то, имея данные по содержанию алюминия в растворе, мы могли вносить соответствующую поправку в результаты измерения F-селективным электродом (т.е. использовать калибровочный график с необходимой концентрацией Al).
Твердые фазы исследовались на электронном сканирующем микроскопе VEGA-TESCAN (ЭСМ) с использованием энергодисперсионного метода анализа. При подготовке шлифов, в том числе при очистке поверхности от абразивного материала и веретенного масла, использовался этиловый спирт, в котором фториды натрия, калия, лития и алюминия имеют очень низкую растворимость и сохранялись на шлифованной поверхности. Т.к. самые интенсивные спектры линий Kα Si и Mα Ta (Блохин, Швейцер, 1982) в электронных спектрах Al–Si стекол имели близкие значения, при анализе расплава лейкогранита была использована L-серия линий Ta. При анализе рудных Ta-содержащих минералов (колумбита, пирохлора) содержание тантала определяли по наиболее интенсивной серии линий Mα Ta.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Кислородные буферы
Во всех опытах, проведенных на гидротермальной установке при 750–800°С, в буферных навесках сохранились оба компонента буфера, однако содержание металлического Co значительно уменьшилось. Несмотря на то, что длительность опытов в газовом сосуде при 950°С составляла 2–3 сут, металлический Co (~0.5 г), находящийся в запаянной Pt толстостенной (0.2 мм) ампуле, полностью превратился в CoO. Известно, что фугитивность кислорода внутри газового сосуда примерно на 2.0–3.5 порядка выше, чем у Ni–NiO буфера (Chevichelov et al., 2008; Симакин и др., 2019). Поэтому мы точно не знаем величину fO2 в опытах при 950°С. Однако присутствие крупных кристаллов (>50 мкм) двуокиси урана в продуктах опытов указывает на то, что окислительно-восстановительные условия опытов соответствовали области стабильности UO2.
Раствор
Условия проведения опытов и результаты анализа растворов после опытов при 750–950°С и давлении 2300–3000 бар представлены в табл. 1. Большинство экспериментов проведено в области несмесимости водно-солевого флюида, поэтому концентрации элементов характеризуют раствор, полученный при смешении охлажденных флюидных фаз. Содержание элементов в каждой из сосуществующих фаз может существенно отличаться от концентрации, полученной в результате анализа закаленного раствора. Величины растворимости рудных компонентов, полученные таким методом, соответствуют кажущейся растворимости.
Таблица 1.
Параметры экспериментов c Co–CoO буфером и результаты анализа растворов на катионы ICP-AES- и ICP-MS-методами, Cl– и F– ион-селективными электродами
| № опыта | Т | Р | Длительность | Смесь фторидов | Исх. конц. фторидов | lgmi, моль · кг–1 H2O в закаленных растворах | ||||||
| °C | бар | сутки | мас. % | Na | K | Li | Al | Ca | Fe | Mn | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 43U | 750 | 2300 | 7 | F1 | 23.0 | –0.32 | –0.63 | –0.97 | –0.91 | –3.59 | –3.83 | –4.29 |
| 34U | 750 | 3000 | 7 | F1 | 5.04 | –0.50 | –0.83 | –0.78 | –1.07 | –2.98 | –3.93 | –3.89 |
| 39U | 750 | 3000 | 16 | F1 | 13.16 | 0.015 | –0.46 | –0.78 | –1.04 | –2.72 | –3.42 | –4.15 |
| 40U | 750 | 3000 | 16 | F1 | 23.63 | –0.57 | –0.88 | –0.90 | –1.13 | –3.02 | –3.94 | –4.09 |
| 37U | 750 | 3000 | 7 | F1 | 28.98 | –0.072 | –0.63 | –0.87 | –0.82 | –3.18 | –3.21 | –4.42 |
| 41U | 750 | 3000 | 16 | F1 | 33.55 | 0.17 | –0.60 | –0.57 | –0.84 | –2.66 | –3.59 | –3.90 |
| 42U | 770 | 2300 | 7 | F1 | 22.7 | –0.41 | –0.91 | –0.86 | –0.82 | –2.99 | –2.93 | –4.06 |
| 38U | 800 | 2300 | 7 | F1 | 4.92 | –0.65 | –0.88 | –0.95 | –1.14 | –3.23 | –3.49 | –4.00 |
| 56U | 800 | 2300 | 11 | F2 | 5.27 | –0.49 | –0.86 | –0.90 | –1.13 | –3.57 | –3.65 | –3.71 |
| 75U | 800 | 2300 | 7 | F3 | 5.12 | –0.44 | –0.70 | –1.33 | –1.00 | –3.62 | –3.89 | –4.51 |
| 67U | 800 | 2300 | 7 | F4 | 5.62 | –0.39 | –0.75 | –1.09 | –1.36 | –3.05 | –4.39 | –3.71 |
| 85U | 800 | 2300 | 7 | F5 | 5.12 | –0.53 | –0.60 | –1.34 | –1.40 | –3.01 | –3.75 | –3.04 |
| 44U | 800 | 2300 | 3 | F1 | 6.20 | –0.42 | –0.77 | –0.82 | –1.15 | –1.98 | –4.05 | –4.94 |
| 35U | 800 | 2300 | 6 | F1 | 13.00 | –0.52 | –0.75 | –0.98 | –1.13 | –2.42 | –3.46 | –3.50 |
| 57U | 800 | 2300 | 11 | F2 | 14.12 | –0.50 | –0.95 | –1.27 | –1.21 | –3.73 | –3.47 | –3.38 |
| 76U | 800 | 2300 | 7 | F3 | 14.34 | –0.47 | –0.62 | –1.46 | –0.75 | –3.52 | –3.14 | –3.35 |
| 86U | 800 | 2300 | 7 | F5 | 14.34 | –0.52 | –0.56 | –1.17 | –1.52 | –3.19 | –4.01 | –3.46 |
| 129U | 800 | 2300 | 7 | F5 | 14.86 | –0.80 | –0.91 | –1.54 | –2.01 | –3.18 | –4.12 | –5.26 |
| 68U | 800 | 2300 | 7 | F4 | 18.01 | –0.46 | –0.77 | –1.10 | –1.16 | –3.29 | –4.43 | –3.51 |
| 127U | 800 | 2300 | 7 | F5 | 19.91 | 0.13 | –0.81 | –1.19 | –3.55 | –3.09 | <–4.6 | –5.72 |
| 36U | 800 | 2300 | 6 | F1 | 23.4 | –0.44 | –0.62 | –1.29 | –1.25 | –2.59 | –3.57 | –3.76 |
| 130U | 800 | 2300 | 7 | F5 | 24.33 | –0.87 | –0.94 | –1.67 | –1.59 | –3.86 | –4.05 | –5.38 |
| 77U | 800 | 2300 | 7 | F3 | 24.90 | –0.55 | –0.72 | –1.53 | –0.91 | –3.48 | –4.21 | –2.99 |
| 58U | 800 | 2300 | 11 | F2 | 25.05 | –0.44 | –1.10 | –1.55 | –1.23 | –3.35 | –4.46 | –3.52 |
| 87U | 800 | 2300 | 7 | F5 | 25.3 | –0.56 | –0.78 | –1.38 | –1.39 | –3.24 | –4.06 | –3.64 |
| № опыта | Т | Р | Длительность | Смесь фторидов | Исх. конц. фторидов | lgmi, моль · кг–1 H2O в закаленных растворах | ||||||
| °C | бар | сутки | мас. % | Na | K | Li | Al | Ca | Fe | Mn | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 69U | 800 | 2300 | 7 | F4 | 27.62 | –0.32 | –0.77 | –1.12 | –1.02 | –3.32 | –4.16 | –3.33 |
| 126U | 800 | 2300 | 7 | F5 | 29.94 | 0.24 | –0.63 | –1.09 | –3.44 | –3.00 | –3.95 | –5.72 |
| 59U | 800 | 2300 | 11 | F2 | 30.71 | –0.43 | –1.22 | –1.63 | –1.21 | –3.95 | Не опр. | –3.96 |
| 78U | 800 | 2300 | 7 | F3 | 30.85 | –0.66 | –0.91 | –1.79 | –0.97 | –3.74 | –4.48 | –3.51 |
| 131U | 800 | 2300 | 7 | F5 | 34.82 | –1.04 | –1.12 | –1.61 | –1.67 | –3.19 | –4.55 | –5.19 |
| 70U | 800 | 2300 | 7 | F4 | 37.63 | –0.24 | –1.45 | –1.59 | –1.05 | –3.21 | –4.01 | –4.11 |
| 91U | 800 | 2300 | 7 | F5 | 4.73 | –0.39 | –0.94 | –0.96 | –2.18 | –3.97 | –4.75 | –6.31 |
| 92U | 800 | 2300 | 7 | F5 | 12.91 | –0.40 | –0.75 | –1.14 | –2.06 | –4.22 | –4.82 | –5.94 |
| 101U | 800 | 2300 | 7 | F5 | 15.03 | –0.90 | – | <–3.8 | –4.86 | |||
| 93U | 800 | 2300 | 7 | F5 | 19.70 | –0.42 | –0.67 | –1.24 | –2.21 | <–4.7 | <–5 | –5.52 |
| 96U | 800 | 2300 | 7 | F5 | 25.58 | –0.462 | –0.66 | –1.02 | –1.81 | –3.89 | Не опр. | –5.04 |
| 102U | 800 | 2300 | 7 | F5 | 30.68 | –1.14 | <–3.8 | –5.02 | ||||
| 94U | 800 | 2300 | 7 | F5 | 4.741 | –0.38 | –0.91 | –1.00 | –1.84 | –4.00 | Не опр. | Не опр. |
| 95U | 800 | 2300 | 7 | F5 | 12.852 | –0.31 | –0.73 | –1.15 | –1.84 | –4.14 | Не опр. | –5.25 |
| 97U | 800 | 2300 | 7 | F5 | 19.74 | –0.37 | –0.62 | –1.17 | –2.07 | –3.86 | Не опр. | Не опр. |
| 98U | 800 | 2300 | 7 | F5 | 25.70 | –0.40 | –0.54 | –0.94 | –1.72 | –3.72 | –3.65 | Не опр. |
| 49U | 950 | 2300 | 3 | F1 | 5.10 | –0.47 | –0.81 | –0.96 | –1.29 | –2.47 | –3.42 | –2.98 |
| 53U* | 950 | 2300 | 3 | F1 | 5.29 | –0.47 | –1.14 | –0.89 | –1.45 | –2.55 | –3.25 | –3.11 |
| 51U | 950 | 2300 | 3 | F1 | 13.61 | –0.56 | –0.72 | –1.12 | –1.19 | –2.50 | –3.84 | –3.46 |
| 54U* | 950 | 2300 | 3 | F1 | 14.17 | –0.66 | –0.98 | –1.26 | –1.30 | –2.53 | –3.72 | –3.85 |
| 50U | 950 | 2300 | 3 | F1 | 23.49 | –0.45 | –0.76 | –1.30 | –1.09 | –2.61 | –3.43 | –3.67 |
| 55U* | 950 | 2300 | 3 | F1 | 24.28 | –0.65 | –1.02 | –1.50 | –1.13 | –2.49 | –3.91 | –3.79 |
| 52U | 950 | 2300 | 3 | F1 | 29.02 | –0.34 | –0.78 | –1.39 | –1.05 | –2.54 | –3.32 | –4.07 |
| 46U | 800 → 620 | 2300 → 1800 | 2 + 9 | – | Не опр. | –1.28 | –2.43 | –2.05 | –1.61 | –1.59 | –3.14 | –4.72 |
| 48U | 800 → 620 | 2300 → 1800 | 2 + 9 | – | Не опр. | –0.55 | –2.19 | –2.12 | –1.67 | –1.31 | –3.29 | –5.01 |
| № опыта | lgmi, моль · кг–1 H2O | |||||||||||
| U | Nb | Ta | Rb | Cs | Mg | Ti | Si | Cl | F | |||
| 1 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | ||
| 43U | –4.47 | –4.34 | –6.49 | –3.91 | –6.14 | <–4 | <–5 | –1.87 | –0.43 | –0.26 | ||
| 34U | –4.87 | –4.23 | <–7 | –3.83 | –6.06 | –3.66 | –4.59 | –1.93 | –0.16 | –0.35 | ||
| 39U | –4.791 | –4.33 | –6.41 | –3.64 | –5.82 | –3.59 | <–5 | –1.53 | –0.21 | –0.22 | ||
| 40U | –5.56 | –4.70 | <–7.5 | –4.06 | –6.30 | –3.94 | <–5 | –2.05 | –0.46 | –0.13 | ||
| 37U | –4.40 | –4.28 | –6.50 | –4.03 | –6.22 | –3.70 | –4.66 | –1.53 | –0.50 | 0.31 | ||
| 41U | –4.21 | –3.64 | –5.66 | –3.99 | –6.34 | –3.55 | <–5 | –1.23 | –0.64 | 0.39 | ||
| 42U | –3.98 | –3.82 | –5.70 | –4.25 | –6.38 | –3.57 | <–5 | –1.84 | –0.86 | –0.20 | ||
| 38U | –5.29 | –4.31 | <–7.5 | –4.01 | –6.05 | –3.94 | <–5 | –1.46 | –0.14 | –0.42 | ||
| 56U | –4.60 | –3.49 | Не опр. | –4.87 | Не опр. | –4.55 | –4.54 | –1.48 | –0.42 | –0.38 | ||
| 75U | –5.10 | –4.93 | –7.31 | –4.89 | –7.09 | –3.89 | –5.37 | –1.54 | –0.19 | –0.82 | ||
| 67U | –4.73 | –4.10 | –8.06 | –5.79 | –6.83 | –4.00 | –4.97 | –1.51 | –0.24 | –0.72 | ||
| 85U | –5.62 | –4.53 | –8.74 | –5.56 | –7.90 | –4.40 | <–5.8 | –1.95 | –0.28 | –1.02 | ||
| 44U | –5.27 | –4.84 | –7.37 | –3.61 | –5.53 | –3.30 | –4.54 | –1.47 | –0.40 | –0.58 | ||
| 35U | –3.52 | –3.61 | –6.89 | –3.95 | –5.91 | –3.65 | <–5 | –1.71 | –0.27 | –0.34 | ||
| 57U | –4.02 | –3.30 | Не опр. | –5.63 | Не опр. | –4.24 | –4.41 | –1.62 | –0.43 | –0.34 | ||
| 76U | –4.38 | –3.90 | –7.17 | –5.01 | –7.41 | –3.93 | –4.62 | –1.71 | –0.17 | –0.61 | ||
| 86U | –5.33 | –5.43 | –8.78 | –5.32 | –7.69 | –4.61 | <–5.8 | –1.64 | –0.17 | –1.13 | ||
| 129U | –3.34 | –3.08 | <–7 | –5.86 | –4.74 | –3.41 | <–5 | –1.37 | – | – | ||
| 68U | –4.26 | –3.45 | –6.80 | –5.20 | –6.93 | –3.97 | –4.34 | –1.60 | –0.25 | –0.46 | ||
| 127U | –3.20 | –2.81 | –5.50 | –5.01 | <–7.2 | <–4.21 | <–5.0 | Не опр. | Не опр. | Не опр. | ||
| 36U | –3.58 | –3.63 | –6.40 | –3.96 | –5.94 | –4.01 | <–5 | –1.68 | –0.53 | –0.30 | ||
| 130U | –3.52 | –2.99 | –6.23 | –5.83 | –4.80 | <–4.3 | <–5 | –1.40 | Не опр. | Не опр. | ||
| 77U | –4.36 | –3.36 | –7.19 | –4.78 | –7.35 | –4.00 | –4.55 | –1.38 | –0.24 | –0.74 | ||
| 58U | –4.10 | –3.47 | –7.35 | –5.63 | Не опр. | –4.46 | –4.31 | –1.78 | –0.56 | –0.43 | ||
| 87U | –5.71 | –5.90 | –8.92 | –5.43 | –7.55 | –4.19 | <–5.9 | –1.71 | –0.24 | –1.07 | ||
| № опыта | lgmi, моль · кг–1 H2O | |||||||||||
| U | Nb | Ta | Rb | Cs | Mg | Ti | Si | Cl | F | |||
| 1 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | ||
| 69U | –4.64 | –3.92 | –6.00 | –5.17 | –6.70 | –4.09 | –4.66 | –1.74 | –0.23 | –0.44 | ||
| 126U | –3.25 | –2.54 | –4.93 | –4.66 | –6.51 | <–4.25 | –4.56 | Не опр. | Не опр. | |||
| 59U | –4.66 | –3.83 | –7.04 | –5.88 | –7.05 | –4.34 | –4.54 | –1.90 | –0.72 | –0.34 | ||
| 78U | –4.30 | –3.89 | –7.68 | –5.07 | –7.85 | –4.16 | –4.8 | –2.00 | –0.20 | –0.78 | ||
| 131U | –3.70 | –3.10 | –5.72 | –5.71 | –5.08 | –3.71 | <–5 | –1.53 | Не опр. | Не опр. | ||
| 70U | –4.20 | –4.16 | –6.16 | –5.94 | –7.32 | –4.08 | –5.23 | –1.91 | –0.43 | –0.55 | ||
| 91U | –3.77 | –2.85 | –6.11 | –5.38 | –8.09 | –4.11 | –4.57 | –0.94 | Не опр. | Не опр. | ||
| 92U | –3.70 | –2.35 | –5.18 | –4.97 | –8.05 | –<–4.8 | –4.15 | –0.88 | Не опр. | Не опр. | ||
| 101U | –2.31 | –2.47 | –4.51 | –4.76 | –7.22 | –4.28 | Не опр. | Не опр. | ||||
| 93U | –3.28 | –2.15 | –5.97 | –4.78 | –7.91 | <–4.8– | –3.95 | –0.99 | Не опр. | Не опр. | ||
| 96U | –2.68 | –2.40 | –5.05 | –4.70 | –7.98 | –4.56 | –3.95 | –0.91 | Не опр. | Не опр. | ||
| 102U | –2.53 | –2.41 | –4.79 | –4.52 | –6.87 | –4.30 | Не опр. | Не опр. | ||||
| 94U | –3.33 | –3.08 | –5.32 | –5.38 | –8.00 | – | –4.69 | –0.96 | Не опр. | Не опр. | ||
| 95U | –3.51 | –2.50 | –5.82 | –5.00 | –7.43 | – | –4.09 | –0.84 | Не опр. | Не опр. | ||
| 97U | –3.61 | –2.20 | –5.68 | –4.75 | <–7.6 | –4.48 | –3.81 | Не опр. | Не опр. | Не опр. | ||
| 98U | –2.58 | –2.03 | –5.48 | –4.48 | <–7.6 | –4.06 | –3.63 | Не опр. | Не опр. | Не опр. | ||
| 49U | –3.97 | –3.15 | <–7.0 | –3.85 | –5.80 | –3.78 | –4.21 | –1.26 | –0.32 | –0.63 | ||
| 53U | –4.45 | –3.41 | –7.46 | –4.01 | –5.93 | –3.92 | –4.61 | –1.44 | –0.48 | –1.77 | ||
| 51U | –4.15 | –3.12 | –6.82 | –3.77 | –5.60 | –4.05 | –4.40 | –1.18 | –0.45 | –0.43 | ||
| 54U | –3.94 | –3.45 | –6.99 | –4.14 | –6.10 | –3.95 | –4.85 | –1.32 | –0.83 | –0.51 | ||
| 50U | –3.58 | –2.96 | –6.21 | –4.07 | –6.08 | –4.09 | –4.35 | –1.26 | –0.77 | –0.19 | ||
| 55U | –3.17 | –3.33 | –6.26 | –4.49 | –6.48 | –4.17 | –4.69 | –1.34 | –1.22 | –0.34 | ||
| 52U | –3.51 | –3.55 | –6.17 | –4.04 | –6.20 | –4.14 | –4.92 | –1.44 | –0.71 | –0.18 | ||
| 46U | –5.07 | –5.65 | <–6.5 | –5.79 | <–6 | –3.24 | <–4.5 | –1.92 | –0.80 | –0.98 | ||
| 48U | –5.17 | –5.59 | <–6.5 | –5.49 | –6.63 | –3.19 | <–4.5 | –1.95 | Не опр. | –1.05 | ||
Примечание. Исходный хлоридный раствор (0.13 мл): 0.373mNaCl + 0.107mKCl + 0.117mLiCl + 0.0187mAlCl3 + 0.00667mCaCl2 + 0.018mHF. Стекло F1: 0.600NaF + 0.171KF + 0.188LiF + 0.030AlF3 + 0.011CaF2. Стекло F2: 0.875NaF + 0.110AlF3 + 0.015CaF2. Стекло F3: 0.756Na3AlF6 + 0.152KF + 0.076LiF + 0.015CaF2. Стекло F4: 0.195Na3AlF6 + 0.766AlF3 + 0.039K2SiF6. Стекло F5: 0.414Na3AlF6 + 0.165KF + 0.401LiF + 0.020AlF3. В эксп. 55U образовался эльпасаит K2NaAlF6. В эксп. 53U-55U давление водорода было 230 бар (смесь 0.9 XAr + 0.1 XH2).
Хлор и фтор. В результате проведенных измерений было установлено, что концентрация хлора в пробах была ниже, чем исходная (фиг. 1). Содержание хлора в гомогенных участках стекла не превышало 0.6 мас. %, так что значительные потери хлора (до 50%) в опытах были связаны с захватом газово-жидких включений силикатным расплавом.
Фиг. 1.
Зависимость отношения (коэффициент несоответствия) исходных (init) концентраций хлора и фтора во фторидных растворах F1–F5 к mCl и F в растворах после опытов (final) при 800°С (◻, ⚪), 950°С (▽, △), от исходной концентрации фтора. В опытах F1 H2 – давление в газовом сосуде задавалось смесью аргона с водородом в мольном отношении 0.9/0.1. Линии – линейные аппроксимации данных для F, Cl и 1-1 равенства minit = mfinal.

Согласно результатам анализа (табл. 1), измеренная концентрация фтора в растворах после опыта в 2–100 раз была ниже, чем в исходном растворе ввиду образования малорастворимых соединений (Na3AlF6 – криолит, CaF2 – флюорит, LiF – грисеит) при закалке и в связи с захватом F-содержащих включений L2-фазы Al–Si-стеклом.
Щелочи. В результате взаимодействия фторидных растворов с алюмосиликатным стеклом произошли существенные изменения в остаточном закаленном растворе, т.е. в той части раствора, который нам удалось вымыть из пробирки примерно 80-кратным объемом 0.01 mHCl. Отношение mNa/mK/mLi в растворах после опытов зависело от исходной концентрации фтора, температуры и давления. На фиг. 2 представлены результаты анализа для гомогенной области флюида при 750°С и 3000 бар и для двухфазной области водно-фторидного флюида 800 и 950°С и 2300 бар. Составы исходного раствора показаны звездочками, а растворы после опытов – треугольниками. Представленные данные (фиг. 2) указывают на то, что в растворе, содержащем 5 мас. % фторидов, наблюдалось незначительное повышение относительного содержания лития и калия, тогда как в растворах, содержащих 25–30 мас. % фторидов, наблюдался рост мольной доли натрия. Рост концентрации фторидов в растворе способствовал росту концентрации калия относительно лития. Суммарная концентрация щелочей в растворах после опыта (табл. 1) значительно ниже, чем исходная, несмотря на то, что примерно 8 мас. % воды из раствора должно было перейти в расплав, и, соответственно, концентрация щелочей должна была увеличиться. Такое несоответствие и значительный разброс данных на диаграмме Na–K–Li (оконтуренная область) связаны, прежде всего, с захватом части плотных включений Al–Si-матрицей (расплавом).
Фиг. 2.
Изменение мольных отношений Na, K и Li в растворах после опытов при 750°С, 3000 бар (a), 800 (б) и 950°С (в), 2300 бар. Условные обозначения: 00 – хлоридный раствор; 01–04 – исходные растворы, содержащие соответственно 5, 15, 25 и 30 мас. % фторидов F1; 1–4 – растворы после опыта, содержащие изначально 5, 15, 25 и 30 мас. % фторидов; G – состав Al–Si-стекла. Контурные линии показывают возможные вариации отношений элементов в растворах после опытов.

Анализ данных, представленных на фиг. 2, указывает на то, что растворы, содержащие ≥25% фторидов при 800°С и 2300 бар, по-видимому, находятся за границей области флюидной несмесимости.
Алюминий и кремний. Концентрация алюминия в растворах после опытов (табл. 1) составляла в среднем 0.083 ± 0.037 моль · кг–1 H2O и имела слабую положительную зависимость от суммарной концентрации F в исходном растворе. Рост концентрации фторидов в растворе способствовал росту концентрации алюминия относительно лития (фиг. 3).
Фиг. 3.
Изменение мольных отношений Na, Al и Li в растворах после опытов при 750°С, 3000 бар (a), 800 (б) и 950°С (в), 2300 бар. Условные обозначения: см. фиг. 2.

Измеренная ICP-AES-методом концентрация кремния в закаленных растворах не превышала 0.05 моль · кг–1 H2O, т.е. была значительно ниже растворимости кварца в воде и растворах солей электролитов (Shibue, 1996; Shmulovich et al., 2006). Данные представленные в табл. 1, указывают на то, что содержание кремния в растворе имело обратную зависимость от концентрации фтора, и большая часть данных при 800 и 950°С, 2300 бар укладывается вдоль линий:
где mSi – кажущаяся мольная концентрация кремния в закаленном растворе, CF – валовая концентрация фторидов, мас. %. Такой характер зависимости mSi от CF дает основание для вывода о предпочтительном накоплении кремнекислоты при 800 и 950°С в менее плотной L1 флюидной фазе, несмотря на высокие концентрации фтора в плотной L2-фазе. При 750°C, 3000 бар имеет место рост mSi от CF, что характерно для гомогенных растворов.Принимая во внимание, что содержание хлора в расплаве гранита оставалось примерно постоянным, можно предположить, что и в закаленном растворе концентрация хлора должна оставаться постоянной с поправкой на воду, которая ушла на насыщение расплава (8 мас. %). Наблюдаемое изменение концентрации хлора в закаленном растворе связано, прежде всего, с захватом части флюидов расплавом. В закаленных стеклах эти включения представлены шарообразными образованиями, заполненными фторидными солями (фиг. 4а, б). Поэтому концентрации всех элементов, представленные в табл. 1, необходимо пересчитать с учетом, что mClinit/mClfinal = 1.
Фиг. 4.
Включения L1 (а) и L2 (б) флюидных фаз в стекле, полученном при 950°С, 2300 бар, 13.61 мас. % фторидов (опыт 51U). Съемка на электронном микроскопе VEGA TESCAN.

Содержание петрогенных элементов во фторидных растворах после опытов с SiO2, расплавом модельного гранита, уран-пирохлором и уранинитом, согласно экспериментальным и расчетным данным, представлены на фиг. 5. Концентрации всех петрогенных элементов имеют тенденцию роста с ростом концентрации фтора, но в разной степени для разных элементов. Согласно данным ICP-AES-анализа, концентрации Li и Al в закаленном растворе имеют близкие значения, но их рост значительно ниже, чем mF. Концентрация кремнекислоты в растворе после опыта была рассчитана по балансу масс элементов с учетом их содержания в Al–Si расплаве и растворе. Согласно проведенным расчетам, mSiO2 во флюиде достигает 2 моль · кг–1 H2O, и такие растворы должны рассматриваться в качестве обособленной водно-силикатной фазы (HSL).
Фиг. 5.
Влияние суммарной концентрации фторидов на валовые концентрации петрогенных элементов в растворах, равновесных с расплавом модельного Li–F-гранита при 800°С и давлении 2300 бар (75U–78U).

В опытах по растворимости уран-пирохлора и уранинита, которые мы провели в растворах, соответствующих по составу тем, которые должны быть равновесными с расплавом модельного Li–F-гранита, были получены шарики силикатной фазы, состоящие из SiO2, H2O, малых количеств (<1 мас. %) Na2O, K2O, Al2O3 и практически не содержащие фтора (Редькин, Величкин, 2013).
Уран, ниобий, тантал. Согласно ICP-MS-анализам, представленным в табл. 1, максимальная концентрация урана в растворах, вымытых из ампул после опытов при 800°С, 2300 бар и Co–CoO буфере, не превышала 3 × 10–4 моль · кг–1 H2O, ниобия – 10–3m, а тантала <2 × 10–6m. В большинстве опытов концентрация U определялась растворимостью уранинита, а Nb и Ta – пирохлором, который в процессе эксперимента замещал исходный колумбит (манганат ниобия). В отдельных опытах, где концентрация фторидов в растворе была выше 20 мас. %, уранинит и колумбит полностью переходили в расплав, и содержание U, Nb и Ta в растворах определялось константами распределения указанных элементов между расплавом и сосуществующими с ним флюидными фазами (L1, L2 и HSL).
На фиг. 6 показаны содержания ниобия, тантала и урана во фторидных растворах F4, равновесных с уранинитом UO2.03, уран-пирохлором (Na1.28Ca0.39U0.25)(NbTa)O6.20F0.66 и расплавом Li–F-гранита при 800°С, 2300 бар и f(O2), заданной Co–CoO буфером. Согласно полученным данным, растворимость рудных минералов незначительная даже в концентрированных фторидных растворах. Отмечается разница в поведении ниобия и тантала: концентрация ниобия во фторидном растворе, равновесном с расплавом Li–F-гранита, в 200–2000 раз превышает концентрацию тантала.
Расплав и твердые фазы
Продукты высокотемпературных экспериментов были исследованы на оптическом микроскопе, на цифровом электронном сканирующем микроскопе и рентгенофазовым методом. Согласно визуальным наблюдениям, в опытах при 750–770°С и 2300–3000 бар было частичное плавление, т.к. твердые продукты опытов были представлены в виде не полностью расплавленных спекшихся агрегатов. В процессе опыта исходная порошкообразная смесь укрупнялась, оставаясь в основной массе в виде хрупких сростков кристаллов фторидов и алюмосиликатного расплава.
При 800 и 950°С имело место полное плавление, т.е. превращение порошковой массы в гомогенный расплав, который при охлаждении превращался в плотное, прозрачное пористое стекло. Фазовый состав стекла зависел от концентрации фтора в системе. Чем больше было введено фторидов, тем больше в стекле было шарообразных включений размером до 30 мкм, заполненных солями фторидов (фиг. 4). При отделении раствора от твердых продуктов опытов на тонкопористом 20 нм фильтре, помимо стекла овальной формы, оставался плохо растворимый порошок. На рентгенограмме этого порошка в опыте 50U обнаруживаются следующие интенсивные линии с межплоскостным расстоянием d/n (I/Io в %) = 3.146 (I = 20.5%), 2.33 (25), 2.32 (40), 2.31 (100), 2.0138 (26.0), 1.6346 (34.5). Согласно PCPDFWIN-2.02, эти линии соответствуют труднорастворимым фторидам LiF, NaF, CaF2 и Na3AlF6. Результаты микрозондового анализа гомогенных (без видимых включений) участков стекла представлены в табл. 2. Согласно этим данным, состав стекла существенно изменился. Агпаитность ((Na + K)/Al в молях) стекла выросла, ввиду значительного привноса K2O, Na2O и выноса Al2O3. Рисунки 7а и б показывают общую тенденцию изменения четырех главных компонентов Al–S-расплава в опытах при 800 и 950°С, 2300 бар.
Таблица 2.
Результаты электронного микроанализа стекол после опытов (в ат. %) по распределению U, Nb, Ta между расплавом и фторидно-хлоридными растворами при 800 и 950оС и 2300 бар (состав стекла п/о нормирован на 90 мас. % из допущения, что в нем 2 мас. % Li2O (0.929 мас. % Li) и 8 мас. % H2O; в скобках указано количество измерений). Агпаитность (NKA) = (Na + K)/Al (в молях)
| Элементы | Расчетный состав стекла | Исходное стекло (7) | 38U(17) 800°C, 2.3 кб, 4.92 мас. % F1 | 56U(27) 800°C, 2.3 кб, 5.27 мас. % F2 | 75U(11) 800°C, 2.3 кб, 5.12 мас. % F3 | 67U(5) 800°C, 2.3 кб, 5.62 мас. % F4 | 85U(17) 800°C, 2.3 кб, 5.12 мас. % F5 | 44U(16) 800°C, 2.3 кб, 6.2 мас. % F1 | 35U(7) 800°C, 2.3 кб, 13.0 мас. % F1 | 57U(14) 800°C, 2.3 кб, 14.12 мас. % F2 |
| Na | 2.76 | 2.62 ± 0.08 | 2.55 ± 0.42 | 4.18 ± 0.61 | 3.98 ± 0.80 | 3.64 ± 0.43 | 5.05 ± 0.26 | 2.48 ± 0.27 | 3.26 ± 0.22 | 4.72 ± 0.90 |
| K | 1.94 | 1.39 ± 0.02 | 1.60 ± 0.08 | 2.99 ± 0.17 | 1.45 ± 0.05 | 1.80 ± 0.09 | 2.51 ± 0.21 | 1.70 ± 0.12 | 2.53 ± 0.13 | 2.85 ± 0.29 |
| Ca | 0.21 | 0.08 ± 0.02 | 0.02 ± 0.02 | 0.15 ± 0.17 | 0.03 ± 0.02 | 0.04 ± 0.04 | 0.14 ± 0.07 | 0.06 ± 0.04 | 0.03 ± 0.03 | 0.05 ± 0.04 |
| Mg | 0.02 | 0.10 ± 0.04 | 0.06 ± 0.04 | 0.08 ± 0.06 | 0.04 ± 0.02 | 0.05 ± 0.05 | 0.00 ± 0.00 | 0.05 ± 0.05 | 0.06 ± 0.04 | 0.09 ± 0.04 |
| Al | 4.53 | 4.67 ± 0.08 | 3.82 ± 0.09 | 5.87 ± 0.17 | 4.24 ± 0.10 | 3.77 ± 0.11 | 9.01 ± 0.09 | 3.99 ± 0.09 | 3.27 ± 0.08 | 5.49 ± 0.61 |
| Si | 23.20 | 18.85 ± 0.11 | 18.61 ± 0.04 | 28.21 ± 0.78 | 17.71 ± 0.38 | 17.51 ± 0.25 | 23.98 ± 0.25 | 18.86 ± 0.14 | 17.30 ± 0.15 | 27.25 ± 0.65 |
| Mn(II) | 0.0 | 0.00 ± 0.01 | 0.08 ± 0.04 | 0.15 ± 0.08 | 0.03 ± 0.03 | 0.08 ± 0.02 | 0.00 ± 0.00 | 0.02 ± 0.03 | 0.17 ± 0.05 | 0.45 ± 0.14 |
| Fe(II) | 0.24 | 0.24 ± 0.02 | 0.02 ± 0.02 | 0.04 ± 0.05 | 0.02 ± 0.04 | 0.02 ± 0.02 | 0.00 ± 0.00 | 0.01 ± 0.01 | 0.08 ± 0.04 | 0.09 ± 0.08 |
| Ti | 0.0 | 0.00 ± 0.01 | 0.02 ± 0.02 | 0.02 ± 0.04 | 0.00 ± 0.01 | 0.01 ± 0.01 | 0.00 ± 0.00 | 0.02 ± 0.02 | 0.01 ± 0.01 | 0.04 ± 0.05 |
| F | 2.17 | 1.65 ± 0.33 | 1.16 ± 0.59 | 1.45 ± 1.17 | 3.14 ± 0.69 | 3.31 ± 0.54 | 9.76 ± 0.32 | 1.07 ± 0.54 | 0.72 ± 0.46 | 0.77 ± 0.31 |
| Cl | 0.0 | 0.01 ± 0.01 | 0.06 ± 0.02 | 0.09 ± 0.07 | 0.07 ± 0.03 | 0.12 ± 0.01 | 0.57 ± 0.14 | 0.04 ± 0.04 | 0.04 ± 0.06 | 0.14 ± 0.17 |
| Nb | 0.0 | 0.02 ± 0.02 | 0.20 ± 0.03 | 1.14 ± 0.70 | 0.07 ± 0.02 | 0.28 ± 0.04 | 0.26 ± 0.26 | 0.03 ± 0.03 | 0.38 ± 0.06 | 1.82 ± 0.21 |
| Ta | 0.0 | 0.02 ± 0.02 | 0.03 ± 0.03 | 0.24 ± 0.23 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.02 ± 0.02 | 0.01 ± 0.02 | 0.08 ± 0.13 |
| U(IV) | 0.0 | 0.00 ± 0.01 | 0.08 ± 0.03 | 0.63 ± 0.36 | 0.02 ± 0.02 | 0.10 ± 0.01 | 0.03 ± 0.13 | 0.02 ± 0.02 | 0.40 ± 0.04 | 2.68 ± 0.38 |
| O | 54.93 | 45.17 ± 0.26 | 45.35 ± 0.70 | 39.62 ± 1.01 | 43.21 ± 0.75 | 42.77 ± 0.64 | 33.54 ± 0.31 | 45.59 ± 0.40 | 44.16 ± 0.40 | 39.21 ± 0.41 |
| NKA | 1.04 | 1.04 ± 0.02 | 1.09 ± 0.13 | 1.22 ± 0.10 | 1.28 ± 0.22 | 1.45 ± 0.13 | 0.84 ± 0.02 | 1.05 ± 0.05 | 1.77 ± 0.06 | 1.40 ± 0.29 |
| Элементы | 76U(3) 800°C, 2.3 кб, 14.34 мас. % F3 | 86U(13) 800°C, 2.3 кб, 14.34 мас. % F5 | 129U(18) 800°C, 2.3 кб, 14.86 мас. % F5 | 68U(5) 800°C, 2.3 кб, 18.01 мас. % F4 | 130U(21) 800°C, 2.3 кб, 24.33 мас. % F5 | 77U(26) 800°C, 2.3 кб, 24.9 мас. % F3 | 58U(15) 800°C, 2.3 кб, 25.05 мас. % F2 | 87U(16) 800°C, 2.3 кб, 25.3 мас. % F5 | 69U(3) 800°C, 2.3 кб, 27.62 мас. % F4 | 59U(12) 800°C, 2.3 кб, 30.71 мас. % F2 |
| Na | 3.40 ± 0.05 | 3.79 ± 0.17 | 3.09 ± 0.30 | 4.25 ± 0.28 | 3.34 ± 0.20 | 2.77 ± 0.42 | 6.39 ± 0.41 | 3.35 ± 0.14 | 4.09 ± 0.56 | 4.85 ± 0.12 |
| K | 3.51 ± 0.18 | 2.67 ± 0.08 | 1.46 ± 0.09 | 2.00 ± 0.09 | 1.84 ± 0.11 | 4.68 ± 0.28 | 3.42 ± 0.45 | 2.90 ± 0.11 | 2.36 ± 0.19 | 1.36 ± 0.06 |
| Ca | 0.06 ± 0.04 | 0.13 ± 0.09 | 0.03 ± 0.04 | 0.05 ± 0.05 | 0.02 ± 0.02 | 0.05 ± 0.06 | 0.13 ± 0.16 | 0.07 ± 0.08 | 0.11 ± 0.06 | 0.07 ± 0.03 |
| Mg | 0.03 ± 0.02 | 0.00 ± 0.00 | 0.02 ± 0.02 | 0.07 ± 0.01 | 0.03 ± 0.03 | 0.03 ± 0.03 | 0.11 ± 0.04 | 0.00 ± 0.00 | 0.08 ± 0.04 | 0.05 ± 0.04 |
| Al | 5.63 ± 0.28 | 7.68 ± 0.20 | 3.23 ± 0.10 | 3.17 ± 0.22 | 3.26 ± 0.10 | 5.40 ± 0.11 | 3.76 ± 0.29 | 6.97 ± 0.11 | 2.48 ± 0.02 | 2.29 ± 0.09 |
| Si | 22.31 ± 0.62 | 27.19 ± 0.42 | 18.54 ± 0.32 | 17.16 ± 0.18 | 17.62 ± 0.21 | 24.59 ± 0.43 | 25.04 ± 0.55 | 29.04 ± 0.20 | 17.01 ± 0.41 | 17.06 ± 0.15 |
| Mn(II) | 0.21 ± 0.29 | 0.00 ± 0.00 | – | 0.22 ± 0.03 | – | 0.30 ± 0.19 | 0.60 ± 0.11 | 0.00 ± 0.00 | 0.25 ± 0.02 | 0.26 ± 0.04 |
| Fe(II) | 0.11 ± 0.13 | 0.00 ± 0.00 | – | 0.00 ± 0.00 | – | 0.08 ± 0.12 | 0.04 ± 0.05 | 0.00 ± 0.00 | 0.03 ± 0.01 | 0.03 ± 0.03 |
| Ti | 0.06 ± 0.05 | 0.00 ± 0.00 | – | 0.01 ± 0.02 | – | 0.05 ± 0.07 | 0.05 ± 0.06 | 0.00 ± 0.00 | 0.02 ± 0.02 | 0.02 ± 0.02 |
| F | 1.78 ± 0.39 | 4.85 ± 0.51 | 3.66 ± 0.73 | 1.57 ± 0.86 | 5.10 ± 0.53 | 1.75 ± 0.44 | 0.97 ± 0.54 | 2.37 ± 0.26 | 2.10 ± 1.08 | 1.23 ± 0.24 |
| Cl | 0.08 ± 0.05 | 0.24 ± 0.05 | 0.06 ± 0.03 | 0.06 ± 0.02 | 0.10 ± 0.04 | 0.07 ± 0.05 | 0.12 ± 0.14 | 0.11 ± 0.10 | 0.09 ± 0.06 | 0.05 ± 0.04 |
| Nb | 0.87 ± 0.22 | 0.48 ± 0.08 | 0.11 ± 0.03 | 0.48 ± 0.05 | 0.16 ± 0.02 | 1.86 ± 0.21 | 3.26 ± 0.25 | 0.00 ± 0.00 | 0.59 ± 0.03 | 0.80 ± 0.06 |
| Ta | 0.11 ± 0.19 | 0.00 ± 0.00 | 0.07 ± 0.03 | 0.02 ± 0.02 | 0.13 ± 0.02 | 0.03 ± 0.08 | 0.23 ± 0.26 | 0.00 ± 0.00 | 0.01 ± 0.02 | 0.02 ± 0.02 |
| U(IV) | 0.61 ± 0.10 | 0.00 ± 0.00 | 0.13 ± 0.03 | 0.25 ± 0.03 | 0.19 ± 0.02 | 1.71 ± 0.33 | 4.74 ± 0.34 | 0.00 ± 0.00 | 0.39 ± 0.02 | 0.48 ± 0.03 |
| O | 38.26 ± 0.58 | 37.83 ± 0.46 | 43.12 ± 0.65 | 43.50 ± 0.73 | 41.32 ± 0.50 | 35.21 ± 0.41 | 36.81 ± 0.54 | 40.05 ± 0.23 | 42.66 ± 1.13 | 43.49 ± 0.13 |
| NKA | 1.23 ± 0.05 | 0.84 ± 0.02 | 1.41 ± 0.08 | 1.98 ± 0.17 | 1.59 ± 0.04 | 1.38 ± 0.10 | 2.62 ± 0.19 | 0.90 ± 0.01 | 2.60 ± 0.18 | 2.71 ± 0.11 |
| Элементы | 78U(18) 800°C, 2.3 кб, 30.85 мас. % F3 | 131U(7) 800°C, 2.3 кб, 34.82 мас. % F5 | 70U(5) 800°C, 2.3 кб, 37.63 мас. % F4 | 48(5) 620°C | 48U(10) 620°C | 48U(8) 800 → → 620°C, 2.3 кб, 6.2 мас. % F | 49U(11) 950°C, 2.3 кб, 5.10 мас. % F1 | 53U(6) H2 950°C, 2.3 кб, 5.29 мас. % F1 | 54U(4) H2 950°C, 2.3 кб, 14.17 мас. % F1 | 55U(5) H2 950°C, 2.3 кб, 24.28 мас. % F1 |
| Na | 2.88 ± 0.42 | 2.44 ± 0.21 | 5.33 ± 0.33 | 3.96 ± 0.20 | 0.83 ± 0.28 | 0.49 ± 0.13 | 3.80 ± 0.19 | 2.50 ± 0.34 | 1.38 ± 0.41 | 1.09 ± 0.31 |
| K | 5.55 ± 0.18 | 2.11 ± 0.07 | 1.10 ± 0.07 | 1.18 ± 0.06 | 4.75 ± 0.39 | 4.93 ± 0.45 | 1.81 ± 0.09 | 1.56 ± 0.10 | 2.06 ± 0.09 | 3.01 ± 0.19 |
| Ca | 0.08 ± 0.06 | 0.03 ± 0.03 | 0.61 ± 0.58 | – | 0.02 ± 0.02 | 0.09 ± 0.16 | 0.04 ± 0.05 | 0.06 ± 0.02 | ||
| Mg | 0.03 ± 0.02 | 0.02 ± 0.02 | 0.09 ± 0.04 | – | 0.08 ± 0.03 | 0.05 ± 0.04 | 0.05 ± 0.02 | 0.17 ± 0.07 | ||
| Al | 5.55 ± 0.13 | 2.83 ± 0.12 | 1.79 ± 0.14 | 4.85 ± 0.19 | 5.17 ± 0.21 | 5.13 ± 0.14 | 3.63 ± 0.11 | 3.97 ± 0.07 | 2.44 ± 0.14 | 3.36 ± 0.08 |
| Si | 25.00 ± 0.19 | 17.94 ± 0.34 | 16.71 ± 0.45 | 24.35 ± 0.0.13 | 20.55 ± 0.35 | 19.90 ± 0.47 | 16.94 ± 0.20 | 17.72 ± 0.20 | 19.27 ± 0.60 | 16.89 ± 0.15 |
| Mn(II) | 0.54 ± 0.24 | – | 0.37 ± 0.05 | – | 0.15 ± 0.05 | 0.10 ± 0.05 | 0.06 ± 0.05 | 0.08 ± 0.04 | ||
| Fe(II) | 0.09 ± 0.17 | – | 0.02 ± 0.03 | – | 0.16 ± 0.06 | 0.01 ± 0.01 | 0.00 ± 0.00 | 0.00 ± 0.01 | ||
| Ti | 0.05 ± 0.05 | – | 0.01 ± 0.02 | – | 0.02 ± 0.03 | 0.02 ± 0.02 | 0.01 ± 0.01 | 0.00 ± 0.04 | ||
| F | 2.66 ± 0.42 | 3.45 ± 1.16 | 1.67 ± 0.99 | 0.06 ± 0.12 | 8.94 ± 0.80 | 10.35 | 1.23 ± 0.04 | 0.98 ± 0.24 | 1.51 ± 0.09 | 1.46 ± 0.39 |
| Cl | 0.08 ± 0.05 | 0.06 ± 0.02 | 0.03 ± 0.02 | – | 0.12 ± 0.13 | 0.16 ± 0.10 | 0.08 ± 0.03 | 0.10 ± 0.02 | ||
| Nb | 3.33 ± 0.22 | 0.23 ± 0.03 | 0.67 ± 0.03 | – | 0.34 ± 0.04 | 0.69 ± 0.06 | 0.62 ± 0.08 | 0.86 ± 0.03 | ||
| Ta | 0.00 ± 0.00 | 0.22 ± 0.02 | 0.02 ± 0.02 | – | 0.02 ± 0.03 | 0.04 ± 0.03 | 0.01 ± 0.01 | 0.08 ± 0.03 | ||
| U(IV) | 2.52 ± 0.29 | 0.39 ± 0.05 | 0.64 ± 0.02 | - | 0.43 ± 0.04 | 0.10 ± 0.02 | 0.19 ± 0.05 | 0.53 ± 0.05 | ||
| O | 36.48 ± 0.26 | 42.60 ± 1.07 | 42.59 ± 0.99 | 60.87 ± 0.33 | 51.37 ± 0.88 | 49.75 ± 1.18 | 43.69 ± 0.58 | 45.16 ± 0.30 | 45.26 ± 0.84 | 43.82 ± 0.33 |
| NKA | 1.51 ± 0.05 | 1.61 ± 0.07 | 3.61 ± 0.25 | 1.06 ± 0.05 | 1.08 ± 0.05 | 1.06 ± 0.07 | 1.55 ± 0.09 | 1.02 ± 0.09 | 1.40 ± 0.09 | 1.22 ± 0.14 |
Фиг. 7.
Изменение атомных соотношений Al, K и Na (a) и Al, K и Si (б) в составе стекла в результате флюидно-магматического взаимодействия гранитного стекла (0) с хлоридно-фторидными флюидами при 800–950°С и давлении 2300 бар. Условные обозначения: 0 – исходное стекло лейкогранита, 1 – после опыта при 800°С в 5% растворе фторидов; 2 – 800°С, 15%; 3 – 950°С, 5%; 4 – 950°С, 15%; 5 – 950°С, 23%, 6 – 950°С, 24%; 7 – 950°С, 29 мас. % фторидов.

Изменение состава системы (фиг. 7) оказывает незначительное влияние на отношение Al2O3/2SiO2 (б), тогда как увеличение концентрации фторидных солей (в том числе и KF) приводит к обогащению стекла K2O при постоянном отношении Al2O3/Na2O и выносу SiO2.
Рост концентрации K2O в расплаве сопровождался также накоплением урана в нем. Несмотря на значительный разброс данных, отношение K/U было близко к 4. В некоторых стеклах соотношение K/U превышает 4.0, что является следствием недосыщенности системы в отношении урана. Несмотря на то что содержание UO2 в исходной смеси твердых фаз составляло 7–13 мас. %, в опытах с неконтролируемой fO2 (50U, 52U), содержащих более 15 мас. % фторидов, при 950°С и 2300 бар происходило полное растворение уранинита.
В опыте 51U, проведенном в растворе, содержащем 13.6 мас. % фторидов, кристаллы уранинита значительно выросли и подверглись замещению богатым ураном (31.1 мас. % UO2), танталом (8.8 мас. % Ta2O5), натрием (7.8 мас. % Na2O) пирохлором (фиг. 8). Содержание фтора в этом пирохлоре было около 1.5 мас. %.
Фиг. 8.
Замещение уранинита пирохлором при 950°С, 2300 бар, в 13.6 мас. % фторидном растворе F1. Содержание UO2 в твердой навеске (стекло + колумбит + уранинит) 12.57 мас. %.

Черного цвета колумбит во фторидных растворах инкогруэнтно растворялся, образуя красного цвета пирохлор в пересыщенных в отношении Nb и Ta расплавах. В составе пирохлоров, как это было показано ранее (Редькин, Бородулин, 2010), можно выделить две разновидности. Первый обогащен фтором и содержит относительно мало урана и тантала. Второй содержит больше натрия, обеднен фтором и весьма богат ураном. Содержание тантала в пирохлорах незначительно, т.к. исходный колумбит был преимущественно ниобиевый. Согласно имеющейся классификации, оба эти минерала относятся к группе пирохлора (Hogarth, 1977; Atencio et al., 2010). Средние составы колумбита и новообразованных пирохлоров представлены в табл. 3. В растворах, содержащих более 13 мас. % фторидов, колумбит при 950°С, 2300 бар полностью растворялся в щелочном агпаитном расплаве.
Таблица 3.
Средние (в скобках указано число определений) формулы колумбита и новообразованных уран- и фтор-пирохлоров (U-Pcl и F-Pcl) в опытах при 770–950°С и Р = 2300 бар
| Элементы | Исходный колумбит | 42U: 770°C, 2300 бар 25.05 мас. % F1 | 56U: 800°C, 2300 бар 5.27 мас. % F2 | 75U: 800°C, 2300 бар 5.12 мас. % F3 | 67U: 800°C, 2300 бар 5.62 мас. % F4 | ||||
| Col (19) | U-Pcl (12) | F-Pcl (14) | U-Pcl (11) | F-Pcl (8) | U-Pcl (34) | F-Pcl (14) | U-Pcl (5) | F-Pcl (5) | |
| Na | 0.02 ± 0.01 | 1.24 ± 0.06 | 1.27 ± 0.06 | 1.01 ± 0.06 | 0.97 ± 0.07 | 0.95 ± 0.05 | 0.92 ± 0.05 | 1.038 ± 0.04 | 0.96 ± 0.06 |
| Ca | 0.00 ± 0.00 | 0.40 ± 0.02 | 0.55 ± 0.10 | 0.64 ± 0.05 | 0.86 ± 0.08 | 0.73 ± 0.05 | 0.92 ± 0.04 | 0.47 ± 0.02 | 0.75 ± 0.07 |
| Fe | 0.44 ± 0.02 | 0.005 ± 0.009 | 0.006 ± 0.007 | 0.00 ± 0.00 | 0.01 ± 0.01 | 0.00 ± 0.00 | 0.005 ± 0.006 | 0.00 ± 0.00 | 0.004 ± 0.005 |
| Mn | 0.55 ± 0.02 | 0.007 ± 0.007 | 0.05 ± 0.04 | 0.00 ± 0.00 | 0.01 ± 0.02 | 0.007 ± 0.007 | 0.01 ± 0.01 | 0.007 ± 0.005 | 0.03 ± 0.02 |
| Ti | 0.03 ± 0.01 | 0.005 ± 0.006 | 0.013 ± 0.007 | 0.02 ± 0.01 | 0.02 ± 0.01 | 0.025 ± 0.006 | 0.027 ± 0.007 | 0.018 ± 0.006 | 0.019 ± 0.003 |
| Nb | 1.92 ± 0.01 | 1.68 ± 0.10 | 1.92 ± 0.01 | 1.81 ± 0.06 | 1.914 ± 0.004 | 1.82 ± 0.06 | 1.90 ± 0.01 | 1.84 ± 0.03 | 1.900 ± 0.004 |
| Ta | 0.086 ± 0.004 | 0.31 ± 0.09 | 0.07 ± 0.01 | 0.19 ± 0.06 | 0.086 ± 0.004 | 0.15 ± 0.06 | 0.08 ± 0.01 | 0.14 ± 0.03 | 0.081 ± 0.003 |
| U | 0.00 ± 0.00 | 0.28 ± 0.03 | 0.04 ± 0.03 | 0.18 ± 0.01 | 0.004 ± 0.003 | 0.12 ± 0.02 | 0.01 ± 0.02 | 0.26 ± 0.01 | 0.002 ± 0.003 |
| F | 0.06 ± 0.06 | 0.52 ± 0.27 | 1.16 ± 0.13 | 0.57 ± 0.09 | 0.92 ± 0.05 | 0.68 ± 0.09 | 0.87 ± 0.11 | 0.47 ± 0.06 | 1.00 ± 0.07 |
| O | 5.97 ± 0.06 | 6.31 ± 0.22 | 5.67 ± 0.17 | 6.26 ± 0.07 | 5.94 ± 0.09 | 6.09 ± 0.05 | 5.96 ± 0.07 | 6.27 ± 0.05 | 5.72 ± 0.07 |
| Элементы | 57U: 800oC, 2300 бар 14.12 мас. % F2 | 76U: 800oC, 2300 бар 14.34 мас. % F3 | 68U: 800oC, 2300 бар 18.01 мас. % F4 | 77U: 800oC, 2300 бар 24.9 мас. % F3 | 58U: 800°C, 2300 бар, 25.05 мас. % F2 | ||||
| U-Pcl (11) | F-Pcl (6) | U-Pcl (19) | F-Pcl (18) | U-Pcl (7) | F-Pcl (5) | U-Pcl (17) | F-Pcl (6) | U-Pcl (22) | |
| Na | 1.13 ± 0.05 | 0.95 ± 0.13 | 1.10 ± 0.06 | 1.08 ± 0.09 | 1.07 ± 0.03 | 1.04 ± 0.05 | 1.22 ± 0.16 | 1.10 ± 0.02 | 1.20 ± 0.08 |
| Ca | 0.43 ± 0.02 | 0.78 ± 0.18 | 0.54 ± 0.04 | 0.71 ± 0.12 | 0.34 ± 0.02 | 0.72 ± 0.02 | 0.34 ± 0.04 | 0.66 ± 0.02 | 0.42 ± 0.05 |
| Fe | 0.003 ± 0.005 | 0.001 ± 0.001 | 0.005 ± 0.005 | 0.004 ± 0.006 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.004 ± 0.004 | 0.005 ± 0.006 | 0.005 ± 0.007 |
| Mn | 0.01 ± 0.01 | 0.01 ± 0.01 | 0.011 ± 0.007 | 0.03 ± 0.04 | 0.01 ± 0.01 | 0.003 ± 0.005 | 0.02 ± 0.01 | 0.01 ± 0.01 | 0.006 ± 0.007 |
| Ti | 0.02 ± 0.01 | 0.02 ± 0.01 | 0.012 ± 0.006 | 0.020 ± 0.008 | 0.018 ± 0.006 | 0.025 ± 0.004 | 0.01 ± 0.01 | 0.02 ± 0.01 | 0.01 ± 0.01 |
| Nb | 1.82 ± 0.01 | 1.82 ± 0.01 | 1.89 ± 0.03 | 1.93 ± 0.01 | 1.83 ± 0.03 | 1.89 ± 0.01 | 1.85 ± 0.02 | 1.918 ± 0.004 | 1.81 ± 0.05 |
| Ta | 0.16 ± 0.01 | 0.08 ± 0.03 | 0.10 ± 0.03 | 0.053 ± 0.005 | 0.15 ± 0.02 | 0.084 ± 0.004 | 0.14 ± 0.02 | 0.064 ± 0.004 | 0.18 ± 0.05 |
| U | 0.29 ± 0.01 | 0.06 ± 0.12 | 0.21 ± 0.02 | 0.008 ± 0.007 | 0.32 ± 0.01 | 0.009 ± 0.004 | 0.28 ± 0.02 | 0.02 ± 0.02 | 0.28 ± 0.03 |
| F | 0.42 ± 0.07 | 0.96 ± 0.24 | 0.61 ± 0.07 | 1.06 ± 0.15 | 0.32 ± 0.09 | 1.07 ± 0.11 | 0.50 ± 0.10 | 1.18 ± 0.02 | 0.46 ± 0.07 |
| O | 6.36 ± 0.05 | 5.99 ± 0.21 | 6.20 ± 0.05 | 5.72 ± 0.13 | 6.35 ± 0.09 | 5.71 ± 0.07 | 6.26 ± 0.08 | 5.66 ± 0.04 | 6.33 ± 0.06 |
| Элементы | 69U: 800°C, 2300 бар 27.62 мас. % F4 | 78U: 800°C, 2300 бар 30.85 мас. % F3 | 70U: 800°C, 2300 бар 37.63 мас. % F4 | 49U: 950°C, 2300 бар 5.1 мас. % F1 | 53U: 950°C, 2300 бар 5.29 мас. % F1, H2 | ||||
| U-Pcl (7) | U-Pcl (17) | F-Pcl (13) | U-Pcl (4) | F-Pcl (4) | U-Pcl (8) | F-Pcl (12) | U-Pcl (35) | F-Pcl (10) | |
| Na | 1.13 ± 0.05 | 1.19 ± 0.05 | 1.13 ± 0.03 | 1.16 ± 0.03 | 1.15 ± 0.01 | 1.082 ± 0.03 | 0.86 ± 0.04 | 0.99 ± 0.06 | 0.81 ± 0.28 |
| Ca | 0.31 ± 0.02 | 0.26 ± 0.04 | 0.55 ± 0.02 | 0.27 ± 0.02 | 0.54 ± 0.05 | 0.33 ± 0.02 | 0.86 ± 0.02 | 0.52 ± 0.07 | 0.78 ± 0.27 |
| Fe | 0.01 ± 0.01 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.00 ± 0.00 | 0.01 ± 0.01 | 0.003 ± 0.003 | 0.003 ± 0.005 | 0.02 ± 0.06 |
| Mn | 0.01 ± 0.01 | 0.025 ± 0.006 | 0.03 ± 0.01 | 0.00 ± 0.00 | 0.03 ± 0.02 | 0.01 ± 0.01 | 0.02 ± 0.01 | 0.01 ± 0.01 | 0.09 ± 0.21 |
| Ti | 0.01 ± 0.01 | 0.00 ± 0.00 | 0.01 ± 0.01 | 0.016 ± 0.008 | 0.007 ± 0.006 | 0.024 ± 0.005 | 0.02 ± 0.01 | 0.02 ± 0.01 | 0.02 ± 0.01 |
| Nb | 1.84 ± 0.04 | 1.83 ± 0.03 | 1.90 ± 0.02 | 1.84 ± 0.02 | 1.931 ± 0.002 | 1.81 ± 0.02 | 1.90 ± 0.01 | 1.84 ± 0.02 | 1.91 ± 0.02 |
| Ta | 0.16 ± 0.04 | 0.16 ± 0.03 | 0.09 ± 0.01 | 0.15 ± 0.02 | 0.061 ± 0.004 | 0.17 ± 0.02 | 0.08 ± 0.01 | 0.14 ± 0.02 | 0.08 ± 0.02 |
| U | 0.31 ± 0.03 | 0.31 ± 0.03 | 0.06 ± 0.01 | 0.338 ± 0.005 | 0.08 ± 0.06 | 0.37 ± 0.02 | 0.005 ± 0.005 | 0.25 ± 0.05 | 0.009 ± 0.003 |
| F | 0.39 ± 0.06 | 0.47 ± 0.05 | 1.02 ± 0.08 | 0.34 ± 0.05 | 0.89 ± 0.12 | 0.26 ± 0.05 | 0.88 ± 0.08 | 0.44 ± 0.11 | 0.77 ± 0.24 |
| O | 6.31 ± 0.07 | 6.20 ± 0.04 | 5.71 ± 0.04 | 6.35 ± 0.03 | 5.82 ± 0.17 | 6.48 ± 0.04 | 5.84 ± 0.05 | 6.28 ± 0.08 | 5.80 ± 0.31 |
К твердым продуктам опытов необходимо также отнести кристаллические образования в сферических включениях в стекле, которые также анализировались на электронном микроскопе. Количество включений увеличивалось с ростом концентрации фторидов. Включения можно разделить на две группы по степени их заполнения кристаллическими образованиями (фиг. 4a, б). Включения с меньшим коэффициентом заполнения (фиг. 4а) были, как правило, бóльшего диаметра и имели гладкие формы. Кристаллические образования внутри этих сфер были сложены на 84 мол. % LiF (рассчитано по избытку F по отношению к сумме всех других фторидов), 8 мол. % NaF, примерно по 1 мол. % AlF3 и SiF4. Содержание урана, ниобия и тантала не превышало первые десятые доли процента, а хлора было еще меньше. В составе некоторых включений на микрозонде определялся только фтор, что указывало на то, что они практически полностью сложены LiF.
Плотные включения не имели гладких очертаний (фиг. 4б) и были плотно заполнены мелкокристаллическими образованиями. Состав твердых фаз варьировал, однако главными компонентами были LiF до 40 моль %, NaF 22–33%, AlF3 5–7%, CaF2 и SiF4 по 1.5%. Содержание урана в этих включениях было в 2–4 раза выше, чем в малоплотных. Измеренная концентрация урана в опыте 51U составила около 0.5 моль %. Содержание Nb и Ta было ниже чувствительности метода.
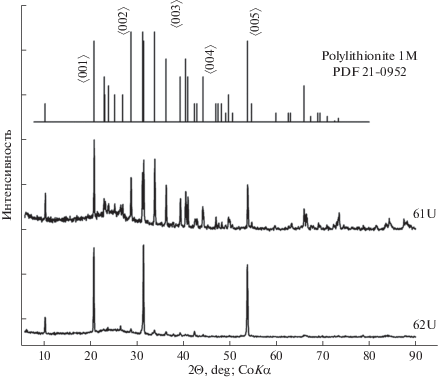
Также была проведена пара опытов по кристаллизации модельного расплава. Материалами для опытов служили овальной формы стекла, насыщенные 5 мас. % раствором фторидов, уранинитом и колумбитом при 800°С, 2300 бар и Co–CoO буфере. Эти водонасыщенные стекла помещали в Pt ампулы. В одну ампулу была введена вода в количестве ¼ часть от навески стекла, в другую – стекло без воды. Реакторы с ампулами выводились в режим (800°С, 2300 бар, Co–CoO) на двое суток, затем медленно ступенчато охлаждались до 620°С, 2000 бар в течение 2 сут, при этих параметрах выдерживались в течение 10 сут, и, наконец, осуществлялась быстрая закалка за 3–5 мин до комнатной температуры. Содержимое ампул вымывалось 0.01 mHCl и анализировалось ICP-методами. В твердых продуктах опытов отмечено образование новой слюдяной фазы, которая кристаллизовалась преимущественно на границе ампулы с расплавом и имела форму гексагональных чешуек размером до 1–2 мм. Согласно рентгенофазовому методу (фиг. 9), новообразованная твердая фаза соответствовала полилитиониту 1М с теми же параметрами элементарной ячейки, что и образец PDF 21-0952 из базы данных PCPDFWIN v. 2.02. Других твердых фаз на рентгенограмме не отмечено. Небольшое гало в районе 22°–27° (2Θ, Co-Kα) связано с рентгеноаморфными веществами. Наиболее интенсивные рефлексы на рентгенограмме соответствуют 〈00N〉 отражениям, что особенно заметно на структурированном образце. Согласно анализу, проведенному на электронном микроскопе, и результатам расчета (Li2O), состав слюд соответствует формулам:
Фиг. 9.
Рентгенограмма продуктов кристаллизации водонасыщенного модельного гранитного расплава при его охлаждении с 800 до 620°С.
и
Как видно из рентгенограмм, 10–15% замещение калия (и лития) натрием в структуре полилитионита не оказало заметного влияния на его параметры элементарной ячейки. Нельзя исключить также возможность неизоморфного вхождения небольшого количества NaF, в виде “реликтового” раствора в межзерновом пространстве слюды.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основываясь на наших предыдущих исследованиях при 750°С и 1000 бар в преимущественно хлоридных растворах (Редькин и др., 2009), мы ожидали, что во фторидных растворах при более высоком давлении (при 2300–3000 бар) модельное гранитное стекло должно плавиться при более низкой температуре. Известно, что рост давления способствует растворимости NaF (виллиомита) и LiF (грисеита), которые имеют ретроградную растворимость в воде при температуре выше 100°C. Было установлено, что твердая смесь порошков алюмосиликатного стекла и наплавленных фторидов лишь незначительно укрупнилась (агрегировалась) без видимого плавления в основной массе. Полное плавление не было установлено также при давлении 2300 бар и температурах 750 и 770°С в 23 мас. % фторидном растворе. В опытах при 800 и 950°С давление флюида было постоянным и составляло 2300 бар, так чтобы иметь возможность захватить область флюидной несмесимости (Редькин и др., 2016). Фторид натрия NaF был главной фторидной солью, выбранной нами в качестве модели. Другие фторидные компоненты (KF, LiF) могли снизить температуру в верхней критической точке TQ (Валяшко, 1990). Двуокись кремния, напротив, согласно представлениям З.А. Котельниковой и А.Р. Котельникова (2010), могла привести к образованию силикатно-фторидной флюидной фазы с более высокими значениями TQ и PQ.
Переход труднорастворимых фторидов во флюидные фазы (растворы-расплавы) не является результатом плавления. В сухих солевых смесях в системе NaF–KF–AlF3, согласно фазовым диаграммам (Phase diagrams …, 1959), исходные фторидные соли и растворимые продукты опытов должны плавиться при 870–900°С (Р = 1 бар), а по расчетным данным (Danielik, Gabèová, 2004) при 800–920°C. В четверных системах KCl–KF–LiCl–LiF, NaCl–NaF–KCl–KF и NaCl–NaF–LiCl–LiF, (Chartrand, Pelton, 2001) плавление исходных составов может иметь место в интервале от 560 до 730°C в K–Li-системе, 860–920°C в Na–K-системе и 660–860°C в Na–Li-хлоридно-фторидной системе, тогда как результирующие водорастворимые хлоридно-фторидные составы должны плавиться при 900°С.
При 800°С и 2300 бар в растворах, содержащих от 5 до 23.4 мас. % фторидов, имело место полное плавление модельного алюмосиликатного стекла. При 950°С, 2300 бар порошок стекла также плавился, полностью превращаясь в плотное блестящее овальной формы стекло, принимающее форму ампулы. Как отмечалось выше, в твердых продуктах опытов оставались малорастворимые соли, представленные NaF (растворимость 0.99 моль · кг–1 H2O при 25°С), LiF (0.33 m), CaF2 (1.92 × 10–5m) и Na3AlF6 (0.002 m) в порядке убывания относительных интенсивностей на рентгенограмме. Криолит, Na3AlF6, присутствовал в очень малых количествах и обнаруживался только при детальном рассмотрении цифровой рентгенограммы, несмотря на то, что составы стекол, полученных при 800 и 950°С (табл. 2), лежат в области устойчивости криолита на диаграмме фазовых равновесий (Девятова и др., 2007). Можно предположить, что фторидные соли выпали в осадок при закалке опытов и не растворились полностью при отмывании твердых фаз 60–80-кратным объемом 0.01 mHCl. Концентрация насыщения хорошо растворимого фторида калия (16.52 m) не была достигнута, и он остался в растворимой форме в анализируемом растворе. Представляется маловероятным, что эти фториды и их расплавы могли остаться в реакционной зоне после насыщения флюидных фаз L1 и L2 солевыми компонентами. Виллиомит и грисеит при 800°С (Williams et al., 2006) имеют меньшую плотность, чем расплав лейкогранита (Dingwell, 1993), тогда как флюорит и криолит, напротив, более плотные. Поэтому можно было ожидать, что при вскрытии ампул после опытов указанные фториды и их сухие расплавы должны остаться как в нижней части ампулы (CaF2 и Na3AlF6), т.е. под алюмосиликатным стеклом, так и верхней части стекла (NaF и LiF). Это явление не было замечено ни в одном из проведенных опытов. Вместе с тем, часть фторидов в виде округлых включений L1 и L2 флюидных фаз могла остаться захваченной в Al–Si-стеклах. К сожалению, точно учесть количество раствора, захваченного расплавом, не представляется возможным, но судя по значениям отношения mClinit/mClfinal, от 20 до 50% хлора из исходного раствора ушло во включения в опытах с F1 и F2 фторидными смесями и 20 ± 12% в опытах с F3–F5 смесями. В изолированных включениях находились преимущественно флюидные фазы L2, на что указывают данные ICP-AES-анализа на калий. Концентрация калия, как и натрия, не только не увеличивалась с ростом концентрации фторидов в растворе, но заметно снижалась в высококонцентрированных фторидных растворах.
Результаты экспериментов показали, что взаимодействие фторидного флюида с модельным гранитным расплавом вызывает десилификацию расплава, изменение агпаитности и отношения Na/K. Составы стекол из опытов при 800 и 950°С в концентрированных фторидных флюидах, согласно (Dolejs, Baker, 2007), соответствуют агпаитовым (щелочным) расплавам. Содержание фтора в Al–Si расплаве зависело от состава раствора. Наибольшие содержания фтора (до 5 моль. %) в стекле отмечены для опытов с фторидным стеклом F5. Наименьшие отклонения содержания фтора в Al–Si стекле были в опытах со стеклом F4. Щелочные расплавы обладают высокой растворяющей способностью в отношении урана, ниобия и тантала. Концентрация U и Nb в насыщенных уранинитом и пирохлором (колумбитом) расплавах закономерно возрастает с увеличением их агпаитности (Na + K)/Al (табл. 2) и главным образом за счет содержания K2O, который образует с ураном (VI) при 950°С, 2300 бар и fO2 $ \gg $ fO2(Co–CoO) легкоплавкий и легкорастворимый в гранитном стекле уранат калия K4UO5. Вероятно, это явление характерно и для Ta, но ввиду того, что его содержание в силикатных расплавах мало, а точность определения по L-линии рентгеноспектральным методом на микроанализаторе VEGA-TESCAN очень низкая, этот вывод в отношении Ta мы опускаем. Для природных процессов такие щелочные составы не характерны, и дефицит U(V, VI), Nb(V) и Ta(V), играющих роль катионов каркасообразователей, восполняется за счет Fe(III). Заметим также, что кларковые содержания урана, ниобия и тантала в гранитах низкие, так что агпаитные расплавы, обладающие высокой растворимостью в отношении этих рудных элементов (0.5–3.0 моль. %), были далеки от насыщения, и выделение рудных минералов при кристаллизации таких расплавов не представляется возможным.
В проведенных экспериментах формированию агпаитовых расплавов способствовал высокотемпературный гидролиз фторидов (NaF, KF, LiF), приводящий к образованию сильных щелочей и слабой кислоты HF. Ранее (Dolejs, Baker, 2007) отмечалось, что использование HF, фторидов щелочных элементов, NaF+AlF3 или фторидных минералов в качестве фторидного компонента в высокотемпературных экспериментах существенным образом сказывается на составах сосуществующих фаз. Мы не учли этот факт, в результате состав расплава в большинстве опытов стал более щелочным по сравнению с модельным лейкогранитовым, изменились его окислительно-восстановительные свойства, что привело к накоплению в расплавах легкорастворимых уранатов (V, VI) и ниобатов. Наименьшие изменения отмечены для опытов с фторидным стеклом F4, содержащим (в молях) 0.705 Na3AlF6 + 0.211 K2SiF6 + 0.07 LiF + + 0.013 CaF2, хотя и с его участием наблюдался вынос SiO2 из алюмосиликатного расплава (фиг. 7). Так как валовый состав каждого опыта известен, а средний состав расплава после опыта был определен методом локального рентгеноспектрального анализа, то, используя метод баланса масс, мы рассчитали валовый состав раствора. На фиг. 10 показаны рассчитанные валовые соотношения компонентов в равновесных растворах, при разных исходных концентрациях фторидов. Состав этих сложных флюидов, по-видимому, соответствует 3-фазовой флюидной системе (L1 + L2+ HSL), описанной в работах (Котельникова, Котельников, 2010, 2018; Смирнов, 2015). Присутствие L1 и L2 фторсодержащих фаз, образующих овальные включения в алюмосиликатном расплаве, четко фиксируется на электронном микроскопе (фиг. 4). Силикатная флюидная фаза (HSL) не наблюдается, но принимая во внимание низкое содержание кремнекислоты (0.01–0.04 mSiO2) в остаточном растворе, можно предположить, что она находилась на границе раздела фаз L1 (mF < 2.0), L2 (mF > 12) и алюмосиликатного расплава и служила в качестве стабилизатора обособленных флюидных фаз. В опытах с флюидами, наиболее близкими по составу к растворам, равновесным с алюмосиликатным расплавом, были получены шарообразные выделения силикатной фазы, состоящие из SiO2, H2O, при подчиненных количествах Na2O, K2O, Al2O3 и фторидов (вероятно, LiF). Фаза HSL не является аддуктом взаимодействия SiO2 (или SiF4) с Na3AlF6, так как доля криолитового компонента в силикатном флюиде ничтожно мала (Dolejs, Baker, 2007). Из этого следует, что в исследованной системе образование алюмо-силикатно-фторидных комплексов является маловероятным. Концентрация SiO2 в фазе HSL превышает 2 моль · кг–1 H2O (фиг. 6), и такие плотные растворы не могут рассматриваться в качестве паровой фазы (V). Ранее в работах (Редькин, Величкин, 2013; Чевычелов, 2013) также было показано, что в области флюидной несмесимости многофазные фторидные флюиды способны накапливать значительные количества кремнекислоты.
Фиг. 10.
Система модельный гранитный расплав – фторидный флюид при 800°C, 2300 бар. Условные обозначения: 0 – исходный состав гранитного стекла, 1 – стекло фторидов F3, 2 – валовые составы опытов, 3 – исходные растворы, 4 – составы Al–Si-стекол после опытов в растворах, содержащих 5.12, 14.34, 24.9 и 30.85 мас. % фторидов соответственно; 5 – рассчитанные валовые соотношения компонентов в равновесных растворах, при разных исходных концентрациях фторидов (75U–78U).

Несмотря на высокие содержания фтора во флюидных фазах L1 и L2, гранитный расплав, имеющий NKA ≈ 1.0, как правило, не обогащался фтором, что также является показателем многофазности флюидной системы.
Флюид, равновесный с модельным расплавом Li–F-гранита при Т = 800°С и Р = 2300 бар и содержащий от 5 до 12 m солей фторидов, является многофазным, содержит значительные количества кремнекислоты и фторидов Na, Al, Li и K (в порядке убывания) (фиг. 5). Концентрации рудных элементов в таких растворах после опытов с уранинитом UO2.03 и уран-пирохлором (Na1.28Ca0.39U0.25)(Nb,Ta)O6.20F0.66), как это следует из фиг. 6, незначительные.
Отмечается существенная разница в поведении Nb и Ta. Концентрация Nb во фторидном растворе, равновесном с расплавом Li–F-гранита, в 200–2000 раз превышает концентрацию Ta. Отчасти это связано с тем, что содержание тантала в исходном колумбите (табл. 3) было в 30 раз ниже, чем ниобия, а в уранпирохлоре, образующемся в ходе опыта, это отношение составляло от 4.5 (800°С) до 3 (950°С). Вместе с тем очевидно, что длительное взаимодействие редкометальных руд с высокотемпературными фторсодержащими гидротермальными растворами приведет к выносу Nb и обогащению руд Ta.
Согласно условиям проведения опытов, исходные растворы содержали 0.667моль · кг–1 H2O хлоридов, и содержание Cl– после опытов не должно было сильно измениться, так как хлор плохо растворим в расплаве гранита. Концентрация Cl– в растворе должна была вырасти до 0.725 m за счет растворения части H2O в гранитном расплаве. В экспериментах при 750°С, 3000 бар, где полного плавления модельного Al–Si-стекла не происходило (34U, 39U), концентрация хлора в пределах ошибки анализа соответствовала исходной. В двухфазной области водно-солевого флюида хлор, как и фтор, должен был перераспределяться между сосуществующими L1 и L2 фазами. Из графика на фиг. 1, построенного на основе данных табл. 1 для температур 800 и 950°С, следует, что если фториды преимущественно накапливались в L2 флюидной фазе, которая плохо выводится из расплава и остается в стекле в виде плотных включений (фиг. 4б), то для хлоридов это не очевидно. Согласно электронно-микроскопическому анализу, состав плотных включений (опыт 51U) соответствует (в моль %): 44 – NaF, 38 – Na3AlF6 и по 9% – CaF2 и SiF4. Сумма по 14 элементам (без кислорода и лития) составляла 70–82 мас. %. Низкая сумма связана с тем, что эти включения не представляют собой плотные расплавные образования, т.к. они изначально содержали воду, которая вместе с хлоридами была вымыта спиртом в процессе пробоподготовки образцов для анализа на электронном микроскопе. Фториды лития, если и были в плотных включениях, то их содержание было ниже, чем NaF, что следует из суммарной концентрации фтора во включении. Включения низкой плотности, напротив, преимущественно содержали LiF. Некоторые включения также содержали мелкие кристаллики фторидов и хлоридов натрия и калия, но их анализ был скорее качественный, поскольку кристаллы находились внутри полых сферических образований (фиг. 4а). Растворы, приготовленные для ICP-AES-анализов, не были насыщены в отношении криолита, т.к., согласно расчетам, растворимость криолита в 0.01 mHCl составляет 0.005 моль · кг–1 H2O. В единичных опытах криолит обнаруживался на тонкопористом фильтре после отмывания овальной формы стекла, но в очень малых количествах. В основном твердые, не растворенные продукты, были представлены NaF и LiF – это указывает на то, что анализируемый раствор был, главным образом, представлен фазой L1, а значительное несоответствие между данными анализа на хлор и фтор связано с низкой растворимостью фторидов LiF, СаF2, Na3AlF6 (Robertson, Hem, 1973) и, возможно, NaF. Часть L2 флюида все же должна была остаться вне расплава, привнося в анализируемый раствор рудные компоненты (U, Nb, Ta). Вопрос о том, какую поправку необходимо внести в результаты ICP-MS-анализов для оценки кажущейся растворимости рудных элементов в многофазном фторсодержащем флюиде, остается открытым. Не известно, какая часть L2-фазы водно-солевого флюида, равновесного с расплавом гранита, была захвачена этим расплавом, что усложняет интерпретацию результатов применительно к природным условиям. Вместе с тем, данные анализов, представленные в табл. 1, для рудных и других компонентов, не образующих труднорастворимые фториды, по крайней мере, необходимо нормировать на исходную концентрацию хлора, равную 0.725 (=0.667/0.92) моль · кг–1 H2O. Результаты такого перерасчета позволяют оценить кажущуюся растворимость урана и ниобия в 5% растворе фторидов, которые составляют (0.3–3.0) × × 10–5 и (3–10) × 10–5 моль ⋅ кг–1 H2O при 800°С и 10–4 и 10–3 моль ⋅ кг–1 H2O при 950°С, 2300 бар и парциальном давлении H2 равном 230 бар соответственно (фиг. 11). В растворах, содержащих 8.0 mF, кажущаяся растворимость уранинита при 950°С значительно выше и достигает примерно 10–2 моль ⋅ кг–1 H2O. Такая концентрация урана во флюиде может рассматриваться в качестве достаточной (Редькин, Величкин, 2020) для образования уникального Mo–U Стрельцовского рудного поля (Восточное Забайкалье). Принимая во внимание, что гранитная магма, как правило, не насыщена в отношении уранинита, концентрация урана во флюидах будет контролироваться константой распределения урана между расплавом и сосуществующими с ним флюидными фазами L1 и L2. В процессе кристаллизации магматического расплава образуются алюмосиликатные минералы, в значительной степени обедненные ураном, ниобием и танталом по сравнению с основной массой. В связи с этим остаточный расплав будет обогащаться рудными элементами, а также фтором и хлором (Рыбалов, Омельяненко, 1989; Юдинцев, Симонова, 1991). Поэтому важно знать растворимость рудных элементов как в магматогенном расплаве, так и в равновесном с ним растворе (флюиде).
Фиг. 11.
Влияние моляльности фтора на содержание урана и ниобия в растворе, насыщенном уранинитом и уран-пирохлором в равновесии с гранитным расплавом при 800 (a) и 950°C (б). Границы области флюидной несмесимости L1 + L2 для системы NaF–H2O при 800°C и 2300 бар показаны на фиг. 11а.
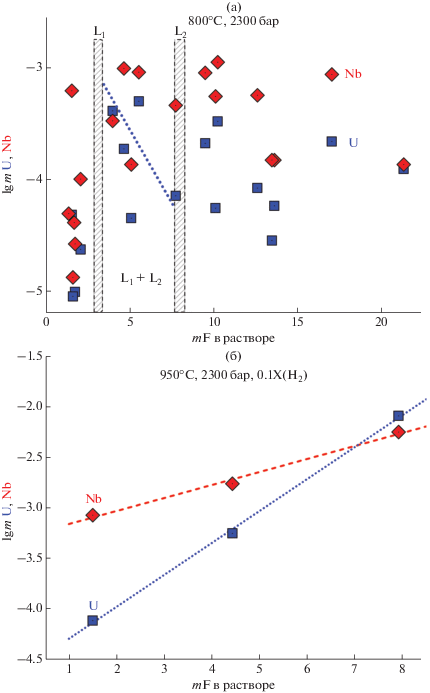
Полученные данные указывают на то, что высокая растворимость уранинита (~0.01 моль ⋅ кг–1 H2O), достаточная для формирования месторождения урана с запасами 276.9 тыс. т из магматического очага кислой Li–F-магмы объемом порядка 30 км3 (Редькин и др., 2020), могла реализоваться только в области флюидной несмесимости фторидных растворов при температуре 950°С и давлении флюида 1.7–2.7 кбар. Глубина формирования такого магматогенного источника рудоносного раствора ограничена величиной 6 ± 1.5 км. Очевидно, что флюиды L1, имеющие меньшую плотность и содержащие высокие концентрации HF и SiO2, будут вызывать окварцевание вмещающих пород, тогда как фторидные флюиды L2, содержащие значительные концентрации фторидов и их гидроокислов, будут способствовать образованию альбита и вызывать гематитизацию (высокие рН и низкие Eh растворов) в них. Таким образом, экспериментально установлено, что кислый водонасыщенный Li–F-магматический расплав мог служить источником урана при формировании уникальных U-месторождений Стрельцовского рудного поля.
Из рассмотрения опущен вопрос о формах переноса урана, ниобия и тантала в исследованных растворах. Для гомогенной области фторидных растворов при высоких TP-параметрах и восстановительной обстановке предложены (Redkin et al., 2018) в качестве преобладающих гидроксофторидные комплексы U(OH)4 – xFx, Nb(OH)5 – xFx, Ta(OH)5 – xFx (x = 1, 2…). Что касается области флюидной несмесимости, вопрос о формах переноса урана, ниобия и тантала остается открытым. Экспериментальными исследованиями можно определить кажущуюся растворимость рудных компонентов в многофазном растворе (т.е. после смешения L1, L2, HSL флюидов). Если известны составы сосуществующих флюидов, то можно оценить концентрации рудных компонентов в них. Вместе с тем, использование аппарата минимизации свободной энергии или констант реакций для области флюидной несмесимости пока невозможно.
ВЫВОДЫ
Выбранная для исследований система в наибольшей степени приближена к природной. Исходный и полученный в опытах состав расплава охватывает широкую область от кислых до щелочных составов гранитов. Взаимодействие фторидно-хлоридного солевого флюида с лейкогранитным расплавом, уранинитом и колумбитом при 800–950°С и Р = 2300 бар приводит к образованию агпаитных расплавов, легко растворяющих уран и ниобий. В этих условиях колумбит неустойчив и замещается пирохлором и уранпирохлором. Содержание фтора в алюмосиликатном расплаве зависит, главным образом, от катионного состава фторсодержащего флюида.
Проведенные исследования показали, что флюид, равновесный с модельным расплавом Li–F-гранита при Т = 800°С и Р = 2300 бар и содержащий от 5 до 12 моль ⋅ кг–1 H2O солей фторидов, является многофазным, содержит значительные количества кремнекислоты (>2 моль ⋅ кг–1 H2O) и фторидов натрия, алюминия, лития и калия (в порядке убывания).
Установлено, что в области несмесимости водно-солевых систем второго типа уран и ниобий способны накапливаться во фторидном рассоле (L2 флюидная фаза) в концентрациях от 10–4 до 1 × 10–3 моль ⋅ кг–1 H2O. Рост температуры с 800 до 950°С при Р = 2300 бар увеличивает растворимость уранинита примерно на один порядок, и такой флюид, равновесный с расплавом гранита, может рассматриваться в качестве модельного магматогенного флюида, контролирующего процессы гидротермального рудообразования.
Проведенные исследования показали, что явление флюидной несмесимости во фторидных системах соль–вода второго типа может изменить растворимость рудных минералов, но это изменение не является весьма существенным (на несколько порядков) из-за буферного воздействия расплава гранита. Ввиду того, что равновесие между расплавом и флюидами при высоких параметрах наступает достаточно быстро (несколько часов–несколько суток), при этом Al–Si-расплав оказывает главное влияние на кислотность флюидов, и содержание HF в них и тем самым определяет содержание рудных компонентов в этих флюидах.
Список литературы
Алешин А.П., Величкин В.И., Крылова Т.Л. Генезис и условия формирования месторождений уникального молибден-уранового Стрельцовского рудного поля: Новые минералого-геохимические и физико-химические данные // Геология руд. месторождений. 2007. Т. 49. № 5. С. 446–470.
Блохин М.А., Швейцер И.Г. Рентгеноспектральный справочник. М.: Наука, 1982. 376 с.
Валяшко В.М. Фазовые равновесия и свойства гидротермальных систем. М.: Наука, 1990. 270 с.
Вольфсон Ф.И. Происхождение руд металлов. М.: Знание, 1974. № 6. 64 с.
Девятова В.Н., Граменицкий Е.Н., Щекина Т.И. Фазовые отношения во фторсодержащих гранитной и нефелин-сиенитовой системах при 800оС и 1 кбар // Петрология. 2007. Т. 15. № 1. С. 21–36.
Жариков В.А., Иванов И.П., Омельяненко Б.И., Редькин А.Ф., Юдинцев С.В. Экспериментальное изучение растворимости уранинита в модельных гранитных расплавах и растворах при высоких параметрах // Геология руд. месторождений. 1987. № 4. С. 3–12.
Казанский В.И., Лаверов Н.П., Тугаринов А.И. Эволюция уранового рудообразования. М.: Атомиздат, 1978. 208 с.
Котельникова З.А., Котельников А.Р. Синтетические NaF-содержащие включения // Геохимия. 2002. № 6. С. 754–763.
Котельникова З.А., Котельников А.Р. NaF-содержащие флюиды: экспериментальное изучение при 500–800°С и Р = 2000 бар методом синтетических флюидных включений в кварце // Геохимия. 2008. № 1. С. 54–68.
Котельникова З.А., Котельников А.Р. Экспериментальное изучение гетерогенных флюидных равновесий в системах силикат–соль–вода // Геология руд. месторождений. 2010. Т. 52. № 2. С. 171–185.
Котельникова З.А., Котельников А.Р. Экспериментальное изучение системы SiO2–H2O–KF–KCl–NaF при 700–800°С и 1–2 кбар методом синтетических флюидных включений в кварце // Геология руд. месторождений. 2018. Т. 60. № 5. С. 504–516.
Крылова Т.Л., Алешин А.П., Ломм Т., Величкин В.И., Кюне М. Свидетельства магматогенного происхождения рудообразующих флюидов на Mo–U месторождениях Стрельцовского рудного поля (Вост. Забайкалье, Россия). Матер. XIII междунар. конф. по термобарогеохимии совместно с IV симпозиумом APIFIS. 2008. Т. 2. С. 64–67. http://www.minsoc.ru/2008-1-84-0
Редькин А.Ф., Бородулин Г.П. Пирохлоры как индикаторы ураноносности магматических расплавов // ДАН. 2010. Т. 432. № 5. С. 664–667.
Редькин А.Ф., Величкин В.И. Фториды урана в гидротермально-магматических системах // ДАН. 2013. Т. 450. № 2. С. 218–221.
Редькин А.Ф., Величкин В.И. Исследование поведения урана, ниобия и тантала в системе гранитный расплав-хлоридный флюид при 750°С и 1000 бар // Геология руд. месторождений. 2020. Т. 62. № 5. С. 414–425.
Редькин А.Ф., Величкин В.И., Алешин А.П., Бородулин Г.П. Исследование взаимодействия модельного фторсодержащего кислого расплава с хлоридным флюидом, уранинитом и колумбитом при 750оС и 1000–2000 бар для оценки рудогенерирующей способности верхнекорового очага под Стрельцовской кальдерой (Восточное Забайкалье) // Геология руд. месторождений. 2009. Т. 51. № 4. С. 325–341.
Редькин А.Ф., Котова Н.П., Шаповалов Ю.Б. Жидкостная несмесимость в системе NaF–H2O и растворимость микролита при 800°C // ДАН. 2016. Т. 469. № 2. С. 210–214.
Рыбалов Б.Л., Омельяненко Б.И. Источники рудного вещества эндогенных урановых месторождений. М.: Наука, 1989. 275 с.
Симакин А.Г., Девятова В.Н., Салова Т.П., Шапошникова О.Ю. Экспериментальное исследование кристаллизации амфибола из высокомагнезиального андезитового расплава вулкана Шивелуч // Петрология. 2019. Т. 27. № 5. С. 476–495.
Смирнов С.З. Флюидный режим кристаллизации водонасыщенных гранитных и пегматитовых магм: физико-химический анализ // Геология и геофизика. 2015. Т. 56. № 9. С. 1643–1663.
Чевычелов В.Ю. Распределение летучих, породообразующих и рудных компонентов в магматических системах: экспериментальные исследования. Автореф. дисс. … докт. геол.-мин. наук. М.: ИЭМ РАН, 2013. 62 с.
Чевычелов В.Ю., Эпельбаум М.Б. Распределение Pb, Zn и петрогенных компонентов в системе гранитный расплав–флюид // В сб. Очерки физико–химической петрологии. Изд. М.: Наука, 1985. Вып. XIII. С. 120-136.
Юдинцев С.В. Исследование поведения урана в щелочных магмах // Геохимия. 1990. № 4. С. 538–544.
Юдинцев С.В., Симонова Л.И. Радиогеохимия оловоносных гранитов литий-фтористого типа // Геохимия. 1991. № 6. С. 806–813.
Atencio D., Andrade M.B., Christy A.G., Gieré R., Kartashov P.M. The pyrochlores supergroup of minerals: nomenclature // Can Mineral. 2010. V. 48. P. 673–698.
Calas G. Etude expérimentale du comportement de l’uranium dans les magmas, états d’oxydation et de coordinance // Geochim. Cosmochim. Acta. 1979. V. 43. P. 1521–1531.
Chabiron A., Alyoshin A.P., Cuney M., Deloule E., Golubev V.N., Velitchkin V.I., Poty B. Geochemistry of the rhyolitic magmas from the Streltsovka caldera (Transbaikalia, Russia): a melt inclusion study // Chem. Geol. 2001. V. 175. P. 273–290.
Chabiron A., Cuney M., Poty B. Possible uranium sources for the largest uranium district associated with volcanism: the Streltsovka caldera (Transbaikalia, Russia) // Miner. Deposita. 2003. V. 38. P. 127–140.
Chartrand P., Pelton A.D. The modified quasi-chemical model: Part III. Two Sublattices // Metall. Mater. Trans. A. 2001. V. 32A. P. 1397–1407.
Chevichelov V.Yu., Bocharnikov R.E., Holtz F. Partitioning of Cl and F between fluid and hydrous phonolitic melt of Mt. Vesuvius at ~850–1000°C and 200 MPa // Chem. Geol. 2008. V. 256. P. 172–184.
Danielik V., Gabèová J. Phase diagram of the system NaF–KF–AlF3 // J. Therm. Anal. Calorim. 2004. V. 76. P. 763–773.
Dingwell, D.B., Knoche, R., Webb, S.L. The effect of F on the density of haplogranite melt // Am. Mineral. 1993. V. 78. P. 325–330.
Dolejš D., Baker D.R. Liquidus equilibria in the system K2O–Na2O–Al2O3–SiO2–F2O–1–H2O to 100 MPa: I. Silicate-fluoride liquid immiscibility in anhydrous systems // J. Petrol. 2007. V. 48. P. 785–806.
Hogarth D.D. Classification and nomenclature of the pyrochlore group // Am. Mineral. 1977. V. 62. P. 403–410.
Keppler H, Wyllie P.J. Role of fluids in transport and fractionation of uranium and thorium in magmatic processes // Nature. 1990. V. 348. P. 531–533.
Keppler H., Wyllie P.J. Partitioning of Cu, Sn, Mo, W, U, and Th between melt and aqueous fluid in the systems haplogranite–H2O–HCl and haplogranite–H2O–HF // Contrib. Mineral. Petrol. 1991. V. 109. P. 139–150.
Peiffert Ch., Nguyen-Trung Ch., Cuney M. Experimental determination of uranium solubility and fluid-melt partition coefficients in the uranium oxide–haplogranite–H2O–NaX (X = Cl, F) system at 770°C, 2 kbar // Geochim. Cosmochim. Acta. 1996. V. 60. P. 1515–1529.
Phase diagrams of nuclear reactor materials. Thoma R.E. (Ed.). Reactor chemistry division. Report ORNL-2548. Oak Ridge National Laboratory, Tennessee, U.S. Atomic Energy Commission. 1959. 205 p.
Redkin A.F, Kotova N.P., Shapovalov Yu.B., Velichkin V.I. Experimental study and thermodynamic modeling of niobium, tantalum, and uranium behavior in supercritical fluoride hydrothermal solutions. In: Solution Chemistry. Advances in Research and Applications. Xiong Y. (Ed.). New York, USA: Nova Sci. Publ., Inc., 2018. P. 1–46.
Roberson C.E., Hem J.D. Solubility of cryolite at 25°C and 1 atmosphere pressure // Jour. Research U.S. Geol. Survey. 1973. V. 1. № 4. P. 483–485.
Shibue Y. Empirical expressions of quartz solubility in H2O, H2O + CO2, and H2O + NaCl fluids // Geochem. J. 1996. V. 30. P. 339–354.
Shmulovich K.I., Yardley B.W.D., Graham C.M. Solubility of quartz in crustal fluids: experiments and general equations for salt solutions and H2O–CO2 mixtures at 400–800°C and 0.1–0.9 GPa // Geofluids. 2006. V. 6. P. 154–167.
Williams D.F., Toth L.M., Clarno K.T. Assessment of candidate molten salt coolants for the advanced high-temperature reactor (AHTR). Report ORNL/TM-2006/12. Nuclear Science and Technology Division Oak Ridge National Laboratory. 2006. 86 p.
Дополнительные материалы отсутствуют.
Инструменты
Геология рудных месторождений



