Вопросы ихтиологии, 2019, T. 59, № 1, стр. 121-124
Взаимосвязь содержания свободных аминокислот в крови и уровня экспрессии аминотрасфераз на примере нильской тиляпии Oreochromis niloticus
Е. В. Гусакова *
Северный (Арктический) федеральный университет – САФУ
Архангельск, Россия
* E-mail: helengusakova@gmail.com
Поступила в редакцию 18.05.2017
После доработки 24.04.2018
Принята к публикации 28.03.2018
Аннотация
У нильской тиляпии Oreochromis niloticus выявлена взаимосвязь концентрации свободных аминокислот в плазме крови и уровня экспрессии гепатических ферментов, вовлечённых в реакции белкового распада. Установлено, что уровень экспрессии гепатических транскриптов аланинаминотрансферазы и аспартатаминотрансферазы коррелирует со скоростью клиренса аминокислот, подвергающихся дезаминированию. При этом активность первого фермента максимальна в начале периода всасывания, в то время как действие второго – пролонгированное и, вероятно, в большей степени способствует поддержанию общего уровня метаболизма, но не является определяющим в общей скорости аминокислотного катаболизма.
Белки являются основным структурообразующим материалом тела рыб, составляя 65–75% сухой массы (Wilson, 2002). Состав белков корма оказывает огромное влияние на показатели роста (Bowen et al., 1995). Попадая в организм рыбы, молекулы белка гидролизуются до аминокислот – промежуточных метаболитов белкового обмена, которые путём активного транспорта через стенку кишечника переносятся в кровь и затем расходуются на катаболические реакции (Halver, Hardy, 2002). Катаболизм белков и аминокислот вносит существенный вклад (41–85%) в общее производство энергии рыбами (Mommsen, Walsh, 1992). Процесс распада аминокислот в основном происходит в печени и в меньшей степени в почках (McDonald et al., 2011). Первым этапом распада аминокислот является удаление аминогруппы, которое проходит по пути дезаминирования или трансаминирования с участием аминотрансфераз. Двумя наиболее изученными аминотрансферазами являются аспартатаминотрасфераза (АСАТ) и аланинаминотрасфераза (АЛАТ). Обе трансаминазы локализованы в клетках печени, их соотношение примерно одинаковое, но содержание зависит от количества поступающих в организм аминокислот: повышение количества аминокислот в крови ведёт к пропорциональному увеличению синтеза АЛАТ и АСАТ; гиперактивность этих ферментов в крови является показателем повреждения и функциональных нарушений печени (Berg et al., 2011). Концентрация АЛАТ и АСАТ, а также их соотношение в крови и тканях активно изучаются, однако взаимосвязь активности этих ферментов с концентрацией аминокислот в крови изучена мало.
Цель работы – изучить катаболизм аминокислот, а также установить взаимосвязь между уровнями экспрессии двух гепатических ферментов (АЛАТ, АСАТ), участвующих в метаболизме аминокислот, с концентрацией свободных аминокислот в плазме крови нильской тиляпии Oreochromis niloticus.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования послужили особи тиляпии 12-го поколения, отобранные для быстрого роста. Эксперимент по выращиванию тиляпии при трёх разных режимах кормления проведён в лаборатории Норвежского университета естественных наук (Norwegian University of Life Sciences, Aas). Рыб выращивали в девяти бассейнах (70 × 50 × 50 см), оснащённых системой рециркуляции воды (180 л/ч), при средней температуре воды 27.5°С, содержании растворённого в воде кислорода 7.5 мг/л и круглосуточном освещении. В каждом бассейне находилось 30 рыб (средняя масса 24.01 ± 0.10 г). Рыб кормили экспериментальным кормом (31% белка, 5% жира и 60% углеводов), приготовленным исключительно из растительных компонентов с добавлением незаменимых аминокислот (метионин, лизин, таурин, треонин и фенилаланин). Измельчённые ингредиенты были переработаны при температуре 54°С на экструдере (P55DV, “Italgy”, Караско, Италия) в гранулы размером 2 × 2 мм, которые после высушивания хранили при температуре –20°С. Рыб разделили на три группы, каждую из которых содержали в трёх бассейнах. Первую группу кормили два раза в день (в 10.00 и 20.00 ч). Корм вносили с избытком, спустя 70 мин его избыток собирали и взвешивали, определяя массу съеденного корма. Вторую группу также кормили два раза в день, а третью – четыре (в 08.00, 12.00, 16.00, 20.00) в течение 35 мин, но норма кормления этих групп составляла 90% объёма, съеденного 1-й группой в предыдущий день.
Пробы крови и печени отобрали на 41-е сут. после начала эксперимента. Кровь отбирали из каудальной вены у трёх рыб (общая проба) из каждого бассейна через 2, 6 и 10 ч после кормления. Гепаринизированную кровь центрифугировали при 1500 g в течение 15 мин при комнатной температуре. До проведения анализа образцы плазмы крови (объёмом ~ 1 мл) хранили при температуре –80°С.
Концентрацию свободных аминокислот в плазме определяли методом обращённо-фазной высокоэффективной жидкостной хроматографии (высокоскоростной анализатор аминокислот Hitachi L-8900 в организации “SGS-CSTC Standards Technical Services Co., Ltd”, Китай). Клиренс аминокислот вычисляли как разность между концентрациями в двух временных точках, т.е. для каждой аминокислоты были получены три значения клиренса: 2–6, 6–10 и 2–10 ч после кормления.
Для анализа экспрессии генов, кодирующих гепатические ферменты, была отобрана и мгновенно заморожена (–80°С) печень от восьми рыб спустя 2 ч после кормления. Общая РНК восьми образцов печени выделена тризолом с использованием набора Zymo Research Direct-zol RNA MiniPrep (R2050, “Zymo Research”, США). Далее РНК анализировали методом наноспектрофотометрии (Nanodrop 1000 Spectrophotometer, “Thermo Scientific”, США).
Синтез комплементарной ДНК осуществлён с использованием набора Transcriptor First Strand cDNA Synthesis Kit (“Roche Applied Science”, Германия) согласно протоколу производителя в двух репликатах: с рандом-гексамерными и олиго(dT)18-анкерными праймерами. Обратный синтез с транскриптазой проходил при температуре 55°С в течение 30 мин для олиго(dT)18-анкерных праймеров и 10 мин при 25°С с последующим нагреванием до 55°С и выдерживанием в течение 30 мин. Транскриптаза была инактивирована удержанием проб при температуре 85°С в течение 5 мин.
Полимеразную цепную реакцию (ПЦР) в реальном времени проводили на амплификаторе Mastercycler ep realplex (“Eppendorf”, Германия) с использованием набора FastStart Essential DNA Green Master (“Roche Applied Science”, Германия). Для расчёта относительной экспрессии ферментов выбраны два гена, кодирующих АЛАТ и АСАТ, и референтный ген β-актина. Праймеры для АЛАТ – F-AGGTCCTGTTTGAGATGGGG и R-TAAGAAGGTTCCCCAGGCTG, для АСАТ – F-TCTCTGTCGGTCCTCCTGTA, R -ACCCCACACGACTTTACCAT, для β-актина – F-CCAGCCTTCCTTCCTTGGTA, R-TCAGGTGGGGCAATGATCTT. ПЦР проходила при следующих условиях: при 95°С в течение 10 с, 40 циклов: при 95°С 10 с, при 60°С 15 с, при 72°С 20 с, заключительная стадия – при 95°С 15 с, при 60°С 15 с, при 95°С 15 с.
Образцы ДНК тестировали трижды. Для ПЦР с АСАТ использована ДНК, полученная с применением произвольно выбранных праймеров, а для реакции с АЛАТ и β-актином – олиго(dT)18-анкерными праймерами. Относительная экспрессия (R) АЛАТ и АСАТ рассчитана с использованием уравнения (Pfaffl, 2001):
где Еtar и Еact – эффективность ПЦР в реальном времени изучаемого (целевого) гена и актина (контрольного гена), рассчитанные по формуле: E = 10[–1/slope]; CP – точка перехода, показывающая число циклов, где флуоресценция пересекает порог детекции; ∆CP – разница СP между контролем и образцом для выбранного гена, актина.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате работы взаимосвязь между режимом питания и экспрессией гепатических ферментов не была выявлена, поэтому данные по трём группам рыб объединили.
Динамика содержания в плазме крови девяти исследованных свободных аминокислот в течение 10 ч после кормления различается (рис. 1). Концентрация одних аминокислот в течение первых 6 ч после кормления увеличивается, а затем снижается; других – в период 2–6 ч не изменяется, после чего снижается; остальных – на протяжении всего периода наблюдений последовательно уменьшается. Максимальный уровень суммарного содержания аминокислот в плазме крови тиляпии наблюдается спустя 6 ч после кормления, что ранее было отмечено у форели Oncorhynchus mykiss (Karlsson et al., 2006). Аминокислоты всасываются в кишечнике посредством активного транспорта (Halver, Hardy, 2002). Можно предположить, что через 10 ч после кормления система транспорта приходит в своё первоначальное состояние, а концентрация аминокислот в плазме крови становится минимальной.
Рис. 1.
Динамика концентрации свободных аминокислот в плазме крови нильской тиляпии Oreochromis niloticus в течение 10 ч после кормления: 1 – лейцин, 2 – фенилаланин, 3 – тирозин, 4 – валин, 5 – метионин, 6 – треонин, 7 – изолейцин, 8 – цистеин, 9 – триптофан.
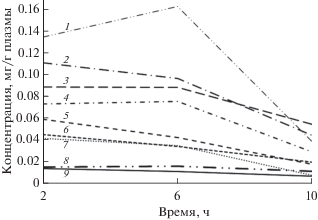
Валин является незаменимой аминокислотой, которая сначала накапливается, а спустя 6 ч активно расходуется в катаболических процессах печени (рис. 1). Концентрация цистеина поддерживается на постоянном уровне; эта заменимая аминокислота может синтезироваться из метионина. В нашем эксперименте в корм был добавлен синтетический метионин в количестве (4.6 г/кг), превышающем минимально необходимый уровень этой аминокислоты для тиляпии. Между тем концентрация метионина после кормления постоянно снижается, что может указывать на возможные дополнительные пути его утилизации, например, на синтез цистеина. Концентрация изолейцина сначала снижается медленно, а после 6 ч – более заметно; по-видимому, эта аминокислота сразу вступает в катаболические реакции. Катаболизм лейцина минимален в течение первых 6 ч после кормления, после чего его концентрация в крови начинает резко снижаться. Концентрация тирозина в плазме крови после 6-часового интервала снижается плавно, а фенилаланина – более стремительно. Вероятно, фенилаланин частично расходуется на синтез тирозина (Li et al., 2009). Содержание треонина и триптофана плавно снижается в течение всего анализируемого периода, т.е. эти незаменимые аминокислоты сразу вступают в катаболические реакции, тогда как ранее было показано (Karlsson et al., 2006), что концентрация треонина и триптофана в течение первых 6 ч повышается и лишь затем снижается. Более медленная убыль триптофана объясняется возможной задержкой его адсорбции, которая наблюдается при комбинированном действии лейцина и триптофана (Umezawa et al., 2007).
Полученные данные подтверждают участие АЛАТ и АСАТ в превращениях аминокислот: выявлена корреляция уровня экспрессии их транскриптов с клиренсом незаменимых (рис. 2а, 2б) и заменимых аминокислот (рис. 2в, 2г), а также их общего содержания (рис. 2д, 2е). Очевидно, перенос аминогруппы является доминирующим в распаде аминокислот (Berg et al., 2011). В процессы катаболизма аминокислот вовлечены АЛАТ и АСАТ, наряду с глутаматдегидрогеназой (ГДГ). При этом АСАТ и ГДГ являются преобладающими в реакциях переноса аминогруппы на начальной стадии катаболизма аминокислот, а АЛАТ – в меньшей степени, так как его активность зависит от интермедиатов, полученных в процессе гликолиза (Bibiano Melo et al., 2006). Выявленная зависимость экспресии АСАТ от клиренса аминокислот в период 2–6 ч свидетельствует о более раннем его участии в реакциях транспорта аминогрупп по сравнению с АЛАТ. В течение 6 ч после кормления идёт наиболее активный распад аминокислот, и этот период соответствует наиболее высокому уровню экспрессии АСАТ, который вне этого временного интервала снижается. Взаимосвязь синтеза АЛАТ и клиренса аминокислот постоянна в течение всего периода наблюдений (в интервале 2–10 ч), что может свидетельствовать о меньшем его вкладе в общее трансаминирование, возможно, в силу недостатка интермедиатов гликолиза.
Рис. 2.
Взаимосвязь уровня экспрессии гепатических трансаминаз аланинаминотрасферазы (АЛАТ) и аспартатаминотрасферазы (АСАТ) и клиренса концентраций аминокислот в плазме крови у нильской тиляпии Oreochromis niloticus за период 2–10 ч (а, в, д) и 2–6 ч после кормления (б, г, е): а, б – незаменимые аминокислоты (НАК), в, г – заменимые аминокислоты (ЗАК), д, е – общее содержание аминокислот (ОСАК).

Таким образом, в результате анализа динамики концентрации свободных аминокислот в плазме крови тиляпии установлено, что большинство аминокислот корма, которые всасываются в кровь из кишечника, накапливаются в течение первых 6 ч после кормления, а затем расходуются на катаболические реакции. Некоторые из аминокислот имеют дополнительные пути катаболизма, а фенилаланин и метионин могут превращаться в другие аминокислоты (соответственно в тирозин и цистеин), модулируя их концентрацию в крови. Выявленная динамика содержания триптофана и треонина в крови отличается от описанной ранее; этот вопрос остаётся открытым для дискуссий и последующих экспериментов. Экспрессия гепатических транскриптов АЛАТ и АСАТ коррелирует с клиренсами аминокислот, что указывает на активный катаболизм аминокислот с доминирующей реакцией их дезаминирования. Уровень экспрессии АСАТ изменяется сразу после кормления, обеспечивая реакции дезаминирования, в то время как АЛАТ имеет отсроченную динамику, и его вклад в общий катаболизм аминокислот, вероятно, ниже.
Список литературы
Berg J.M., Timoczko J.L., Stryer L. 2011. Biochemistry. N.Y.: W.H. Freeman, 1120 p.
Bibiano Melo J.F., Lundstedt L.M., Metón I. et al. 2006. Effects of dietary levels of protein on nitrogenous metabolism of Rhamdia quelen (Teleostei: Pimelodidae) // Comp. Biochem. Physiol. Pt. A. Mol. Integr. Physiol. V. 145. № 2. P. 181–187. doi 10.1016/j.cbpa.2006.06.007
Bowen S.H., Lutz E.V., Ahlgren M.O. 1995. Dietary protein and energy as determinants of food quality: trophic strategies compared // Ecology. V. 76. № 3. P. 899–907. doi 10.1016/j.cbpa.2006.06.007
Halver J.E., Hardy R.W. 2002. Fish nutrition. San Diego: Acad. Press, 824 p.
Karlsson A., Eliason E.J., Mydland L.T. et al. 2006. Postprandial changes in plasma free amino acid levels obtained simultaneously from the hepatic portal vein and the dorsal aorta in rainbow trout // J. Exp. Biol. V. 209. № 24. P. 4885–4894. doi 10.1242/jeb.02597
Li P., Mai K., Trushenski J. 2009. New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds // Amino Acids. V. 37. № 1. P. 43–53. doi 10.1242/jeb.02597
McDonald P., Edwards R.A., Greenhalgh J.F.D. et al. 2011. Animal nutrition. Harlow, UK: Pearson, 714 p.
Mommsen T.P., Walsh P.J. 1992. Biochemical and environmental perspectives on nitrogen metabolism in fishes // Experientia. V. 48. № 6. P. 583–593. doi 10.1007/BF01920243
Pfaffl M.W. 2001. A new mathematical model for relative quantification in real-time RT-PCR // Nucleic Acids Res. V. 29. № 9. P. e45. doi 10.1093/nar/29.9.e45
Umezawa C., Maeda Y., Haba K. et al. 2007. Effect of leucine on intestinal absorption of tryptophan in rats // Brit. J. Nutrition. V. 54. № 3. P. 695–703. doi 10.1079/BJN19850155
Wilson R.P. 2002. Amino acid and proteins // Fish nutrition / Eds. Halver J.E., Hardy R.W. San Diego: Acad. Press. P. 144–179.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


