Вопросы ихтиологии, 2019, T. 59, № 1, стр. 80-86
Ультраструктура кишечного эпителия у хрящевых рыб
В. В. Кузьмина 1, *, Л. В. Балабанова 1, А. К. Смирнов 1
1 Институт биологии внутренних вод РАН − ИБВВ
Некоузский район, Ярославская область, пос. Борок, Россия
* E-mail: vkuzmina@ibiw.yaroslavl.ru
Поступила в редакцию 13.09.2017
После доработки 05.03.2018
Принята к публикации 10.01.2018
Аннотация
По данным электронной микроскопии выявлены особенности структуры эпителиальных клеток у трёх видов хрящевых рыб, отличающихся по характеру питания: катрана Squalus acanthias (типичный ихтиофаг), ската-хвостокола Dasyatis pastinaca и шиповатого ската Raja clavata (бентофаги-факультативные ихтиофаги). У катрана длина микроворсинок щёточной каймы энтероцитов в медиальном отделе спирального кишечника меньше, чем у ската-хвостокола и шиповатого ската (0.66 ± 0.05 против 1.16 ± 0.07 и 1.04 ± 0.10 мкм), а их диаметр, напротив, больше (0.10 против 0.08 и 0.07 мкм). У ската-хвостокола выявлены хорошо выраженный гликокаликс и уменьшение длины микроворсинок в дистальном направлении. Обсуждается роль щёточной каймы энтероцитов в увеличении пищеварительной и транспортной поверхности кишечника, а также роль отдельных органелл в процессах пищеварения и транспорта нутриентов у исследованных видов рыб.
Слизистая оболочка кишечника играет витальную роль в пищеварительных, резорбтивных и метаболических процессах у разных животных. Тонкое строение кишечного эпителия у костистых рыб (Teleostei) изучено достаточно подробно (Odense, Bіshор, 1966; Yamamoto, 1966; Iwai, 1969; Gauthier, Landis, 1972; Noaillac-Dереyrе, Gаs, 1973, 1974, 1979; Krementz, Chapman, 1975; Stroband, 1977; Ezeasor, Stokoe, 1981; Kuperman, Kuz’mina, 1994; Horn et al., 2006; Dai et al., 2007; German, 2009; Naguib et al., 2011). В этих работах особое внимание уделялось строению энтероцитов. При этом отмечалось фундаментальное сходство ультраструктуры кишечного эпителия у рыб разных таксономических групп и у других позвоночных (Уголев, Кузьмина, 1993). Важно, что апикальная поверхность мембраны энтероцитов образует щёточную кайму, состоящую из многочисленных пальцеобразных выступов плазматической мембраны (микроворсинок) и отходящих от них тонких нитей мукополисахаридной природы, образующих сеть (гликокаликс).
Высота микроворсинок энтероцитов у разных видов костистых рыб, как правило, изменяется в пределах ~1−2 мкм и варьирует в разных частях кишечника рыб (Уголев, Кузьмина, 1993). Наиболее ярко вариабельность высоты микроворсинок энтероцитов проявляется у рыб с длинным кишечником, особенно у представителей семейства Loricariidae (Siluriformes), питающихся древесиной. Длина кишечника у этих рыб больше длины их тела в 11.6–17.2 раза, а у отдельных особей Hypostomus pyrineusi – в 40 раз. У четырёх исследованных видов семейства Loricariidae высота кишечных складок, длина и плотность микроворсинок уменьшаются в дистальном направлении. При этом у трёх видов (Panaque cf. nigrolineatus, P. nocturnus, Hypostomus pyrineusi) различия в длине и плотности микроворсинок в разных отделах кишечника достоверны, у Pterygoplichthys disjunctivus – недостоверны (German, 2009).
Толщина гликокаликса энтероцитов, как правило, составляет до 0.1 мкм. Однако у рыб эта структура выявлена лишь в немногих работах (Huebner, Chee, 1978; Kuperman, Kuz’mina, 1994). При этом не только размер микроворсинок, но и наличие гликокаликса имеют принципиальное значение. Микроворсинки, будучи структурной основой процессов мембранного пищеварения, увеличивают пищеварительную и транспортную поверхность энтероцитов (Уголев, 1972, 1985; Уголев, Кузьмина, 1993; Kuperman, Kuz’mina, 1994). Гликокаликс сепарирует молекулы по величине и заряду, способствует продвижению нутриентов к апикальной мембране энтероцитов, выполняет акцепторные и рецепторные функции, в том числе иммунные, препятствует проникновению бактерий и некоторых ксенобиотиков (Уголев, 1985).
Сведения, касающиеся ультраструктуры кишечного эпителия у хрящевых ганоидов (Chondrostei) (Radaelli et al., 2000; Корнева, Бедняков, 2011) и особенно у хрящевых рыб (Chondrichthyes) (Wilson, Castro, 2010), немногочисленны. Вместе с тем известно, что кишечник у хрящевых рыб значительно отличается по морфологическому строению от такового у костистых рыб и делится на две части: переднюю, представляющую собой тонкую трубку, и расположенную дистальнее более толстую часть, характеризующуюся наличием спирального клапана – так называемый спиральный кишечник (Chatchavalvanich et al., 2006; Wilson, Castro, 2010). Стенка спирального клапана образуется из складок слизистой оболочки кишечника и подслизистой. Площадь поверхности слизистой оболочки увеличивается благодаря наличию складок слизистой на складках спирального клапана, расположенного вдоль продольной оси кишечника и имеющего винтообразную форму. Число витков и высота складок у разных видов рыб различна (Wilson, Castro, 2010). При этом у акулы Sphyrna tiburo активность пищеварительных гидролаз максимальна в медиальной части спирального кишечника (Jhaveri et al., 2015).
Цель настоящего исследования – изучить ультраструктуру эпителия спирального кишечника у трёх видов хрящевых рыб (катрана Squalus acanthias, ската-хвостокола Dasyatis pastinaca и шиповатого ската Raja clavata), различающихся по типу питания.
МАТЕРИАЛ И МЕТОДИКА
Исследованы взрослые особи катрана, ската-хвостокола и шиповатого ската (по 5 экз. каждого вида массой 1700−2100 г), отловленные в Чёрном море в течение сентября–октября. Катран – типичный ихтиофаг, питающийся в течение всего года. Скаты – бентофаги-факультативные ихтиофаги; их пищу составляют беспозвоночные, в основном ракообразные, в меньшей степени моллюски и полихеты, а также рыбы небольшого размера (Никольский, 1954).
Сразу после отлова рыб обездвиживали, разрезали брюшную полость, изымали кишечник и помещали его на ледяную баню. Для электронно-микроскопических исследований спиральный кишечник разрезали вдоль и делили на три равные части (проксимальную, медиальную и дистальную). В связи с тем, что для процессов пищеварения наиболее важна медиальная часть спирального кишечника, наибольшее внимание уделено исследованию ультраструктуры эпителия этого участка. Из верхушек гребней спирального клапана изымали три фрагмента, которые сразу фиксировали и впоследствии рассматривали как одну пробу. У катрана пробы отбирали из двух участков медиальной части (ближе на 1 см от центра к проксимальному и к дистальному отделам); у ската-хвостокола – из медиальной и дистальной части; у шиповатого ската – из середины медиальной части. Фиксацию и последующую обработку материала проводили по стандартной для электронной микроскопии методике (Миронов и др., 1994). Материал фиксировали в течение 2 ч в 2−5%-ном глутаровом альдегиде на фосфатном буфере (рН 7.4), затем − в 1%-ном растворе ОsО4 в том же буфере в течение 1.0−1.5 ч. Дегидратацию проводили в прогрессивной градуированной концентрации этанола и ацетоне, после чего заливали в эпон-аралдит. Ультратонкие срезы (50−60 нм) контрастировали 4%-ным водным раствором уранил-ацетата, окрашивали 1%-ным раствором цитрата свинца и исследовали в трансмиссионном электронном микроскопе JEM 100C при 80 кВ.
Данные обработаны статистически с использованием приложения Excel программы MS Office’XP, а также в программе STATISTICA 6.0. Достоверность результатов оценивали по критерию Стьюдента для малых выборок при р ≤ 0.05.
РЕЗУЛЬТАТЫ
Эпителий медиального отдела спирального кишечника катрана в основном состоит из удлинённых цилиндрических энтероцитов (рис. 1а). Апикальная часть плазмолеммы энтероцитов несёт многочисленные микроворсинки, образующих щёточную кайму (рис. 1а, 1б). Апикальная часть микроворсинок значительно уплотнена и содержит фрагменты гликокаликса (рис. 1б). Мембрана микроворсинок имеет типичную трёхслойную структуру (на рис. 1а, врезка). В большинстве случаев энтероциты расположены плотно, а щёточная кайма представляет собой непрерывный ряд. Однако в расположенной ближе к дистальной части кишечника заметно чётко выраженное расстояние между энтероцитами в их апикальной части (рис. 1в).
Рис. 1.
Тонкая структура кишечного эпителия катрана Squalus acanthias: а – энтероциты медиальной части спирального кишечника (на врезке – поперечный срез микроворсинок), б – апикальная часть тех же энтероцитов, в – энтероциты дистальной части спирального кишечника, г – структуры неизвестной природы, возможно, супрануклеарные тела. Масштаб: а – 3 (врезка – 0.3), б – 0.5, в – 1, г – 5 мкм.
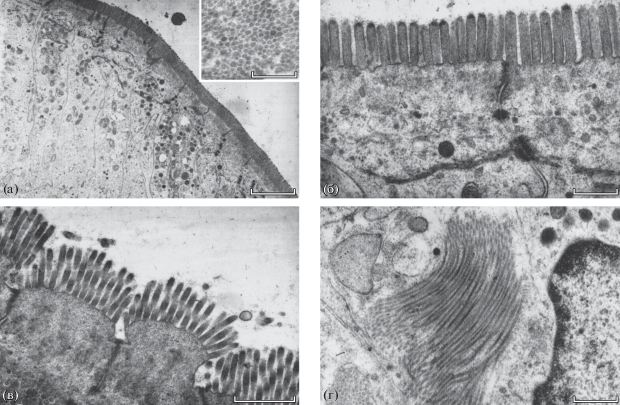
Внутри микроворсинок видны микрофибриллы, нити которых выступают в апикальную часть цитоплазмы, где находится слабо развитая терминальная сеть. Ниже видны многочисленные полиморфные митохондрии с плотной матрицей, а также везикулы и вакуоли. Кроме того, цитоплазма энтероцитов содержит цистерны гранулярного эндоплазматического ретикулума, рибосомы и плотные округлые тела, содержащие липиды (рис. 1а). Важно отметить неравномерное распределение последних внутри клеток, а также их разное содержание в соседних клетках. Апикальные части эпителиальных клеток связаны между собой различными типами соединений, в том числе десмосомами, от которых отходят электронно-плотные тяжи, лежащие поперёк энтероцитов и содержащие липидные капли (рис. 1а, 1б). При этом апикальная мембрана выглядит слегка изогнутой. Также следует отметить наличие структур, более тонких и длинных, чем микроворсинки, которые на снимке расположены рядом с ядром (рис. 1г), но, возможно, лежат выше ядра и являются супрануклеарными телами.
Ультраструктура эпителия спирального кишечника скатов близка таковой акул (рис. 2). Однако цитоплазма в ряде случаев имеет бóльшую электронную плотность, а форма энтероцитов отличается от описанной для катрана (рис. 2а, 2д). У обоих видов скатов энтероциты имеют меньшую длину и более разнообразную форму по сравнению с вытянутыми цилиндрическими энтероцитами катрана. Апикальная часть микроворсинок менее уплотнена, чем у катрана, но у ската-хвостокола гликокаликс выражен отчётливее (рис. 2г). Обращает на себя внимание складчатость латеральной мембраны энтероцитов (рис. 2а), а также разная плотность расположения микроворсинок (рис. 2б). Также следует отметить разную форму и размер ядер у ската-хвостокола и шиповатого ската (рис. 2в, 2г). Рядом с ядром видны митохондрии, гранулярный ретикулум и аппарат Гольджи.
Рис. 2.
Тонкая структура кишечного эпителия ската-хвостокола Dasyatis pastinaca (а−г) и шиповатого ската Raja clavata (д−е): а, д – энтероциты медиальной части спирального кишечника; б – поперечный срез микроворсинок энтероцитов; в, е – ядра и разные органеллы в центре энтероцитов из медиальной части спирального кишечника, г – энтероциты дистальной части спирального кишечника. Масштаб: а, б, г, д – 1; в, е – 2 мкм.
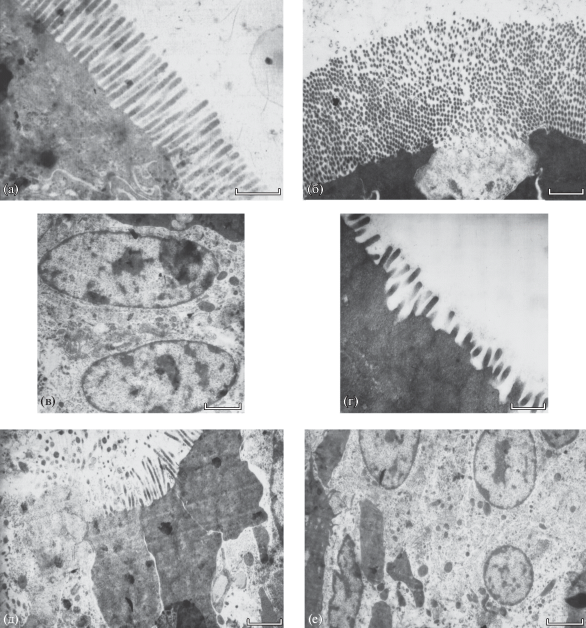
Имеющиеся данные позволили сравнить характеристики микроворсинок, входящих в состав щёточной каймы энтероцитов (таблица). Средняя длина микроворсинок, расположенных на апикальных поверхностях энтероцитов медиальной части кишечника, у катрана в обоих случаях меньше, чем у ската-хвостокола (в 1.8 и 1.5 раза) и шиповатого ската (в 1.6 и 1.3 раза). Однако диаметр микроворсинок у катрана больше, чем у скатов. У ската-хвостокола длина микроворсинок в дистальной части спирального кишечника достоверно меньше, чем в его медиальной части. Максимальное количество микроворсинок у катрана несколько выше, чем у ската-хвостокола. Вместе с тем важно отметить неравномерное распределение микроворсинок у последнего, создающее впечатление наличия пустот, из-за которых количество микроворсинок снижается до 37.
Размеры и количество микроворсинок на апикальной поверхности энтероцитов спирального кишечника у акулы Squalus acanthias и скатов Dasyatis pastinaca и Raja clavata
| Вид | Число рыб, экз. | Размер микроворсинок, мкм | Число микроворсинок, шт/мкм2 | ||
|---|---|---|---|---|---|
| высота | диаметр | ||||
| M ± m | lim | ||||
| Катран* | 5 | $\quad\frac{{0.66 \pm 0.05}}{{0.78 \pm 0.10}}$ | $\frac{{0.5--0.8}}{{0.5--1.0}}$ | $\frac{{0.10}}{{0.10}}$ | 92 – |
| Скат-хвостокол ** | 5 | $\frac{{1.16 \pm {{{0.07}}^{{\text{а }}}}}}{{0.72 \pm {{{0.12}}^{{\text{б }}}}}}$ | $\frac{{1.0--1.3}}{{0.5 - 1.0}}$ | $\frac{{0.08}}{{0.08}}$ | 83 – |
| Шиповатый скат*** | 5 | 1.04 ± 0.10а | 0.7–1.2 | 0.07 | – |
Примечание. M ± m − среднее значение и его ошибка, lim – пределы варьирования показателя; * медиальная часть, расположенная ближе к проксимальной (над чертой) и ближе к дистальной (под чертой) частям; ** середина медиальной (над чертой) и дистальной (под чертой) частей; *** середина медиальной части; различия достоверны: апо сравнению с катраном, бмежду медиальной и дистальной частями спирального кишечника.
ОБСУЖДЕНИЕ
Результаты исследования подтверждают данные, касающиеся не только принципиального сходства ультраструктуры энтероцитов у разных видов рыб, но и вариабельности высоты микроворсинок (Уголев, Кузьмина, 1993; Kuperman, Kuz’mina, 1994) и электронной плотности цитоплазмы (Abaurrea-Equisoain, Ostos-Garrido, 1996). Площадь поверхности слизистой оболочки у хрящевых рыб увеличивается благодаря наличию складок слизистой на складках спирального клапана (Wilson, Castro, 2010), поэтому длина, диаметр и количество микроворсинок на апикальной поверхности энтероцитов имеют большое значение для процессов пищеварения. Выявленная у ската-хвостокола меньшая длина микроворсинок в дистальной части спирального кишечника по сравнению с проксимальной частью хорошо согласуется с данными, полученными для костистых рыб: высота микроворсинок в заднем отделе меньше, чем в переднем и среднем отделах кишечника (Iwai, 1969; Noaillac-Dереyrе, Gаs, 1973; Stroband, 1977; Kuperman, Kuz’mina, 1994).
Различия количественных характеристик микроворсинок у катрана и скатов могут быть связаны с характером питания рыб, в частности, с более однородной по химическому составу пищей ихтиофага по сравнению с таковой бентофагов. Ранее при исследовании ультраструктуры энтероцитов кишечника у рыб, различающихся по характеру питания, бóльшая длина микроворсинок была отмечена у бентофага леща – Abramis brama, чем у ихтиофага щуки – Esox lucius (Kuperman, Kuz’mina, 1994). Особого внимания заслуживает наличие гликокаликса у всех исследованных видов, особенно ярко выраженного у скатов, поскольку эта структура редко обнаруживается у рыб. Ранее хорошо выраженный гликокаликс был выявлен на микроворсинках энтероцитов верхней части кишечника костистой рыбы Hорlоsternum thorocatum (Huebner, Chee, 1978) и на микроворсинках энтероцитов медиального отдела кишечника налима Lota lota (Kuperman, Kuz’mina, 1994). Для представителей осетровых (Acipenseridae) отмечалось, что гликокаликс у них развит слабо (Корнева, Бедняков, 2011). Однако отсутствие или слабая выраженность этой структуры может быть результатом технических погрешностей, в частности, быстрого лизиса в результате задержки времени фиксации препаратов.
Выявленное у катрана увеличенное расстояние между энтероцитами в их апикальной части близко ранее обнаруженному увеличенному расстоянию при исследовании ультраструктуры щёточной каймы энтероцитов бычка-кругляка Neogobius melanostomus. Поскольку у представителя костистых рыб это расстояние наблюдается на уровне микроворсинок, это позволило их распределение охарактеризовать как кустикообразное (Уголев, 1972). По всей вероятности, и в том и в другой случае это явление связано с персорбцией – транспортом макромолекул по межклеточным пространствам.
Обнаруженные у скатов энтероциты с электронно-плотной цитоплазмой по основным ультраструктурным характеристикам не отличаются от типичных энтероцитов. Присутствие энтероцитов двух типов ранее было описано для угря Anguilla anguilla (Abaurrea-Equisoain, Ostos-Garrido, 1996) и представителей осетровых (Корнева, Бедняков, 2011); причём последние авторы не выявили существенных отличий в строении клеток этого типа, а наблюдаемые различия в морфологии клеток объяснили их физиологическим состоянием.
Для костистых рыб и хрящевых ганоидов были описаны простые контакты – десмосомы, а также плотные и промежуточные контакты (Kapoor еt аl., 1975; Kuperman, Kuz’mina, 1994; Корнева, Бедняков, 2011). Помимо этого, на уровне терминальной сети описаны терминальный простой и мультидесмосомальные контакты (Yamamoto, 1966). У акул и в меньшей степени у скатов между латеральными мембранами энтероцитов в апикальной части клеток также выявлены различного рода контакты, в частности, десмосомы. Считается, что они осуществляют связь между соседними клетками. Мы обнаружили электронно-плотные тяжи, лежащие поперёк энтероцитов и содержащие липидные капли, которые отходят от десмосом. По всей вероятности, они способствуют более быстрому проникновению нутриентов, поступающих через межклеточные пространства, внутрь клеток. По-видимому, наличие контактов различного типа обусловлено физиологическим состоянием исследуемых животных (Kuperman, Kuz’mina, 1994) .
Цитоплазма энтероцитов слизистой кишечника исследованных видов рыб содержит органеллы, аналогичные таковым других видов рыб (Yamamoto, 1966; Noaillac-Dереyrе, Gаs, 1973; Kapoor еt аl., 1975; Stroband, 1977; Kuperman, Kuz’mina, 1994; Khojasteh еt аl., 2009; Корнева, Бедняков, 2011; Khadse, Gadhikar, 2017). Однако количество и расположение разных органелл у хрящевых и костистых рыб может быть различным, что в значительной мере зависит от функционального состояния пищеварительной системы (Yamamoto, 1966; Gauthier, Landis, 1972; Noaillac-Dереyrе, Gаs, 1973, 1979; Olsen еt аl., 1999). В отличие от костистых рыб у хрящевых, как и у хрящевых ганоидов (стерляди Acipenser ruthenus, белуги Huso huso и их гибридов бестера H. huso × A. ruthenus и стербела A. ruthenus × H. huso), терминальная сеть в апикальной части энтероцитов развита умеренно (Корнева, Бедняков, 2011; Бедняков, 2014).
Наличие везикул и вакуолей в апикальной части цитоплазмы энтероцитов вблизи плазматической мембраны может быть связано с наличием пиноцитоза (Yamamoto, 1966; Iwai, 1969; Gauthier, Landis, 1972; Noaillac-Dереyrе, Gаs, 1973, 1979; Kuperman, Kuz’mina, 1994). У костистых рыб пиноцитоз сопровождается появлением инвагинаций мембраны и связан с транспортом жиров и белков, которые гидролизуются при участии внутриклеточного пищеварения. Важно отметить, что жиры транспортируются в более проксимальных, белки – в более дистальных участках кишечника (Noaillac-Dереyrе, Gаs, 1973). Обнаруженные нами у катрана электронно-плотные тяжи, лежащие поперёк энтероцитов и содержащие липидные капли, отходящие от десмосом, могут быть обусловлены потреблением жирной пищи. По всей вероятности, они способствуют более быстрому проникновению нутриентов, поступающих через межклеточные пространства внутрь клеток в осенний период, когда жирность костистых рыб – объектов питания катрана − увеличивается (Шульман, 1972). Однако это предположение нуждается в дальнейшей экспериментальной проверке.
Таким образом, ультратонкое строение апикальной части энтероцитов у исследованных видов хрящевых рыб близко таковому рыб других систематических групп. Вместе с тем у катрана и скатов выявлены различия в форме энтероцитов, размерах микроворсинок, а также в количестве и расположении органелл, которые могут быть обусловлены различиями в характере питания этих видов рыб.
Работа выполнена в рамках государственного задания ФАНО России (тема № АААА-А18-118012690102-9).
Список литературы
Бедняков Д.А. 2014. Структурно-функциональные особенности мембранного пищеварения у осетрообразных видов рыб и их гибридов: Автореф. дис. … докт. биол. наук. Астрахань: АГТУ, 44 с.
Корнева Ж.В., Бедняков Д.А. 2011. Сравнительная характеристика ультраструктуры кишечного эпителия осетровых рыб // Биология внутр. вод. № 4. С. 48–57.
Миронов А.А., Комиссарчик Я.Ю., Миронов В.А. 1994. Методы электронной микроскопии в биологии и медицине. СПб.: Наука, 400 с.
Никольский Г.В. 1954. Частная ихтиология. М.: Сов. наука, 458 с.
Уголев A.M. 1972. Мембранное пищеварение. Полисубстратные процессы, организация и регуляция. Л.: Наука, 358 с.
Уголев A.M. 1985. Эволюция пищеварения и принципы эволюции функций. Л.: Наука, 544 с.
Уголев AM., Кузьмина В.В. 1993. Пищеварительные процессы и адаптации у рыб. СПб: Гидрометеоиздат, 238 с.
Шульман Г.Е. 1972. Физиолого-биохимические особенности годовых циклов рыб. М.: Пищ. пром-сть, 368 с.
Abaurrea-Equisoai M.A., Ostos-Garrido M.V. 1996. Cell types in the esophageal epithelium of (Pisces, Teleostei), cytochemical and ultrastructural characteristic // Micron. V. 27. P. 419–429.
Chatchavalvanich K., Marcos R., Poonpirom J. et al. 2006. Histology of the digestive tract of the freshwater stingray Himantura signifer Compagno and Roberts, 1982 (Elasmobranchii, Dasyatidae) // Anat. Embriol. V. 211. P. 507–518.
Dai X., Shu M., Fang W. 2007. Histological and ultrastructural study of the digestive tract of rice field eel, Monopoterus albus // J. Appl. Ichthyol. V. 23. P. 177–183.
Ezeasor D.N., Stokoe W.M. 1981. Light and electron microscopic studies on the absorptive cells of the intestine, caeca and rectum of the adult rainbow trout, Salmo gairdnerii Rich. // J. Fish. Biol. V. 18. № 5. P. 527–544.
Gauthier G.F., Landis S.C. 1972. The relationship of ultrastructural and cytochemical features to absorptive activity in the goldfish intestine // Anat. Rec. V. 172. P. 675–702.
German D.P. 2009. Inside the guts of wood-eating catfishes: can they digest wood? // J. Comp. Physiol. V. 179B. P. 1011–1023.
Horn M.H., Gawlicka A., German D.P. et al. 2006. Structure and function of the stomachless digestive system in three related species of New World silverside fishes (Atherinopsidae) representing herbivory, omnivory, and carnivory // Mar. Biol. V. 149. P. 1237–1245.
Huebner E., Chee G. 1978. Histological and ultrastructural specialization of the digestive tract of the intestinal air breather Hoplosternum thoracatum (Teleost) // J. Morphol. V. 157. № 3. P. 301–327.
Iwai T. 1969. Fine structure of gut epithelial cells of larval and juvenile carp during absorption of fat and protein // Arch. Histol. Jpn. V. 30. P. 183–189.
Jhaveri P., Papastamatiou Y., German D.P. 2015. Digestive enzyme activities in the guts of bonnethead sharks (Sphyrna tiburo) provide insight into their digestive strategy and evidence for microbial digestion in their hindguts // Comp. Biochem. Physiol. V. 189A. P. 76–83.
Kapoor B.G., Smit H., Verighina I.A. 1975. The alimentary canal and digestion in teleosts // Adv. Mar. Biol. V. 13. P. 109–239.
Khadse T.A., Gadhikar Y.A 2017. Histological and ultrastructural study of intestine of Asiatic knife fish, Notopterus notopterus // Int. J. Fish. Aquat. Stud. V. 5. № 1. P. 18–22.
Khojasteh S.M.B., Sheikhzadeh F., Mohammadnejad D., Azami A. 2009. Histological and ultrastructural study of the intestine of Rainbow trout (Oncorhynchus mykiss) // World Appl. Sci. J. V. 6. P. 1525–1531.
Krementz A.B., Chapman G.B. 1975. Ultrastructure of the posterior half of the intestine of the catfish, Ictalurus punctatus // J. Morphol. V. 145. № 4. P. 441–482.
Kuperman B.I., Kuz’mina V.V. 1994. The ultrastructure of the intestinal epithelium in fishes with different types of feeding // J. Fish Biol. V. 44. P. 181–193.
Naguib S.A.A., EI-Shabaka H.A., Ashour F. 2011. Comparative histological and ultrastructural studies on the stomach of Schilbe mystus and the intestinal swelling of Labeo niloticus // J. Amer. Sci. V. 7. № 8. P. 251–263.
Noaillac-Depeyre J., Gas N. 1973. Mise en evidence d’une zone adapté au transport des ions dans l’intestin de la carpe commune (Cyprinus carpio L.) // C. R. Acad. Sci. (Paris). V. 276. № 4. P. 773–776.
Noaillac-Depeyre J.,Gas N. 1974. Fat absorption by the enterocytes of the carp (Cyprinus carpio L.) // Cell. Tissue Res. V. 155. № 3. P. 353–365.
Noaillac-Depeyre J., Gas N. 1979. Structure and function of the intestinal epithelial cells in the perch (Perca fluviatilis L.) // Anat. Rec. V. 195. № 4. P. 621–639.
Odense P.H., Bishop C.M. 1966. The ultrastructure of the epithelial border of the ileum, pyloric caeca, and rectum of the cod, Gadus morhua // J. Fish. Res. Board Can. V. 23. № 12. P. 1841–1843.
Olsen R.E., Myklebust R., KainoT., Ringø E. 1999. Lipid digestibility and ultrastructural changes in the enterocytes of Arctic char (Salvelinus alpinus L.) fed linseed oil and soybean lecithin // Fish Physiol. Biochem. V. 21. P. 35–44.
Radaelli G., Domeneghini C., Arrighi S. et al. 2000. Ultrastructural features of the gut in the white sturgeon, Acipenser transmontanus // Histol. Histopathol. V. 15. P. 429–439.
Stroband H.W.J. 1977. Growth and diet dependent structural adaptations of the digestive tract in juvenile grass carp (Ctenopharyngodon idella Val.) // J. Fish Biol. V. 11. № 2. P. 167–174.
Wilson J.M., Castro L.F.C. 2010. Morphological diversity of the gastrointestinal tract in fishes // Fish Physiology / Eds. Grosell M. et al. V. 30. London: Acad. Press. P. 1–55.
Yamamoto T. 1966. An electron microscopic study of the columnar epithelial cell in the intestine of fresh-water teleosts: goldfish (Carassius auratus) and rainbow trout (Salmo irideus) // Z. Zellforsch. V. 72. P. 66–87.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


