Вопросы ихтиологии, 2019, T. 59, № 1, стр. 33-38
Динамика сроков размножения тихоокеанской волосатки Hemitripterus villosus (Hemitripteridae) в юго-западной части залива Петра Великого: результаты мониторинга за 20-летний период (1997−2016)
А. И. Маркевич *
Дальневосточный морской заповедник – филиал ННЦМБ ДВО РАН
Владивосток, Россия
* E-mail: alexmarkfish@mail.ru
Поступила в редакцию 20.07.2017
После доработки 12.10.2017
Принята к публикации 02.08.2017
Аннотация
Визуальными водолазными методами изучены сроки размножения тихоокеанской волосатки Hemitripterus villosus в зал. Петра Великого Японского моря в 1997−2016 гг. Выяснено, что в некоторые годы начало и конец нереста сдвигались на более поздние сроки (на 5−12 сут.), что объясняется повышенной на 1.6−2.5°С температурой воды на нерестилище в сентябре−октябре. Сильно возросла (с 35.2 до 60.4%) степень повреждения открыто лежащих кладок икры, основной хищник – морской ёж Mesocentrotus nudus. Наблюдающиеся изменения сроков размножения и увеличение степени выедания икры хищниками не являются критическими факторами для снижения численности тихоокеанской волосатки.
С конца ХХ в. на нашей планете начали регистрировать самые различные проявления эффекта глобального повышения температуры. Отмечены они и в Тихом океане: это непосредственно повышение температуры воды (Abraham et al., 2013), обесцвечивание кораллов (Goreau, Hayed, 1994), расширение на север ареалов тепловодных видов рыб (Perry et al., 2005) и других морских животных. Как следствие, подобные процессы отмечены и в зал. Петра Великого Японского моря – это небольшое повышение температуры воды (Лучин, Тихомирова, 2010) и увеличение числа встреч тропических рыб (Соколовский и др., 2011). На акватории Дальневосточного морского заповедника, расположенной в юго-западной части зал. Петра Великого, ранее было подробно изучено размножение широкобореального тихоокеанского донного вида рыб – тихоокеанской волосатки Hemitripterus villosus (Маркевич, 2000). Выяснено, что динамика подходов этой рыбы на нерестилище в сентябре зависит от темпа осеннего охлаждения вод. В начале ХХI в. отмечены изменения в ходе нереста волосатки, связанные с заметным повышением температуры воды в районе нерестилища (Маркевич, 2007, 2011, 2016).
Цель настоящей работы − анализ динамики сроков размножения тихоокеанской волосатки за 20-летний период (1997−2016 гг.) на нерестилище в Дальневосточном морском заповеднике (ДВМЗ).
МАТЕРИАЛ И МЕТОДИКА
В настоящей работе впервые представлены данные наблюдений за рыбами, полученные в 2014 и 2016 гг., а также использованы сравнительные сведения из работ автора в 1997, 1998, 2000, 2001, 2003, 2008 и 2015 гг. (Маркевич, 2000, 2007, 2011, 2016). Все наблюдения за размножением тихоокеанской волосатки проводили в августе, сентябре и октябре в бухте на севере о-ва Большой Пелис (восточный участок ДВМЗ). В бухте расположено самое крупное нерестилище этих рыб из всех известных в зал. Петра Великого (рис. 1). Схема бухты построена с использованием интернет-сервиса “Google Earth” (версия 6.2). Координаты расположения нерестилищ определены с помощью GPS-приёмника Garmin eTrex Legend HCx. Размеры нерестилищ измерены рулеткой непосредственно под водой, глубину регистрировали по данным водолазного компьютера Tusa Imprex II с точностью 0.1 м.
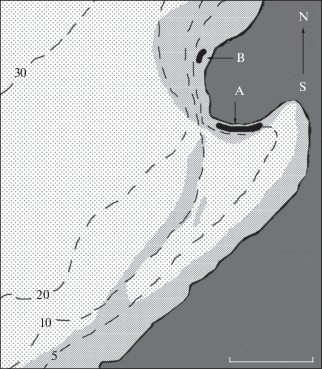
Рис. 1.
Схема бухты на севере о-ва Большой Пелис, юго-западная часть зал. Петра Великого:
А, В − нерестилища тихоокеанской волосатки Hemitripterus villosus, (- -) – изобаты, ( ) – валунный грунт, (
) – валунный грунт, ( ) – песчаный грунт. Масштаб: 112.5 м.
) – песчаный грунт. Масштаб: 112.5 м.
Непосредственно на нерестилище встречаются только самки, что объясняется отсутствием необходимости прямого осеменения самцами отложенной икры – сперма переносится в половые пути самки во время копуляции за несколько дней до нереста (Munehara, 1996). Интенсивность нереста оценивали по визуальным водолазным учётам числа размножающихся самок на мелководном (0.7−3.5 м) валунном нерестилище, описанном ранее (Маркевич, 2000). Регистрировали календарные сроки прохождения нереста. Температуру воды измеряли ртутным термометром с ценой деления 0.5°С в поверхностном слое воды в 8 и 18 ч. Число рыб, находящихся на нерестилище, подсчитывали визуально с поверхности воды два раза в сутки (08.00−9.00 и 17.00−18.00 ч), в двух повторностях (туда и обратно). Под водой регистрировали распределение и поведение рыб на нерестилище и вблизи него, а также размещение кладок икры. В 2014 и 2016 гг. проведено 318 учётов (принимая туда и обратно за 1 учёт), за все годы наблюдений – 1748. При обследовании кладок икры учитывали общее их видимое число, визуально определяли животных, повреждающих кладки, и их численность. В 1997 и 1998 г. обследовано 657 кладок (Маркевич, 2000), в 2016 г. – 373.
РЕЗУЛЬТАТЫ
В бухте на севере о-ва Большой Пелис, у северо-западного еë берега, располагается нерестилище А тихоокеанской волосатки (рис. 1). Валунная коса прикрывает нерестилище от частых в осенне-зимний период штормов северо-западного направления, что обеспечивает более удобные условия для нереста рыб и сохранности кладок икры, чем у открытых прибрежий. На противоположном берегу бухты, где штормовые волны часто накатывают на берег, нерестящиеся рыбы не встречаются. Начало нерестилища А находится у пирса кордона заповедника, в точке с координатами 42°40′22″ с.ш. 131°27′41″ в.д. Длина нерестилища составляет около 60 м, ширина до 5 м, глубина 0.8−2.8 м. В 2014 г. впервые отмечено скопление рыб на нерестилище В, находящемся на западной оконечности валунной косы в 100 м от нерестилища А, в точке с координатами 42°40′23″ с.ш. 131°27′37″ в.д. Здесь нерестилище представляет собой три отдельных пятна размерами около 3 × 2 м с пригодным для откладки икры рыб каменистым грунтом (размеры камней овальной формы от 0.2 до 0.4 м в поперечнике) (рис. 2). Пятна небольших камней располагаются между валунами размером до 0.6 м. Общая площадь нерестилища около 20 м2, глубина – 1.7−3.8 м. Температура здесь обычно на 1.0−1.2°С ниже, чем на нерестилище А.
Рис. 2.
Самки тихоокеанской волосатки Hemitripterus villosus на нерестилище В у о-ва Большой Пелис, юго-западная часть зал. Петра Великого. Фото автора.

За 7−10 сут. до нереста волосатки начинают встречаться у подножия каменистой гряды вблизи нерестилищ на глубинах от 26 до 12 м. Распределяются они преимущественно поодиночке, изредка парами. Общее число рыб, встречающихся ежедневно, невелико (10−15 особей), из них 60−90% составляют самки. По мере приближения начала нереста самки перемещаются ближе к нерестилищам и распределяются на каменистых склонах на глубине 4−8 м. На нерестилище рыбы проводят простейшую подготовку субстрата к откладке икры: очищают поверхность камней, пытаются их сдвигать, вследствие чего у 1/4 всех рыб видны повреждения кожи на нижней челюсти.
В 1997 г. первая самка появилась на нерестилище А 31 августа при температуре воды 18.0°С (табл. 1) (Маркевич, 2000). В течение двух недель число рыб на нерестилище постепенно увеличивалось и 12 сентября достигло 42 экз., температура воды составляла 17.9°С; 14 сентября число рыб скачкообразно возросло, достигнув максимума – 117 особей, температура воды практически не изменилась (18.0°С). В последующие дни число нерестующих рыб медленно снижалось, 28 сентября осталось 23 особи, температура воды при этом немного повысилась (18.7°С). Закончился нерест волосатки 12 октября при температуре 15.2°С.
Таблица 1.
Сроки нереста, наибольшая численность самок тихоокеанской волосатки Hemitripterus villosus и температура воды на нерестилище А у о-ва Большой Пелис в разные годы
| Год | Общий период нереста (начало–конец) | Период массового нереста (начало–конец) | Пик нереста | ||||
|---|---|---|---|---|---|---|---|
| Даты | Температура, °С | Даты | Температура, °С | Дата | n, экз. | Температура, °С | |
| 1997 | 31.08–12.10 | 18.0–15.2 | 14.09–28.09 | 17.9–18.7 | 14.09 | 117 | 18.0 |
| 2000 | 04.09–11.10 | 21.5–16.8 | 15.09–23.09 | 20.5–19.0 | 18.09 | 75 | 19.5 |
| 2001 | 06.09–13.10 | 21.2–16.0 | 15.09–25.09 | 20.2–19.5 | 23.09 | 73 | 19.5 |
| 2003 | 04.09–н/д | 20.3–н/д | 15.09–н/д | 19.7–н/д | 18.09 | 60 | 19.2 |
| 2008 | 11.09–н/д | 20.5–н/д | 21.09–30.09 | 20.2–18.0 | 30.09 | 63 | 17.5 |
| 2014 | 11.09–18.10 | 19.6–14.6 | 17.09–02.10 | 18.2–16.0 | 22.09 | 92 | 18.2 |
| 2015 | 10.09–19.10 | 19.9–14.0 | 22.09–31.09 | 20.1–18.0 | 24.09 | 44 | 19.8 |
| 2016 | 31.08–22.10 | 12.7–12.0 | 12.09–30.09 | 17.9–17.0 | 23.09 | 81 | 18.5 |
В 2000, 2001, 2003 и 2008 гг. наблюдалось постепенное смещение на более поздние даты (от 5 до 11 сут.) как начала и конца нереста, так и момента с максимальным числом самок на нерестилище (табл. 1) (Маркевич, 2007, 2011). В эти годы по сравнению с 1997 г. температура воды на нерестилище была выше: при появлении на нерестилищах первых самок – на 2.3–3.5°С, в начале массового нереста – на 1.8–2.6°С, в конце – на 0.3−0.8°С.
В 2014 г. первая самка волосатки на нерестилище А появилась 11 сентября при температуре 19.6°С (табл. 1; рис. 3). Массовый нерест начался 17 сентября (34 экз.) и продолжался до 2 октября (тоже 34 экз.). Наибольшее число самок (92) зарегистрировано 22 сентября (18.2°С). Закончился нерест 18 октября при температуре воды 14.6°С. В этом году впервые обнаружено небольшое нерестилище В (рис. 1). Самок здесь обычно было в два–три раза меньше, чем на нерестилище А, но в редкие дни почти столько же. Возможно, причиной образования этого нерестилища в какой-то мере явилось усиление охранной деятельности на кордоне заповедника. Нерестилище А вплотную примыкает к пирсу кордона, и учащение движения моторных лодок инспекторов охраны заповедника от пирса является фактором беспокойства для нерестящихся рыб. Неоднократно регистрировали, что после прохода лодки 20−50% волосаток, находящихся на нерестилище А, уходят с него. Наблюдения показали, что самки либо спускались ниже по каменистому склону и распределялись по нему и всей бухте, либо уплывали в сторону нерестилища В; в периоды покоя рыбы обычно возвращались на мелководье нерестилища А как с глубины, так и с нерестилища В.
Рис. 3.
Численность самок Hemitripterus villosus и температура воды на нерестилище А у о-ва Большой Пелис, юго-западная часть зал. Петра Великого. Усреднённые данные соответственно по числу рыб и температуре воды за каждый день: 1, 4 – 2014 г., 2, 5 – 2015 г., 3, 6 − 2016 г.
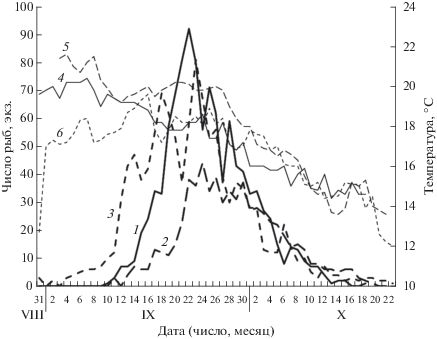
В 2015 г. первая самка пришла на нерестилище А 10 сентября при температуре воды 19.9°С (табл. 1; рис. 3) (Маркевич, 2016). Период массового нереста длился с 22 по 31 сентября. Максимальное число самок зарегистрировано 24 сентября при температуре воды 19.8°С. Резкое увеличение числа самок (с 15 до 38) отмечено с 20 по 22 сентября при практически стабильной температуре воды (20.2–20.1°С); последняя самка обнаружена 19 октября (14.0°С). Как и в 2014 г., при беспокойстве отмечен заметный уход рыб с нерестилища А и увеличение в это же время числа рыб на нерестилище В.
В 2016 г. первая самка на нерестилище А появилась 31 августа при температуре воды 12.7°С (табл. 1; рис. 3). Вследствие прошедшего по территории Приморья 29−30 августа тайфуна Лайонрок произошло перемешивание поверхностных и глубинных вод, температура воды на поверхности в районе нерестилища резко понизилась с 19.0°С 30 августа до 12.2−13.2°С 31 августа. 2 сентября на нерестилище откладывали икру три самки, температура воды заметно повысилась (17.0°С). Период массового нереста длился с 12 (31 особь, 17.9°С) по 30 (35, 17.0°С) сентября. Наибольшее число самок (81) зарегистрировано 23 сентября; последняя самка − 22 октября (12.0°С). Как и в предыдущие два года, при беспокойстве неоднократно регистрировали уход рыб с нерестилища А и переход их на нерестилище В. Но число самок на нерестилище В ни разу одновременно не превысило таковое на нерестилище А. На обоих нерестилищах отмечена тенденция рыб объединяться в плотные группы во время откладки икры. На нерестилище А чаще всего такие группы состояли из трёх–шести самок, изредка – до восьми–девяти; на нерестилище В обычное число рыб в группе – семь–восемь, но встречались группы по 12−14 самок.
В последние две недели нереста на обоих нерестилищах все больше стало встречаться кладок икры, поедаемых различными животными. Обычно это происходит, когда бóльшая часть промежутков между валунами, куда самки откладывают икру, занята, и вновь прибывшим рыбам приходится помещать кладки так, что часть их выступает на поверхность. Либо самки при беспокойстве сбрасывают икру в неподходящем месте. В 2016 г. значительная часть (60.4%) таких кладок была повреждена (табл. 2). Подавляющее количество икры волосаток (87.9%) поедали морские ежи Mesocentrotus nudus, значительно меньшую часть – морские звёзды Patiria pectinifera и другие животные. Отдельные кладки поедали как несколько особей одного вида хищников (например, от одного до шести M. nudus), так и разные виды хищников совместно.
Таблица 2.
Доля кладок икры тихоокеанской волосатки Hemitripterus villosus на нерестилищах у о-ва Большой Пелис, повреждённых разными животными, в 1997−1998 и 2016 гг.
| Вид животного | Доля повреждённых кладок, % общего числа | |
|---|---|---|
| 1997−1998 | 2016 | |
| Mesocentrotus nudus | 48.37 | 87.9 |
| Strongylocentrotus intermedius | 0 | 5.8 |
| Patiria pectinifera | 49.90 | 15.7 |
| Aphelasterias japonica | 1.63 | 0 |
| Asterias amurensis | 0.05 | 0 |
| Lysastrosoma anthosticta | 0.05 | 0 |
| Hemigrapsus sanguineus | 0 | 2.2 |
| Поврежденные кладки | 35.15 | 60.4 |
| Общее число обследованных кладок, шт. | 657 | 373 |
ОБСУЖДЕНИЕ
Анализ многолетних наблюдений за размножением тихоокеанской волосатки на нерестилище в зал. Петра Великого подтвердил ранее сделанный вывод (Маркевич, 2000): ход и интенсивность размножения этого вида рыб, как и многих морских животных (Милейковский, 1970; Danilowicz, 1995), определяется температурой воды, регистрируемой в каждый конкретный год в районе нерестилища. Так, если в 1997 г. нерест начался 31 августа при 18.0°С, то в 2000−2003 гг. его начало сдвинулось на 4−6 сентября из-за значительно более высокой (20.3−21.5°С) температуры воды. В 2008, 2014 и 2015 гг. этот сдвиг увеличился ещё на 5−7 сут. (соответственно на 12, 11 и 10 сентября), температура была ниже, чем в предыдущие годы наблюдений, в первую неделю сентября (19.6−19.9°С), но по сравнению с 1997 г. − выше более чем на 1.5°С. Соответственно, сдвинулись на более поздние сроки (на 7−10 сут.) и даты массового нереста, и сроки его окончания.
Связь нереста волосатки с температурой воды не является очень жёсткой: рыбы могли бы сместиться с нерестилища немного глубже по каменистому склону, где температура обычно на 0.5−1.0°С ниже. Это явление наблюдалось, но оно не приняло массового характера (Маркевич, 2011). Объяснить это можно тем, что глубже каменистый склон состоит из больших валунов со значительно бóльшими промежутками между ними, здесь волосатки не могут успешно скрыть откладываемые комки икры. Следует отметить, что вечером на нерестилище А температура воды обычно была на 0.7−1.4°С выше, чем утром (из-за нагона тёплой воды волнами с юго-запада и инсоляции), а число самок всегда в два–три раза ниже. В 2016 г. вследствие резкого снижения температуры на нерестилище ход размножения волосатки фактически был сходен с таковым в 1997 г. Таким образом, за 20-летний период наблюдений выявлена норма реакции тихоокеанской волосатки на температурные условия, необходимые для нормального прохождения нереста и отклик на них рыб: при превышении температурного оптимума происходит смещение сроков начала нереста на более поздние даты (в исследованные годы – до 12 сут.). Как отмечено ранее (Гнюбкина, Маркевич, 2011), такой сдвиг сроков нереста волосатки в море не является критичным для нормального развития еë икры: серьёзные нарушения в эмбриогенезе начинают возникать только при очень высокой температуре воды в аквариальных условиях (15.0−18.4°С) и сильном превышении суммы градусо-дней (Kyushin, 1968), необходимых для нормального эмбриогенеза. В зал. Петра Великого в зимний период температура воды далеко не достигает таких значений, и угрозы аномалий развития эмбрионов волосатки в естественных условиях нет.
По сравнению с 1997 г. заметно уменьшилось максимальное число рыб на нерестилище А − с 117 до 44−92 экз. в последующие годы. Это объяснимо прямым антропогенным влиянием: часть каменистого склона в куту бухты занято двумя пирсами для моторных лодок инспекторов заповедника, поэтому рыбы перестали заходить в эту часть бухты, как было ранее. Образовалось второе небольшое нерестилище В, куда часть рыб уходит при беспокойстве и откладывает икру там. С учётом рыб на этом нерестилище общее число особей, приходящих на нерест в бухту о-ва Большой Пелис, не изменилось.
Вследствие уменьшения площади нерестилища А и пригодного субстрата для откладки икры рыбы стали собираться в более крупные плотные группы, чем было отмечено в 1997 г. (до 8−14 против 2−4 экз.), сократилось минимальное расстояние между отдельными рыбами и группами. Более высокая плотность откладки икры в последние годы, видимо, повлияла на значительное увеличение хищничества икры. Если в 1997−1998 гг. зарегистрировано поедание 35.2% открыто лежащих кладок икры (Маркевич, 2000), то в 2016 г. эта доля увеличилась почти в два раза – до 60.4%. Несмотря на очень высокую механическую прочность оболочек икры (Гомелюк, Маркевич, 1985), кладки икры могут сохраняться нетронутыми, только будучи скрытыми глубоко в щелях между камнями. Главным хищником, уничтожающим икру волосатки, как и других рыб (например, японского терпуга Hexagrammos otakii) в бухте, стал морской ёж M. nudus, численность которого здесь очень высока, а корма мало – водорослей и морских трав осенью здесь практически нет.
Устойчивые изменения сроков размножения тихоокеанской волосатки в зал. Петра Великого, зарегистрированные в начале ХХI в., явились ещё одним из фактов влияния потепления вод Мирового океана на морскую биоту, наряду с другими проявлениями, отмеченными ранее во многих морях – ухудшение обеспеченности пищей мелких пелагических рыб в Чёрном море (Шульман и др., 2007), сильное смещение района нереста на север у тихоокеанского побережья Японии и изменения в экологии у Sardinops melanostictus (Okunishi et al., 2012) и такое же смещение на север Атлантики у Scomber scombrus (Bruge et al., 2016). В результате повышения температуры вод океанов отмечены также заметные изменения в структуре сообществ рыб у побережья Канады (Hutchings et al., 2012) и в Южно-Китайском море (Hwang, Jung, 2012), изменения в структуре уловов рыб в Атлантике (Teixeira et al., 2014) и многие другие эффекты.
Являются ли описанные изменения сроков размножения тихоокеанской волосатки устойчивыми или они временные и в ближайшие годы произойдёт возврат к модели конца ХХ в., должны показать результаты дальнейшего мониторинга.
Список литературы
Гнюбкина В.П., Маркевич А.И. 2011. Эмбриональное развитие и предличинки тихоокеанской волосатки Hemitripterus villosus (Scorpaeniformes: Hemitripteridae) с замечаниями к ранее сделанным описаниям // Изв. ТИНРО. Т. 166. С. 54−60.
Гомелюк В.Е., Маркевич А.И. 1985. О прочности оболочек икры волосатой рогатки Hemitripterus villosus (Pallas) (Cottidae) // Вопр. ихтиологии. Т. 25. Вып. 4. С. 690−692.
Лучин В.А., Тихомирова Е.А. 2010. Межгодовая изменчивость температуры воды в заливе Петра Великого (Японское море) // Изв. ТИНРО. Т. 163. С. 338−348.
Маркевич А.И. 2000. Размножение костистой рыбы Hemitripterus villosus в заливе Петра Великого Японского моря // Биология моря. Т. 26. № 4. С. 272−274.
Маркевич А.И. 2007. Влияние климатических изменений на размножение тихоокеанской волосатки Hemitripterus villosus (Osteichthyes: Hemitripteridae) в Дальневосточном морском заповеднике // Матер. VIII Дальневост. конф. по заповедному делу. Т. 2. Благовещенск: Изд-во АФ БСИ ДВО РАН; БГПУ. С. 150−153.
Маркевич А.И. 2011. Влияние температуры воды и глубины на размножение рыб – тихоокеанской волосатки Hemitripterus villosus и южного однопëрого терпуга Pleurogrammus azonus в Дальневосточном морском биосферном заповеднике // Биота и среда заповедников Дальнего Востока. № 1. С. 121−133.
Маркевич А.И. 2016. Динамика размножения тихоокеанской волосатки Hemitripterus villosus (Actinopteri: Scorpaeniformes: Hemitripteridae) в Дальневосточном морском заповеднике – отклик на температурные изменения // Морские биологические исследования: достижения и перспективы. Т. 1. Севастополь: ЭКОСИ−Гидрофизика. С. 208−211.
Милейковский С.А. 1970. Зависимость размножения и нереста морских шельфовых донных беспозвоночных от температуры воды // Тр. ИО АН СССР. Т. 88. Экология и распределение морской донной фауны и флоры. С. 113−149.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2011. Рыбы залива Петра Великого. Владивосток: Дальнаука, 431 с.
Шульман Г.Е., Никольский В.Н., Юнева Т.В. и др. 2007. Воздействие глобальных климатических и региональных факторов на мелких пелагических рыб Черного моря // Мор. экол. журн. Т. 6. № 4. С. 18−30.
Abraham J.P., Baringer M., Bindoff N.L. et al. 2013. A review of global ocean temperature observations: implications for ocean heat content estimates and climate change // Rev. Geophys. V. 51. P. 450−483.
Bruge A., Alvarez P., Fontan A. et al. 2016. Thermal niche tracking and future distribution of Atlantic mackerel spawning in response to ocean warming // Front. Mar. Sci. V. 3. № 86. P. 1−13. doi 10.3389/fmars.2016.00086
Danilowicz B.S. 1995. The role of temperature in spawning of the damselfish Dascillus albisella // Bull. Mar. Sci. V. 54. № 3. P. 624−636.
Goreau T.J., Hayed P.M. 1994. Coral bleaching and ocean “Hot spots” // Ambio. V. 23. P. 176−180.
Hutchings J.A., Côte I.M., Dodson J.J. et al. 2012. Climate change, fisheries, and aquaculture: trends and consequences for Canadian biodiversity // Environ. Rev. V. 20. № 4. P. 220−311. doi 10.1139/a2012-011
Hwang K., Jung S. 2012. Decadal changes in fish assemblages in waters near the Ieodo ocean research station (East China Sea) in relation to climate change from 1984 to 2010 // Ocean Sci. J. V. 47. № 2. P. 83−94. doi 10.1007/s12601-012-0009-3
Kyushin K. 1968. The embryonic development and larval stages of Hemitripterus villosus (Pallas) // Bull. Fac. Fish. Hokkaido Univ. V. 18. № 4. P. 277−289.
Munehara H. 1996. Sperm transfer during copulation in the marine sculpin Hemitripterus villosus (Pisces, Scorpaeniformes) by means of a retractable genital duct and ovarian secretion in females // Copeia. № 2. P. 452−454.
Okunishi T., Ito S., Hashioka T. et al. 2012. Impacts of climate change on growth, migration and recruitment success of Japanese sardine (Sardinops melanostictus) in the western North Pacific // Climatic Change. V. 115. P. 485−503. doi 10.1007/s10584-012-0484-7
Perry A.I., Low P.J., Ellis J.R. et al. 2005. Climate change and distribution shifts in marine fishes // Science. V. 308. P. 1912−1915. doi 10.1126/science.1111322
Teixeira C.M., Gamito R., Leităo F. et al. 2014. Trends in landings of fish species potentially affected by climate change in Portuguese fisheries // Reg. Environ. Change. V. 14. № 2. P. 657−659. doi 10.1007/s10113-013-0524-5
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


