Вопросы ихтиологии, 2019, T. 59, № 1, стр. 54-59
Особенности питания бурого морского петушка Alectrias alectrolophus (Stichaeidae) в Авачинской губе (Восточная Камчатка)
М. Ю. Мурашева 1, 2, *, А. М. Токранов 1
1 Камчатский филиал Тихоокеанского института географии Дальневосточного отделения РАН – КФ ТИГ
Петропавловск-Камчатский, Россия
2 Камчатский государственный университет
Петропавловск-Камчатский, Россия
* E-mail: rossiavaslubit@gmail.com
Поступила в редакцию 03.11.2017
После доработки 01.03.2018
Принята к публикации 15.01.2018
Аннотация
Приведены сведения о питании бурого морского петушка Alectrias alectrolophus в Авачинской губе (Восточная Камчатка): рассмотрены сезонные, локальные, возрастные и межгодовые изменения состава его пищи. Данный вид является бентофагом, его основными объектами в Авачинской губе являются бокоплавы (Amphipoda).
Бурый морской петушок Alectrias alectrolophus – широкобореальный приазиатский вид, распространённый в северо-западной части Тихого океана (Андрияшев, 1954; Линдберг, Красюкова, 1975; Федоров и др., 2003). Эта рыба небольшого размера, максимальная длина которой не превышает 15 см (Черешнев и др., 2001). В Авачинской губе, как и в большинстве районов своего обитания, бурый морской петушок считается обычным представителем ихтиофауны (Popov, 1933; Токранов, Шейко, 2015). Это типично литоральный вид (хотя известны его находки на глубине до 100 м), который в период открытой воды постоянно держится в приливно-отливной зоне, оставаясь здесь в укрытиях под камнями и в лужах во время отливов. Особенно многочислен в литоральной зоне бухт с галечно-щебнистым дном (Андрияшев, 1954). Хотя численность петушка повсеместно довольно высока, сведения о его питании в дальневосточных морях немногочисленны (Андрияшев, 1954; Цурпало, 1993; Чегодаева, 2005; Колпаков, Милованкин, 2014), а в Авачинской губе ограничиваются лишь краткой информацией (Виноградов, 1946 – цит. по: Токранов, Шейко, 2015; Токранов, 2014; Мурашева, Токранов, 2017).
Цель данной работы — дать характеристику особенностей питания бурого морского петушка в Авачинской губе.
МАТЕРИАЛ И МЕТОДИКА
Материал по питанию бурого морского петушка собран в мае–сентябре 2014–2016 гг. на двух участках приливно-отливной зоны северо-восточной части Авачинской губы (рис. 1). Первый из них, обследование которого выполняли регулярно в течение трёх лет, расположен вблизи пос. Сероглазка рядом с местом базирования рыболовецких судов; второй, где сборы проводили лишь в 2016 г., – в центре г. Петропавловск-Камчатский у сопки Никольская. Рыб отлавливали руками под камнями в приливно-отливных лужах во время максимальных отливов и фиксировали в 6%-ном формалине. Анализ содержимого желудков проводили в лабораторных условиях количественно-весовым методом (Методическое пособие …, 1974). Всего обработано содержимое желудков 866 экз. бурого морского петушка полной длиной (TL) 49−143 мм в возрасте 1−7 лет. В качестве показателей, характеризующих состав его пищи и интенсивность питания, использованы частота встречаемости пищевых объектов и их относительное значение (% массы пищи), а также индекс наполнения желудков (ИНЖ, ‱) и доля пустых желудков.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По литературным данным, бурый морской петушок − бентофаг, использующий в пищу различных мелких донных беспозвоночных, в первую очередь ракообразных, моллюсков и червей (Виноградов, 1946 – цит. по: Токранов, Шейко, 2015; Андрияшев, 1954; Цурпало, 1993; Чегодаева, 2005; Колпаков, Милованкин, 2014). Результаты наших исследований свидетельствуют о том, что пищевой спектр бурого морского петушка в Авачинской губе включает представителей восьми систематических групп донных организмов. Основными объектами его питания на обоих обследованных участках в мае−сентябре являются бокоплавы (Amphipoda) − 66.2−89.1% массы пищи, среди которых доминирует анизогаммарус Тюшева Anisogammarus tiuschovi (табл. 1). Заметную долю в пище петушка в первом районе занимают также зелёные водоросли рода Spirogira, а во втором − брюхоногие моллюски рода Littorina, которых можно отнести к второстепенным пищевым объектам. Доля остальных организмов, потребляемых петушками, сравнительно незначительна. В целом состав пищевых компонентов на двух рассматриваемых участках сходен, за исключением присутствующих в рационе особей петушка вблизи пос. Сероглазка изопод Saduria entomon и личинок рыб семейства Stichaeidae.
Таблица 1.
Значение разных кормовых организмов в пище бурого морского петушка Alectrias alectrolophus в Авачинской губе в мае–сентябре 2014−2016 гг.
| Компонент пищи и другие показатели | Июнь−август 2014 г. | Июнь−июль 2015 г. | Май−сентябрь 2016 г. | Среднее | ||||
|---|---|---|---|---|---|---|---|---|
| Частота встречаемости, % | Доля, % массы |
Частота встречаемости, % | Доля, % массы |
Частота встречаемости, % | Доля, % массы |
Частота встречаемости, % | Доля, % массы |
|
| Chlorophyta | ||||||||
| Spirogira sp. | 4.5 | 1.0 | 5.0 | 14.5 | 5.0 | 7.6 | 4.8 | 7.7 |
| Polychaeta | – | – | 1.0 | 1.7 | 0.6 | 0.9 | 0.5 | 1.3 |
| Amphipoda, в том числе: | 78.9 | 89.1 | 86.0 | 65.9 | 58.4 | 72.6 | 66.9 | 75.8 |
| Anisogammarus tiuschovi | 60.5 | 84.3 | 63.0 | 63.7 | 48.0 | 66.8 | 57.1 | 71.8 |
| Anisogammarus sp. | 8.5 | 2.4 | 10.0 | 1.2 | 9.3 | 3.5 | 9.1 | 2.2 |
| прочие Amphipoda | 13.0 | 2.4 | 14.0 | 1.0 | 11.3 | 2.3 | 12.7 | 1.8 |
| Isopoda | ||||||||
| Saduria entomon | – | – | – | – | 0.7 | 0.4 | 0.5 | 0.4 |
| Bivalvia | ||||||||
| Mytilus sp. | 7.1 | 0.3 | 2.0 | 4.2 | 4.2 | 3.8 | 4.7 | 2.8 |
| Gastropoda | ||||||||
| Littorina sp. | 17.9 | 8.4 | 3.0 | 11.2 | 8.5 | 13.2 | 10.3 | 10.9 |
| Chironomidae (larvae) | – | – | – | – | 1.3 | 1.1 | 0.8 | 1.1 |
| Pisces (juv.) | ||||||||
| Alectrias alectrolophus (?) | 2.2 | 1.2 | 1.0 | 2.5 | – | – | 0.7 | 1.8 |
| Pisces (ova) | – | – | – | – | 0.4 | 0.4 | 0.2 | 0.4 |
| Индекс наполнения желудков, ‱ | 86.9 | 116.6 | 92.1 | 91.6 | ||||
| Доля пустых желудков, % | 14.4 | 14.0 | 28.4 | 23.1 | ||||
| Число рыб, экз. | 223 | 100 | 543 | 866 | ||||
Выявлены некоторые сезонные изменения потребления петушками отдельных групп организмов (табл. 2). Для рыб на первом участке наибольшее разнообразие пищевых компонентов наблюдалось в мае, тогда как в остальные месяцы отмечено значительное сужение спектра питания, который в целом становится сходным с таковым у рыб на втором участке в июне–сентябре. Интересно, что икра рыб присутствует в рационе бурого морского петушка в первом районе весной, а во втором − осенью. С мая по август для петушков из обоих районов характерно снижение потребления мидий Mytilus sp. и наличие в пище только в июле личинок комаров (Tendipedidae = Chironomidae).
Таблица 2.
Сезонные изменения состава пищи бурого морского петушка Alectrias alectrolophus на двух обследованных участках Авачинской губы в 2016 г., % массы пищи
| Компонент пищи и другие показатели | Вблизи пос. Сероглазка (район 1) | У сопки Никольская (район 2) | ||||||
|---|---|---|---|---|---|---|---|---|
| Май | Июнь | Июль | Август | Июнь | Июль | Август | Сентябрь | |
| Водоросли рода Spirogira | 11.2 | 5.1 | 4.3 | 14.0 | 11.4 | 5.7 | 4.2 | – |
| Polychaeta | 3.7 | – | – | – | – | – | 2.1 | 1.5 |
| Amphipoda | 74.2 | 87.2 | 85.3 | 76.7 | 68.6 | 71.7 | 66.2 | 71.6 |
| Isopoda | 1.9 | – | – | 1.6 | – | – | – | – |
| Bivalvia | 5.2 | 5.1 | 3.7 | – | 7.9 | 5.6 | 4.2 | 3.1 |
| Gastropoda | 1.9 | 2.6 | 5.0 | 7.7 | 12.1 | 12.5 | 23.3 | 22.3 |
| Chironomidae (larvae) | – | – | 1.7 | – | – | 4.5 | – | – |
| Pisces (ova) | 1.9 | – | – | – | – | – | – | 1.5 |
| Индекс наполнения желудков, ‱ | 103.6 | 75.5 | 76.5 | 93.8 | 109.9 | 71.8 | 98.2 | 89.2 |
| Доля пустых желудков, % | 35.7 | 44.0 | 30.0 | 41.7 | 30.0 | 28.0 | 12.2 | 19.5 |
| Число рыб, экз. | 56 | 50 | 50 | 60 | 100 | 50 | 90 | 87 |
Межгодовая изменчивость состава пищи бурого морского петушка невелика. На участке вблизи пос. Сероглазка на протяжении всех трёх лет исследования основными объектами его питания были бокоплавы, менялся лишь состав второстепенных компонентов (табл. 1): в 2014 г. на втором месте в рационе были брюхоногие моллюски рода Littorina, в 2015−2016 гг. их место заняли зелёные водоросли рода Spirogira, а моллюски переместились на третье.
Особенностью питания бурого морского петушка в Авачинской губе, которую ранее никто никогда не отмечал в других местах его обитания, является потребление в отдельные годы в первой половине июня молоди рыб семейства Stichaeidae. Несмотря на значительную степень переваренности, по нашему определению, это осевшие на дно личинки собственного вида (Токранов, 2014; Мурашева, Токранов, 2017). Так, в июне 2014 г. в желудках пяти наиболее крупных особей петушка TL 61−96 мм были обнаружены восемь мальков длиной 14−19 мм; в июне 2015 г. в желудке петушка TL 64 мм − 1 экз. длиной 15 мм. Возможно, это обусловлено достаточно высокой концентрацией личинок бурого морского петушка, длина которых соизмерима с таковой других пищевых объектов в приливно-отливной зоне в июне. По данным Виноградова (Виноградов, 1946 – цит. по: Токранов, Шейко, 2015), нерест петушка проходит в апреле, к началу июня завершается пелагическая стадия развития и личинки переходят к донному образу жизни на литорали. В дальнейшем по мере роста подвижность мальков повышается, они приобретают способность лучше скрываться в убежищах на дне и, очевидно, становятся недоступными как кормовые объекты для своих более крупных собратьев.
Степень наполнения желудков петушка в 2014−2016 гг. свидетельствует о достаточно высокой интенсивности питания: средний индекс наполнения желудков составлял 91.6‱ (табл. 1), заметно превышая значения этого показателя у бурого петушка из зал. Ольги Японского моря – 59.1−77.3‱ (Колпаков, Милованкин, 2014). В исследованных районах Авачинской губы в разные месяцы 2016 г. ИНЖ изменялся незначительно – 71.8−109.9‱ (табл. 2) – в отличие от литорали бухт о-ва Шикотан (Южные Курилы), где этот показатель варьировал от 13.4 до 720.7‱ (Цурпало, 1993).
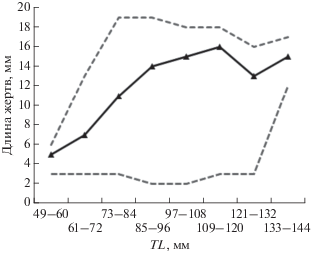
С увеличением размера бурого морского петушка доля основного объекта питания (бокоплавов) в его рационе уменьшается, а потребление брюхоногих моллюсков возрастает с 7.6% массы пищи у наиболее мелких экземпляров (TL < 80 мм) в возрасте 1−2 года до 13.2% у самых крупных (TL > 110 мм) в возрасте 5 лет и старше (рис. 2). Кроме того, по мере роста увеличиваются и размеры потребляемых бокоплавов: если у молоди TL 49–60 мм их длина составляет в среднем 5 мм, то у взрослых рыб (TL > 110 мм) – 13−16 мм (рис. 3). Эти различия в величине потребляемых бокоплавов, очевидно, снижают пищевую конкуренцию между особями бурого морского петушка разных размерных групп, обитающих в одном биотопе. Подобная закономерность отмечена у многих видов рыб (Токранов, 1998, 2000, 2001, 2014).
Рис. 2.
Состав пищи разных размерных групп бурого морского петушка Alectrias alectrolophus (май−сентябрь 2016 г.): (◼) – Amphipoda, (◼) − Gastropoda, (◻) − водоросли рода Spirogira, ( ) − прочие.
) − прочие.
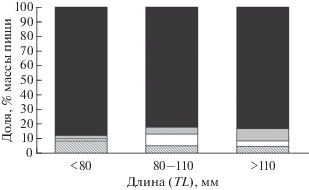
Рис. 3.
Размер бокоплавов в пище особей бурого морского петушка Alectrias alectrolophus разной длины (TL): (−▲−) – среднее значение, (- -) – пределы варьирования.
Состав пищи самок и самцов бурого морского петушка сходен, о чём наглядно свидетельствуют значения индексов пищевого сходства (88.2% на участке вблизи пос. Сероглазка и 93.3% – у сопки Никольская), хотя интенсивность питания самок на обоих участках выше (табл. 3). Правда, некоторые кормовые организмы присутствуют в пище либо самцов (в первом районе – Isopoda, а во втором – Polychaeta), либо самок (например, Gastropoda в первом районе).
Таблица 3.
Состав пищи самок и самцов бурого морского петушка Alectrias alectrolophus в Авачинской губе в мае–сентябре 2016 г., % массы
| Компонент пищи и другие показатели | Вблизи пос. Сероглазка (район 1) | У сопки Никольская (район 2) | ||
|---|---|---|---|---|
| Самки | Самцы | Самки | Самцы | |
| Водоросли рода Spirogira | 10.5 | 12.3 | 13.5 | 11.0 |
| Polychaeta | 1.8 | 2.1 | – | 1.5 |
| Amphipoda | 65.8 | 68.9 | 65.1 | 69.8 |
| Isopoda | – | 1.8 | – | – |
| Gastropoda | 11.8 | – | 9.7 | 10.2 |
| Прочие | 10.1 | 14.9 | 11.7 | 7.5 |
| Индекс наполнения желудков, ‱ | 93.9 | 78.5 | 100.8 | 96.9 |
| Доля пустых желудков, % | 21.1 | 19.8 | 37.3 | 30.5 |
| Число рыб, экз. | 95 | 121 | 150 | 177 |
Полученная нами информация позволяет сравнить состав доминирующих пищевых организмов бурого морского петушка в Авачинской губе в первой половине XX и в начале XXI вв. По материалам Виноградова (Виноградов, 1946 – цит. по: Токранов, Шейко, 2015), главными кормовыми объектами этого вида здесь в 1930-е гг. являлись многощетинковые черви (преимущественно Eteone longa) и брюхоногие моллюски рода Littorina. По нашим данным, в настоящее время основу его пищи на обследованных участках литорали составляют бокоплавы, тогда как доля многощетинковых червей не превышает 3−4%. Одна из возможных причин этого – разные районы сбора материала, а также то, что мы отлавливали петушков исключительно в литоральных лужах в период максимальных отливов, тогда как Виноградов ловил их также в зоне прибрежного мелководья на глубинах до 5 м. Не исключено, что замена доминирующего кормового организма у бурого петушка в Авачинской губе обусловлена ростом численности бокоплавов в прибрежье в результате значительного увеличения во второй половине XX в. антропогенного загрязнения прибрежной зоны данного водоёма органическими отходами, содержащимися в промышленных и бытовых стоках.
По данным литературы (Цурпало, 1993; Чегодаева, 2005; Колпаков, Милованкин, 2014), основными пищевыми объектами бурого морского петушка в разных районах дальневосточных морей везде служат такие донные беспозвоночные, как бокоплавы, брюхоногие моллюски и многощетинковые черви. Однако в отличие от прибрежных вод о-ва Шикотан (Цурпало, 1993), Тауйской губы Охотского моря (Чегодаева, 2005) и зал. Ольги Японского моря (Колпаков, Милованкин, 2014) доля многощетинковых червей в пище бурого морского петушка в Авачинской губе не превышает 3−4% массы, а основными объектами питания являются бокоплавы. Также, несмотря на значительный объём обработанного материала, в желудках бурого петушка в Авачинской губе в 2014−2016 гг. мы ни разу не обнаружили веслоногих ракообразных (Copepoda) и каких-либо других пелагических организмов, отмеченных в незначительном количестве в составе пищи данного вида в зал. Ольги Японского моря (Колпаков, Милованкин, 2014). По-видимому, это обусловлено тем, что наши материалы собраны исключительно на литорали в приливно-отливных лужах, тогда как в зал. Ольги бурого петушка для исследований питания отлавливали сачком на глубинах от 0.5 до 1.5 м в поясе водорослей-макрофитов (Колпаков, Милованкин, 2014), где могут встречаться некоторые представители зоопланктона, в том числе веслоногие ракообразные.
ВЫВОДЫ
1. Пищевой спектр бурого морского петушка в Авачинской губе довольно узок и включает представителей восьми крупных таксонов донных животных и зелёные водоросли рода Spirogira. Основными объектами его питания с мая по сентябрь служат бокоплавы (66.2−89.1% массы пищи), среди которых доминирует Anisogammarus tiuschovi.
2. Межгодовые, сезонные, локальные, возрастные и половые изменения состава пищи у бурого морского петушка Авачинской губы выражены незначительно.
3. Особенностью питания бурого морского петушка в Авачинской губе в отличие от прибрежных вод о-ва Шикотан, Тауйской губы Охотского моря и зал. Ольги Японского моря является незначительное потребление многощетинковых червей, доля которых не превышает 3−4% массы пищи.
Список литературы
Андрияшев А.П. 1954. Рыбы северных морей СССР. М.; Л.: Изд-во АН СССР, 566 с.
Колпаков Е.В., Милованкин П.Г. 2014. Размерно-возрастной состав, рост и питание бурого морского петушка Alectrias alectrolophus (Pisces: Stichaeidae) из залива Ольга Японского моря // Вопр. ихтиологии. Т. 54. № 3. С. 372−376. doi 10.7868/S0042875214030084
Линдберг Г.У., Красюкова З.В. 1975. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 4. Teleostomi. XXIX. Perciformes. Blennioidei. Gobioidei. Л.: Наука, 463 с.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. 1974. М.: Наука, 254 с.
Мурашева М.Ю., Токранов А.М. 2017. Биологическая характеристика бурого морского петушка Alectrias alectrolophus (Stichaeidae) Авачинской губы (восточная Камчатка) // V Всерос. науч. конф. “Водные биоресурсы, аквакультура и экология водоёмов”. Калининград: Изд-во КГТУ. С. 38−42.
Токранов А.М. 1998. Некоторые вопросы биологии Icelus perminovi Taranetz и I.canaliculatus Gilbert (Cottidae, Pisces) в тихоокеанских водах северных Курильских островов // Бюл. МОИП. Отд. биол. Т. 103. Вып. 3. С. 21−24.
Токранов А.М. 2000. Распределение и некоторые черты биологии черноперой глубоководной лисички Bathyagonus nigripinnis (Agonidae) в тихоокеанских водах юго-восточной Камчатки и северных Курильских островов // Вопр. ихтиологии. Т. 40. № 5. С. 614−620.
Токранов А.М. 2001. Некоторые черты биологии черноперого крючкорога Artediellichthys nigripinnis (Cottidae) в тихоокеанских водах северных Курильских островов и юго-восточной Камчатки // Там же. Т. 41. № 5. С. 615−619.
Токранов А.М. 2014. Некоторые черты биологии бурого морского петушка Alectrias alectrolophus (Stichaeidae) Авачинской бухты (восточная Камчатка) // Тез. докл. ХV Mеждунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 209–213.
Токранов А.М., Шейко Б.А. 2015. Современный состав ихтиофауны Авачинской губы (Юго-Восточная Камчатка) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 36. С. 48−54. doi 10.15853/2072-8212.2015.36.48-54
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. 2003. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука, 204 с.
Цурпало А.П. 1993. Трофические характеристики литоральных рыб Alectrias alectrolophus и Stichaeopsis nana (Stichaeidae) о-ва Шикотан (Курильские острова) // Вопр. ихтиологии. Т. 33. Вып. 2. С. 309–312.
Чегодаева Е.А. 2005. Новые данные по морфологии и биологии морского петушка Alectrias alectrolophus (Stichaeidae) Тауйской губы Охотского моря // Матер. VI науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 164–168.
Черешнев И.А., Волобуев В.В., Хованский И.Е., Шестаков А.В. 2001. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука, 197 с.
Popov A.M. 1933. Fishes of Avatcha Bay on the southern coast of Kamtchatka // Copeia. № 2. P. 59–67.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии