Вопросы ихтиологии, 2019, T. 59, № 1, стр. 94-102
Межгодовая изменчивость содержания липидов и жирных кислот у азовской хамсы Engraulis encrasicolus maeoticus (Engraulidae) в период современного осолонения Азовского моря
Т. В. Юнева 1, *, В. Н. Никольский 1, С. А. Забелинский 2, А. М. Щепкина 1, Л. И. Булли 3, Г. Е. Шульман 1
1 Институт морских биологических исследований РАН – ИМБИ
Республика Крым, Севастополь, Россия
2 Институт эволюционной физиологии и биохимии РАН – ИЭФиБ
Санкт-Петербург, Россия
3 Керченский государственный морской технологический университет – КГМТУ
Республика Крым, Керчь, Россия
* E-mail: yunev@mail.ru
Поступила в редакцию 09.09.2017
После доработки 23.11.2018
Принята к публикации 26.10.2018
Аннотация
Исследовали обеспеченность пищей азовской хамсы Engraulis encrasicolus maeoticus в 2006−2013 гг., когда солёность Азовского моря повышалась с 9.3 до 12.6‰. Об обеспеченности пищей судили по накоплению липидов и незаменимых полиненасыщенных жирных кислот (эйкозапентаеновой и докозагексаеновой) в теле хамсы при завершении нагула (октябрь−ноябрь). Содержание суммарных липидов в теле хамсы по мере осолонения моря увеличилось с 15.5 до 18.0−18.7% за счёт содержания триацилглицеринов; абсолютное содержание эйкозапентаеновой и докозагексаеновой кислоты − соответственно в 1.9 и 2.6 раза (с 576 до 1091 и с 594 до 1540 мг/100 г сырой массы). Одновременно многократно возросли запасы хамсы, что также указывает на значительное улучшение обеспеченности рыб пищей. Отмечено изменение качественного состава пищи хамсы в сторону преобладания в ней черноморских мигрантов и увеличение в рационе доли животной пищи. Рассматривается связь между межгодовой изменчивостью обеспеченности пищей хамсы в 2006−2013 гг. и запасами её основных трофических конкурентов в Азовском море – тюльки Clupeonella delicatula delicatula и гребневика мнемиопсиса Mnemiopsis leidyi.
Азовская хамса Engraulis encrasicolus maeoticus обитает в морях с разной солёностью – Азовском и Чёрном. В богатом пищевыми ресурсами Азовском море хамса нерестится с мая по август и нагуливается с августа по октябрь (Световидов, 1964). В период нереста и нагула хамса питается любой доступной животной пищей (Бокова, 1955; Корнилова, 1955; Дементьева, 1959; Будниченко, Фирулина, 1998; Rogov et al., 2004), а при её недостатке потребляет фитопланктон и даже детрит (Михман, Романович, 1977; Чащина, 2001). К окончанию нагула жирность хамсы многократно увеличивается (Шульман, 1972), она образует скопления и с понижением температуры воды до 12–14°С мигрирует в Чёрное море, где зимует у берегов Крыма или Кавказа (Chashchin et al., 2015). Готовность хамсы к началу зимовальных миграций, плотность миграционных и зимовальных скоплений, выживание на зимовке зависят от уровня накопления липидов в теле рыб в период нагула (Шульман, 1972). Запасы хамсы в Азовском море в начале 2000-х гг. не превышали 100 тыс. т., а с 2007 по 2011 г. возросли до беспрецедентной величины (650 тыс. т) и сохранялись на высоком уровне в последующие годы (Chashchin et al., 2015). Увеличение запасов хамсы по времени совпало с достаточно резким повышением солёности Азовского моря с 9.3‰ в 2006 г. до 12.6‰ – в 2013 г. (Косенко, 2016).
Можно предположить, что изменения в экосистеме Азовского моря, связанные с его осолонением, оказали положительное влияние на состояние кормовой базы эврибионтной хамсы в период нереста и нагула, что способствовало увеличению её запасов. Для проверки данной гипотезы представлялось важным исследовать обеспеченность хамсы пищей начиная с 2006 г., когда солёность Азовского моря и запасы рыб находились на минимальном уровне, до 2013 г., когда оба показателя значительно увеличились. Индикаторами обеспеченности пищей могут служить содержание в теле рыб липидов и жирных кислот в период завершения нагула (Shulman, Love, 1999). Среди жирных кислот в составе липидов особого внимания заслуживают полиненасыщенные жирные кислоты (ПНЖК) семейства омега-3 − эйкозапентаеновая (ЭПК, С20:5n3) и докозагексаеновая (ДГК, С22:6n3)11 (Sargent, Henderson, 1995; Iverson et al., 2004). В организме морских рыб эти кислоты не синтезируются из метаболических предшественников, но необходимы для нормальной жизнедеятельности (Arts, Kohler, 2009; Parrish, 2009). В морских экосистемах ЭПК и ДГК синтезируются только фитопланктоном, а затем передаются по пищевой цепи рыбам (Dalsgaard et al., 2003). Их содержание в пище рыб зависит от видового состава планктонного сообщества (St. John, Lund, 1996; Litzow et al., 2006; Arts, Kohler, 2009; Parrish, 2009).
На основании представлений о липидном метаболизме (Tocher, 2003) в экспериментах по питанию и во время полевых наблюдений было показано, что индикаторами качественного состава потребляемой пищи могут служить жирнокислотные трофические индексы − соотношение суммарного содержания ПНЖК n3 к суммарному содержанию ПНЖК n6 и соотношение между содержанием ДГК и ЭПК (Dalsgaard et al., 2003; Iverson, 2009). В морских пищевых цепях синтезируются главным образом ПНЖК семейства n3, тогда как в пресноводных – n6 (Henderson, Tocher, 1987; Sargent, Henderson, 1995). Величина отношения ∑n3/∑n6 жирных кислот в резервных липидах пресноводных рыб составляет 1.1–3.3, морских рыб − 8.3−11.3, у солоноватоводных имеет промежуточное значение (Henderson, Tocher, 1987); т.е. увеличение ∑n3/∑n6 в липидах может указывать на изменения состава пищи в сторону преобладания в ней галофильных организмов. Соотношение между ДГК и ЭПК (ДГК/ЭПК) в резервных липидах указывает на преобладание доли животной или растительной пищи в рационе потребителей. Например, питание рыб фитопланктоном приводит к преобладанию ЭПК над ДГК, а питание животной пищей, напротив, к преобладанию ДГК (Sargent et al., 2002; Dalsgaard et al., 2003).
Цель настоящей работы – исследовать динамику содержания суммарных липидов, триацилглицеринов и жирных кислот в теле азовской хамсы, на основе этих данных оценить изменчивость качественного состава её пищи в период современного осолонения Азовского моря (2006−2013 гг.), а также проанализировать связь между этими показателями и величинами запасов хамсы и её основных трофических конкурентов – тюльки Clupeonella delicatula delicatula и гребневика мнемиопсиса Mnemiopsis leidyi.
МАТЕРИАЛ И МЕТОДИКА
Хамсу отбирали из уловов ставных неводов и тралов в Азовском море и Керченском проливе в период завершения нагула – во второй половине октября–ноябре 2006−2013 гг. Из каждого улова отбирали по 200 экз., измеряли длину по Смитту (FL) и разделяли на размерные группы с интервалом 5 мм. Для анализа использовали рыб трёх наиболее массовых групп, общая численность которых обычно составляла более 70% выборки. Определяли среднюю массу рыб в группах. Рыб каждой группы измельчали в блэндере целиком, пробы фарша массой 0.5 г использовали для определения содержания суммарных липидов (СЛ, % сырой массы), доли в них триацилглицеринов (ТАГ, % СЛ), состава и содержания жирных кислот в ТАГ (% суммы жирных кислот), как подробно описано ранее (Юнева и др., 2016). Абсолютное содержание незаменимых жирных кислот ЭПК и ДГК в теле рыб рассчитывали в мг/100 г сырой массы (Litzow et al., 2006). О потенциальном влиянии осолонения моря на изменение состава пищи хамсы судили по величине жирнокислотного индекса ∑n3/∑n6 (Henderson, Tocher, 1987). Для оценки соотношения в рационе хамсы животной и растительной пищи рассчитывали индекс ДГК/ЭПК (Dalsgaard et al., 2003). Величина ДГК/ЭПК > 1 в резервных липидах указывает на преобладание в рационе животной пищи, <1 – растительной.
Статистическую обработку полученных данных выполняли с применением стандартных процедур пакета Microsoft® Office Excel.
РЕЗУЛЬТАТЫ
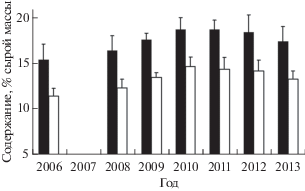
В 2006–2013 гг. средняя длина и средняя масса хамсы в выборках варьировали в пределах 85.6–97.2 мм и 6.0–8.4 г; максимальные размеры отмечены в 2006 г., минимальные – в 2011 г. (табл. 1). Содержание СЛ в теле рыб, напротив, было минимальным (15.5% сырой массы) в 2006 г. и увеличилось до 18.7% в 2010−2011 гг., после чего менялось незначительно. Несмотря на большую внутригодовую вариабельность содержание СЛ характеризуется существенной (> 1/3 общей дисперсии) и статистически достоверной (p < 0.001) межгодовой изменчивостью (табл. 2). Содержание резервных липидов (ТАГ), на долю которых приходилось 73.9–77.5% СЛ, менялось от 11.8 до 14.2% сырой массы тела и практически повторяло (R2 = 0.82) динамику содержания СЛ (рис. 1).
Таблица 1.
Длина, масса азовской хамсы Engraulis encrasicolus maeoticus и содержание суммарных липидов и триацилглицеринов (M ± SD) в её теле в октябре–ноябре 2006–2013 гг.
| Годы | Число проб | Длина (FL), мм | Масса, г | Суммарные липиды (СЛ), % сырой массы | Триацилглицерины, % СЛ |
|---|---|---|---|---|---|
| 2006 | 8 | 97.2 ± 0.1 | 8.4 ± 0.1 | 15.5 ± 1.7 | 73.9 ± 0.9 |
| 2008 | 12 | 90.8 ± 2.4 | 7.6 ± 0.8 | 16.4 ± 1.6 | 75.2 ± 1.5 |
| 2009 | 8 | 89.7 ± 1.3 | 6.7 ± 0.4 | 17.6 ± 0.7 | 76.5 ± 0.7 |
| 2010 | 27 | 87.3 ± 1.6 | 6.6 ± 0.3 | 18.7 ± 1.3 | 77.5 ± 1.3 |
| 2011 | 9 | 85.6 ± 3.5 | 6.0 ± 0.6 | 18.7 ± 1.0 | 77.5 ± 1.0 |
| 2012 | 9 | 91.0 ± 2.0 | 6.6 ± 0.5 | 18.4 ± 1.9 | 77.2 ± 1.9 |
| 2013 | 18 | 90.1 ± 2.7 | 6.7 ± 0.3 | 17.4 ± 1.6 | 76.2 ± 1.6 |
| 2006−2009 | 28 | 91.8 ± 3.6 | 7.5 ± 0.9 | 16.4 ± 1.5 | 75.2 ± 1.5 |
| 2010−2013 | 63 | 88.5 ± 2.9 | 6.4 ± 0.5 | 18.3 ± 1.6 | 77.1 ± 1.5 |
Примечание. Здесь и в табл. 3: M ± SD – среднее значение показателя и среднее квадратичное отклонение.
Таблица 2.
Результаты дисперсионного анализа межгодовой изменчивости содержания суммарных липидов в теле хамсы Engraulis encrasicolus maeoticus в октябре–ноябре 2006–2013 гг.
| Источник дисперсии | Сумма квадратов отклонений | Число степеней свободы | Средний квадрат | F | Fкр. | p |
|---|---|---|---|---|---|---|
| Между годами | 103.4 | 6 | 17.2 | 8.19 | 2.21 | <0.001 |
| Внутригодовая | 176.7 | 84 | 2.1 | |||
| Общая | 280.1 | 90 |
Рис. 1.
Содержание суммарных липидов (◼) и триацилглицеринов (◻) в теле азовской хамсы Engraulis encrasicolus maeoticus в октябре–ноябре 2006, 2008–2013 гг.; (I) − среднеквадратичное отклонение.
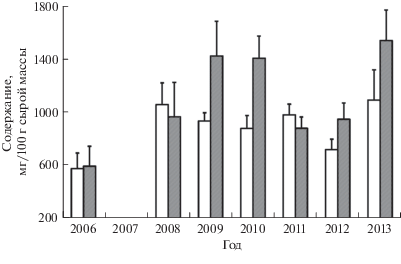
Данные по жирнокислотному составу ТАГ хамсы в октябре–ноябре 2006−2013 гг. представлены в табл. 3. Доля насыщенных жирных кислот (НЖК) составляла 33.1–39.0% суммы всех ЖК. Среди НЖК доминировала пальмитиновая (16:0) кислота (22.4–26.5%). Содержание кислот 14:0 и 18:0 составляло соответственно 4.8–7.6 и 4.2–5.3%. Суммарное содержание мононенасыщенных жирных кислот (МНЖК) менялось от 39.7% в 2006 г. до 31.2% в 2013 г. преимущественно за счёт уменьшения содержания доминирующей среди МНЖК олеиновой кислоты (18:1). Содержание ПНЖК, напротив, увеличивалось от 23.0% в 2006 г. до 33.6% в 2013 г. за счёт увеличения доли кислот n3 (∑n3). Суммарное содержание ПНЖК n6 (∑n6) характеризовалось относительным постоянством. Соответственно, индекс ∑n3/∑n6 увеличился с 2.8 в 2006 г. до 4.2–5.0 в последующие годы. Среди ПНЖК n3 преобладали ДГК и ЭПК, содержание которых варьировало в пределах соответственно 5.7−12.3 и 4.9–9.1% суммы жирных кислот, с минимальными величинами в 2006 г. и максимальными − в 2013 г. Значительной межгодовой изменчивостью характеризовался индекс ДГК/ЭПК. В 2006 и 2008 гг. его значения были близки к единице, а в последующие годы составляли 1.3–1.6; исключением является 2011 г. (<1). Абсолютное содержание ЭПК и ДГК в исследуемый период постепенно увеличилось соответственно с 576 до 1091 и с 594 до 1540 мг/100 г сырой массы (рис. 2).
Таблица 3.
Содержание жирных кислот (% суммы жирных кислот) в триацилглицеринах (M ± SD) азовской хамсы Engraulis encrasicolus maeoticus в октябре–ноябре 2006−2013 гг.
| Жирная кислота | Год | ||||||
|---|---|---|---|---|---|---|---|
| 2006 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | |
| C14:0 | 6.3 ± 0.4 | 5.8 ± 0.8 | 5.6 ± 0.8 | 4.8 ± 0.4 | 7.6 ± 0.5 | 7.3 ± 0.4 | 6.5 ± 0.3 |
| C16:0 | 26.2 ± 0.8 | 23.8 ± 0.8 | 22.4 ± 1.1 | 24.2 ± 1.5 | 24.5 ± 1.4 | 26.5 ± 0.8 | 23.8 ± 0.9 |
| C18:0 | 5.1 ± 0.3 | 5.0 ± 0.2 | 5.1 ± 0.4 | 4.6 ± 0.6 | 5.3 ± 0.3 | 5.2 ± 0.4 | 4.2 ± 0.3 |
| Σ НЖК | 37.6 ± 1.6 | 34.6 ± 1.7 | 33.1 ± 1.5 | 33.6 ± 1.8 | 37.5 ± 0.3 | 39.0 ± 0.6 | 34.5 ± 1.3 |
| C14:1 | 0.8 ± 0.1 | 0.4 ± 0.0 | 0.3 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.1 | 0.6 ± 0.0 | 0.6 ± 0.1 |
| C16:1 | 9.7 ± 0.4 | 9.9 ± 1.5 | 8.8 ± 0.4 | 8.3 ± 0.9 | 10.3 ± 0.3 | 10.4 ± 0.4 | 10.4 ± 0.4 |
| C18:1 | 26.0 ± 0.9 | 24.4 ± 1.0 | 22.9 ± 1.2 | 22.0 ± 1.3 | 23.6 ± 0.7 | 18.7 ± 1.0 | 18.6 ± 1.1 |
| C20:1n9 | 3.3 ± 0.5 | 1.9 ± 0.4 | 2.4 ± 0.1 | 2.0 ± 0.1 | 1.8 ± 0.2 | 1.8 ± 0.2 | 1.7 ± 0.2 |
| Σ МНЖК | 39.7 ± 1.9 | 36.6 ± 3.1 | 34.4 ± 0.8 | 32.8 ± 1.5 | 36.2 ± 1.3 | 31.6 ± 1.8 | 31.2 ± 1.9 |
| С16:2n7 | 3.1 ± 0.2 | 1.6 ± 0.3 | 1.4 ± 0.1 | 1.6 ± 0.1 | 1.5 ± 0.1 | 1.2 ± 0.1 | 1.6 ± 0.3 |
| C18:2n6 | 1.9 ± 0.4 | 2.6 ± 0.3 | 2.4 ± 0.1 | 2.6 ± 0.2 | 2.3 ± 0.0 | 1.9 ± 0.2 | 2.1 ± 0.1 |
| C18:3n3 | 0.6 ± 0.0 | 0.5 ± 0.1 | 0.6 ± 0.1 | 0.4 ± 0.1 | 0.3 ± 0.0 | 0.5 ± 0.1 | 0.3 ± 0.1 |
| C18:4n3 | 1.7 ± 0.4 | 2.0 ± 0.5 | 2.5 ± 0.1 | 2.8 ± 0.4 | 2.7 ± 0.2 | 2.0 ± 0.2 | 2.2 ± 0.3 |
| C20:4n6 | 1.4 ± 0.1 | 1.7 ± 0.2 | 1.5 ± 0.2 | 1.5 ± 0.1 | 0.9 ± 0.0 | 1.0 ± 0.2 | 1.6 ± 0.2 |
| C20:4n3 | 0.5 ± 0.1 | 0.7 ± 0.0 | 0.3 ± 0.0 | 0.8 ± 0 | 0.6 ± 0.3 | 0,9 ± 0.2 | 0.9 ± 0.3 |
| C20:5n3 (ЭПК) | 4.9 ± 0.3 | 8.7 ± 0.7 | 8.4 ± 0.1 | 6.8 ± 0.4 | 7.7 ± 0.0 | 6.2 ± 0.8 | 9.1 ± 1.4 |
| C22:4n3 | 0.9 ± 0.5 | 0.5 ± 0.0 | 0.4 ± 0.1 | 0.6 ± 0.1 | 0.5 ± 0.1 | 1.0 ± 0.2 | 0.6 ± 0.3 |
| C22:4n6 | 1.0 ± 0.5 | 1.0 ± 0.8 | 0.4 ± 0.1 | 0.4 ± 0.1 | 0.5 ± 0.0 | 1.0 ± 0.7 | 0.7 ± 0.2 |
| C22:5n6 | 1.0 ± 0.4 | 0.7 ± 0.3 | 0.4 ± 0.1 | 0.5 ± 0.1 | 0.5 ± 0.0 | 1.0 ± 0.4 | 0.9 ± 0.3 |
| C22:5n3 | 0.4 ± 0.2 | 0.6 ± 0.7 | 0.5 ± 0.1 | 1.0 ± 0.2 | 0.7 ± 0.0 | 1.8 ± 0.3 | 1.3 ± 0.2 |
| C22:6n3 (ДГК) | 5.7 ± 0.7 | 7.4 ± 1.4 | 11.5 ± 0.4 | 10.9 ± 1.2 | 6.8 ± 0.3 | 8.3 ± 0.8 | 12.3 ± 1.1 |
| Σ ПНЖК | 23.0 ± 1.4 | 29.0 ± 1.9 | 31.0 ± 0.2 | 31.5 ± 1.6 | 24.5 ± 0.2 | 26.8 ± 1.5 | 33.6 ± 2.4 |
| Σ n-3 | 14.8 ± 2.3 | 20.9 ± 1.3 | 24.5 ± 1.3 | 23.3 ± 1.3 | 19.3 ± 1.3 | 20.7 ± 1.3 | 26.7 ± 1.3 |
| Σ n-6 | 5.3 ± 1.0 | 5.9 ± 1.0 | 5.1 ± 1.0 | 5.0 ± 1.0 | 4.2 ± 1.0 | 4.9 ± 1.0 | 5.0 ± 1.0 |
| Σ n3/Σ n6 | 2.80 | 3.54 | 4.80 | 4.66 | 5.00 | 4.22 | 4.68 |
| ДГК/ЭПК | 1.16 | 0.85 | 1.37 | 1.60 | 0.88 | 1.34 | 1.35 |
Рис. 2.
Содержание эйкозапентаеновой (◻) и докозагексаеновой (◼) кислоты в триацилглицеринах азовской хамсы Engraulis encrasicolus maeoticus в октябре–ноябре 2006, 2008–2013 гг.; ост. обозначения см. на рис. 1.
Значительная межгодовая вариабельность жирнокислотного состава ТАГ хамсы в исследуемый период указывает на существенные изменения в составе потребляемой пищи. О направленности таких изменений свидетельствуют изменения трофических индексов ∑n3/∑n6 ПНЖК и ДГК/ЭПК. Отношение ∑n3/∑n6 ПНЖК в резервных липидах рыб увеличивается по мере увеличения солёности водоёма, в котором рыбы обитают (Henderson, Tocher, 1987; Sargent, Henderson, 1995). Например, у тихоокеанского анчоуса E. japonicus эта величина составляет 8.0−8.9 (Sajiki et al., 1992; Kim et al., 2014), у средиземноморского E. encrasicolus – 9.2 (Öksüz et al., 2009), у черноморской хамсы E. encrasicolus ponticus – 6.1−7.3 (Turan et al., 2007; Öksüz, Özyılmaz, 2010). По нашим данным, в 2009−2013 гг. по сравнению с 2006 г. величина ∑n3/∑n6 в ТАГ азовской хамсы увеличилась в 1.5−1.8 раза и приблизилась к этой величине у черноморской хамсы (Turan et al., 2007). Кроме того, в 2009−2013 гг. (за исключением 2011 г.), в рационе хамсы увеличилась доля животной пищи (ДГК/ЭПК > 1) (табл. 3), тогда как в начальный период осолонения (2006 и 2008 г.) хамса больше потребляла растительную пищу (ДГК/ЭПК ≈ 1). То есть качественные перестройки в трофической цепи азовской хамсы, произошедшие в процессе осолонения Азовского моря, привели к увеличению содержания липидов и, что особенно важно, к значительному увеличению содержания незаменимых жирных кислот в теле рыб в период нагула.
ОБСУЖДЕНИЕ
Азовское море – полузамкнутый мелководный солоноватый водоём, основную роль в гидрологическом режиме которого играет сток Дона и Кубани и водообмен через Керченский пролив с Чёрным морем (Костяной и др., 2014). Солёность Азовского моря характеризуется мультидекадной изменчивостью в диапазоне 9−14‰. В 1920–1950-х гг. солёность Азовского моря составляла 10.5‰, c начала 1950-х до середины 1970-х гг. постепенно увеличилась до 13.9‰, а затем вновь уменьшилась до минимальной величины (9.3‰) в 2006 г. Начиная с 2007 г. экосистема Азовского моря функционирует в условиях снижения материкового стока и увеличения притока более солёных черноморских вод (Косенко, 2016). В 2013 г. солёность собственно Азовского моря (без учёта опреснённого Таганрогского залива) составила 12.6‰, а к 2015 г. достигла 13.6‰ (Александрова и др., 2016; Косенко, 2016).
Уменьшение пресного стока и увеличение поступления черноморской воды в Азовское море привело к сокращению ареалов пресноводных и солоноватоводных фито- и зоопланктёров и, напротив, расширению ареалов галофильных организмов (Mirzoyan, 2004). Уже на 4-й год с начала осолонения эвгалобы морского генезиса стали массово проникать даже в наиболее удалённый от Керченского пролива и опреснённый Таганрогский залив (Сафронова, Лужняк, 2016). По данным учётных съёмок в Азовском море 2006–2013 гг. (Chashchin et al., 2015), спустя 5 лет после начала осолонения запасы азовской хамсы увеличились в 10 раз (табл. 4). Рост запасов сопровождался увеличением в теле рыб в период нагула содержания липидов (R2 = 0.74) (рис. 3) и незаменимых жирных кислот ЭПК и ДГК (рис. 2), необходимых для обеспечения двигательной активности рыб, солёностных и температурных адаптаций и других процессов (Sargent, Henderson 1995; Arts, Kohler 2009). Увеличение содержания липидов, ЭПК и ДГК в теле хамсы не только повышает энергетический статус организма, но, вероятно, способствует быстрой адаптации рыб к солёности Чёрного моря, сокращению сроков зимовальных миграций, повышению выживаемости зимой в условиях низкой температуры и устойчивости к болезням и большему возврату производителей в Азовское море.
Таблица 4.
Запасы хамсы Engraulis encrasicolus maeoticus, тюльки Clupeonella delicatula delicatula и мнемиопсиса Mnemiopsis leidyi (Chashchin et al., 2015), а также рассчитанное суточное потребление ими пищи
| Годы | Запасы, тыс. т | Потребление пищи, тыс. т/сут. | ||||
|---|---|---|---|---|---|---|
| Хамса | Тюлька | Мнемиопсис | Хамса | Тюлька | Мнемиопсис | |
| 2006 | 60 | 360 | Нет данных | 6.0 | 36.0 | Нет данных |
| 2007 | 116 | 450 | 6400 | 11.6 | 45.0 | 6.4 |
| 2008 | 250 | 500 | 10 200 | 25.0 | 50.0 | 10.2 |
| 2009 | 150 | 320 | 1400 | 15.0 | 32.0 | 1.4 |
| 2010 | 480 | 210 | 520 | 48.0 | 21.0 | 0.5 |
| 2011 | 650 | 260 | 660 | 65.0 | 26.0 | 0.7 |
| 2012 | 510 | 180 | 3100 | 51.0 | 18.0 | 3.1 |
| 2013 | 370 | 156 | 120 | 37.0 | 15.6 | 0.1 |
| 2006–2009 | 144 | 407 | 6000 | 14.4 | 40.7 | 6.0 |
| 2010–2013 | 502 | 201 | 1100 | 50.2 | 20.1 | 1.1 |
Рис. 3.
Зависимость содержания суммарных липидов (а) и средней массы (б) хамсы Engraulis encrasicolus maeoticus от величины её запаса: а − R2 = 0.74, б –R2 = 0.67.
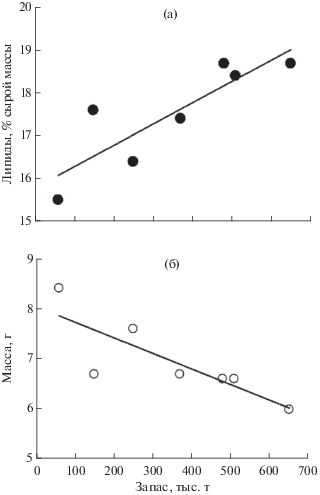
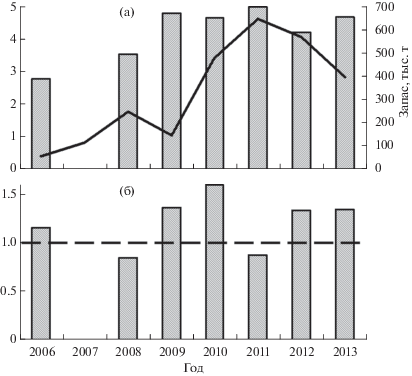
Резкое увеличение запасов хамсы одновременно с улучшением обеспеченности рыб пищей могли иметь общую причину, связанную с перестройкой экосистемы Азовского моря во время осолонения. В годы с высокими запасами (2010−2013) по сравнению с 2006 и 2008 гг. существенно изменился качественный состав пищи хамсы: увеличилось потребление черноморских организмов и более калорийной животной пищи, о чём свидетельствуют более высокие значения трофических индексов − ∑n3/∑n6 и ДГК/ЭПК (рис. 4). Лишь в 2011 г., когда запасы были экстремально высокими, хамса, вероятно, была вынуждена потреблять больше растительной пищи (ДГК/ЭПК < 1), что указывает на ухудшение условий питания (Rogov et al., 2004). Таким образом, судя по исследованным липидным характеристикам и росту запасов, осолонение моря оказало положительное влияние на состояние популяции азовской хамсы. В то же время средняя масса рыб в уловах с увеличением запасов уменьшалась (R2 = 0.67) (рис. 3б), что, вероятно, происходило из-за демографических изменений в популяции: увеличения доли младших возрастных групп. Кроме того, понижение размерно-весовых показателей хамсы при высоких запасах связывают с “перенаселением” Азовского моря данным видом и возникающей внутривидовой конкуренцией (Chashchin et al., 2015).
Рис. 4.
Динамика трофических индексов в триацилглицеринах ( ) и запаса (—) азовской хамсы Engraulis encrasicolus maeoticus, октябрь–ноябрь 2006, 2008–2013 гг.: а – соотношение ∑n3/∑n6, б – соотношение ДГК/ЭПК
(данные по запасу: Chashchin et al., 2015).
) и запаса (—) азовской хамсы Engraulis encrasicolus maeoticus, октябрь–ноябрь 2006, 2008–2013 гг.: а – соотношение ∑n3/∑n6, б – соотношение ДГК/ЭПК
(данные по запасу: Chashchin et al., 2015).
Обеспеченность пищей хамсы зависит не только от состояния кормовой базы водоёма, но и от общей численности (биомассы) и пространственного распределения основных трофических конкурентов (Shulman, Love, 1999). В пелагиали Азовского моря основными потребителями планктона являются собственно хамса, а также тюлька и гребневик-вселенец мнемиопсис (Rogov et al., 2004; Chashchin et al., 2015). Последний на протяжении почти трех десятилетий ежегодно в летние месяцы проникает из Чёрного моря в Азовское. Если в начальный период осолонения (2006–2009 гг.) ежегодные запасы хамсы составляли в среднем 144 тыс. т, тюльки – 407 тыс. т, мнемиопсиса – 6600 тыс. т, то в последующие годы (2010−2013 гг.) запасы хамсы значительно увеличились, а тюльки и мнемиопсиса, напротив, сократились (табл. 4). Исходя из величины запасов и принимая удельные рационы для хамсы и тюльки за 10% сырой массы тела (Михман, Романович, 1977; Rogov et al., 2004), а для мнемиопсиса за 0.1% сырой массы тела (Финенко и др., 2013), можно ориентировочно оценить количество пищи, потребляемой каждым из этих консументов. В 2006−2009 гг. хамса потребляла в три раза меньше пищи, чем тюлька, а на долю мнемиопсиса приходилось около 10% пищи, потребляемой рыбами. В 2010–2013 гг. хамса, напротив, потребляла в 2.5 раза больше пищи, чем тюлька, а на долю мнемиопсиса приходилось лишь 1.5% общего количества. Такая очень приблизительная оценка позволила, тем не менее, показать, что в 2010–2013 гг. хамса стала главным потребителем в пелагиали Азовского моря, значительно опережая тюльку и мнемиопсиса.
Благоприятные условия, которые возникли для хамсы при современном осолонении Азовского моря, оказались неблагоприятными для нереста и нагула тюльки. Нерест хамсы проходит в море при 10–13‰, оптимумы для развития личинок и молоди составляют 10−15‰ (Бокова, 1955; Rogov et al., 2004). Тюлька нерестится в опреснённом Таганрогском заливе; допустимая солёность для развития икры и личинок тюльки не превышает 7‰ (Rogov et al., 2004). С увеличением солёности моря (и особенно Таганрогского залива до 7−9‰) ареалы размножения и откорма молоди тюльки сократились. Эвригалинная хамса, напротив, расширила ареал, который в 2010–2013 гг. охватывал не только собственно море, но и значительную часть Таганрогского залива (Александрова и др., 2016). Ранее было показано, что при осолонении вследствие экспансии черноморских планктёров в Азовское море его продуктивность и видовое разнообразие уменьшаются (Mirzoyan, 2004). Это, вероятно, приводит к значительному ухудшению условий питания тюльки, которая является облигатным зоофагом и очень требовательна к высоким концентрациям животной пищи (Rogov et al., 2004).
В отличие от тюльки хамса является эврифагом. Она способна питаться организмами разного размера в разных слоях Азовского моря: планктонными (Acartia, Calanipeda, Ciripedia и др.), придонными (Macropsis slabberi), донными, обитающими не в толще грунта, а в придонном слое, такими как Nereis succenea в период размножения, Spionidae, Hydrobia, Ostracoda, и оседающей молодью моллюсков, икрой и личинками тюльки (Бокова, 1955). При недостатке животной пищи хамса активно потребляет фитопланктон (Дементьева, 1959; Корнилова, 1955; Михман, Романович, 1977; Чащина, 2001). Во время массового вселения и развития в Азовском море хищных желетелых − медузы Aurelia aurita в 1970-е гг. и мнемиопсиса в 1990-е гг. − более половины содержимого желудков хамсы в период нагула составлял фитопланктон (Михман, Романович, 1977; Чащина, 2001).
В 2006−2013 гг. последним по значимости потребителем зоопланктона в Азовском море является мнемиопсис (табл. 4). Анализ межгодовой и пространственной вариабельности динамики численности и биомассы мнемиопсиса в Чёрном и Азовском морях с момента его первого обнаружения до настоящего времени является предметом многочисленных исследований (Shiganova et al., 2001; Mirzoyan et al., 2004, Costello et al., 2012; Chashchin et al., 2015). В конце 1980-х–начале 1990-х гг. биомасса мнемиопсиса в Азовском море была очень высокой, он интенсивно размножался и широко расселялся по всему морю, интенсивно выедая кормовой планктон (Chashchin et al., 2015). В последнее десятилетие численность мнемиопсиса в Азовском море существенно сократилась, в том числе и благодаря массовому развитию его потребителя – гребневика Beroe ovata. В августе 2009–2011 гг. мнемиопсис присутствовал лишь на небольших акваториях в центральной и юго-восточной частях Азовского моря (Chashchin et al., 2015). Сокращение биомассы и относительная пространственная изоляция мнемиопсиса значительно уменьшили его влияние на кормовую базу рыб. Хамса в последние годы, напротив, распространялась по всему Азовскому морю и проникала в Таганрогский залив, потеснив при этом тюльку (Александрова и др., 2016).
Таким образом, увеличение солёности Азовского моря способствовало расширению ареалов размножения и нагула эвригалинной хамсы. Помимо этого, в результате замещения солоноватоводных планктонных организмов черноморскими улучшилась обеспеченность хамсы пищей, о чём свидетельствует увеличение содержания липидов и, что особенно важно, незаменимых жирных кислот ЭПК и ДГК в теле рыб ко времени завершения нагула. Благоприятные условия нагула, в свою очередь, являются необходимым фактором, определяющим выживание хамсы в период зимовки (Шульман, 1972). В исследуемый период выживанию рыб способствовали также относительно высокая температура воды в Чёрном море в зимние месяцы (Костяной и др., 2014) и малое промысловое изъятие (Chashchin et al., 2015). Совокупность всех этих факторов, вероятно, и явилась причиной (вероятно, не единственной) резкого увеличения запасов хамсы в Азовском море в 2010–2011 гг. и сохранения их на высоком уровне в последующие годы.
Таким образом, анализ межгодовой динамики содержания липидов и их жирнокислотного состава позволил оценить обеспеченность пищей взрослой части популяции хамсы во время нагула в Азовском море. Однако в данном исследовании не рассматривалась молодь, формирующая пополнение следующего года. Как нам представляется, распространение мониторинговых исследований на младшую возрастную группу не только даст целостное представление о состоянии популяции хамсы в период, предшествующий зимовке, но и позволит оценить потенциал пополнения, которое у короткоцикловых рыб определяет динамику численности будущего нерестового стада.
Список литературы
Александрова У.Н., Игнатенко А.С., Перевалов О.А. и др. 2016. Состояние сырьевой базы в Азово-Черноморском бассейне в 2013 г. и ее использование промыслом // Тр. ВНИРО. Т. 160. С. 12−25.
Бокова Е.Н. 1955. Питание азовской хамсы на разных этапах ее развития // Там же. Т. 31. С. 356−367.
Будниченко Э.В., Фирулина А.В. 1998. Условия нагула хамсы и тюльки в Азовском море в 1992−1997 гг. // Тр. ЮгНИРО. Т. 44. С. 22−33.
Дементьева Т.Ф. 1959. Методика изучения влияния естественных факторов на численность азовской хамсы // Тр. ВНИРО. Т. 34. С. 30−62.
Кейтс М. 1975. Техника липидологиии. М.: Мир, 222 с.
Корнилова В.П. 1955. Питание азовской хамсы // Тр. ВНИРО. Т. 31. С. 368–377.
Косенко Ю.В. 2016. Особенности пространственно-временной изменчивости характеристик гидрохимического режима Азовского моря в период осолонения // Матер. Всерос. науч.-практ. конф. “Морские биологические исследования: достижения и перспективы”. Т. 2. Севастополь: ЭКОСИ–Гидрофизика. С. 319−322.
Костяной А.Г., Гинзбург А.И., Лебедев С.А., Шеремет Н.А. 2014. Воздействия изменений климата на морские природные системы. Южные моря России // II оценочный доклад Росгидромета об изменениях климата и их последствиях на территории Российской Федерации. М.: Росгидромет. С. 644−683.
Михман А.С.. Романович Л.В. 1977. О питании азовской хамсы Engraulis encrasicholus maeoticus Pusanov // Вопр. ихтиологии. Т. 17. Вып. 2 (103). С. 270−274.
Сафронова Л.М.. Лужняк О.Л. 2016. Трансформация фитопланктона Азовского моря в условиях современного осолонения // Матер. Всерос. науч.-практ. конф. “Морские биологические исследования: достижения и перспективы”. Т. 2. Севастополь: ЭКОСИ–Гидрофизика. С. 417−420.
Световидов А.Н. 1964. Рыбы Черного моря. М.: Наука, 550 с.
Финенко Г.А., Аболмасова Г.И., Романова З.А. и др. 2013. Динамика популяции гребневика Mnemiopsis leidyi и ее воздействие на зоопланктон прибрежных районов Черного моря у берегов Крыма // Океанология. Т. 53. № 1. С. 88−97.
Чащина А.В. 2001. Питание азовских рыб планктофагов в современный период // Рыб. хоз-во Украины. № 5. С. 35−38.
Шульман Г.Е. 1972. Физиолого-биохимические особенности годовых циклов рыб. М.: Пищ. пром-сть, 368 с.
Юнева Т.В., Забелинский С.А., Дацык Н.А. и др. 2016. Влияние качественного состава пищи на содержание липидов и незаменимых жирных кислот в теле черноморского шпрота Sprattus sprattus phalericus (Clupeidae) // Вопр. ихтиологии. Т. 56. № 3. С. 304–313.
Arts M.T., Kohler C.C. 2009. Health and condition in fish: the influence of lipids on membrane competency and immune response // Lipids in aquatic ecosystems / Eds. Arts M.T. et al. N. Y.: Springer. P. 237–255.
Chashchin A., Shlyakhov V.A., Dubovik V.E., Negoda S. 2015. Stock assessment of anchovy (Engraulis encrasicolus L.) in the Northern Black Sea and the Sea of Azov // Progressive engineering practices in marine resource management / Eds. Zlateva I. et al. Hershey, USA: IGI Global. P. 209–243.
Costello J.H., Bayha K.M., Mianzan H.W. et al. 2012. Transitions of Mnemiopsis leidyi (Ctenophora: Lobata) from a native to an exotic species: a review // Hydrobiologia. V. 690. P. 21–46.
Dalsgaard J., St. John M., Kattner G. et al. 2003. Fatty acid trophic markers in the pelagic marine environment // Adv. Mar. Biol. V. 46. P. 225–340.
Henderson R.J., Tocher D.R. 1987. The lipid composition and biochemistry of freshwater fish // Progr. Lipid Res. V. 26. P. 281–347.
Iverson S.J. 2009. Tracing aquatic food webs using fatty acids: from qualitative indicators to quantitative determination // Lipids in aquatic ecosystems / Eds. Arts M.T. et al. N.Y.: Springer. P. 281−307.
Iverson S.J., Field C., Bowen W.D., Blanchard W. 2004. Quantitative fatty acid signature analysis: a new method of estimating predator diets // Ecol. Monographs. V. 74. P. 211−235.
Kim J.Y., Kim H., Choi M.-S. et al. 2014. Spatial and temporal variations of the trophodynamics of anchovy (Engraulis japonicus) in the southern coastal waters of Korea using fatty acid trophic markers // Animal Cells Systems. V. 18. № 6. P. 425−434.
Litzow M.A., Bailey K.M., Prahl F.G., Heintz R. 2006. Climate regime shifts and reorganization of fish communities: the essential fatty acid limitation hypothesis // Mar. Ecol. Progr. Ser. V. 315. P. 1–11.
Mirzoyan Z.A. 2004. Changes in the structure and productivity of the zooplankton community after the appearance of ctenophore // Ctenophore Mnemiopsis leidyi (A. Agassiz) in the Azov and Black Seas: its biology and consequences of its intrusion / Ed. Volovik S.P. Istanbul: Turkish Mar. Res. Foundation. P. 175−192.
Mirzoyan Z.A., Kornienko G.G., Dudkin S.I., Lozhichevskaya T.V. 2004. Biology of ctenophore Mnemiopsis leidyi in the Azov Sea // Ibid. P. 94−132.
Öksüz A., Özyılmaz A. 2010. Changes in fatty acid compositions of Black Sea anchovy (Engraulis encrasicolus L. 1758) during catching season // Turk. J. Fish. Aquat. Sci. V. 10. P. 381−385.
Öksüz A., Özyılmaz A., Turan C. 2009. Comparative study on fatty acid profiles of anchovy from Black Sea and Mediterranean Sea (Engraulis encrasicholus L., 1758) // Asian J. Chem. V. 21. № 4. P. 3081−3086.
Parrish C.C. 2009. Essential fatty acids in aquatic food webs // Lipids in aquatic ecosystems / Eds. Arts M.T. et al. N.Y.: Springer. P. 309−326.
Rogov S.F., Lutz G.I., Volovik S.P. 2004. Biology and adaptation of anchovy and tyulka vis-à-vis the intrusion of ctenophore // Ctenophore Mnemiopsis leidyi (A. Agassiz) in the Azov and Black Seas: its biology and consequences of its intrusion . Istanbul: Turkish Mar. Res. Foundation. P. 218−278.
Sajiki J., Takahashi K., Hayashi Yu. et al. 1992. Fatty acid composition in anchovy (Engraulis japonicus) infected with Anisakis simplex // Jpn. J. Toxicol. Environ. Health. V. 38. P. 361−365.
Sargent J.R., Henderson R.J. 1995. Marine (n-3) polyunsaturated fatty acids // Developments in oils and fats / Ed. Hamilton R.J. Boston: Springer. P. 32–65.
Sargent J.R., Tocher D.R., Bell J.G. 2002. The lipids // Fish nutrition / Eds. Halver E., Hard R.W. San Diego: Acad. Press. P. 181–257.
Shiganova T.A., Mirzoyan Z.A., Studenikina E.A. et al. 2001. Population development of the invader ctenophore Mnemiopsis leidyi in the Black Sea and other seas of the Mediterranean basin // Mar. Biol. V. 139. P. 431–445.
Shulman G.E., Love R.M. 1999. The biochemical ecology of marine fishes // Adv. Mar. Biol. V. 36. 352 p.
St. John M.A., Lund T. 1996. Lipid biomarkers: linking the utilization of frontal plankton biomass to enhanced condition of juvenile North Sea cod // Mar. Ecol. Progr. Ser. V. 131. P. 75–85.
Tocher D.R. 2003. Metabolism and functions of lipids and fatty acids in teleost fish // Rev. Fish. Sci. V. 11. P. 107–184.
Turan H., Kaya Ya., Erkoyuncu I. 2007. Protein and lipid content and fatty acid composition of anchovy meal produced in Turkey // Turk. J. Vet. Anim. Sci. V. 31. P. 113−117.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


