Вопросы ихтиологии, 2019, T. 59, № 1, стр. 68-79
Гаметогенез радужной форели Parasalmo mykiss, выращенной от вылупления до полового созревания при температуре около 20°C
О. В. Зеленников 1, *, В. М. Голод 2
1 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
2 Федеральный селекционно-генетический центр рыбоводства “Ропша” − ФСГЦР
Ленинградская область пос. Ропша, Россия
* E-mail: Oleg_Zelennikov@rambler.ru
Поступила в редакцию 13.10.2017
После доработки 01.03.2018
Принята к публикации 26.02.2018
Аннотация
Исследовано развитие гонад в течение первого репродуктивного цикла у самок и самцов радужной форели Parasalmo mykiss, выращенных при температуре около 20°С. Установлено, что выращивание при этой температуре ведёт к увеличению в яичниках доли жировой и стромальной ткани, уменьшению числа ооцитов периода превителлогенеза и в дальнейшем к задержке полового созревания большинства самок; в возрасте около 2 лет половой зрелости могли достичь 36.6% особей. При этом у всех самок незадолго до полового созревания наблюдается тотальная резорбция близких к дефинитивному состоянию ооцитов старшей генерации. У самцов период, в течение которого у разных особей в гонадах начинается волна активного сперматогенеза, существенно растянут. На этапе, непосредственно предшествующем половому созреванию, у всех самцов происходит тотальная резорбция зрелых спермиев.
Радужная форель Parasalmo mykiss – один из наиболее продуктивных и широко распространённых объектов аквакультуры; её все больше начинают воспроизводить за пределами естественного ареала лососёвых рыб. В этой связи актуальными становятся работы по изучению способности форели выживать при сравнительно высокой температуре (Davies et al., 1995; Dockray et al., 1996), а также возможности увеличения пределов толерантности к этому фактору в ходе селекции (Molony, 2001; Ineno et al., 2005). Одно из направлений этих работ – изучение функции воспроизводства, реализация которой может быть особенно затруднена под воздействием неблагоприятных факторов, и, в частности, оценка состояния гонад как интегрального показателя функционирования репродуктивной системы. До настоящего времени при исследовании влияния повышенной температуры на гаметогенез форели анализировали состояние половых желёз на каком-то отдельном этапе онтогенеза (Алешин, 1987; Pornsoping et al., 2007; Павлов и др., 2013).
Цель нашей работы − изучить развитие половых желёз у самок и самцов радужной форели при повышенной температуре в период от вылупления до полового созревания.
МАТЕРИАЛ И МЕТОДИКА
Работу проводили на потомстве ропшинской радужной форели, адаптированной к местным условиям (среднегодовая температура воды 11°С, преднерестовое содержание производителей – около 6°С). Проведению работ предшествовала серия предварительных экспериментов, в ходе которых была определена верхняя предельно допустимая граница температуры при инкубации икры. При температуре воды выше 14°С все эмбрионы погибали уже в первые дни инкубации. Максимальное значение, при котором выживаемость эмбрионов на стадии дробления соответствовала нормативу, составило 12°С. После завершения стадии дробления температуру воды постепенно повышали до 18°С. При этом режиме выживаемость эмбрионов была такой же, как и при постоянной температуре 12°С, а продолжительность развития зародышей от осеменения до их массового вылупления была на 20% меньше, составив 23 сут.
После вылупления и в течение полного репродуктивного цикла рыб содержали при температуре воды около 20°С (19.8−20.5°С). До возраста 17 мес. рыб выращивали на базе ФСГЦР в бассейнах с проточной водой, которую предварительно подогревали, а затем до возраста 22 мес. – в лаборатории экспериментальной ихтиологии СПбГУ в бассейнах с оборотным водоснабжением. Рыб кормили кормом Биомар (Дания) с частотой и нормой, предложенной производителем с учётом массы рыб и плотности их посадки.
Яичники и семенники для гистоморфологического анализа фиксировали в жидкости Буэна и затем обрабатывали по стандартной методике (Микодина и др., 2009). До возраста 11 мес. у всех особей обрабатывали обе гонады целиком. Затем, не выявив заметных различий между гонадами по внешним признакам и на гистологическом уровне, обрабатывали по фрагменту одной из гонад. Так же фрагмент гонад обрабатывали у самцов после начала у них мейотических преобразований. Для каждой особи делали не менее 100 серийных поперечных срезов двух или одной гонады. Готовые препараты окрашивали железным гематоксилином по Гейденгайну. Всего исследованы гистологически гонады 108 самок и 102 самцов. Уровень развития гонад оценивался по их массе, величине коэффициента зрелости (отношение массы гонад к общей массе тела, %), составу половых клеток, состоянию половых клеток старшей генерации, а у самок − и по диаметру ооцитов. У каждой самки под микроскопом с использованием программы ImageJ измеряли по 30 наиболее крупных ооцитов, находя у всех выбранных для измерения клеток срединное сечение. Поскольку ооциты имеют овальную форму, за диаметр принимали полусумму длинной и короткой осей.
РЕЗУЛЬТАТЫ
Развитие яичников. Исследование развития половых желёз начали в возрасте 2.5 мес. от вылупления, когда масса самок варьировала от 0.6 до 1.1 г. Фонд половых клеток у всех 12 исследованных особей был представлен гониями и ооцитами периода ранней профазы мейоза (мейоцитами). Лишь у наиболее крупной из исследованных рыб отдельные ооциты вступили в период превителлогенеза (рис. 1а), а их диаметр достигал 30−35 мкм.
Рис. 1.
Состояние яичников у самок форели Parasalmo mykiss в разном возрасте: а − 2.5 мес., ооциты начала периода превителлогенеза; б, в − 3 мес., значительный объём стромальной ткани в гонадах; г − 3.5 мес., начало структуризации фонда ооцитов периода превителлогенеза. Масштаб: 0.1 мм.
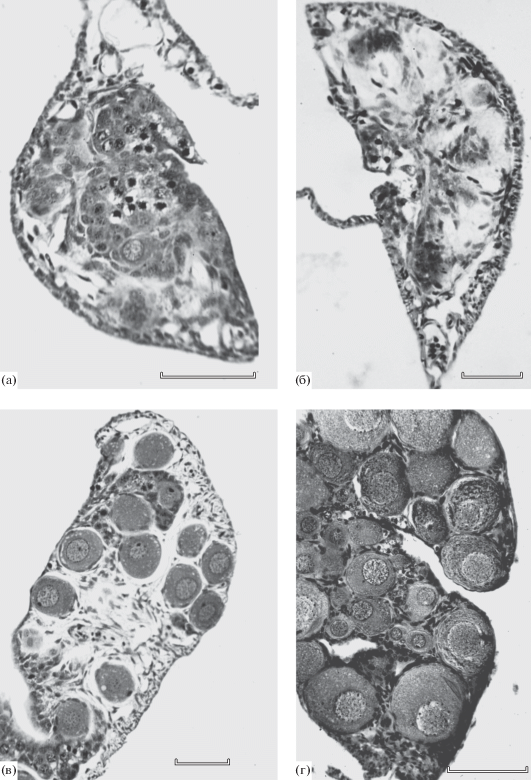
В возрасте 3 мес. масса исследованных самок варьировала от 0.8 до 2.3 г. В яичниках уже всех особей, помимо гониев и мейоцитов, присутствовали ооциты периода превителлогенеза, диаметр которых достигал 70 мкм. Вместе с тем по микроанатомической структуре половых желёз и состоянию фонда половых клеток яичники у разных рыб существенно различались. Так, у двух из восьми исследованных самок на 108 и 138 серийных срезах обеих гонад обнаружены соответственно только один и четыре ооцита периода превителлогенеза. В яичниках у этих особей на месте жировых отложений отмечены столь значительные многочисленные пустоты, что на некоторых поперечных срезах половых желёз полностью отсутствовали половые клетки (рис. 1б). Ещё у четырёх самок ооциты периода превителлогенеза отмечены практически на всех срезах, но их число было относительно невелико – не более одной–трёх клеток на срез. Наконец, в яичниках ещё двух самок на каждом поперечном срезе было по 10−15 превителлогенных ооцитов. Однако и у таких рыб площадь, занимаемая половыми клетками на срезах, была относительно невелика, а бóльшая часть яичников была занята клетками стромы гонад и отложениями жира (рис. 1в).
В возрасте 3.5 мес. старшую генерацию половых клеток у всех 11 исследованных самок составляли превителлогенные ооциты, диаметр которых в гонадах каждой особи существенно варьировал (рис. 1г) − от 25−30 до 100−110 мкм. Очевидно, что развитие репродуктивного фонда в яичниках было связано как с ростом ооцитов, так и с постепенным вступлением в превителлогенез новых генераций мейоцитов.
К возрасту 6 мес. яичники увеличились настолько, что их было возможно отпрепарировать от комплекса внутренних органов и взвесить; их масса в среднем составила 0.014 г. Диаметр ооцитов старшей генерации увеличился до 149.5 мкм (табл. 1), а его величина тесно коррелировала с длиной (y = 0.113x – 5.7, r = 0.94) и массой (y = = 0.538x – 62.25, r = 0.71) самок. В возрасте 7 мес. масса гонад и диаметр ооцитов возросли в среднем до 0.035 г и 171.7 мкм.
Таблица 1.
Состояние яичников радужной форели Parasalmo mykiss, развивающейся при 20°С в течение первого репродуктивного цикла
| Возраст, мес. |
Число рыб, экз. |
Длина (FL), см |
Масса, г | Коэффициент зрелости, % |
Диаметр ооцитов, мкм |
|
|---|---|---|---|---|---|---|
| тела | гонад | |||||
| 6 | 9 | $\frac{{11.2 \pm 0.7}}{{9.2 - 15.1}}$ | $\frac{{18.2 \pm 4.3}}{{6.1 - 43.9}}$ | $\frac{{0.014 \pm 0.003}}{{0.007 - 0.038}}$ | $\frac{{0.082 \pm 0.015}}{{0.018 - 0.163}}$ | $\frac{{149.5 \pm 5.7}}{{127 - 184}}$ |
| 7 | 7 | $\frac{{15.2 \pm 0.4}}{{14.4 - 17.0}}$ | $\frac{{57.4 \pm 4.5}}{{46.5 - 80.9}}$ | $\frac{{0.035 \pm 0.004}}{{0.025 - 0.049}}$ | $\frac{{0.062 \pm 0.006}}{{0.038 - 0.084}}$ | $\frac{{171.7 \pm 8.1}}{{142 - 196}}$ |
| 8 | 12 | $\frac{{16.8 \pm 0.8}}{{13.2 - 21.8}}$ | $\frac{{136.8 \pm 19.5}}{{59.6 - 294.0}}$ | $\frac{{0.061 \pm 0.010}}{{0.019 - 0.146}}$ | $\frac{{0.044 \pm 0.005}}{{0.011 - 0.068}}$ | $\frac{{181.0 \pm 8.3}}{{172 - 215}}$ |
| 9.5 | 9 | $\frac{{20.9 \pm 1.0}}{{15.9 - 25.0}}$ | $\frac{{138.9 \pm 21.5}}{{62.2 - 255.5}}$ | $\frac{{0.155 \pm 0.021}}{{0.099 - 0.245}}$ | $\frac{{0.122 \pm 0.018}}{{0.055 - 0.207}}$ | $\frac{{222.5 \pm 9.1}}{{175 - 256}}$ |
| 11 | 11 | $\frac{{23.4 \pm 0.7}}{{17.6 - 25.6}}$ | $\frac{{404.2 \pm 33.3}}{{166.3 - 540.0}}$ | $\frac{{0.206 \pm 0.040}}{{0.057 - 0.434}}$ | $\frac{{0.048 \pm 0.007}}{{0.020 - 0.092}}$ | $\frac{{246.4 \pm 10.3}}{{195 - 321}}$ |
| 12 | 7 | $\frac{{27.1 \pm 0.3}}{{25.6 - 30.1}}$ | $\frac{{307.1 \pm 15.1}}{{244.4 - 454.7}}$ | $\frac{{0.317 \pm 0.022}}{{0.221 - 0.466}}$ | $\frac{{0.103 \pm 0.007}}{{0.074 - 0.132}}$ | $\frac{{249.5 \pm 13.5}}{{194 - 298}}$ |
| 14 | 5 | $\frac{{30.1 \pm 1.7}}{{26.2 - 36.5}}$ | $\frac{{436.1 \pm 88.5}}{{298 - 781}}$ | $\frac{{0.526 \pm 0.180}}{{0.238 - 1.2}}$ | $\frac{{0.113 \pm 0.022}}{{0.082 - 0.181}}$ | $\frac{{267.0 \pm 10.7}}{{230 - 293}}$ |
| 2 | 25.0−30.4 | 227−425 | 0.610−0.700 | 0.164−0.268 | 484−552 | |
| 17 | 6 | $\frac{{35.5 \pm 1.1}}{{31.5 - 39.0}}$ | $\frac{{785.2 \pm 74.5}}{{535 - 930}}$ | $\frac{{1.02 \pm 0.20}}{{0.4 - 1.4}}$ | $\frac{{0.124 \pm 0.011}}{{0.074 - 0.150}}$ | $\frac{{347.8 \pm 19.6}}{{279 - 415}}$ |
| 3 | $\frac{{36.8 \pm 1.9}}{{33.0 - 39.0}}$ | $\frac{{646.7 \pm 177.0}}{{450 - 1000}}$ | $\frac{{18.8 \pm 9.4}}{{7.1 - 37.4}}$ | $\frac{{2.58 \pm 0.63}}{{1.58 - 3.74}}$ | $\frac{{1777 \pm 173.2}}{{1400 - 2000}}$ | |
| 22 | 3 | $\frac{{42.6 \pm 2.2}}{{38.5 - 46.0}}$ | $\frac{{1284.7 \pm 213.8}}{{889 - 1623}}$ | $\frac{{1.74 \pm 0.36}}{{1.02 - 2.10}}$ | $\frac{{0.133 \pm 0.014}}{{0.11 - 0.16}}$ | $\frac{{292.3 \pm 26.4}}{{240 - 325}}$ |
| 1 | 41.0 | 865 | 3.4 | 0.39 | − | |
| 1 | 42.5 | 1389 | 17.7 | 1.27 | − | |
| 1 | 42.5 | 1120 | 114.0 | 10.18 | 3800 | |
Примечание. Здесь и в табл. 2: над чертой – среднее значение и его ошибка, под чертой – пределы варьирования показателя.
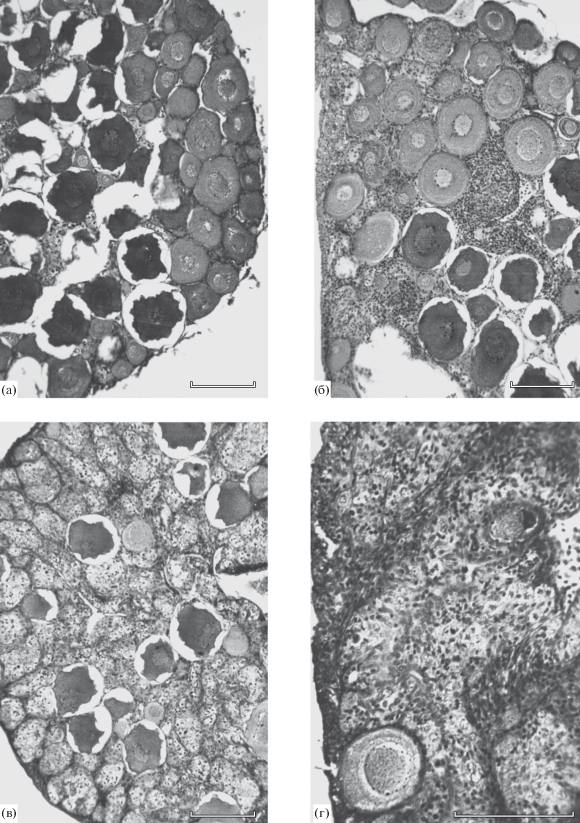
В возрасте 8 мес. яичники по микроанатомической структуре и составу половых клеток у разных особей вновь существенно различались. Так, у двух самок превителлогенные ооциты занимали практически всю площадь поперечного среза гонад (рис. 2а). У трёх других они были расположены менее плотно, и в пространстве между ними в массе присутствовали многочисленные гонии и мейоциты (рис. 2б). Ещё у четырёх особей площадь, занимаемая превителлогенными ооцитами на поперечных срезах, была невелика (рис. 2в). И, наконец, у трёх особей такие ооциты присутствовали как исключение. Например, у одной из самок на 80 серийных срезах обоих яичников были обнаружены только два ооцита периода превителлогенеза (рис. 2г). Отметим также, что практически для всех наиболее крупных ооцитов была характерна деформация и потеря ими обычной эллипсоидной формы.
Рис. 2.
Степень варьирования числа ооцитов периода превителлогенеза в гонадах у самок форели Parasalmo mykiss в возрасте 8 мес. (пояснения см. в тексте). Масштаб: 0.2 мм.
В возрасте 9.5 и 11 мес. старшую генерацию половых клеток в яичниках у всех 20 исследованных самок по-прежнему составляли ооциты периода превителлогенеза, диаметр которых увеличился в среднем соответственно до 222.5 и 246.4 мкм (табл. 1). В возрасте 11 мес. у некоторых самок в наиболее крупных ооцитах присутствовали желточные ядра, что свидетельствовало о скором завершении периода превителлогенеза и вступлении в период вителлогенеза.
В возрасте 12 мес. в ооцитах самой крупной (454.7 г) из семи самок появились кортикальные вакуоли, что свидетельствовало о переходе гонад отдельных особей на III стадию зрелости.
В возрасте 14 мес. у пяти самок старшая генерация половых клеток, как и ранее, была представлена ооцитами периода превителлогенеза, диаметр которых в среднем составлял 267.0 мкм (табл. 1). У двух других самок в цитоплазме ооцитов старшей генерации присутствовали кортикальные и жировые вакуоли (рис. 3а). Средний диаметр таких ооцитов (518 мкм) был в два раза больше, чем у самок первой группы. Таким образом, к возрасту 14 мес. произошло разделение опытной группы на особей с разным темпом оогенеза. При этом вакуолизация начиналась в ооцитах не самых крупных рыб. Одна из таких самок была наименьшей из всех рыб в данном возрасте.
Рис. 3.
Ооциты старшей генерации в яичниках самок форели Parasalmo mykiss в возрасте 14 (а) и 17 (б) мес. и их резорбция в яичниках самок в возрасте 22.5 мес. (в, г). Масштаб: а − 0.1, б−г − 0.5 мм.
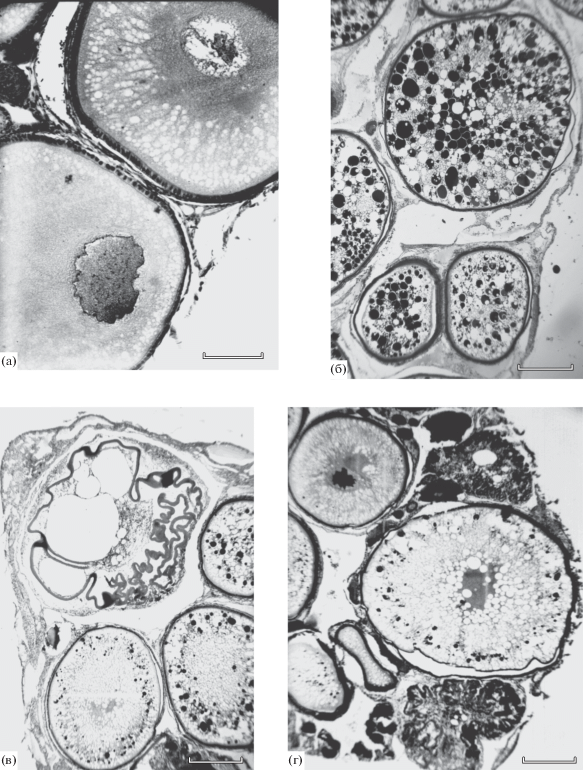
В возрасте 17 мес. дифференциация самок по состоянию гонад, отмеченная у рыб в возрасте 14 мес., стала ещё более выраженной. Так, у шести особей старшая генерация половых клеток по-прежнему была представлена ооцитами периода превителлогенеза; масса их яичников и величина коэффициента зрелости в среднем составили 0.96 г и 0.12% (табл. 1). У трёх других самок средние значения массы гонад (18.8 г) и коэффициента зрелости (2.58%) были почти в 20 раз больше, чем у рыб первой группы. Половые клетки старшей генерации были представлены ооцитами периода вителлогенеза, диаметр которых в среднем у разных рыб варьировал от 1.4 до 2.0 мм. В цитоплазме этих ооцитов помимо жировых вакуолей отмечены интенсивно окрашенные гематоксилином желтковые глобулы (рис. 3б), диаметр которых достигал 180−200 мкм.
В возрасте 22 мес. по состоянию гонад мы также выявили две группы самок. У половины рыб масса гонад в среднем составила 1.74 г, а наиболее крупные половые клетки по-прежнему были представлены ооцитами периода превителлогенеза. У других самок состояние яичников существенно различалось. Так, у одной особи с гонадами массой 114 г старшая генерация половых клеток была представлена ооцитами периода вителлогенеза диаметром в среднем 3.8 мм. Однако в ходе гистологического анализа было установлено, что все ооциты находились в состоянии начала резорбции; мы отметили многочисленные нарушения целостности оболочек, а также излияние содержимого ооцитов в межклеточное пространство. Ещё у двух рыб на гистологических препаратах наблюдали тотальную резорбцию ооцитов старшей генерации (рис. 3в, 3г). Таким образом, всех опытных самок в этом возрасте по состоянию гонад также можно было разделить на две группы – с ооцитами периода превителлогенеза или с ооцитами периода вителлогенеза на разных этапах резорбции.
Развитие семенников. В возрасте 2.5 мес. семенники у всех восьми исследованных особей находились на I стадии зрелости. Они имели на срезе характерную для лососёвых рыб треугольную форму с крупным кровеносным сосудом, расположенным в районе мезорхия. Фонд половых клеток в семенниках был представлен гониями.
В возрасте 3, 3.5, 6 и 7 мес. исследовали гонады 26 самцов, у которых по-прежнему присутствовали только гонии (рис. 4а), число которых увеличивалось в ходе митотических делений. В течение этого периода в семенниках происходило формирование семенных канальцев, что свидетельствовало о переходе половых желёз на II стадию зрелости.
Рис. 4.
Состояние семенников у самцов форели Parasalmo mykiss в разном возрасте: а − 8 мес., фонд половых клеток представлен гониями; б − 9.5 мес., половые клетки всех периодов сперматогенеза, за исключением зрелых спермиев; в, г − 12 мес., варьирование площади срезов гонад у разных рыб, занимаемой зрелыми спермиями. Масштаб: 0.2 мм.
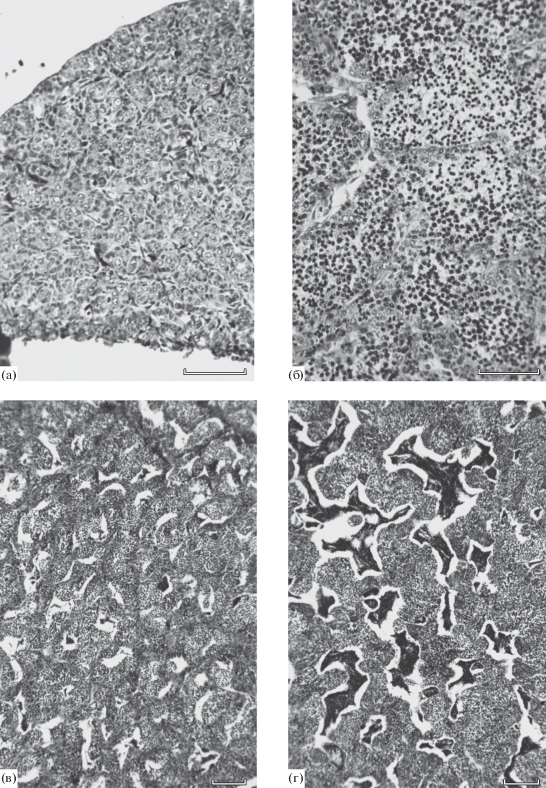
В возрасте 8 мес. было изучено состояние семенников у 10 существенно различающихся по массе рыб (табл. 2). У девяти особей в гонадах массой 11−35 мг по-прежнему присутствовали только гонии, тогда как у наиболее крупного самца в семенниках массой 982 мг помимо гониев отмечены половые клетки всех периодов сперматогенеза, за исключением зрелых спермиев (рис. 4б). Можно заключить, что у части рыб этого возраста уже осуществлялась волна активного сперматогенеза.
Таблица 2.
Состояние семенников радужной форели Parasalmo mykiss, развивающейся при 20°С в течение первого репродуктивного цикла
| Возраст, мес |
Число рыб, экз |
Длина (FL), см |
Масса, г | Коэффициент зрелости, % | |
|---|---|---|---|---|---|
| тела | гонад | ||||
| 6 | 9 | $\frac{{11.0 \pm 0.8}}{{7.1 - 14.4}}$ | $\frac{{16.8 \pm 4.0}}{{2.8 - 39.0}}$ | $\frac{{0.006 \pm 0.002}}{{0.005 - 0.015}}$ | $\frac{{0.029 \pm 0.003}}{{0.017 - 0.041}}$ |
| 7 | 5 | $\frac{{14.9 \pm 0.9}}{{12.2 - 17.4}}$ | $\frac{{59.6 \pm 8.9}}{{39.4 - 86.0}}$ | $\frac{{0.021 \pm 0.004}}{{0.010 - 0.028}}$ | $\frac{{0.034 \pm 0.005}}{{0.025 - 0.050}}$ |
| 8 | 9 | $\frac{{14.7 \pm 0.8}}{{13.0 - 19.9}}$ | $\frac{{115.0 \pm 15.6}}{{55.9 - 192.4}}$ | $\frac{{0.021 \pm 0.003}}{{0.011 - 0.035}}$ | $\frac{{0.019 \pm 0.001}}{{0.013 - 0.025}}$ |
| 1 | 20.0 | 219.6 | 0.98 | 0.45 | |
| 9.5 | 4 | $\frac{{21.9 \pm 0.6}}{{20.3 - 22.9}}$ | $\frac{{146.5 \pm 16.4}}{{100.0 - 171.9}}$ | $\frac{{0.068 \pm 0.004}}{{0.060 - 0.076}}$ | $\frac{{0.048 \pm 0.006}}{{0.035 - 0.065}}$ |
| 2 | 18.1−22.4 | 78.2−139.8 | 0.59−1.32 | 0.420−0.682 | |
| 11 | 5 | $\frac{{20.6 \pm 1.7}}{{15.9 - 26.5}}$ | $\frac{{329.2 \pm 79.4}}{{164.5 - 632.5}}$ | $\frac{{0.051 \pm 0.010}}{{0.032 - 0.090}}$ | $\frac{{0.016 \pm 0.001}}{{0.012 - 0.019}}$ |
| 4 | $\frac{{27.1 \pm 0.6}}{{26.2 - 29.0}}$ | $\frac{{636.3 \pm 30.1}}{{571.5 - 716.8}}$ | $\frac{{4.111 \pm 0.805}}{{1.947 - 5.800}}$ | $\frac{{0.641 \pm 0.123}}{{0.57 - 0.92}}$ | |
| 12 | 10 | $\frac{{25.0 \pm 0.8}}{{21.6 - 28.8}}$ | $\frac{{252.1 \pm 28.1}}{{152.9 - 384.0}}$ | $\frac{{0.161 \pm 0.036}}{{0.045 - 0.394}}$ | $\frac{{0.063 \pm 0.013}}{{0.027 - 0.145}}$ |
| 10 | $\frac{{27.6 \pm 0.4}}{{25.8 - 29.8}}$ | $\frac{{334.2 \pm 22.0}}{{270.5 - 446.0}}$ | $\frac{{7.5 \pm 1.4}}{{3.0 - 17.3}}$ | $\frac{{2.31 \pm 0.45}}{{0.67 - 5.47}}$ | |
| 14 | 1 | 30.7 | 466.5 | 6.2 | 1.33 |
| 4 | $\frac{{32.2 \pm 1.0}}{{30.5 - 34.0}}$ | $\frac{{505.0 \pm 46.3}}{{404.9 - 615.2}}$ | $\frac{{8.0 \pm 0.9}}{{6.1 - 10.3}}$ | $\frac{{1.59 \pm 0.11}}{{1.51 - 1.90}}$ | |
| 17 | 7 | $\frac{{39.4 \pm 0.9}}{{36.0 - 42.5}}$ | $\frac{{905.9 \pm 79.1}}{{505 - 1165}}$ | $\frac{{9.8 \pm 3.3}}{{3.4 - 27.9}}$ | $\frac{{1.14 \pm 0.37}}{{0.37 - 2.62}}$ |
| 19 | 5 | $\frac{{39.8 \pm 2.3}}{{32.5 - 45.0}}$ | $\frac{{1124.0 \pm 156.3}}{{660 - 1540}}$ | $\frac{{25.9 \pm 5.4}}{{11.0 - 44.6}}$ | $\frac{{2.25 \pm 0.25}}{{1.65 - 2.90}}$ |
| 22 | 2 | 41.0−45.5 | 961−1890 | 0.2−0.5 | 0.020−0.026 |
| 4 | $\frac{{43.6 \pm 1.0}}{{42.0 - 46.7}}$ | $\frac{{1262.7 \pm 157.0}}{{864 - 1580}}$ | $\frac{{35.7 \pm 5.2}}{{26.5 - 50.5}}$ | $\frac{{2.84 \pm 0.22}}{{2.22 - 3.20}}$ | |
У рыб в возрасте 9.5, 11 и 12 мес. в общей сложности были изучены гонады 35 самцов. По состоянию семенников среди рыб каждого возраста можно было выделить две группы (табл. 2). У одних особей в гонадах по-прежнему присутствовали только гонии, у других − половые клетки разных периодов сперматогенеза (от гониев до зрелых спермиев). При этом с возрастом площадь на срезах, занимаемая клетками более старших фаз, увеличивалась. Отдельные самцы, судя по площади, занимаемой на срезах массами зрелых спермиев, находились в состоянии близком к половому созреванию (рис. 4в, 4г).
В возрасте 14, 17 и 19 мес. были проанализированы гонады 17 особей (табл. 2). В отличие от предыдущего периода состояние семенников у этих самцов было сходным. Так, у 16 из них на поперечных срезах гонад присутствовали скопления зрелых сперматозоидов, хотя площади, занимаемые ими на срезах у разных особей, существенно варьировали. Вместе с тем во всех семенниках можно было видеть участки, где интенсивно осуществлялся процесс резорбции зрелых половых клеток. У одного самца в возрасте 14 мес. в гонадах присутствовали только гонии. Однако крупные размеры семенников, а также обильная васкуляризация стромы позволяли предположить, что у данной особи в гонадах ранее уже осуществлялись мейотические преобразования.
В возрасте 22 мес. состояние гонад у опытных самцов вновь качественно различалось. Так, у двух особей в семенниках (массой 0.2 и 0.5 г) присутствовали только гонии. В ходе микроскопического анализа можно было отметить обширные жировые отложения. В противоположность этому у четырёх других самцов масса гонад была значительно больше (26.5−50.5 г), семенники находились на III стадии зрелости, но лишь у одной особи в семенных канальцах присутствовали незначительные скопления зрелых спермиев.
ОБСУЖДЕНИЕ
Радужная форель не только популярный объект товарного выращивания, но и наиболее востребованный среди рыб модельный биологический объект (Игнатьева, 1975), поэтому её гаметогенез хорошо изучен (Титарев, 1975; Van den Hurk et al., 1980; Van den Hurk, Slof, 1981; Lebrun et al., 1982; Мгеладзе, Титарев, 1984; Nakari et al., 1987). Изучен и гаметогенез форели ропшинской породной группы, причём как в условиях рыбоводного хозяйства “Ропша” (Бабушкин, 1976; Леманова, 1976; Зимакова, Кузнецов, 1983; Кузнецов, Зимакова, 1983; Терентьева, 2005), так и в лабораторных условиях при воздействии разных факторов (Захарова, 1984; Алешин, 1987; Чмилевский, 2000). Мы, в свою очередь, изучали гаметогенез форели преимущественно в раннем онтогенезе (Зеленников, 1996; Zelennikov, 1997), но также и в течение полного репродуктивного цикла (Зеленников, 1999, 2003а). Все накопленные в литературе данные позволяют составить представление о естественном ходе гаметогенеза у радужной форели и заключить, что повышенная температура воды замедляет его темп и нарушает ход развития половых желёз как у самок, так и у самцов.
В яичниках у молоди форели мы выявили значительные жировые отложения. Впрочем, следует отметить, что корм Биомар, которым кормили рыб, предназначен для использования при более низкой температуре. Не исключено, что значительный объём жировых отложений в гонадах только косвенно связан с повышенной температурой и обусловлен потреблением корма, не соответствующего данным условиям. Наблюдаемое у форели разрастание стромальной ткани, при котором бóльшая часть гонады занята клетками стромы и жировыми отложениями, является абсолютно нехарактерным для лососёвых рыб. В норме из фонда ооцитов периода превителлогенеза формируется старшая генерация половых клеток, которые занимают практически весь объём гонад как у полицикличных (Мурза, Христофоров, 1991), так и у моноцикличных лососёвых рыб (Персов, 1975; Зеленников, 2003б). Именно рост этих клеток в дальнейшем определяет увеличение объёма и массы половых желёз. У форели, содержавшейся при температуре 19.8−20.5°С, вследствие замедления темпа оогенеза завершение репродуктивного цикла в течение 2 лет отмечено лишь у 36.6% самок, тогда как при 15−17°С доля таких рыб достигает 97.3% (Зеленников, 1999).
Полученные данные согласуются с литературными сведениями. Так, замедление темпа оогенеза при повышенной температуре уже отмечали ранее как у молоди радужной форели в краткосрочных опытах (Алешин, 1987), так и у других видов рыб (Lukšienė et al., 2000; Pawson et al., 2000). Показано, что содержание молоди форели при 21°С ускоряет цитологическую дифференцировку пола, но вызывает уменьшение числа митозов гониев и замедление роста ооцитов периода превителлогенеза (Алешин, 1987).
Отдельного внимания заслуживают работы о выращивании форели в странах с тропическим климатом, в которых авторы указывают на многочисленные нарушения развития гонад: асинхронность роста половых клеток, их резорбцию, уменьшение доли самок, достигающих полового созревания, и другие (Pankhurst et al., 1996; Pornsoping et al., 2007; Павлов и др., 2013). Однако сравнить данные выращивания форели в этих и наших условиях оказалось затруднительно. Во-первых, объектами аквакультуры в странах с тропическим климатом часто являются более приспособленные для этих условий триплоидные рыбы (Yamamoto, Iida, 1994), гаметогенез которых и в оптимальных условиях идёт с заметными отклонениями (Carrasco et al., 1998; Krisfalusi et al., 2000; Han et al., 2010). Именно в большей степени с триплоидией, а не с воздействием внешних факторов, авторы связывают анатомические и цитологические нарушения половых желёз (Павлов и др., 2013). Во-вторых, в условиях тропического климата особи оказываются за пределами толерантности сразу по нескольким важным параметрам (Павлов, 2011) и можно полагать, что именно воздействием комплекса факторов объясняются нарушения развития гонад. Так, в группе контрольных диплоидных рыб было выявлено 10% гермафродитных и 35% стерильных особей (Павлов и др., 2016), тогда как при более высокой температуре среди 210 особей мы не выявили ни одной гермафродитной или стерильной особи. Ранее, оказывая на молодь форели сублетальное кислотное воздействие, приводящее к гибели значительного числа рыб, мы также не выявили гермафродитных или стерильных рыб (Зеленников, 1997, 2003а).
В семенниках форели волну активного сперматогенеза мы наблюдали уже в возрасте 8 мес.; затем доля рыб, в гонадах которых присутствовали клетки в состоянии мейоза, увеличивалась, как увеличивалась и доля ткани семенников, занятая более зрелыми половыми клетками. Вместе с тем за весь период исследования не выявили ни одной особи с гонадами V стадии зрелости. Не исключено, что причиной этого могло быть отсутствие близких к половому созреванию самок. При температуре 15−17°С с возраста 12 мес. у всех самцов форели гонады находились на III или IV стадии зрелости (Зеленников, 1999). При повышенной температуре в настоящей работе в возрасте 12 мес. у 10 из 20 исследованных рыб гонады ещё находились на II стадии зрелости.
В завершении рассмотрим вопрос, очевидно, не связанный с воздействием повышенной температуры. Начиная с возраста 8 мес. мы отмечали массовую деформацию ооцитов периода превителлогенеза. В литературе аналогичную картину часто связывают с резорбцией ооцитов этого периода развития (Акимова и др., 1995; Емельянова и др., 2000). Вероятно, в каждом случае причины подобных деформаций могут быть свои (Подушка, 2000). Мы же не склонны рассматривать такую форму ооцитов как указание на начало их резорбции и связывать факт их появления с негативным воздействием повышенной температуры. Во-первых, с подобной картиной мы сталкивались, исследуя ход развития гонад у форели в течение полного репродуктивного цикла и при более низкой температуре (Зеленников, 1999). Во-вторых, в ходе периодических фиксаций при исследовании одной и той же партии форели мы, безусловно, обнаружили бы особей не только на начальных, но и на завершающих этапах резорбции ооцитов, тем более при такой массовой атрезии. В-третьих, деформация была характерна не для всех превителлогенных ооцитов, а только для клеток определённого размера. И, наконец, в-четвёртых, исследуя рыб одной партии в течение полного репродуктивного цикла, мы, несомненно, выявили бы уменьшение числа ооцитов у особей в возрасте после 8 мес. Можно предположить, что массовая деформация превителлогенных ооцитов определённого размера у самок форели объясняется несоответствием осмотичности цитоплазмы этих клеток использованному фиксатору.
По совокупности полученных данных и высказанных соображений мы можем сделать следующее заключение. В условиях выращивания при повышенной температуре у самок форели в раннем возрасте замедляется темп формирования и структуризации фонда ооцитов периода превителлогенеза. В гонадах наблюдается чрезмерное отложение жира и увеличение доли стромальной ткани. При переходе к вителлогенезу среди одновозрастных самок выделяются группы особей с разным темпом оогенеза. При этом доля рыб, достигающих полового созревания в возрасте около 2 лет, примерно в три раза меньше, чем в норме. В период, непосредственно предшествующий половому созреванию, у всех самок происходит тотальная резорбция ооцитов старшей генерации. У самцов период, в течение которого у разных особей в гонадах начинается волна активного сперматогенеза, чрезмерно растянут. Во время, непосредственно предшествующее половому созреванию, у всех особей происходит тотальная резорбция зрелых спермиев и вновь появляются самцы, у которых фонд половых клеток представлен только гониями.
Список литературы
Акимова Н.В., Панаиотиди А.И., Рубан Г.И. 1995. Нарушения в развитии и функционировании репродуктивной системы осетровых рыб (Acipenseridae) реки Енисей // Вопр. ихтиологии. Т. 35. № 2. С. 236−246.
Алешин С.А. 1987. Ранний гаметогенез радужной форели при различных пищевых и температурных режимах: Автореф. дис. … канд. биол. наук. Л.: ЛГУ, 20 с.
Бабушкин Ю.П. 1976. Сперматогенез и половые циклы самцов радужной форели // Сб. науч. тр. ГосНИОРХ. Вып. 117. С. 51−63.
Емельянова Н.Г., Макеева А.П., Зеленков В.М. и др. 2000. Развитие половых желез у радужной форели Parasalmo mykiss в условиях марикультуры Белого моря // Вопр. ихтиологии. Т. 40. № 3. С. 370−378.
Захарова Н.И. 1984. Морфофункциональные закономерности раннего гаметогенеза радужной форели (Salmo gairdneri Rich.) при различном температурном режиме и рентгеновском облучении: Автореф. дис. … канд. биол. наук. Л.: ЛГУ, 20 с.
Зеленников О.В. 1996. Ускорение и дифференциация оогенеза как формы адаптивной реакции репродуктивной системы рыб на кислотный стресс // ДАН. Т. 346. № 4. С. 570−572.
Зеленников О.В. 1997. Влияние закисления воды на становление и развитие воспроизводительной системы рыб в раннем онтогенезе: Автореф. дис. … канд. биол. наук. СПб.: ГосНИОРХ, 19 с.
Зеленников О.В. 1999. Гаметогенез радужной форели Onchorynchus mykiss, выращенной в системе с оборотным водоснабжением от вылупления до полового созревания при оптимальной температуре // Вопр. ихтиологии. Т. 39. № 1. С. 89−97.
Зеленников О.В. 2003а. Влияние закисления воды на гаметогенез радужной форели Parasalmo mykiss // Там же. Т. 43. № 3. С. 388−401.
Зеленников О.В. 2003б. Сравнительный анализ состояния яичников у молоди тихоокеанских лососей в связи с проблемой становления моноциклии // Там же. Т. 43. № 4. С. 490−498.
Зимакова И.Ю., Кузнецов Ю.К. 1983. Состояние семенников у разноразмерных двухлеток радужной форели на протяжении сезона выращивания // Сб. науч. тр. ГосНИОРХ. Вып. 203. С. 89−95.
Игнатьева Г.И. 1975. Радужная форель Salmo gairdneri Richardson, 1936 // Объекты биологии развития / Под ред. Детлаф Т.А. М.: Наука. С. 278−308.
Кузнецов Ю.К., Зимакова И.Ю. 1983. Состояние яичников у разноразмерных двухлеток радужной форели на протяжении сезона выращивания // Сб. науч. тр. ГосНИОРХ. Вып. 203. С. 63−71.
Леманова Н.А. 1976. Сравнительный анализ развития ооцитов периода трофоплазматического роста у радужной форели, принадлежащей к разным породным группам // Там же. Вып. 117. С. 19−30.
Мгеладзе Э.Г., Титарев Е.Ф. 1984. Развитие воспроизводительной системы форели на втором году жизни в зависимости от условий содержания // Сб. науч. тр. ВНИИПРХ. Вып. 43. С. 57−65.
Микодина Е.В., Седова М.А., Чмилевский Д.А. и др. 2009. Гистология для ихтиологов: опыт и советы. М.: Изд-во ВНИРО, 112 с.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Л.: Изд-во ГосНИОРХ, 102 с.
Павлов Е.Д. 2011. Состояние половых желёз лососёвых рыб в условиях интродукции: Автореф. дис. … канд. биол. наук. М.: Изд-во ВНИРО, 24 с.
Павлов Е.Д., Ганжа Е.В., Нгуен Вьет Туи, Нгуен Ти Хуан Ту. 2013. Состояние половых желёз годовиков триплоидной радужной форели в высокогорных условиях Южного Вьетнама при воздействии андрогенного гормона // Вопр. ихтиологии. Т. 53. № 6. С. 726–740.
Павлов Е.Д., Ганжа Е.В., Пономарева В.Ю. и др. 2016. Влияние метилтестостерона на физиологическое состояние и реореакцию радужной форели Parasalmo mykiss (=Oncorhynchus mykiss) при неблагоприятных условиях содержания // Там же. Т. 56. № 6. С. 740–752.
Персов Г.М. 1975. Дифференцировка пола у рыб. Л.: Изд-во ЛГУ, 148 с.
Подушка С.Б. 2000. Критический обзор публикаций о нарушениях репродуктивной системы у осетровых // Науч.-тех. бюл. лаб. ихтиологии ИНЭНКО. № 3. С. 9−30.
Терентьева Е.Г. 2005. Совершенствование ропшинских пород форели по возрасту полового созревания // Генетика, селекция и племенное дело в аквакультуре России / Под ред. Голода В.М. М.: Росинформагротех. С. 261−270.
Титарев Е.Ф. 1975. Ускорение полового созревания радужной форели (Salmo gairdneri Rich.) под влиянием повышенной температуры воды // Вопр. ихтиологии. Т. 15. Вып. 3. С. 565−566.
Чмилевский Д.А. 2000. Оогенез рыб в норме и при экстремальных воздействиях: Автореф. дис. … докт. биол. наук. СПб.: СПбГУ, 44 с.
Carrasco L.A.P., Doroshovo S., Penman D.J., Bromage N. 1998. Sexual differentiation and gametogenesis in triploid trout: the same story as in triploid chickens? // J. Exp. Zool. V. 281. № 5. P. 508.
Davies B., Swanson P., Bromage N. 1995. The effects of photoperiod and temperature on serum GTHI and GTHII and the timing of maturation in the female rainbow trout // Proc. 5-th Internat. Symp. “Reproductive physiology of fish” / Eds. Goetz F., Thomas P. Austin: Univ. Texas Press. P. 185.
Dockray J.J., Reid S.D., Wood C.M. 1996. Effects of elevated summer temperatures and reduced pH on metabolism and growth of juvenile rainbow trout (Oncorhynchus mykiss) on unlimited ration // Can. J. Fish. Aquat. Sci. V. 53. P. 2752−2763.
Han Y., Liu M., Lan Zang L. et al. 2010. Comparison of reproductive development in triploid and diploid female rainbow trout Oncorhynchus mykiss // J. Fish Biol. V. 76. № 7. P. 1742–1750.
Ineno T., Tsuchida S., Kanda M., Watabe S. 2005. Thermal tolerance of a rainbow trout Oncorhynchus mykiss strain selected by high-temperature breeding // Fish. Sci. V. 71. P. 767–775.
Krisfalusi M., Wheeler P.A., Thorgaard G.H., Cloud J.G. 2000. Gonadal morphology of female diploid gynogenetic and triploid rainbow trout // J. Exp. Zool. V. 286. № 5. P. 505−512.
Lebrun C., Billard R., Jalabert B. 1982. Changes in the number of germ cells in the gonads of the rainbow frout (Salmo gairdneri) during the first 10 post-hatching weeks // Repr. Nutr. Devel. V. 22. № 2. P. 405−412.
Lukšienė D., Sandström O., Lounasheimo L. Andersson J. 2000. The effects of thermal effluent exposure on the gametogenesis of female fish // J. Fish Biol. V. 56. P. 37–50.
Molony B. 2001. Environmental requirements and tolerances of rainbow trout (Oncorhynchus mykiss) and brown trout (Salmo trutta) with special reference to Western Australia: a review // Fish. Res. Rept. № 130. P. 1–28.
Nakari T., Soivio A., Pesonen S. 1987. Effects of an advanced photoperiod cycle on the gonadal development and spavning time of 2 year-old Salmo gairdneri R. reared in earth ponds under extreme annual water temperatures // Aquaculture. V. 67. P. 369−384.
Pankhurst N.W., Purser G.J., van der Kraak G. et al. 1996. Effect of holding temperature on ovulations, egg fertility, plasma levels of reproductive hormones and in vitro ovarian steridogenesis in the rainbow trout Oncorhynchus mykiss // Ibid. V. 146. P. 277–290.
Pawson M.G., Pickett G.D., Witthames P.R. 2000. The influence of temperature on the onset of first maturity in sea bass // J. Fish Biol. V. 56. P. 319–327.
Pornsoping P., Unsrisong G., Vearasilp T. et al. 2007. Reproductive performance of female rainbow trout Oncorhynchus mykiss (Walbaum) kept under water temperatures and photoperiods of 13° and 51°N latitude // Aquacult. Res. V. 38. № 12. P. 1265–1273.
Van den Hurk R., Slof G.A. 1981. A morphological and experimental study of gonadal sex differentiation in the rainbow trout, Salmo gairdneri // Cell Tiss. Res. V. 218. P. 487−497.
Van den Hurk R., Slof G.A., Schurer F.A. 1980. Gonadal sex differentiation in rainbow frout, Salmo gairdneri, with special reference to the effects of steroid hormones and N,N-Dimethylformamide // Gen. Comp. Endocrinol. V. 40. P. 323.
Yamamoto A., Iida T. 1994. Oxygen consumption and hypoxic tolerance of triploid rainbow trout (Oncorhynchus mykiss) // Fish Path. V. 29. P. 245−251.
Zelennikov O.V. 1997. The effect of acidification on the oogenesis of rainbow trout during sex differentiation // J. Fish Biol. V. 50. P. 18−21.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


