Вопросы ихтиологии, 2019, T. 59, № 2, стр. 163-173
Распределение и некоторые черты биологии двурогого бычка Enophrys diceraus (Cottidae) в российских водах Японского моря
В. В. Панченко 1, *, О. И. Пущина 1
1 Тихоокеанский научно-исследовательский рыбохозяйственный центр – ТИНРО-центр
Владивосток, Россия
* E-mail: vlad-panch@yandex.ru
Поступила в редакцию 16.04.2018
После доработки 25.06.2018
Принята к публикации 25.06.2018
Аннотация
В российских водах Японского моря двурогий бычок Enophrys diceraus в течение года встречается на глубинах от 4 до 605 м при температуре от –1.4 до +16.8°С. Летом концентрируется в диапазоне глубин 30–90 м при 7.3–2.1°С, зимой – 200–380 м при стабильной слабоположительной температуре. Осенью его нерестовые, а весной нагульные миграции направлены в сторону берега. У материкового побережья основные скопления формируются на юге (зал. Петра Великого) и в центральных областях, у островного – в южной части Сахалина. В северной части Татарского пролива скоплений не образует. В Японском море двурогий бычок достигает бóльших, чем в северных морях, размеров – длины 38 см и массы более 1 кг. Максимальные размеры присущи самцам. В северо-западной части Японского моря двурогий бычок является бентофагом-полифагом: молодь питается в основном двустворчатыми моллюсками, амфиподами и полихетами, взрослые особи – иглокожими (преимущественно офиурами) и моллюсками. Выявленная региональная и сезонная изменчивость состава пищи, по-видимому, обусловлена особенностями кормовой базы. В апреле–августе суточный рацион рыб длиной 11–30 см в среднем составляет 1.1% массы тела, снижаясь по мере их роста с 2.6 до 0.9%. Биомасса двурогого бычка в российских водах Японского моря в последние годы варьирует в пределах 5–7 тыс. т. Основная часть запаса сосредоточена у материкового побережья.
Двурогий бычок Enophrys diceraus – широкобореальный вид; вдоль азиатских берегов Тихого океана распространён от северного побережья п‑ова Корея до южной части Чукотского моря, в тихоокеанских водах Камчатки, Курильских о-вов, вокруг Хоккайдо, вдоль американских – до Юго-Восточной Аляски, включая Алеутские о-ва (Mori, 1952; Неелов, 1979; Сон Ён Хо, 1986; Линдберг, Красюкова, 1987; Kim, Yoon, 1992; Amaoka et al., 1995; Борец, 2000; Федоров, 2000; Шейко, Федоров, 2000; Mecklenburg et al., 2002; Федоров и др., 2003; Фадеев, 2005; Парин и др., 2014; Eschmeyer, 2018; Froese, Pauly, 2018). В российских водах Японского моря является обычным или массовым видом (Новиков и др., 2002; Соколовский и др., 2007). Несмотря на обширный ареал двурогого бычка, данные по его биологии весьма ограничены. Целенаправленные исследования проводились только у охотоморского побережья Камчатки (Токранов, 2013) и в зал. Петра Великого Японского моря (Соколовский, Соколовская, 1999; Панченко, 2005; Пущина и др., 2016). В других публикациях по Японскому морю содержатся лишь отрывочные сведения о его распределении и питании (Вдовин, Зуенко, 1997; Калчугин, 1998; Ким Сен Ток, 2001, 2004; Пущина, 2005; Соломатов, 2008; Панченко, Зуенко, 2009; Панченко и др., 2016).
Цель настоящей работы – на основе обобщения всех имеющихся у авторов данных охарактеризовать распределение, размерно-половую структуру, питание и состояние запасов двурогого бычка в российских водах Японского моря.
МАТЕРИАЛ И МЕТОДИКА
В работе использованы материалы донных траловых съёмок и контрольных тралений, проведённых ТИНРО-центром в российских водах Японского моря в разные сезоны 1981–2017 гг. Проанализированы данные 12313 тралений на глубинах от 2 до 935 м, из них 6954 сопровождались измерением температуры придонного слоя воды. Бóльшая часть тралений ниже 5-метровой изобаты выполнена донными тралами с мягким грунтропом, длиной верхней подборы от 20 до 69 м (горизонтальное раскрытие от 13 до 38 м) и ячеёй в кутце от 10 до 30 мм со скоростью 1.5–4.5 (в среднем 2.7) узлов. На меньших глубинах основным орудием лова был модифицированый в ТИНРО-центре бим-трал (Вдовин и др., 2009) с ячеёй в кутце 10 мм и горизонтальным раскрытием 3 м; скорость траления 1.3–3.4 (2.4) узла. Для получения сравнимых результатов при использовании тралов разных конструкций уловы рыб пересчитывали на плотность по формуле: P = B/S, где P – плотность, кг/км2; B – улов, кг; S – площадь траления, км2.
Деление на гидрологические сезоны проводили по классификации Зуенко (1994): зимний период – январь–февраль, весенний – март–апрель, летний – июнь–сентябрь, осенний – ноябрь–декабрь; май является переходным месяцем между весенним и летним сезонами, октябрь – между летним и осенним. Поскольку характер распределения донных рыб в мае ближе к таковому весной, а в октябре – к лету (Соломатов, 2008), май мы относим к весеннему сезону, а октябрь – к летнему.
Анализ пространственного распределения двурого бычка выполнен с помощью программного пакета CHARTMASTER методом сплайн-аппроксимации. Всего измерили абсолютную длину (TL) 38795 особей, из них 8014 с определением пола; индивидуально взвесили 1546 экз. Материал на питание (332 желудка) собирали в водах Приморья в апреле–августе. Обработку проб вели в соответствии с Методическим пособием (1974). Величину суточного рациона оценивали методом Новиковой (1949) в модификации Чучукало и Напазакова (1999) путём определения продолжительности переваривания исходной (восстановленной) массы кормовых организмов в зависимости от температуры придонного слоя воды. Средние величины и соотношение компонентов рациона вычислены с учётом биомассы отдельных размерных групп бычка и их вклада в общее потребление.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В северо-западной части Японского моря двурогий бычок относится к элиторально-сублиторальной группировке рыб, обитающих в пределах всего шельфа и проникающих в верхний отдел материкового склона (Соломатов, 2008). По нашим наблюдениям, в течение года он встречается в диапазоне глубин 4–605 м, а возможно, и глубже. Однако нахождение этого вида ниже 605 м требует дополнительного подтверждения, поскольку здесь всем тралениям, в которых он отмечался, предшествовали работы на меньших глубинах. В связи с сильным развитием шипов на голове двурогий бычок зачастую застревает в трале, при этом обладает высокой живучестью. Отдельные его особи могут остаться незамеченными, и при коротких промежутках между тралениями в следующем улове их можно ошибочно принять за свежепойманных.
Диапазон обитания двурого бычка наиболее узок в летний период (рис. 1). В это время он встречался в пределах 9–380 м при температуре воды 16.8–0.1°С, но основная масса рыб избегала чрезмерно прогреваемого мелководья, придерживаясь глубин 30–90 м со средней температурой 7.3–2.1°С (рис. 1в). По данным Токранова (2013), в северной части ареала, на западнокамчатском шельфе, батиметрическое распределение этого вида в летний период отличается: максимальная глубина обнаружения не превышает 80 м, его концентрации отмечаются на глубинах от 11 (минимальная глубина исследований) до 40 м; встречается при придонной температуре от 0.2 до 11.4°С (возможно, в неохваченном исследованиями прогреваемом прибрежье – и при большей), основные скопления формируются при температуре свыше 6°С.
Рис. 1.
Средние плотности двурогого бычка Enophrys diceraus (−◼−) и температурный режим (- × -) в разных диапазонах глубин в российских водах Японского моря по сезонам: а – зима, б – весна, в – лето, г – осень.
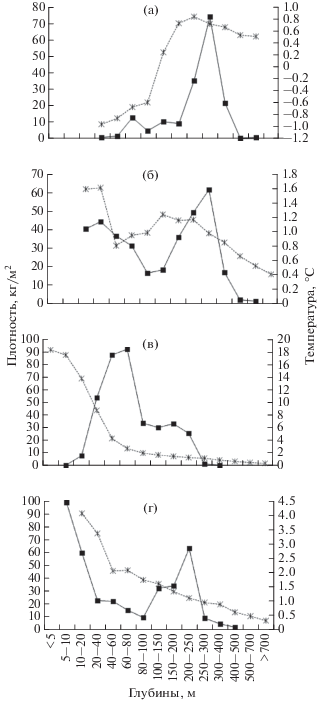
В осенний период диапазон обитания бычка расширяется как в сторону глубоководной, так и мелководной зон: в траловых уловах он встречался в пределах 6–439 м (рис. 1г) при температуре от –0.3 до +7.2°С. По данным Соколовского и Соколовской (1999), осенью двурогий бычок проникает и на меньшие глубины: в зал. Петра Великого преднерестовые особи регулярно присутствовали в уловах ставных сетей, выставленных на глубине 2–5 м, в конце октября–ноябре (позднее исследования из-за ледостава не проводили) при температуре от 8.6°С в начальный период наблюдений до 1.7°С – в конечный. Мы здесь в ноябре также обнаружили преднерестовую самку в сетном улове на глубине 4 м при придонной температуре 8.4°С. В этом месяце начинается нерест двурогого бычка: во второй половине ноября в зал. Петра Великого на глубине 7 м при температуре воды около 3°С мы наблюдали самца, охраняющего кладку икры нескольких самок (Панченко, 2005), а в Северном Приморье в середине ноября на глубине около 20 м при придонной температуре 4.9°С – отнерестившихся особей. Следовательно, образование наиболее плотных скоплений рыб в диапазоне 5–20 м обусловлено нерестовыми подходами (рис. 1г). С возрастанием глубины вплоть до 100-метровой изобаты уловы падали, после чего стали повышаться и достигли максимума в диапазоне глубин 200–250 м, где, видимо, начинали формироваться зимовальные скопления.
В зимний период двурогий бычок концентрировался в верхнем отделе материкового склона, в основном на глубинах 200–380 м при стабильной слабоположительной температуре воды (рис. 1а). В целом температурный диапазон его встречаемости в январе–феврале варьировал от –1.4 до +1.6°С, а наиболее глубоководная поимка отмечена на 538 м. Не исключено, что зимой он обитает и ниже, где репрезентативные данные за этот период у нас отсутствуют. На минимальных обследованных в январе–феврале глубинах (20–40 м), где температура воды опускается до отрицательных значений, плотность двурогого бычка была самой низкой. Между тем некоторая часть его особей может зимовать и на меньших глубинах в районе нерестилищ, поскольку нерестовое поведение двурогого бычка включает охрану самцами кладок икры (Панченко, 2005), а вылупление личинок происходит в весенний период (Соколовский, Соколовская, 1999).
В марте–мае, по нашим данным, нижняя граница обитания двурогого бычка составляет не менее 605 м (рис. 1б). В период весенних миграций выделялись две батиметрические зоны его концентраций: одна располагалась в верхнем отделе материкового склона на глубинах зимовки, вторая – в верхнем отделе шельфа. В последней наиболее высокие уловы отмечались на глубине 15–30 м, где температура воды весной постепенно повышалась, достигая в мае 7.6°С, хотя среднее сезонное значение здесь составило лишь 1.6°С. Наибольшие уловы двурогого бычка отмечались при температуре свыше 3°С. Таким образом, в шельфовой зоне концентрации рыб в весенний период располагались на меньших глубинах, чем в летний. Однако минимальная глубина обнаружения двурогого бычка весной была большей, чем летом (12 против 9 м). Отсутствие бычка в наших сборах выше 12-метровой изобаты, скорее всего, связано с малым числом выполненных здесь тралений, так как известно, что весной в зал. Петра Великого двурогий бычок поедает икру тихоокеанской сельди Clupea pallasii (Вдовин, Зуенко, 1997; Новиков и др., 2002), нерест которой протекает в основном на глубинах до 6 м (Амброз, 1931; Посадова, 1985). На наш взгляд, проникновению бычка в мелководную зону способствует благоприятный для него гидрологический фон: в апреле придонная температура в заливе на глубине 3–7 м составляет ~5.7°С, в мае – ~10.8°С (Панченко, 2002).
Пространственное распределение двурогого бычка в российских водах Японского моря (рис. 2) отличается неоднородностью, что хорошо видно на примере летнего периода (рис. 2в). В это время наибольшие его концентрации формировались на широком шельфе юга района, в западной и центральной частях зал. Петра Великого. С продвижением в северо-восточном направлении плотность вида снижалась: за исключением небольшого пятна повышенной биомассы в районе 43°–44° с.ш. вдоль материкового побережья значительных концентраций не наблюдалось. На большей части примыкающей к островному побережью акватории Татарского пролива плотность рыб была минимальной и только южнее 48° с.ш. отмечались области высокой населённости.
Рис. 2.
Пространственное распределение двурогого бычка Enophrys diceraus в российских водах Японского моря по сезонам: а – зима, б – весна, в – лето, г – осень.
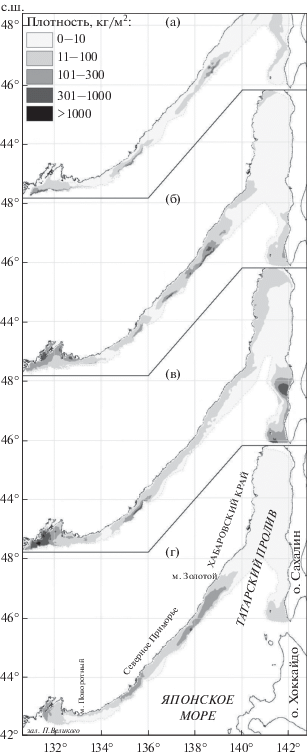
К сожалению, мы не располагаем репрезентативными данными о распределении двурогого бычка в западной части зал. Петра Великого в осенний период, но, судя по его концентрации в прилегающих водах залива (рис. 2г), можно предположить, что в ноябре–декабре здесь сохранялась высокая плотность вида. В южной части Северного Приморья концентрации бычка располагались в том же районе, что и летом, но были смещены на меньшие глубины вследствие подходов половозрелых особей на нерестилища. В центральной части материковой акватории наблюдались более плотные по сравнению с летом скопления двурогого бычка, образующиеся, видимо, в результате его миграций из северных и центральных районов Татарского пролива. Для этой области Японского моря характерен субарктический тип вертикальной структуры вод с пониженными значениями температуры и солёности (Зуенко, 2008), неблагоприятными для обитания многих видов гидробионтов, в том числе таких представителей семейства рогатковых, как красный Alcichthys elongatus и длинношипый Taurocottus bergii бычки (Панченко и др., 2011, 2015). Очевидно, что и в январе–феврале плотность двурогого бычка на большей части Татарского пролива остаётся минимальной, однако подтвердить это эмпирическими данными (ввиду отсутствия здесь работ в зимний период) не представляется возможным. На остальной обследованной акватории пространственное распределение вида зимой было сходным с таковым осенью, отличаясь только смещением рыб в более глубоководную мористую зону (рис. 2а).
С весенним прогревом вод, когда рыбы перемещаются к местам летнего нагула, плотность двурогого бычка в центральной части материкового побережья ещё оставалась высокой, хотя одновременно происходило постепенное её увеличение в водах Хабаровского края и у островного побережья Татарского пролива (рис. 2б). Высокие плотности отмечались и на юге российских вод, в зал. Петра Великого, однако здесь в отличие от летнего сезона двурогий бычок распределялся равномерней: не отмечалось выраженное ядро плотности в западной части залива, зато в восточной уловы достигали более высоких значений, чем летом.
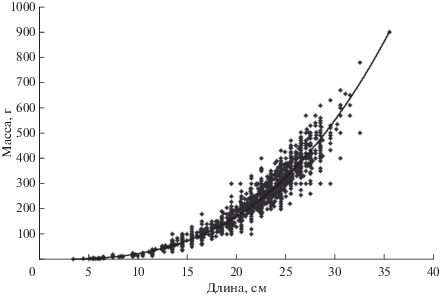
По мнению Фадеева (2005), наибольших размеров (TL 32 см и масса 760 г) двурогий бычок достигает в южной части ареала – в зал. Петра Великого. По нашим данным, максимальные размеры его здесь и в прилегающих районах Северного Приморья ещё выше – до 38 см (Панченко, 2005; Панченко и др., 2016). Для исследованной выборки особей TL 3.5–35.5 см и массой (W) 2–900 г связь между длиной и массой двурогого бычка описывается степенной зависимостью W = 0.0286TL2.9019, R2 = 0.9545 (рис. 3), согласно которой масса рыб максимального размера (38 см) составляет 1.1 кг.
Рис. 3.
Зависимость между длиной (TL) и массой двурогого бычка Enophrys diceraus в российских водах Японского моря.
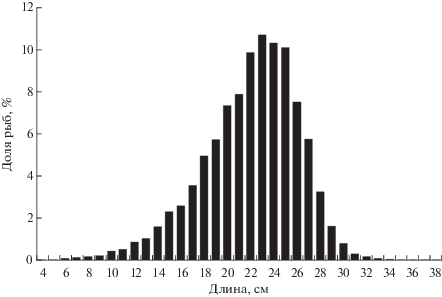
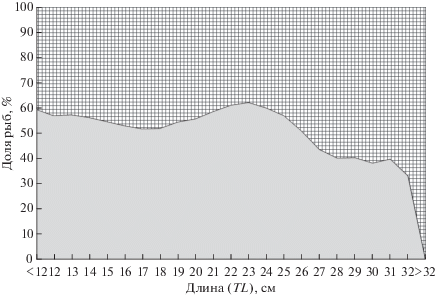
Среди бычков TL < 23 см доля пойманных особей каждого размерного класса поступательно возрастает, по мере дальнейшего увеличения размеров она снижается (рис. 4). С ростом рыб их численность в результате смертности уменьшается, отмеченная для двурогого бычка TL < 23 см обратная зависимость объясняется снижением уловистости тралящих орудий лова с уменьшением размеров рыб. Уменьшение же доли учтённых особей двурогого бычка TL > 23 см объективно отражает падение их численности в результате элиминации старших размерно-возрастных групп.
Рис. 4.
Размерный состав (TL) двурогого бычка Enophrys diceraus в уловах донного трала в российских водах Японского моря.
Как было показано ранее (Панченко, 2005), в зал. Петра Великого самцы двурогого бычка достигают большей длины, чем самки, хотя в целом доля самок в популяции этого вида несколько выше. Наши исследования, охватившие и другие районы Японского моря, подтвердили эти закономерности (рис. 5). Следует отметить, что с ростом бычка соотношение полов в его размерных классах постоянно меняется. Среди мелких неполовозрелых особей доля самок несколько выше, после чего численность самцов постепенно возрастает, и среди рыб TL 17–18 см соотношение полов примерно равное. В репродуктивной части популяции двурогого бычка (TL > 18 см) численность самцов, напротив, снижается, но по достижении TL 23 см вновь возрастает, и среди рыб TL > 32 см самки не встречаются. Уменьшение доли самок среди относительно крупных особей обусловлено наступлением у них этапа старения (и, соответственно, возрастания естественной смертности) при меньших, чем у самцов размерах. Изменения же в соотношении полов среди рыб меньших размеров можно связать с различиями в темпах роста самцов и самок на предшествующих этапах жизненного цикла.
Рис. 5.
Соотношение размерных групп самцов ( ) и самок (◼) двурогого бычка Enophrys diceraus в российских водах Японского моря.
) и самок (◼) двурогого бычка Enophrys diceraus в российских водах Японского моря.
Сведения по трофологии двурогого бычка немногочисленны и порой противоречивы. Одни авторы характеризуют его как бентофага, предпочитающего офиур (Ophiuroidea) (Fujita et al., 1995), многощетинковых червей (Polychaeta) и амфипод (Amphipoda) (Токранов, 2016), другие – как эврифага, использующего помимо бентоса гидроидных медуз (Hydrozoa) (Чучукало, 2006), икру и молодь рыб (Табунков, Чернышева, 1985; Новиков и др., 2002). Ким Сен Ток (2001) отмечает, что зимой на материковом склоне Юго-Западного Сахалина бычок питается исключительно офиурами, но в то же время объединяет его с потребителями амфипод, эвфаузиид (Euphausiacea), креветок (Pandalidae, Crangonidae) и кальмаров (Gonatidae).
Результаты наших исследований показали, что в северо-западной части Японского моря двурогий бычок является бентофагом-полифагом. В весенне-летний период более 80% его рациона формируют представители самых массовых групп донных беспозвоночных – иглокожих (офиуры, молодь морских ежей Echinoidea), двустворчатых моллюсков (Bivalvia) и полихет, причём с ростом рыб потребление ими червей и моллюсков сокращается, а иглокожих (особенно офиур Ophiura sarsi) возрастает (таблица). Из других компонентов корма наиболее значительную роль в питании бычка играют ракообразные: амфиподы входят в состав основной пищи его молоди TL 11–15 см, а декаподы (раки-отшельники Paguridae и молодь обыкновенного краба-стригуна Chionoecetes opilio) существенно дополняют рацион взрослых особей.
Состав пищи двурого бычка Enophrys diceraus в северо-западной части Японского моря (апрель–август), % массы
| Компонент пищи и другие показатели | Размерная группа, см | В среднем | |||
|---|---|---|---|---|---|
| 11–15 | 16–20 | 21–25 | 26–30 | ||
| Polychaeta | 24.3 | 21.8 | 14.1 | 0.8 | 11.7 |
| Aphrodita australis | – | 3.7 | 1.1 | – | 1.3 |
| Arctonoe vittata | – | 2.7 | – | – | 0.6 |
| Nereis sp. | – | 7.5 | – | – | 1.7 |
| Euphrosyne hortensis | – | 4.2 | – | – | 0.9 |
| Lumbrineris sp. | 2.3 | – | – | – | + |
| Cirratulidae gen. sp. | 7.5 | – | – | – | + |
| Pherusa plumosa | – | 1.4 | 3.2 | – | 1.8 |
| Ampharetidae gen. sp. | – | 0.7 | 1.3 | 0.3 | 0.9 |
| Sabellidae gen. sp. | – | 0.3 | 7.7 | – | 3.6 |
| Polychaeta varia | 14.5 | 1.3 | 0.8 | 0.5 | 0.9 |
| Echiurida | – | 3.3 | 1.0 | 1.7 | 1.7 |
| Amphipoda | 27.3 | 3.2 | 0.6 | – | 1.1 |
| Anonyx lilljeborgi | 27.2 | 0.1 | 0.1 | – | 0.2 |
| Amphipoda varia | 0.1 | 3.1 | 0.5 | – | 0.9 |
| Decapoda | 0.9 | 14.7 | 7.4 | 9.1 | 9.4 |
| Pandalus prensor | 0.9 | 2.7 | – | – | 0.6 |
| Pagurus anomalus | – | 4.2 | – | – | 0.9 |
| P. brachiomastus | – | – | 0.6 | 1.0 | 0.6 |
| P. pubescens | – | – | 3.0 | 7.2 | 3.6 |
| Chionoecetes opilio | – | 7.8 | 3.8 | 0.9 | 3.7 |
| Loricata | 2.6 | 1.3 | – | – | 0.3 |
| Gastropoda | 0.6 | – | 1.5 | 0.5 | 0.9 |
| Bivalvia | 35.0 | 26.6 | 21.0 | 27.2 | 24.4 |
| Nucula sp. | 7.4 | 0.1 | 0.9 | – | 0.5 |
| Yoldia pseudonotabile | 6.8 | 23.9 | 4.1 | – | 7.2 |
| Chlamys chosenica | – | – | 2.9 | 19.4 | 7.4 |
| Parvamussium alaskensis | – | – | – | 6.9 | 2.2 |
| Clinocardium ciliatum | – | 1.4 | 3.5 | – | 1.9 |
| Serripes groenlandicus | 20.3 | 0.1 | 0.5 | – | 0.4 |
| S. notabilis | – | – | 8.4 | – | 3.9 |
| Bivalvia varia | 0.5 | 1.1 | 0.7 | 0.9 | 0.9 |
| Echinoidea | 3.3 | 10.3 | 19.3 | 14.9 | 15.9 |
| Strogylocentrotus intermedius | 3.3 | 2.5 | – | – | 0.6 |
| S. pallidus | – | 7.8 | 19.3 | 14.9 | 15.3 |
| Ophiuroidea | 6.0 | 16.6 | 33.0 | 45.8 | 33.2 |
| Ophiopholis aculeata | 3.3 | 4.1 | 1.3 | 5.0 | 3.1 |
| Amphiodia rossica | – | 3.0 | 7.3 | – | 4.0 |
| Ophiura maculata | 1.7 | 3.1 | – | 1.9 | 1.3 |
| O. sarsi | – | 1.6 | 24.2 | 38.9 | 23.7 |
| Ophiurae varia | 1.0 | 4.8 | 0.2 | – | 1.1 |
| Ascidiae | – | – | 2.0 | – | 0.9 |
| Прочие | – | 2.2 | 0.1 | – | 0.5 |
| Средний суточный рацион, % массы тела | 2.6 | 1.8 | 1.1 | 0.9 | 1.1 |
| Число желудков, шт. | 33 | 103 | 133 | 63 | 332 |
| Доля пустых желудков, % | 36.4 | 36.9 | 48.9 | 34.9 | 41.3 |
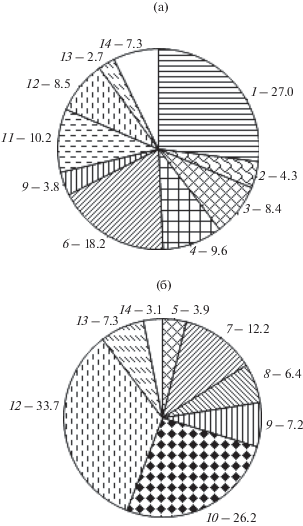
Соотношение и таксономический состав ведущих групп кормовых организмов в желудках двурогого бычка в зал. Петра Великого и в водах Северного Приморья заметно различаются (рис. 6). Если в первом районе 27.0% массы пищи рыб приходится на полихет, 22.0% – на двустворчатых моллюсков (с доминированием Yoldia pseudonotabile), 21.4% – на офиур (главным образом, Amphiodia rossica и O. sarsi) и 18.0% – на декапод (раков-отшельников, молодь краба-стригуна), то во втором доля иглокожих (за счёт O. sarsi и молоди палевого морского ежа Strogylocentrotus pallidus) достигает 67.2%, двустворчатых моллюсков (преимущественно молоди бело-розового гребешка Chlamys chosenica и Serripes notabilis) – 25.8%, а полихеты и декаподы составляют соответственно всего 1.6 и 3.9%. Перечисленные различия в питании бычка связаны, очевидно, с региональными особенностями его кормовой базы. По данным литературы (Шунтов, 2001; Надточий, Галышева, 2012), при сходных величинах средней биомассы макрозообентоса на глубине до 300 м в зал. Петра Великого (338.4 г/м3) и в водах Северного Приморья (358.0 г/м3) концентрация полихет на единицу площади в первом районе в 2.3 раза превышает таковую во втором; средняя биомасса двустворчатых моллюсков различается менее значительно (в 1.3 раза), а иглокожих находится практически на одном уровне. Однако в заливе свыше 60% последних слагают не используемые рыбами голотурии (Holothuroidea) и морские звёзды (Asteroidea) (Надточий, Галышева, 2012), тогда как у побережья Северного Приморья (судя по приведённому в работе Шунтова (2001) списку наиболее массовых видов) преобладают офиуры и морские ежи. Что касается отсутствия здесь молоди краба-стригуна в желудках рыб, то его можно объяснить в целом более низкой, чем в зал. Петра Великого, численностью этого вида севернее м. Поворотный (Слизкин, Кобликов, 2013).
Рис. 6.
Состав пищи (% массы) двурогого бычка Enophrys diceraus в весенне-летний период в зал. Петра Великого (а) и в водах Северного Приморья (б): 1 – Polychaeta, 2 – Echiurida, 3 – Paguridae, 4 – Chionoecetes opilio, 5 – Decapoda, 6 – Yoldia pseudonotabile, 7 – Chlamys chosenica, 8 – Serripes notabilis, 9 – остальные Bivalvia, 10 – Echinoidea, 11 – Amphiodia rossica, 12 – Ophiura sarsi, 13 – остальные Ophiuroidea, 14 – прочие.
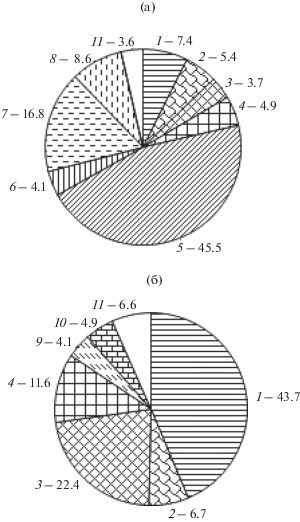
Наряду с размерно-возрастной и региональной у двурого бычка хорошо выражена сезонная изменчивость состава пищи, обусловленная, по-видимому, особенностями его распределения и биотопическими различиями состава бентоса. Например, в зал. Петра Великого весной, когда основная масса бычка придерживается северо-восточных участков шельфа (рис. 2б), в рационе его взрослых особей доминируют двустворчатые моллюски (49.6%) и офиуры (27.1%) (рис. 7а). В летние месяцы, после смещения основных концентраций рыб в юго-западный и центральный районы залива (рис. 2в), где биомасса моллюсков на порядок меньше (Надточий, Галышева, 2012), главной пищей бычка становятся полихеты (43.7%) и декаподы (34.0%) (рис. 7б).
Рис. 7.
Состав пищи (% массы) двурогого бычка Enophrys diceraus TL 16–30 см в зал. Петра Великого в апреле–мае (а) и июне–августе (б): 1 – Polychaeta, 2 – Echiurida, 3 – Paguridae, 4 – Chionoecetes opilio, 5 – Yoldia pseudonotabile, 6 – остальные Bivalvia, 7 – Amphiodia rossica, 8 – Ophiura sarsi, 9 – Ophiuroidea, 10 – Ascidiae, 11 – прочие.
Летом в зал. Петра Великого среди массовых представителей рогатковых двурогий бычок отличается самой низкой интенсивностью питания (Пущина и др., 2016). Слабая кормовая активность этого вида в нагульный период ранее была отмечена в зал. Терпения (Табунков, Чернышева, 1985) и на западнокамчатском шельфе, где в июле суточный рацион особей TL 10–20 см оценён ориентировочно в 1.4% массы тела (Чучукало, 2006). По нашим расчётам, в северо-западной части Японского моря в апреле–августе суточный рацион двурогого бычка составляет в среднем 1.1%, снижаясь по мере роста рыб с 2.6 до 0.9% (таблица). Значительной сезонной динамики интенсивности питания бычка в исследованный период не наблюдается, хотя величина рациона взрослых особей TL 16–30 см в апреле–мае несколько выше, чем в июне–августе (соответственно 1.4 и 1.0%).
По данным учётных траловых съёмок ТИНРО-центра, в последние 10 лет биомасса двурогого бычка в российских водах Японского моря (рассчитанная с использованием коэффициента уловистости 0.5) варьирует в пределах 5–7 тыс. т. Основная часть запаса сосредоточена у материкового побережья, однако доля его в межгодовом и сезонном аспектах меняется. О современном состоянии запасов можно судить по съёмке 2015 г., когда в весенне-летний период последовательно обследовались все участки российских вод Японского моря: зал. Петра Великого, побережье Северного Приморья, Хабаровского края и Западного Сахалина. В этот период учтено 6.76 тыс. т двурогого бычка, что, на наш взгляд, объективно отражает современное состояние его запасов в российских водах Японского моря.
ВЫВОДЫ
1. В российских водах Японского моря двурогий бычок в течение года встречается на глубинах от 4 до 605 м при температуре от –1.4 до +16.8°С. Летом концентрируется в диапазоне глубин 30–90 м при 7.3–2.1°С, зимой – 200–380 м при стабильной слабоположительной температуре. Осенью его нерестовые, а весной нагульные миграции направлены в сторону берега. У материкового побережья основные скопления формируются на юге (зал. Петра Великого) и в центральных областях, у островного – в южной части Сахалина. В северной части Татарского пролива скоплений не образует.
2. В Японском море, на юге ареала, двурогий бычок достигает бóльших, чем в северных морях, размеров – длины 38 см и массы более 1 кг. Максимальные размеры присущи самцам. Среди молоди доля самок выше, с приближением половой зрелости соотношение полов выравнивается, самки TL > 32 см не встречаются.
3. В северо-западной части Японского моря двурогий бычок является бентофагом-полифагом: молодь питается в основном двустворчатыми моллюсками, амфиподами и полихетами, взрослые особи – иглокожими (преимущественно офиурами) и моллюсками. Выявленная региональная и сезонная изменчивость состава пищи, по-видимому, обусловлена особенностями кормовой базы. В весенне-летний период величина суточного рациона особей TL 11–30 см в среднем составляет 1.1% массы тела, снижаясь по мере роста рыб с 2.6 до 0.9%.
4. Биомасса двурогого бычка в российских водах Японского моря в последние годы варьирует в пределах 5–7 тыс. т. Основная часть запаса сосредоточена у материкового побережья.
Список литературы
Амброз А.И. 1931. Сельдь (Clupea harengus pallasi C. V.) залива Петра Великого. Биологический очерк // Изв. ТИНРО. Т. 6. 313 с.
Борец Л.А. 2000. Аннотированный список рыб дальневосточных морей. Владивосток: Изд-во ТИНРО-центр, 192 с.
Вдовин А.Н., Зуенко Ю.И. 1997. Вертикальная зональность и экологические группировки рыб залива Петра Великого // Изв. ТИНРО. Т. 122. С. 152–176.
Вдовин А.Н., Мизюркин М.А., Пак А. 2009. Возможности использования бим-трала для прямых учетов гидробионтов // Вопр. рыболовства. Т. 10. № 1(37). С. 150–160.
Зуенко Ю.И. 1994. Типы термической стратификации вод на шельфе Приморья // Комплексные исследования морских гидробионтов и условий их обитания. Владивосток: Изд-во ТИНРО. С. 20–39.
Зуенко Ю.И. 2008. Промысловая океанография Японского моря. Владивосток: Изд-во ТИНРО-центр, 227 с.
Калчугин П.В. 1998. Распределение рогатковых (Cottidae) у северного Приморья // Изв. ТИНРО. Т. 123. С. 82–88.
Ким Сен Ток. 2001. Зимние миграции шельфовых рыб в зону материкового склона юго-западного Сахалина // Вопр. ихтиологии. Т. 41. № 5. С. 593–604.
Ким Сен Ток. 2004. Сезонные особенности вертикальной структуры ихтиоценов западносахалинского шельфа и островного склона // Там же. Т. 44. № 1. С. 77–88.
Линдберг Г.У., Красюкова З.В. 1987. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 5. Л.: Наука, 526 с.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. 1974. М.: Наука, 254 с.
Надточий В.А., Галышева Ю.А. 2012. Современное состояние макробентоса залива Петра Великого // Современное экологическое состояние залива Петра Великого Японского моря. Владивосток: Издат. дом ДВФУ. С. 129–174.
Неелов А.В. 1979. Сейсмосенсорная система и классификация керчаковых рыб. Л.: Наука, 207 с.
Новиков Н.П., Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2002. Рыбы Приморья. Владивосток: Изд-во Дальрыбвтуз, 552 с.
Новикова Н.С. 1949. О возможности определения суточного рациона рыб в естественных условиях // Вестн. МГУ. № 9. С. 107–111.
Панченко В.В. 2002. Сезонное распределение бычков рода Myoxocephalus (Cottidae) в прибрежной зоне залива Петра Великого (Японское море) // Вопр. ихтиологии. Т. 42. № 1. С. 64–69.
Панченко В.В. 2005. Сезонное распределение двурогого бычка Enophrys diceraus (Cottidae) в заливе Петра Великого Японского моря // Биология моря. Т. 31. № 5. С. 323–328.
Панченко В.В., Зуенко Ю.И. 2009. Распределение бычков семейства Cottidae в заливе Петра Великого Японского моря в летний период // Вопр. рыболовства. Т. 10. № 4 (40). С. 750–763.
Панченко В.В., Пущина О.И., Антоненко Д.В. и др. 2011. Распределение и некоторые черты биологии красного бычка Alcichthys elongatus (Cottidae) в северо-западной части Японского моря // Вопр. ихтиологии. Т. 51. № 2. С. 195–204.
Панченко В.В., Пущина О.И., Милованкин П.Г, Нуж-дин В.А. 2015. Распределение и некоторые черты биологии длинношипого бычка Берга Taurocottus bergii (Cottidae) в северо-западной части Японского моря // Там же. Т. 55. № 3. С. 313–322.
Панченко В.В., Калчугин П.В., Соломатов С.Ф. 2016. Уточнение глубин обитания и максимальных размеров донных и придонных видов рыб в российских водах Японского моря // Там же. Т. 56. № 3. С. 264–283.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Посадова В.П. 1985. Межгодовая изменчивость нерестовых подходов сельди залива Петра Великого // Сельдевые северной части Тихого океана. Владивосток: Изд-во ТИНРО. С. 22–29.
Пущина О.И. 2005. Питание и пищевые взаимоотношения массовых видов донных рыб в водах Приморья в весенний период // Изв. ТИНРО. Т. 142. С. 246–269.
Пущина О.И., Соломатов С.Ф., Калчугин П.В., Будникова Л.Л. 2016. Питание и пищевые отношения массовых видов рогатковых (Cottidae, Pisces) зал. Петра Великого (Японское море) в летний период // Там же. Т. 184. С. 186–203.
Слизкин Ф.Г., Кобликов В.Н. 2013. Динамика биологических параметров, распределение и некоторые вопросы прогнозирования состояния запасов краба-стригуна опилио Chionoecetes opilio в южной части подзоны Приморье // Там же. Т. 175. С. 26–41.
Соколовский А.С., Соколовская Т.Г. 1999. Ранний онтогенез двурогого бычка Enophrys diceraus (Cottidae) из вод залива Петра Великого (Японское море) // Вопр. ихтиологии. Т. 39. № 2. С. 273–277.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. 2007. Рыбы российских вод Японского моря: аннотированный и иллюстрированный каталог. Владивосток: Дальнаука, 200 с.
Соломатов С.Ф. 2008. Состав и многолетняя динамика донных ихтиоценов северного Приморья: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр, 24 с.
Сон Ён Хо. 1986. О распределении рыб в прибрежных водах Восточного моря // Тр. Вонсан. ин-та рыб. хоз-ва Восточ. моря. № 1. С. 132–150.
Табунков В.Д., Чернышева Э.Р. 1985. Питание непромысловых видов рыб в заливе Терпения // Изв. ТИНРО. Т. 110. С. 98–104.
Токранов А.М. 2013. Особенности распределения и размерные показатели четырех малоизученных видов рогатковых рыб (Cottidae) в прикамчатских водах Охотского моря // Вопр. ихтиологии. Т. 53. № 4. С. 430–441.
Токранов А.М. 2016. Трофические группировки рогатковых рыб (Cottidae) в прикамчатских водах // Матер. Всерос. науч.-практ. конф. “Морские биологические исследования: достижения и перспективы”. Т. 2. Севастополь: ЭКОСИ-Гидрофизика. С. 182–185.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северо-западной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Федоров В.В. 2000. Видовой состав, распределение и глубины обитания видов рыбообразных и рыб северных Курильских островов // Промыслово-биологические исследования рыб в тихоокеанских водах Курильских о-вов и прилежащих районах Охотского и Берингова морей в 1992−1998 гг. М.: Изд-во ВНИРО. С. 7−41.
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. 2003. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука, 204 с.
Чучукало В.И. 2006. Питание и пищевые отношения нектона и нектобентоса в дальневосточных морях. Владивосток: Изд-во ТИНРО-центр, 483 с.
Чучукало В.И., Напазаков В.В. 1999. К методике определения суточных рационов питания и скорости переваривания пищи у хищных и бентосоядных рыб // Изв. ТИНРО. Т. 126. С. 160–171.
Шейко Б.А., Федоров В.В. 2000. Глава 1. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных Камчатки и сопредельных морских акваторий / Под ред. Моисеева Р.С., Токранова А.М. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Шунтов В.П. 2001. Биология дальневосточных морей России. Т. 1. Владивосток: Изд-во ТИНРО-центр, 580 с.
Amaoka K., Nakaya K., Yabe M. 1995. The fishes of Northern Japan. Sapporo: Kita-Nihon Kaiyo Center Co. Ltd., 391 p.
Eschmeyer W.N. 2018. Catalog of fishes. Version 03/2018. (http://researcharchive.calacademy.org/research/Ichthyology/catalog/fishcatmain.asp)
Froese R., Pauly D. (eds.). 2018. Fishbase. World Wide Web electronic publication. Version 02/2018. (www.fishbase.org)
Fujita T., Kitagawa D., Okuyama Y. et al. 1995. Diets of the demersal fishes on the shelf off Iwate, northern Japan // Mar. Biol. V. 123. № 2. P. 219–233.
Kim I.-S., Yoon C.-H. 1992. Synopsis of the Family Cottidae (Pisces: Scorpaeniformes) from Korea // Korean J. Ichthyol. V. 4. № 1. P. 54–79.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. 2002. Fishes of Alaska. Bethesda, Maryland: Amer. Fish. Soc., 1037 p.
Mori T. 1952. Check-list of the fishes of Korea // Mem. Hyogo Univ. Agric. V. 1. № 3. P. 1–228.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


