Вопросы ихтиологии, 2019, T. 59, № 2, стр. 186-194
Особенности питания пескороек речной миноги Lampetra fluviatilis из реки Чёрная (бассейн Балтийского моря)
Н. В. Полякова 1, А. В. Кучерявый 1, *, Д. С. Павлов 1, И. А. Цимбалов 1
1 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
* E-mail: kucheryavyy@sevin.ru
Поступила в редакцию 16.05.2018
После доработки 16.05.2018
Принята к публикации 22.05.2018
Аннотация
Приведены результаты анализа пищевого комка личинок речной миноги Lampetra fluviatilis, пойманных в мае в р. Чёрная. Проведён количественный анализ основных пищевых компонентов, установлен таксономический состав водорослей и беспозвоночных. Содержимое пищевого тракта в основном (>90% массы) состоит из песка и детрита, в его состав также входят водоросли и беспозвоночные. Впервые среди пищевых объектов в больших количествах обнаружены диатомовые, другие планктонно-перифитонные одноклеточные водоросли и ценобии, а также планктонные коловратки. Показано, что существенную роль в питании пескороек могут играть организмы из речного потока.
Исследование питания позволяет получить важную информацию об образе жизни, трофических связях и роли организмов в экосистеме. Данные по питанию личинок миног (Petromyzontidae) – пескороек – малочисленны и сводятся в основном к общим сведениям о качественном составе пищевого комка. Впервые содержимое кишечника пескороек описано у Lethenteron appendix (Creaser, Hann, 1929); авторы отметили большое количество песка и растительных остатков и показали, что объектами питания являются диатомовые (Bacillariophyta) и десмидиевые (Desmidiales) водоросли.
Авторы обычно указывают, что личинки миног, являясь фильтраторами, питаются детритом, включающим растительные и животные остатки, донные водоросли, большей частью диатомовые (Hardisty, Potter 1971; Moore, Mallatt, 1980; Макеева и др., 2011; Лошакова, Книжин, 2015). Также отмечают, что встречаются мейобентосные животные: мелкие моллюски, личинки хирономид (Chironomidae), амфиподы (Amphipoda), нематоды (Nematoda), иногда донные коловратки (Rotifera) (Moore, Potter, 1976; Назаров, 2012). В большинстве работ не приведён таксономический список организмов, что делает невозможным сравнение состава пищи личинок одного вида в разные сезоны, из разных биотопов внутри одного водоёма или из разных рек, а также проведение межвидового анализа. Кроме того, при отсутствии таксономических списков невозможно понять принадлежность пищевых объектов к донным или планктонным формам. Отсутствие количественных данных также затрудняет сравнение и не позволяет оценить участие отдельных компонентов в питании личинок.
В ряде работ оценена роль органической составляющей детрита в рационе (Sutton, Bowen, 1994; Bowen et al., 1998), веществ автохтонного и аллохтонного происхождения (Hollet, 1995; Evans, Bauer, 2016). В экспериментальных исследованиях питания пескороек установлена способность личинок потреблять различную пищу, а также определена усвояемость отдельных её компонентов (Moore, Potter, 1976; Mallatt, 1983; Bowen et al., 1998; Jolley et al., 2012).
Цель работы – провести качественный и количественный состав пищевого комка личинок речной миноги Lampetra fluviatilis и установить экологическую принадлежность организмов – компонентов пищевого комка.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в середине мая 2016 г. в 5.9 км от устья р. Чёрная, впадающей в Финский залив Балтийского моря (60°13′15.74″ с.ш. 29°30′56.26″ в.д.). Температура воды составляла 16–17°C. Личинок ловили сетью Киналёва в полдень в типичном местообитании – илистом грунте, покрытом слоем детрита у отвесного берега. Всего поймано 39 личинок, питание проанализировано у 30 особей общей длиной тела (TL) 16–109 мм. Параллельно для оценки состава пищевых объектов отобраны пробы грунта, воды непосредственно над грунтом, а также отфильтровано 100 л воды из основного потока через сеть Апштейна (газ № 70). Весь материал зафиксирован 4%-ным раствором формальдегида.
Анализ питания проводили по общепринятым методикам (Инструкция …, 1971; Методические рекомендации …, 1984). После определения длины и массы тела личинок вскрывали, извлекали и взвешивали кишечник. Степень наполнения пищеварительного канала оценивали визуально в баллах по 6-балльной шкале Лебедева (1936). Пищевая трубка у пескороек практически не дифференцирована на отделы, поэтому её визуально делили на три части – переднюю с пищеводом, среднюю и заднюю. Каждую часть изучали отдельно. Содержимое вымывали, фиксировали в 4%-ном растворе формальдегида. Массу пищевого комка определяли как разность массы заполненной и пустой пищеварительной трубки. Все взвешивания проводили на аналитических весах OHAUS Discovery с точностью до 0.1 мг.
Сортировку компонентов пищевого комка проводили под бинокуляром МБС 9 при увеличении 4 × 8, отмечая наличие крупных включений, таких как различные растительные остатки и части крупных животных организмов. Под микроскопом при увеличении 10 × 10 обнаруживали и подсчитывали единично встречающиеся в кишечниках организмы. Число клеток и массу водорослей, содержащихся в пищевом комке, рассчитывали по стандартной методике (Методические рекомендации …, 1984; Радченко и др., 2010). Разбавленный водой пищевой комок встряхивали и в зависимости от количества водорослей отбирали от 1/4 до 1/20 его части для дальнейшего анализа (Спетницкая и др., 2008). Подсчёт отдельных клеток проводили под микроскопами Микромед 1 или Leica DM 1000 при увеличении 10 × 40. Из каждой пробы брали три повторности. Организмы идентифицировали до рода или вида. Количественную оценку сине-зелёных (Cyanobacteria) и шаровидных протококковых водорослей (Protococcophyceae) не проводили ввиду сложности определения, разделения отдельных форм и их подсчёта. В программе Leica LAS EZ оценивали размер клеток для расчёта объёма и перевода в массу (Радченко и др., 2010). Массу нематод оценивали по формуле W = 1.024L2.21 (Цалолихин, 1981), коловраток и ракообразных – W = qLb, где значения коэффициента q для каждого вида брали из литературных источников (Алимов, 1989). Для оценки сходства состава пищевого комка у разных личинок проводили кластерный анализ, мерой сходства/различия служило Евклидово расстояние. Полученные вторичные матрицы анализировали методом Уорда. Результаты кластеризации представлены в виде дендрограмм.
Статистическую обработку материала проводили с помощью стандартных пакетов статистики Microsoft Office Excel 2010, PAST и Statistica 10.
РЕЗУЛЬТАТЫ
Характеристика личинок. По данным наших исследований миноги р. Чёрная (Павлов и др., 2014, 2017), для пескороек характерно расселение в ночное время, с утренними сумерками личинки уходят в грунт. В настоящей работе рассматриваются личинки, извлечённые из грунта. Сбор материала проводили во время нереста миноги, сеголетки ещё отсутствовали, поэтому выборка (39 экз.) представлена особями в возрасте один год и старше. Доля пескороек I размерного класса (TL 16–29 мм) составила 33% общего числа пойманных личинок, II (30–49 мм) – 18%, III (50–69 мм) – 26%, IV (70–89 мм) – 18%, V (90–109 мм) – 5%. Таким образом, в биотопе находились все размерные классы личинок, представленные в реке в это время года.
Структура микробиотопа. Пескороек вылавливали в типичном для них местообитании, в так называемом личиночном ложе. Облавливаемый микробиотоп представлял собой участок реки у отвесного берега. Высота толщи воды над участком составляла 15–70 см, толщина мусорных наносов из относительно крупных остатков растительного происхождения – 10–20 см; мощность слоя иловых наносов – 12–30 см, их нижний слой имел чёрный цвет и запах сероводорода. Кроме личинок миноги были пойманы макробентосные организмы: мелкие двустворчатые моллюски семейства Sphaeriidae, личинки стрекоз (Odonata) и подёнок (Ephemeroptera). Главным компонентом этого микробиотопа являлся песок, смешанный с илом и растительными остатками.
В ходе анализа альгофлоры микробиотопа установлено, что таксоны, которые могут служить кормовыми объектами для личинок речной миноги, по своему соотношению в грунте и воде отличаются (табл. 1). В пробе грунта преобладали донные формы – виды родов Navicula и Nitzschia, а также Aulacoseira (67%), в слое воды над грунтом (0–1 см над поверхностью) Aulacoseira, Tabellaria и Ulnaria (84%), в основном потоке – Aulacoseira (85%), а Navicula и Nitzschia отсутствовали.
Таблица 1.
Соотношение численности кормовых объектов личинок речной миноги Lampetra fluviatilis в р. Чёрная
| Таксон (род) | Доля, % общей численности | ||
|---|---|---|---|
| в грунте | в воде над грунтом | в потоке | |
| Aulacoseira | 17 | 54 | 85 |
| Ulnaria | 1 | 14 | 4 |
| Tabellaria | 3 | 20 | 3 |
| Navicula | 22 | 3 | 0 |
| Nitzschia | 28 | 5 | 0 |
| Прочие* | 29 | 4 | 8 |
Наполнение пищеварительного тракта. У большинства исследованных личинок наблюдалась высокая степень наполненности кишечника – 2–4 балла (табл. 1). Наполненность отдельных участков была не всегда одинаковой. Пищевод был заполнен целиком только у одной личинки, у шести особей отмечены остатки пищи, у остальных пищевод был пуст. Передний отдел у 14 экз. содержал небольшое количество пищи (1–2 балла), у остальных его наполненность была выше (3–4 балла). Средний и задний отделы кишечника были заполнены обычно плотно и равномерно. Соотношение заполнения переднего, среднего и заднего отделов можно оценить как 1 : 2 : 2.
Содержимое пищеварительного тракта. Основную массу содержимого всех кишечников составляли песок или другие частички неорганического происхождения (обычно > 90%). Кроме неорганических частиц обнаружены тонкий детрит (главным образом растительного происхождения), пыльца высших растений (большей частью голосеменных), водоросли, коловратки, мелкие нематоды, ракообразные и их фрагменты.
Водоросли представлены в основном диатомовыми (Bacillariophyta), кроме них постоянно присутствуют сине-зелёные (Cyanobacteria), харовые (Charophyta, порядок десмидиевые, Desmidiales) и зелёные (Chlorophyta), в частности, представители классов протококковые (Protococcophyceae) и хлорококковые (Chlorococcales). Доля водорослей в общей массе пищевого комка невелика – в пределах 0.03–1.50 (в среднем 0.25 ± 0.07)% (табл. 2). Основу составляют диатомовые водоросли, в частности, виды родов Aulacoseira, Navicula, Nitzschia, Tabellaria, Pinnularia, Ulnaria, встреченные в 90–100% кишечников и составляющие >80% общей массы водорослей (рис. 1).
Таблица 2.
Основные показатели исследованных личинок речной миноги Lampetra fluviatilis и характеристика их пищевого рациона
| Показатель | Размерные классы (число личинок, экз.) | ||||
|---|---|---|---|---|---|
| I (4) | II (7) | III (10) | IV (7) | V (2) | |
| Длина (TL), мм | $\frac{{16{\kern 1pt} --{\kern 1pt} 24}}{{20.2 \pm 1.8}}$ | $\frac{{31{\kern 1pt} --{\kern 1pt} 49}}{{40.0 \pm 2.4}}$ | $\frac{{50{\kern 1pt} --{\kern 1pt} 66}}{{58.4 \pm 2.1}}$ | $\frac{{70{\kern 1pt} --{\kern 1pt} 81}}{{78.3 \pm 1.4}}$ | $\frac{{90{\kern 1pt} --{\kern 1pt} 105}}{{97.5 \pm 7.5}}$ |
| Масса, г | $\frac{{0.01{\kern 1pt} --{\kern 1pt} 0.03}}{{0.02 \pm 0.004}}$ | $\frac{{0.06{\kern 1pt} --{\kern 1pt} 0.24}}{{0.12 \pm 0.025}}$ | $\frac{{0.20{\kern 1pt} --{\kern 1pt} 0.54}}{{0.34 \pm 0.040}}$ | $\frac{{0.36{\kern 1pt} --{\kern 1pt} 0.94}}{{0.69 \pm 0.070}}$ | $\frac{{1.08{\kern 1pt} --{\kern 1pt} 1.19}}{{1.14 \pm 0.060}}$ |
| Степень наполнения, баллы | 3–4 | 2–4 | 2–4 | 2–4 | 3–4 |
| Индекс наполнения, ‱ | 52.9 ± 7.01 | 29.3 ± 26.31 | 21.0 ± 9.12 | 19.1 ± 8.93 | – |
| Доля организмов, ‱ массы комка: | |||||
| – Algae | $\frac{{7{\kern 1pt} --{\kern 1pt} 37}}{{20 \pm 9}}$ | $\frac{{10{\kern 1pt} --{\kern 1pt} 147}}{{51 \pm 32}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 60}}{{28 \pm 8}}$ | $\frac{{3{\kern 1pt} --{\kern 1pt} 25}}{{10 \pm 3}}$ | $\frac{9}{{9 \pm 0}}$ |
| – Rotifera | $\frac{{0{\kern 1pt} --{\kern 1pt} 20}}{{5 \pm 5}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 47}}{{17 \pm 9}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 85}}{{18 \pm 10}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 9}}{{6 \pm 1}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 7}}{{4 \pm 3}}$ |
| – Crustacea | $\frac{{0{\kern 1pt} --{\kern 1pt} 67}}{{24 \pm 16}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 22}}{{19 \pm 13}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 1}}{{1 \pm 1}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 8}}{{3 \pm 3}}$ | 0 |
| – Nematoda | 0 | $\frac{{0{\kern 1pt} --{\kern 1pt} 1790}}{{68 \pm 33}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 490}}{{160 \pm 60}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 1390}}{{330 \pm 220}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 38}}{{20 \pm 20}}$ |
Рис. 1.
Вклад отдельных родов водорослей в общую массу водорослей в пищевом комке личинок речной миноги Lampetra fluviatilis из р. Чёрная: 1 – Aulacoseira, 2 – Navicula, 3 – Synedra, 4 – Nitzschia, 5 – Tabellaria, 6 – Pinnularia, 7 – Closterium, 8 – прочие.
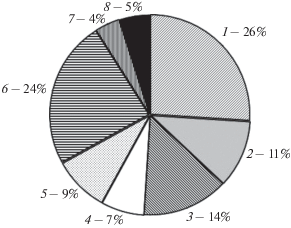
Соотношение числа клеток массовых таксонов водорослей в пищевом комке исследованных личинок различалось несущественно (рис. 2а). Доля Aulacoseira sp. составляла 34–93 (64)% общего числа клеток, причём у большинства особей была выше 80%. Виды рода Navicula составляли 1–38 (17)%, только у восьми личинок превышая 20%; Nitzschia – 1–28 (8)%, обычно не превышая 10%. Массовая доля клеток этих таксонов несколько отличается (рис. 2б): Aulacoseira – 0.1–59 (26)%, Navicula – 0.3–22 (11)%, Nitzschia – 0.1–34 (7)%. Единичные клетки крупных водорослей могли составлять существенную долю в общей массе: Pinnularia sp. – 0–99 (24)%, Closterium sp. – 0–26 (4)%. В кишечнике также постоянно встречались виды других родов диатомовых водорослей – Cymbella, Cyclotella, Fragilaria, Meridion и ещё несколько единично отмеченных таксонов. Их общий вклад обычно не превышал 1–2%, изредка достигая 5% общей массы. Зелёные водоросли представлены очень мелкими проттококковыми, иногда массово присутствующими в составе пищевого комка, из которых идентифицирован и количественно учтён только Monoraphidium sp., отмеченный в 100% кишечников личинок, но не играющий существенного значения в общем числе и массе водорослей. Часто (25–40%) встречались хлорококковые Scenedesmus sp. и Pediastrum sp. (Chlorophyta) и виды рода Closterium (Charophyta). Масса представителей последнего из-за крупных размеров в отдельных случаях достигала 20% общей массы водорослей, несмотря на малое число (обычно не больше трёх клеток на кишечник).
Рис. 2.
Соотношение массовых таксонов водорослей в пищевых комках личинок речной миноги Lampetra fluviatilis разной длины (TL): а – доля числа клеток, %; б – доля массы, %; ( ) – Aulacoseira, (◼) – Navicula, (
) – Aulacoseira, (◼) – Navicula, ( ) – Synedra, (◻) – Nitzschia, (
) – Synedra, (◻) – Nitzschia, ( ) – Tabellaria, (
) – Tabellaria, ( ) – Pinnularia, (
) – Pinnularia, ( ) – Closterium, (◼) – прочие.
) – Closterium, (◼) – прочие.
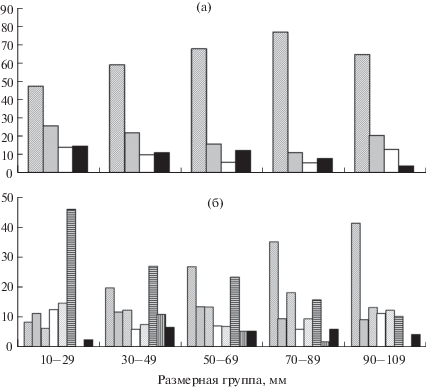
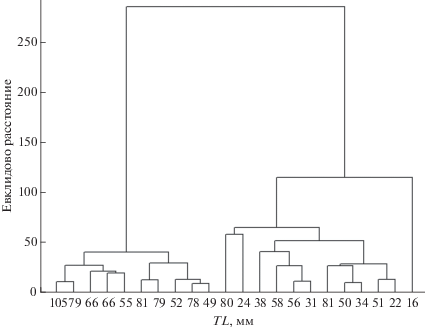
По результатам кластерного анализа доли в общей массе отдельных таксонов водорослей в кишечниках выделены две группы личинок (рис. 3). В первую группу вошли личинки, у которых в составе пищевого комка преобладает Aulacoseira sp. (её доля в общей численности составила >70%, в массе – ~50%); во вторую – личинки с преобладанием в рационе донных водорослей, в основном Navicula sp. и Nitzschia sp. Во второй группе Aulacoseira sp. составила ~50% численности и 8% массы. Средние размеры личинок в этих группах (71 ± 5.4 и 45 ± 6.0 мм) достоверно различаются по критерию Манна–Уитни (p = 0.02).
Рис. 3.
Дендрограмма сходства личинок речной миноги Lampetra fluviatilis по доле водорослей (% общей массы водорослей).
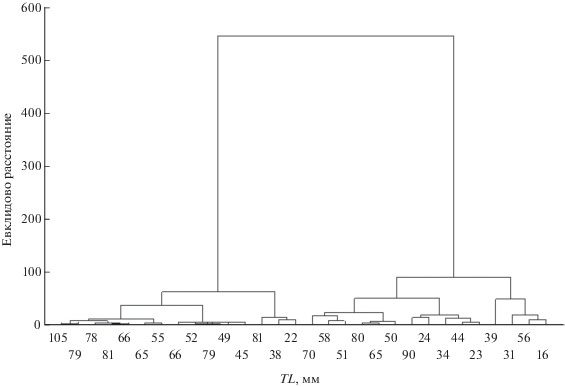
Кроме водорослей в кишечниках личинок присутствовали мелкие беспозвоночные. Основную роль среди них играли коловратки, встреченные в 74% кишечников, в первую очередь Keratella cochlearis, число особей которой в отдельных кишечниках варьировало от единиц до 103 экз. Кроме того, у большей части личинок присутствовали Kellicotia longispina (43%) и Colurella colurus (47%). Единично встречались Keratella quadrata, Brachionus angularis, Bdelloidae indet. Их доля составляла 0.01–0.81 (0.12 ± 0.04)% общей массы комка. На дендрограмме сходства личинок по числу коловраток также выделяются две группы (рис. 4).
Рис. 4.
Дендрограмма сходства личинок речной миноги Lampetra fluviatilis по доле коловраток (% числа коловраток).
Нематоды (обычно единичные особи) отмечены у 55% личинок. Их доля в общей массе комка составляла 0.7–17.9 (2.8 ± 0.96)%.
Единично представлены планктонные ракообразные – ветвистоусые Bosmina sp. и Chydorus sp. и Copepoda ювенильных стадий; их доля в общей массе не превышала 0.03%. У трёх личинок присутствовали единичные экземпляры донных ракообразных семейства Harpacticoidae, составляющих до 0.7% общей массы.
ОБСУЖДЕНИЕ
Исследованный микробиотоп является одним из типичных местообитаний личинок миног всех возрастов. Низкая скорость течения, защищённость отвесным берегом и высшей растительностью от прямого воздействия солнечных лучей, наносы органического мусора, толстые иловые отложения, богатые органическими соединениями, создают для личинок условия, по всей видимости, близкие к оптимальным. По данным Назарова с соавторами (Nazarov et al., 2016), численность пескороек в таком типе биотопа может достигать 100 экз/м2. Физические параметры биотопа позволяют задерживаться и/или постоянно обитать в нём не только типично бентосным организмам, но и другим группам – вплоть до перифитонных и планктонных водорослей, коловраток и ракообразных, которые могут служить кормовыми объектами личинок миноги.
По типу питания личинки миноги являются фильтраторами. Неорганические частички и пища попадают в ротовую полость вместе с током воды. Здесь твёрдые частички налипают на цири и затем поступают в пищевод. Анализ пищевого комка пескороек из р. Чёрная показал, что его состав типичен для личинок миног и не имеет выраженных отличий от данных из других регионов (Schroll, 1959; Manion, 1967; Hardisty, Potter, 1971; Moore, Potter, 1976; Sutton, Bowen, 1994; Макеева и др., 2011; Назаров, 2012; Лошакова, Книжин, 2015). Основу содержимого пищеварительного тракта составляют песок, тонкий детрит с растительными остатками, водоросли и мелкие беспозвоночные.
Эксперименты (Moore, Potter, 1976) показали, что, несмотря на высокое содержание детрита и, соответственно, бактерий, бóльшую ценность как пищевой компонент имеют водоросли. Личинки, которые питались только детритом или культурами бактерий, росли медленнее, чем личинки, питающиеся водорослями. Авторы считают, что необходимого для нормального роста и развития пескороек количества бактерий в естественной среде нет, соответственно, участие их в питании незначительно.
Многие авторы указывают на питание именно донными водорослями – представителями родов Navicula, Nitzschia, Ulnaria (старое название Synedra), Gomphonema, Cymbella, Fragilaria, Pinnularia, Closterium. Эти таксоны отмечены и в кишечниках изученных пескороек.
Некоторые авторы (Creaser, Hann, 1929; Wigley, 1959) предполагали, что, несмотря на образ жизни личинок (обитание в илисто-песчаном грунте водотока), организмы из потока играют важную роль в их питании, так как в кишечнике объектов из толщи воды было больше, чем из грунта. По мнению других (Hardisty, Potter, 1971), пескоройки собирают с поверхности грунта упавшие из потока, чаще всего уже умершие организмы. С помощью анализа аминокислот и органической компоненты в ходе экспериментов с личинками Ichthyomyzon fossor было показано преобладание пищевых ресурсов сестона над детритом (Yap, Bowen, 2003).
Ранее никто не указывал виды рода Aulacoseira (старое название Melosira) в качестве пищевого объекта пескороек. По нашим данным, эти водоросли играют ведущую роль в их питании (64 ± 4.4% общего числа и 26 ± 4.4% общей массы). Род Aulacoseira является широко распространённой формой фитопланктона (Round et al., 1990), в частности, в р. Нева и других водоёмах северо-запада России (Никулина, 2008; Белова и др., 2011). При описании сообществ донных водорослей её указывают как немассовый вид (Губелит, 2008). В пробах грунта концентрация Aulacoseira примерно в пять раз ниже, чем в толще воды (табл. 1). Более низкая доля Aulacoseira в общей массе, по сравнению с численностью, связана с небольшими размерами её клеток. Более крупные донные водоросли при меньшем числе дали более высокие значения массы. Масса нескольких клеток крупной Pinnularia sp. в некоторых случаях составляла больше 50% общей массы водорослей (в среднем 24 ± 4.7%). Несмотря на то что Ulnaria sp. является формой перифитона, в придонном слое воды она характеризуется гораздо более высокими концентрациями.
Из зелёных водорослей в пищевом комке в литературе обычно указываются только десмидиевые, в частности Closterium sp. Нами отмечено не менее двух видов этого рода. Несмотря на то что обычно число клеток водорослей этого рода в кишечнике не превышает единиц, их доля по массе вследствие больших размеров может быть существенной, особенно у мелких личинок (I–II размерных классов). Низкая численность Closterium sp. в составе пищевого комка, вероятно, связана с тем, что в середине мая развитие водорослей этой группы либо не достигло своего пика, либо для данного биотопа эти водоросли не характерны. Это предположение подтверждается данными о существенных сезонных изменениях вклада водорослей в питание пескороек (Schroll, 1957, 1959; Moore, Potter, 1976; Назаров, 2012). Кроме Closterium sp. в кишечниках пескороек регулярно встречались ценобии Scenedesmus sp. и Pediastrum sp., что также не известно из литературных источников. В отличие от типично донной формы Closterium sp. они являются планктонно-перифитонными микроорганизмами (Анисимова, Гололобова, 2006; Баринова и др., 2006). В целом таксономический состав водорослей, входящих в состав пищевого комка пескороек, типичен для водоёмов Карелии и других районов северо-запада России (Комулайнен, 2003; Комулайнен и др., 2006; Губелит, 2008; Балашова и др., 2016).
Доля водорослей в общей массе пищевого комка исследованных личинок варьировала в пределах 0.03–1.47 (0.05)%, что ниже указанной в литературе – в среднем 0.14–1.5%, иногда до 5% (Moore, Mallatt, 1980). Это можно объяснить разным составом пищи. Так, в публикации Мура и Малата (Moore, Mallatt, 1980) говорится о существенном преобладании крупных водорослей рода Navicula, а в нашем случае размеры клеток массовых форм часто были намного меньше.
Мы не обнаружили какой-либо связи между долей водорослей в пищевом комке и размером личинок. Это не подтверждает идею о связанной с размерами личинок избирательности пищевых объектов. С одной стороны, подобная связь может быть следствием разной миграционной активности личинок: после окончания расселения с утренними сумерками личинки оседают на грунт и уходят в его толщу не так глубоко, как личинки, которые в предыдущую ночь (или в этот сезон) не расселялись. С другой – разобщённостью мест обитания личинок и водорослей в грунте: водоросли никогда не проникают глубоко в грунт. Эти предположения требуют дальнейшего исследования. Достоверная зависимость численного состава доминирующих таксонов водорослей в пищевом комке от длины тела личинки также не выявлена. Наибольшая доля водорослей отмечена в кишечниках личинок II размерного класса (табл. 2).
О роли водной фауны в питании пескороек известно лишь в самом общем виде. Среди объектов питания обычно отмечают нематод и изредка некоторых других донных беспозвоночных (Sterba, 1953; Mihail, 1962; Alvarez del Villar, 1966; Назаров, 2012). Коловратки упоминаются в некоторых работах (Sterba, 1953; Alvarez del Villar, 1966), но без указания их таксономического состава, количественных показателей и экологической принадлежности. В нашей выборке у большинства личинок присутствовали Keratella cochlearis, Kellicotia longispina и Colurella colurus. Первые два вида являются типичными представителями зоопланктона большинства водоёмов, они входят в комплекс массовых видов зоопланктона водоёмов Карелии (Герд, 1946; Григорьев, 1965; Андроникова, 1996). В пробах воды над грунтом и в потоке отмечено большое количество этих организмов. Colurella colurus распределяется в придонном слое и зарослях растительности; её обычно отмечают в небольших заросших водоёмах (Кутикова, 1970; Koste, 1978). В наших пробах из потока её нет, но в придонном слое воды она присутствует. В пробе грунта коловратки не обнаружены. Поскольку общее число коловраток в пищевом комке достигало иногда нескольких десятков, нельзя считать их попадание в кишечник случайным. Коловратки присутствовали у личинок всех размеров во всех отделах кишечника (табл. 2). Их доля в составе пищевого комка наиболее значительна у личинок II–III размерных классов; особенно в группе личинок, у которых в пищевом комке доминировала Aulacoseira sp. – 0.24 ± 0.07 (3–119) против 0.015 ± 0.007 (0–4) коловраток/особь в навикуло-нитцшеевой группе. Это ещё раз подтверждает наличие различий в питании личинок.
Таким образом, значительную роль в питании пескороек играют не только детрит и донные микроорганизмы. Постоянное присутствие в их кишечниках типично планктонных коловраток и водорослей рода Aulacoseira позволяет говорить о потреблении организмов из толщи воды и придонного слоя, что подтверждает высказанные ранее предположения (Creaser, Hann, 1929; Wigley, 1959; Yap, Bowen, 2003). Мы не можем считать присутствие планктонных организмов случайным, в первую очередь, из-за наличия их во всех отделах кишечника в большом количестве у половины исследованных личинок. Предположение, что это мёртвые, упавшие на дно организмы, сомнительно, поскольку у водорослей видны зелёные хлоропласты, а у коловраток – хорошо сохранившиеся внутренности. Присутствие в кишечниках как донных, так и планктонных форм водорослей и беспозвоночных, возможно, связано с особенностями поведения личинок: часть времени они питаются, зарывшись в грунт, но периодически высовывают голову из грунта, в результате чего в кишечник попадает вода с планктонными организмами.
Мы не выявили достоверной закономерности изменения состава пищи от размера личинок. Наши данные позволяют с некоторой долей вероятности утверждать, что с увеличением длины изменяется соотношение таксонов водорослей в пищевом комке: доля Aulacoseira sp. увеличивается, а Navicula sp., наоборот, снижается. Это может быть связано как с разной миграционной активностью личинок (личинки младшего возраста расселяются более активно), так и с разной глубиной их обитания в грунте.
БЛАГОДАРНОСТИ
Авторы признательны за общие консультации и ценные замечания А.С. Демчук (ЗИН РАН); за помощь в идентификации альгофлоры и консультации – Р.М. Гогореву (БИН РАН); А.А. Улановой (Department of Earth Sciences, Uppsala University, Uppsala, Sweden), В.Н. Михееву (ИПЭЭ РАН) и Д.Л. Лайусу (СПбГУ) – за обсуждение рукописи статьи.
Работа выполнена при финансовой поддержке РНФ, грант № 14-14-01171.
Список литературы
Алимов А.Ф. 1989. Введение в продукционную гидробиологию. Л.: Гидрометеоиздат, 151 с.
Андроникова И.Н. 1996. Структурно-функциональная организация зоопланктона озерных экосистем. СПб.: Наука, 189 с.
Анисимова О.В., Гололобова М.А. 2006. Краткий определитель родов водорослей. М.: Изд-во МГУ, 159 с.
Балашова Н.Б., Киселёв Г.А., Степанова В.А., Тобиас А.В. 2016. Диатомовые водоросли бентоса южного побережья Финского залива (заказник “Лебяжий”) // Вестн. СПбГУ. Сер. 3. Вып. 16. С. 9–25.
Баринова С.С., Медведева Л.А., Анисимова О.В. 2006. Биоразнообразие водорослей-индикаторов окружающей среды. Тель-Авив: Pilies Studio Publ. House, 498 с.
Белова М.А., Большакова В.А., Зайцева И.И., Нефедова Е.Д. 2011. Многолетний мониторинг фитопланктона реки Невы (1955–2010) как элемент биоиндикации качества воды источника водоснабжения г. Санкт-Петербурга и Ленинградской области // Сб. матер. II Междунар. конф. “Биоиндикация в мониторинге пресноводных экосистем”. Санкт-Петербург. С. 79–84.
Герд С.В. 1946. Планктонный комплекс больших озёр Карелии и летние миграции ряпушки // Уч. зап. Карел. ун-та. Т. 1. С. 305–344.
Григорьев С.В. 1965. Озёра и реки Карелии и их особенности // Фауна озёр Карелии. М.; Л.: Наука. С. 21–41.
Губелит Ю.И. 2008. Фитоперифитон эстуария реки Невы // Экосистема эстуария р. Невы: биологическое разнообразие и экологические проблемы / Под ред. Алимова А.Ф., Голубкова С.М. М.: Т-во науч. изд. КМК. С. 96–105.
Инструкция по сбору и обработке материала для исследования питания рыб в естественных условиях. Ч. 1. 1971. М.: Изд-во ВНИРО, 68 с.
Комулайнен С.Ф. 2003. Методические рекомендации по изучению фитоперифитона в малых реках. Петрозаводск: Изд-во КарНЦ РАН, 43 с.
Комулайнен С.Ф., Чекрыжева Т.А., Вислянская А.Г. 2006. Альгофлора озер и рек Карелии. Таксономический состав и экология. Петрозаводск: Изд-во КарНЦ РАН, 81 с.
Кутикова Л.А. 1970. Коловратки фауны СССР. Л.: Наука, 744 с.
Лебедев Н.В. 1936. Опыты над отношением хамсы к течению и их значение для объяснения миграций // Рыб. хоз-во. № 9. С. 27–32.
Лошакова Ю.В., Книжин И.Б. 2015. Морфологическая характеристика и особенности экологии непаразитической резидентной формы миноги рода Lethenteron (Petromyzontidae) бассейна реки Ангара // Вопр. ихтиологии. Т. 55. № 2. С. 146–155. doi 10.7868/ S0042875215010117
Макеева А.П., Павлов Д.С., Павлов Д.А. 2011. Атлас молоди пресноводных рыб России. М.: Т-во науч. изд. КМК, 383 с.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях на пресноводных водоёмах. Задачи и методы изучения использования кормовой базы рыбой. 1984. Л.: Изд-во ГосНИОРХ; ЗИН АН СССР, 19 с.
Назаров А.В. 2012. Морфобиологическая характеристика миноги сибирской среднего течения р. Енисей // Сб. матер. VIII Всерос. науч.-технич. конф. “Молодёжь и наука”. Красноярск: СФУ, 4 с. (http://conf.sfu-kras.ru/sites/mn2012/section31.html)
Никулина В.Н. 2008. Фитопланктон эстуария реки Невы // Экосистема эстуария р. Невы: биологическое разнообразие и экологические проблемы / Под ред. Алимова А.Ф., Голубкова С.М. М.: Т-во науч. изд. КМК. С. 77–96.
Павлов Д.С., Назаров Д.Ю., Звездин А.О., Кучерявый А.В. 2014. Покатная миграция ранних личинок европейской речной миноги Lampetra fluviatilis // ДАН. Т. 459. № 2. С. 248–251.
Павлов Д.С., Звездин А.О., Костин В.В. и др. 2017. Временная характеристика покатной миграции смолтов речной миноги Lampetra fluviatilis в реке Чёрной // Изв. РАН. Сер. биол. № 3. С. 276–282.
Радченко И.Г, Капков В.И., Фёдоров В.Д. 2010. Практическое руководство по сбору и анализу проб морского фитопланктона. М.: Мордвинцев, 59 с.
Спетницкая Н.А., Гогорев Р.М., Иванов М.В. 2008. Особенности питания беломорских культивируемых мидий (Mytilus edulis L.) фитопланктоном // Вестн. СПбГУ. Вып. 4. С. 39–46.
Цалолихин С.Я. 1981. Определение веса пресноводных нематод // Эволюция, систематика, морфология и экология свободноживущих нематод / Под ред. Платоновой Т.А., Цалолихина С.Я. Л.: Изд-во ЗИН АН СССР. С. 80–85.
Alvarez del Villar J. 1966. Ictiologia michoacana, IV. Contribucion al conocimiento Biologico y systematico de las Lampreas de Jacona, Mich. Mexico // An. Esc. Nac. Cienc. Biol. Mex. V. 13. P. 107–144.
Bowen S.H., Sutton T.M., Yap M.R. et al. 1998. Feeding ecology and habitat use by lampreys in Great Lakes tributaries // Final Rept. Michigan Tech. Univ. Task Area Team. Houghton, 44 p.
Creaser C.W., Hann C.S. 1929. The food of larval lampreys // Pap. Mich. Acad. Sci. Arts Lett. 10. P. 433–437.
Evans T.M., Bauer J.E. 2016. Identification of the nutritional resources of larval sea lamprey in two Great Lakes tributaries using stable isotopes // J. Great Lakes Res. V. 42. № 1. P. 99–107. doi 10.1016/j.jglr.2015.11.010
Hardisty M.W., Potter I.C. 1971. The behavior, ecology and growth of larval lampreys // The biology of lampreys. V. 1 / Eds. Hardisty M.W., Potter I.C. London: Acad. Press. P. 85–125.
Hollet A.K. 1995. A feasibility study to determine the immediate source of carbon filtered by Petromyzon marinus ammocoetes from the Root River, Sault Ste. Marie through the use of stable isotope analysis: A senior honours thesis. Univ. Waterloo, 44 p.
Jolley J.C., Silver G.S., Whitesel T.A., Telles L. 2012. Captive rearing of Pacific lamprey // Ann. Rept. US Fish Wildlife Serv. 15 p.
Koste W. 1978. Rotatoria. Die Rädertiere Mitteleuropas. V. 1. Berlin; Stuttgart: Gebruder Borntraeger, 673 p.
Mallatt J. 1983. Laboratory growth of larval lampreys (Lampetra (Entosphenus) tridentata Richardson) at different food concentrations and animal densities // J. Fish. Biol. V. 22. P. 293–301.
Manion P.J. 1967. Diatoms as food of larval lampreys in a small tributary of Northern Lake Michigan // Trans. Amer. Fish. Soc. V. 96. P. 224–226.
Mihail N. 1962. Zur Biologie und Ökologie von Eudontomyzon danfordi // Zool. Anz. V. 168. P. 139–143.
Moore J.W., Mallatt J.M. 1980. Feeding of larval lamprey // Can. J. Fish. Aquat. Sci. V. 37. P. 1658–1664.
Moore J.W., Potter I.C. 1976. A laboratory study on the feeding of larvae of the brook lamprey Lampetra planeri (Bloch) // J. Anim. Ecol. V. 45. № 1. P. 81–90.
Nazarov D., Kucheryavyy A., Pavlov D. 2016. Distribution and habitat types of the lamprey larvae in rivers across Eurasia // Jawless fishes of the World. V. 1 / Eds. Orlov A.M., Beamish R. Cambridge: Cambridge Scholars Publ. P. 280–298.
Round F.E., Crawford R.M., Mann D.G. 1990. The diatoms. Biology and morphology of the genera. Cambridge: Cambridge Univ. Press, 747 p.
Schroll F. 1957. Zur Ernahrungsbiologie der Ammocoeteslarven der Cyclostomen // Zool. Anz. V. 159. P. 75–78.
Schroll F. 1959. Zur Ernahrungsbiologie der steirischen Ammocoeten Lampetra planeri (Bloch) und Eudontomyzon danfordi (Regan) // Int. Rev. Hydrobiol. V. 44. P. 395–429. doi 10.1002/iroh.19590440121
Sterba G. 1953. Die Physiologie und Histogenese der Schilddriise und des Thymus beim Bachneunauge (Lampetra planeri Bloch) als Grundlage phylogenetischer Studien über die Evolution der innsekretorischen Kiemendarmderivate // Wiss. Z. Friedrich-Schiller Univ. Jena. V. 2. P. 239–298.
Sutton T.M., Bowen S.H. 1994. Significance of organic detritus in the diet of larval lampreys in the Great Lakes Basin // Can. J. Fish. Aquat. Sci. V. 51. P. 2380–2387.
Wigley R.L. 1959. Life history of the sea lamprey of Cayugaf Lake, New York // Fish. Bull. V. 59. P. 561–617.
Yap M.R., Bowen S.H. 2003. Feeding by Northern Brook lamprey (Ichthyomyzon fossor) on sestonic biofilm fragments: habitat selection results in ingestion of a higher quality diet // J. Great Lakes Res. V. 29. P. 15–25.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


