Вопросы ихтиологии, 2019, T. 59, № 3, стр. 301-310
Современное состояние популяций и особенности питания длиннохвостого бычка Книповича Knipowitschia longecaudata (Gobiidae) в дельте Дона и восточной части Таганрогского залива
А. Р. Болтачев 1, *, Е. П. Карпова 1, И. В. Вдодович 1, Ю. А. Загородняя 1, Р. Е. Прищепа 1
1 Институт морских биологических исследований РАН – ИМБИ РАН
Севастополь, Республика Крым, Россия
* E-mail: a_boltachev@mail.ru
Поступила в редакцию 29.01.2018
После доработки 11.07.2018
Принята к публикации 16.07.2018
Аннотация
Изучен размерный, половой состав, особенности питания длиннохвостого бычка Книповича Knipo-witschia longecaudata в дельте Дона и восточной части Таганрогского залива. По сравнению с 1950-ми гг. отмечено увеличение максимальных размеров особей, что, вероятно, связано с уменьшением пресса хищных рыб. Выявлено изменение спектра объектов питания, обусловленное трансформацией видовой структуры зоопланктона и появлением морских форм в результате повышения солёности воды. Впервые оценены удельная численность и биомасса вида: в восточной части Таганрогского залива максимальная численность достигает 36.4 тыс. экз/га, в дельте Дона – 6.7 тыс. экз/га, биомасса – соответственно 5.0 и 1.7 кг/га. Проанализированы особенности пространственно-временного распределения численности и биомассы K. longecaudata.
Длиннохвостый бычок Книповича, или длиннохвостая книповичия Knipowitschia longecaudata, – понто-каспийский солоноватоводный вид, относится к группе олигогалинных (или пресноводно-олигогалинных) эндемичных бычков; обитает в воде солёностью менее 4.14‰, что определяет приуроченность вида к опреснённым лиманам, эстуарным зонам и низовьям рек, следствием этого является мозаичность его распространения в пределах исторического ареала, охватывающего Понто-Каспийский бассейн (Манило, 2014). Это один из наиболее мелких видов рыб региона: максимальная длина самцов 50 мм, самок – 40 мм, в среднем – около 30 мм; при этом местами может достигать высокой численности, например, в Таганрогском заливе, лиманах Кубани, низовьях Днепра (Москалькова, 1960; Троицкий, 1961; Рыбы в заповедниках …, 2013; Матишов и др., 2017). В отличие от других понто-каспийских представителей семейства Gobiidae, длиннохвостый бычок Книповича ведёт придонный (полупелагический) образ жизни, держится в толще воды, часто крупными скоплениями, возле зарослей водной растительности над глинистыми, песчаными и илистыми грунтами (Москалькова, 1962; Васильева, Лужняк, 2013; Рыбы в заповедниках …, 2013).
Имеется немало публикаций, посвящённых этому бычку, среди которых заметно выделяются результаты оригинальных исследований Москальковой (1960, 1962), отражающие особенности роста, размножения, питания, распределения и трофические взаимоотношения длиннохвостого бычка Книповича с другими видами рыб. В основу этих работ положен материал, собранный автором с апреля по сентябрь 1954 г. в восточной части Таганрогского залива, на основании анализа которого было установлено, что продолжительность жизни длиннохвостого бычка Книповича составляет около года, подробно изучена динамика ежемесячных изменений размерной структуры популяций. Так, в апреле популяцию бычка составляют перезимовавшие особи стандартной длиной (SL) 16–40 мм, из них около 76% – рыбы SL > 24 мм. В июле отнерестившиеся годовики погибают (вид моноцикличен), а половозрелая часть популяции формируется за счёт сеголеток в возрасте в среднем 2.5 мес. SL 24 мм. Дочерняя генерация сеголеток, появившаяся в осенние месяцы, после зимовки нерестится весной следующего года (Москалькова, 1960). Для Таганрогского залива указывается наибольшая стандартная длина самок 37 мм, самцов – 40 мм при средних значениях соответственно 30 и 28 мм. В 1950-е гг. среди мелких рыб этот вид занимал в уловах по численности 3-е место после тюльки Clupeonella cultriventris и перкарины Percarina demidoffii. Он как зоопланктофаг является серьёзным пищевым конкурентом молоди судака Sander lucioperca, тюльки и других важных промысловых видов; при этом его взрослые особи служат объектом питания судака, черноморско-азовской проходной сельди Alosa immaculata, чехони Pelecus cultratus, сома Silurus glanis и других хозяйственно значимых рыб (Троицкий, 1961; Москалькова, 1962). Эти исследования были выполнены с целью изучения последствий начавшегося осолонения Азовского моря в результате строительства Цимлянского водохранилища, в связи с чем прослеживалось уменьшение площади обитания длиннохвостого бычка Книповича в Таганрогском заливе в среднем от 5.6 до 4.0 тыс. км2 при повышении солёности на 1.5‰ и до 3.5 тыс. км2 – при осолонении до 3–4‰ (Москалькова, 1962).
На протяжении последующих десятилетий под воздействием хозяйственной деятельности произошли значительные изменения в экосистеме бассейна Азовского моря в целом и в структуре сообществ рыб, в частности, для оценки которых мы выполнили комплексные гидробиологические и ихтиологические исследования в восточной части Таганрогского залива и рукавах дельты реки Дон.
Цель работы – сравнение ранее полученных данных в отношении популяционных характеристик, некоторых особенностей биологии и взаимоотношения с другими видами рыб длиннохвостого бычка Книповича с современными. Принципиально новой информацией является оценка удельной численности и биомассы этого вида и особенности их распределения в исследованном районе.
МАТЕРИАЛ И МЕТОДИКА
Сбор материала проводили в дельте р. Дон: в главном судоходном рукаве Старый Дон и второстепенных рукавах (гирлах) Сухая Каланча, Мериново, Песчаное и Свиное в сентябре 2015 г. и августе 2016 г., а также в верхней мелководной восточной части Таганрогского залива в августе 2016 г. (рис. 1). Обловы рыб проводили буксируемым моторной лодкой бимтралом, имевшим ширину жёсткой рамы 2.0 м, высоту – 0.3 м, траловый мешок которого оснащён вставкой с размером ячеи 3 мм. Всего выполнено 38 тралений общей протяжённостью около 18 км в диапазоне глубин 0.4–11.0 м, преимущественно менее 3 м (табл. 1). Координаты начала и окончания траления определяли с помощью GPS, глубину траления – портативным эхолотом.
Рис. 1.
Схема расположения станций (▲) облова длиннохвостого бычка Книповича Knipowitschia longecaudata бимтралом.
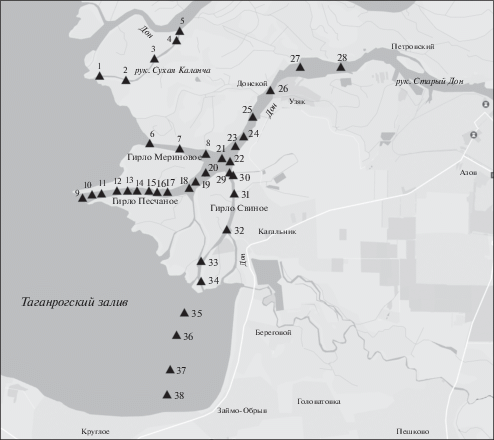
Таблица 1.
Данные о траловых станциях облова длиннохвостого бычка Книповича Knipowitschia longecaudata
| Станция | Дата | Координаты траления | Дистанция облова, м | Глубина, м | |||
|---|---|---|---|---|---|---|---|
| начало | окончание | ||||||
| с.ш. | в.д. | с.ш. | в.д. | ||||
| 1 | 04.08.2016 | 47°7′25.52″ | 39°14′24.23″ | 47°7′29.61″ | 39°14′42.30″ | 400 | 1.3–1.7 |
| 2 | » | 47°7′28.56″ | 39°15′4.37″ | 47°7′24.10″ | 39°15′26.62″ | 495 | 1.7–2.0 |
| 3 | » | 47°7′36.44″ | 39°15′58.58″ | 47°7′48.07″ | 39°16′9.67″ | 434 | 1.7–2.0 |
| 4 | » | 47°8′1.20″ | 39°16′36.81″ | 47°8′13.51″ | 39°16′48.99″ | 464 | 1.7–2.0 |
| 5 | » | 47°8′14.56″ | 39°16′49.71″ | 47°8′21.15″ | 39°16′49.88″ | 204 | 2.0–3.0 |
| 6 | 05.08.2016 | 47°6′15.54″ | 39°15′50.57″ | 47°6′8.87″ | 39°16′28.00″ | 814 | 1.5–3.2 |
| 7 | » | 47°6′7.09″ | 39°16′53.51″ | 47°6′6.62″ | 39°17′5.48″ | 251 | 3.2–3.6 |
| 8 | » | 47°6′1.93″ | 39°17′36.06″ | 47°5′57.56″ | 39°17′49.91″ | 318 | 3.2–3.6 |
| 9 | 29.09.2015 | 47°5′11.72″ | 39°14′27.74″ | 47°5′8.12″ | 39°13′59.38″ | 610 | 0.4–0.8 |
| 10 | 09.08.2016 | 47°5′15.14″ | 39°14′39.55″ | 47°5′13.50″ | 39°14′25.64″ | 295 | 0.5–4.5 |
| 11 | 29.09.2015 | 47°5′14.68″ | 39°14′56.47″ | 47°5′11.72″ | 39°14′27.74″ | 610 | 0.5–6.5 |
| 12 | » | 47°5′18.20″ | 39°15′24.84″ | 47°5′14.89″ | 39°14′42.47″ | 900 | 0.8–2.6 |
| 13 | 09.08.2016 | 47°5′18.89″ | 39°15′27.54″ | 47°5′18.56″ | 39°15′12.96″ | 310 | 0.8–2.6 |
| 14 | 29.09.2015 | 47°5′17.08″ | 39°15′50.43″ | 47°5′18.71″ | 39°15′22.28″ | 590 | 1.1–2.8 |
| 15 | » | 47°5′16.25″ | 39°16′16.60″ | 47°5′17.09″ | 39°15′50.44″ | 540 | 0.7–2.9 |
| 16 | 09.08.2016 | 47°5′17.95″ | 39°16′22.30″ | 47°5′18.74″ | 39°16′5.02″ | 364 | 0.8–2.7 |
| 17 | 29.09.2015 | 47°5′16.01″ | 39°16′48.36″ | 47°5′16.26″ | 39°16′16.61″ | 680 | 0.6–1.8 |
| 18 | » | 47°5′22.13″ | 39°17′15.11″ | 47°5′15.63″ | 39°16′48.51″ | 590 | 1.2–2.5 |
| 19 | 09.08.2016 | 47°5′25.87″ | 39°17′15.94″ | 47°5′20.34″ | 39°17′0.22″ | 372 | 1.1–2.6 |
| 20 | 29.09.2015 | 47°5′46.76″ | 39°18′3.44″ | 47°5′22.16″ | 39°17′8.95″ | 1507 | 0.8–1.9 |
| 21 | 09.08.2016 | 47°5′58.27″ | 39°18′5.39″ | 47°5′51.88″ | 39°17′56.10″ | 274 | 0.8–2.0 |
| 22 | 29.09.2015 | 47°6′6.32″ | 39°18′24.78″ | 47°5′46.90″ | 39°18′3.56″ | 740 | 0.6–1.8 |
| 23 | 09.08.2016 | 47°6′18.54″ | 39°18′35.71″ | 47°6′6.29″ | 39°18′18.72″ | 519 | 0.9–2.0 |
| 24 | 29.09.2015 | 47°6′20.41″ | 39°18′39.92″ | 47°6′6.30″ | 39°18′24.80″ | 530 | 0.9–2.0 |
| 25 | 10.08.2016 | 47°6′44.19″ | 39°18′56.77″ | 47°6′35.78″ | 39°18′47.29″ | 326 | 4.0–5.5 |
| 26 | » | 47°7′23.70″ | 39°19′30.23″ | 47°7′16.48″ | 39°19′22.45″ | 275 | 5.8–8.0 |
| 27 | » | 47°7′37.19″ | 39°20′15.04″ | 47°7′36.90″ | 39°20′4.90″ | 212 | 10.0–11.0 |
| 28 | » | 47°7′37.31″ | 39°21′27.54″ | 47°7′38.29″ | 39°21′4.06″ | 494 | 10.0–11.0 |
| 29 | 03.08.2016 | 47°5′41.06″ | 39°18′9.79″ | 47°5′26.63″ | 39°18′19.49″ | 490 | 0.5–1.5 |
| 30 | 29.09.2015 | 47°5′37.39″ | 39°18′13.64″ | 47°5′26.34″ | 39°18′20.16″ | 360 | 0.5–1.5 |
| 31 | 03.08.2016 | 47°5′5.24″ | 39°18′19.76″ | 47°5′0.80″ | 39°18′19.71″ | 127 | 0.8–1.5 |
| 32 | » | 47°4′46.63″ | 39°18′15.37″ | 47°4′27.59″ | 39°18′1.84″ | 650 | 0.8–1.5 |
| 33 | » | 47°4′8.47″ | 39°17′36.67″ | 47°3′55.86″ | 39°17′25.19″ | 464 | 0.8–1.5 |
| 34 | » | 47°3′44.73″ | 39°17′21.45″ | 47°3′32.89″ | 39°17′26.05″ | 388 | 0.8–1.5 |
| 35 | 11.08.2016 | 47°3′7.27″ | 39°16′41.22″ | 47°3′0.11″ | 39°16′32.21″ | 292 | 0.8–1.5 |
| 36 | » | 47°2′39.21″ | 39°16′18.95″ | 47°2′28.92″ | 39°16′10.71″ | 358 | 0.8–1.5 |
| 37 | » | 47°1′57.27″ | 39°15′52.55″ | 47°1′45.05″ | 39°15′45.54″ | 403 | 0.8–1.5 |
| 38 | » | 47°1′32.64″ | 39°15′41.22″ | 47°1′22.55″ | 39°15′37.32″ | 324 | 0.8–1.5 |
Для оценки относительного обилия и значимости вида принято следующее деление: редкий и малочисленный – <1% в уловах, обычный – 1.1–5.0%, субдоминант – 5.1−10.0%, доминант – >10%, супердоминант – >50% (Терещенко, Надиров, 1996).
Удельную численность исследуемого вида (Ns, экз/га) на каждом участке траления рассчитывали по формуле: Ns = [n/(L × b)] × 10000, где n – число рыб в улове, экз.; L – длина пройденного пути, определённая по координатам начала и окончания траления, м; b – ширина жёсткой рамы бимтрала, м. По аналогичной формуле вычисляли удельную биомассу (Ws, кг/га). Учитывая небольшие размеры длиннохвостого бычка Книповича (SL < 4 см), коэффициент уловистости трала принимали равным 1. Для каждой протоки, в которой было выполнено более одного траления, а также в целом для исследованного участка дельты Дона определены средние значения удельной численности и биомассы, вычисленные как частное от суммы соответствующих показателей на число тралений.
Рыб фиксировали сразу после вылова 4%-ным раствором формальдегида для последующих исследований. Биологический анализ проводили по стандартным методикам: помимо стандартной длины (SL) определяли общую массу тела и пол (Правдин, 1966). Длину рыб измеряли поверенным штангенциркулем с точностью до 0.1 мм, массу тела и кишечника определяли на электронных весах AXIS ADG500C с точностью до 0.001 г. Всего биологическому анализу подвергли около 2 тыс. особей, в том числе 611 и 782 экз. из рукавов дельты Дона (2015 и 2016 гг.) и 600 экз. − из верхней части Таганрогского залива.
Питание изучено у 93 рыб из двух рукавов дельты Дона и восточной части Таганрогского залива. Исследование содержимого кишечников проводили по методике Дуки и Синюковой (1976). Обнаруженные в кишечниках и хорошо различимые пищевые объекты идентифицировали по определителям (Мануйлова, 1964; Определитель фауны …, 1969). Значение кормовых объектов в питании бычка оценивали по их встречаемости (F, %) и доле в общем числе жертв (N, %). Суточные рационы (R) рассчитывали по формуле (Бокова, 1964; Дука, Синюкова, 1976): R = Wf × 24/n, где Wf – масса пищи в кишечнике, n – продолжительность переваривания пищи. За массу пищи принимали 20% массы наполненного кишечника (остальные 80% приходятся на плотный и массивный кишечник). Продолжительность переваривания пищи принимали равной 3 ч (Бокова, 1964).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Популяционные характеристики. В августе 2016 г. в верхней части Таганрогского залива (рис. 2а) в уловах бимтрала встречались рыбы SL 11.0–28.8 (в среднем 20.0) мм и массой 0.011–0.308 (0.099) г. Самки достигали большей максимальной длины и массы по сравнению с самцами, но уступали им по средним показателям (табл. 2). В рукавах дельты Дона (рис. 2б) зарегистрированы рыбы SL 9.7–32.1 (21.7) мм и массой 0.003–0.472 (0.150) г. Средние значения длины и массы исследованных рыб здесь были несколько больше, чем в Таганрогском заливе, при этом самки были крупнее самцов (табл. 2). Однако как в прилежащей акватории Таганрогского залива, так и в рукавах дельты Дона среди особей обоих полов преобладала размерная группа 24−27 мм (рис. 2а, 2б).
Рис. 2.
Размерный состав длиннохвостого бычка Книповича Knipowitschia longecaudata в уловах бимтрала в дельте Дона (б, в) и в восточной части Таганрогского залива (а): а, б – август 2016 г., в – сентябрь 2015 г.; (◼) – самки, (◻) – самцы, (◼) – ювенильные особи, (– –) – все особи.
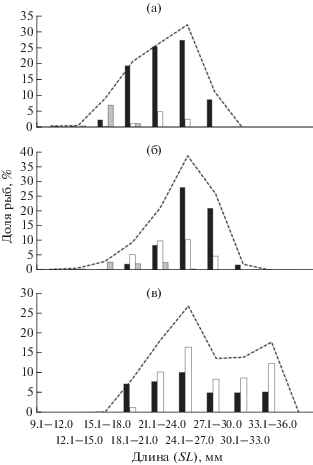
Таблица 2.
Длина (SL) и масса самок и самцов длиннохвостого бычка Книповича Knipowitschia longecaudata в дельте Дона и восточной части Таганрогского залива в августе 2016 и сентябре 2015 гг.
| Район | Месяц, год | Самки | Самцы | ||
|---|---|---|---|---|---|
| SL, мм | масса, г | SL, мм | масса, г | ||
| Таганрогский залив | VIII, 2016 | $\frac{{13.9{\kern 1pt} --{\kern 1pt} 28.8}}{{20.3}}$ | $\frac{{0.021{\kern 1pt} --{\kern 1pt} 0.308}}{{0.101}}$ | $\frac{{17.6{\kern 1pt} --{\kern 1pt} 26.6}}{{23.1}}$ | $\frac{{0.053{\kern 1pt} --{\kern 1pt} 0.293}}{{0.152}}$ |
| Дельта Дона | VIII, 2016 | $\frac{{10.9{\kern 1pt} --{\kern 1pt} 32.1}}{{22.9}}$ | $\frac{{0.022{\kern 1pt} --{\kern 1pt} 0.472}}{{0.150}}$ | $\frac{{14.1{\kern 1pt} --{\kern 1pt} 27.8}}{{20.8}}$ | $\frac{{0.023{\kern 1pt} --{\kern 1pt} 0.279}}{{0.110}}$ |
| IX, 2015 | $\frac{{13.8{\kern 1pt} --{\kern 1pt} 35.8}}{{23.3}}$ | $\frac{{0.025{\kern 1pt} --{\kern 1pt} 0.631}}{{0.172}}$ | $\frac{{16.0{\kern 1pt} --{\kern 1pt} 34.5}}{{25.2}}$ | $\frac{{0.041{\kern 1pt} --{\kern 1pt} 0.600}}{{0.218}}$ | |
Примечание. Здесь и в табл. 3, 4: над чертой – пределы варьирования показателя, под чертой – среднее значение.
В сентябре 2015 г. в дельте Дона средние значения длины (24.4 мм) и массы (0.197 г) рыб были ожидаемо выше, чем в августе. Максимальные размеры самок по-прежнему превышали таковые самцов, однако по средним значениям самки уступали (табл. 2). Размерный ряд приобрёл двухмодальный тип: помимо размерной группы 24–27 мм по частоте встречаемости выделялась группа 33–36 мм, в которой преобладали самцы (рис. 2в).
Для сравнения: в августе 1954 г. в восточной части Таганрогского залива максимальная длина длиннохвостого бычка Книповича не превышала 27 мм, а модальный класс формировали рыбы существенно меньшего размера – SL 9–12 мм (Москалькова, 1960). В сентябре 1954 г. были получены данные, в целом сходные с нашими, а именно: в размерном составе длиннохвостой книповичии также выделялись два модальных класса – 6–9 и 18−21 мм. Однако доля рыб SL > 21 мм была значительно меньше, чем в наших уловах (36 против 91%), что обусловлено разными орудиями отбора проб. Москалькова (1960) использовала икорную сеть из газа № 140 мм, а также тралы Петерсена и салазочный, что позволяло облавливать все размерные группы длиннохвостого бычка Книповича – от личинок SL 4–6 мм до взрослых особей. Мы отбирали пробы бимтралом со вставкой из дели с ячеёй 3 мм, которым в основном облавливались рыбы SL > 15 мм; доля мелких особей составила ~4% общей выборки (~2 тыс. экз.). Рыбы SL < 15 мм с высотой тела 2 мм проходят через мелкоячейную вставку трала.
Немаловажным фактом является особенность вертикального распределения разных размерных групп длиннохвостого бычка Книповича: особи SL 9–21 мм обычно обитают в толще воды, а более крупные придерживаются придонных слоёв (Москалькова, 1962). Бимтралом в основном облавливаются рыбы, находящиеся в придонном слое воды. В связи с этим репрезентативное сравнение размерного состава бычков возможно в основном для половозрелой части населения этого вида. По нашим данным, популяция длиннохвостого бычка Книповича отличается существенно бóльшими размерами особей, чем в 1954 г. (Москалькова, 1960). Вероятно, это связано с резким снижением численности хищных рыб, которые выедали взрослую часть его популяции. В первую очередь это касается одного из наиболее массовых в те годы хищников – судака. Так, если в 1950-е гг. официальный вылов судака в Азовском море варьировал в пределах 8–17 (в среднем 10.7) тыс. т (Аверкиев, 1960), то, по данным АзНИИРХ, в 2007–2016 гг. – 6–107 (< 50) т, а с 2017 г. промышленный лов судака в Азовском море закрыт.
Средняя длина молоди судака в мае и июне составляет 7 и 20 мм соответственно; основой её питания, как и у длиннохвостого бычка Книповича, является зоопланктон; в июле длина мальков судака увеличивается до 50–70 мм, в августе – до 100 мм, и они в основном переходят на хищничество, при этом описываемый бычок играет немаловажную роль в их питании (Москалькова, 1960). Длиннохвостой книповичией питаются и взрослые особи судака, а также чехонь, азово-черноморская проходная сельдь, сом, белуга Huso huso, перкарина и другие хищные рыбы (Москалькова, 1962), численность которых к настоящему времени также существенно сократилась.
Половая структура популяции длиннохвостого бычка Книповича в исследованных выборках значительно различалась. В августе в дельте Дона и восточной части Таганрогского залива доля неполовозрелых особей составляла до 8.3%, в рукавах дельты самки по численности почти вдвое преобладали над самцами, а на акватории залива самки доминировали в соотношении 9.6 : 1. В сентябре в дельте Дона неполовозрелые особи отсутствовали, а доля самцов существенно возросла (до 59.2%). Возможно, это связано с тем, что часть отнерестившихся самок погибли, а остались отнерестившиеся самцы, охранявшие кладки икры, а также сеголетки обоих полов, которые должны были нереститься весной следующего года. По данным Москальковой (1960), в период активного нереста, приходящегося на летние месяцы, соотношение самок и самцов примерно 2 : 1. Наши данные подтверждают сложившееся к настоящему времени мнение о высокой изменчивости и неоднородности популяционных характеристик этого вида, способствующих поддержанию его высокой численности в напряжённых условиях обитания в исследованном районе.
Питание. У длиннохвостого бычка Книповича, как у многих представителей бычковых рыб, желудок анатомически не дифференцирован (Дука, Синюкова, 1976; Кобегенова, Джумалиев, 1991). На ранних стадиях развития его кишечник имеет форму трубки, её стенки плотные, непрозрачные и характеризуются сетчатой структурой, по мере развития бычка кишечник несколько усложняется, визуально желудок не выражен. Степень переваривания потреблённых организмов в кишечниках бычков была разная – от слегка до сильно переваренных либо разрушенных.
В августе в пище длиннохвостого бычка Книповича доминировали ветвистоусые (Cladocera) и веслоногие (Copepoda) ракообразные. Разная степень переваривания пищи не позволила определить до вида все потреблённые организмы. Calanoida в основном были представлены Calanipeda aquaedulcis, Cyclopoida – Mesocyclops sp. Кладоцеры Bosmina sp. и Chydorus sp. в переваренном виде хорошо сохраняли форму тела и легко идентифицировались до рода. Кладоцеры родов Diaphanosoma и Moina сильнее переваривались, различить их по остаткам порой было сложно, поэтому их объединили в одну группу. В пищевых комках шести особей были обнаружены остатки каменной креветки Palaemon elegans (видовую принадлежность удалось установить по отдельным хитиновым фрагментам – антеннулам, роструму, максиллипедам, уроподам). Случайно заглоченные (чешуя рыб) и редкие (яйца гидробионтов и водоросли) объекты при расчёте пищевых индексов не учитывали.
При сравнении спектров питания мелких и более крупных особей выявлены различия в размерном составе жертв. В пище бычков SL ≤ 23 мм отмечены организмы длиной 0.2–0.7 мм, преобладали жертвы размером 0.325–0.500 мм. Размерный диапазон объектов питания бычков SL > 23 мм был шире – 0.2–3.8 мм, при этом наблюдалось чётко выраженное предпочтение жертв длиной 0.425–0.500 мм и увеличение доли крупных жертв. В связи с этим питание анализировали у двух размерных групп бычка (табл. 3).
Таблица 3.
Состав пищи и суточные рационы двух размерных групп длиннохвостого бычка Книповича Knipowischia longecaudata в дельте Дона и восточной части Таганрогского залива в августе 2016 г.
| Компонент пищи и другие показатели | Песчаное Гирло, устьевая часть | Рукав Сухая Каланча | Таганрогский залив | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| устьевая часть | средняя часть | |||||||||||||
| SL ≤ 23 мм | SL > 23 мм | SL ≤ 23 мм | SL > 23 мм | SL ≤ 23 мм | SL > 23 мм | SL ≤ 23 мм | ||||||||
| N, % | F, % | N, % | F, % | N, % | F, % | N, % | F, % | N, % | F, % | N, % | F, % | N, % | F, % | |
| Cladocera: | ||||||||||||||
| – Diaphanosoma sp. + Moina sp. | 50.5 | 82 | 29.9 | 80 | 17.0 | 36 | 8.3 | 35 | 13.8 | 22 | 7.1 | 50 | – | – |
| – Bosmina sp. | 14.9 | 35 | 2.6 | 20 | 24.0 | 43 | 11.0 | 48 | – | – | – | – | 11.1 | 33 |
| – Chydorus sp. | – | – | 3.3 | 20 | 3.5 | 14 | 10.7 | 35 | 35.8 | 67 | 28.6 | 50 | – | – |
| Copepoda: | ||||||||||||||
| – Calanoida | 34.6 | 88 | 63.4 | 100 | 47.3 | 93 | 51.6 | 100 | 39.4 | 100 | 64.3 | 100 | 66.7 | 100 |
| – Cyclopoida | – | – | 0.3 | 8 | 1.2 | 14 | 9.2 | 48 | 0.9 | 11 | – | – | – | – |
| – Harpacticoida | – | – | – | – | 7.0 | 14 | 8.3 | 26 | 10.1 | 22 | – | – | 22.2 | 67 |
| Decapoda (Palaemon elegans) | – | – | 0.5 | 12 | – | – | 0.9 | 13 | – | – | – | – | – | – |
| Число рыб, экз. | 17 | 25 | 14 | 23 | 9 | 2 | 3 | |||||||
| Длина (SL), мм | $\frac{{14{\kern 1pt} - {\kern 1pt} 23}}{{18.8}}$ | $\frac{{24{\kern 1pt} - {\kern 1pt} 31}}{{26.8}}$ | $\frac{{14{\kern 1pt} - {\kern 1pt} 23}}{{19.9}}$ | $\frac{{24{\kern 1pt} - {\kern 1pt} 31}}{{27.3}}$ | $\frac{{18{\kern 1pt} - {\kern 1pt} 23}}{{21.9}}$ | $\frac{{24{\kern 1pt} --{\kern 1pt} 24}}{{24.0}}$ | $\frac{{19{\kern 1pt} - {\kern 1pt} 23}}{{20.7}}$ | |||||||
| Масса, г | $\frac{{0.020{\kern 1pt} - {\kern 1pt} 0.126}}{{0.074}}$ | $\frac{{0.125{\kern 1pt} - {\kern 1pt} 0.356}}{{0.267}}$ | $\frac{{0.032{\kern 1pt} - {\kern 1pt} 0.196}}{{0.111}}$ | $\frac{{0.148{\kern 1pt} - {\kern 1pt} 0.278}}{{0.225}}$ | $\frac{{0.062{\kern 1pt} - {\kern 1pt} 0.173}}{{0.138}}$ | $\frac{{0.223{\kern 1pt} --{\kern 1pt} 0.223}}{{0.223}}$ | $\frac{{0.062{\kern 1pt} - {\kern 1pt} 0.098}}{{0.079}}$ | |||||||
| Масса кишечника, г | $\frac{{0.001{\kern 1pt} - {\kern 1pt} 0.014}}{{0.005}}$ | $\frac{{0.008{\kern 1pt} - {\kern 1pt} 0.026}}{{0.017}}$ | $\frac{{0.001{\kern 1pt} - {\kern 1pt} 0.005}}{{0.002}}$ | $\frac{{0.002{\kern 1pt} - {\kern 1pt} 0.019}}{{0.008}}$ | $\frac{{0.001{\kern 1pt} - {\kern 1pt} 0.013}}{{0.006}}$ | $\frac{{0.004{\kern 1pt} - {\kern 1pt} 0.006}}{{0.005}}$ | $\frac{{0.001{\kern 1pt} --{\kern 1pt} 0.001}}{{0.001}}$ | |||||||
| Суточный рацион, мг | $\frac{{1.6{\kern 1pt} --{\kern 1pt} 22.4}}{{7.3}}$ | $\frac{{12.8{\kern 1pt} --{\kern 1pt} 41.62}}{{6.8}}$ | $\frac{{1.6{\kern 1pt} --{\kern 1pt} 8.0}}{{3.9}}$ | $\frac{{3.2{\kern 1pt} --{\kern 1pt} 30.4}}{{13.3}}$ | $\frac{{4.8{\kern 1pt} --{\kern 1pt} 20.8}}{{10.0}}$ | $\frac{{6.4{\kern 1pt} --{\kern 1pt} 9.6}}{{8.0}}$ | $\frac{{1.6{\kern 1pt} --{\kern 1pt} 1.6}}{{1.6}}$ | |||||||
| Средний суточный рацион, % массы тела | 9.4 | 10.0 | 3.6 | 5.7 | 7.1 | 3.6 | 2.1 | |||||||
На исследованных участках видовой состав пищи бычков несколько различался (табл. 3). В устьевой части Песчаного Гирла, в отличие от других акваторий, у бычков обеих размерных групп отмечена высокая встречаемость не только Calanoida (88–100%), но и кладоцер Diaphanosoma sp. и Moina sp. (80–82%). При этом последние у особей SL ≤ 23 мм являлись доминирующей пищей (50.5% числа жертв), тогда как бычки SL > 23 мм потребляли преимущественно Calanoida (63.4%). Видовой состав пищи 2-й размерной группы был разнообразнее, чем 1-й группы. В рукаве Сухая Каланча в питании всех бычков первую позицию по частоте встречаемости и обилию в кишечниках занимали Calanoida, вторую – Cladocera; причём доля Calanoida у крупных особей по сравнению с мелкими была выше (51.6–64.3 против 39.4–47.3%). Пищевой спектр бычков в устьевой части этого рукава отличался наибольшим разнообразием. У 3 экз. из Таганрогского залива среди жертв также преобладали Calanoida.
Сравнение полученных данных с результатами исследования питания длиннохвостого бычка Книповича в 1950-х гг. (Москалькова, 1962) показало, что основу его пищи по-прежнему составляют Calanoida. Разнообразие потребляемых копепод сократилось из-за резкого снижения численности Eurytemora velox и Heterocope caspia в море. В 1950-х гг. кладоцеры D. brachyurum и Moina sp. в кишечниках бычков не отмечены, тогда как в 2016 г. в устьевой части Песчаного Гирла их встречаемость у обеих размерных групп была высокой, а у особей SL ≤ 23 мм они доминировали по численности. Мы не обнаружили в кишечниках бычков Amphipoda, Mysidacea, Cumacea, червей и Chironomidae, которые ранее играли незначительную роль в его питании. Произошедшие по сравнению с 1950-ми гг. изменения в рационе длиннохвостого бычка Книповича обусловлены существенными изменениями в составе зоопланктона, произошедшими на протяжении двух последних десятилетий. Преобладание разных кормовых объектов в питании бычков в исследованных акваториях позволяет предположить, что бычки питались наиболее многочисленными и доступными жертвами; вероятно, избирательность питания у этого вида слабо выражена либо отсутствует. Косвенно это подтверждает использование в пищу нового для региона вида – каменной креветки. Включение в рацион длиннохвостого бычка Книповича этого морского вида свидетельствует о перестройке трофических связей и в целом о трансформации сообщества гидробионтов дельты Дона. Данный вид сравнительно недавно стал встречаться в районе исследования, его численность в дельте Дона в настоящее время растёт (Статкевич, 2016; Матишов и др., 2017). Это является следствием интенсивного повышения солёности воды в Таганрогском заливе до 10.5‰, при этом постоянная изогалина 2−4‰ подошла непосредственно к дельте Дона, что при интенсивных нагонах провоцирует заток солоноватых вод в реку вплоть до г. Ростов-на-Дону, расположенного выше в 30 км от устья (Матишов и др., 2017). По данным гидрометеопоста “Кагальник”, расположенного в средней части рукава Свиное Гирло, в период наших исследований солёность воды поверхностного слоя варьировала в пределах 0.62–1.06‰, у дна – 0.62–2.07‰ и зависела от гидрометеорологической ситуации.
В августе 2016 г. в кишечниках исследованных особей одновременно находились от одной до 43 жертв. Рассчитанные для двух размерных групп суточные рационы варьировали в пределах 2–10% массы тела (табл. 3). Максимальные значения отмечены в Песчаном Гирле (9.4–10.0%), где они у рыб SL ≤ 23 мм в среднем составляли 7.3 мг, SL > 23 мм – 26.8 мг. В средней части рукава Сухая Каланча они были соответственно на уровне 10.0 и 8.0 мг, а в устьевой части этой протоки – 3.9 и 13.3 мг. Наименьший суточный рацион зарегистрирован в Таганрогском заливе у особей 1-й размерной группы – 1.6 мг. За исключением высоких значений у рыб SL > 23 мм в Песчаном Гирле рассчитанные нами рационы соответствуют данным, полученным ранее Боковой (1964) – 13 мг для бычков SL 11–30 мм.
Показатели обилия. В августе (2016 г.) в дельте Дона доля длиннохвостого бычка Книповича по численности в уловах бимтрала была достаточно высокой. В Песчаном Гирле он являлся доминирующим (12.5–15.1%) и субдоминирующим (5.2–5.9%) видом; в Мериновом и Свином – преимущественно доминирующим (соответственно 18.4–26.7 и 19.2–39.1%), за исключением устьевой части Свиного Гирла, где являлся субдоминантом. В рукаве Сухая Каланча доля длиннохвостого бычка Книповича в сообществах была ещё выше – 28.9–53.5%, а наибольшая степень доминирования наблюдалась в мелководной восточной части Таганрогского залива, где вид составлял 64.1–91.0% уловов. Доля этого мелкого вида по биомассе в уловах была значительно ниже и не превышала 15.8% в речной системе, существенно выше (до 46.5%) она была на акватории Таганрогского залива.
В сентябре (2015 г.) в дельте Дона доля длиннохвостого бычка Книповича по численности в уловах была выше, чем в августе. Так, в Песчаном Гирле и самой нижней части рукава Старый Дон этот вид был супердоминантом (52.1–89.7%). На 70% обследованной акватории рукавов дельты он также занимал доминирующее положение (10.2–35.6%.) По массе доля этого вида была значительно ниже, чем в августе, она не превышала 14.7%, в среднем составляя 6.6%.
Значения удельной численности и биомассы бычка Книповича в исследованном районе подвержены чрезвычайно высокой изменчивости как во времени, так и в пространстве (рис. 3, табл. 4). Наиболее плотные скопления бычка мы зарегистрировали в августе 2016 г. в мелководной восточной части Таганрогского залива на участках с густой водной растительностью и илисто-песчаным дном. Здесь его удельная численность на станции № 36 превышала 36 тыс. экз/га, биомасса − 5 кг/га при средних величинах соответственно 20.2 тыс. экз/га и 2.5 кг/га. В рукавах дельты Дона средние значения удельной численности и биомассы бычка в это время были на один–два порядка ниже, чем в заливе. На станциях № 25–28, выполненных в акватории фарватера рукава Старый Дон на глубине 4–11 м, бычок в уловах отсутствовал (табл. 1, рис. 3).
Рис. 3.
Удельная численность (Ns) длиннохвостого бычка Книповича Knipowitschia longecaudata в дельте Дона и восточной части Таганрогского залива в августе 2016 (⚪) и сентябре 2015 гг. (⚫).
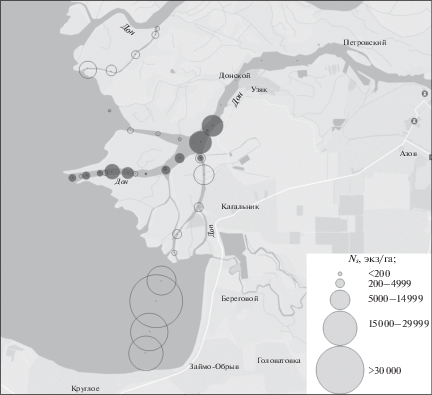
Таблица 4.
Удельная численность (Ns) и биомасса (Ws) длиннохвостого бычка Книповича Knipowitschia longecaudata в дельте Дона и восточной части Таганрогского залива в августе 2016 и сентябре 2015 гг.
| Район | Август 2016 г. | Сентябрь 2015 г. | ||
|---|---|---|---|---|
| Ns, экз/га | Ws, кг/га | Ns, экз/га | Ws, кг/га | |
| Дельта Дона, рукав: | ||||
| Старый Дон | $\frac{{0{\kern 1pt} --{\kern 1pt} 48}}{{24.1}}$ | $\frac{{0{\kern 1pt} --{\kern 1pt} 0.010}}{{0.005}}$ | $\frac{{5943{\kern 1pt} --{\kern 1pt} 6689}}{{6316.3}}$ | $\frac{{1.496{\kern 1pt} --{\kern 1pt} 1.686}}{{1.591}}$ |
| Песчаное Гирло | $\frac{{134{\kern 1pt} --{\kern 1pt} 355}}{{251.3}}$ | $\frac{{0.031{\kern 1pt} --{\kern 1pt} 0.082}}{{0.052}}$ | $\frac{{832{\kern 1pt} --{\kern 1pt} 1818}}{{1183.1}}$ | $\frac{{0.238{\kern 1pt} --{\kern 1pt} 0.495}}{{0.300}}$ |
| Свиное Гирло | $\frac{{361{\kern 1pt} --{\kern 1pt} 5276}}{{2031.5}}$ | $\frac{{0.070{\kern 1pt} --{\kern 1pt} 0.843}}{{0.300}}$ | 569* | 0.200* |
| Мериново Гирло | $\frac{{142{\kern 1pt} --{\kern 1pt} 430}}{{270.2}}$ | $\frac{{0.014{\kern 1pt} --{\kern 1pt} 0.091}}{{0.050}}$ | ||
| Сухая Каланча | $\frac{{270{\kern 1pt} --{\kern 1pt} 3875}}{{1831.4}}$ | $\frac{{0.037{\kern 1pt} --{\kern 1pt} 0.545}}{{0.300}}$ | ||
| Таганрогский залив | $\frac{{10925{\kern 1pt} --{\kern 1pt} 36355}}{{20237.4}}$ | $\frac{{1.088{\kern 1pt} --{\kern 1pt} 5.006}}{{2.500}}$ | ||
Годом ранее, в сентябре 2015 г., в нижней части рукава Старый Дон и в Песчаном Гирле средние значения удельной численности и биомассы этого бычка были значительно выше, чем в 2016 г.: Ns – 6316 против 24 и 1183 против 251 экз/га, Ws – 1.591 против 0.005 и 0.300 против 0.052 кг/га (табл. 4, рис. 3). Не исключено, что значительное сокращение численности популяции длиннохвостой книповичии в этих судоходных рукавах связано с интенсивными дноуглубительными работами, которые проводили в этот период. Следует отметить, что в Сухой Каланче и Мериновом Гирле вверх по течению численность бычка снижается, тогда как в Свином гирле, наоборот, повышается. Для объяснения причин обнаруженных различий необходимы дополнительные исследования на постоянной основе, охватывающие все возможные для проведения обловов месяцы.
Таким образом, полученные данные свидетельствуют о том, что длиннохвостый бычок Книповича является одним их наиболее массовых видов в низовьях дельты Дона и восточной части Таганрогского залива. Высокие значения удельной численности и биомассы свидетельствуют о существенном вкладе бычка в общую рыбопродуктивность района. Роль этого вида в функционировании эстуарного экотона реки существенно возросла по сравнению с 1960-ми гг. в связи с резким снижением численности хищных рыб, в первую очередь судака. Результаты изучения питания длиннохвостой книповичии в дельте Дона и Таганрогском заливе подтверждают его трофическую пластичность, в связи с этим пища не является лимитирующим фактором для выживания этих рыб при некотором увеличении солёности и изменении трофических условий в устье Дона, что обеспечивает высокую конкурентную способность вида.
БЛАГОДАРНОСТИ
Авторы выражают благодарность Г.Г. Матишову (ЮНЦ РАН) за содействие в организации экспедиций на базе Научно-экспедиционного центра “Кагальник”; А.В. Старцеву (ЮНЦ РАН) – за помощь в сборе материала; А.А. Котову (ИБВВ РАН), С.В. Статкевич и Е.В. Ануфриевой (ИМБИ РАН) – за консультации при определении отдельных таксономических групп в кишечниках бычков; В.А. Лужняку (АзНИИРХ) – за предоставленные данные по промысловой статистике.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках бюджетной темы “Закономерности формирования и антропогенная трансформация биоразнообразия и биоресурсов Азово-Черноморского бассейна и других районов Мирового океана” № АААА-А18-118020890074-2. В работе использован коллекционный материал длиннохвостого бычка Кпиповича, хранящийся в ЦКП “Коллекция гидробионтов Мирового океана ИМБИ РАН”, поддержанном программой биоресурсных коллекций ФАНО.
Список литературы
Аверкиев Ф.В. 1960. Сборник статистических сведений об уловах рыб и нерыбных объектов в Азово-Черноморском бассейне за 1927–1959 гг. // Тр. АзНИИРХ. Т. 1. Вып. 2. 93 с.
Бокова Е.Н. 1964. Оценка степени использования зоопланктона молодью рыб Таганрогского залива // Тр. ВНИРО. Т. IV. С. 89−96.
Васильева Е.Д., Лужняк В.А. 2013. Рыбы бассейна Азовского моря. Ростов н/Д.: Изд-во ЮНЦ РАН, 272 с.
Дука Л.А., Синюкова В.И. 1976. Руководство по изучению питания личинок и мальков морских рыб в естественных и экспериментальных условиях. Киев: Наук. думка, 133 с.
Кобегенова С.С., Джумалиев М.К. 1991. Морфофункциональные особенности пищеварительной системы некоторых бычковидных рыб (Gobioidei) // Вопр. ихтиологии. Т. 31. Вып. 6. С. 492−505.
Манило Л.Г. 2014. Рыбы семейства бычковые (Perciformes, Gobiidae) морских и солоноватых вод Украины. Киев: Наук. думка, 243 с.
Мануйлова Е.Ф. 1964. Ветвистоусые рачки фауны СССР. Л.: Наука, 326 с.
Матишов Г.Г., Болтачев А.Р., Степаньян О.В. и др. 2017. Современное таксономическое разнообразие и пространственное распределение сообществ рыб и некоторых высших ракообразных экотона эстуарной зоны реки Дон // Наука юга России. Т. 13. № 1. С. 84−101.
Москалькова К.И. 1960. Некоторые особенности роста и размножения бычка Книповича в Таганрогском заливе // Тр. АзНИИРХ. Т. 1. Вып. 1. С. 441–446.
Москалькова К.И. 1962. О питании и распределении бычка Knipowitschia longecaudata (Kessler) в Таганрогском заливе // Вопр. ихтиологии. Т. 2. Вып. 3(24). С. 492−505.
Определитель фауны Чёрного и Азовского морей. 1969. Т. 2. Киев: Наук. думка, 536 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Рыбы в заповедниках России. 2013. Т. 2. Морские рыбы / Под ред. Решетникова Ю.С. М.: Т-во науч. изд. КМК, 673 с.
Статкевич С.В. 2016. Современное состояние фауны десятиногих ракообразных в устье Дона в условиях изменения среды обитания // Экол. безопасность прибрежной и шельфовой зоны моря. № 4. С. 64–69.
Терещенко В.Г., Надиров С.Н. 1996. Формирование структуры рыбного населения предгорного водохранилища // Вопр. ихтиологии. Т. 36. № 2. С. 169−178.
Троицкий С.К. 1961. Биология и рыбохозяйственное значение бычка Knipowitschia longecaudata в кубанских лиманах // Тр. АзНИИРХ. Вып. 4. С. 124–130.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


