Вопросы ихтиологии, 2019, T. 59, № 3, стр. 369-372
Функциональные свойства гемоглобина леща Abramis brama и карася Carassius carassius при гипоксии
И. М. Камшилов 1, *, Т. Б. Камшилова 1
1 Институт биологии внутренних вод РАН – ИБВВ
Ярославская область, пос. Борок, Россия
* E-mail: kim@ibiw.yaroslavl.ru
Поступила в редакцию 02.04.2018
После доработки 23.05.2018
Принята к публикации 23.05.2018
Аннотация
Исследовано влияние внешней гипоксии на функциональные свойства гемоглобинов карася Carassius carassius и леща Abramis brama. Выявлено увеличение сродства гемоглобина к кислороду и величины эффекта Бора под воздействием внешней гипоксии.
Гипоксия – это такое состояние, когда к тканям не поступает достаточное количество кислорода, что приводит к угнетению жизненных процессов и нередко к гибели. В работах, посвящённых изучению этого состояния, объектом, как правило, являются представители семейства Salmonidae (Gold et al., 2015) и рассматриваются в основном проблемы, либо связанные с внешней гипоксией, а именно низким рО2 в водоёме (McKenzie et al., 2004), изменениями в жабрах (Matey et al., 2008) и гематологических показателей (Gaulke et al., 2014), либо связанные с действием органических фосфатов (Val et al., 1984, 2015; Monteiro et al., 1987; Val, 2000; Rutjes et al., 2007) и катехоламинов (Thomas, Gilmour, 2012). А исследований влияния гипоксии на функциональные свойства гемоглобинов рыб практически нет.
Цель работы – изучить влияние внешней гипоксии на функциональные свойства и спектральные характеристики гемоглобинов карася Carassius carassius и леща Abramis brama.
МАТЕРИАЛ И МЕТОДИКА
Работа проведена на особях карася (массой 80–120 г) и леща (250–350 г), отловленных неводом в естественном водоёме. Контрольную пробу крови (норма) брали непосредственно на берегу сразу после отлова. Экспериментальных рыб содержали в бассейнах объёмом 600–700 л в течение двух недель с нормальной продувкой воздухом, затем подачу воздуха прекращали для карася и уменьшали для леща. Концентрация кислорода в бассейнах с карасём и лещом снижалась соответственно до ~ 2.5 и 3.5 мг/л. Карася выдерживали в таких условиях 40 сут., леща – 20 сут. Отбор проб крови и получение гемоглобина проводили по стандартной методике, кривые кислородного равновесия получали спектрофотометрически по разработанной ранее методике (Камшилов, 2001).
РЕЗУЛЬТАТЫ
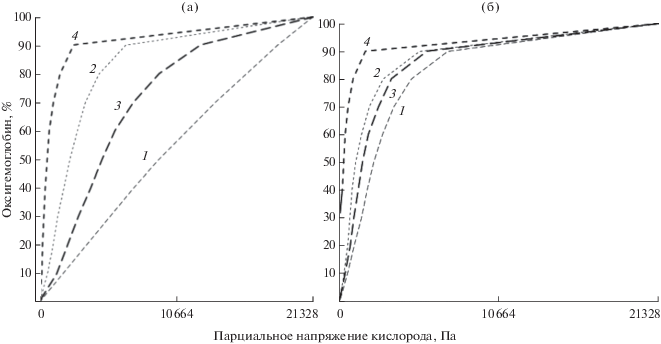
Под воздействием гипоксии форма кривой кислородного равновесия гемоглобина карася изменяется, переходя от S-образной к гиперболической, что особенно хорошо заметно при рН 7.2 и обеих молярностях буферной системы 0.005 и 0.05 М (рис. 1). Несколько иная картина наблюдается у леща. В норме при рН 6.6 и молярности 0.05 М эта кривая имеет практически прямую форму, при гипоксии становится S-образной, а при рН 7.2 переходит в гиперболу (рис. 2а). При 0.005 М и рН 7.2 у леща нарушается процесс дезоксигенации: гемоглобин дезоксигенируется только на 67% (рис. 2б). Все исследованные кривые неинвариантные, т.е. не могут быть трансформированы друг в друга. У обоих исследуемых видов рыб под воздействием гипоксии значительно увеличивается сродство гемоглобина к кислороду: у карася при 0.005 М и рН 7.2 и 6.6 сродство увеличивается соответственно в 3.4 и 2.5 раза, а при 0.05 М – в 3.1 и 1.5 раза; у леща – соответственно в 3.7 и 1.5 и в 3.9 и 1.9 раза.
Рис. 1.
Кривые кислородного равновесия гемоглобина карася Carassius carassius в нормальных условиях и под воздействием гипоксии при молярности буферного раствора 0.05 М (а) и 0.005 М (б): 1 – норма, pH 6.6; 2 – норма, рН 7.2; 3 – гипоксия, pH 6.6; 4 – гипоксия рН 7.2.
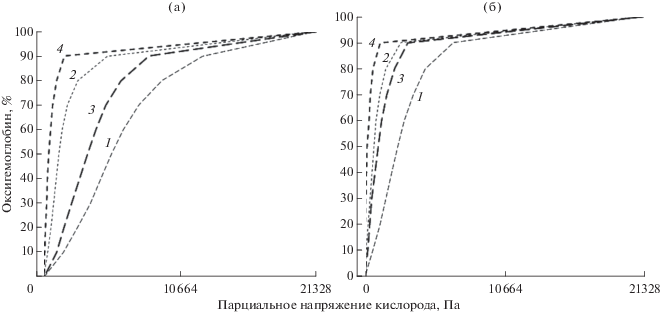
Рис. 2.
Кривые кислородного равновесия гемоглобина леща Abramis brama в нормальных условиях и под воздействием гипоксии при молярности буферного раствора 0.05 М (а) и 0.005 М (б); обозначения см. на рис. 1.
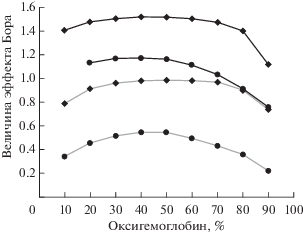
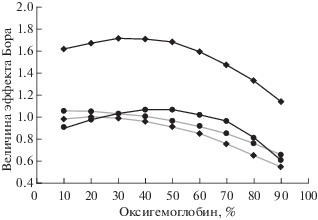
Величина эффекта Бора у исследованных видов рыб под воздействием гипоксии увеличивается по-разному. У карася при 0.005 М происходит незначительное увеличение, тогда как при 0.05 М эффект увеличивается в 1.8 раза (рис. 3). При этом в норме изменение молярности не оказывает значимого влияния на величину эффекта Бора гемоглобина карася – кривые практически полностью совпадают. Несколько иная картина наблюдается у кривых эффекта Бора гемоглобина леща (рис. 4). При обеих молярностях буферного раствора воздействие гипоксии приводит к увеличению эффекта Бора тем более выраженному, чем меньше молярность: при 0.005 М эффект увеличился в 2.1 раза, а при 0.05 М – в 1.5 раза.
Рис. 3.
Величины эффекта Бора гемоглобина карася Carassius carassius в нормальных условиях (—) и под воздействием гипоксии (—) при молярности буферного раствора 0.05 М (◆) и 0.005 М (⚫).
ОБСУЖДЕНИЕ
Карась населяет болотистые пруды, заросшие водной растительностью озёра, участки рек с медленным течением; может жить при очень низком содержании кислорода в воде (Никольский, 1971; Вилер, 1983; Шатуновский и др., 1988). Кроме того, хорошо переносит низкую температуру и загрязнение водоёмов органическими сточными водами (Вилер, 1983). Лещ также населяет водоёмы со слабым течением. В реках живёт в омутах или заливах, в водохранилищах придерживается наиболее глубоких русловых участков. Обычно встречается у дна на илистых и песчанно-илистых грунтах. Ведёт оседлый образ жизни, совершая лишь ограниченные перемещения, связанные с нагулом, нерестом и зимовкой (Шатуновский и др., 1988). Если карась может жить в водоёмах c очень низким (0.5–2.0 мг/л) содержанием кислорода (Садыкова, 2016) и даже переходить на анаэробный тип энергообеспечения (Гулевский и др., 2007), то лещ выживает только при содержании кислорода в придонных слоях не ниже 3.5–4.0 мг/л летом и 2.5 мг/л зимой (Кожина, 1956).
Пертнер и Кнуст (Pörtner, Knust, 2007) обнаружили, что крупные рыбы более чувствительны к недостатку кислорода, чем мелкие особи. В нашем случае исследованные караси были значительно меньше лещей. Известно также (Wells, 2009), что более активные рыбы менее приспособлены к внешней гипоксии, обитают в хорошо актированных водоёмах и способны испытывать внутреннюю или функциональную гипоксию, происходящую при длительных чрезмерных нагрузках; как правило, они обладают высокой способностью получать кислород при относительно низком сродстве гемоглобина к кислороду, которое модулируется при помощи АТФ. Противоположная картина наблюдается у рыб, ведущих спокойный образ жизни и обитающих в условиях гипоксии.
У карася, находящегося в близком к гибели состоянии, происходит резкое снижение сродства гемоглобина к кислороду (величина Р50 при рН 7.2 увеличивается почти в 3.0 раза, при рН 6.6 − более чем в 1.6 раза), что, по-видимому, свидетельствует о смещении равновесия между ионами магния и АТФ в сторону увеличения последнего (Камшилов, 2017). Однако гипоксия оказывает совершенно противоположное действие. Это свидетельствует о том, что у гемоглобина карася имеются некоторые механизмы, при помощи которых он может относительно долгое время находится в условиях дефицита кислорода. Об этом свидетельствует высокое сродство гемоглобина к кислороду. Если при уменьшении молярности буферного раствора в 10 раз у гемоглобина леща при гипоксии наблюдается нарушение процесса дезоксигенации, то у карася таких нарушений нет, хотя сродство гемоглобина выше, чем у леща (Р50 1.6 против ~ 293.3 Па). Следует также отметить, что в процессе акклимации к низкому содержанию кислорода рыбы долгое время оставались без пищи, что привело к постепенному расходованию АТФ и в конце концов к значительному смещению равновесия между содержанием ионов магния и макроэргом в сторону Mg2+. Примечательно, что у гемоглобина леща, как и у большинства исследованных нами ранее видов рыб, величина эффекта Бора при гипоксии при обеих молярностях статистически значимо увеличивается, тогда как у гемоглобина карася при 0.005 М он практически не изменяется.
Таким образом, воздействие гипоксии на функциональные свойства гемоглобинов карася и леща вызывает значительное увеличение сродства гемоглобина к кислороду и возрастание величины эффекта Бора.
Список литературы
Вилер А. 1983. Определитель рыб морских и пресных вод североевропейского бассейна. М.: Лег и пищ. пром-сть, 432 с.
Гулевский А.К., Релина Л.И., Жегунова Е.Г. и др. 2007. Роль гликолиза при холодовой адаптации карася серебряного Carassius auratus gibelio // Проблемы криобиологии. Т. 17. № 1. С. 64–70.
Камшилов И.М. 2001. Методика определения функциональных свойств у рыб (влияние метгемоглобина и АТФ) // Биология внутр. вод. № 1. С. 96−101.
Камшилов И.М. 2017. Функциональные свойства гемоглобина карася Carassius auratus перед гибелью // Вопр. ихтиологии. Т. 57. № 6. С. 755–758.
Кожина Е.С. 1956. Наблюдения над ранними стадиями жизни леща в Миккельском озере и Крошнозере // Тр. Карел. филиала АН СССР. Т. 2. С. 164–187.
Никольский Г.В. 1971. Частная ихтиология. М.: Высш. шк., 427 с.
Садыкова И.А. 2016. Санитарные условия для рыбохозяйственных водоемов. Уфа: БашГАУ, 18 с.
Шатуновский М.И., Огнев Е.Н., Соколов Л.И. и др. 1988. Рыбы Подмосковья. М.: Наука, 143 с.
Gaulke G.L., Dennis C.E., Wahl D.H. et al. 2014. Acclimation to a low oxygen environment alters the hematology of largemouth bass (Micropterus salmoides) // Fish Physiol. Biochem. V. 40. № 1. P. 129–140. https://doi.org/10.1007/s10695-013-9830-6
Gold D.K., Loirat T., Farrell A.P. 2015. Cardiorespiratory responses to haemolytic anaemia in rainbow trout Oncorhynchus mykiss // J. Fish Biol. V. 87. № 4. P. 848–859. https://doi.org/10.1111/jfb.12742
Matey V., Richards J.G., Wang Y. et al. 2008. The effect of hypoxia on gill morphology and ionoregulatory status in the Lake Qinghai scaleless carp, Gymnocypris przewalskii // J. Exp. Biol. V. 211. P. 1063–1074.
McKenzie D.J., Wong S., Randall D.J. et al. 2004. The effects of sustained exercise and hypoxia upon oxygen tensions in the red muscle of rainbow trout // Ibid. V. 207. P. 3629–3637.
Monteiro P.J.C., Val A.L., Almeida-Val V.M.F. 1987. Biological aspects of Amazonian fishes. Hemoglobin, hematology, intraerythrocytic phosphates and whole blood Bohr effect of Mylossoma duriventris // Can. J. Zool. V. 65. P. 1805–1811.
Pörtner H.O., Knust R. 2007. Climate change affects marine fishes through the oxygen limitation of thermal tolerance // Science. V. 315. P. 95–97.
Rutjes H.A., Nieveen M.C., Weber R.E. et al. 2007. Multiple strategies of Lake Victoria cichlids to cope with lifelong hypoxia include hemoglobin switching // Amer. J. Physiol. V. 293. P. 1376–1383.
Thomas J.B., Gilmour K.M. 2012. Low social status impairs hypoxia tolerance in rainbow trout (Oncorhynchus mykiss) // J. Comp. Physiol. V. 182B. № 5. P. 651–662. https://doi.org/10.1007/ s00360-012-0648-9
Val A.L. 2000. Organic phosphates in the red blood cells of fish // Comp. Biochem. Physiol. V. 125A. P. 417–435.
Val A.L., Almeida-Val V.M.F., Schwantes A.R. et al. 1984. Biological aspects of Amazonian fishes I. Red blood cell phosphates of schooling fishes (genus Semaprochilodus: Prochilodontidae) // Ibid. V. 78B. P. 215–217.
Val A.L., Gomes K.R.M., Almeida-Val V.M.F. 2015. Rapid regulation of blood parameters under acute hypoxia in the Amazonian fish Prochilodus nigricans // Ibid. V. 184A. P. 125–131.
Wells R.M.G. 2009. Blood-gas transport and hemoglobin function: adaptations for functional and environmental hypoxia // Fish Physiology. V. 27. Hypoxia / Eds. Farrell A.P., Brauner C.J.N. Y.: Acad. Press. P. 255–299.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии