Вопросы ихтиологии, 2019, T. 59, № 3, стр. 311-317
Устойчивость молоди окуня Perca fluviatilis и ротана Perccottus glenii к выеданию щукой Esox lucius
А. К. Смирнов 1, *, Е. С. Смирнова 1, Ю. В. Кодухова 1, Д. П. Карабанов 1
1 Институт биологии внутренних вод РАН – ИБВВ
Ярославская область, пос. Борок, Россия
* E-mail: smirnov@ibiw.yaroslavl.ru
Поступила в редакцию 24.04.2018
После доработки 24.10.2018
Принята к публикации 25.10.2018
Аннотация
В экспериментальных условиях исследована устойчивость молоди ротана Perccottus glenii и окуня Perca fluviatilis к воздействию хищника-ихтиофага щуки Esox lucius. В большинстве опытов ротаны выедались щуками значительно эффективнее. Данная тенденция сохранялась в аквариумах разного объёма и формы, в отсутствие и при наличии в среде укрытий. В отличие от окуня молодь ротана не использует поведенческие реакции групповой защиты, что в условиях эксперимента способствовало её большей уязвимости. Полученные данные подтверждают вывод полевых наблюдений о ключевом влиянии хищников-ихтиофагов на возможность заселения ротаном тех или иных водоёмов.
Ротан-головешка Perccottus glenii (Odontobutidae) − один из самых массовых чужеродных видов рыб в Европе, вызывающий при вселении существенную трансформацию водных экосистем. Несомненно, что выявление природных факторов контроля над его численностью является актуальной задачей управления биологическими ресурсами. Нативный ареал ротана приурочен к пресным водоёмам Приамурья и Приморья (Никольский, 1956). Как правило, он заселяет небольшие, мелководные, сильно зарастающие и не соединённые бóльшую часть года с руслом Амура пойменные озёра, а также пруды и болота. С 1916 г. ротан-головешка широко распространился в Северной Евразии, став достаточно обычным представителем ихтиофауны пресных водоёмов европейской части России и стран Восточной Европы (Reshetnikov, Ficetola, 2014). Следует отметить, что и в приобретённой части ареала он тяготеет к небольшим водоёмам антропогенного (карьеры, пруды, канавы) и естественного (пойменные озёра, старицы рек) происхождения. В крайне редких случаях вид отмечается в сильно заросших водной растительностью мелководных заливах водохранилищ р. Волга (Вечканов и др., 2007; Kas’yanov, Goroshkova, 2012). По нашим данным, на настоящий момент на Волге найдены лишь три местообитания (в акватории Чебоксарского, Саратовского и Волгоградского водохранилищ), где бы в уловах регулярно встречался ротан.
Таким образом, в пределах как нативного, так и приобретённого ареала ротан не встречается в крупных озёрах, водохранилищах, а также в основном течении рек. Очевидно, в этих водоёмах имеются некие экологические факторы, препятствующие существованию данного вида. Чаще всего среди таковых указывают высокую уязвимость ротана для хищников, а также избегание им водоёмов даже со средними скоростями течения (Рыбы в заповедниках …, 2010). Вместе с тем известно, что роль ротана в пище амурских хищных рыб относительно невелика (Никольский, 1956; Рыбы в заповедниках …, 2010). Семенов (2009) отметил потребление ротана-головешки щукой Esox lucius в акватории Куйбышевского водохранилища, но не указал биотоп, где были выловлены хищники. Имеются данные (Литвинов, 1993; Litvinov, O’Gorman, 1996) о питании ротаном крупного окуня Perca fluviatilis и щуки в дельте Селенги и прилегающих водоёмах бассейна Байкала. В этих работах подчёркивается, что существенную долю в рационе хищников ротан составляет лишь в малых водоёмах, полностью отшнурованных или связанных с основным водотоком (река, крупная протока или озеро) только в период половодья, либо протяжёнными каналами. В целом же отсутствие крупных ихтиофагов в большинстве водоёмов, населённых ротаном, косвенно указывает на то, что хищники могут являться одним из основных факторов, сдерживающих его распространение. В то же время сведений о прямых исследованиях этого вопроса в экспериментальных или полевых условиях мы не обнаружили.
Как показали наши почти 20-летние наблюдения за численностью и распределением рыб в прибрежье водохранилищ бассейна Волги, наиболее обильна здесь молодь карповых (Cyprinidae) и окуня, а основной резидентный хищник – щука; при этом совместное обитание молоди окуня и ротана-головешки практически не отмечалось. Несомненно, помимо абиотических условий ключевым элементом регуляции численности рыб в прибрежье служит пресс хищника. В связи с этим изучение относительной устойчивости нативных и адвентивных видов к воздействию хищников-ихтиофагов актуально как с точки зрения экологии, так и прогноза распространения чужеродных видов. Кроме того, эти данные могут служить основой для разработки методов регуляции численности видов-вселенцев и перспективных технологий биологического контроля инвазий в пресноводных экосистемах (Makhrov et al., 2014; Карабанов, Кодухова, 2015).
Цель данного исследования − выявить различия в устойчивости одновозрастной молоди инвазийного и нативного видов (ротана и окуня) к воздействию хищника (щука).
МАТЕРИАЛ И МЕТОДИКА
Исследование выполнено в 2014−2017 гг. на одноразмерной молоди ротана и окуня в возрасте 0−1+ массой соответственно 1.5−22.0 и 2.0−15.0 г, полной длиной (TL) 30−105 и 35−95 мм. В качестве хищника использованы особи щуки в возрасте 1+−2+ длиной 150−400 мм. Рыб отлавливали активными орудиями лова (малый невод − длина 9 м, высота 1.5 м, ячея в крыльях и кутке 4 мм и большой невод – длина 24 м, ячея в крыльях 12 мм, ячея в кутке 9 мм): окуней и щук − в прибрежье Рыбинского водохранилища, ротанов − в небольшом изолированном водоёме в 2 км от его побережья. После вылова в течение как минимум двух недель рыбы проходили период адаптации к лабораторным условиям в аквариумах объёмом 350 л. Всего провели три эксперимента, в которых использовали 410 особей ротана-головешки, 410 особей окуня и 76 щук; молодь и хищников повторно в экспериментах не использовали. При содержании и во время 1-го и 2-го эксперимента молодь кормили искусственным кормом на основе рыбного фарша. Наблюдения и запись данных проводили дважды в сутки на протяжении всего срока экспериментов с помощью цифровой системы видеофиксации на базе камеры DCS-2210 (“D-Link”, Тайвань).
Первый эксперимент выполняли в аквариуме объёмом 1.15 м3 (1.6 × 1.2 × 0.6 м). Для оценки устойчивости молоди к воздействию хищников в аквариум помещали смешанную группу из 20 одноразмерных особей ротана и окуня (в соотношении 1 : 1). После адаптации к новой среде в течение 2 сут. к ним подсаживали двух щук. Для уменьшения влияния видового соотношения на доступность рыб для хищника эксперимент продолжался до момента выедания 50% особей одного из исследуемых видов. Всего выполнено 16 опытов: по восемь в отсутствии и присутствии укрытий. Укрытия представляли собой отрезки керамических трубок диаметром 60 мм и длиной 340 мм, случайным образом размещённых на дне аквариума.
Второй эксперимент проводили по аналогичной схеме и в том же объёме (восемь опытов при отсутствии укрытий и восемь – при их наличии), но в аквариуме, имеющем форму длинного узкого мелководного лотка − 3.0 × 0.4 × 0.25 м (0.3 м3). Это было сделано с целью ограничить возможности окуня избегать контакта с хищником, так как его двигательная активность выше, чем у ротана.
В третьем эксперименте изучали особенности поведения молоди исследуемых видов на фоне отсутствия и присутствия хищника (щука TL ~ 30 см). Опыты выполняли в плоском аквариуме − 1.3 × × 0.9 × 0.1 м (0.12 м3). В начале каждого опыта 15 особей одного вида помещали в аквариум на несколько часов для адаптации к новой среде. Распределение рыб по площади фиксировали четыре раза: по завершении периода адаптации (I), непосредственно после помещения хищника в экспериментальную среду (II), спустя 15 мин (III) и через 1 ч (IV) после этого события. Для оценки защитной реакции критерием служила средняя дистанция между особями. По фотоснимкам определяли расстояние между ближайшими особями в группе, полученные результаты пересчитывали в дистанции, выраженные в длине тела экспериментальных рыб (Д, nTL). В отдельных случаях на момент съёмки могло быть несколько групп, поэтому при статистическом анализе значение Д > 8 TL не учитывали. Это позволило повысить репрезентативность полученных данных. Всего выполнено шесть опытов, в течение которых рыб не кормили.
Статистическая обработка данных выполнена в программе STATISTICA v. 6 (“StatSoft Inc.”, США). Для оценки достоверности различий в устойчивости молоди исследуемых видов на воздействие хищника использован непараметрический критерий χ2. Для определения достоверности различий между средними дистанциями в группах рыб использован непараметрический критерий Манна−Уитни (U) как наиболее чувствительный и мощный метод для подобных сравнений (Ивантер, Коросов, 2011).
РЕЗУЛЬТАТЫ
Выполненные эксперименты подтвердили высокую уязвимость молоди ротана к воздействию хищников. В первом эксперименте в отсутствие укрытий окуни значительно легче избегали контакта с хищником (рис. 1а). В связи с этим именно ротан составлял основу питания щук (78 ± 9% общего числа жертв) в большинстве опытов (χ2 = 543.4, df = 7, p < 0.05). Добавление в аквариум укрытий привело к некоторому снижению доли ротана (64 ± 12%) в рационе хищников (рис. 1б). Однако и в этом случае его преобладающая роль в питании щук сохранялась (χ2 = = 835.6, df = 7, p < 0.05).
Рис. 1.
Встречаемость молоди окуня Perca fluviatilis (◻) и ротана Perccottus glenii (◼) в рационе щук Esox lucius при отсутствии (а, в) и наличии (б, г) укрытий: а, б – 1-й эксперимент; в, г – 2-й эксперимент; (◻) – среднее значение, (◻) – его ошибка, (⊤) – 95%-ный доверительный интервал.
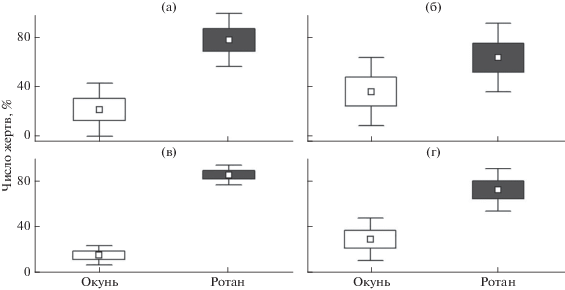
В большинстве опытов второго эксперимента щуки ещё более эффективно выедали молодь ротана в сравнении с окунем (рис. 1в, 1г). Статистический анализ подтвердил значимо бóльшую уязвимость ротана к воздействию хищника как при отсутствии (χ2 = 466.3, df = 7, p < 0.05), так и в присутствии укрытий (χ2 = 1133.9, df = 7, p < 0.05). Как и в первом эксперименте, добавление укрытий в аквариум приводило к снижению доли особей ротана в рационе щук с 85 ± 3 до 72 ± 8% общего числа жертв.
При отслеживании защитных поведенческих реакций выявлены значительные различия в оборонительном поведении окуня и ротана. При помещении в экспериментальный аквариум и по истечении некоторого адаптационного периода молодь распределялась в нём случайным образом (рис. 2): расстояние между особями в скоплениях ротана и окуня достоверно не различалось (До = = 3.1 и Др = 3.0, U = 1066, p > 0.05). В ответ на появление хищника молодь окуня реагировала резким увеличением агрегированности (До = 1.7, U = 422, p < 0.05), в то время как средняя дистанция в группах ротана почти не изменялась (Др = 2.9, U = = 999, p > 0.05). Окуни, как правило, формировали одну относительно плотную группу, дистанцированную от хищника (рис. 3а), а молодь ротана рассредоточивалась по периметру аквариума, образуя в его углах скопления из нескольких особей (рис. 3б). Спустя 15 мин после посадки хищника средняя дистанция между особями окуней ощутимо возрастала, но не достигала первоначальной (До = 2.5, U = 772, p < 0.05); в противоположность этому расстояние между особями ротана незначительно снижалось (Др = 2.7, U = 1117, p > 0.05). По прошествии 1 ч окуни двигались по аквариуму плотной группой (До = 1.6, U = 743, p < 0.05), держась от хищника на определённом расстоянии; тогда как молодь ротана чаще всего располагалась неподвижно в одном или нескольких углах аквариума, образуя плотные скопления (Др = 0.9, U = = 670, p < 0.05). При этом значительная часть рыб непосредственно соприкасалась друг с другом (Д < 1 у более чем 66% особей). Также для поведения молоди ротана было характерно отсутствие попыток избежать контакта с приближающимся хищником. Достоверные различия средних дистанций между особями в группах окуня и ротана наблюдали лишь через 1 ч после помещения щуки в экспериментальную среду (До = 1.6 и Др = 0.9, U = 553, p < 0.05).
Рис. 2.
Дистанция между особями (Д, nTL) в группе молоди окуня Perca fluviatilis и ротана Perccottus glenii на разных этапах эксперимента: I – до посадки щуки Esox lucius, II – на момент посадки; III, IV – спустя 15 и 60 мин после посадки хищника; обозначения см. на рис. 1.
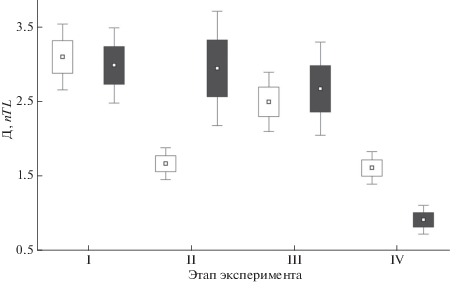
Рис. 3.
Схема распределения молоди окуня Perca fluviatilis (a) и ротана Perccottus glenii (б) в аквариуме на I−IV этапах эксперимента при отсутствии и в присутствии щуки Esox lucius; обозначения этапов см. на рис. 2.

ОБСУЖДЕНИЕ
При оценке относительной устойчивости молоди ротана к воздействию рыб-ихтиофагов в качестве контрольного вида мы использовали молодь окуня сходного размера и возраста. Этот вид один из самых распространённых в большинстве водоёмов европейской части России и служит обычным объектом питания хищных рыб (Рыбы Рыбинского водохранилища …, 2015). Модельным хищником во всех экспериментах служили некрупные щуки, так как этот вид характерен для широкого спектра водоёмов – от омутов на малых реках до озёр и водохранилищ. Кроме того, щука часто встречается в заросших водной растительностью заливах и мелководьях, в которых может обитать ротан.
Эксперименты, выполненные в аквариумах разной конфигурации и объёма, продемонстрировали низкую устойчивость молоди ротана к воздействию хищника, особенно в среде, лишённой укрытий (рис. 1). В то же время в нескольких опытах как первого, так и второго эксперимента окуни выедались щуками быстрее. Исходя из имеющихся данных, сложно указать точную причину таких событий. Можно только предположить, что щуки, посаженные в аквариум, имели некоторые индивидуальные предпочтения в выборе жертв. Следует учесть и тот факт, что все они были отловлены в прибрежье Рыбинского водохранилища и молодь окуня была для них привычным объектом питания, тогда как ротан до начала экспериментов был им абсолютно неизвестен, что могло определённым образом повлиять на результаты опытов. Тем не менее щуки достоверно чаще потребляли молодь ротана, доказывая предположение о том, что в выборе объекта питания хищники-ихтиофаги руководствуются, прежде всего, его доступностью (высокая численность, заметность, особенности защитного поведения и т.д.), а не привычностью жертвы.
В качестве одной из возможных причин, объясняющих более низкую уязвимость молоди окуня для хищников, можно было бы указать её развитую двигательную активность. Чтобы нивелировать это преимущество, было решено провести серию опытов в узком неглубоком аквариуме небольшого объёма (второй эксперимент). Однако это фактически не повлияло на полученные результаты (рис. 1): как и в первом эксперименте, в подавляющем большинстве случаев ротаны достоверно чаще становились жертвами щук. Можно заключить, что различная двигательная активность исследованных видов не является ключевым фактором, определяющим низкую устойчивость молоди ротана к воздействию хищников.
Укрытия играют важную роль в защите молоди многих видов рыб от хищников (Christensen, Persson, 1993; Bevelhimer, 1996). Заросли макрофитов, расположенные на прогреваемых участках литорали, часто используются рыбами в качестве естественных укрытий. Имеются данные, что наличие подобного рода укрытий может даже приводить к смене видового состава жертв одного и того же хищника (Schramm, Zale, 1985). Работ, посвящённых эффективности использования укрытий молодью ротана, мы не обнаружили, однако полевые наблюдения подтверждают тяготение данного вида к густой растительности прибрежья.
Как и ожидалось, добавление в экспериментальную среду укрытий привело к росту устойчивости ротана к воздействию хищника (рис. 1б). При этом в аквариумах разной конфигурации были получены весьма схожие результаты (снижение доли ротана в рационе хищников на 13−14%). Однако в целом тенденция к быстрому выеданию молоди этого вида сохранялась. Возможно, что использованные в экспериментах в качестве укрытий отрезки керамических трубок не удовлетворяли молодь ротана по каким-либо характеристикам. Вполне вероятно, что при наличии других укрытий, имитирующих, например, густую растительность, потребление ротана щуками значительно изменилось бы. Между тем по визуальной оценке занятость укрытий особями ротана и окуня была довольно высокой. Однако при этом наблюдались определённые видовые отличия в их использовании. Окуни обычно отмечались внутри керамических трубок либо держались около них плотной группой, а ротаны чаще неподвижно располагались снаружи, занимая пространство между дном аквариума и нависающей стенкой укрытия. Возможно, именно эти особенности поведения повлияли на различную доступность особей исследованных видов для щук.
Внутривидовые взаимоотношения и, в частности, стайное поведение играют значительную роль в жизни многих видов рыб, обеспечивая им успешное существование как в пределах нативного, так и вновь приобретённого ареала (Pavlov et al., 2006). Чаще всего молодь рыб реагирует на появление в среде хищника увеличением агрегации в скоплении особей (Turner, Pitcher, 1986; Sumpter, 2010). Такое групповое поведение обладает целым рядом преимуществ: увеличение зоркости в стае, эффект растворения и замешательство атакующего хищника. При сравнении защитного поведения окуня и ротана выявлены значительные различия (рис. 2, 3). Появление хищника в лишённой укрытий среде приводило к быстрому сокращению дистанций между особями в группе окуней. Ротаны реагировали иначе, сильно рассредоточиваясь по периметру аквариума. Так как сразу после посадки щуки были малоактивны и чаще всего не двигались, то агрегированность групп окуней в течение 15 мин значительно снижалась. Спустя 1 ч активность хищника возрастала, что вновь вызывало образование достаточно плотных и компактных групп окуней с относительно выровненными дистанциями между особями (нормальное распределение с преобладающим модальным классом Д 1.0−1.5 TL). При этом рыбы часто перемещались по площади аквариума, выдерживая определённую дистанцию до хищника. В отличие от этого ротаны после высадки щук двигались очень мало и предпочитали располагаться на стыке дна и боковых стенок аквариума, концентрируясь в разрозненных локальных группах. Через 1 ч они размещались в одном или двух углах ёмкости, образуя очень плотные скопления с отдельными удалёнными от них особями (асимметричное распределение с преобладающим модальным классом 0−1 TL), и фактически не реагировали на приближение хищника. Подобная пассивная реакция затаивания, вероятно, является характерной для ротана чертой защитного поведения, что разительно отличает его от окуня, активно избегающего опасность. Эти особенности оборонительного поведения у исследуемых видов хорошо заметны на схематичных изображениях распределения рыб, сделанных на основе фотографий опытов (рис. 3).
Отмеченные в эксперименте факты позволяют сделать вывод о том, что молодь ротана и окуня при взаимодействии с хищником использует различные поведенческие стратегии. Окуни активно избегают контакта с щукой, делая основной упор на реакции групповой защиты и хорошо развитую двигательную активность, а ротаны затаиваются около различных объектов (керамические укрытия, стенки аквариума, особи собственного вида), больше полагаясь на свою неподвижность и маскирующую окраску. Подобная тактика приносила успех лишь в единичных опытах. В ходе экспериментов у ротана не были отмечены сколь-нибудь выраженные групповые оборонительные реакции. Возможно, именно этими фактами объясняется высокая доступность для хищников молоди ротана-головешки в сравнении с окунем, особенно в обеднённой экспериментальной среде.
Имеются немногочисленные данные о находках ротана в мелководных, сильно заросших водной растительностью заливах водохранилищ Волги, что свидетельствует о возможности существования его популяций и в водоёмах, находящихся под прессом ихтиофагов (Вечканов и др., 2007; Семенов, 2009; Kas’yanov, Goroshkova, 2012; наши данные). Вероятно, успешное обитание ротана на этих участках определяется другими факторами. Можно предположить, что сильно заросшие мелководные биотопы, в которых отмечается ротан, избегаются хищниками вследствие их физической недоступности, а также в связи с неблагоприятными термическим и кислородным режимами. Вместе с тем последние два фактора не могут служить препятствием для существования ротана: его температурная устойчивость гораздо выше таковой для многих хищных видов рыб (Golovanov et al., 2013), то же самое касается и его толерантности к низкому содержанию в воде кислорода (Рыбы в заповедниках …, 2010).
Выполненные эксперименты подтверждают низкую устойчивость молоди вселенца ротана-головешки в сравнении с аборигенным окунем к воздействию крупных ихтиофагов. Полученные данные служат доказательством того, что хищники могут выступать одним из главных экологических факторов, ограничивающих распространение ротана в естественной среде. Хотелось бы отметить тот факт, что молодь ротана, использованная нами в работе, была отловлена в водоёме без хищников. Исключение могли составлять лишь крупные особи самого ротана, среди которых возможен каннибализм (Спановская и др., 1964). В отличие от этого молодь окуня была отловлена в прибрежье Рыбинского водохранилища, где она находилась под постоянным прессом хищников, в том числе и щук, непосредственно с момента вылупления. Вследствие этого степень научения молоди исследованных видов избегать контакта с данным видом хищника изначально разнилась, что могло определённым образом повлиять на результаты исследования. В то же время анализ расселения ротана в естественной среде показывает, что в подавляющем большинстве случаев как в нативном, так и в приобретённом ареале данный вид с успехом заселяет лишь те водоёмы, в которых хищник отсутствует, либо его численность крайне низка. Кроме того, существуют данные литературы, которые показывают, что вселение окуня в водоёмы, изобилующие ротаном, может привести к полному исчезновению последнего (Рыбы в заповедниках …, 2010). Всё это вполне согласуется с низкой устойчивостью ротана-головешки к воздействию хищников, отмеченной нами в условиях эксперимента.
ВЫВОДЫ
1. Определённая в экспериментальных условиях устойчивость молоди ротана к воздействию хищников-засадчиков (щука) значительно ниже таковой окуня вне зависимости от наличия укрытий.
2. Исследованные виды рыб используют разные поведенческие стратегии для избегания контакта с хищниками. Молодь окуня демонстрирует чёткую реакцию групповой защиты, в то время как молодь ротана предпочитает затаиваться около различных объектов, делая основную ставку на неподвижность и маскирующую окраску.
3. Полученные экспериментальные данные подтверждают вывод полевых наблюдений о том, что хищники служат одним из основных экологических факторов, ограничивающих распространение ротана в естественной среде.
Список литературы
Вечканов В.С., Ручин А.Б., Семенов Д.Ю., Михеев В.А. 2007. К экологии и распространению ротана Perccottus glenii Dyb. (Odontobutidae, Pisces) в водоемах правобережья Средней Волги // Вестн. Мордов. ун-та. № 4. С. 36–49.
Ивантер Э.В., Коросов А.В. 2011. Введение в количественную биологию. Петрозаводск: Изд-во ПетрГУ, 302 с.
Карабанов Д.П., Кодухова Ю.В. 2015. Традиционные и перспективные методы борьбы с чужеродными видами рыб // Вестн. АГТУ. Сер. Рыб. хоз-во. № 1. С. 124–133.
Литвинов А.Г. 1993. Экология ротана-головешки (Perccottus glenii Dyb.) в бассейне оз. Байкал и его влияние на промысловых рыб: Автореф. дис. … канд. биол. наук. СПб.: ГосНИОРХ, 25 с.
Никольский Г.В. 1956. Рыбы бассейна Амура. Итоги Амурской ихтиологической экспедиции 1945–1949 гг. М.: Изд-во АН СССР, 551 с.
Рыбы в заповедниках России. 2010. Т. 1. Пресноводные рыбы / Под ред. Решетникова Ю.С. М.: Т-во науч. изд. КМК, 628 с.
Рыбы Рыбинского водохранилища: популяционная динамика и экология. 2015 / Под ред. Герасимова Ю.В. Ярославль: Филигрань, 418 с.
Семенов Д.Ю. 2009. Роль чужеродных видов в питании хищных рыб Куйбышевского водохранилища // Поволж. экол. журн. № 2. С. 148–157.
Спановская В.Д., Савваитова К.А., Потапова Т.Л. 1964. Об изменчивости ротана (Percottus glehni Dyb., fam. Eleotridae) при акклиматизации // Вопр. ихтиологии. Т. 4. Вып. 4. С. 632–643.
Bevelhimer M.S. 1996. Relative importance of temperature, food, and physical structure to habitat choice by smallmouth bass in the field and laboratory // Trans. Amer. Fish. Soc. V. 125. № 2. P. 274–283.
Christensen B., Persson L. 1993. Species-specific antipredatory behaviours: effects on prey choice in different habitats // Behav. Ecol. Sociobiol. V. 32. № 1. P. 1–9.
Golovanov V.K., Kapshai D.S., Gerasimov Y.V. et al. 2013. Thermopreference and thermostability of the Amur sleeper juveniles Perccottus glenii in autumn // J. Ichthyol. V. 53. № 3. P. 240–244.
Kas’yanov A.N., Goroshkova T.V. 2012. Morphological features of the Amur sleeper (Perccottus glenii, Perciformes, Eleotridae) introduced into water bodies of European Russia // Contemp. Probl. Ecol. V. 5. № 1. P. 58–70.
Litvinov A.G., O’Gorman R. 1996. Biology of Amur sleeper (Perccottus glehni) in the delta of the Selenga River, Burya-tia, Russia // J. Great Lakes Res. V. 22. № 2. P. 370–378.
Makhrov A.A., Karabanov D.P., Koduhova Yu.V. 2014. Genetic methods for the control of alien species // Russ. J. Biol. Invasions. V. 5. № 3. P. 194–202.
Pavlov D.S., Mikheev V.N., Dgebuadze Yu.Yu. 2006. Beha-vioral aspects of biological invasions of alien fish species // J. Ichthyol. V. 46. Suppl. 2. P. S117–S124.
Reshetnikov A.N., Ficetola G.F. 2014. Potential range of the invasive fish rotan (Perccottus glenii) in the Holarctic // Biol. Invasions. V. 13. № 12. P. 2967–2980.
Schramm H.L., Zale A.V. 1985. Effects of cover and prey size on preferences of juvenile largemouth bass for blue tilapias and bluegills in tanks // Trans. Amer. Fish. Soc. V. 114. № 5. P. 725–731.
Sumpter D.J.T. 2010. Collective animal behavior. Princeton, UK: Princ. Univ. Press, 312 p.
Turner G.F., Pitcher T.J. 1986. Attack abatement: a model for group protection by combined avoidance and dilution // Amer. Naturalist. V. 128. № 2. P. 228–240.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


