Вопросы ихтиологии, 2019, T. 59, № 3, стр. 318-328
Вкусовая привлекательность водных организмов для нильской тиляпии Oreochromis niloticus (Cichlidae)
М. И. Виноградская 1, А. О. Касумян 1, 2, *
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
* E-mail: alex_kasumyan@mail.ru
Поступила в редакцию 30.07.2018
После доработки 08.10.2018
Принята к публикации 09.10.2018
Аннотация
Оценена вкусовая привлекательность для нильской тиляпии Oreochromis niloticus шести видов водных животных и пяти видов растений. Водные экстракты большинства организмов (10 видов из 11) обладают привлекательным вкусом, что соответствует эврифагии и пищевой пластичности нильской тиляпии. Несмотря на фитофагию, вкусовая привлекательность экстракта животных выше, чем растений. Невысокий стимулирующий эффект экстракта малой ряски Lemna minor предполагает присутствие в ней природных вкусовых детеррентов. Экстракт канадской элодеи Elodea canadensis в зависимости от происхождения растения либо полностью блокирует потребление, либо имеет инертные вкусовые свойства. Разные части водяного гиацинта Eichhornia crassipes (листья, корни) имеют сходную вкусовую привлекательность. Для пищевого поведения нильской тиляпии, проявляемого при оросенсорном тестировании пищи, повторные схватывания мало характерны. Результаты исследования свидетельствуют о способности рыб тонко дифференцировать пищевые организмы по их вкусовым качествам и подчёркивают важную роль вкусовой рецепции в выборе рыбами объектов питания.
В последние десятилетия благодаря разработанным методам поведенческого тестирования начаты и быстро развиваются исследования вкусовых предпочтений у рыб. Для этих целей в качестве вкусовых стимулов обычно используют свободные аминокислоты и другие химические соединения (Hidaka, 1982; Mackie, 1982; Jones, 1989, 1990; Lim et al., 2017). Это позволило оценить широту вкусовых спектров и выяснить уровень вкусовой чувствительности рыб, сравнить функциональные характеристики вкусовой системы у разных по биологии и систематике видов и у особей, находящихся под влиянием различных внешних факторов (Kasumyan, Døving, 2003; Абтахи и др., 2018; Kasumyan, 2019).
Несмотря на очевидный прогресс в изучении вкусовой рецепции и отношения рыб к различным вкусовым стимулам, слабо исследованной остаётся их способность оценивать вкусовые качества водных организмов, с которыми они встречаются в природных водоёмах и которые могут быть объектами питания. Большинство выполненных с этой целью работ основаны на сравнении соотношения доступных организмов в водоёме и в пищеварительном тракте рыб (Шорыгин, 1952; Stoecker, Govoni, 1984; Pryor, Epifanio, 1993; Sudo, Azeta, 2001; Shaw et al., 2003; Alford, Beckett, 2007; Verliin et al., 2011) или на сравнении потребления рыбами в эксперименте нескольких одновременно или последовательно предъявляемых пищевых организмов или их фрагментов (Строганов, 1962, 1963, 1968; Beukema, 1968; Ивлев, 1977; Antoine et al., 1986; Bonar et al., 1990; Chifamba, 1990; Barry, Ehret, 1993; Soriguer et al., 2002; Parker et al., 2006). При этом возможное влияние запаховых, текстурных или иных особенностей сравниваемых объектов на проявляемую рыбами пищевую избирательность, как правило, не учитывается, несмотря на то что эти свойства могут влиять на выбор рыб (Prado, Heck, 2011; Касумян, 2012). Сведения, полученные с использованием методов, позволяющих исключать эти эффекты и определять именно вкусовую привлекательность пищевых организмов, всё ещё малочисленны. Большинство таких работ выполнены в области водной химической экологии и касаются химической защищённости от рыб преимущественно морских животных и растений (O’Neal, Pawlik, 2002; Long, Hay, 2006; Nusnbaum et al., 2012; Тинькова и др., 2014; Marty et al., 2016). Вкусовые свойства пищевых организмов для пресноводных рыб изучены крайне слабо (Parker et al., 2006; Касумян, Тинькова, 2013; Lari et al., 2013).
Цель настоящей работы заключалась в сравнительной оценке вкусовых качеств разных водных растений и беспозвоночных животных для нильской тиляпии Oreochromis niloticus – всеядной пресноводной рыбы с хорошо выраженной фитофагией.
МАТЕРИАЛ И МЕТОДИКА
Опыты выполнены на двух группах молоди нильской тиляпии (24 экз., средняя общая длина (TL) 8.0 см, масса 9 г), полученной в ООО “Крафтфиш” (популяционное происхождение неизвестно) в 2015 г. (серии 1 и 2) и 2016 г. (серия 3). До начала опытов рыб в течение двух недель содержали в аквариуме объёмом 70 л при температуре воды 26°С. Кормление проводили живыми личинками хирономид (Chironomidae).
За несколько дней до опытов рыб рассаживали поодиночке в аквариумы (10 л) с непрозрачными задней и боковыми стенками, предотвращавшими визуальные контакты соседних особей. Грунт в аквариумах отсутствовал, искусственное освещение не использовали. Температуру воды поддерживали около 26°С с помощью терморегуляторов AquaEL EH-25W. Кормили рыб живыми личинками хирономид один раз в день после завершения опытов. До начала опытов рыб обучали схватывать подаваемых поштучно живых личинок хирономид, а затем гранулы, вырезанные из 2%-ного агар-агарового геля (“Reanal”, Венгрия) и содержащие водный экстракт личинок и 5 мкМ красителя Ponceau 4R (“Chroma-Gesellschaft Schmidt Gmbh”, Германия).
В каждом опыте в аквариум вносили одну агар-агаровую гранулу, содержащую кроме красителя водный экстракт живых или свежезамороженных водных растений или животных (175 г/л). Их полный перечень с указанием происхождения и систематики приведён в табл. 1.
Таблица 1.
Животные и растения, использованные для исследования вкусовой привлекательности нильской тиляпии Oreochromis niloticus
| Организм | Систематика | Естественный ареал и условия обитания | Происхождение объектов | Материал, использованный для экстракции |
|---|---|---|---|---|
| Хирономиды | Chironomidae, Diptera, Insecta | Всесветное (кроме Антарктиды), пресные воды | Зоомагазин, Москва | Живые личинки |
| Коретра Chaoborus sp. |
Culicidae, Diptera, Insecta | То же | То же | Свежезамороженные личинки |
| Дафния Daphnia magna |
Daphniidae, Cladocera, Branchiopoda, Crustacea | Голарктика, Африка, пресные воды | » | Свежезамороженные взрослые особи |
| Артемия Artemia salina |
Artemidae, Anostraca, Branchiopoda, Crustacea | Всесветное (кроме Антарктиды), солёные водоёмы | » | Свежезамороженные науплии |
| Каланида Hemidiaptomus sp. |
Calanidae, Copepoda, Maxillopoda, Crustacea | Всесветное, пресные воды | » | Свежезамороженные взрослые особи |
| Креветка северная Pandalus borealis | Pandalidae, Decapoda, Malacostraca, Crustacea | Атлантический и Тихий океаны, арктическая и бореальная зоны | Супермаркет, Москва | Брюшко (без экзоскелета) свежезамороженных взрослых особей |
| Салат-латук Lactuca sativa |
Asteraceae, Asterales, Magnoliopsida | Европа, Средняя и Передняя Азия, Сибирь (до Алтая), Северная Африка | То же | Листья свежего растения |
| Ряска малая Lemna minor |
Lemnaceae, Arales, Liliopsida | Европа, Азия, Африка, Северная Америка, пресные воды | р. Москва, Звенигородский район, Московская область | Свежее растение целиком |
| Элодея канадская Elodea canadensis |
Hydrocharitаceae, Hydrocharitales, Liliopsida | Северная Америка, пресные воды | Шараповский карьер, Звенигородский район, Московская область; | Верхняя часть побега и листья свежего растения |
| зоомагазин, Москва | Листья свежего растения | |||
| Риччия Riccia sp. |
Ricciaceae, Marchantiales, Marchantiopsida | Европа, Азия, Африка, Северная Америка, пресные воды | Зоомагазин, Москва | Свежее растение целиком |
| Водяной гиацинт Eichhornia crassipes | Pontederiaceae, Pontederiales, Liliopsida | тропическая Америка, пресные воды | Питомник растений, Калужская область | Свежее растение: корни, листья |
Растения и животных гомогенизировали в фарфоровой ступке в 4 мл дистиллированной воды. Гомогенат центрифугировали при 6000 об/мин (4000 g) в течение 15 мин при температуре 20°С в центрифуге ЦУМ-1, супернатант вместе с раствором красителя Ponceau 4R вносили в горячий 2%-ный раствор агар-агара, перемешивали и выливали в чашку Петри. В качестве контроля применяли гранулы, содержащие только краситель. Агар-агаровый гель с экстрактами хранили при 5°С не более 3 сут. Гранулы (длина 4 мм, диаметр 2 мм, объём 12.56 мм3) вырезали с помощью трубки из нержавеющей стали непосредственно перед внесением их в аквариум.
В ходе опыта регистрировали длительность интервала между падением гранулы в воду и схватыванием её рыбой (латентный период реакции на гранулу), число повторяющихся схватываний гранулы, продолжительность удержания гранулы после первого схватывания и в течение всего опыта, заглатывание или отказ рыбы от потребления гранулы. Каждый опыт продолжался ~1–2 мин и заканчивался заглатыванием гранулы либо окончательным отказом от потребления, о котором судили по прекращению повторных схватываний гранулы, потере у рыбы интереса к ней и уходу в сторону. Немногочисленные опыты, в которых рыбы гранулу не схватывали в течение 1 мин или потребление гранулы невозможно было определить из-за её разрушения рыбой и образования большого числа фрагментов, не учитывали. Несъеденную гранулу или её фрагменты из аквариума удаляли сразу после окончания опыта. Опыты с гранулами, содержащими разные экстракты, проводили в случайной последовательности с интервалом 10–15 мин. Общее число выполненных опытов – 1187. Для относительной оценки вкусовых свойств экстрактов рассчитывали индекс вкусовой привлекательности по формуле: Indpal = = [(R – C)/(R + C)] × 100, где R – потребление гранул с экстрактом; С – потребление контрольных гранул, %.
Для статистического анализа результатов использовали критерий χ2, U-критерий Манна−Уитни и ранговый коэффициент корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
До подачи гранулы рыбы обычно спокойно перемещаются по всему аквариуму, иногда поднимаются к поверхности воды или на несколько секунд замирают на месте. Приближение экспериментатора привлекает рыб к передней стенке аквариума, где они остаются в ожидании корма. Внесённую гранулу рыбы схватывают быстрым и резким броском, затрачивая на это в среднем не более 3 с. Во время удержания схваченной гранулы рыбы не перемещаются и остаются у передней стенки аквариума. Проглатывание гранулы предваряют хорошо заметные характерные жующие движения челюстями и учащённый ритм жаберных крышек. После проглатывания гранулы ритм сразу же нормализуется и рыбы восстанавливают исходное спокойное плавание по аквариуму. Поведение восстанавливается также и при отказе от потребления после одного или нескольких повторных схватываний гранулы. В этом случае рыбы прекращают реагировать на гранулу и возвращаются к прежнему плаванию. Отвергнутая гранула обычно остаётся неразрушенной.
Гранулы с водным экстрактом животных были высоко привлекательными для тиляпии (табл. 2): рыбы потребляли их либо в 100% (хирономиды, креветка), либо в 93–96% (дафния, артемия, коретра, каланиды) опытов (серия 1). В большинстве случаев рыбы потребляли гранулы сразу после первого схватывания, средняя длительность удержания гранулы в ротовой полости не превышала 5 с. Экстракт большинства растений также повышал потребление гранул (серия 2). Наиболее привлекательными были гранулы с экстрактом риччии и листьев водяного гиацинта, менее охотно тиляпия потребляла гранулы с экстрактом корней гиацинта, салата-латука и ряски. Гранулы с экстрактом элодеи, приобретённой в зоомагазине, рыбы после схватывания отвергли во всех опытах. Экстракт элодеи, взятой из естественного водоёма, влияния на потребление гранул не оказывал (серия 3). Во всех трёх выполненных сериях потребление контрольных гранул было сходным (45–50%).
Таблица 2.
Вкусовые ответы (среднее значение показателя и его ошибка) нильской тиляпии Oreochromis niloticus на агар-агаровые гранулы, содержащие водные экстракты (175 г/л) животных и растений
| Раздражитель | Латентный период реакции на гранулу, с | Потребление гранул, % | Число схватываний гранулы | Продолжительность удержания гранулы, с | Число опытов | |
|---|---|---|---|---|---|---|
| после первого схватывания | в течение всего опыта | |||||
| Серия 1 | ||||||
| Хирономиды | 2.1 ± 0.3 | 100.0 ± 0.0*** | 1.0 ± 0.0*** | 3.6 ± 0.2*** | 3.7 ± 0.2*** | 102 |
| Креветка северная | 2.1 ± 0.3 | 100.0 ± 0.0*** | 1.0 ± 0.0*** | 3.2 ± 0.2*** | 3.2 ± 0.2*** | 81 |
| Дафния | 2.8 ± 0.5 | 96.1 ± 2.2*** | 1.1 ± 0.0*** | 4.6 ± 0.3 | 4.8 ± 0.4*** | 77 |
| Артемия | 2.9 ± 0.5 | 95.8 ± 2.4*** | 1.1 ± 0.0*** | 4.1 ± 0.3* | 4.3 ± 0.3*** | 71 |
| Коретра | 2.3 ± 0.4 | 94.7 ± 2.6*** | 1.1 ± 0.0*** | 4.6 ± 0.3 | 4.9 ± 0.3*** | 75 |
| Каланида | 1.4 ± 0.2* | 92.8 ± 3.1*** | 1.1 ± 0.0*** | 3.9 ± 0.2* | 4.1 ± 0.3*** | 69 |
| Контроль | 2.1 ± 0.3 | 45.2 ± 5.5 | 1.5 ± 0.1 | 6.0 ± 0.5 | 7.3 ± 0.5 | 84 |
| Серия 2 | ||||||
| Риччия | 1.3 ± 0.2** | 95.4 ± 2.6*** | 1.0 ± 0.0*** | 5.7 ± 0.5 | 5.8 ± 0.5 | 65 |
| Водяной гиацинт: | ||||||
| – листья | 1.7 ± 0.2 | 93.9 ± 3.0*** | 1.0 ± 0.0*** | 4.7 ± 0.3 | 4.8 ± 0.3*** | 65 |
| – корни | 1.3 ± 0.2* | 86.9 ± 4.4*** | 1.2 ± 0.1** | 5.0 ± 0.5 | 5.4 ± 0.5** | 61 |
| Салат-латук | 1.8 ± 0.2 | 80.8 ± 3.9 *** | 1.1 ± 0.0 *** | 5.8 ± 0.4 | 6.3 ± 0.4 | 104 |
| Ряска малая | 1.8 ± 0.3 | 76.6 ± 4.9*** | 1.3 ± 0.1** | 5.7 ± 0.3 | 6.2 ± 0.4 | 77 |
| Элодея канадская (зоомагазин) | 1.5 ± 0.2 | 0.0 ± 0.0*** | 3.9 ± 0.3*** | 2.5 ± 0.2*** | 5.4 ± 0.4* | 72 |
| Контроль | 1.8 ± 0.2 | 50.0 ± 5.9 | 1.7 ± 0.1 | 5.9 ± 0.5 | 7.1 ± 0.5 | 74 |
| Серия 3 | ||||||
| Элодея канадская (карьер) | 2.0 ± 0.3 | 44.0 ± 5.0 | 1.6 ± 0.1 | 6.0 ± 0.5* | 7.8 ± 0.5* | 100 |
| Контроль | 2.1 ± 0.3 | 50.0 ± 4.7 | 1.6 ± 0.1 | 8.1 ± 0.5 | 9.6 ± 0.5 | 114 |
Рыбы редко схватывали гранулы повторно, особенно с экстрактом наиболее привлекательных животных и растений (потребление >90%) и удерживали во рту более короткое время, чем контрольные гранулы. Наибольшее число раз рыбы схватывали гранулы с экстрактом элодеи из зоомагазина, но длительность их удержания была минимальной (табл. 2). Статистические расчёты выявили значимую отрицательную связь между потреблением гранул и числом их схватываний в опыте (rs = –0.88, p < 0.001), удержанием после первого схватывания (rs = –0.55, p < 0.05) и суммарно в течение всего опыта (rs = –0.80, p < 0.001). Чем больше раз гранула схватывалась, тем более длительным было суммарное время удержания (rs = 0.71, p < 0.01). Высоко значимой была связь между длительностью первого и суммарного удержания гранулы (rs = 0.90, p < 0.001).
Для гранул, которые были потреблены рыбами или окончательно отвергнуты не менее, чем в шести опытах, было проведено сравнение ответов, закончившихся потреблением или отверганием гранулы (ПГ- и ОГ-опыты). Потреблению предшествует значимо более быстрая реакция схватывания (три типа гранул из семи), схваченная гранула подвергается меньшему числу отверганий и повторных схватываний (все типы гранул), а также в среднем меньше по времени удерживается рыбой (четыре типа гранул) (табл. 3).
Таблица 3.
Параметры вкусового ответа (среднее значение показателя и его ошибка) нильской тиляпии Oreochromis niloticus в опытах, закончившихся потреблением и отверганием гранул, с водными экстрактами растений (175 г/л) и контрольных гранул
| Раздражитель | Латентный период реакции на гранулу, с | Число схватываний гранулы | Продолжительность удержания гранулы, с | Число опытов | |
|---|---|---|---|---|---|
| после первого схватывания | в течение всего опыта | ||||
| Водяной гиацинт, корни | $\frac{{1.2 \pm 0.1}}{{2.4 \pm 0.9}}$ | $\frac{{1.1 \pm 0.1{\text{***}}}}{{2.0 \pm 0.2}}$ | $\frac{{5.2 \pm 0.6}}{{3.4 \pm 0.7}}$ | $\frac{{5.5 \pm 0.6}}{{4.6 \pm 0.6}}$ | $\frac{{53}}{8}$ |
| Салат-латук | $\frac{{1.6 \pm 0.2}}{{2.7 \pm 0.8}}$ | $\frac{{1.0 \pm 0.0{\text{**}}}}{{1.5 \pm 0.1}}$ | $\frac{{5.9 \pm 0.4}}{{5.5 \pm 1.0}}$ | $\frac{{6.1 \pm 0.4}}{{7.2 \pm 1.3}}$ | $\frac{{84}}{{20}}$ |
| Ряска малая | $\frac{{1.6 \pm 0.2{\text{*}}}}{{2.5 \pm 0.7}}$ | $\frac{{1.1 \pm 0.0{\text{***}}}}{{2.2 \pm 0.3}}$ | $\frac{{5.9 \pm 0.4}}{{5.0 \pm 0.6}}$ | $\frac{{6.0 \pm 0.4}}{{6.7 \pm 0.8}}$ | $\frac{{59}}{{18}}$ |
| Элодея канадская (карьер) | $\frac{{1.4 \pm 0.3{\text{**}}}}{{2.5 \pm 0.4}}$ | $\frac{{1.4 \pm 0.1{\text{*}}}}{{1.8 \pm 0.1}}$ | $\frac{{8.4 \pm 0.7{\text{***}}}}{{4.9 \pm 0.5}}$ | $\frac{{9.8 \pm 0.8{\text{***}}}}{{6.2 \pm 0.6}}$ | $\frac{{44}}{{56}}$ |
| Контроль, серия 1 | $\frac{{1.9 \pm 0.5}}{{2.3 \pm 0.4}}$ | $\frac{{1.2 \pm 0.1{\text{**}}}}{{1.8 \pm 0.1}}$ | $\frac{{8.9 \pm 0.8{\text{***}}}}{{3.5 \pm 0.3}}$ | $\frac{{10.2 \pm 0.8{\text{***}}\quad}}{{4.9 \pm 0.4}}$ | $\frac{{38}}{{46}}$ |
| Контроль, серия 2 | $\frac{{1.5 \pm 0.3{\text{*}}}}{{2.1 \pm 0.3}}$ | $\frac{{1.3 \pm 0.1{\text{***}}}}{{2.1 \pm 0.2}}$ | $\frac{{7.9 \pm 0.9{\text{***}}}}{{3.8 \pm 0.4}}$ | $\frac{{9.0 \pm 0.9{\text{***}}}}{{5.1 \pm 0.4}}$ | $\frac{{37}}{{37}}$ |
| Контроль, серия 3 | $\frac{{1.7 \pm 0.2}}{{2.5 \pm 0.5}}$ | $\frac{{1.4 \pm 0.1{\text{*}}}}{{1.8 \pm 0.1}}$ | $\frac{{11.1 \pm 0.8{\text{***}}\quad}}{{5.1 \pm 0.5}}$ | $\frac{{12.8 \pm 0.7{\text{***}}\quad}}{{6.3 \pm 0.6}}$ | $\frac{{57}}{{57}}$ |
ОБСУЖДЕНИЕ
Полученные результаты показывают, что большинство использованных для тестирования животных и растений (10 из 11) имеют привлекательный вкус для нильской тиляпии. Включение в состав агар-агарового геля водного экстракта этих организмов приводит к значимому повышению потребления гранул, предлагавшихся опытным рыбам. Столь большая доля объектов, обладающих вкусовой привлекательностью, может быть связана с эврифагией, присущей многим видам тиляпий (Philippart, Ruwet, 1982). К сожалению, питание нильской тиляпии в природных водоёмах, как и питание большинства других тиляпий, входящих в род Oreochromis и близких к нему Sarotherodon и Danakilia, изучено крайне слабо. Сообщается, что основу питания крупных особей нильской тиляпии составляют планктонные сине-зёленые, зелёные и диатомовые водоросли, реже в пищу используются макрофиты, донные водоросли и детрит. Эпизодически объектами питания нильской тиляпии становятся различные водные животные – планктонные ракообразные, коловратки, упавшие в воду воздушные насекомые, их личинки (Moriarty, Moriarty, 1973; Philippart, Ruwet, 1982; Trewavas, 1983; Getachew, 1987, 1993; Khallaf, Alne-na-ei, 1987; Getachew, Fernando, 1989). Иногда такие объекты, например личинки хирономид, могут составлять значительную долю в рационе (Trewavas, 1983). У личинок и ювенильных особей нильской тиляпии доля животной пищи в рационе значительно выше (Trewavas, 1983; Froese, Pauly, 2018).
Тиляпиям свойственна высокая пищевая пластичность, проявляющаяся в освоении новых пищевых организмов при сезонных или иных изменениях условий существования и в использовании разной пищи в разных водоёмах (Philippart, Ruwet, 1982). Однако только эврифагией и пищевой пластичностью вряд ли можно объяснить высокую вкусовую привлекательность для нильской тиляпии организмов, которые далеки от неё по среде обитания и ареалу и не могут рассматриваться даже в качестве её потенциальных пищевых объектов. Тиляпия − пресноводная рыба, тогда как северная креветка – типично морское животное, артемия населяет замкнутые водоёмы с высокой солёностью. В африканских водоёмах, населяемых тиляпией, не встречаются водяной гиацинт и малая ряска, салат-латук не является водным растением. И тем не менее экстракты всех животных и большинства растений придавали гранулам высоко привлекательный вкус. По-видимому, стимулирующий потребление эффект вызван присутствием в составе этих и многих других организмов широко распространённых химических веществ, таких как свободные аминокислоты, карбоновые кислоты и другие низкомолекулярные соединения (Dabrowski, Rusiecki, 1983; De la Noue, Choubert, 1985; Holm, Walther, 1988; Kumai et al., 1989; Шивокене, 1989; Carr et al., 1996; Bogut et al., 2007; Kamio, Derby, 2017; Jiménez-Prada et al., 2018). Так, в листьях салата-латука много аспарагина, глутамина, пролина, серина, аланина и других аминокислот и их производных (Uhazy et al., 1978), по другим данным – глутаминовой и аспарагиновой кислот и лизина (Johnsen, Adams, 1986). В ряске большое содержание аспарагиновой и глутаминовой кислот (Зеленая лавка, 2018).
Растительная пища доминирует в рационе нильской тиляпии в природных водоёмах (Moriarty, Moriarty, 1973; Philippart, Ruwet, 1982; Getachew, 1987, 1993; Khallaf, Alne-na-ei, 1987; Getachew, Fernando, 1989). Экстракты большинства использованных нами растений имеют для неё привлекательный вкус и повышают потребление агар-агаровых гранул, что соответствует хорошо выраженной фитофагии нильской тиляпии. Известно, что для многих рыб и других животных, принадлежащих к факультативным и облигатным фитофагам, привлекательным вкусом обладает сахароза (Бронштейн, 1950; Кассиль, 1972; Харборн, 1985; Касумян, Морси, 1997; Касумян, Николаева, 1997; Kasumyan, Nikolaeva, 2002). Подтверждается ли это правило на примере нильской тиляпии, остаётся неизвестным.
Индекс вкусовой привлекательности водных экстрактов животных и растений (175 г/л) для нильской тиляпии Oreochromis niloticus: 1 – личинки хирономид Chironomidae, 2 – северная креветка Pandalus borealis, 3 – дафния Daphnia magna, 4 – артемия Artemia salina, 5 – личинки коретры Chaoborus sp., 6 – каланида Hemidiaptomus sp., 7 – риччия Riccia sp., 8 – водяной гиацинт Eichhornia crassipes (а – листья, б – корни), 9 – салат-латук Lactuca sativa, 10 – ряска малая Lemna minor, 11 – канадская элодея Elodea canadensis (а – из зоомагазина, б – из естественного водоёма).
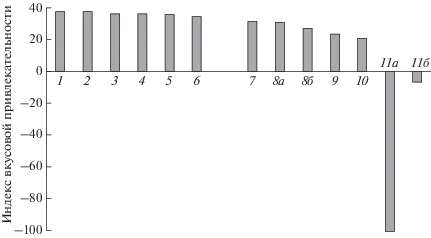
Из использованных нами растений ранее оценке вкусовой привлекательности для рыб была подвергнута малая ряска. Плотва Rutilus rutilus потребляла агар-агаровые гранулы с экстрактом ряски лучше, чем контрольные, но менее охотно, чем с экстрактом другого растения – нитчатки Cladophora sp. (Касумян, Тинькова, 2013). Интересно, что нильская тиляпия также потребляла гранулы с экстрактом ряски хуже, чем с экстрактом других растений – риччии, водяного гиацинта и салата-латука (рисунок). Избираемость ряски была невысокой в опытах с белым амуром Ctenopharyngodon idella, в которых рыбам одновременно предлагалось шесть–восемь видов растений из около 80, использованных для исследования (Строганов, 1963). В других экспериментах белый амур ряску отвергал, как полагают, из-за неприятного вкуса (Vincent, Sibbing, 1992). Ряска, плавающая на поверхности воды и обычно имеющая в водоёме большую численность, хорошо заметна и легко доступна для рыб. В ней содержатся не только аминокислоты, придающие пище благоприятный вкус, но и много флавоноидов и тритерпеновых соединений (Зеленая лавка, 2018). Присутствие именно этих широко распространённых веществ, относящихся к вторичным метаболитам, вынуждает растительноядных рыб и других фитофагов отказываться частично или полностью от питания растениями (Lewis, 1985; Targett et al., 1986; Hay et al., 1987; Steinberg, Paul, 1990; Capper et al., 2006; Paul et al., 2006, 2007; Kamio et al., 2016).
В отличие от ряски вкус водяного гиацинта, также плавающего на поверхности воды, оказался высоко привлекательным для нильской тиляпии, причём не только вкус корней, но и листьев (рисунок). Это инвазийное растение в настоящее время широко распространено во внутренних водоёмах тропической и субтропической зон всех континентов и часто создаёт здесь большую биомассу. Возможно, отсутствие химической защиты у водяного гиацинта от потребления нильской тиляпией обусловлено несовпадением естественных ареалов этих видов (табл. 1). Нельзя исключать, что отсутствие вкусовой детеррентности вызвано использованием водяным гиацинтом других защитных механизмов, препятствующих или компенсирующих выедание фитофагами, таких как необычайно быстрый рост и размножение. Сообщается, что водяной гиацинт относится к опасным растениям из-за большого содержания в нём кристаллов оксалата кальция (Шанцер, 2017). Кристаллы могут снижать текстурные качества водяного гиацинта, а кальций – влиять на его вкусовые свойства. Так, у человека степень выраженности горького вкуса пищевых растений хорошо коррелирует с концентрацией в них Са2+ (Tordoff, Sandell, 2009).
Канадская элодея также принадлежит к инвазийным гидрофитам. Однако её вкусовые качества для нильской тиляпии иные, чем у водяного гиацинта и других использованных нами растений. Присутствие в гранулах экстракта элодеи не стимулирует их заглатывание рыбами, а полностью блокирует потребление либо не оказывает на него какого-либо влияния (рисунок). Обнаруженная вкусовая детеррентность элодеи (серия 2) подтверждает высказывавшиеся ранее предположения о химической защищённости этого растения от фитофагов (Newman 1991; Kornijow et al., 1995) и соответствует экспериментальным данным об избегании использования в пищу элодеи Elodea nuttallii гусеницами подводной белой огнёвки Acentria ephemerella (Erhard et al., 2007). У элодеи E. nuttallii и E. сanadensis выявлена аллелопатическая активность в отношении эпифитов и планктонных водорослей (Erhard, Gross, 2006). Защитные свойства могут быть обусловлены флавоноидами, обнаруженными у обоих видов элодеи (Mues, 1983; Erhard et al., 2007) и являющимися, как отмечено выше, эффективными природными вкусовыми детеррентами для рыб.
Вкусовые детерренты, по-видимому, не обеспечивают полную защиту канадской элодеи от потребления рыбами. Сообщается, что элодею в пищу использует плотва Rutilus rutilus (Horppila, 1994; Prejs, Jackowska, 1978 – обе цит. по: Horppila, Nurminen, 2009). Канадской элодеей в эксперименте питается белый амур (Bonar et al., 1990; Vincent, Sibbing, 1992), а при наличии выбора белый амур избирает канадскую элодею намного чаще, чем несколько десятков других испытанных растений (Строганов, 1963). Разное отношение к вкусу канадской элодеи можно объяснить видовой специфичностью вкусовых спектров рыб (Kasumyan, Døving, 2003).
Однако более реальной причиной, по-видимому, следует считать вариабельность химического состава водных растений, в том числе элодеи. При сравнении канадской элодеи, взятой из относительно близко расположенных, но отличающихся по гидрохимии воды озёр, выяснено, что элодея из этих водоёмов существенно различается по содержанию ряда химических элементов и некоторых органических веществ. Тестирование образцов элодеи, взятых из этих озёр, обнаружило, что в эксперименте белый амур потребляет её с разной интенсивностью: тем чаще, чем больше в элодее кальция и лигнина и чем меньше железа, кремния и целлюлозы (Bonar et al., 1990). Известны и другие примеры значительной географической, сезонной, биотопической и иной вариабельности химического состава и пищевой привлекательности растений для рыб и других фитофагов (Coen, Tanner, 1989; Cronin, Hay, 1996b; Cole, Haggitt, 2001; Taylor et al., 2003; Capper et al., 2006; Elger et al., 2006; Oliveira et al., 2013). В наших опытах вкусовые качества элодеи разного происхождения также различались (p < 0.001). Весьма вероятно, что состав воды и условия выращивания у элодеи, взятой нами из карьера и приобретённой в магазине, отличались, что и обусловило столь сильные различия вкусовых свойств двух исследованных образцов. Следует отметить, что общая жёсткость воды в карьере составляла около 10°, карбонатная жесткость – 8°, общее содержание растворенных солей – 237 мг/л. Элодея из карьера была взята для тестирования в начале лета (I декада июня), т.е. представляла собой молодое растение. За редким исключением (Cronin, Hay, 1996a) молодые верхушечные части у многих растений накапливают в себе больше защитных веществ и оказывают на фитофагов более сильный детеррентный эффект, чем более старые (Hay et al., 1988; Carlson et al., 1989; Meyer, Paul, 1992, 1995; Lima et al., 2008). Такое распределение детеррентности хорошо согласуется с теорией оптимальной защиты, согласно которой защитные вещества должны накапливаться в организме так, чтобы наибольшая их концентрация создавалась в наиболее уязвимых структурах или частях растений и животных (Rhoades, 1979). Таким образом, наличие детеррентности у элодеи, приобретённой в магазине, и отсутствие детеррентности даже у молодых побегов элодеи из карьера свидетельствуют о том, что вкусовые свойства растений, использующих химическую защиту, лабильны и существенно зависят от внешних факторов.
Для пищевого поведения нильской тиляпии характерно редкое проявление повторных схватываний гранулы в процессе оросенсорного тестирования её качеств. Такая особенность поведения присуща в основном рыбам с плохим развитием зрения, например осетровым (Acipenseridae) (Kasumyan, 1999, 2018), либо рыбам, живущим на течении, где отвергание пищевого объекта с большой вероятностью ведёт к его потере (Kasumyan, Nikolaeva, 2002; Касумян Сидоров, 2005). В природе тиляпия питается преимущественно в дневные часы, что косвенно указывает на хорошо развитое зрение, и населяет водоёмы с проточной или стоячей водой (Philippart, Ruwet, 1982; Trewavas, 1983). Отсутствие у тиляпии склонности совершать многократные отвергания и повторные схватывания объекта питания, по-видимому, связано с групповым образом жизни и снижает у находящихся рядом рыб возможность перехватить добычу. Такая же особенность пищевого поведения характерна, например, для трёхиглой Gasterosreus aculeatus и девятииглой Pungitius pungitius колюшек (Gill, Hart, 1996a, 1996b; Михайлова, Касумян, 2015).
Детальное исследование пищевого поведения не входило в число специальных задач настоящей работы. Однако сравнение опытов, завершившихся потреблением или отверганием гранулы, показывает, что пищевое поведение нильской тиляпии развивается по разным стереотипам. Потреблению предшествует более быстрое схватывание рыбой упавшей в воду гранулы, которая намного реже тестируется повторно и меньше по времени удерживается рыбой во рту, чем это происходит в случае отказа от потребления гранулы. Провести такое сравнение было возможно только для гранул с экстрактом четырёх пищевых организмов из 11. Для более убедительных выводов о закономерностях пищевого поведения нильской тиляпии необходимо использование более широкого набора вкусовых стимулов.
Выполненное исследование показывает, что пищевые организмы различаются по своим вкусовым свойствам для рыб. Это подтверждает результаты более ранних исследований, в том числе выполненных с использованием аналогичной или сходной методик (Касумян, Тинькова, 2013; Lari et al., 2013; Тинькова и др., 2014). Биологический смысл различий объектов питания по вкусовой привлекательности вполне очевиден и имеет прямое отношение к селективному питанию рыб, к избирательному потреблению ими одних доступных кормовых организмов и отказу от других. Использованная методика в отличие от экспериментов по скармливанию рыбам растений и животных или их фрагментов (Строганов, 1962, 1963, 1968; Beukema, 1968; Ивлев, 1977; Antoine et al., 1986; Bonar et al., 1990; Chifamba, 1990; Barry, Ehret, 1993; Soriguer et al., 2002; Parker et al., 2006) позволяет избежать побочное влияние запаховых и текстурных свойств пищевого объекта и получать строгие оценки его вкусовой привлекательности. Результаты исследования свидетельствуют о способности рыб тонко дифференцировать пищевые организмы по их вкусовым качествам и подчеркивают важную роль вкусовой рецепции в выборе рыбами адекватных объектов питания.
Полученные данные о вкусовой привлекательности пищевых организмов, особенно водных растений, могут иметь практическое значение. Нильская тиляпия принадлежит к наиболее распространённым объектам культивирования во многих странах, объём её производства в мире постоянно растёт и в 2015 г. составил свыше 3.9 млн т (FAO, 2017). Учитывая дефицит и высокую стоимость искусственных кормов, сведения о вкусовых качествах для тиляпии различных широко распространённых и массовых животных и растений могут способствовать выявлению малоиспользуемых или неиспользуемых ресурсов и созданию новых технологий аквакультуры. Сведения о вкусовой привлекательности водяного гиацинта для нильской тиляпии могут представлять интерес для разработки новых способов биологической борьбы с этим инвазийным растением.
Список литературы
Абтахи Б., Набави Х., Джафари Шамушаки В. и др. 2018. Воздействие инсектицидовдиазинона и эндосульфана на вкусовую рецепцию персидского осетра Acipenser persicus (Acipenseridae) // Вопр. ихтиологии. Т. 58. № 2. С. 223–229. https://doi.org/10.7868/S004287521802011X
Бронштейн А.И. 1950. Вкус и обоняние. М.; Л.: Изд-во АН СССР, 306 с.
Зеленая лавка. 2018. Ряска малая (трава). (http:// zelenaya-lavka.ru/shop/travy/riaska-malaia-trava/)
Ивлев В.С. 1977. Экспериментальная экология питания рыб. Киев: Наук. думка, 272 с.
Кассиль В.Г. 1972. Вкус // Физиология сенсорных систем. Ч. 2. Л.: Наука. С. 562–606.
Касумян А.О. 2012. Исследование внутриротовой тактильной рецепции и её взаимодействия с вкусовой системой у рыб // ДАН. Т. 447. № 5. С. 579–581.
Касумян А.О., Морси А.М.Х. 1997. Вкусовые предпочтения классических вкусовых веществ молоди белого амура, Ctenopharyngodon idella (Cyprinidae, Pisces), выращенной на животном и растительном корме // Там же. Т. 357. № 2. С. 284–286.
Касумян А.О., Николаева Е.В. 1997. Вкусовые предпочтения гуппи, Poecilia reticulata (Cyprinodontiformes, Pisces) // Вопр. ихтиологии. Т. 37. № 5. С. 696–703.
Касумян А.О., Сидоров С.С. 2005. Вкусовые предпочтения кумжи Salmo trutta трех географически изолированных популяций // Там же. Т. 45. № 1. С. 117–130.
Касумян А.О., Тинькова Т.В. 2013. Вкусовая привлекательность различных гидробионтов для плотвы Rutilus rutilus, горчака Rhodeus sericeus amarus и радужной форели Parasalmo (=Oncorhynchus) mykiss // Там же. Т. 53. № 4. С. 479–489. https://doi.org/10.7868/S0042875213040024
Михайлова Е.С., Касумян А.О. 2015. Вкусовые предпочтения и пищевое поведение девятииглой колюшки Pungitius pungitius популяций бассейнов Атлантического и Тихого океанов // Там же. Т. 55. № 5. С. 541–564. https://doi.org/10.7868/S0042875215050112
Строганов Н.С. 1962. Экологическая физиология рыб. М.: Изд-во МГУ, 444 с.
Строганов Н.С. 1963. Избирательная способность амуров к пище // Проблемы рыбохозяйственного использования растительноядных рыб в водоемах СССР. Ашхабад: Изд-во АН ТССР. С. 181–191.
Строганов Н.С. 1968. Акклиматизация и выращивание осетровых рыб в прудах. М.: Изд-во МГУ, 377 с.
Тинькова Т.В., Касумян А.О., Дгебуадзе П.Ю. и др. 2014. Детеррентность морских лилий (Comatulida) Южного Вьетнама для помацентровой рыбы Abudefduf vaigiensis // ДАН. Т. 456. № 3. С. 370–373. https://doi.org/10.7868/ S0869565214150250
Харборн Дж. 1985. Введение в экологическую биохимию. М.: Мир, 312 с.
Шанцер И.А. 2017. Растения средней полосы Европейской России. М.: Т-во науч. изд. КМК, 390 с.
Шивокене Я.С. 1989. Симбионтное пищеварение у гидробионтов и насекомых. Вильнюс: Мокслас, 223 с.
Шорыгин А.А. 1952. Питание и пищевые взаимоотношения рыб в Каспийском море. М.: Пищепромиздат, 268 с.
Alford J.B., Beckett D.C. 2007. Selective predation by four darter (Percidae) species on larval chironomids (Diptera) from a Mississippi stream // Environ. Biol. Fish. V. 78. P. 353–364.
Antoine T., Carraro S., Micha J.-C., Van Hove C. 1986. Comparative appetency for Azolla of Cichlasoma and Oreochromis (Tilapia) // Aquaculture. V. 53. P. 95–99.
Barry J.P., Ehret M.J. 1993. Diet, food preference, and algal availability for fishes and crabs on intertidal reef communities in southern California // Environ. Biol. Fish. V. 37. P. 75–95.
Beukema J.J. 1968. Predation by three-spined stickleback (Gasterosteus aculeatus L.): the influence of hunger and experience // Behaviour. V. 31. P. 1–126.
Bogut I., Has-Schön E., Adamek Z. et al. 2007. Chironomus plumosus larvae – a suitable nutrient for freshwater farmed fish // Poljoprivreda. V. 13. № 1. P. 1–5.
Bonar S.A., Sehgal H.S., Pauley G.B., Thomas G.L. 1990. Relationship between the chemical composition of aquatic macrophytes and their consumption by grass carp, Ctenopharyngodon idella // J. Fish Biol. V. 36. P. 149–157.
Capper A., Tibbetts I.R., O’Neil J.M., Shaw G.R. 2006. Feeding preference and deterrence in rabbitfish Siganus fuscescens for the cyanobacterium Lyngbya majuscule in Moreton Bay, south-east Queensland, Australia // Ibid. V. 68. P. 1589–1609.
Carlson D.J., Lubchenco J., Sparrow M.A., Trowbridge C.D. 1989. Fine-scale variability of lanosol and its disulfate ester in the temperate red alga Neorhodomela larix // J. Chem. Ecol. V. 15. P. 1321–1333.
Carr W.E.S., Netherton J.C., III, Gleeson R.A., Derby C.D. 1996. Stimulants of feeding behavior in fish: analyses of tissues of diverse marine organisms // Biol. Bull. V. 190. P. 149–160.
Chifamba P.C. 1990. Preference of Tilapia rendalli (Boulenger) for some species of aquatic plants // J. Fish Biol. V. 36. P. 701–705.
Coen L.D., Tanner C.E. 1989. Morphological variation and differential susceptibility to herbivory in the tropical brown alga Lobophora variegate // Mar. Ecol. Progr. Ser. V. 54. P. 287–298.
Cole R.G., Haggitt T. 2001. Dietary preferences of Evechinus chloroticus and the persistence of the fucalean macroalga Carpophyllum flexuosum on coralline-dominated areas in northeastern New Zealand // Echinoderms 2000 / Ed. Barker M.F. Lisse: Swets & Zeitlinger. P. 425–430.
Cronin C., Hay M.E. 1996a. Within-plant variation in seaweed palatability and chemical defenses: optimal defense theory versus the growth-differentiation balance hypothesis // Oecologia V. 105. P. 361–368.
Cronin G., Hay M.E. 1996b. Induction of seaweed chemical defenses by amphipod grazing // Ecology. V. 77. P. 2287–2301.
Dabrowski K., Rusiecki M. 1983. Content of total and free amino acids in zooplanktonic food of fish larvae // Aquaculture. V. 30. № 1–4. P. 31–42.
De la Noue J., Choubert G. 1985. Apparent digestibility of invertebrate biomasses by rainbow trout // Ibid. V. 50. P. 103–112.
Elger A., Barrat-Segretain M.H., Willby N.J. 2006. Seasonal variability in the palatability of freshwater macrophytes: a case study // Hydrobiologia. V. 570. P. 89–93.
Erhard D., Gross E.M. 2006. Allelopathic activity of Elodea canadensis and Elodea nuttallii against epiphytes and phytoplankton // Aquat. Bot. V. 85. P. 203–211.
Erhard D., Pohnert G., Gross E.M. 2007. Chemical defense in Elodea nuttallii reduces feeding and growth of aquatic herbivorous Lepidoptera // J. Chem. Ecol. V. 33. P. 1646–1661.
FAO. 2017. Fishery and Aquaculture Statistics. Statistiques des pȇches et de l’aquaculture. Estadísticas de pesca y acuicultura. 2015. Rome: FAO, 78 p.
Froese R., Pauly D. (eds.). 2018. FishBase. World Wide Web electronic publication. (www.fishbase.org. Version 02/2018).
Getachew T. 1987. A study on an herbivorous fish, Oreochromis niloticus L., diet and its quality in two Ethiopian Rift Valley lakes, Awasa and Zwai // J. Fish. Biol. V. 30. P. 439–449.
Getachew T. 1993. The composition and nutritional status of the diet of Oreochromis niloticus L. in Lake Chamo, Ethiopia // Ibid. V. 42. P. 865–874.
Getachew T., Fernando C.H. 1989. The food habits of an herbivorous fish (Oreochromis niloticus Linn.) in Lake Awasa, Ethiopia // Hydrobiologia. V. 174. P. 195–200.
Gill A.B., Hart P.J.B. 1996a. Unequal competition between three-spined stickleback, Gasterosteus aculeatus L., encountering sequential prey // Anim. Behav. V. 51. P. 689−698.
Gill A.B., Hart P.J.B. 1996b. How feeding performance and energy intake change with a small increase in the body size of the three-spined stickleback // J. Fish Biol. V. 48. P. 878−890.
Hay M.E., Fenical W., Gustafson K. 1987. Chemical defense against diverse coral-reef herbivores // Ecology. V. 68. № 6. P. 1581–1591.
Hay M.E., Paul V.J., Lewis S.M. et al. 1988. Can tropical seaweeds reduce herbivory by growing at night? Diel patterns of growth, nitrogen content, herbivory, and chemical versus morphological defenses // Oecologia. V. 75. P. 233–245.
Hidaka I. 1982. Taste receptor stimulation and feeding behavior in the puffer // Chemoreception in fishes / Ed. Hara T.J. Amsterdam: Elsevier Sci. Publ. Co. P. 243–257.
Holm J.C., Walther B. 1988. Free amino acids in live freshwater zooplankton and dry feed: possible importance for first feeding in Atlantic salmon (Salmo salar) // Aquaculture. V. 71. P. 341–354.
Horppila J., Nurminen L. 2009. Food niche segregation between two herbivorous cyprinid species in a turbid lake // J. Fish Biol. V. 75. 1230–1243.
Jiménez-Prada P., Hachero-Cruzado I., Giráldez I. et al. 2018. Crustacean amphipods from marsh ponds: a nutritious feed resource with potential for application in integrated multi-trophic aquaculture // PeerJ. 6:e4194. https://doi.org/10.7717/peerj.4194
Johnsen P.B., Adams M.F. 1986. Chemical feeding stimulants for the herbivorous fish, Tilapia zillii // Comp. Biochem. Physiol. V. 83A. № 1. P. 109–112.
Jones K.A. 1989. The palatability of amino acids and related compounds to rainbow trout, Salmo gairdneri Richardson // J. Fish Biol. V. 34. № 1. P. 149–160.
Jones K.A. 1990. Chemical requirements of feeding in rainbow trout, Oncorhynchus mykiss (Walbaum); palatability studies on amino acids, amides, amines, alcohols, aldehydes, saccharides, and other compounds // Ibid. V. 37. P. 413–423.
Kamio M., Derby C.D. 2017. Finding food: how marine invertebrates use chemical cues to track and select food // Nat. Prod. Rept. V. 34. № 5. P. 463–560.
Kamio M., Koyama M., Hayashihara N. et al. 2016. Sequestration of dimethylsulfoniopropionate (DMSP) and acrylate from the green alga Ulva spp. by the sea hare Aplysia juliana // J. Chem. Ecol. V. 42. P. 452–460.
Kasumyan A.O. 1999. Olfaction and taste senses in sturgeon behaviour // J. Appl. Ichthyol. V. 15. P. 228–232.
Kasumyan A. 2018. Olfaction and gustation in Acipenseridae, with special references to the Siberian sturgeon, Acipenser baerii // The Siberian sturgeon (Acipenser baerii, Brandt, 1869). V. 1. Biology / Eds. Williot P., Nonnotte G. et al. Cham: Springer. P. 173–205.
Kasumyan A.O. 2019. The taste system in fishes and the effect of environmental variables // J. Fish Biol. V. 94. doi 10.1111/jfb.13940
Kasumyan A. Døving K.B. 2003. Taste preferences in fish // Fish Fish. V. 4. № 4. P. 289–347.
Kasumyan A.O., Nikolaeva E.V. 2002. Comparative analysis of taste preferences in fishes with different ecology and feeding // J. Ichthyol. V. 42. Suppl. 2. P. S203–S214.
Khallaf E.A., Alne-na-ei A.A. 1987. Feeding ecology of Oreochromis niloticus (Linnaeus) & Tilapia zillii (Gervias) in a Nile canal // Hydrobiologia. V. 146. P. 57–62. https://doi.org/10.1007/BF00007577
Kornijow R., Gulati R.D., Ozimek T. 1995. Food preference of freshwater invertebrates: comparing fresh and decomposed angiosperm and a filamentous alga // Freshw. Biol. V. 33. P. 205–212.
Kumai H., Kimura I., Nakamura M. et al. 1989. Studies on digestive system and assimilation of a flavored diet in ocellate puffer // Nippon Suisan Gakkaishi. V. 55. № 6. P. 1035–1043.
Lari E., Kasumyan A., Falahat F. et al. 2013. Palatability of food animals for stellate sturgeon Acipenser stellatus Pallas, 1771 // J. Appl. Ichthyol. V. 29. P. 1222–1224. https://doi.org/10.1111/jai.12324
Lewis S.M. 1985. Herbivory on coral reefs: algal susceptibility to herbivorous fishes // Oecologia. V. 65. P. 370–375.
Lim L.-S., Lai S.-K.J., Yong A.S.-K. et al. 2017. Feeding response of marble goby (Oxyeleotris marmorata) to organic acids, amino acids, sugars and some classical taste substances // Appl. Anim. Behav. Sci. V. 196. P. 113–118.
Lima L.M.S., Alor R., Uriostegui R. et al. 2008. Within-plant variation in palatability and chemical defenses in the green seaweed Avrainvillea elliottii // Bot. Mar. V. 51. P. 21–25.
Long J.D., Hay M.E. 2006. Fishes learn aversions to a nudibranch’s chemical defense // Mar. Ecol. Progr. Ser. V. 307. P. 199–208.
Mackie A.M. 1982. Identification of the gustatory feeding stimulants // Chemoreception in fishes / Ed. Hara T.J. Amsterdam: Elsevier Sciю Publ. Co. P. 275–291.
Marty M.J., Blum J.E., Pawlik J.R. 2016. No accounting for taste: palatability of variably defended Caribbean sponge species is unrelated to predator abundance // J. Exp. Mar. Biol. Ecol. V. 485. P. 57–64.
Meyer K.D., Paul V.J. 1992. Intraplant variation in secondary metabolite concentration in three species of Caulerpa (Chlorophyta: Caulerpales) and its effects on herbivorous fishes // Mar. Ecol. Progr. Ser. V. 82. P. 249–257.
Meyer K.D., Paul V.J. 1995. Variation in secondary metabolite and aragonite concentrations in the tropical green seaweed Neomeris annulata: effects on herbivory by fishes // Mar. Biol. V. 122. P. 537–545.
Moriarty D.J.W., Moriarty C.M. 1973. The assimilation of carbon from phytoplankton by two herbivorous fishes: Tilapia nilotica and Haplochromis nignipinnis // J. Zool. V. 171. P. 41–55.
Mues R. 1983. Species specific flavone glucuronides in Elodea species // Biochem. Syst. Ecol. V. 11. P. 261–265.
Newman R.M. 1991. Herbivory and detritivory on freshwater macrophytes by invertebrates: a review // J. North Amer. Benthol. Soc. V. 10. P. 89–114.
Nusnbaum M., Aggio J.F., Derby C.D. 2012. Taste-mediated behavioral and electrophysiological responses by the predatory fish Ariopsis felis to deterrent pigments from Aplysia californica ink // J. Comp. Physiol. V. 198A. P. 283–294.
Oliveira A.S., Sudatti D.B., Fujii M.T. et al. 2013. Inter- and intrapopulation variation in the defensive chemistry of the red seaweed Laurencia dendroidea (Ceramiales, Rhodophyta) // Phycologia. V. 52. № 2. P. 130–136.
O’Neal W., Pawlik J.R. 2002. A reappraisal of the chemical and physical defenses of Caribbean gorgonian corals against predatory fishes // Mar. Ecol. Progr. Ser. V. 240. P. 117–126.
Parker J.D., Collins D.O., Kubanek J. et al. 2006. Chemical defenses promote persistence of the aquatic plant Micranthemum umbrosum // J. Chem. Ecol. V. 32. P. 815–833.
Paul V.J., Puglisi M.P., Ritson-Williams R. 2006. Marine chemical ecology // Nat. Prod. Rept. V. 23. P. 153–180.
Paul V.J., Arthur K.E., Ritson-Williams R. et al. 2007. Chemical defenses: from compounds to communities // Biol. Bull. V. 213. P. 226–251.
Philippart J.-Cl., Ruwet J.-Cl. 1982. Ecology and distribution of tilapias // Proc. conf. “The biology and culture of tilapias”. V. 7 / Eds. Pullin R.C.V., Lowe-McConnell. Manila: ICLARM. P. 15–59.
Prado P., Heck K.L., Jr. 2011. Seagrass selection by omnivorous and herbivorous consumers: determining factors // Mar. Ecol. Progr. Ser. V. 429. P. 45–55.
Pryor V.K., Epifanio C.E. 1993. Prey selection by larval weakfish (Cynoscion regalis): the effects of prey size, speed, and abundance // Mar. Biol. V. 116. P. 31–37.
Rhoades D.F. 1979. Evolution of plant chemical defense against herbivores // Herbivores: their interactions with secondary plant metabolites / Eds. Rosenthal G.A., Janzen D.H. N.Y.: Acad. Press. P. 3–54.
Shaw G.W., Pankhurst P.M., Purser G.J. 2003. Prey selection by greenback flounder Rhombosolea taparina (Günther) larvae // Aquaculture. V. 22. P. 249–265.
Soriguer M.C., Domezain A., Aragonés J. et al. 2002. Feeding preference in juveniles of Acipenser naccarii Bonaparte 1836 // J. Appl. Ichthyol. V. 18. P. 691–694.
Steinberg P.D., Paul V.J. 1990. Fish feeding and chemical defenses of tropical brown algae in Western Australia // Mar. Ecol. Progr. Ser. V. 58. P. 253–259.
Stoecker D.K., Govoni J.J. 1984. Food selection by young larval gulf menhaden (Brevoortia patronus) // Mar. Biol. V. 80. P. 299–306.
Sudo H., Azeta M. 2001. The microhabitat and size of gammarid species selectively predated by young red sea bream Pagrus major // Fish. Sci. V. 67. P. 389–400.
Targett N.M., Targett T.E., Vrolijk N.H., Ogden J.C. 1986. Effect of macrophyte secondary metabolites on feeding prefe-rences of the herbivorous parrotfish Sparisoma radians // Mar. Biol. V. 92. № 1. P. 141–148.
Taylor R.B., Lindquist N., Kubanek J., Hay M.E. 2003. Intraspecific variation in palatability and defensive chemistry of brown seaweeds: effects on herbivore fitness // Oecologia. V. 136. P. 412–423.
Tordoff M.G., Sandell M.A. 2009. Vegetable bitterness is related to calcium content // Appetite. V. 52. P. 498–504.
Trewavas E. 1983. Tilapiine fishes of the genera Sarotherodon, Oreochromis and Danakilia // Brit. Mus. Nat. Hist. Publ. № 878. 583 p.
Uhazy L.S., Tanaka R.D., MacInnis A.J. 1978. Schistosoma mansoni: identification of chemicals that attract or trap its snail vector, Biomphalaria glabrata // Science. V. 201. P. 924–926.
Verliin A., Kotta J., Orav-Kotta H. et al. 2011. Food selection of Coregonus lavaretus in a brackish water ecosystem // J. Fish Biol. V. 74. № 2. P. 540–551.
Vincent J.F.V., Sibbing F.A. 1992. How the grass carp (Ctenopharyngodon idella) chooses and chews its food-some clues // J. Zool. V. 226. P. 435–444.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


