Вопросы ихтиологии, 2019, T. 59, № 4, стр. 430-447
Репродуктивные стратегии и происхождение парапатрических и симпатрических форм арктического гольца Salvelinus alpinus (Salmonidae) в системе озёр Большое и Малое Леприндо (Северное Забайкалье)
С. С. Алексеев 1, 2, *, М. Ю. Пичугин 3, Н. В. Гордеева 4, В. П. Самусенок 5, А. Л. Юрьев 5, В. С. Хлыстов 5, А. Н. Матвеев 5
1 Институт биологии развития РАН – ИБР
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
3 Московский государственный университет
Москва, Россия
4 Институт общей генетики РАН – ИОГен
Москва, Россия
5 Иркутский государственный университет
Иркутск, Россия
* E-mail: alekseyev@mail.ru
Поступила в редакцию 20.03.2018
После доработки 06.07.2018
Принята к публикации 25.09.2018
Аннотация
Изучено размножение двух изолированных популяций карликовой формы арктического гольца Salvelinus alpinus в системе озёр Большое и Малое Леприндо (бассейн Лены, Забайкалье). С привлечением данных по ранее обитавшей здесь крупной форме описана уникальная комбинация симпатрических и парапатрических форм гольца с осенним (крупная форма), летним (карликовая форма, Большое Леприндо) и впервые отмеченным в России зимне-весенним (карликовая форма, Малое Леприндо) пиками нереста. В обоих озёрах карликовая форма нерестится в профундальной зоне на илистом дне на глубине 25−58 м: в первом − с конца июня по октябрь с пиком в июле−августе при температуре воды 5−6°С, во втором − с января по июль, с пиком в январе−марте при 2.5−3.0°С. Развитие икры, отложенной в июле−августе в оз. Большое Леприндо, продолжается 3.0−3.5 мес., в январе−марте в оз. Малое Леприндо – ориентировочно 4.0−4.5 мес., в обоих озёрах её активно выедает налим Lota lota. У карликовой формы по сравнению с крупной в два раза больше относительная плодовитость за счёт меньших размеров икры, что компенсирует её высокую смертность. Предполагается, что различия нерестовых стратегий сформировались вследствие вытеснения карликовых гольцов крупными из литоральной зоны в профундальную, где круглогодичная низкая температура привела к увеличению продолжительности и смещению сроков их нереста. Эти различия обусловили репродуктивную изоляцию и генетическую дивергенцию трёх популяций гольцов.
Дифференциация по особенностям размножения является важнейшим фактором микроэволюции, обеспечивающим презиготическую репродуктивную изоляцию между близкими видами и внутривидовыми формами. В этой связи выявление различий в сроках, продолжительности, местах и условиях нереста − приоритетная задача при исследованиях видо- и формообразования у рыб (Skúlason, Kristjansson, 2015). Арктический голец Salvelinus alpinus s. l. является одной из наиболее полиморфных групп рыб, в которой активно протекают процессы формообразования (Савваитова, 1989; Jonsson, Jonsson, 2001; Klemetsen, 2013). Этот вид (или видовой комплекс) отличается большим разнообразием репродуктивных стратегий (Balon, 1980; Johnson, 1980; Павлов и др., 1990, 1993; Klemetsen et al., 2003), однако подробные исследования их различий у симпатрических и парапатрических форм арктического гольца на территории России немногочисленны. В Северном Забайкалье, одном из основных центров диверсификации арктического гольца (Алексеев, 2016), такие исследования затрудняются труднодоступностью его местообитаний.
Озёра Большое и Малое Леприндо (далее − БЛ и МЛ) (бассейн рек Чара−Олёкма−Лена) относятся к числу наиболее крупных озёр Забайкалья, населённых арктическим гольцом. Они расположены в юго-западной оконечности Чарской тектонической впадины и возникли после таяния Сюльбанского перемётного ледника, покрывавшего этот район во время последнего (сартанского) оледенения 25−10 тыс. лет назад. Первоначально сформировался единый водоём, который с падением уровня воды разделился на два (Ендрихинский, 1982; Еникеев, 1998). Гольцы, видимо, заселили их из существовавшего ниже по течению р. Чара крупного ледниково-подпрудного Чарского озера (Музис, 1982; Еникеев, 2009). В озёрах до середины 1980-х гг. обитала мигрировавшая между ними крупная хищная форма гольца (Заплатин, 1964; Пронин, 1967; Савваитова и др., 1981б), уничтоженная неконтролируемым промыслом в период строительства БАМ, и в каждом ныне существует своя популяция карликовой планктоноядной формы (Алексеев и др., 2000; Alekseyev et al., 2013). Карликовые гольцы из двух озёр, несколько различаясь по темпу роста, сходны по меристическим признакам и экологии, но существенно отличаются от крупной формы по биотопическому распределению, питанию, числу жаберных тычинок, пилорических придатков, позвонков, жаберных лучей и некоторым другим признакам (Alekseyev et al., 2013). По данным анализа изменчивости микросателлитных локусов, они генетически сегрегированы и репродуктивно изолированы друг от друга и от крупной формы (Alekseyev et al., 2013). В обоих озёрах у карликовых гольцов отмечен один и тот же гаплотип контрольной области мтДНК, распространённый во всех озёрах бассейна верхней Чары (Alekseyev et al., 2009), хотя из оз. МЛ был изучен лишь 1 экз. Изучение мтДНК крупной формы не проводилось.
Сведения о размножении крупной формы гольца в оз. МЛ содержатся в работах Пронина (1967) и Савваитовой с соавторами (1981б), карликовой формы в оз. БЛ – Алексеева с соавторами (Алексеев и др., 2000; Alekseyev et al., 2013), однако подробные исследования не проводились; данные о нересте карликовой формы в оз. МЛ отсутствуют.
Цель настоящей работы – изучить особенности размножения и развития парапатрических и симпатрических форм арктического гольца из системы озёр Большое и Малое Леприндо для оценки их роли в формировании репродуктивной изоляции между формами, а также уточнить происхождение и генетические различия этих форм.
МАТЕРИАЛ И МЕТОДИКА
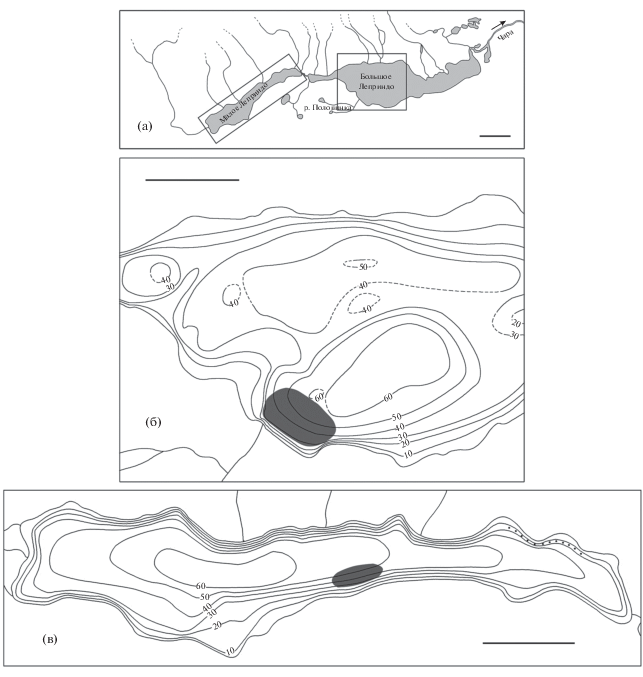
Озёра МЛ (56°36.5′ с.ш. 117°22′ в.д., 7.0 × 1.5 км, площадь поверхности 6.5 км2, высота 978 м над уровнем моря) и БЛ (56°37′ с.ш. 117°31′ в.д., 11.5 × × 2.8 км, 17 км2, 975 м над уровнем моря) (рис. 1а) имеют ледниково-тектоническое происхождение. Оба озера олиготрофные, глубоководные (по нашим данным, максимальная глубина соответственно 63.3 и 67.1 м). В БЛ основные глубины находятся в его западной части (рис. 1б), восточная более мелководна; в МЛ − в западной и центральной, мелководная зона выражена слабо (рис. 1в). Из МЛ вытекает короткая (450 м) протока, а из БЛ – р. Чара, крупный приток Олёкмы. По нашим данным, в БЛ вода характеризуется следующими показателями: pH 8.05, общая минерализация 12 мг/л, электропроводность 27 мкСм/см, прозрачность по диску Секки 2.5 м. Озёра освобождаются ото льда в середине июня, замерзают в конце октября−начале ноября, толщина льда к началу весны может достигать 1.5 м. Помимо арктического гольца в них обитают сиг-пыжьян Coregonus pidschian (фоновый вид), байкалоленский хариус Thymallus baicalolenensis, обыкновенный гольян Phoxinus phoxinus, гольян Лаговского Rhynchocypris lagowskii, сибирская щиповка Cobitis melanoleuca, сибирский голец Barbatula toni, налим Lota lota, пестроногий подкаменщик Cottus poecilopus, изредка встречается острорылый ленок Brachymystax lenok. Помимо этого в БЛ отмечался таймень Hucho taimen, а в мелководных заливах его восточной части обитают обыкновенная щука Esox lucius, плотва Rutilus rutilus, серебряный карась Carassius auratus gibelio, речной окунь Perca fluviatilis (Томилов, 1954; Пронин, 1977; Савваитова и др., 1981а; Матвеев и др., 2004), а также озёрный гольян Rh. percnurus (наши наблюдения).
Рис. 1.
Общая схема озёр Леприндо (а) и карты глубин Большого (западная часть, б) и Малого
(в) Леприндо с указанием нерестилищ карликовой ( ) и крупной (···) форм арктического гольца Salvelinus alpinus; (——) – изобаты, (- -) – участки изобат, требующие уточнения. Масштаб: а – 2; б, в − 1 км.
) и крупной (···) форм арктического гольца Salvelinus alpinus; (——) – изобаты, (- -) – участки изобат, требующие уточнения. Масштаб: а – 2; б, в − 1 км.
Гольцов карликовой формы отлавливали в 1996−2017 гг. донными жаберными сетями с ячеёй 12, 14, 16, 18, 20 мм (ячею 12 и 14 мм использовали только в БЛ, где размеры рыб меньше), которые выставляли на глубину 5−58 м от берега или от якорей, закреплённых на разных глубинах, а после ледостава – со льда. Контрольные обловы на нерестилище в оз. БЛ проводили с июня по октябрь и ограниченно – в феврале и марте, в оз. МЛ – круглогодично. Регистрировали глубину, на которой были пойманы рыбы, вычисляли уловы на единицу промыслового усилия (число экземпляров на 1 м2 сети за ночь (~12 ч)). У рыб измеряли длину по Смитту (FL), определяли массу, пол, стадию зрелости по Правдину (1966), плодовитость, диаметр зрелых ооцитов. Коэффициент зрелости (КЗ, %) рассчитывали как отношение массы гонад к полной массе рыбы. Возраст определяли по отолитам. При анализе питания налимов, пойманных на нерестилищах карликовой формы гольца, определяли долю разных компонентов пищи (в % общей массы пищевого комка) и частоту их встречаемости в желудках (Методическое пособие …, 1974).
На нерестилищах брали пробы грунта при помощи дночерпателя, выставляли автономные регистраторы температуры: в оз. БЛ − на срок ~11 мес. (XI.2013–X.2014 г., в толще воды на глубинах 5, 10, 20, 40, 50 м) и ~3 мес. (VII−IX.2015 г., у дна на глубинах 10, 20, 30 м); в оз. МЛ – на срок ~16.5 мес. (II.2014−VI.2015 г., в толще воды на глубинах 5, 25, 50 м) и ~2.5 мес. (IX−XI.2017 г., у дна на глубине 10 м). Температуру фиксировали каждые 2−6 ч. Карты глубин составляли с использованием двухлучевого ультразвукового эхолота и GPS-приёмника.
Сведения о размножении крупной формы приводятся по данным литературы (Пронин, 1967; Савваитова и др., 1981б) с нашими дополнениями, основанными на исходных материалах анализа гольцов в выборках 1977−1978 гг., любезно предоставленных авторами второй работы.
Для изучения раннего онтогенеза карликовой формы из оз. БЛ в 2013−2016 гг. в период с 1 по 23 августа отбирали половые продукты от текучих производителей (8−10 самок и 15−20 самцов в год); икру осеменяли сухим способом (~300−800 икринок в год). Режимы инкубации в разные годы и в разных партиях одного года различались. В 2013 г. икру в течение 41 сут. выдерживали в озере и затем в холодильнике при температуре ~6°С, далее во льду перевозили в лабораторию кафедры ихтиологии МГУ (4 сут. при ~1°С), где проводили её дальнейшую инкубацию сначала при ~2°С в течение 12 сут. (серия 1) и 62 сут. (серия 2) и далее при ~6°С. В 2014 г. набухшую икру (серия 3) сразу помещали в талый лёд, а через две недели в лаборатории МГУ инкубировали при 1−4°С; при той же температуре инкубировали несколько живых икринок с эмбрионами на стадии, близкой к началу пигментации глаза, извлечённых в 2014 г. из желудков налимов.
Икра, собранная в 2015 и 2016 гг., была использована для определения её выживаемости на разных глубинах. В 2015 г. икру в день осеменения разместили на глубины 20, 30 и 40 м, а в 2016 г. после инкубации в течение 7 сут. на глубине 35 м и удаления погибших за это время икринок − на глубины 5, 10, 20, 30, 40 и 50 м. По прошествии 45 сут. (2015 г.) и 30 сут. (2016 г.) провели учёт погибших и выживших за время экспериментов икринок. Для дальнейшего изучения была использована икра, развивавшаяся на глубинах 30−50 м при средней температуре 5.3−6.1°С, в лаборатории её инкубировали при ~6°С (серии 4 и 5 соответственно). Таким образом, икра серий 1 и 4−5 развивалась в более тепловодных режимах, чем икра серий 2 и 3.
В озере икру инкубировали в пластмассовых ёмкостях с отверстиями для циркуляции воды, в лаборатории − в помещённых в холодильник чашках Петри (2013 и 2014 гг.) с ежедневной подменой 1/4−1/3 объёма воды или в плавучих садках (2015 и 2016 гг.), помещённых в аэрируемые аквариумы объёмом 10 л, при низкой освещённости. Молодь серии 3 подращивали при 1−4°С, остальных серий – при ~6°С. Вылупившихся в течение одних суток эмбрионов отсаживали по 2−4 экз. в ёмкости объёмом 0.2 л с еженедельной подменой 1/4−1/3 объёма воды и содержали при естественном фотопериоде. Через 1 мес. при увеличении двигательной активности предличинок пересаживали в ёмкости объёмом 1 л, куда вносили живые кормовые организмы (планктонных ракообразных, мелких личинок Chironomidae). Начало питания отмечали по активным попыткам схватывания подвижных объектов и появлению фекалий, наличие воздуха в плавательном пузыре – по длительному пребыванию особей в толще воды.
Для уточнения генетических различий между формами гольцов по описанным ранее методикам (Alekseyev et al., 2009; Гордеева и др., 2018) провели анализ последовательностей контрольной области мтДНК (545 п.о.). Ему подвергли 6 экз. исчезнувшей крупной и 9 экз. карликовой формы из оз. МЛ. ДНК крупных гольцов, выловленных в 1977−1978 гг., выделили из сухих остатков тканей вестибулярного аппарата, эндолимфы и крови на бумаге чешуйных книжек (предоставлены К.А. Савваитовой и В.А. Максимовым), ДНК карликовых − из фиксированных 96%-ным этанолом фрагментов мышц. Генетические различия между формами оценивали при помощи точного теста дифференциации (Raymond, Rousset, 1995) в программе TFPGA (Miller, 1997). Новая последовательность, выявленная в настоящем исследовании, помещена в базу GenBank под номером MH105053.
Для выяснения модуса происхождения форм использовали полученные ранее данные по изменчивости восьми микросателлитных локусов гольцов из озёр Леприндо (Alekseyev et al., 2013) и других забайкальских водоёмов (Gordeeva et al., 2015). Были генотипированы 66 экз. карликовой формы из оз. БЛ, 53 − из оз. МЛ и 12 экз. крупной формы из оз. МЛ, а также 399 гольцов из других озёр. Три экземпляра “мелкой формы” из оз. БЛ и два − из оз. МЛ, являющихся карликовыми гольцами, которые претерпели ускорение роста в позднем онтогенезе (Alekseyev et al., 2013), объединены с карликовой формой из этих озёр. По частотам аллелей были рассчитаны оценки хорд-дистанций (DCE) (Cavalli-Sforza, Edwards, 1967) и по результатам 1000 бутстреп-повторов методом ближайшего связывания (NJ) построено бескорневое консенсусное дерево в пакете программ PHYLIP 3.6 (Felsenstein, 2004). Дополнительно для проверки монофилии форм из системы озёр Леприндо был также привлечён байесовский анализ генетической кластеризации с использованием вероятностной классификации особей на основании аллельных частот, который выполняли в программе STRUCTURE, версия 2.3.2.1 (Pritchard et al., 2000). Использовали данные для географически близких озёр из бассейна р. Чара − Даватчан, Гольцовое, Кирялта-3 и Кирялта-4. Расчёт вероятностей проводили в рамках модели admixture в комбинации с независимыми частотами аллелей для числа кластеров (K) от 1 (генетическое единообразие) до 18 (максимально возможное число популяций (форм) во всех шести озёрах), для каждого выполняли 10 итераций с 250000 циклами прожига и 750000 MCMC-симуляций. Число генетических единиц определяли методом Эванно (Evanno et al., 2005), основанным на сравнении изменчивости оценок лог-вероятности между K с помощью вычисляемого параметра ΔК, в программе STRUCTURE HARVESTER Web (Earl, vonHoldt, 2012). Кластеризацию проводили также отдельно для объединённых выборок из озёр БЛ и МЛ (для K = 1 − 6) в условиях той же модели как с независимыми, так и со скоррелированными частотами аллелей. Результаты кластеризации для K = 6 (общий анализ) и K = 2 (только озёра Леприндо) визуализировали с помощью программы CLUMPAK (Kopelman et al., 2015).
РЕЗУЛЬТАТЫ
Сроки, места и особенности нереста. В оз. БЛ карликовая форма нерестится в его юго-западной части в заливе и в прилегающей к нему открытой акватории недалеко от устья р. Половинка (рис. 1б). В конце июня, после освобождения озера ото льда, начинается подход производителей к нерестилищу, их численность в уловах невелика (рис. 2) − по всем сетям на глубине >25 м в среднем 0.06 экз/м2 сети за ночь (рис. 2а). Среди них имеются отдельные текучие самцы; текучие и отнерестившиеся самки в уловах отсутствуют (рис. 3), однако в желудках пойманных здесь налимов (двух из пяти вскрытых) отмечена икра гольца, что свидетельствует о начале нереста. С начала июля численность гольцов резко возрастает, в июле и августе усреднённые по всем сетям уловы достигают соответственно 0.37 и 0.42 экз/м2 сети за ночь (рис. 2а). В эти два месяца происходит массовый нерест в профундальной зоне на глубине 25−58 м (рис. 2в), возможно, и на большей. Дно на этих глубинах покрыто тёмно-серым илом, который является единственным доступным нерестовым субстратом. В уловах преобладают текучие производители (рис. 3а, 3б), численно доминируют самцы (79−84%) (рис. 4). В профундальной зоне резко снижается численность сига-пыжьяна, почти полностью вытесняемого гольцами из района нерестилища, хотя в другие месяцы он здесь численно доминирует (рис. 5). В разные годы численность гольца на нерестилище была сходной: уловы в сети с ячеёй 18−20 мм на глубине >25 м в июле−августе 2013, 2015−2017 гг. в среднем составляли 0.22−0.29 экз/м2 сети за ночь.
Рис. 2.
Уловы карликовой формы арктического гольца Salvelinus alpinus в озёрах Леприндо на глубине >25 м в разные месяцы (а, б) и на разных глубинах в
период максимальной нерестовой активности (в): а – Большое Леприндо (БЛ), б – Малое
Леприндо (МЛ), в − БЛ в июле−августе, МЛ в январе−марте. Размер ячеи сетей в БЛ: ( ) − 12 мм, (
) − 12 мм, ( ) – 14−16 мм, (◼) – 18−20 мм, (
) – 14−16 мм, (◼) – 18−20 мм, ( ) − все сети, 12−20 мм; в МЛ: (◻) − 16−20 мм.
) − все сети, 12−20 мм; в МЛ: (◻) − 16−20 мм.
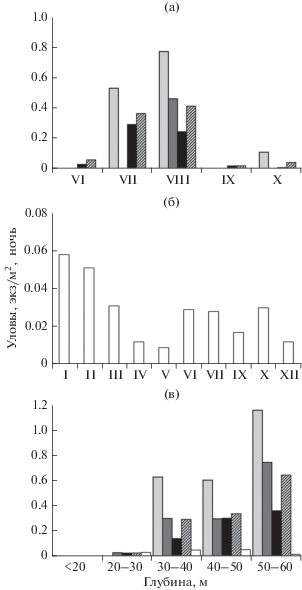
Рис. 3.
Соотношение участвующих в нересте текущего года самок (а, в) и самцов (б, г) карликовой
формы арктического гольца Salvelinus alpinus с разным состоянием гонад в уловах на нерестилищах в озёрах Большое (а, б) и Малое
(в, г) Леприндо в разные месяцы: ( ) – созревающие и готовые к нересту особи (стадии зрелости гонад II−III, III, III−IV,
IV), (
) – созревающие и готовые к нересту особи (стадии зрелости гонад II−III, III, III−IV,
IV), ( ) – текучие (стадия V), (◼) – отнерестившиеся (стадия VI−II).
) – текучие (стадия V), (◼) – отнерестившиеся (стадия VI−II).
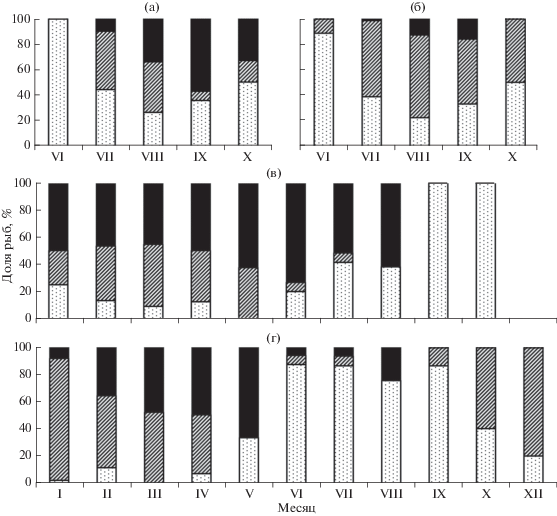
Рис. 4.
Соотношение самцов ( ) и самок (
) и самок ( ) карликовой формы арктического гольца Salvelinus alpinus в уловах из озёр Большое (а) и Малое (б) Леприндо в разные месяцы.
) карликовой формы арктического гольца Salvelinus alpinus в уловах из озёр Большое (а) и Малое (б) Леприндо в разные месяцы.
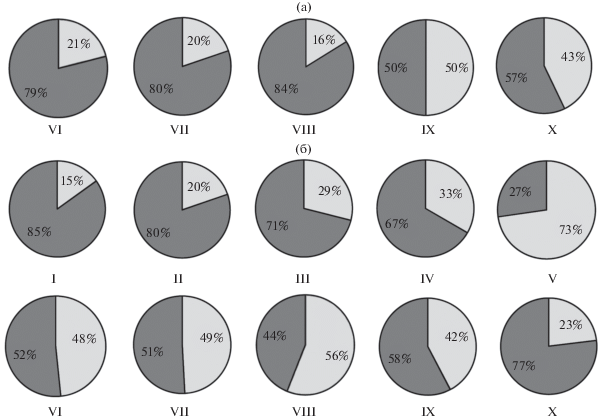
Рис. 5.
Соотношение карликовой формы арктического гольца Salvelinus alpinus ( ) и сига-пыжьяна Coregonus pidschian (◻) в уловах из озёр Большое (а) и Малое (б) Леприндо в разные месяцы.
) и сига-пыжьяна Coregonus pidschian (◻) в уловах из озёр Большое (а) и Малое (б) Леприндо в разные месяцы.
Отложенной икрой активно питаются налимы, в июле−сентябре она становится их основной пищей (рис. 6а, 6б; табл. 1). Характерно, что во многих икринках, извлечённых из желудков налимов, зародыши находились на продвинутых стадиях развития (рис. 6в), т.е. икра была съедена не в момент откладки, а намного позже. Так, с начала августа в желудках налима встречалась икра с зародышами на стадии пигментированного глазка, отложенная, судя по степени развития зародышей, в конце июня−начале июля, а в сентябре – отложенная в августе. Очевидно, икра откладывается не в укрытия (их нет за пределами каменистого берегового склона), а лежит открыто на поверхности ила или частично в него погружена. Наличие в желудках некоторых налимов большого количества икринок, находящихся на одной и той же стадии развития, свидетельствует о том, что производители откладывают икру компактными кладками, располагаясь непосредственно у дна, а не разбрасывают её дисперсно, находясь надо дном. В желудках гольцов собственная икра никогда не отмечалась.
Рис. 6.
Икра карликовой формы арктического гольца Salvelinus alpinus в желудках налимов Lota lota, пойманных на нерестилище этой формы в оз. Большое Леприндо (а, б), и икра с зародышами из желудка (в).

Таблица 1.
Питание налимов Lota lota, пойманных на нерестилищах карликовой формы арктического гольца Salvelinus alpinus в озёрах Большое и Малое Леприндо
| Компонент пищи и другие показатели | Большое Леприндо (июль−сентябрь) | Малое Леприндо (апрель) | ||
|---|---|---|---|---|
| Частота встречаемости, % | Доля массы пищи, % | Частота встречаемости, % | Доля массы пищи, % | |
| Икра арктического гольца | 82.61 | 85.09 | 25.00 | 6.27 |
| Икра сига-пыжьяна | – | – | 18.75 | 9.71 |
| Рыба | 17.39 | 13.64 | 68.75 | 63.40 |
| Водные беспозвоночные | 26.09 | 1.18 | 62.50 | 19.14 |
| Прочее | 17.39 | 0.09 | 37.50 | 1.48 |
| Доля пустых желудков, % | 8.7 | 20.0 | ||
| Число рыб, экз. | 23 | 20 | ||
В сентябре массовый нерест заканчивается, бóльшая часть гольцов покидает нерестилище, их уловы в сентябре−октябре снижаются до 0.02−0.04 экз/м2 сети за ночь, соотношение полов становится равным. Однако до конца октября встречаются отдельные текучие и неотнерестившиеся самцы и самки. В ноябре лов на нерестилище не проводили, а в восточной части озера уловы гольца составили 0.009 экз/м2 сети (18−20 мм) за ночь (только отнерестившиеся особи); в феврале и марте в результате ограниченного лова на нерестилище были пойманы лишь сиги.
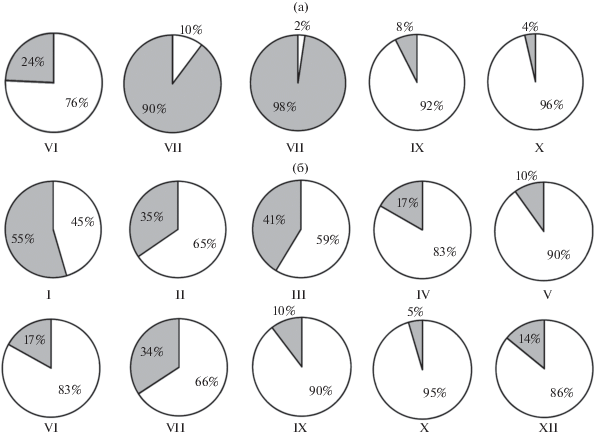
В оз. МЛ у карликовой формы нерест сильно растянутый. Текучие самки отмечены с января (возможно, встречаются и раньше, но малочисленные ноябрьская и декабрьская выборки представлены только самцами) по июль (рис. 3в), текучие самцы – во все месяцы, за исключением мая (очевидно, результат малочисленности выборки) и августа (рис. 3г), в том числе в ноябре (данные на рис. 3г не приведены). Пик нереста приходится на январь−март, когда наблюдается наибольшая численность текучих производителей; наибольшие уловы отмечены в январе−феврале (рис. 2б). К апрелю интенсивность нереста снижается, а к августу он, видимо, заканчивается. Однако уже в сентябре вновь начинают встречаться текучие самцы, а в октябре их доля в уловах резко возрастает в связи с приближением следующего нереста. Размножение происходит вдоль северо-западного и юго-восточного берегов на береговом свале, как и в оз. БЛ, на глубине >25 м, в основном 30−50 м (рис. 2в), на илистом субстрате. Наибольшие концентрации производителей обнаружены у юго-восточного берега в 3 км от восточной оконечности озера (рис. 1в). Нерест не носит массового характера, численность производителей на этом нерестилище невысока: на пике нереста на оптимальных глубинах уловы примерно в шесть раз меньше, чем в БЛ (рис. 2б). В январе−марте и октябре самцы составляют 71−85% уловов, в апреле и июне−сентябре – 44−67%, в мае – 27% (видимо, оценка занижена из-за малочисленности выборки) (рис. 4б). В ноябре и декабре были пойманы только самцы. Во все сезоны на нерестилище присутствуют сиги (рис. 5б), составляющие в январе−марте и в июле 45−66% уловов, а в остальные месяцы − 83−95%. В желудках пойманных здесь налимов также обнаружена икра гольца, её доля в питании налимов меньше, чем в БЛ, в соответствии с более низкой численностью нерестящихся гольцов. Одновременно налим поедает здесь и икру гораздо более многочисленного сига, нерестовые площади которого расположены поблизости либо, возможно, территориально перекрываются с нерестилищами гольца (табл. 1).
Репродуктивные параметры. Отдельные самцы и самки карликовой формы в оз. БЛ впервые созревают в возрасте трёх (самки единично), в оз. МЛ – четырёх лет, основная их часть в обоих озёрах на год позже. Достигшие половой зрелости рыбы нерестятся ежегодно, подавляющее большинство гольцов в выборках (БЛ – 98.8%, МЛ – 96.2%), судя по состоянию гонад, нерестились или должны были нереститься в год поимки. При максимальной продолжительности жизни в оз. БЛ 12 лет, в оз. МЛ 14 лет (Alekseyev et al., 2013), одна и та же особь может принимать участие в нересте 9−11 сезонов, но обычно, вероятно, 5−6. В соответствии с меньшими размерами самок их индивидуальная абсолютная плодовитость (ИАП) в оз. БЛ меньше, чем в оз. МЛ, индивидуальная относительная плодовитость (ИОП) в двух озёрах сходна, сходен и диаметр зрелых ооцитов. В оз. БЛ коэффициент зрелости готовых к нересту (IV стадия зрелости гонад) самок меньше, а самцов больше, чем в оз. МЛ (табл. 2).
Таблица 2.
Репродуктивные параметры карликовой и крупной формы арктического гольца Salvelinus alpinus из озёр Большое и Малое Леприндо
| Озеро | Длина самок, мм | Масса самок, г | Плодовитость | Диаметр, мм | Коэффициент зрелости (IV стадия зрелости гонад), % | Источник информации | |||
|---|---|---|---|---|---|---|---|---|---|
| абсолютная, шт. | относительная, шт/г | зрелых ооцитов | набухших икринок* | самки | самцы | ||||
| Карликовая форма | |||||||||
| Большое Леприндо | $\frac{{127{\kern 1pt} - {\kern 1pt} {{{189}}^{1}}}}{{152\left( {63} \right)}}$ | $\frac{{18{\kern 1pt} - {\kern 1pt} 46}}{{30\left( {61} \right)}}$ | $\frac{{63{\kern 1pt} - {\kern 1pt} 187}}{{109\left( {63} \right)}}$ | $\frac{{2.0{\kern 1pt} - {\kern 1pt} 6.1}}{{3.8\left( {61} \right)}}$ | $\frac{{2.5{\kern 1pt} - {\kern 1pt} 4.6}}{{3.6\left( {81} \right)}}$ | $\frac{{3.7{\kern 1pt} - {\kern 1pt} 5.2}}{{4.16{\kern 1pt} - {\kern 1pt} 4.86(7)}}$ | $\frac{{5.5{\kern 1pt} - {\kern 1pt} 23.8}}{{12.5\left( {28} \right)}}$ | 1.5−7.1 4.0 (60) |
Наши данные |
| Малое Леприндо | $\frac{{146{\kern 1pt} - {\kern 1pt} {{{200}}^{1}}}}{{179\,(18)}}$ | $\frac{{33{\kern 1pt} - {\kern 1pt} 75}}{{51\,(17)}}$ | $\frac{{104{\kern 1pt} - {\kern 1pt} 325}}{{182\,(18)}}$ | $\frac{{2.4{\kern 1pt} - {\kern 1pt} 5.6}}{{3.6\,(17)}}$ | $\frac{{3.1{\kern 1pt} - {\kern 1pt} 4.4}}{{3.5\,(41)}}$ | – | $\frac{{10.8{\kern 1pt} - {\kern 1pt} 19.7}}{{15.1\left( {13} \right)}}$ | $\frac{{1.0{\kern 1pt} - {\kern 1pt} 4.7}}{{2.7\left( {27} \right)}}$ | То же |
| Крупная форма | |||||||||
| Малое Леприндо | $\frac{{335{\kern 1pt} - {\kern 1pt} {{{400}}^{2}}}}{{376\,(6)}}$ | $\frac{{480{\kern 1pt} - {\kern 1pt} 750}}{{618\,(6)}}$ | $\frac{{772{\kern 1pt} - {\kern 1pt} 1056}}{{954\,(6)}}$ | $\frac{{1.4{\kern 1pt} - {\kern 1pt} 1.8}}{{1.6\,(6)}}$ | $\frac{{5.7{\kern 1pt} - {\kern 1pt} 6.3}}{ - }$ | – | – | – | Пронин, 1967; наш расчёт по данным Пронина (1967) |
| $\frac{{450{\kern 1pt} - {\kern 1pt} {{{612}}^{1}}}}{{546(3)}}$ | $\frac{{800{\kern 1pt} - {\kern 1pt} 2220}}{{1620\,(3)}}$ | $\frac{{1484{\kern 1pt} - {\kern 1pt} 4200}}{{2935\,(3)}}$ | $\frac{{1.7{\kern 1pt} - {\kern 1pt} 1.9}}{{1.8\,(3)}}$ | $\frac{{4.4{\kern 1pt} - {\kern 1pt} 4.9}}{{4.7\,(5)}}$ | – | – | – | Савваитова и др., 1981б; наш расчёт по данным К.А. Савваитовой и В.А. Максимова | |
Раннее развитие. Показатель оплодотворения во всех сериях был низким и не превышал 40−60%; неоплодотворённая икра массово погибала по истечении 2 мес. инкубации и позже. Продолжительность развития от оплодотворения до вылупления в серии 1 составила 3.4−3.6 мес., в серии 2 − 3.8−4.2 мес., в серии 3 − 3.1−3.7 мес., в сериях 4 и 5 − 2.9−3.8 мес.
Вылупление в тепловодной серии 1 происходило в диапазоне 543−579 градусо-дней, в холодноводной серии 2 – 415−499 градусо-дней. Заполнение воздухом плавательного пузыря у личинок из серий 1, 4 и 5 наблюдали в возрасте ~2 мес., из серии 2 – ~2.7 мес. Переход на внешнее питание наблюдали при начальном кормлении смесью планктонных рачков за несколько суток до заполнения плавательного пузыря, а при начальном кормлении остракодами или мелкими личинками хирономид – вскоре после этого.
Температурный режим серии 3 оказался неблагоприятным для развития эмбрионов. Оно происходило, по-видимому, с большими энергетическими потерями. Наблюдали высокую смертность при абортивном вылуплении и малые размеры свободных эмбрионов (FL 12.5−14.0 против 14.5−17.0 мм в остальных сериях); зародыши не смогли перейти к смешанному питанию и погибли, достигнув FL 15.5−16.1 мм в возрасте 60−87 сут. Икра из желудков налимов, отложенная предположительно в конце июня−начале июля 2014 г., развивалась ~3.5−4.5 мес., вылупление эмбрионов FL 13−14 (13.75) мм происходило с 15 октября по 12 ноября. Они также не перешли к этапу смешанного питания и погибли в возрасте 23−34 сут.
В 2015 г. наименьшую смертность икры наблюдали на глубинах 30 и 40 м, в 2016 г. − 20−50 м (табл. 3). Более высокая смертность икры на одинаковых глубинах в 2015 г., очевидно, связана с большей длительностью эксперимента и с тем, что в 2016 г. не учитывали икру, погибшую за первую неделю инкубации, предшествовавшую эксперименту.
Таблица 3.
Смертность икры карликовой формы арктического гольца Salvelinus alpinus из оз. Большое Леприндо при экспериментальной инкубации на разных глубинах
| Глубина, м |
Температура воды, °С1 | 2015 г.2 | 2016 г.3 | ||
|---|---|---|---|---|---|
| Число икринок, шт. | Смертность, % | Число икринок, шт. | Смертность, % | ||
| 5 | 10.6−16.1 (13.8) | – | – | 60 | 100.0 |
| 10 | 7.6−15.1 (10.1) | – | – | 60 | 83.3 |
| 20 | 6.6−10.2 (7.7) | 29 | 41.4 | 60 | 6.7 |
| 30 | 5.6−6.6 (6.1) | 56 | 21.4 | 60 | 10.0 |
| 40 | 4.6−6.2 (5.3) | 148 | 20.3 | 60 | 1.7 |
| 50 | 5.1−5.6 (5.3) | – | – | 60 | 10.0 |
Температура воды. По данным автономных регистраторов температуры, озёра БЛ (рис. 7а, 7б) и МЛ (рис. 7в, 7г) имеют сходный температурный режим. После замерзания в ноябре до февраля на всех глубинах наблюдается стабильно низкая температура, имеет место обратная термическая стратификация. Среднемесячная температура воды последовательно увеличивается с глубины 5 до 50 м от 0.6−2.6 до 3.0−3.1°С. В марте−апреле начинается прогрев воды вследствие проникновения сквозь лёд солнечного излучения, и к маю–июню устанавливается весенняя гомотермия со среднемесячной температурой 4.0−4.4°С на всех глубинах. В июне, после освобождения озёр ото льда, начинается подъём температуры воды, приводящий к прямой термической стратификации. При этом с глубиной температура воды и амплитуда её колебаний снижаются, а температурный пик смещается на более позднее время. Температура на глубине 5 м достигает максимума в июле (в среднем 15.2−15.8°С), на глубине 50 м – в сентябре−октябре (5.5−5.8°С). После достижения пика происходит падение и выравнивание температуры от поверхности к нижележащим слоям, достигающее нижних слоёв в середине октября, когда устанавливается осенняя гомотермия, предшествующая ледоставу.
Рис. 7.
Сезонные изменения температуры воды в озёрах Большое (а, б) и Малое (в, г) Леприндо
на разных глубинах (по данным автономных регистраторов температуры, выставленных в
толще воды (а, в) и у дна (б, г) в 2013−2017 гг.). Среднесуточные (линии) и среднемесячные
(значки) значения температуры на глубинах: (- - -⚪- - -) – 5 м, (—◻—) – 10 м, (···△···)
– 20 м, (···◇···) – 25 м, (· - · - · - · -) – 30 м, (- - -
· - · -) – 30 м, (- - - - - -) – 40 м, (—
- - -) – 40 м, (—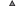 —) – 50 м.
—) – 50 м.
В обоих озёрах на глубине >25 м температура воды в течение года не превышает 8−9°С и подходит для нереста гольца, учитывая сроки развития икры и личинок, в любой сезон, а на глубине <20 м – только осенью и зимой. На глубине >25 м в оз. БЛ нерест карликовой формы проходит при повышении температуры воды с 4.5−5.5°С в конце июня−начале июля до 6.0−6.5°С в конце сентября и дальнейшем её понижении до 4.0−4.5°С в конце октября; заканчивается, видимо, при 2.5−3.0°С в начале ноября. В оз. МЛ с января по апрель нерест проходит при стабильной температуре 2.0−3.5°С, затем при её повышении до 4.5−6.0°С в июле. Пик нереста в БЛ и МЛ приходится на диапазоны температуры соответственно 5.0−6.0° и 2.5−3.0°С.
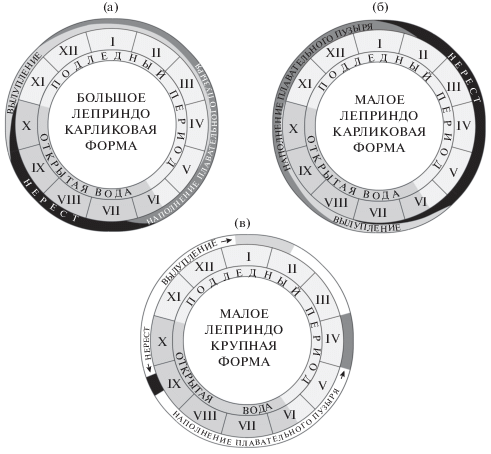
На основании показаний регистраторов температуры и экспериментальных данных о продолжительности развития икры и личинок карликовой формы из БЛ можно приблизительно оценить продолжительность развития икры, а также сроки вылупления и развития личинок в природе. При этом следует иметь в виду, что для МЛ эти оценки основаны на предположении о сходном темпе развития икры и личинок карликовой формы в двух озёрах. Икра, отложенная в период максимальной нерестовой активности в БЛ (июль−август), развивается 3.0−3.5 мес., в МЛ (январь−март) – ориентировочно 4.0−4.5 мес., продолжительность развития икры, отложенной позже, в БЛ увеличивается, а в МЛ сокращается. Учитывая растянутые сроки нереста, в оз. БЛ вылупление предличинок продолжается с конца сентября−начала октября до середины мая (рис. 8а), в оз. МЛ − с начала июня до конца октября (рис. 8б), а заполнение плавательного пузыря воздухом (после чего они могут покинуть нерестилище) – соответственно с начала декабря до начала июля и с начала августа до начала февраля, т.е. до наступления следующего нерестового сезона. Таким образом, в БЛ и МЛ икра, отложенная в начале нереста, развивается до вылупления соответственно при 5.0−6.5 и 2.0−3.5°С; но чем ближе к концу нереста она отложена, тем сильнее сроки её развития захватывают в первом холодный зимний, а во втором тёплый летний периоды. В результате растянутого нереста общие температурные диапазоны развития икры и предличинок до заполнения пузыря в двух озёрах практически полностью перекрываются − от 2.0−2.5 до 7.5−8.0°С.
Рис. 8.
Календарные схемы нереста и событий раннего онтогенеза карликовой (а, б) и крупной (в) формы арктического гольца Salvelinus alpinus в озёрах Большое (а) и Малое (б, в) Леприндо.
мтДНК, микросателлиты. У всех девяти исследованных гольцов карликовой формы из оз. МЛ обнаружен гаплотип контрольной области мтДНК SIB21 – тот же самый, который был ранее отмечен у всех гольцов из озёр бассейна верхнего течения р. Чара, включая карликовых из оз. БЛ (Alekseyev et al., 2009). Он же найден у двух крупных гольцов из МЛ, а у остальных четырёх – новый гаплотип SIB34, отличающийся от SIB21 на одну мутацию. Различия в частотах гаплотипов между карликовыми гольцами из двух озёр таким образом отсутствуют, а между крупными и карликовыми как из МЛ, так и из БЛ (n = 16, Alekseyev et al., 2009) значимы (p = 0.0144, p = 0.0032).
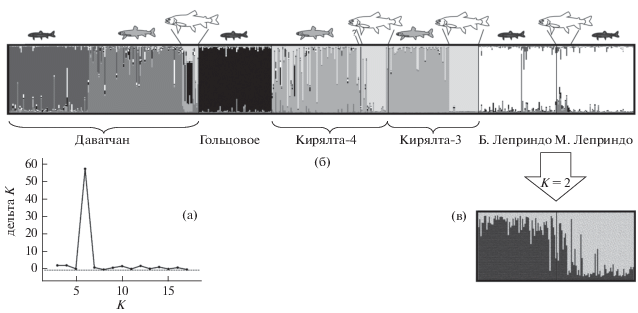
На консенсусном NJ-дереве, построенном по микросателлитным данным, карликовые гольцы из двух озёр объединяются друг с другом, а на следующем уровне – с крупными гольцами, все вместе образуя монофилетическую группу (рис. 9). По результатам байесовского анализа генетической подразделённости объединённого массива мультилокусных данных выборок из БЛ, МЛ и четырёх близлежащих озёр показано оптимальное число генетических единиц K = 6 (ΔK = 57.56, lnP(K) = –7895.64) (рис. 10а), а внутри системы Леприндо K = 2 (ΔK = 151.85, lnP(K) = –2546.45). При анализе данных по шести озёрам генотипы гольцов из БЛ и МЛ отнесены к одному кластеру (рис. 10б) (усреднённый коэффициент сходства Q = 0.904); при анализе данных только по гольцам БЛ и МЛ видны явные различия между гольцами карликовой формы из двух этих озёр (рис. 10в), а у гольцов крупной формы наблюдается сильное варьирование индивидуальных оценок Q.
Рис. 9.
Бескорневое консенсусное NJ-дерево арктических гольцов Salvelinus alpinus из озёр Забайкалья, построенное по величинам хорд-дистанций (DCE, Cavalli-Sforza, Edwards, 1967), рассчитанным на основании данных по восьми микросателлитным локусам. Приведены названия озёр и обозначения форм гольца: D – карликовая, S – мелкая, L – крупная; вдоль ветвей − индексы бутстрэпа (>50%).
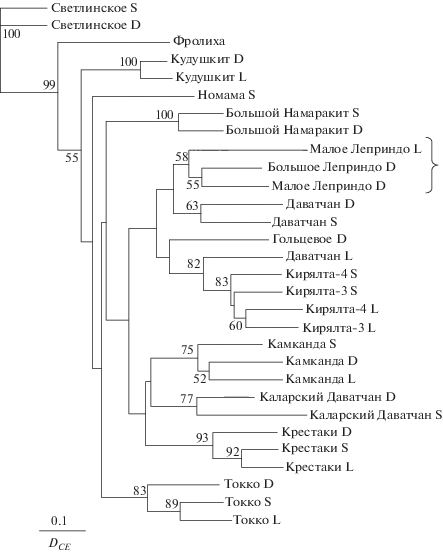
Рис. 10.
Результат определения наиболее вероятного числа генетических единиц K (по: Evanno et al., 2005) на основании байесовского анализа объединенных мультилокусных микросателлитных данных выборок арктических гольцов из шести озёр бассейна р. Чара (Забайкалье) в программе STRUCTURE (а) и графическая визуализация результатов кластеризации при K = 6 (6 озёр) (б) и K = 2 (Большое и Малое Леприндо) (в). Секции столбцов с разной заливкой соответствуют шести наиболее вероятным генетическим кластерам при K = 6 и двум наиболее вероятным кластерам при K = 2. Размер секций отражает долю принадлежности индивидуальных генотипов к каждому из кластеров. Обозначения форм: тёмные рыбы – карликовая, серые – мелкая, светлые – крупная, (?) – особи с промежуточными морфологическими характеристиками.
ОБСУЖДЕНИЕ
В системе озёр Леприндо обнаружена уникальная комбинация форм арктического гольца с летним, осенним и впервые отмеченным в России зимне-весенним пиками нереста. Парапатрические карликовые гольцы из озёр БЛ и МЛ нерестятся в профундали на илистом субстрате, где круглый год сохраняется низкая температура воды, благоприятная для развития икры и личинок, но отсутствуют укрытия для них. Сроки нереста, несмотря на его растянутость (в БЛ > 4 мес., в МЛ > 6 мес.), в двух озёрах мало перекрываются, а его пики разнесены на полгода. Учитывая продолжительные сроки нереста, в обоих озёрах икра из кладок, отложенных в разное время и на разных глубинах, развивается при разных температурных режимах, но в оз. БЛ в среднем при более высокой температуре, чем в оз. МЛ. Гольцы исчезнувшей крупной формы, сосуществовавшие в обоих озёрах с гольцами карликовой, нерестились в сжатые сроки в сентябре на ограниченном участке крутого каменистого берегового склона восточной части оз. МЛ в районе впадения холодных фреатических ключей. В 1963 г. нерест продолжался с 15 по 25 сентября (Пронин, 1967); в 1978 г. мы ловили здесь текучих самцов 7 сентября на глубине 10−15 м. Дно на этом участке покрыто камнями до глубины 20−22 м. Перед нерестом наблюдалась миграция крупных гольцов из БЛ в МЛ через протоку (Заплатин, 1964; Пронин, 1966). Это указывает на то, что здесь совместно нерестились крупные гольцы из обоих озёр и даёт основания считать вслед за Прониным (1967), что они составляли единое стадо. Самцы и самки крупной формы, по данным Пронина (1967), впервые созревали в возрасте 5−6 лет, ИАП самок TL 335−400 мм и массой 480−750 г составляла 772−1056 (954) икринок, диаметр зрелых ооцитов − 5.7−6.3 мм. ИОП, вычисленная по данным, приведённым в этой работе, − 1.4−1.8 (1.6) икринок/г массы тела самки (табл. 2). По данным Савваитовой с соавторами (1981б), возраст созревания самцов и самок составляет 9 лет, ИАП самок FL 45−61 см и массой 800−2220 г − 1484−4200 (2935) икринок, ИОП, вычисленная по данным, предоставленным К.А. Савваитовой и В.А. Максимовым, − 1.7−1.9 (1.8) шт/г, средний диаметр ооцитов − 4.7 мм. Исключение составила одна самка FL 370 мм, имевшая очень низкую ИАП (346 икринок) и мелкую икру (3.9 мм). Нерест, насколько можно судить по ограниченным данным, у большинства особей был ежегодным, так как в выборках 1977−1978 гг. все особи в возрасте 9 лет и старше (кроме одной) имели в августе−сентябре зрелые гонады. Икра развивалась в не доступных для питающихся ею рыб щелях между камнями. Во время нереста крупной формы в оз. МЛ на глубине 10−15 м температура воды составляла ~7−8°С (не исключено, что в зоне выходов фреатических ключей температура была ниже), икра начинала развиваться при быстром снижении температуры до 1.5−2.5°С, дальнейшее её развитие, а также всё развитие личинок до заполнения плавательного пузыря воздухом происходило при этих стабильно низких значениях температуры. При условии, что икра и личинки развивались примерно так, как у карликовой формы из БЛ, вылупление происходило приблизительно с I декады января по I декаду февраля, заполнение плавательного пузыря воздухом – в апреле (рис. 8в).
По нашим и литературным (Swift, 1965; Jungwirth, Winkler, 1984; Gillet, 1991) данным, верхний температурный предел для нормального развития икры арктического гольца составляет 8°С. Как показывают проведённые в 2015 и 2016 гг. в оз. БЛ эксперименты, на глубине 5−10 м, где средние за период инкубации икры значения температуры воды лежат в пределах 10−14°С, погибает вся или почти вся икра (табл. 3). На глубине 20 м, где средняя температура воды приближается к 8°С, а максимальная достигает 10°С, выживает бóльшая часть икры, но смертность сильно варьирует между годами даже с учётом разницы в условиях эксперимента. Наименьшая же смертность в оба года отмечена на глубинах 30 м и более при средних значениях температуры 5−6°С. С другой стороны, отрицательные результаты инкубации икры серии 3, чувствительные начальные стадии эмбриогенеза которой проходили при температуре 1°С, а органогенез – при 1−4°С, видимо, указывают на то, что и низкая температура во время критических периодов развития оказывает неблагоприятное воздействие на эмбриогенез карликовой формы из оз. БЛ. Таким образом, можно предполагать его специализацию к температуре 5−6°С.
Учитывая время развития икры и личинок до заполнения плавательного пузыря воздухом, а также динамику температуры воды на разных глубинах, нерест карликовых гольцов в обоих озёрах в характерные для них сроки на глубине <20 м был бы неэффективен. В БЛ он привёл бы к гибели значительной части икры, а в МЛ − к гибели личинок, а также икры от позднего нереста во время летне-осеннего температурного пика. По той же причине нерест крупной формы в оз. МЛ на небольшой глубине оказался бы неэффективен весной и летом.
Нерест гольцов карликовой формы в озёрах БЛ и МЛ на илистом субстрате, где икра и личинки активно выедаются, приводит к жёсткому отбору на ранних стадиях их развития. Дополнительным негативным фактором является неблагоприятный кислородный режим (Павлов и др., 1990). Высокая смертность на этих стадиях компенсируется удвоением ИОП по сравнению с гольцами крупной формы. Это достигается за счёт уменьшения в ходе эволюции размеров икры до значений, приближающихся к наименьшим отмеченным у арктических гольцов – 3.2 мм (Smalås et al., 2017). Подобное уменьшение происходило независимо в разных популяциях арктического гольца: в частности, у глубоководных форм из озёр Аттерзее (Brenner, 1980), Фьелльфросватн (Klemetsen et al., 2003), весенненерестующей формы из оз. Уиндермир (Baroudy, Elliott, 1994), а в Забайкалье − у нерестящихся на илистом субстрате мелких гольцов из оз. Леприндокан (Павлов и др., 1990) и глубоководных карликовых гольцов из оз. Даватчан (Алексеев и др., 2000; Павлов, Осинов, 2008). Хотя не во всех случаях у арктического гольца такое уменьшение связано с глубоководностью, оно может рассматриваться как одно из характерных направлений эволюции глубоководных форм этого вида. Происходило оно и в эволюции другого вида гольцов – глубоководной длиннопёрой палии Световидова Salvelinus (Salvethymus) svetovidovi из оз. Эльгыгытгын, имеющей ИОП 1.8−4.7 (3.3) шт/г массы тела самки, диаметр икры 2−3 мм и нерестящейся на илистом грунте котловины озера (Черешнев, Скопец, 1993; Черешнев, 2008).
В некоторых озёрах на ареале наблюдается нерест арктического гольца весной или летом, но эти сроки не являются для него типичными. Весенний (или зимне-весенний) нерест известен у гольцов из оз. Уиндермир в Англии (Frost, 1965; Elliott, Baroudi, 1995) и Лох О (Awe) в Шотландии (Kettle-White, 2001; Garduño-Paz et al., 2012), у глубоководных карликов из оз. Фьелльфросватн (Klemetsen et al., 1997) и чёрных гольцов из оз. Каландсватнет (Telnes, Saegrov, 2004) в Норвегии. В каждом из упомянутых озёр весенненерестующая форма симпатрична с осенненерестующей. В России весенний нерест не отмечался. Летний нерест описан у крупных гольцов из альпийского оз. Аттерзее (Buresch, 1925) и крупных бентофагов из оз. Тингваллаватн в Исландии (Sandlund et al., 1992), а в России − у мелких гольцов из оз. Лабынкыр (Савваитова, 1991), боганидской и чёрной палий из оз. Лама (Савваитова и др., 1980; Павлов и др., 1999), карликовых гольцов из озёр Даватчан (Алексеев и др., 2000; Павлов, Осинов, 2008), Токко (наши данные) и Тунэрндэ (Алексеев, Кириллов, 2001). В некоторых популяциях Сибири нерест проходит в конце лета−начале осени: у крупных гольцов из оз. Лабынкыр (Савваитова, 1991), у гольцов из оз. Форелевое в дельте Лены (Савваитова, Максимов, 1980), пучеглазки из озёр Лама и Капчук (Савваитова и др., 1980; Павлов и др., 1999), боганидской палии из оз. Собачье (Павлов и др., 1994), короткотычиночных гольцов и тыптушки из оз. Хантайское (Романов, 1983). У глубоководных карликовых гольцов из озёр Аттерзее (Brenner, 1980) и норвежского Сирдальсватн (Hesthagen et al., 1995) нерест круглогодичный, в последнем − с пиком в июле−сентябре. На Чукотке среди гольцов, относящихся или предположительно относящихся к группе гольца Таранца, летний нерест отмечен у мелких глубоководных гольцов из оз. Северный Гитгынпильхин (Савваитова, Максимов, 1991), летне-осенний − у гольцов из озёр Каноль и Аргитхин (Гудков, 1993), а также у боганидской и малоротой палий из оз. Эльгыгытгын (Черешнев, Скопец, 1993).
Наиболее характерен для арктических гольцов осенний или осенне-зимний нерест (Johnson, 1980) на каменистом субстрате в литоральной зоне озёр, который обеспечивает наилучшие условия развития икры и личинок при оптимальных низких значениях температуры и в защищённых местах. Этот наиболее распространённый тип нереста, характерный и для крупной формы из оз. БЛ, можно считать предковым. Места и сама возможность нереста в другие сезоны определяются конкретными условиями водоёма – прежде всего, температурным режимом. В относительно тепловодных озёрах, к каким относятся расположенные на высоте <1000 м над уровнем моря озёра Леприндо, он возможен только в профундальной зоне (если она имеется), где круглый год сохраняется стабильно низкая температура, на единственно доступном в ней илистом субстрате. В этой зоне нерест может смещаться на конец зимы, весну или лето и быть очень растянутым, в крайнем варианте круглогодичным (Аттерзее, Сирдальсватн).
Обнаруженные различия по срокам, местам и особенностям нереста свидетельствуют об эффективной репродуктивной изоляции парапатрических карликовых гольцов из озёр БЛ и МЛ друг от друга и от симпатричной с ними крупной формы, подтверждаемой полученными ранее (Alekseyev et al., 2013) и в настоящем исследовании генетическими данными. По данным Алексеева с соавторами (Alekseyev et al., 2013), все три формы генетически различаются по микросателлитным маркерам; величина дифференциации между карликовыми гольцами из БЛ и МЛ (FST = 0.110) меньше, чем в парных сравнениях их с крупной формой из МЛ (соответственно 0.185 и 0.165); все оценки статистически значимы. Эти выводы подкрепляются выявленными в настоящей работе различиями в частотах гаплотипов мтДНК между карликовыми и крупными гольцами, а также байесовским анализом генетической кластеризации внутри системы озёр Леприндо, продемонстрировавшим различия карликовых гольцов из БЛ и МЛ. При этом результаты анализа изменчивости микросателлитных локусов с включением других популяций забайкальских озёр (рис. 9, 10) свидетельствуют о монофилетическом происхождении трёх форм как наиболее вероятном. При интерпретации результатов кластеризации в STRUCTURE следует учитывать ограничения мощности алгоритма для выявления истинной подраздёленности при имеющихся значительных различиях в размерах выборок (Puechmaille, 2016). В данном случае малочисленность выборок крупных гольцов из озёр МЛ и Даватчан, скорее всего, привела к недооценке истинного числа генетических единиц.
Можно полагать, что в конце плейстоцена возникшее на месте растаявшего ледника единое озеро Леприндо было заселено из расположенного ниже Чарского палеоозера осенненерестующим гольцом, который разделился в нём на крупную и карликовую формы. Первая, как более конкурентоспособная, вытеснила вторую из более кормной и предоставляющей оптимальные условия для нереста литоральной зоны в пелагическую и профундальную, где та освоила ресурсы зоопланктона и была вынуждена перейти к глубоководному нересту, сроки и продолжительность которого стали меняться. Видимо, уже тогда началось разделение карликовой формы на популяции верхней и нижней озёрных чаш, превратившихся позже в озёра МЛ и БЛ. Смещение сроков нереста карликовых гольцов в двух озёрах на разные сезоны, возможно, связано с конкуренцией за нерестилища на этапе симпатрии или с различной динамикой численности планктонных кормовых организмов, от которой зависят темп роста и сроки созревания производителей. После разделения озёр гольцы крупной формы остались единой популяцией и продолжали использовать нерестилище, оказавшееся в акватории оз. МЛ, а гольцы карликовой формы образовали две популяции, изолированные как темпорально (сформировавшимися различиями в сроках нереста), так и географически (вследствие образования мелководной протоки между озёрами, которая стала для этих глубоководных рыб труднопреодолимым препятствием). Сценарий дивергенции трёх форм гольца внутри системы озёр Леприндо подтверждается полученными нами данными об их монофилии, а обнаруженные различия нерестовых стратегий объясняют механизм формирования репродуктивной изоляции между ними.
БЛАГОДАРНОСТИ
Авторы благодарны Р.С. Андрееву, А.И. Вокину, И.Б. Книжину, В.К. Помазкину, И.И. Юрьеву и И.Г. Хорошеву (ИГУ), Е.Ф. Кирику, А.А. Соколову и Д.В. Щепоткину (ИБР РАН), А.Г. Осинову (МГУ), С.Д. Свиридову (ОАО Тепловодоканал, п.г.т. Н. Чара), Т.Н. Болотиной и А.М. Новикову (метеостанция “Большая Лепринда”), а также В.В., М.М. и Е.М. Пичугиным за помощь в сборе материала; В.А. Максимову и К.А. Савваитовой (МГУ) за переданные материалы; М.В. Мине (ИБР РАН) и двум анонимным рецензентам за ценные замечания по тексту рукописи.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 18-04-00092), Программы Президиума РАН № 17 “Эволюция органического мира. Роль и влияние планетарных процессов” и в рамках разделов госзадания ИБР РАН № 0108-2019-0007, ИПЭЭ РАН № 0109-2019-0076 (С.С. Алексеев), ИОГен РАН № 0112-2019-0001 (Н.В. Гордеева).
Список литературы
Алексеев С.С. 2016. Распространение, разнообразие и диверсификация арктических гольцов Salvelinus alpinus complex (Salmoniformes, Salmonidae) Сибири: Автореф. дис. … докт. биол. наук. М.: МГУ, 48 с.
Алексеев С.С., Кириллов А.Ф. 2001. Первая находка арктического гольца Salvelinus alpinus complex в бассейне Алдана и её значение для понимания истории расселения гольцов в Восточной Сибири // Вопр. ихтиологии. Т. 41. № 4. С.465−480.
Алексеев С.С., Матвеев А.Н., Пичугин М.Ю. и др. 2000. Биология гольцов Salvelinus alpinus complex (Salmonidae) из озер водораздела рек Куанда и Чара (северное Забайкалье) и изменения в структуре их популяций в связи с антропогенным влиянием (1977−1999 гг.) // Бюл. МОИП. Сер. биол. Т. 105. Вып. 4. С. 22−41.
Гордеева Н.В., Алексеев С.С., Кириллов А.Ф. и др. 2018. Распространение, состав и родственные отношения филогенетических групп арктического гольца Salvelinus alpinus (Salmonidae) в европейской части России и Сибири по данным анализа нуклеотидных последовательностей митохондриальной ДНК // Вопр. ихтиологии. Т. 58. № 6. С. 659−669.
Гудков П.К. 1993. О симпатричных формах гольцов рода Salvelinus из некоторых озёр Чукотского полуострова // Там же. Т. 33. № 5. С. 618−625.
Ендрихинский А.С. 1982. Последовательность основных геологических событий на территории Южной Сибири в позднем плейстоцене и голоцене // Поздний плейстоцен и голоцен юга Восточной Сибири. Новосибирск: Наука. С. 6−35.
Еникеев Ф.И. 1998. История развития восточной части Байкальской рифтовой зоны // Биоразнообразие водных систем Забайкалья. Видовая структура гидробиоценозов озёр и рек горных территорий. Новосибирск: Изд-во СО РАН. С. 5−20.
Еникеев Ф.И. 2009. Плейстоценовые оледенения Восточного Забайкалья и юго-востока Средней Сибири // Геоморфология. № 2. С. 33−49. https://doi.org/10.15356/0435-4281-2009-2-33-49
Заплатин М.А. 1964. Чара. С киноаппаратом по Забайкалью. М.: Мысль, 144 с.
Матвеев А.Н., Самусенок В.П., Юрьев А.Л. 2004. Ихтиофауна горных озёр северной части Байкальской рифтовой зоны и её изменения в результате антропогенного воздействия // Матер. I Междунар. симп. “Байкал. Современное состояние поверхностной и подземной гидросферы горных стран”. Новосибирск: Наука. С. 181−188.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. 1974. М.: Наука, 254 с.
Музис А.И. 1982. Среднечетвертичный озёрный водоем Чарской впадины // Мезозойские и кайнозойские озёра Сибири. Новосибирск: Наука. С. 125−138.
Павлов Д.А., Осинов А.Г. 2008. Размножение и развитие карликовой формы арктического гольца Salvelinus alpinus из озера Даватчан (Забайкалье) // Вопр. ихтиологии. Т. 48. № 1. С. 102−119.
Павлов Д.А., Пичугин М.Ю., Савваитова К.А. 1990. Размножение и развитие даватчана Salvelinus alpinus erythrinus и проблема разнообразия особенностей воспроизводства у арктических гольцов // Там же. Т. 30. № 6. С. 941−956.
Павлов Д.А., Пичугин М.Ю., Савваитова К.А. 1993. К проблеме формирования жизненной стратегии у арктических гольцов рода Salvelinus // Там же. Т. 33. № 6. С. 753−762.
Павлов Д.С., Савваитова К.А., Груздева М.А. и др. 1999. Разнообразие рыб Таймыра: систематика, экология, структура видов как основа биоразнообразия в высоких широтах, современное состояние в условиях антропогенного воздействия. М.: Наука, 208 с.
Павлов С.Д., Савваитова К.А., Максимов В.А. 1994. О взаимоотношениях симпатрических группировок арктических гольцов в озере Собачье (Норило-Пясинская водная система) // Систематика, биология и биотехника разведения лососевых рыб. СПб.: Изд-во ГосНИОРХ. С. 148−151.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 324 с.
Пронин Н.М. 1966. Паразиты рыб водоемов Чарской котловины (Забайкальский север) // Вопросы географии и биологии. Чита: Изд-во ЧитГПИ. С. 120−159.
Пронин Н.М. 1967. О биологии даватчана и восточно-сибирского сига Куандо-Чарского водораздела // Уч. зап. Иркут. пед. ин-та. Сер. биол. Вып. 24. Ч. 1. С. 59−68.
Пронин Н.М. 1977. Рыбы Верхнечарской котловины (Забайкальский север) // Тр. Бурят. ИЕН БФ СО АН СССР. Т. 15. С. 110−140.
Романов В.И. 1983. Экологическая структура гольцов (р. Salvelinus) Хантайского озера // Вопр. географии Сибири. Вып. 14. С. 73−88.
Савваитова К.А. 1989. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат, 223 с.
Савваитова К.А. 1991. К проблеме симпатрических форм у гольцов рода Salvelinus (Salmonidae) из водоемов Восточной Сибири // Биологические проблемы Севера. Биология гольцов Дальнего Востока. Владивосток: Изд-во ДВО АН СССР. С. 5−20.
Савваитова К.А., Максимов В.А. 1980. Формообразование у гольцов рода Salvelinus (Salmoniformes, Salmonidae) из озер дельты Лены // Зоол. журн. Т. 59. № 12. С. 1820−1830.
Савваитова К.А., Максимов В.А. 1991. О симпатрических формах гольцов рода Salvelinus (Salmonidae) из Пегтымельских озер Чукотки // Биологические проблемы Севера. Биология гольцов Дальнего Востока / Под ред. Черешнева А.И., Глубоковского М.К. Владивосток: Изд-во ДВО АН СССР. С. 37−56.
Савваитова К.А., Максимов В.А., Нестеров В.Д. 1980. К систематике и экологии гольцов рода Salvelinus (сем. Salmonidae) водоемов полуострова Таймыр // Вопр. ихтиологии. Т. 20. Вып. 2. С. 195−210.
Савваитова К.А., Максимов В.А., Кобылянский С.Г. 1981а. Ихтиофауна озер Куандо-Чарского водораздела (Северное Забайкалье) // Эколого-фаунистические исследования. Биологические ресурсы территории в зоне строительства БАМ. М.: Изд-во МГУ. С. 103−118.
Савваитова К.А., Максимов В.А., Мережин В.К. 1981б. Гольцы рода Salvelinus (Salmonidae, Salmoniformes) Куандо-Чарских горных озер Забайкалья // Там же. С. 119−166.
Томилов А.А. 1954. Материалы по гидробиологии некоторых глубоководных озёр Олёкмо-Витимской горной страны // Тр. ИркутГУ. Сер. биол. Т. 11. С. 5−85.
Черешнев И.А. 2008. Пресноводные рыбы Чукотки. Магадан: Изд-во СВНЦ ДВО РАН, 324 с.
Черешнев И.А., Скопец М.Б. 1993. Биология гольцовых рыб озера Эльгыгытгын // Биологические проблемы Севера. Природа впадины озера Эльгыгытгын (проблемы изучения и охраны). Магадан: Изд-во СВКНИИ ДВО РАН. С. 105−127.
Alekseyev S.S., Bajno R., Gordeeva N.V. et al. 2009. Phylogeography and sympatric differentiation of the Arctic charr Salvelinus alpinus (L.) complex in Siberia as revealed by mtDNA sequence analysis // J. Fish Biol. V. 75. P. 368–392. https://doi.org/10.1111/j.1095?8649.2009.02331.x
Alekseyev S.S., Gordeeva N.V., Samusenok V.P. et al. 2013. Extant and extinct forms of Arctic charr Salvelinus alpinus (L.) complex from the Leprindo lake system (Transbaikalia): differentiation in life history, morphology, and genetics // J. Ichthyol. V. 53. № 10. P. 792−803. https://doi.org/10.1134/S0032945213100020
Balon E.K. 1980. Comparative ontogeny of charrs // Charrs: salmonid fishes of the genus Salvelinus. Perspectives in vertebrate science 1 / Ed. Balon E.K. The Hague: Dr. W. Junk Publ. P. 703−720.
Baroudy E., Elliott J.M. 1994. Racial differences in eggs and juveniles of Windermere charr, Salvelinus alpinus // J. Fish Biol. V. 45. P. 407–415. https://doi.org/10.1111/j.1095-8649.1994.tb01323.x
Brenner T. 1980. The Arctic charr, Salvelinus alpinus salvelinus, in the prealpine Attersee, Austria // Charrs: salmonid fishes of the genus Salvelinus. Perspectives in vertebrate science 1 / Ed. Balon E.K. The Hague: Dr. W. Junk Publ. P. 765−772.
Buresch R. 1925. Studien am Seesaibling mehrerer Alpenseen // Z. Fisch. V. 23. P. 99−109.
Cavalli-Sforza L.L., Edwards W.F. 1967. Phylogenetic analysis: models and estimation procedures // Evolution. V. 32. P. 550–570. https://doi.org/10.1111/j.1558-5646.1967.tb03411.x
Earl D.A., Holdt B.M., von. 2012. Structure harvester: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Cons. Gen. Resour. V. 4. № 2. P. 359−361. https://doi.org/10.1007/s12686-011-9548-7
Elliott J.M., Baroudi E. 1995. The ecology of Arctic charr, Salvelinus alpinus, and brown trout, Salmo trutta, in Windermere (northwest England) // Nord. J. Freshw. Res. V. 71. P. 33−48.
Evanno G., Regnaut S., Gould J. 2005. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study // Mol. Ecol. V. 14. P. 2611–2620.
Felsenstein J. 2004. PHYLIP: Phylogeny inference package. Ver. 3.4. Dept. Genome Sci. Biol. Univ. Wash. Seattle. WA. USA. (http://evolution.gs.washington.edu/phylip/software.html)
Frost W.E. 1965. Breeding habits of Windermere charr Salvelinus willughbii (Günther), and their bearing on speciation of these fish // Proc. Roy. Soc. V. 163B. P. 232−284.https://doi.org/10.1098/rspb.1965.0070
Garduño-Paz M.V., Adams C.E., Verspoor E. et al. 2012. Convergent evolutionary processes driven by foraging opportunity in two sympatric morph pairs of Arctic charr with contrasting post-glacial origins // Biol. J. Linn. Soc. V. 106. P. 794−806.https://doi.org/10.1111/j.1095-8312.2012.01906.x
Gillet C. 1991. Egg production in an Arctic charr (Salvelinus alpinus L.) brood stock: effects of temperature on the timing of spawning and the quality of eggs // Aquat. Liv. Resour. V. 4. P. 109−116.https://doi.org/10.1051/alr:1991010
Gordeeva N.V., Alekseyev S.S., Matveev A.N., Samusenok V.P. 2015. Parallel evolutionary divergence in Arctic charr Salvelinus alpinus (L.) complex from Transbaikalia: variation in differentiation degree and segregation of genetic diversity among sympatric forms // Can. J. Fish. Aquat. Sci. V. 72. P. 96−115.https://doi.org/10.1139/cjfas-2014-0014
Hesthagen T., Hindar K., Jonsson B., Ousdal J.Ø. 1995. Effects of acidification on normal and dwarf Arctic charr Salvelinus alpinus in a Norwegian lake // Biol. Conserv. V. 74. P. 115−123.https://doi.org/10.1016/0006-3207(95)00020-5
Johnson L. 1980. Arctic charr // Charrs: salmonid fishes of the genus Salvelinus. Perspectives in vertebrate science 1 / Ed. Balon E.K. The Hague: Dr. W. Junk Publ. P. 15−98.
Jonsson B., Jonsson N. 2001. Polymorphism and speciation in Arctic charr // J. Fish Biol. V. 58. P. 605−638.https://doi.org/10.1111/j.1095-8649.2001.tb00518.x
Jungwirth M., Winkler H. 1984. The temperature dependence of embryonic development of grayling (Thymallus thymallus), Danube salmon (Hucho hucho), Arctic charr (Salvelinus alpinus) and brown trout (Salmo trutta fario) // Aquaculture. V. 38. P. 315−327. https://doi.org/10.1016/0044-8486(84)90336-3
Kettle-White A. 2001. New fish records: stoneloach, roach and a spring spawning Arctic charr population in Loch Awe, Argyll // Glasgow Naturalist. V. 23. P. 120−121.
Klemetsen A. 2013. The most variable vertebrate on Earth // J. Ichthyol. V. 53. № 10. P. 781−791. https://doi.org/10.1134/S0032945213100044
Klemetsen A., Amundsen P.-A., Knudsen R., Hermansen B. 1997. A profundal, winter-spawning morph of Arctic charr Salvelinus alpinus (L.) in lake Fjellfrøsvatn, northern Norway // Nord. J. Freshw. Res. V. 73. P. 13−23.
Klemetsen A., Amundsen P.-A., Dempson J.B. et al. 2003. Atlantic salmon Salmo salar L., brown trout Salmo trutta L., and Arctic charr Salvelinus alpinus (L.): a review of aspects of their life histories // Ecol. Freshw. Fish. V. 12. P. 1−59.https://doi.org/10.1034/j.1600-0633.2003.00010.x
Kopelman N.M., Mayzel J., Jakobsson M. et al. 2015. CLUMPAK: a program for identifying clustering modes and packaging population structure inferences across K // Mol. Ecol. Resour. V. 15. № 5. P. 1179−1191. https://doi.org/10.1111/1755-0998.12387
Miller M.P. 1997. Tools for population genetic analyses (TFPGA), version 1.3. A Windows program for the analysis of allozyme and molecular population genetic data // Dept. Biol. Sci. N. Arizona Univ., 33 p. (http://www.ccg.unam.mx/~vinuesa/tlem09/docs/TFPGADOC.PDF)
Pritchard J.K., Stephens M., Donnelly P. 2000. Inference of population structure using multilocus genotype data // Genetics. V. 155. P. 945–959.
Puechmaille S.J. 2016. The program STRUCTURE does not reliably recover the correct population structure when sampling is uneven: sub-sampling and new estimators alleviate the problem // Mol. Ecol. Res. V. 16. № 3. P. 608−627.
Raymond M.L., Rousset F. 1995. An exact test for population differentiation // Evolution. V. 49. P. 1280−1283.https://doi.org/10.1111/j.1558-5646.1995.tb04456.x
Sandlund O.T., Gunnarson K., Jonasson P.M. et al. 1992. The Arctic charr Salvelinus alpinus in Thingvallavatn // Oikos. V. 64. P. 305−351. https://doi.org/10.2307/3545056
Skúlason S., Kristjansson B.K. 2015. The origin and significance of reproductive isolation for processes of divergence // Evolutionary biology of the Atlantic salmon / Eds. Vladić T., Petersson E. Boca Raton: CRC Press, Taylor and Francis Group. P. 3−25.
Smalås A., Amundsen P.-A., Knudsen R. 2017. The trade-off between fecundity and egg size in a polymorphic population of Arctic charr (Salvelinus alpinus (L.)) in Skogsfjordvatn, subarctic Norway // Ecol. Evol. V. 7. P. 1−7. https://doi.org/10.1002/ece3.2669
Swift D.R. 1965. Effect of temperature on mortality and rate of development of the eggs of the Windermere charr (Salvelinus alpinus) // J. Fish. Res. Board Can. V. 22. № 4. P. 913−917.
Telnes T., Saegrov H. 2004. Reproductive strategies in two sympatric morphotypes of Arctic charr in Kalandsvatnet, west Norway // J. Fish Biol. V. 65. P. 574−579.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


