Вопросы ихтиологии, 2019, T. 59, № 4, стр. 473-482
Вкусовая привлекательность желчных веществ для рыб
А. О. Касумян 1, 2, *, М. И. Виноградская 1
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
* E-mail: alex_kasumyan@mail.ru
Поступила в редакцию 16.07.2018
После доработки 04.12.2018
Принята к публикации 06.12.2018
Аннотация
Оценена вкусовая привлекательность холата натрия (10–1 М), таурохолата натрия (10–1 М) и дегидрохолевой кислоты (0.5 × 10–3 М) для астианакса Astyanax fasciatus (слепая форма), серебристого метинниса Metynnis argenteus, нильской тиляпии Oreochromis niloticus, меченосца Xiphophorus hellerii и плотвы Rutilus rutilus. Значимым вкусовым эффектом обладают все вещества, но отношение рыб к их вкусу разное, как и ответ на одно и то же вещество. Вкусовое предпочтение желчных веществ (таурохолат натрия, дегидрохолевая кислота) обнаружено только у астианакса, что, по-видимому, позволяет ему питаться своеобразной пищей (гуано летучих мышей), доступной в пещерных водоёмах, где другие пищевые ресурсы крайне незначительны. Для остальных рыб желчные вещества имеют инертный или отталкивающий вкус, что может препятствовать копрофагии и способствовать длительному сохранению в среде фекалий, являющихся важным источником запаховых сигналов для рыб. Предложено рассматривать желчные вещества в качестве важных химических регуляторов взаимоотношений рыб в водных сообществах.
Вещества, вызывающие у человека основные типы вкусовых ощущений, а также аминокислоты, являющиеся компонентами внутренней среды организмов, широко используются в качестве стандартных раздражителей в электрофизиологических и поведенческих исследованиях функциональных свойств вкусовой системы человека и различных животных (Iwasaki et al., 1985; Tinti et al., 2000; Blüthgen, Fiedler, 2004; Kawai et al., 2012). На примере этих веществ выяснены вкусовые спектры многих видов рыб, определён уровень вкусовой чувствительности к наиболее эффективным веществам, оценено влияние на вкусовую рецепцию различных внешних факторов и мотивационного состояния особи, прослежены онтогенетические изменения (Kasumyan, Døving, 2003; Hara, 2006).
В последние годы в экспериментальных исследованиях вкусовой рецепции рыб начинают использовать и другие типы веществ – карбоновые кислоты, углеводы, спирты, некоторые амины и нуклеотиды, производные аминокислот (Hara, 2006; Morais, 2016). Число таких работ невелико и существующие знания об эффективности веществ, не относящихся к классическим вкусовым веществам и свободным аминокислотам, остаются ограниченными. Эти сведения, однако, позволили бы лучше понять роль вкусовой рецепции, являющейся ведущей сенсорной системой в оценке качества пищи, в селективном выборе и потреблении рыбами адекватных пищевых объектов (Павлов, Касумян, 1998; Касумян, Тинькова, 2014). Среди химических соединений, ранее редко использовавшихся в качестве вкусовых раздражителей, особое внимание привлекают желчные вещества – конъюгированные и неконъюгированные желчные кислоты, их соли и спирты. Эти вещества представляют собой производные холановой кислоты и относятся к конечным продуктам обмена холестерина; основная функция их связана с эмульгацией и процессами переваривания и всасывания липидов (Haslewood, 1967; Hofmann, 1999; Hofmann, Hagey, 2008). Для обонятельной системы рыб желчные вещества относятся к числу наиболее эффективных стимулов. С помощью электрофизиологических и поведенческих экспериментов на разных видах показано, что обонятельная чувствительность к этим веществам достигает 10–10–10–11 М, т.е. пороговые концентрации на несколько порядков ниже, чем, например, у свободных аминокислот (Døving et al., 1980; Michel, Lubomudrov, 1995; Huertas et al., 2010; Giaquinto et al., 2015). У морской миноги Petromyzon marinus вещества этой группы служат основными компонентами феромонов, экскретируемых в воду пескоройками и взрослыми самцами и привлекающих мигрирующих к местам нереста самок (Li et al., 1995, 2002; Polkinghorne et al., 2001; Buchinger et al., 2015; Brant et al., 2016). Предполагается, что желчные кислоты и различные их производные могут входить в состав и других феромонов (Huertas et al., 2007; Giaquinto et al., 2015), а также быть химическими маркерами популяций, используемыми лососёвыми рыбами (Salmonidae) при хоминге (Døving et al., 1980; Døving, Stabell, 2003). Растворы некоторых желчных веществ привлекают мигрирующих в реки личинок европейского угря Anguilla anguilla (Sola, Tosi, 1993), вызывают пищевую реакцию у атлантической трески Gadus morhua (Hellstrøm, Døving, 1986). Выделяя желчные вещества вместе с фекалиями, территориальные рыбы, как полагают, метят таким образом собственные участки и руководствуются этими химическими ориентирами при возвращении на свои территории (Stabell, 1987; Døving et al., 2006). Таурохолат натрия был одним из большого числа испытанных химических раздражителей, который вызывал ответные реакции в нервных волокнах, иннервирующих одиночные хемосенсорные клетки, принадлежащих к системе общего химического чувства у трёхусого налима Gaidropsarus vulgaris (Kotrschal et аl., 1996).
Сведения о желчных веществах как о вкусовых стимулах для рыб значительно менее полные. Полагают, что желчные кислоты и их соли являются вкусовыми раздражителями лишь для лососёвых рыб и не воспринимаются другими рыбами (Marui, Caprio, 1992). Пороговые концентрации некоторых из желчных кислот, установленные в электрофизиологических экспериментах на радужной форели Oncorhynchus (=Parasalmo) mykiss, озёрном гольце-кристивомере Salvelinus namaycush и кундже S. leucamaenis, достигают 10–12 М, что не уступает обонятельной чувствительности этих рыб (Hara et al., 1984, 1999; Yamashita et al., 2006). Крайне высокая вкусовая чувствительность к желчным веществам подтверждена в электрофизиологических экспериментах на канальном соме Ictalurus punctatus (Rolen, Caprio, 2008). Обнаружено также, что восприятие этих веществ обеспечивается особым типом вкусовых рецепторов – иным, чем те, что предназначены для восприятия аминокислот (Yamashita et al., 2006; Rolen, Caprio, 2008). Какие-либо предположения о назначении высокой вкусовой чувствительности рыб к желчным кислотам и их производным отсутствуют, специальные исследования вкусовой привлекательности этих веществ для рыб не выполнялись.
Цель настоящей работы − оценить вкусовые свойства желчных веществ для астианакса Astyanax fasciatus и метинниса Metynnis argenteus (Characiformes: Characidae), нильской тиляпии Oreochromis niloticus (Perciformes: Cichlidae), меченосца Xiphophorus hellerii (Cyprinodontiformes: Poeciliidae) и плотвы Rutilus rutilus (Cypriniformes: Cyprinidae), а также выяснить, зависят ли вкусовые свойства этих веществ от типа питания рыб.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на половозрелых особях слепой формы астианакса (средняя полная длина (TL) 5.9 см, средняя масса 4.8 г; доставлены из Индонезии, популяционное происхождение неизвестно), молоди нильской тиляпии (TL 8.0 см, масса 9.0 г; получена от ООО “Крафт Тау”, Московская область), молоди серебристого метинниса (TL 7.5 см, масса 12.50 г; приобретены в аквариумной компании “Аквалого”, Москва), молоди красно-чёрной формы меченосца (TL 3–4 см, приобретены в зоомагазине, Москва), молоди плотвы (TL 7.0 см, масса 4.8 г; отловлены в р. Воря, Московская область).
После доставки в лабораторию и содержания в общих аквариумах (70 л) в течение 2–6 недель при ежедневном кормлении живыми личинками хирономид (Chironomidae) рыб для опытов рассаживали по индивидуальным аквариумам (5–10 л). Непрозрачные задняя и боковые стенки аквариумов предотвращали визуальные контакты между соседними особями. Грунт в аквариумах отсутствовал, искусственное освещение не использовали. Температура воды в аквариумах с плотвой была 20–22°С, в аквариумах с другими рыбами температуру поддерживали на уровне ~26°С с помощью терморегуляторов AquaEL EH-25W. Кормили рыб живыми личинками хирономид один раз в день после проведения опытов.
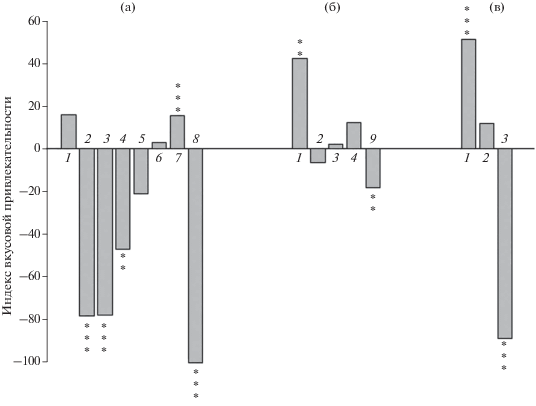
Индекс вкусовой привлекательности желчных веществ (а – холат натрия, 10–1 М; б – таурохолат натрия, 10–1 М (10–2 М – для европейской солеи); в – дегидрохолевая кислота, 0.5 × 10–3 М) для разных видов рыб: 1 – астианакс Astyanax fasciatus (слепая форма), 2 – серебристый метиннис Metynnis argenteus, 3 – нильская тиляпия Oreochromis niloticus, 4 – плотва Rutilus rutilus, 5 – меченосец Xiphophorus hellerii, 6 – линь Tinca tinca, 7 – горчак Rhodeus sericeus amarus, 8 – девятииглая колюшка Pungitius pungitius, 9 – европейская морская солея Solea solea; 1–5 – наши данные; 6 – Касумян, Прокопова, 2001; 7 – Исаева, 2007; 8 –Михайлова, Касумян, 2018; 9 – рассчитано по данным: Mackie, Mitchell, 1982. Достоверные различия потребления гранул относительно соответствующего контроля при р: ** < 0.01, *** < 0.001.
До проведения опытов рыб обучали схватывать подаваемых поштучно живых личинок хирономид, а затем агар-агаровые гранулы (2%), содержащие водный экстракт личинок (75–300 г/л) и краситель Ponceau 4R (5 мкМ). После этого предварительного этапа приступали к опытам, в которых в аквариум подавали агар-агаровую гранулу, содержащую кроме красителя одно из желчных веществ: холат натрия (10–1 М), таурохолат натрия (10–1 М) или дегидрохолевую кислоту (0.5 × 10–3 М). В качестве контроля применяли гранулы, содержащие только краситель. Для оценки мотивационного состояния рыб (их готовность потреблять предлагаемые гранулы) выполняли опыты, используя гранулы с экстрактом хирономид. Гель с желчными веществами хранили при 5°С не более трёх недель, с экстрактом хирономид – не более 3 сут. Гранулы вырезали с помощью трубки из нержавеющей стали непосредственно перед подачей их в аквариум. Гранулы были 4.0 мм в длину; в опытах с тиляпией и метиннисом имели диаметр 2.0 мм, с плотвой и астианаксом − 1.35, с меченосцем − 1.0 мм.
В каждом опыте регистрировали число схватываний гранулы, продолжительность удержания гранулы после первого схватывания и в течение всего опыта, заглатывание или отказ от потребления гранулы к концу опыта. В опытах с астианаксом и тиляпией дополнительно регистрировали продолжительность латентного периода – время от падения гранулы в воду до начала её поиска (астианакс) или схватывания (тиляпии), а также продолжительность поисковой реакции – время от начала поиска до момента схватывания гранулы (астианакс). Каждый опыт продолжался ~1–2 мин и заканчивался проглатыванием гранулы либо окончательным отказом от потребления, о котором судили по поведению рыбы (отказ от повторных схватываний гранулы, потеря интереса к грануле и уход в сторону). Немногочисленные опыты, в которых рыбы гранулу не схватывали в течение 1 мин после внесения в аквариум или потребление гранулы нельзя было определить из-за её разрушения рыбой и образования большого числа фрагментов, не учитывали. Несъеденную гранулу или её фрагменты из аквариума удаляли сразу после окончания опыта. Опыты с разными типами гранул проводили в случайной последовательности с интервалом 10–15 мин.
Опыты выполнены на 12 тиляпиях, 14 астианаксах, 10 метиннисах, 18 особях плотвы и 15 меченосцах. Общее число опытов – 2605. Для количественной оценки вкусового предпочтения веществ рассчитывали индекс вкусовой привлекательности по формуле: Indpal = [(R – C)/(R + C)] × 100, где R – потребление гранул с веществом, %; С – потребление контрольных гранул, %. Для статистического анализа результатов использовали критерий χ2, U-критерий Манна−Уитни и ранговый коэффициент корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
Тестированию подвергнуты три желчных вещества. Каждое вещество вызывало значимые изменения потребления гранул хотя бы у одного из исследованных видов рыб (таблица). Холевая соль натрия, испытанная на всех пяти видах рыб, у большинства из них подавляет потребление гранул по сравнению с контролем: у тиляпии и метинниса – в восемь раз, у плотвы – почти в три раза. Для меченосца и астианакса это вещество имеет индифферентный вкус. Присутствие в гранулах таурохолевой соли натрия повышает их вкусовую привлекательность для астианакса в 2.5 раза, но не влияет на отношение к ним тиляпии, метинниса и плотвы. Дегидрохолевая кислота в силу своей плохой растворимости в воде испытана в концентрации в 200 раз более низкой (0.5 × 10–3 М), чем два предыдущих вещества (10–1 М). Несмотря на низкую концентрацию, присутствие в гранулах дегидрохолевой кислоты приводит к резкому снижению их потребления у тиляпии (почти в 17 раз) и к повышению потребления у астианакса (почти в три раза). Отношение метинниса к гранулам с этой кислотой такое же, как и к контрольным. Потребление всеми рыбами гранул с экстрактом хирономид высокое – от 75 до 100%.
Слепые астианаксы в отличие от остальных рыб не реагируют на гранулу сразу же после её падения в воду. Латентный период (время от момента падения гранулы до начала её активного поиска) в среднем длится 19–29 с, почти столько же (14−20 с) продолжается поиск гранулы рыбой. Продолжительности латентного периода и пищевого поиска сходны для всех типов гранул и значимо не отличаются от контроля. Во время поиска астианакс, приняв характерный наклон вперёд под углом 30°–40°, быстро перемещается у дна по сложной траектории, совершает резкие развороты; схватывание гранулы происходит только после случайного касания её губами. Тиляпия реагирует на гранулу быстрым броском и схватыванием, затрачивая на это в среднем от 1.6 до 3.1 с, причём время реакции на гранулы с тестируемыми веществами такое же, как на контрольные (p > 0.05). Схваченную гранулу рыба могла многократно отвергать и повторно схватывать в ходе опыта. Такое поведение типично для всех видов рыб, кроме астианакса, который совершает такие действия редко. Тиляпия, метиннис и плотва чаще совершают повторные схватывания гранул, которые потребляются хуже, чем контрольные. Наиболее долго схваченную гранулу удерживает в ротовой полости астианакс: в опытах с привлекательной для него дегидрохолевой кислотой в среднем это время достигает почти 40 с, гранулы других типов он тестирует не столь долго, но всё же дольше, чем другие рыбы (таблица).
Вкусовые ответы (M ± m) астианакса Astyanax fasciatus (слепая форма), нильской тиляпии Oreochromis niloticus, серебристого метинниса Metynnis argenteus, меченосца Xiphophorus hellerii и плотвы Rutilus rutilus на агар-агаровые гранулы с желчными кислотами и их солями
| Раздражитель | Концен-трация, М (г/л) | Латентный период реакции, с | Длительность поисковой реакции, с | Потребление гранул, % | Число схватываний | Длительность удержания гранулы, с | Число опытов | |
|---|---|---|---|---|---|---|---|---|
| после первого схватывания | в течение всего опыта | |||||||
| Астианакс | ||||||||
| Холат натрия | 10–1 | 25.0 ± 3.6 | 17.9 ± 3.3 | 33.3 ± 8.3 | 1.2 ± 0.1 | 18.6 ± 2.8 | 20.6 ± 3.3 | 33 |
| Таурохолат натрия | 10–1 | 19.4 ± 2.6 | 15.1 ± 2.7 | 59.4 ± 8.8** | 1.2 ± 0.1 | 18.4 ± 2.0** | 22.6 ± 2.9** | 32 |
| Дегидрохолевая кислота | 0.5 × 10–3 | 24.3 ± 3.0 | 19.6 ± 3.6 | 74.2 ± 8.0*** | 1.1 ± 0.1 | 37.2 ± 8.8*** | 37.9 ± 8.8*** | 31 |
| Экстракт хирономид | (175) | 26.7 ± 2.4 | 15.0 ± 2.1 | 84.0 ± 0.1*** | 1.1 ± 0.0 | 9.4 ± 0.0 | 9.8 ± 0.0 | 50 |
| Контроль | – | 29.4 ± 3.9 | 13.8 ± 2.6 | 24.2 ± 7.6 | 1.0 ± 0.0 | 14.5 ± 3.9 | 15.5 ± 3.9 | 33 |
| Нильская тиляпия | ||||||||
| Холат натрия | 10–1 | 1.7 ± 0.3 | – | 5.6 ± 2.8*** | 2.3 ± 0.2*** | 3.8 ± 0.8*** | 6.9 ± 1.1** | 71 |
| Таурохолат натрия | 10–1 | 3.1 ± 1.1 | – | 47.0 ± 6.2 | 2.0 ± 0.2 | 18.4 ± 2.6 | 22.4 ± 2.6*** | 66 |
| Дегидрохолевая кислота | 0.5 × 10–3 | 1.6 ± 0.3 | – | 2.7 ± 1.9*** | 2.9 ± 0.2*** | 3.0 ± 0.4*** | 5.9 ± 0.6* | 74 |
| Экстракт хирономид | (175) | 2.1 ± 0.3 | – | 100 ± 0.0*** | 1.0 ± 0.0*** | 3.6 ± 0.2*** | 3.7 ± 0.2*** | 102 |
| Контроль | – | 2.1 ± 0.3 | 45.2 ± 5.5 | 1.5 ± 0.1 | 6.0 ± 0.5 | 7.3 ± 0.5 | 84 | |
| Серебристый метиннис | ||||||||
| Холат натрия | 10–1 | – | – | 7.7 ± 3.7*** | 2.1 ± 0.2 | 4.1 ± 1.6*** | 6.6 ± 1.8*** | 52 |
| Таурохолат натрия | 10–1 | – | – | 55.8 ± 7.0 | 2.3 ± 0.3 | 10.5 ± 2.2 | 19.9 ± 2.8* | 52 |
| Дегидрохолевая кислота | 0.5 × 10–3 | – | – | 71.7 ± 6.2 | 1.8 ± 0.2 | 14.0 ± 3.7 | 19.6 ± 3.7** | 53 |
| Экстракт хирономид | (175) | – | – | 100 ± 0.0*** | 1.0 ± 0.0** | 6.6 ± 0.3* | 6.8 ± 0.3 | 51 |
| Контроль | – | – | – | 63.5 ± 6.7 | 1.5 ± 0.1 | 5.6 ± 0.8 | 8.7 ± 0.9 | 52 |
| Меченосец (серия 1) | ||||||||
| Холат натрия | 10–1 | – | – | 6.7 ± 2.6 | 2.2 ± 0.2*** | 1.0 ± 0.2* | 2.7 ± 0.5 | 90 |
| Контроль | – | 10.3 ± 2.3 | 1.5 ± 0.1 | 1.9 ± 0.3 | 2.8 ± 0.3 | 174 | ||
| Меченосец (серия 2) | ||||||||
| Экстракт хирономид | (75) | – | – | 74.7 ± 3.6*** | 2.1 ± 0.1** | 9.1 ± 0.8*** | 14.0 ± 0.7*** | 150 |
| Контроль | – | – | – | 0.6 ± 0.6 | 1.7 ± 0.1 | 0.8 ± 0.1 | 1.4 ± 0.2 | 150 |
| Плотва (серия 1) | ||||||||
| Холат натрия | 10–1 | – | – | 9.0 ± 7.0** | 2.3 ± 0.4** | 2.5 ± 2.1 | 7.4 ± 3.4 | 67 |
| Таурохолат натрия | 10–1 | – | – | 31.8 ± 11.5 | 2.7 ± 0.6*** | 6.6 ± 2.1* | 14.7 ± 4.1*** | 66 |
| Контроль | – | – | – | 25.0 ± 12.2 | 1.6 ± 0.3 | 3.3 ± 1.0 | 3.6 ± 1.0 | 52 |
| Плотва (серия 2) | ||||||||
| Экстракт хирономид | (300) | – | – | 97.0 ± 1.2*** | 1.1 ± 0.0*** | 7.9 ± 0.3 | 8.1 ± 0.2 | 735 |
| Контроль | – | – | – | 48.3 ± 1.2 | 1.4 ± 0.2 | 7.2 ± 1.3 | 8.0 ± 1.2 | 60 |
ОБСУЖДЕНИЕ
Результаты проведённых опытов показали, что для исследованных нами видов рыб желчные вещества обладают вкусовыми качествами. Значимые изменения потребления гранул вызывают все три использованные вещества, но их эффект разный. В четырёх случаях реакция рыб на тестируемые вещества резко аверсивная, в двух случаях эти вещества стимулируют потребление гранул и в шести отношение к их вкусу индифферентное. Ответ рыб разных видов на одни и те же вещества также не совпадает (рисунок). Так, вкус дегидрохолевой кислоты для тиляпии отталкивающий, для астианакса − привлекательный, для метинниса − безразличный. Таурохолат натрия привлекателен для астианакса и безразличен для тиляпии, метинниса и плотвы. Холат натрия подавляет потребление гранул у тиляпии, метинниса и плотвы, но не эффективен для астианакса и меченосца. Столь же разное отношение к вкусу желчных веществ и у других ранее исследовавшихся видов рыб. Холат натрия безразличен по вкусу для линя Tinca tinca, привлекателен для горчака Rhodeus sericeus amarus и неприятен для девятииглой колюшки Pungitius pungitius (Касумян, Прокопова, 2001; Исаева, 2007; Михайлова, Касумян, 2018). Таурохолат натрия снижает потребление корма у европейской солеи Solea solea (Mackie, Mitchell, 1982). Такое разнообразие вкусовых ответов в полной мере соответствует выводу о видовой специфичности вкусовых предпочтений у рыб, сформулированному ранее на примере других групп веществ (Касумян, 1997; Kasumyan, Døving, 2003; Виноградская и др., 2017).
Отношение рыб к вкусу желчных веществ, в основном к холату натрия, к настоящему времени известно: с учётом данных литературы, из девяти исследованных видов индифферентные ответы проявляют только меченосец и линь; для остальных рыб желчные вещества являются значимыми вкусовыми раздражителями. Эти виды принадлежат к пяти разным отрядам, среди них есть пресноводные и морские рыбы и рыбы, существенно различающиеся по питанию: эврифаги с разной долей растительной пищи в рационе – от высокой (нильская тиляпия, серебристый метиннис) до менее заметной или эпизодической (плотва, горчак), и типично животноядные, питающиеся преимущественно бентосными (европейская солея) или планктонными (девятииглая колюшка) организмами (Hynes, 1950; Khallaf, Alne-na-ei, 1987; Horppila, 1994; Beveridge, Baird, 2000; Froese, Pauly, 2018). Среди этих видов особое внимание привлекает астианакс, для которого, в отличие от других, большинство желчных веществ обладают привлекательным вкусом: таурохолат натрия и дегидрохолевая кислота высокоэффективные стимулы (p < 0.01 и p < 0.001) и повышают потребление гранул соответственно в 2.5 и 3.0 раза. Ни одно из трёх желчных веществ, подвергнутых тестированию, не имеет для астианакса отталкивающего вкуса. Для других видов (за исключением горчака), в том числе для метинниса, принадлежащего, как и астианакс, к Characidae, использованные желчные вещества не обладают привлекательным вкусом и либо не влияют на вкусовые качества гранул, либо резко подавляют их потребление.
Заметно отличающееся от других рыб отношение астианакса к вкусу желчных кислот хорошо согласуется с особенностями его питания. Пища слепых астианаксов, населяющих небольшие пещерные водоёмы, почти полностью состоит из гуано летучих мышей, пережидающих здесь дневное время (Wilkens, 1972; Mitchell et al., 1977; Huppop, 1987). Известно, что большинство желчных веществ образуются у позвоночных животных в печени в результате преобразований холестерина и экскретируются в кишечник. Некоторые из желчных веществ, такие как дезоксихолевая кислота, возникают из первичных желчных веществ под влиянием ферментов организмов кишечной микрофлоры. Другие переходят в так называемые конъюгаты, связываясь с некоторыми аминокислотами (глицин, таурин), например, в таурохолевую кислоту. Многие из желчных веществ присутствуют в желчи в форме хорошо растворимых натриевых и калиевых солей. Бóльшая часть многочисленных желчных веществ из полости кишечника поступает в кровь, а затем в печень и вновь экскретируется в кишечник, другая часть выводится из организма вместе с непереваренной пищей (Haslewood, 1967, 1978). В фекалиях рыб идентифицированы разнообразные желчные кислоты и их соли (Li et al., 2015).
Большинство исследованных рыб реагируют на вкус желчных кислот негативно или индифферентно (Mackie, Mitchell, 1982; Касумян, Прокопова, 2001; Михайлова, Касумян, 2018; наше исследование). Человек вкус желчи воспринимает как горький или неприятный (Frank, Hettinger, 1992). Иное отношение астианакса к вкусу этих веществ следует рассматривать в качестве сенсорной адаптации, позволяющей ему использовать пищу с неблагоприятными для других рыб вкусовыми качествами, и благодаря этому успешно выживать в небольших пещерных водоёмах, где пищевые ресурсы крайне незначительны, а кормовые организмы могут попадать в эти водоёмы лишь с паводковыми водами (Wilkens, 1972; Mitchell et al., 1977; Espinasa et al., 2017). О благополучии пещерных популяций астианакса свидетельствует не только длительная история их существования – сотни тысяч лет (Chakraborty, Nei, 1974; Wilkens, 1988; Romero, Green, 2005; Gross, 2012), но и относительно высокая плотность популяций (Espinasa et al., 2017). Возможно, привлекательный или индифферентный вкус желчные вещества имеют и для других рыб-копрофагов. В некоторых водных сообществах таких рыб довольно много. Например, из 88 исследованных видов рыб коралловых рифов копрофагия выявлена у 45 (Robertson, 1982), что вызвано, как полагают, высокой энергетической и пищевой ценностью фекалий, особенно у рыб с животноядным типом питания (зоопланктофаги, хищники и т.п.). Фекалии этих рыб потребляются совместно обитающими с ними рыбами почти полностью (до 99%) (Bailey, Robertson, 1982). Копрофагия встречается не только у рыб коралловых рифов (Barlow, 1975; Moyer, Nakazono, 1978; Conway et al., 1999; Sazima et al., 2003; Yallaly et al., 2015).
Длительное существование астианакса в подземных водоёмах не приводит к компенсаторному усилению функциональных характеристик сенсорных систем с большой дистантностью – слуховой и обонятельной (Popper, 1970; Касумян, Марусов, 2015б), но вызывает адаптивные преобразования в других сенсорных системах – боковой линии и вкуса. Слепой астианакс, благодаря свободным невромастам, более многочисленным и с более высокой купулой, способен лоцировать ближнее пространство, легко обнаруживать подводные объекты и не сталкиваться с ними, распознавать их форму и размеры (von Campenhausen et al., 1981; Weissert, von Campenhausen, 1981; Teyke, 1990). У слепого астианакса больше, чем у астианакса зрячей формы, населяющего наземные водоёмы, вкусовых почек, они шире распределены на теле рыб, имеют более развитую иннервацию, отличаются морфологическими параметрами (Breder, Rasquin, 1943; Schemmel, 1967; Bensonilah, Denizot, 1991; Boudriot, Reutter, 2001; Девицина, Головкина, 2018), что, несомненно, облегчает поиск пищи. Сравнительные исследования функции вкусовой системы у разных форм астианакса отсутствуют. Однако результаты, демонстрирующие иное, чем у других рыб, отношение слепого астианакса к вкусу желчных кислот, позволяют предположить, что функциональные характеристики этой системы могли претерпеть изменения.
В настоящей работе мы не определяли пороговые концентрации желчных веществ, однако имеющиеся данные указывают на высокий уровень вкусовой чувствительности рыб к некоторым из них. Так, дегидрохолевая кислота при концентрации 0.5 × 10–3 М обладает эффективностью для двух видов из трёх, на которых такое тестирование проведено. Несмотря на низкое содержание этой кислоты в гранулах, у одного из видов (тиляпия) она вызывает 17-кратное снижение потребления гранул по сравнению с контролем. Учитывая характер снижения эффекта от концентрации вкусового вещества (Касумян, Сидоров, 2005, 2012), можно полагать, что пороговая концентрация этого вещества может быть на один–два порядка ниже, т.е. составлять 10–4–10–5 М. Пороги высокоэффективных вкусовых веществ, установленные с помощью методов, сходных с использованным в настоящей работе, варьируют в пределах 10–1–10–3 М и лишь в некоторых случаях достигают 10–4 М (Jones, 1989; Lamb, Finger, 1995; Kasumyan, Døving, 2003; Goli et al., 2015). Реакция на гранулы, лежащая в основе этих методов тестирования привлекательности веществ, у рыб обеспечивается внутриротовой вкусовой рецепцией (Kasumyan, Døving, 2003) и не связана с обонятельной чувствительностью (Касумян, Сидоров, 2005, 2012). Это должно быть справедливым и для астианакса, несмотря на то что схватывание гранулы у него предваряют длительные латентный период и пищевой поиск, вызываемые, возможно, запахом гранулы. Однако наличие запахов в воде не влияет на решение рыб потребить или отвергнуть схваченную гранулу (Касумян, Марусов, 2015а). Ещё одна хемосенсорная система – общее химическое чувство – также не участвует в рецепции желчных веществ, как это показано на примере хемочувствительных свободных нервных окончаний тройничного нерва у радужной форели (Mettam et al., 2012).
В специальные задачи работы не входило детальное исследование поведения, проявляемого рыбами при реакции на гранулы с желчными веществами, поскольку оно в большей мере определяется не типом вещества, а зависит от итогового результата тестирования гранулы – заглатывания или отказа от потребления (Виноградская и др., 2017). Однако следует отметить, что среди исследованных видов наиболее своеобразным поведением обладает астианакс. Схватив гранулу, найденную в результате длительного поиска, астианакс необычно долго удерживает её в ротовой полости и до заглатывания или отказа от потребления не совершает повторных тестирований. Многократные промежуточные схватывания и отвергания гранулы, проявляемые остальными видами рыб, не характерны для астианакса, что можно объяснить полным отсутствием у него зрения. Остальные рыбы обычно совершают такие действия многократно, но времени на принятие и реализацию окончательного решения о пригодности гранулы затрачивают намного меньше, чем астианакс. Поиск причин, объясняющих такие особенности поведения, требует дополнительных исследований.
Таким образом, выполненная работа показывает, что желчные вещества – кислоты и их соли – могут быть отнесены к высокоэффективным хемосенсорным раздражителям для рыб. Вещества этой крайне разнообразной группы химических соединений воспринимаются не только обонятельной системой и входят в состав феромонов рыб, но и обладают для них значимыми вкусовыми свойствами. Для большинства видов желчные вещества имеют инертный или отталкивающий (детеррентный) вкус. Желчные вещества, попадающие в окружающую среду вместе с фекалиями, часто используются рыбами в качестве химических маркеров и запаховых ориентиров в репродуктивном, миграционном и территориальном поведении (Stabell, 1987; Døving, Stabell, 2003; Døving et al., 2006; Huertas et al., 2007; Buchinger et al., 2015; Giaquinto et al., 2015). Вполне возможно, что инертные или отталкивающие вкусовые качества желчных веществ препятствуют копрофагии, что, как следствие, будет способствовать длительному сохранению источников этих важных запаховых сигналов в среде. У копрофагов – широко распространённой среди рыб трофической категории − отношение к вкусу желчных веществ преимущественно позитивное, что позволяет им использовать такой ценный пищевой ресурс как фекалии, особенно в условиях, где другая пища отсутствует или крайне ограничена. Несомненно, что желчные вещества являются важными химическими регуляторами взаимоотношений рыб в водных сообществах и эта роль остается ещё слабо изученной.
БЛАГОДАРНОСТИ
Авторы искренне благодарны А.В. Яковлеву (OOO “Арт-Деко М”) за помощь в приобретении астианаксов, Л.Р. Тауфику (ООО “Крафт Тау”) за предоставление нильской тиляпии, А.Н. Грубаню и Т.В. Тиньковой (МГУ) за участие в выполнении опытов. Авторы признательны Е.А. Марусову (МГУ) за плодотворное обсуждение полученных результатов.
Список литературы
Виноградская М.И., Михайлова Е.С., Касумян А.О. 2017. Вкусовые предпочтения, оросенсорное тестирование и генерация звуков при питании у жемчужного гурами Trichopodus leerii // Вопр. ихтиологии. Т. 57. № 3. С. 324–337. https://doi.org/10.7868/S004287521703016X
Девицина Г.В., Головкина Т.В. 2018. Структурная организация вкусового аппарата у харациновых рыб (Characidae, Teleostei) // Там же. Т. 58. № 1. С. 53–66. https://doi.org/10.7868/S0042875218010071
Исаева О.М. 2007. Вкусовые предпочтения и вкусовое поведение карповых рыб: Автореф. дис. … канд. биол. наук. М.: МГУ, 25 с.
Касумян А.О. 1997. Вкусовая рецепция и пищевое поведение рыб // Вопр. ихтиологии. Т. 37. № 1. С. 78–93.
Касумян А.О., Марусов Е.А. 2015а. Избирательное питание рыб: влияние пищевой и оборонительной мотиваций, вызванных натуральными запахами // Журн. общ. биологии. Т. 76. № 3. С. 195–211.
Касумян А.О., Марусов Е.А. 2015б. Хемоориентация в пищевом поведении у слепой пещерной рыбы Astyanax fasciatus (Characidae, Teleostei) // Экология. № 6. С. 439–443. https://doi.org/10.7868/S0367059715060050
Касумян А.О., Прокопова О.М. 2001. Вкусовые предпочтения и динамика вкусового поведенческого ответа у линя Tinca tinca (Cyprinidae) // Вопр. ихтиологии. Т. 41. № 5. С. 670–685.
Касумян А.О., Сидоров С.С. 2005. Вкусовые предпочтения у рыб с хронической аносмией // Там же. Т. 45. № 3. С. 539–547.
Касумян А.О., Сидоров С.С. 2012. Влияние длительной аносмии, совмещенной с зрительной депривацией, на вкусовую чувствительность и пищевое поведение радужной форели Oncorhynchus mykiss // Там же. Т. 52. № 1. С. 116–126.
Касумян А.О., Тинькова Т.В. 2014. Распространение детеррентности как способа химической защиты у гидробионтов коралловых рифов Вьетнама // ДАН. Т. 454. № 2. С. 237–240. https://doi.org/10.7868/S0869565214020273
Михайлова Е.С., Касумян А.О. 2018. Вкусовые свойства карбоновых кислот для девятииглой колюшки Pungitius pungitius // Вопр. ихтиологии. Т. 58. № 4. С. 496−502. https://doi.org/10.1134/S0042875218040124
Павлов Д.С., Касумян А.О. 1998. Структура пищевого поведения рыб // Вопр. ихтиологии. Т. 38. № 1. С. 123–136.
Bailey T.G., Robertson D.R. 1982. Organic and caloric levels of fish feces relative to its consumption by coprophagous reef fishes // Mar. Biol. V. 64. P. 45–50.
Barlow G.W. 1975. On the sociobiology of four Puerto Rican parrotfishes (Scaridae) // Ibid. V. 33. P. 281–293.
Bensonilah M., Denizot J.-P. 1991. Taste buds and neuromasts of Astyanax jordani: distribution and immunochemical demonstration of co-localized substance P and enkephalins // Europ. J. Neurosci. V. 3. P. 407–414.
Beveridge M.C.M., Baird D.J. 2000. Diet, feeding and digestive physiology // Tilapias: biology and exploitation / Eds. Beveridge M.C.M., McAndrew B.J. Dordrecht: Kluwer Acad. Publ. P. 59–87.
Blüthgen N., Fiedler K. 2004. Preferences for sugars and amino acids and their conditionality in a diverse nectar-feeding ant community // J. Anim. Ecol. V. 73. P. 155–166.
Boudriot F., Reutter K. 2001. Ultrastructure of the taste buds in the blind cave fish Astyanax jordani (“Anoptichthys”) and the sighted river fish Astyanax mexicanus (Teleostei, Characidae) // J. Comp. Neurol. V. 434. P. 428–444.
Brant C.O., Huertas M., Li K., Li W. 2016. Mixtures of two bile alcohol sulfates function as a proximity pheromone in sea lamprey // PLoS ONE. V. 11(2). P. e0149508. https://doi.org/10.1371/journal.pone.0149508
Breder C.M., Rasquin P. 1943. Chemical sensory reactions in the Mexican blind characins // Zoologica. V. 28. P. 169–200.
Buchinger T.J., Siefkes M.J., Zielnski B.S. et al. 2015. Chemical cues and pheromones in the sea lamprey (Petromyzon marinus) // Front. Zool. V. 12. P. 32. https://doi.org/10.1186/s12983-015-0126-9
Campenhausen C., von, Riess I., Weissert R. 1981. Detection of stationary objects by the blind cave fish Anoptichthys jordani (Characidae) // J. Comp. Physiol. V. 143A. P. 369–374.
Chakraborty R., Nei M. 1974. Dinamics of gene differentiation between incompletely isolated populations of unequal sizes // Theor. Populat. Biol. V. 5. P. 460–469.
Conway D.V.P., Coombs S.H., Lindley J.A., Llewellyn C.A. 1999. Diet of mackerel (Scomber scombrus) larvae at the shelf-edge to the south-west of the British Isles and the incidence of piscivory and coprophagy // Vie Milieu. V. 49. P. 213–220.
Døving K.B., Stabell O.B. 2003. Trails in open waters: sensory cues in salmon migration // Sensory processing in aquatic environments / Eds. Collin S.P., Marshall N.J. N.Y.: Springer-Verlag. P. 39–52.
Døving K.B., Selset R., Thommesen G. 1980. Olfactory sensitivity to bile acids in salmonid fishes // Acta Physiol. Scand. V. 108. P. 123–131.
Døving K.B., Stabell O.B., Östlund-Nilsson S., Fisher R. 2006. Site fidelity and homing in tropical coral reef cardinalfish: are they using olfactory cues? // Chem. Senses. V. 31. P. 265–272.
Espinasa L., Bonaroti N., Wong J. et al. 2017. Contrasting feeding habits of post-larval and adult Astyanax cavefish // Subterr. Biol. V. 21. P. 1–17.
Frank M.E., Hettinger T.P. 1992. The sense of taste: neurobiology, aging, and medication effects // Critical Rev. Oral Biol. Med. V. 3. № 4. P. 371–393.
Froese R., Pauly D. (eds.). 2018. FishBase. World Wide Web electronic publication (www.fishbase.org. Version 02/2018).
Giaquinto P.C., Barreto R.E., Volpato G.L. et al. 2015. Bile acids as potential pheromones in pintado catfish Pseudoplatystoma corruscans (Spix & Agassiz, 1829): eletrophysiological and behavioral studies // Neotrop. Ichthyol. V. 13. № 1. P. 237–244.
Goli S., Jafari V., Ghorbani R., Kasumyan A. 2015. Taste preferences and taste thresholds to classical taste substances in the carnivorous fish, kutum Rutilus frisii kutum (Teleostei: Cyprinidae) // Physiol. Behav. V. 140. P. 111–117.
Gross J.B. 2012. The complex origin of Astyanax cavefish // BMC Evol. Biol. V. 12. P. 105. https://doi.org/10.1186/1471-2148-12-105
Hara T.J. 2006. Gustation // Fish physiology. V. 25. Sensory systems neuroscience / Eds. Hara T.J., Zielinski B.S. San Diego: Acad. Press. P. 45–96.
Hara T.J., Macdonald S., Evans R.E. et al. 1984. Morpholine, bile acids and skin mucus as possible chemical cues in salmonid homing: electrophysiological reevaluation // Mechanisms of migration in fishes / Eds. McCleave J.D. et al. N.Y.: Plenum Press. P. 363–378.
Hara T.J., Carolsfeld J., Kitamura S. 1999. The variability of the gustatory sensibility in salmonids, with special reference to strain differences in rainbow trout, Oncorhynchus mykiss // Can. J. Fish. Aquat. Sci. V. 56. P. 13–24.
Haslewood G.A.D. 1967. Bile salt evolution // J. Lipid Res. V. 8. P. 535–550.
Haslewood G.A.D. 1978. The biological importance of bile salts. Amsterdam: North-Holland Publ. Co., 206 p.
Hellstrøm T., Døving K.B. 1986. Chemoreception of taurocholate in anosmic and sham-operated cod Gadus morhua // Behav. Brain Res. V. 21. P. 155–162.
Hofmann A.F. 1999. Bile acids: the good, the bad, and the ugly // News Physiol. Sci. V. 14. P. 24–29.
Hofmann A.F., Hagey L.R. 2008. Bile acids: chemistry, pathochemistry, biology, pathobiology, and therapeutics // Cell. Mol. Life Sci. V. 65. P. 2461–2483.
Horppila J. 1994. The diet and growth of roach (Rutilus rutilus (L.)) in Lake Vesijarvi and possible changes in the course of biomanipulation // Hydrobiologia. V. 294. P. 35–41.
Huertas M., Hubbard P.C., Canário A.M., Cerdà J. 2007. Olfactory sensitivity to conspecific bile fluid and skin mucus in the European eel Anguilla anguilla (L) // J. Fish Biol. V. 70. P. 1907–1920.
Huertas M., Hagey L., Hofmann A.F. et al. 2010. Olfactory sensitivity to bile fluid and bile salts in the European eel (Anguilla anguilla), goldfish (Carassius auratus) and Mozambique tilapia (Oreochromis mossambicus) suggests a ‘broad range’ sensitivity not confined to those produced by conspecifics alone // J. Exp. Biol. V. 213. P. 308–317.
Huppop K. 1987. Food-finding ability in cave fish (Astyanax fasciatus) // Int. J. Speleol. V. 16. P. 59–66.
Hynes H.B.N. 1950. The food of fresh-water sticklebacks (Gasterosteus aculeatus and Pygosteus pungitius), with a review of methods used in studies of the food of fishes // J. Anim. Ecol. V. 19. P. 36–58.
Iwasaki K., Kasahara T., Sato M. 1985. Gustatory effectiveness of amino acids in mice: behavioral and neurophysiological studies // Physiol. Behav. V. 34. P. 531–542.
Jones K.A. 1989. The palatability of amino acids and related compounds to rainbow trout, Salmo gairdneri Richardson // J. Fish Biol. V. 34. № 1. P. 149–160.
Kasumyan A. Døving K.B. 2003. Taste preferences in fish // Fish Fish. V. 4. № 4. P. 289–347.
Kawai M., Sekine-Hayakawa Y., Okiyama A., Ninomiya Y. 2012. Gustatory sensation of L- and D-amino acids in humans // Amino Acids. V. 43. P. 2349–2358.
Khallaf E.A., Alne-na-ei A.A. 1987. Feeding ecology of Oreochromis niloticus (Linnaeus) & Tilapia zillii (Gervais) in a Nile Canal // Hydrobiologia. V. 146. № 1. P. 57–62.
Kotrschal K., Peters R.C., Døving K.B. 1996. Chemosensory and tactile nerve responses from the anterior dorsal fin of a rockling, Gaidropsarus vulgaris (Gadidae, Teleostei) // Prim. Sens. Neuron. V. 1. № 4. P. 297–309.
Lamb C., Finger T.E. 1995. Gustatory control of feeding behavior in goldfish // Physiol. Behav. V. 57. P. 483–488.
Li K., Buchinger T.J., Bussy U. et al. 2015. Quantification of 15 bile acids in lake charr feces by ultra-high performance liquid chromatography–tandem mass spectrometry // J. Chromatogr. V. 1001B. P. 27−34.
Li W., Sorensen P.W., Gallaher D.D. 1995. The olfactory system of migratory adult sea lamprey (Petromyzon marinus) is specifically and acutely sensitive to unique bile acids released by conspecific larvae // J. Gen. Physiol. V. 105. № 5. P. 569–587.
Li W.M., Scott A.P., Siefkes M.J. et al. 2002. Bile acid secreted by male sea lamprey that acts as a sex pheromone // Science. V. 296. № 5565. P. 138–141.
Mackie A.M., Mitchell A.I. 1982. Further studies on the chemical control of feeding behaviour in the Dover sole, Solea solea // Comp. Biochem. Physiol. V. 73A. № 1. P. 89–93.
Marui T., Caprio J. 1992. Teleost gustation // Fish chemoreception / Ed. Hara T.J. London: Chapman and Hall. P. 171–198.
Mettam J.J., McCrohan C.R., Sneddon L.U. 2012. Characterisation of chemosensory trigeminal receptors in the rainbow trout, Oncorhynchus mykiss: responses to chemical irritants and carbon dioxide // J. Exp. Biol. V. 215. P. 685–693.
Michel W.C., Lubomudrov L.M. 1995. Specificity and sensitivity of the olfactory organ of the zebrafish, Danio rerio // J. Comp. Physiol. V. 177A. P. 191–199.
Mitchell R.W., Russell W.H., Elliott W.R. 1977. Mexican eyeless characin fishes, genus Astyanax: environment, distribution, and evolution // Spec. Publ. Mus. Texas Tech. Univ. V. 12. P. 1–89.
Morais S. 2016. The physiology of taste in fish: potential implications for feeding stimulation and gut chemical sensing // Rev. Fish. Sci. Aquacult. V. 25. № 2. P. 133−149.https://doi.org/10.1080/23308249.2016.1249279
Moyer J.T., Nakazono A. 1978. Population structure, reproductive behavior and protogynous hermaphroditism in the angelfish Centropyge interruptus at Miyakejima, Japan // Jpn. J. Ichthyol. V. 25. P. 25–39.
Polkinghorne C.N., Olson J.M., Gallaher D.G., Sorensen P.W. 2001. Larval sea lamprey release two unique bile acids to the water at a rate sufficient to produce detectable riverine pheromone plumes // Fish Physiol. Biochem. V. 24. № 1. P. 15–30.
Popper A.N. 1970. Auditory capacities of the Mexican blind cave fish (Astyanax jordani) and its eyed ancestor (Astyanax mexicanus) // Anim. Behav. V. 18. P. 552–562.
Robertson D.R. 1982. Fish feces as fish food on a pacific coral reef // Mar. Ecol. Progr. Ser. V. 7. P. 253–265.
Rolen S.H., Caprio J. 2008. Bile salts are effective taste stimuli in channel catfish // J. Exp. Biol. V. 211. P. 2786–2791.
Romero A., Green S.M. 2005. The end of regressive evolution: examining and interpreting the evidence from cavefish // J. Fish Biol. V. 67. P. 3–32.
Sazima I., Sazima C., Silva J.M., Jr. 2003. The cetacean offal connection: feces and vomits of spinner dolphins as a food source for reef fishes // Bull. Mar. Sci. V. 72. P. 151–160.
Schemmel C. 1967. Vergleichende Untersuchungen an den Hautsinnesorganen ober- und unterirdisch lebender Astyanax-Formen // Z. Morphol. Tiere. Bd. 61. S. 255–316.
Sola C., Tosi L. 1993. Bile salts and taurine as chemical stimuli for glass eels, Anguilla anguilla: a behavioral study // Environ. Biol. Fish. V. 37. P. 197–204.
Stabell O.B. 1987. Intraspecific pheromone discrimination and substrate marking by Atlantic salmon parr // J. Chem. Ecol. V. 13. № 7. P. 1625–1643.
Teyke T. 1990. Morphological differences in neuromasts of the blind cave fish Astyanax hubbsi and the sighted river fish Astyanax mexicanus // Brain Behav. Evol. V. 35. P. 23–30.
Tinti J.M., Glaser D., Wanner M., Nofre C. 2000. Comparison of gustatory responses to amino acids in pigs and in humans // LWT − Food Sci. Technol. V. 33. № 8. P. 578–583.
Weissert R., Campenhausen C., von. 1981. Discrimination between stationary objects by the blind cave fish Anopthichthys jordani (Characidae) // J. Comp. Physiol. V. 143A. P. 378–381.
Wilkens H. 1972. Zur phylogenetischen Rückbildung des Auges Cavernicoler: Untersuchungen an Anoptichthys jordani (=Astyanax mexicanus) // Ann. Spéléol. V. 27. P. 411–432.
Wilkens H. 1988. Evolution and genetics of epigean and cave Astyanax fasciatus (Characidae, Pisces) support for the neutral mutation theory // Evolutionary biology. V. 23 / Eds. Hecht M.K., Wallace B. N.Y.: Plenum Publ. Co. P. 271–367.
Yallaly K.L., Seibert J.R., Phelps Q.E. 2015. Synergy between silver carp egestion and benthic fishes // Environ. Biol. Fish. V. 98. P. 511–516.
Yamashita S., Yamada T., Hara T.J. 2006. Gustatory responses to feeding- and nonfeeding-stimulant chemicals, with special emphasis on amino acids, in rainbow trout // J. Fish Biol. V. 68. P. 783–800.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


