Вопросы ихтиологии, 2019, T. 59, № 4, стр. 461-471
Оценка обилия донных рыб на шельфе и материковом склоне Северного Приморья
Д. Г. Кравченко 1, *, Д. В. Измятинский 1
1 Тихоокеанский филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии −ТИНРО
Владивосток, Россия
* E-mail: gennadyevich85@yandex.ru
Поступила в редакцию 12.09.2018
После доработки 19.02.2019
Принята к публикации 25.02.2019
Аннотация
По материалам донных траловых съёмок 2009–2015 гг. оценена биомасса и численность донных рыб Японского моря между мысами Поворотный и Золотой (Северное Приморье). Приводятся сведения о популяционной структуре массовых видов рыб в районе работ. По среднемноголетним данным по биомассе доминируют камбала Надёжного Acanthopsetta nadeshnyi (20.43%) и минтай Gadus chalcogrammus (11.31%). Общая среднемноголетняя ихтиомасса составляет 188.3 тыс. т, или 5.4 т/км2; численность – 1482.6 млн экз., или 42.3 тыс. экз/км2. Средняя удельная биомасса рыб по годам варьировала от 1.8 (в 2010 г.) до 7.8 т/км2 (в 2014 г.). В 2010-х гг. по сравнению с 2000-ми средняя удельная биомасса рыб увеличилась примерно в два раза за счёт появления ряда относительно урожайных поколений массовых видов донного ихтиоцена.
В российской зоне Японского моря в целом зарегистрировано более 310 видов рыб (Новиков и др., 2002; Соколовский и др., 2007; Панченко и др., 2016; Кравченко и др., 2018). В литературе имеются сведения об оценках численности и биомассы рыб в районе между мысами Поворотный и Золотой до 2008 г. (Гаврилов и др., 1988; Борец, 1990, 1997; Дударев, 1996; Дударев и др., 1998, 2000; Вдовин и др., 2004; Калчугин и др., 2006; Соломатов, 2008). После 2008 г. было опубликовано только две обобщающие работы по ресурсам донных и придонных рыб на основе данных экспедиции, проведённой 31.03−08.07.2015 г. (Калчугин и др., 2016а, 2016б). Однако изменения в составе донного ихтиоцена происходили и с 2008 по 2015 гг. В этот период учётные донные траловые съёмки не прекращались, у нас накоплено достаточно данных для того, чтобы выявить произошедшие изменения в составе донной ихтиофауны на протяжении всех указанных лет. Кроме того, в разные годы менялись состав доминирующих видов и видовая структура ихтиоцена. При этом в изменении биомассы (как и численности) конкретных массовых видов проявлялись разные тенденции. Изучение этих тенденций должно приблизить к пониманию общих причин формирования рыбной сырьевой базы района исследований.
Цель работы – оценить численность и биомассу донного ихтиоцена на акватории Японского моря между мысами Поворотный и Золотой по среднемноголетним данным 2009−2015 гг. и сравнить их с более ранними оценками других авторов.
МАТЕРИАЛ И МЕТОДИКА
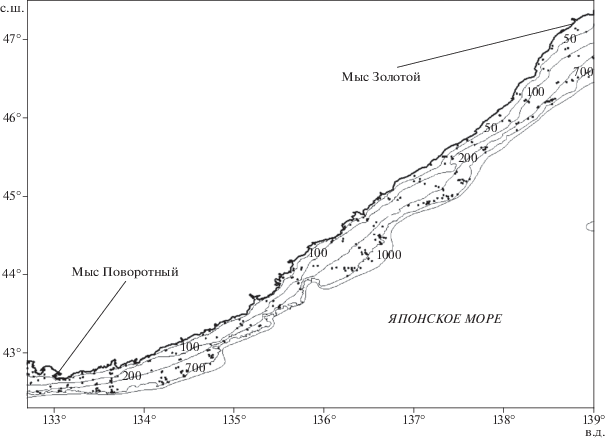
В основу работы положены материалы учётных донных траловых съёмок и контрольных тралений, выполненных в экспедициях ТИНРО-центра в марте–декабре 2009–2015 гг. на судах типа СТМ “Профессор Кизеветтер” (2009 г.), РК МРТ “Бухоро” (2009–2015 гг.) и МРТК “Янтарь” (2009–2012 гг.). Тралениями была охвачена вся морская акватория Северного Приморья от м. Поворотный до м. Золотой в диапазоне глубин 20–1000 м (рис. 1). В целях учета особенностей батиметрического распределения рыб мы старались полноценно охватить все рассматриваемые глубины. Так, за весь период работ на глубинах 20−100 м сделано 531 траление, 100−200 м – 341, 200−300 м – 309, 300−400 м – 266, 400−500 м – 228, 500−600 м – 202, 600−700 м – 156 и 700− 1000 м – 177 тралений. Траления на глубинах <20 м не выполняли, поскольку в Северном Приморье во многих местах распространены скальные породы, разрывающие трал. Всего было выполнено 2210 тралений: из них в 2009 г. – 324, в 2010 г. – 331, в 2011 г. – 319, в 2012 г. – 314, в 2013 г. – 279, в 2014 г. – 306, в 2015 г. – 337. Использовали донные тралы типа ДТ/ТВ с мягким грунтропом двух конструкций: с длиной верхней подборы 27.1 м (СТМ “Профессор Кизеветтер” и РК МРТ “Бухоро”) и 23.2 м (МРТК “Янтарь”), горизонтальным раскрытием в среднем соответственно 13 и 15 м. Вертикальное раскрытие тралов варьировало в пределах 6−8 м; продолжительность одного траления 20−60 мин, чаще всего составляла 30 мин. Площадь облова изменялась в диапазоне 0.020− 0.097 км2. Длина ваеров при тралениях зависела от глубины места, составляя от 50 м на глубине около 20 м до 2100 м на глубине около 1000 м. Ячея в кутце используемых тралов изначально была равна 30 мм, но в каждый трал была вшита мелкоячейная вставка с размером ячеи 10 мм. Скорость хода разных судов при тралениях немного различалась: на СТМ “Профессор Кизеветтер” она составляла 2.7−3.5, на РК МРТ “Бухоро” – 2.5−3.0, а на МРТК “Янтарь” – не более 2.5 узлов.
Численность (N, экз.) и биомассу (W, кг) рыб оценивали методом площадей по формуле (Аксютина, 1968): N(W) = (с × Q)/(q × k), где c – улов вида, экз. или кг, Q – площадь исследуемой акватории, км2, q – площадь траления, км2, k – коэффициент уловистости трала, являющийся индивидуальным для разных видов и размерных групп рыб. Взятые нами значения коэффициентов уловистости приведены в более ранней публикации (Измятинский, Калчугин, 2010).
В качестве показателя обилия того или иного вида в рассматриваемом районе был выбран средний улов (экз/ч траления) по аналогии с работой Борца (1985). При уловах свыше 20 экз. в среднем по всему району вид относили к массовым, 0.5−20 экз. – к обычным, менее 0.5 экз. – к редким. Так как использовали тралы двух конструкций, при определении данного показателя все уловы 23.2-метрового трала пересчитывали на 27.1-метровый трал.
Для характеристики встречаемости видов в уловах принята шкала, предложенная Шейко и Федоровым (2000), согласно которой к категории высокая частота встречаемости относятся виды, отмеченные более чем в 50% уловов; средняя частота встречаемости – вид, обнаруженный в 10–50% уловов; низкая частота встречаемости – вид, зарегистрированный в менее чем 10% уловов.
Используемые в статье латинские названия рыб соответствуют электронному каталогу Калифорнийской академии наук (Eschmeyer, 2018).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За период исследований в Японском море на акватории между мысами Поворотный и Золотой (рис. 1) мы зарегистрировали 159 видов рыб донного ихтиоцена. В 2009–2015 гг. доли только двух видов превысили 10% суммарной ихтиомассы в диапазоне глубин 20–1000 м (таблица). Это колючая камбала, или камбала Надёжного Acanthopsetta nadeshnyi, (доминантный вид) и минтай Gadus chalcogrammus (субдоминант 1-го порядка). По среднемноголетним данным, наиболее значительный вклад в ихтиомассу вносила камбала Надёжного (20.43%), доля минтая была почти в два раза меньше (11.31%).
Для выявления причин формирования скоплений видов в конкретном географическом районе важны знания об их популяционной организации (Правдин, 1966; Никольский, 1974; Федоров, Гильманов, 1980; Одум, 1986а, 1986б). Считается, что камбала Надёжного, как и другие камбалы в водах Приморья, представлена одной популяцией (Вдовин и др., 2001; Фадеев, 2005). Но её скопления разбиваются на локальные стада. Так, предполагается, что производители камбалы Надёного в зал. Петра Великого и в водах Северного Приморья репродуктивно изолированы друг от друга (Моисеев, 1953; Гаврилов, 1998; Иванкова, 2001; Фадеев, 2005). Биомасса колючей камбалы высока вдоль всего побережья Приморья, но в водах севернее м. Поворотный плотность её распределения, как правило, выше. Это обусловлено тем, что на акватории севернее м. Поворотный глубины в основном превышают 50 м, что благоприятно для камбалы Надёжного, предпочитающей нижнюю часть шельфа и верхние отделы континентального склона. В зал. Петра Великого доля акватории с глубинами >50 м не так значительна.
Характеристика состава, обилия и промыслового значения видов рыб, преобладающих в уловах донного трала в Северном Приморье между мысами Поворотной и Золотой на глубинах 20−1000 м в 2009−2015 гг. (M ± m)
| Вид | Численность, экз/км2 | Биомасса, кг/км2 | Доля, % общей | Масса, г | Длина (FL), см | ЭГ | Промысловое значение | ||
|---|---|---|---|---|---|---|---|---|---|
| числен-ности | биомассы | средняя | промыс-ловая* | ||||||
| Acanthopsetta nadeshnyi | 7517.12 ± 794.4 | 1096.41 ± 429.7 | 17.79 | 20.43 | 146 ± 39 | 26 ± 2 | 23 | эл | Промысловый |
| Gadus chalcogrammus | 6070.42 ± 683.2 | 606.84 ± 108.3 | 14.36 | 11.31 | 100 ± 25 | 25 ± 2 | 37 | эл | То же |
| Myoxocephalus polyacanthocephalus | 296.86 ± 41.6 | 480.05 ± 92.7 | 0.70 | 8.94 | 1617 ± 216 | 47 ± 3 | – | эл | Перспективный |
| Pleurogrammus azonus | 1985.37 ± 418.7 | 420.45 ± 52.3 | 4.70 | 7.83 | 212 ± 55 | 26 ± 2 | 23 | эл | Промысловый |
| Glyptocephalus stelleri | 1956.34 ± 407.2 | 372.82 ± 78.4 | 4.63 | 6.95 | 191 ± 43 | 29 ± 2 | 23 | эл | То же |
| Gymnocanthus detrisus | 1707.15 ± 392.1 | 349.99 ± 45.1 | 4.04 | 6.52 | 205 ± 42 | 25 ± 2 | – | эл | Перспективный |
| Bathyraja parmifera | 115.43 ± 38.3 | 332.32 ± 42.6 | 0.27 | 6.19 | 2879 ± 329 | 71 ± 4 | – | мб | То же |
| Clupea pallasii | 10348.55 ± 1203.4 | 255.93 ± 40.8 | 24.48 | 4.77 | 25 ± 8 | 14 ± 1 | 24 | нп | Промысловый |
| Gymnocanthus herzensteini | 901.77 ± 136.4 | 237.49 ± 41.2 | 2.13 | 4.43 | 263 ± 59 | 28 ± 2 | – | эл | Перспективный |
| Gadus macrocephalus | 70.19 ± 14.2 | 124.36 ± 26.1 | 0.17 | 2.32 | 1772 ± 386 | 53 ± 3 | 43 | эл | Промысловый |
| Hippoglossoides dubius | 278.54 ± 43.5 | 86.39 ± 19.4 | 0.66 | 1.61 | 310 ± 83 | 33 ± 2 | 23 | эл | То же |
| Enophrys diceraus | 262.60 ± 42.1 | 69.88 ± 12.3 | 0.62 | 1.30 | 266 ± 64 | 25 ± 2 | – | эл | Перспективный |
| Bothrocara hollandi | 1373.10 ± 423.7 | 68.93 ± 11.9 | 3.25 | 1.28 | 50 ± 17 | 23 ± 2 | – | мб | Непромысловый |
| Icelus cataphractus | 1436.93 ± 424.2 | 66.87 ± 11.5 | 3.40 | 1.25 | 47 ± 16 | 18 ± 2 | – | эл | Перспективный |
| Eleginus gracilis | 801.20 ± 115.6 | 60.64 ± 11.4 | 1.90 | 1.13 | 76 ± 22 | 22 ± 2 | 21 | эл | Промысловый |
| Pseudopleuronectes herzensteini | 281.22 ± 48.1 | 59.43 ± 10.9 | 0.67 | 1.11 | 211 ± 56 | 27 ± 2 | 23 | сл | То же |
| Myoxocephalus jaok | 53.26 ± 8.0 | 55.47 ± 10.7 | 0.13 | 1.03 | 1041 ± 186 | 43 ± 3 | – | эл | Перспективный |
| Lycodes tanakae | 88.24 ± 19.6 | 54.75 ± 11.3 | 0.21 | 1.02 | 620 ± 115 | 48 ± 3 | – | мб | То же |
| Osmerus mordax dentex | 1523.76 ± 426.0 | 32.21 ± 9.2 | 3.61 | 0.60 | 21 ± 6 | 14 ± 1 | 17 | ан | Промысловый |
| Hypoptychus dybowski | 526.11 ± 92.1 | 1.23 ± 0.2 | 1.24 | 0.02 | 2 ± 1 | 8 ± 1 | – | сл | Непромысловый |
| Прочие | 4671.11 ± 526.4 | 534.36 ± 93.6 | 11.05 | 9.96 | 114 ± 26 | ||||
| Всего | 42265.29 ± 1482.6 | 5366.82 ± 648.3 | 100 | 100 | 127 ± 38 | ||||
Примечание. M ± m – среднее значение и его ошибка; *приведённая в Правилах рыболовства минимальная промысловая длина (стандартная, SL) пересчитана на длину по Смитту (FL); ЭГ – экологическая группировка вида: сл – сублиторальный, эл – элиторальный, мб – мезобентальный, нп – неритопелагический, ан – анадромный.
Среднемноголетняя удельная биомасса камбалы Надёжного в 2009–2015 гг. была равна 1096.41 кг/км2. Сопоставляя эту цифру с данными литературы (Измятинский, 2012; Шунтов и др., 2014; Шунтов, Волвенко, 2015, 2016а, 2016б), можно сделать вывод о том, что мы имеем дело с историческим максимумом плотности обилия камбалы Надёжного в северо-западной части Японского моря. По крайней мере по данным Измятинского (2012), удельная биомасса этой камбалы в элиторали российской зоны Японского моря только один раз приближалась к 600 кг/км2 (1994 г.), а в период с 1983 по 2006 гг. обычно находилась на уровне <300 кг/км2.
Камбала Надёжного в массе созревает на 6-м году жизни, в то время как возраст массового полового созревания других камбал составляет 3−5 лет (Моисеев, 1953; Иванков и др., 1972; Иванкова, 1975; Фадеев, 2005). Было отмечено, что предыдущие вспышки численности камбалы Надёжного были сопряжены с большим количеством молоди в её уловах (Измятинский, 2012). Но при проведенном нами анализе размерного состава стало очевидно, что скопления камбалы Надёжного в 2009−2015 гг. в основном были представлены половозрелыми особями. Так, её средняя длина в уловах была равна 26 см, тогда как при массовом половом созревании длина этой камбалы составляет 16 см.
Таким образом, мы наблюдали уникальную ситуацию, когда удельная биомасса камбалы Надёжного была особенно высока и в уловах она в основном была представлена промысловыми особями. Видимо, такие обстоятельства сформировались вследствие невостребованности промыслом камбалы Надёжного в 2000-е гг., который в то время был ориентирован на другие, более ценные промысловые виды рыб. Однако в середине 2010-х гг. в водах Приморья можно было рекомендовать промысел именно камбалы Надёжного, которая, не являясь первостепенным промысловым объектом, всё же обладает хорошими гастрономическими (при правильном приготовлении) и питательными свойствами.
В российской зоне Японского моря выделяют четыре популяции минтая: корейскую, южноприморскую, западносахалинскую и северной части Татарского пролива, пространственно разобщённые между собой и различающиеся сроками нереста (Шунтов и др., 1993; Нуждин, 1998; Зверькова, 2003). В водах Северного Приморья от мыса Поворотного до мыса Золотого, по сути, распространена только южноприморская популяция. Но также нельзя исключать проникновение в данный район особей минтая из других япономорских популяций. В плане обилия минтая рассматриваемые годы (2009–2015) следует считать периодом его низкой численности. В течение этих лет средняя удельная биомасса минтая составляла 606.84 кг/км2, тогда как в годы средней численности этот показатель достигал не менее 2−4 т/км2, а в годы высокой численности порой превышал 10 т/км2 (Измятинский, 2012).
В общем можно заключить, что в 2009–2015 гг., по сравнению с более ранним периодом, в донном ихтиоцене Японского моря на акватории между мысами Поворотный и Золотой произошла смена доминирующего вида. По данным съёмок, до 2006 г. в большинстве лет наблюдений по биомассе преобладал минтай, в другие годы несколько больше было южного однопёрого терпуга Pleurogrammus azonus, а иногда – тихоокеанской сельди Clupea pallasii (Шунтов, 2016). Теперь же минтай уступил первое место по биомассе камбале Надёжного, что, по нашим данным, произошло впервые. Кроме перелова, снижение численности минтая связывают со сменой климатических эпох, обусловливающих перестройки в сообществах (Шунтов и др., 1997; Шунтов, 2016). Считается, что численность минтая особенно высока в годы похолодания (Шунтов и др., 1993; Зверькова, 2003). Но в первом и втором десятилетиях XXI в. наметились тенденции потепления, что, возможно, и обусловило снижение численности минтая.
Следующая группа рыб, которую можно выделить по обилию, это субдоминанты более низкого порядка (со 2-го по 17-й), которые населяют различные биотопы. В донных траловых съёмках их доля по биомассе (57.68%) больше, чем совместная доля доминанта и субдоминанта 1-го порядка (таблица). Среди выделенных субдоминантов 2–17-го порядков в число видов, имеющих промысловое значение, входят южный однопёрый терпуг, малорот Стеллера Glyptocephalus stelleri, южная палтусовидная Hippoglossoides dubius и жёлтополосая Pseudopleuronectes herzensteini камбалы, тихоокеанская сельдь, тихоокеанская треска Gadus macrocephalus и дальневосточная навага Eleginus gracilis.
В Японском море выделяют три популяции южного однопёрого терпуга (Вдовин, 1988). Но в Северном Приморье в основном встречаются особи только одной из них, а именно приморской популяции. Иногда в южную часть исследуемых вод могут проникать особи корейской популяции терпуга. А третья япономорская популяция терпуга географически абсолютно изолирована от этого района, так как распространена только у о-ва Хоккайдо и частично у о-ва Хонсю.
Малорот Стеллера, южная палтусовидная и жёлтополосая камбалы, подобно камбале Надёжного, в российской части Японского моря, судя по всему, имеют однопопуляционную структуру. Но популяции этих камбал разбиваются на отдельные стада субпопуляционного ранга. Так, скопления данных камбал в районе между мысами Поворотный и Золотой, по-видимому, не пересекаются с их скоплениями в зал. Петра Великого и Татарском проливе. По крайней мере, по устному сообщению З.Г. Иванковой (ТИНРО), результаты мечения, проводимого в 1970-х гг., не установили наличие миграций камбал между указанными акваториями.
Внутривидовая структура тихоокеанской сельди в российской зоне Японского моря представлена четырьмя популяциями: зал. Петра Великого, пластуно-нельманской, сахалино-хоккайдской и де-кастринской (Гаврилов, 1998; Науменко, 2001; Фадеев, 2005). В водах от м. Поворотный до м. Золотой основу сельдевых скоплений образует пластуно-нельманская популяция. Но на юге исследуемых вод в значительных количествах может встречаться и сельдь из популяции зал. Петра Великого. Калчугин и Вдовин (2000) проводят границу между этими двумя популяциями по зал. Ольга. Основанием для данного популяционного деления является тот факт, что длина особей пластуно-нельманской сельди не превышает 35 см. Значит, особи сельди FL > 35 см, известные из южной части района работ, относятся к популяции зал. Петра Великого. Севернее зал. Ольга такие особи не отмечались. В северной части района работ может иметь место некоторое смешение сельдей пластуно-нельманской, сахалино-хоккайдской и де-кастринской популяций, хотя смешение этих популяций гораздо менее вероятно, чем пересечение пластуно-нельманской популяции с популяцией зал. Петра Великого. Сахалино-хоккайдскую от пластуно-нельманской сельди отделяет глубоководная котловина Японского моря, а де-кастринская сельдь, мало того что удалена от пластуно-нельманской географически, ещё и относится к другим экологическим формам сельдей. Так, де-кастринская сельдь представлена озёрными и прибрежными формами, в то время как пластуно-нельманская является морской сельдью (Фролов, 1949, 1950).
Тихоокеанская треска и дальневосточная навага в северо-западной части Японского моря не разбиваются на популяции, но, по мнению изучавших эти виды авторов, в разных районах северо-западной части Японского моря (в зал. Петра Великого, между мысами Поворотный и Золотой и в Татарском проливе) существуют самостоятельные стада как трески (Моисеев, 1953), так и наваги (Дубровская, 1953; Покровская, 1960), которые из одного района в другой, как правило, не мигрируют.
Согласно показателю обилия, предложенному Борцом (1985), по результатам наших исследований девять видов (камбала Надёжного, минтай, южный однопёрый терпуг, малорот Стеллера, охотский шлемоносец Gymnocanthus detrisus, тихоокеанская сельдь, голландский аллолепис Bothrocara hollandi, колючий ицел Icelus cataphractus, зубастая корюшка Osmerus mordax dentex) оказались массовыми, 63 вида – обычными и 87 – редкими.
Из ценных промысловых объектов в донном ихтиоцене япономорских вод от м. Поворотный до м. Золотой к обычным видам относятся сублиторальные камбалы, в частности, японская Pseudopleuronectes yokohamae, жёлтопёрая Limanda aspera, длиннорылая L. punctatissima, остроголовая Cleisthenes herzensteini и звёздчатая Platichthys stellatus, которые образуют промысловые скопления в соседнем зал. Петра Великого, где зона сублиторали более обширна. Среди обычных представителей ихтиоцена рассматриваемого района к перспективным для промысла объектам можно отнести более 15 видов бычков семейств Cottidae, Hemitripteridae и Psychrolutidae, несколько видов ликодов семейства Zoarcidae, липарисов семейства Liparidae и японского волосозуба Arctoscopus japonicus. Данные виды пользуются промышленным спросом в других странах, географически близких к России. Среди обычных в уловах непромысловых видов донного ихтиоцена здесь, как и в других районах дальневосточных морей России, много представителей семейств лисичковых (Agonidae) и стихеевых (Stichaeidae).
Самую маленькую часть в промысловой ихтиофауне составляют редкие виды. Они вносят 0.06% в общую среднемноголетнюю численность и 0.09% в общую среднемноголетнюю биомассу. Часть из этих видов на самом деле очень малочисленны (например, стихей Невельского Stichaeopsis nevelskoi и двугуб разукрашенный Bilabria ornata), другие – из-за особенностей биологии – плохо облавливаются донным тралом, в том числе по причине их обитания на малых глубинах. Так, например, батимастер Дерюгина Bathymaster derjugini и мраморный керчак Myoxocephalus stelleri обитают на глубинах <20 м – за пределами доступных глубин для работы судна. Кроме того, в категорию малочисленных видов попали рыбы, которые относятся к случайным элементам рассматриваемого нами донного ихтиоцена. Это виды рыб, для которых родным биотопом является пелагиаль (например, сима Oncorhynchus masou); причём многие из них входят в состав субтропического комплекса рыб, совершающих сезонные миграции из низких широт в район наших исследований (тихоокеанская сайра Cololabis saira, японский анчоус Engraulis japonicas, японский гипероглиф Hyperoglyphe japonica, собаки-рыбы – Takifugu porphyreus и T. stictonotus).
Говоря о частоте встречаемости видов в уловах, следует отметить, что четыре вида рыб (камбала Надёжного, минтай, южный однопёрый терпуг и малорот Стеллера) за время исследований (2009–2015 гг.) имели высокую частоту встречаемости в уловах. Ещё 43 вида характеризовались средней частотой встречаемости (10−50%). В разные годы состав видов с высокой и средней частотой встречаемости существенно изменялся. Однако за весь период исследований можно выделить 12 видов, имевших постоянно высокую либо среднюю частоту встречаемости. К ним относятся минтай, камбала Надёжного, малорот Стеллера и южная палтусовидная кмбала, тихоокеанская треска, тихоокеанская сельдь, дальневосточная навага, охотский шлемоносец, колючий ицел, многоиглый керчак Myoxocephalus polyacanthocephalus, керчак-яок M. jaok и охотский липарис Liparis ochotensis. Но большинство видов характеризовались низкой частотой встречаемости. Хотя среди последних есть виды, которые на самом деле не являются малочисленными. Например, крючкороги рода Artediellus присутствовали в 1% траловых уловов, что связано с их зарыванием в грунт. В то же время, по архивным данным ТИНРО, при выполнении дражных уловов обилие крючкорогов вырастает в сотни и даже тысячи раз (Кравченко и др., 2017).
Среди всех семейств рыб самую значительную долю по биомассе в донном ихтиоцене на рассматриваемой акватории Японского моря составляют Pleuronectidae. Тогда как число видов в семействе рогатковых (Cottidae) в 2.5 раза, а в семействе стихеевых в 1.5 раза больше, чем в семействе камбаловых. Бельдюговые (Zoarcidae) и лисичковые (с намного меньшим вкладом в ихтиомассу, чем у камбаловых) имеют примерно такое же, как камбаловые, число видов. Семейства с относительно маленьким числом видов могут вносить весьма существенный вклад в ихтиомассу. Так, в состав Gadidae входят только три вида, но по биомассе они находятся на 3-м месте (после камбаловых и рогатковых). Терпуговые, представленные тремя видами, по биомассе занимают 4-е место, а три вида скатов (Rajidae и Arhynchobatidae) – 5-е место. В целом, за исключением камбаловых и рогатковых, вклад семейств с самым большим числом видов в промысловую биомассу рыб не значим.
В целом по среднемноголетней оценке общая численность донного ихтиоцена вод Приморья от м. Поворотный до м. Золотой составила 1482.6 млн экз., а биомасса – 188.3 тыс. т; средняя удельная численность и биомасса − соответственно 42.3 тыс. экз/км2 и 5.4 т/км2 (таблица). Последняя цифра близка к среднемноголетней оценке удельной биомассы круглоротых и рыб в бентали всей северо-западной части Японского моря. По данным Шунтова (2016), данная величина составляет 5.9 т/км2, а в других морях российского Дальнего Востока она значительнее и в Охотском море достигает 9.9, в Беринговом – 13.6, в тихоокеанских водах Курильских о-вов – 17.1, в тихоокеанских водах Камчатки – 20.6 т/км2.
Средняя удельная биомасса рыб на изучаемой акватории в рассматриваемый период варьировала в пределах 1.8−7.8 т/км2 (рис. 2). В разные годы различались как состав преобладающих видов с долей в ихтиомассе >10% и число таких видов (от одного до четырёх), так и их общая доля по биомассе − от 39.6 (2015 г.) до 56.8% (2009 г.).
Рис. 2.
Динамика удельной биомассы рыб на шельфе и материковом склоне Северного Приморья от м. Поворотный до м. Золотой в диапазоне глубин 20−1000 м, 2009−2015 гг.
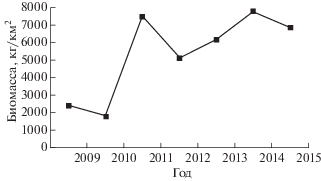
Особенно специфичным в плане состава доминирующих по биомассе в донном ихтиоцене видов оказался 2009 г., когда мало того что только один вид имел долю >10% ихтиомассы, но этим видом оказалась ещё и тихоокеанская сельдь; а 2-е место по обилию заняла зубастая корюшка, относящаяся к проходным видам. Хотя по биомассе в 2009 г. её доля была 6.8%, по численности корюшка составила 11% общего числа особей. В остальные годы обязательным компонентом в составе преобладающих по биомассе видов (>10% ихтиомассы) была камбала Надёжного, по три года из семи такими видами были минтай (2011, 2014, 2015), многоиглый керчак и южный однопёрый терпуг (2012, 2013, 2014) и в один год (2011) – малорот Стеллера. Колебания суммарной биомассы в донном ихтиоцене главным образом происходили за счёт вариабельности биомассы девяти видов: камбалы Надёжного, малорота Стеллера, минтая, тихоокеанской сельди, многоиглого керчака, южного однопёрого терпуга, охотского и дальневосточного Gymnocanthus herzensteini шлемоносцев и щитоносного ската Bathyraja parmifera. Индивидуальные оценки удельной биомассы остальных видов в разные годы менялись менее чем на 300 кг. Наиболее значительно колебались биомассы камбалы Надёжного, минтая и тихоокеанской сельди – более чем на 1000 кг/км2.
Ранее камбала Надёжного по биомассе не занимала первое место (Дударев, 1996; Дударев и др., 1998, 2000; Соломатов, 2002, 2008). В 2009 г. её биомасса составляла всего 142 кг/км2, в последующие два года наблюдался резкий скачок – до 1839 кг/км2 в 2011 г. Затем биомасса камбалы Надёжного несколько снизилась и в течение 3 лет (2012–2014) держалась на уровне ~1100−1200 кг/км2, а в 2015 г. чуть поднялась − до 1381 кг/км2 (рис. 3а). Во все рассматриваемые годы камбала Надёжного в уловах была представлена в основном особями промысловых размеров.
Рис. 3.
Удельная биомасса и средняя длина (FL) рыб в уловах на шельфе и материковом склоне Северного Приморья от м. Поворотный до м. Золотой в диапазоне глубин 20−1000 м, 2009−2015 гг.: а − камбала Надёжного Acanthopsetta nadeshnyi, б – минтай Gadus chalcogrammus, в − тихоокеанская сельдь Clupea pallasii, г − многоиглый керчак Myoxocephalus polyacanthocephalus, д − малорот Стеллера Glyptocephalus stelleri, е − южный однопёрый терпуг Pleurogrammus azonus; (◆) – биомасса, (▲) – длина (FL).
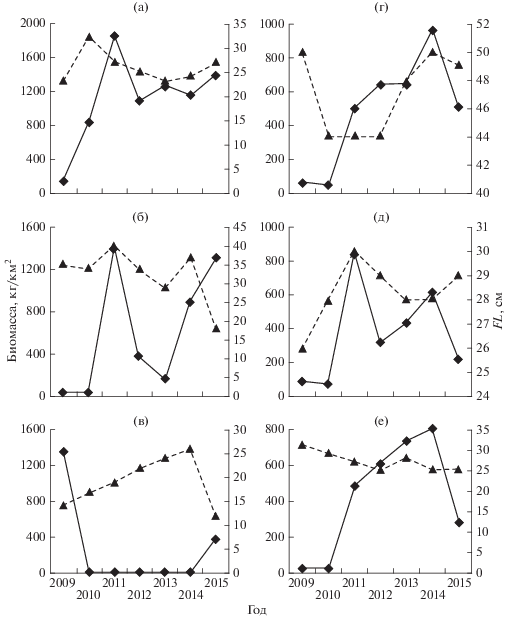
Более резкие скачки биомассы наблюдались у минтая (рис. 3б). В 2009−2010 гг. биомасса этого вида была низкая (40−50 кг/км2). Вспышка биомассы минтая в придонных слоях была зафиксирована в 2011 г. (1393 кг/км2), когда основу его скоплений образовывали промысловые особи 2005–2006 гг. рождения. В дальнейшем эти поколения, видимо, перераспределились в другой район, потому что основу минтаевых скоплений стали составлять особи более младших поколений. Биомасса минтая после 2011 г. сначала сильно снизилась – до 170 кг/км2 в 2013 г., а затем возросла – до 1327 кг/км2 в 2015 г. Такой скачок биомассы минтая произошел за счёт урожайного поколения 2014 г. рождения, которое ко времени съёмки в 2015 г. достигло возраста только одного года (или около того).
Биомасса тихоокеанской сельди в придонных слоях была высока только в 2009 г. (1355 кг/км2), когда её основу формировали особи среднеурожайных поколений 2007 и 2008 гг. в возрасте соответственно 1 и 2 года (рис. 3в), в связи с чем главную часть сельдевых косяков образовывали непромысловые особи FL 12−16 см. В последующие пять лет длина сельди в уловах увеличилась, но её удельная биомасса была низкой (6−21 кг/км2). Рост биомассы сельди был отмечен только в 2015 г., и произошёл он за счёт годовиков FL 8−14 см. Это свидетельствует о том, что после ряда низкоурожайных поколений поколение сельди 2014 г. было среднеурожайным.
Биомасса многоиглого керчака после относительно низких значений в 2009−2010 гг. (51.9− 63.5 кг/км2) начиная с 2011 г. непрерывно росла, достигнув в 2014 г. 955 кг/км2, но в 2015 г. снизилась примерно до уровня 2011 г. − ~500 кг/км2 (рис. 3г). С 2012 по 2014 гг. средний размер особей керчака в уловах увеличивался. Это говорит о том, что наблюдаемый рост биомассы керчака с 2011 по 2014 гг. был обусловлен наличием одного или двух относительно урожайных поколений, появившихся после 2005 г.
Ранее отмечалось, что в начале нового века была зарегистрирована наиболее низкая удельная биомасса малорота Стеллера − 92 кг/км2 (Измятинский, 2012); приблизительно на этом уровне она оставалась и в 2009−2010 гг. (рис. 3д). Но в 2011 г. имело место резкое повышение биомассы этой камбалы до 842 кг/км2 при средней длине особей ~30 см, что соответствует примерно возрасту 6+ (2004 г. рождения). По данным донных съёмок наиболее значительную часть траловых уловов малорота образуют особи FL ≥ 28 см в возрасте от 6 лет, т.е. в массе промысловое стадо начинают формировать именно такие особи. Дальнейший уровень биомассы малорота, судя по всему, поддерживался преимущественно особями этого же поколения 2004 г. рождения и отчасти следующих поколений, так как средняя длина рыб в уловах чуть снизилась и во все последующие годы равнялась 28−29 см. В целом биомасса малорота в 2012−2015 гг. удерживалась примерно на том же на уровне, что в 1990-е гг. (~300 кг/км2), когда она была на пике.
В 2009−2010 гг. плотность биомассы южного однопёрого терпуга составляла 40−50 т/км2, в период 2011−2014 гг. непрерывно повышалась – с 482 до 799 кг/км2, а в 2015 г. снизилась до 281 кг/км2 (рис. 3е). Примечательно, что в результате этого очередного повышения биомассы ресурсы терпуга пока стабилизировались на более низком уровне, чем это было на рубеже 1980-х и 1990-х гг., в 1990-х и в первой половине 2000-х гг. Биомасса терпуга во время пика численности (1990 г.) приближалась к 5 т/км2, а в другие годы высокой численности находилась на уровне ~2 т/км2 (Вдовин, 1998; Измятинский, 2012). Нельзя не отметить, что в 2010-х гг. произошло значительное омоложение возрастного состава терпуга. Если в течение всего предыдущего периода съёмок (с 1983 г.) средний размер терпуга в траловых уловах характеризовался удивительным постоянством – практически всегда составлял ~30 см (Измятинский, 2012), то начиная с 2011 г. он не превышал 28 см, а чаще всего был равен 25 см. В связи с тем что терпуг в массе созревает на 4-м году жизни при FL 26 см (Вдовин, 1998), можно говорить о существенном увеличении доли особей непромысловых размеров в его уловах.
В целом в районе исследований в 2010-х гг. биомасса рыб возросла по сравнению с 2000-ми гг., когда она была минимальна. После 2005 г. стали появляться более урожайные поколения ряда основных ресурсообразующих видов: камбалы Надёжного, малорота Стеллера, минтая, тихоокеанской сельди, многоиглого керчака и, видимо, некоторых других. Ясно, что у долгорастущих камбалы Надёжного и малорота Стеллера возникновение первых поколений повышенной численности пришлось ещё на первую половину 2000-х гг. В первой половине 2010-х гг. у разных массовых видов также происходило чередование поколений уровня первого десятилетия с более урожайными. В результате этого средняя удельная биомасса рыб во втором десятилетии XXI в. по сравнению с первым увеличилась приблизительно в два раза – с ~3 до ~6 т/км2.
Несмотря на примерно 2-кратное увеличение ихтиомассы между десятилетиями, никаких резких скачков биомассы отдельных видов, по нашему мнению, не происходило. Только у минтая была относительно существенная разница между оценками биомассы в 2010 и 2011 гг. и у сельди – в 2009 и 2010 гг.; в обоих случаях разница составила ~1350 т/км2. И в первом, и во втором случае скачок биомассы мы объясняем перераспределением скоплений рыб: минтая − между разными географическими районами, а сельди – между разными горизонтами воды. У остальных видов оценки биомассы в последовательных съёмках различались не более чем на 1 т/км2. Изменение биомассы видов на такую величину между смежными съёмками – обычное явление. Мы многократно отмечали подобные различия как в собственных, так и в данных других исследователей, в том числе в хранящихся в архиве ТИНРО данных Л.А. Борца. Дело в том, что съёмка не может тотально охватить всю акваторию. Траления ежегодно выполняются только в выборочных местах согласно намеченной сетке станций, а наибольшие скопления рыб в один год могут локализоваться между этими станциями, а в другой год – как раз в местах выполнения тралений. Отсюда и скачки в оценках биомассы разных видов между съёмками.
Рассуждая об обилии видов, надо иметь в виду, что не все зарегистрированные виды встречались в каждой съёмке. Даже некоторые массовые в рассматриваемых водах виды отсутствовали в отдельных учётных съёмках. Например, это касается зубастой корюшки. Этот вид входит в число регулярно встречающихся, т.е. отмечающихся более чем в 50% съёмок. Регулярно в съёмках встречаются 88 видов. К ним относятся не только массовые и обычные, но и некоторые малообильные рыбы (согласно среднемноголетним оценкам численности). В частности, из малообильных видов в число регулярно встречающихся в съёмках входят белобрюхая камбала Lepidopsetta mochigarei, двенадцатигранная лисичка Occella dodecaedron, батимастер Дерюгина и глазчатый опистоцентр Opisthocentrus ocellatus. Остальные рыбы (71 вид) встречаются эпизодически.
Особого внимания заслуживают виды, зарегистрированные в каждой съёмке, так называемые постоянно встречающиеся. К ним отнесён 41 вид массовых и обычных рыб в уловах. По мнению Вдовина (1996), постоянно встречающиеся виды образуют видовой облик ихтиофауны. Среди постоянно встречающихся в районе исследований 9 видов принадлежат к семейству рогатковых, 7 – камбаловых, по 3 – к семействам тресковых, стихеевых, лисичковых и липаровых, по 2 – терпуговых, психролютовых, бельдюговых и круглопёровых (Cyclopteridae), по 1 – к семействам сельдевых, короткопёрых песчанок (Hypoptychidae), корюшковых (Osmeridae) и морских окуней (Sebastidae).
Таким образом, по данным донных траловых ловов, в районе исследований зарегистрировано 159 видов рыб. В 2009−2015 гг. на глубинах 20−1000 м их суммарная биомасса в среднем составляла 188.3 тыс. т, численность – 1482.6 млн экз., удельная биомасса – 5.4 т/км2. Преобладающими видами по биомассе являлись камбала Надёжного и минтай. По сравнению с другими морями российского Дальнего Востока биомасса рыб на единицу площади в исследуемых водах была наиболее низка. По сравнению с прошлым десятилетием в первой половине нынешнего уровень ихтиомассы в исследуемых водах увеличился примерно в два раза.
Список литературы
Аксютина З.М. 1968. Элементы математической оценки результатов наблюдений в биологических и рыбохозяйственных исследованиях. М.: Пищ. пром-сть, 289 с.
Борец Л.А. 1985. Состав и современное состояние сообщества донных рыб Карагинского залива // Изв. ТИНРО. Т. 110. С. 20–28.
Борец Л.А. 1990. Состав и биомасса донных рыб на шельфе северной части Японского моря // Биология шельфовых и проходных рыб. Владивосток: Изд-во ДВО АН СССР. С. 59–65.
Борец Л.А. 1997. Донные ихтиоцены российского шельфа дальневосточных морей: состав, структура, элементы функционирования и промысловое значение. Владивосток: Изд-во ТИНРО-центр, 217 с.
Вдовин А.Н. 1988. Биология и состояние запасов южного одноперого терпуга в водах Приморья: Автореф. дис. … канд. биол. наук. Владивосток: ДВО ИБМ АН СССР, 23 с.
Вдовин А.Н. 1996. Состав и биомасса рыб Амурского залива // Изв. ТИНРО. Т. 119. С. 72–88.
Вдовин А.Н. 1998. Биология и динамика численности южного одноперого терпуга (Pleurogrammus azonus) // Там же. Т. 123. С. 16–45.
Вдовин А.Н., Швыдкий Г.В., Калчугин П.В. 2001. Сезонное распределение колючей камбалы Acanthopsetta nadeshnyi в северо-западной части Японского моря // Вопр. ихтиологии. Т. 41. № 1. С. 36–41.
Вдовин А.Н., Измятинский Д.В., Соломатов С.Ф. 2004. Основные результаты исследований рыб морского прибрежного комплекса Приморья // Изв. ТИНРО. Т. 138. С. 168–190.
Гаврилов Г.М. 1998. Состав, динамика численности и промысел рыб в экономической зоне России и прилегающих водах Японского моря // Там же. Т. 124. С. 271–319.
Гаврилов Г.М., Пушкарева Н.Ф., Стрельцов М.С. 1988. Состав и биомасса донных и придонных рыб экономической зоны СССР Японского моря // Изменчивость состава ихтиофауны, урожайности поколений и методы прогнозирования запасов рыб в северной части Тихого океана. Владивосток: Изд-во ТИНРО. С. 37–55.
Дубровская С.В. 1953. Биология и промысел дальневосточной наваги: Автореф. дис. … канд. биол. наук. М.: МТИРПХ, 14 с.
Дударев В.А. 1996. Состав и биомасса донных и придонных рыб на шельфе северного Приморья // Вопр. ихтиологии. Т. 36. № 3. С. 333–338.
Дударев В.А., Зуенко Ю.И., Ильинский Е.Н., Калчугин П.В. 1998. Новые данные о структуре сообществ донных и придонных рыб на шельфе и свале глубин Приморья // Изв. ТИНРО. Т. 123. С. 3–15.
Дударев В.А., Измятинский Д.В., Калчугин П.В. 2000. Некоторые аспекты пространственной и временной изменчивости сообществ донных рыб северного Приморья // Там же. Т. 127. С. 109–118.
Зверькова Л.М. 2003. Минтай. Биология, состояние запасов. Владивосток: Изд-во ТИНРО-центр, 248 с.
Иванков В.Н., Иванкова З.Г., Волкова Т.Д. 1972. Типы икрометания и сроки нереста камбал залива Петра Великого // Уч. зап. ДВГУ. Т. 60. С. 49–61.
Иванкова З.Г. 1975. Изменения структуры популяций камбал в заливе Петра Великого в условиях регулирования их промысла // Изв. ТИНРО. Т. 96. С. 149–160.
Иванкова З.Г. 2001. Изменения численности и структуры популяций камбал залива Петра Великого (Японское море) // Тез. докл. Междунар. конф. “Биологические основы устойчивого развития прибрежных морских экосистем”. Мурманск: Апатиты. С. 95.
Измятинский Д.В. 2012. Временная и пространственная изменчивость биомассы рыб в элиторали российской зоны Японского моря // Вопр. ихтиологии. Т. 52. № 1. С. 39–49.
Измятинский Д.В., Калчугин П.В. 2010. Состав и количество рыб в элиторали российских вод Японского моря в теплое и холодное время года // Изв. ТИНРО. Т. 161. С. 79–91.
Калчугин П.В., Вдовин А.Н. 2000. Некоторые аспекты внутривидовой дифференциации тихоокеанской сельди (Clupea pallasi) в водах Приморья // Там же. Т. 127. С. 166–170.
Калчугин П.В., Измятинский Д.В., Соломатов С.Ф. и др. 2006. Состав и биомасса донного ихтиоцена у материкового побережья западной части Японского моря в летний период // Вопр. рыболовства. Т. 7. № 3 (27). С. 464–480.
Калчугин П.В., Бойко М.И., Соломатов С.Ф., Черниенко Э.П. 2016а. Современное состояние донных и придонных видов рыб в Российских водах Японского моря // Изв. ТИНРО. Т. 184. С. 54–59.
Калчугин П.В., Соломатов С.Ф., Бойко М.И. 2016б. Распределение и запасы массовых донных и придонных рыб в различных районах северо-западной части Японского моря // Там же. Т. 185. С. 3–15.
Кравченко Д.Г., Пантюх З.М., Измятинский Д.В. 2017. Характеристика ихтиофауны элиторали российских вод Японского моря в теплое время года // Вопр. рыболовства. Т. 18. № 4. С. 473–486.
Кравченко Д.Г., Калчугин П.В., Измятинский Д.В., Бадаев О.З. 2018. Сравнение состава ихтиофауны в разных районах российских и корейских вод Японского моря // Вопр. ихтиологии. Т. 58. № 1. С. 75–86.
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Изв. ТИНРО. Т. 44. 288 с.
Науменко Н.И. 2001. Биология и промысел морских сельдей Дальнего Востока. Петропавловск-Камчатский: Камчат. печат. двор, 330 с.
Никольский Г.В. 1974. Экология рыб. М.: Высш. шк., 367 с.
Новиков Н.П., Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2002. Рыбы Приморья. Владивосток: Изд-во Дальрыбвтуз, 552 с.
Нуждин В.А. 1998. Минтай северо-западной части Японского моря – особенности биологии, размножения, промысел // Изв. ТИНРО. Т. 123. С. 53–73.
Одум Ю. 1986а. Экология. Т. 1. М.: Мир, 328 с.
Одум Ю. 1986б. Экология. Т. 2. М.: Мир, 376 с.
Панченко В.В., Калчугин П.В., Соломатов С.Ф. 2016. Уточнение глубин обитания и максимальных размеров донных и придонных видов рыб в российских водах Японского моря // Вопр. ихтиологии. Т. 56. № 3. С. 264–283.
Покровская Т.Н. 1960. Географическая изменчивость биологии наваги // Тр. ИО АН СССР. Т. 31. С. 19–100.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 367 с.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. 2007. Рыбы российских вод Японского моря: аннотированный и иллюстрированный каталог. Владивосток: Дальнаука, 200 с.
Соломатов С.Ф. 2002. Батиметрическое и пространственное распределение рыб на свале глубин северного Приморья в осенний период // Изв. ТИНРО. Т. 131. С. 156–163.
Соломатов С.Ф. 2008. Состав и многолетняя динамика донных ихтиоценов Северного Приморья. Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр, 24 с.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Федоров В.Д., Гильманов Т.Г. 1980. Экология. М.: Изд-во МГУ, 463 с.
Фролов А.И. 1949. О локальных стадах сахалинской сельди // ДАН СССР. Т. 69. № 6. С. 861–864.
Фролов А.И. 1950. О локальных формах сахалинской сельди // Изв. ТИНРО. Т. 32. С. 65–71.
Шейко Б.А., Федоров В.В. 2000. Рыбообразные и рыбы // Каталог позвоночных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Шунтов В.П. 2016. Биология дальневосточных морей России. Т. 2. Владивосток: Изд-во ТИНРО-центр, 604 с.
Шунтов В.П., Волвенко И.В. 2015. Генерализованные оценки состава, количественного распределения и биомассы макрофауны бентали на шельфе и свале глубин северо-западной Пацифики // Изв. ТИНРО. Т. 182. С. 3–22.
Шунтов В.П., Волвенко И.В. 2016а. Дополнения к генерализованным количественным оценкам макрофауны бентали в дальневосточных морях и сопредельных водах Тихого океана. 1. Региональные особенности распределения биомассы рыб // Там же. Т. 186. С. 3−31.
Шунтов В.П., Волвенко И.В. 2016б. Дополнения к генерализованным количественным оценкам макрофауны бентали в дальневосточных морях и сопредельных водах Тихого океана. 2. Региональные и батиметрические особенности распределения биомассы и плотности концентраций рыб и некоторых групп беспозвоночных // Там же. Т. 186. С. 32−60.
Шунтов В.П., Волков А.Ф., Темных О.С., Дулепова Е.П. 1993. Минтай в экосистемах дальневосточных морей. Владивосток: Изд-во ТИНРО, 426 с.
Шунтов В.П., Радченко В.И., Дулепова Е.П., Темных О.С. 1997. Биологические ресурсы дальневосточной российской экономической зоны: структура пелагических и донных сообществ, современный статус, тенденции многолетней динамики // Изв. ТИНРО. Т. 122. С. 3–15.
Шунтов В.П., Волвенко И.В., Кулик В.В., Бочаров Л.Н. 2014. Макрофауна бентали северо-западной части Японского моря: таблицы встречаемости, численности и биомассы. 1978−2010. Владивосток: Изд-во ТИНРО-центр, 554 с.
Eschmeyer W.N. 2018. Catalog of fishes (http:// www.calacademy.org./research/ichthyology/ annotated/ annchkphyl.html. Version 07/ 2018).
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии