Вопросы ихтиологии, 2019, T. 59, № 5, стр. 601-605
Термоадапционные характеристики смолтов речной миноги Lampetra fluviatilis
В. К. Голованов 1, Н. С. Некрутов 1, А. О. Звездин 2, *, А. К. Смирнов 1, И. А. Цимбалов 2
1 Институт биологии внутренних вод РАН – ИБВВ
Ярославская область, пос. Борок, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
* E-mail: a.o.zvezdin@gmail.com
Поступила в редакцию 24.08.2018
После доработки 10.09.2018
Принята к публикации 12.10.2018
Аннотация
В экспериментальных условиях впервые получены данные, характеризующие термоадаптационные показатели смолтов речной миноги Lampetra fluviatilis. Окончательно избираемая температура у смолтов, предварительно акклимированных к температуре воды 9°С, составила 15.3°С. Значение сублетальной температуры, определённой методом критического термического максимума при скорости нагрева воды 9°С/ч, равно 29.0°С; верхней летальной температуры – 30.8°С. Значения окончательно избираемой и верхней летальной температуры у смолтов речной миноги близки к таковым у лососёвых и сиговых рыб.
Оценка термоадаптационных характеристик пресноводных и морских видов рыб в последнее время становится всё более актуальной в связи с наблюдающимся потеплением климата и изменением температурного режима водоёмов. В этом аспекте представители некоторых семейств, таких как карповые (Cyprinidae), окунёвые (Percidae), лососёвые (Salmonidae), изучены достаточно подробно, в то время как информации о термоизбирании и верхней температурной границе жизнедеятельности у бесчелюстных, в частности у миног (Petromyzontiformes), сравнительно мало. Имеются отрывочные данные по верхней летальной температуре у личинок некоторых видов миног (Potter, Beamish, 1975; Macey, Potter, 1978). Термоадаптационное поведение морской миноги Petromyzon marinus было изучено ранее на личинках и взрослых особях этого вида (McCauley et al., 1977; Reynolds, Casterlin, 1978). В то же время данные о термоизбирании и термоустойчивости речной миноги Lampetra fluviatilis на разных стадиях развития, широко распространённой на европейской части России, практически отсутствуют.
Особенности экологии речной миноги и её поведенческие реакции на важнейшие факторы среды в последнее время исследуются всё более интенсивно (Moser et al., 2014; Звездин и др., 2017; Павлов и др., 2017). При этом большой интерес вызывают особи на стадии смолтификации. После длительного личиночного периода (4–6 лет обитания в реках) смолты речной миноги, как и многих других видов, совершают покатную миграцию в море (Kirillova et al., 2011; Goodman et al., 2015; Baer et al., 2018). На этом этапе развития, как, впрочем, и во всём жизненном цикле, прослеживается множество аналогий между миногами и лососёвыми рыбами (Савваитова и др., 2007; Kirillova et al., 2016). Поэтому вопросы терморегуляционного поведения и верхней границы термоустойчивости смолтов речной миноги представляют интерес как в общем контексте исследований миног, так и в сравнительном аспекте с лососёвыми.
Цель настоящего исследования – оценить особенности распределения смолтов речной миноги L. fluviatilis в градиенте температуры, а также определить верхнюю сублетальную и летальную температуры при нагреве воды со скоростью 9°С/ч.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена в весенний период 2017 г. на смолтах речной миноги, отловленных в р. Чёрная (Выборгский район Ленинградской области, 5.9 км от Финского залива, 60°13′15.74″ с.ш. 29°30′56.26″ в.д.). Смолтов транспортировали в пос. Борок (Ярославская область) в течение 11 ч в пластиковом баке (55 л) при непрерывной аэрации воды. Перед экспериментом их акклимировали к лабораторным условиям в течение 10 сут. Смолтов содержали в аквариуме объёмом 160 л при температуре воды 9°С в условиях постоянного фотопериода 12 : 12 ч (свет с 7 до 19 ч). Абсолютная длина (TL) смолтов составила 12.9 ± 1.9 см, масса – 3.3 ± 0.15 г. В опытах по термоизбиранию (две повторности) использовано 20 особей, при определении термоустойчивости (три повторности) – 21 особь. В период акклимации и во время экспериментов смолтов не кормили.
Избираемую температуру (ИТ) и окончательно избираемую температуру (ОИТ) определяли методом термопреферендума (Голованов, 2013) в двухканальной горизонтальной термоградиентной установке, представляющей собой два лотка из прозрачного стекла размерами 420 × 37 × 17 см. Горизонтальный градиент температуры создавали путём нагрева и охлаждения воды на противоположных концах лотков, разница температуры в которых составляла 12–16°С. В течение первых 3 сут. опыта градиент температуры поддерживали в диапазоне 5–17, 4−6 сут. − 5–21, 7−9 сут. − 10–24°С. Этот методический приём необходим для предотвращения температурного шока (Голованов, 2013) и вызван отсутствием данных по ОИТ у смолтов миноги. Каждый лоток был разделён с помощью неполных перегородок на 11 камер, в которых находилось по два распылителя с подачей воздуха. Смолтов миноги помещали в отсек с температурой, равной температуре акклимации. ИТ и распределение смолтов регистрировали визуально девять раз в светлое время суток и три раза в вечернее время (21–22 ч, сумерки), а также с помощью видеокамеры. Значения ИТ отражают выбор температуры в начальный период опыта, значения ОИТ – на стабильном участке выбора (Голованов, 2013). Для определения зоны ОИТ принят 3-суточный критерий стабильного выбора, когда в течение трёх последовательных дней опыта различия среднесуточных значений ИТ отсутствуют. Продолжительность каждого из двух опытов составляла 9 сут. Данные двух опытов в лотках суммированы отдельно для дневного и вечернего времени.
Верхнюю сублетальную и верхнюю летальную температуру (ВЛТ) определяли методом критического термического максимума – КТМ (Beitinger et al., 2000; Голованов, 2013). Для этого группу смолтов (7 экз.) помещали в экспериментальный аквариум объёмом 60 л, оборудованный системой нагрева и аэрации. Температуру воды в опытном аквариуме повышали со скоростью 9°С/ч до потери смолтами равновесия (переворот кверху брюшком), верхнее сублетальное значение температуры фиксировали как КТМ. Продолжая нагрев до прекращения движения жабр, фиксировали значение ВЛТ. Скорость нагрева 9°С/ч обычно применяется при определении характеристик термоустойчивости рыб, она считается стандартной (Beitinger et al., 2000; Голованов, 2013), а также может наблюдаться при аварийных сбросах подогретых вод тепловых и атомных электростанций. Общая продолжительность каждого опыта составила ~2.6 ч. Два опыта проведены в дневное время и их результаты суммированы, один опыт – в вечернее время.
Результаты представлены в виде средних значений и их ошибок (M ± m). Достоверность различий оценивали по t-критерию Стьюдента при p ≤ 0.05.
РЕЗУЛЬТАТЫ
Бóльшую часть времени в термоградиентных лотках смолты проводили, присосавшись к стенкам или дну установки, периодически перемещаясь из отсека в отсек. В период акклимации до опыта было замечено увеличение активности смолтов в вечернее время. Однако поведение и распределение миног в термоградиенте в дневное (с 9 до 17 ч) и вечернее (с 21 по 22 ч, сумерки и темнота) время существенно не различались (рисунок).
Средние значения ИТ в первые 3 сут. опыта в дневное время варьировали в пределах 10−13, на 4–6-е сут. – 12.9−15.2, в последние 3 сут. − 14.3–16.3°С (рисунок). Среднее значение ОИТ, исходя из данных за последние 3 сут. опытов, в дневное и вечернее время составило соответственно 15.3 ± 0.3 и 15.7 ± 0.6°С, статистически значимые отличия этих показателей отсутствуют (p > 0.05). Особи распределялись по отсекам установки равномерно по 1–3 экз., чаще в зоне ОИТ.
Значение КТМ у смолтов в дневное время составило 29.0 ± 0.2°С, ВЛТ – 30.8 ± 0.2°С, в вечернее время − соответственно 28.9 ± 0.1 и 31.1 ± 0.2°С. До уровня температуры 24–25°С поведение особей было относительно спокойным, все они, как правило, находились у дна, присосавшись к нему или к стенкам аквариума. При последующем повышении температуры воды были отмечены частые открепления смолтов от стенок аквариума с последующим присасыванием в другом месте. В интервале температуры 26.5–27.0°С и выше несколько раз фиксировали кратковременное присасывание выше уровня воды в аквариуме. При этом у миног частота дыхания увеличивалась, были отмечены судороги, частые подёргивания, конвульсии и изгибание тела во многих местах. Опыты в дневное и вечернее время показали практически идентичные результаты.
ОБСУЖДЕНИЕ
Результаты экспериментов по термоизбиранию (терморегуляционному поведению), а также по термоустойчивости у разных видов миног немногочисленны, что объясняется их сложным жизненным циклом, экологической спецификой и особенностями поведения. У личинок морской миноги Petromyzon marinus (TL 10–13 см) после предварительной акклимации к температуре воды 10°С средняя ИТ за 3-суточный опыт в электронном шаттл-боксе составила 13.6°С, диапазон ИТ – 10−19°С (Reynolds, Casterlin, 1978). Близкое значение средней ИТ (14.3°С) показано и для взрослых особей морской миноги (TL ~400 мм) после предварительной акклимации к температуре воды 10°С в краткосрочном (2.5 ч) эксперименте в условиях горизонтального термоградиента (McCauley et al., 1977). Значение ИТ у взрослых особей трёхзубой миноги Entosphenus tridentatus несколько выше – 16–17°С (Lemons, Crawshaw, 1978). Несмотря на то что значения ИТ для морской и трёхзубой миног получены в кратковременных опытах, они позволяют оценить возможную зону эколого-физиологического оптимума и ОИТ в диапазоне температуры от 13 до 17°С (Jobling, 1981). Значение ОИТ, полученное нами для смолтов речной миноги в дневное и вечернее время (15.3 ± 0.3 и 15.7 ± 0.6°С), хорошо согласуется с результатами для других видов миног.
Данные по ВЛТ у четырёх видов пресноводных и одного вида морской миноги приведены в работах американских и австралийских исследователей (Potter, Beamish, 1975; Macey, Potter, 1978). Так, для личинок мичиганской пресноводной Ichthyomyzon fossor, морской P. marinus, американской восточной ручьевой Lethenteron appendix (старое название Lampetra (Lethenteron) lamottenii) и пресноводной формы речной (ручьевой) (=Lampetra planeri) миног верхняя пороговая летальная температура после акклимации к температуре воды 15°С составила соответственно 30.5, 30.0, 29.5 и 28.5°С (Potter, Beamish, 1975). Дополнительные опыты, проведённые с использованием более высокой и низкой температур акклимации, показали, что окончательная пороговая ВЛТ для морской миноги равна 31.4°С, для ручьевой миноги – 29.4°С. Для личинок австралийской миноги Geotria australis, акклимированной в диапазоне температуры воды 5−25°С, значение окончательной пороговой ВЛТ близко к ранее приведённым данным – 28.3°С (Macey, Potter, 1978). Следует отметить, что эти результаты получены методом температурного скачка по методике Фрая (Fry, 1971), позволяющим по наблюдениям за смертностью личинок в аквариумах с разной температурой воды в течение двух недель рассчитывать температуру, при которой число погибших особей составит 50%. Интересно отметить, что акклимация к разной температуре (5, 15 и 25°С), изменяла уровень ВЛТ у личинок морской и ручьевой миног не более чем на 2°С (Potter, Beamish, 1975). Значения КТМ (29.0 и 28.9°С днём и вечером) и ВЛТ (30.8 и 31.1°С днём и вечером) для смолтов речной миноги, полученные нами при нагреве воды со скоростью 9°C/ч в течение ~2.5 ч, близки к установленным ранее.
Рис. 1.
Динамика избираемой температуры (M ± m) смолтами речной миноги Lampetra fluviatilis в условиях 9-суточного эксперимента, наблюдения: (–◻–) – дневные, (–◼–) – вечерние.
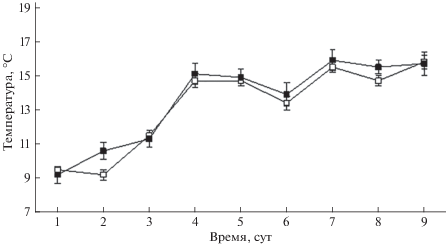
Таким образом, впервые в длительных (9-суточных) лабораторных экспериментах показано, что смолты речной миноги проявляют реакцию термоизбирания. Этот процесс, как и у многих видов рыб, включает два этапа: выбор текущей ИТ, отражающей процесс акклимации в термоградиентных условиях, и выбор ОИТ, отражающий некоторую стабилизацию процесса термоизбирания. Выбор температуры в экспериментальной термоградиентной установке сравнительно медленный, требуется не менее 7 сут., чтобы особи вышли в предполагаемую зону возможной ОИТ. Термоизбирание происходит не в группе, как это отмечено для молоди карповых и окунёвых видов рыб, а индивидуально, как, например, у ротана-головешки Perccottus glenii (Голованов, 2013) или радужной форели Oncorchynchus (=Parasalmo) mykiss (Голованов, Валтонен, 2000).
Выбор температуры следует признать относительно пассивным, бóльшую часть времени в термоградиенте смолты проводили, присосавшись ко дну или стенкам установки. Возможно, относительно широкое рассредоточение по отсекам лотков было обусловлено отсутствием в экспериментальной установке привычной для смолтов среды (например, грунта) или поиском укрытий. При этом статистически значимая разница в ОИТ в дневное и вечернее время не отмечена. Значение ОИТ у смолтов речной миноги в дневное и вечернее время (15.3 ± 0.3 и 15.7 ± 0.6°С) находится в интервале значений ИТ у личинок и взрослых особей морской миноги − соответственно 13.6 и 14.3°С (Potter, Beamish, 1975) и взрослых особей трёхзубой миноги − 16–17°С (Macey, Potter, 1978). Несмотря на то что экспериментальные установки и продолжительность опытов (от 2.5 ч до 9 сут.) различались, следует отметить сходство значений ИТ и ОИТ на различных стадиях жизненного цикла у разных видов миног.
Значения ОИТ смолтов речной миноги близки к таковым холодолюбивых видов лососёвых (Salmonidae) и сиговых (Coregoninae) рыб (13–17°С), что существенно ниже, чем у молоди осетровых (Acipenseridae) (21–25°С), а также теплолюбивых карповых и окунёвых (26–30°С) видов (Cherry, Cairns, 1982; Голованов, 2013). Приведённые данные для личинок, смолтов и взрослых миног подтверждают предположение о том, что терморегуляционное поведение относится к наиболее древним адаптациям водных животных.
В нашей работе впервые получены данные, характеризующие термоустойчивость смолтов речной миноги у верхней температурной границы жизнедеятельности. Сублетальное значение (КТМ) при скорости нагрева 9°С/ч составило днём и вечером соответственно 29.0 и 28.9, ВЛТ – 30.8 и 31.1°С. Следует отметить сходство этих результатов с данными для личинок других видов и форм миног, несмотря на то что они получены для разных стадий онтогенеза с использованием двух различных методов – КТМ и температурного скачка. Так, например, для личинок морской и ручьевой миног зарегистрирован уровень верхней окончательной пороговой температуры соответственно 31.4 и 29.4°С (Potter, Beamish, 1975); у личинок трёхзубой миноги этот показатель несколько ниже − 28.3°С (Macey, Potter, 1978). Значения КТМ и ВЛТ у смолтов речной миноги близки к таковым холодолюбивых лососёвых, сиговых, а также осетровых видов рыб (29–31°С), что существенно ниже, чем у молоди теплолюбивых карповых и окунёвых (35–41°С) видов (Cherry, Cairns, 1982; Голованов, 2013).
Высокий коэффициент корреляции (>0.9) между ОИТ и оптимальной температурой роста у 49 видов морских и пресноводных видов рыб, включая морскую миногу (Jobling, 1981), а также у молоди 13 видов рыб, обитающих в северо-западном регионе России (Голованов, 2013), позволяют рассматривать зону ОИТ у рыб и миног в качестве эколого-физиологического оптимума. Подобная корреляция, выявленная между ОИТ, оптимальной температурой роста и ВЛТ, у рыб и миног отражает определённый уровень верхней границы термоустойчивости в зависимости от расположения зоны оптимума. Интервал сублетальных значений температуры и ВЛТ можно рассматривать как эколого-физиологический пессимум рыб и миног. Значения ОИТ (отражающей эколого-физиологический оптимум) и ВЛТ (отражающей верхнюю границу жизнедеятельности или эколого-физиологический пессимум) у смолтов речной миноги аналогичны таковым у лососёвых и сиговых видов рыб. Так, значения ОИТ для большинства лососёвых и сиговых видов рыб находятся в интервале температуры 13−17°С, а верхняя граница термоустойчивости − 28−31°С (Голованов, 2013). Ряд экологических аналогий (сроки нереста, диапазоны нерестовой температуры, продолжительность инкубации икры и пр.) ранее неоднократно отмечали для разных видов миног и лососёвых рыб (Берг, 1935; Гриценко, 1968; Савваитова и др., 2007; Kirillova et al., 2016). Таким образом, по температурным характеристикам (ОИТ и ВЛТ) речную миногу можно отнести к холодолюбивым, аналогичным лососёвым и сиговым видам рыб. Полученные данные ещё раз подтверждают сходство экологических характеристик миног, лососёвых и, возможно, сиговых. Для получения более полных данных по температурным характеристикам речной миноги необходимы исследования на личинках и взрослых особях.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках государственного задания № АААА-А18-118012690102-9 при поддержке Российского научного фонда (проект № 14-14-01171-П, полевые работы и отлов смолтов миноги), Программы Президента РФ “Ведущие научные школы” НШ-7894.2016.4 “Экологические аспекты адаптаций и популяционная организация у рыб” (экспериментальная работа), а также при частичной поддержке Президиума РАН, тема 0122-2018-0001.
Список литературы
Берг Л.С. 1935. Экологические параллели между миногами и лососевыми // ДАН СССР. Т. 3. Вып. 2. С. 91–94.
Голованов В.К. 2013. Эколого-физиологические закономерности распределения и поведения пресноводных рыб в термоградиентных условиях // Вопр. ихтиологии. Т. 53. № 3. С. 286−314. https://doi.org/10.7868/S0042875213030016
Голованов В.К., Валтонен Т. 2000. Изменчивость термоадаптационных свойств радужной форели Oncorchynchus mykiss Walbaum в онтогенезе // Биология внутр. вод. № 2. С. 106–115.
Гриценко О.Ф. 1968. К вопросу об экологическом параллелизме между миногами и лососями // Изв. ТИНРО. Т. 65. С. 157–168.
Звездин А.О., Павлов Д.С., Кучерявый А.В., Цимбалов И.А. 2017. Экспериментальное изучение миграционного поведения речной миноги Lampetra fluviatilis (L.) в период первичного расселения молоди // Биология внутр. вод. № 2. С. 94–103. https://doi.org/10.7868/S032096521702019X
Павлов Д.С., Звездин А.О., Костин В.В. и др. 2017. Временная характеристика покатной миграции смолтов речной миноги Lampetra fluviatilis в реке Черной // Изв. РАН. Сер. биол. № 3. С. 276–282. https://doi.org/10.7868/S0002332917030067
Савваитова К.А., Павлов Д.С., Кузищин К.В. и др. 2007. Экологические аналогии у тихоокеанской миноги Lethenteron camtschaticum и микижи Parasalmo mykiss Камчатки // Вопр. ихтиологии. Т. 47. № 3. С. 296–302.
Baer J., Hartmann F., Brinker A. 2018. Abiotic triggers for sea and river lamprey spawning migration and juvenile outmigration in the River Rhine, Germany // Ecol. Freshw. Fish. V. 27. № 4. P. 988−998.https://doi.org/10.1111/eff.12409
Beitinger T.L., Bennet W.A., McCauley R.W. 2000. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature // Environ. Biol. Fish. V. 58. № 3. P. 237–275.
Cherry D.S., Cairns J., Jr. 1982. Biological monitoring. Pt. V. Preference and avoidance studies // Water Res. V. 16. № 3. P. 263–301.
Fry F.E.J. 1971. The effect of environmental factors on the physiology of fish // Fish physiology. V. 6 / Eds. Hoar W.S., Randall D.J. London; N.Y.: Acad. Press. P. 1–98.
Goodman D.H., Reid S.B., Som N.A., Poytress W.R. 2015. The punctuated seaward migration of Pacific lamprey (Entosphenus tridentatus): environmental cues and implications for streamflow management // Can. J. Fish. Aquat. Sci. V. 72. № 12. P. 1817–1828. https://doi.org/10.1139/cjfas-2015-0063
Jobling M. 1981. Temperature tolerance and the final preferendum – rapid methods for the assessment of optimum growth temperature // J. Fish. Biol. V. 19. № 4. P. 439–455.
Kirillova E.A., Kirillov P.I., Kucheryavyy A.V., Pavlov D.S. 2011. Downstream migration in ammocoetes of the Arctic lamprey Lethenteron camtschaticum in some Kamchatka rivers // J. Ichthyol. V. 51. № 11. P. 1117–1125.https://doi.org/10.1134/S0032945211110051
Kirillova E.A., Kirillov P.I., Kucheryavyy A.V., Pavlov D.S. 2016. Common behavioral adaptations in lamprey and salmonids // Jawless Fishes of the World. V. 2. Ch. 23 / Eds. Orlov A., Beamish R. Cambridge: Cambr. Scholars Publ. P. 196–213.
Lemons D.E. Crawshaw L.I. 1978. Temperature regulation in the Pacific lamprey (Lampetra tridentata) // Fed. Proc. V. 37. P. 929.
Macey D.J., Potter I.C. 1978. Lethal temperatures of ammocoetes of the southern hemisphere lamprey, Geotria austral // Environ. Biol. Fish. V. 3. № 2. P. 241–243.
McCauley R.W., Reynolds W.W., Huggins N.H. 1977. Photokinesis and behavioral thermoregulation in adult sea lampreys (Petromyzon marinus) // J. Exp. Zool. V. 202. № 3. P. 431–437.
Moser M.L., Jackson A.D., Lucas M.C., Mueller R.P. 2014. Behavior and potential threats to survival of migrating lamprey ammocoetes and macrophtalmia // Rev. Fish. Biol. Fish. V. 25. № 1. P. 103–116. https://doi.org/10.1007/s11160-014-9372-8
Potter I.C., Beamish F.W.H. 1975. Lethal temperatures in ammocoetes of four species of lampreys // Acta Zool. V. 56. № 1. P. 85–91.
Reynolds W.W., Casterlin M.E. 1978. Behavioral thermoregulation by ammocoete larvae of the sea lamprey (Petromyzon marinus) in electronic shuttlebox // Hydrobiologia. V. 61. № 2. P. 145–147.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


