Вопросы ихтиологии, 2019, T. 59, № 5, стр. 590-599
Естественная гибридизация щиповок родов Cobitis и Sabanejewia (Cobitidae)
Е. Д. Васильева 1, *, В. П. Васильев 2
1 Зоологический музей Московского государственного университета
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ
Москва, Россия
* E-mail: vas_katerina@mail.ru
Поступила в редакцию 17.12.2018
После доработки 06.01.2019
Принята к публикации 15.01.2019
Аннотация
Дано подробное описание фенотипически гибридной щиповки, выловленной в Малом Кызылагачском заливе, в сравнении с тремя известными из бассейна залива видами вьюновых рыб: каспийской щиповкой Sabanejewia caspia, Cobitis saniae и хвалынской щиповкой C. amphilekta. Подтверждается гибридизация двух первых видов, которой способствовали их симпатрия, перекрывание сроков нереста и заметная разница в численности в совместно населяемых биотопах. Крайне низкая частота гибридизации каспийской щиповки и C. saniae объясняется существенными различиями в экологии нереста и в нерестовом поведении двух видов.
Естественная гибридизация близкородственных видов, которая приводит к образованию постоянных гибридных форм, продуцирующих нередуцированные диплоидные яйцеклетки и размножающихся с помощью гиногенеза или партеногенеза, представляет собой первый этап особого способа видообразования, в результате которого образуются клональные диплоидные, триплоидные или тетраплоидные виды (формы), известные в ряде групп позвоночных животных: рыб, амфибий и рептилий. На последнем этапе гибридогенного, или сетчатого, видообразования могут возникать бисексуальные тетраплоидные виды. Впервые это было доказано для щиповок рода Cobitis Linnaeus, 1758 из семейства вьюновых (Cobitidae) (Васильев, 1981; Васильев, Васильева, 1982; Васильев и др., 1983). Обнаруженный в бассейне р. Москва диплоидно-полиплоидный, или однополо-двуполый, комплекс включал: два бисексуальных диплоидных вида – C. taenia Linnaeus, 1758 и C. melanoleuca Nichols, 1925, триплоидную форму, возникшую в результате оплодотворения нередуцированной яйцеклетки гибрида видов близкородственных C. taenia спермой C. taenia и представленную только самками, размножающимися путём гиногенеза, и две тетраплоидные формы, возникшие путём оплодотворения нередуцированной триплоидной яйцеклетки самцами C. melanoleuca (форма состоит только из тетраплоидных самок) и C. taenia (форма включает тетраплоидных самок и самцов). Таким образом, в этом комплексе представлены два последних этапа сетчатого видообразования и отсутствуют диплоидные формы гибридного происхождения, образующиеся на первом этапе (Васильев, Васильева, 2010). К настоящему времени входящие в состав диплоидно-полиплоидных, или однополо-двуполых, комплексов диплоидные гибриды обнаружены в природе для ряда пар видов рода Cobitis: C. elongatoides Băcescu et Mayer, 1969 и C. tanaitica Băcescu et Mayer, 1969 в бассейнах Одера и Эльбы (Bohlen et al., 2002), C. elongatoides и C. taenia в системе рек Одра и Везер (Janko et al., 2007, 2012), C. hankugensis Kim, Park, Son et Nalbant, 2003 и C. longicorpus Kim, Choi et Nalbant, 1976 в реках Кореи (Saitoh et al., 2004). Все однополые гибридные формы из диплоидно-полиплоидных комплексов по внешним характеристикам не отличаются от других полиплоидных форм комплекса и родительских бисексуальных видов и были выявлены только с помощью генетического анализа. При этом исследования последних лет показали, что бисексуально размножающиеся гибриды в диплоидно-полиплоидных комплексах щиповок отсутствуют или, возможно, они очень редки (Janko et al., 2012).
Однополые криптические диплоидные и триплоидные формы, продуцирующие нередуцированные яйцеклетки, обнаружены также у вьюнов рода Misgurnus Lacepède, 1803 в естественных популяциях в водах Японии и Китая (Itono et al., 2007; Morishima et al., 2008). Происхождение этих форм остаётся неясным в силу отсутствия разработанной таксономии вьюнов Японии. В то же время искусственно полученные жизнеспособные гибриды Misgurnus anguillicaudatus (Cantor, 1842) и Paramisgurnus dabryanus Guichenot, 1872 (его младший синоним Misgurnus mizolepis Günther, 1888 нередко употребляется в цитируемых ниже публикациях по вьюнам) часто используются в экспериментальных исследованиях в Корее и Японии (Kim et al., 1995; Fujimoto et al., 2008; You et al., 2009; Zhao et al., 2016). Такие гибриды характеризуются высокими показателями роста, и их использование в аквакультуре стран Азии постепенно возрастает (Zhang et al., 2018). Однако в естественных популяциях гибриды вьюнов встречаются редко: среди 20 предполагаемых гибридов из водоёмов Японии только для одной особи с помощью генетических методов было доказано гибридное происхождение (You et al., 2009).
Уникальный для вьюновых случай естественной гибридизации, приводящий не к образованию стабильной гибридной формы, а к постепенному вытеснению одного вида другим, обнаружен у щиповок рода Cobitis из рек Южной Кореи (Kwan et al., 2014). Вследствие строительства каналов, соединивших две реки, произошёл вторичный контакт двух видов, время дивергенции между которыми оценивается в 3.3 млн лет. Как показал генетический анализ, в результате однонаправленной интродукции вида C. tetralineata Kim, Park et Nalbant, 1999 в образовавшейся гибридной зоне за 80 лет контакта полностью исчезли чистые особи нативного вида C. nalbanti Vasil’eva, Kim, Vasil’ev, Ko et Won, 2016 (в цитируемой статье этот вид дан как C. lutheri Rendahl, 1935), а частота гибридных особей разного происхождения достигла 93%. Следует отметить, что в данном случае проведённые авторами экспериментальные скрещивания и представленные результаты явно свидетельствуют о продуцировании гибридами первого поколения гаплоидных яйцеклеток и о бисексуальном размножении. Важно также подчеркнуть, что гибридизирующие виды C. tetralineata и C. nalbanti хорошо различаются по особенностям пигментации тела, поэтому их гибриды можно идентифицировать визуально (Kwan et al., 2014. Fig. 1) в отличие от однополых гибридов в европейских диплоидно-полиплоидных комплексах.
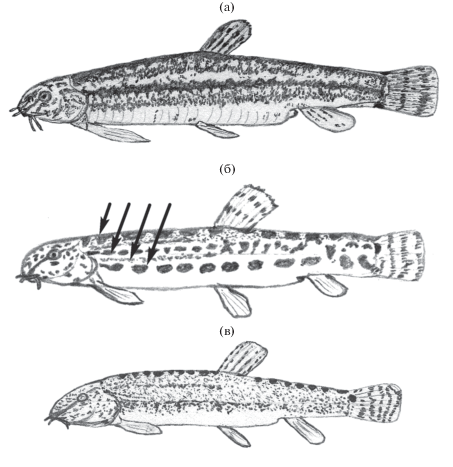
Рис. 1.
Взрослые самки каспийской щиповки Sabanejewia caspia TL 74 мм (a), Cobitis saniae TL 61 мм (б) и их гибрид TL 63 мм (в), масштаб не соблюдён; (→) – зоны пигментации Гамбетты у C. saniae.
Интрогрессивная гибридизация в естественных условиях может наблюдаться и между видами разных родов, потомки которых будут плодовитыми. В частности, ряд случаев интрогрессивной или массовой гибридизации, приводящей только к образованию гибридов первого поколения, у видов разных родов отмечен для карповых (Cyprinidae) рыб, близкородственных вьюновым (Hubbs, 1955; Greenfield, Greenfield, 1972; Avise et al., 1975; Economidis, Sinis, 1988; Berrebi et al., 1989; Ünver, Erk’akan, 2005; Crivelli, Dupont, 2006). У вьюновых рыб естественные гибриды между видами разных родов до сих пор неизвестны.
В настоящей работе впервые приводятся сведения о естественной гибридизации между видами родов Cobitis и Sabanejewia Vladykov, 1929, дано подробное описание гибридной особи в сравнении с симпатрично обитающими родительскими видами, рассматриваются возможные причины редкого появления гибридов.
МАТЕРИАЛ И МЕТОДИКА
Материал, использованный в настоящем исследовании, был собран нами в Малом Кызылагачском заливе близ пос. Нариманабад 2 (Западный Каспий, Азербайджан) в 1982, 1985 и 2018 гг. Во всех случаях рыб отлавливали сачком трапециевидной формы. В заливе и в канале, соединяющем залив с морем, было выловлено: 20–24.1982 г. – 91 экз. каспийской щиповки Sabanejewia caspia (Eichwald, 1838), 58 экз. щиповок рода Cobitis, идентифицируемых нами в настоящее время как C. saniae Eagderi, Jouladeh-Roudbar, Jalili, Sayyadzadeh et Esmaeili, 2017, и одна самка щиповки, по особенностям окраски и пропорциям тела отличающаяся от обоих этих видов (рис. 1), что позволяло предположить её гибридное происхождение; 09–12.05.1985 г. – 224 экз. каспийской щиповки и 31 экз. C. saniae; 05.06.2018 г. – 9 экз. каспийской щиповки и 1 экз. C. saniae.
У всех отловленных рыб были изучены особенности окраски и ряд морфологических признаков, являющихся диагностическими для каспийской щиповки: форма нижней губы, форма чешуи, форма суборбитального шипа и длина усиков (Васильева, Васильев, 2019). Морфометрические признаки, обычно используемые в исследованиях щиповок (Bănărescu et al., 1972; Васильева, 1984; Васильева, Позняк, 1986), изучены у предполагаемой гибридной особи, отловленных в 1982 г. 18 экз. каспийской щиповки и 17 экз. C. saniae. Для статистического анализа морфометрических характеристик использовали стандартные унивариантные методы (М ± m, tst). Степень сходства гибрида с предполагаемыми родительскими видами оценивали на основе значений гибридного индекса (HI), определённого по формуле (Николюкин, 1972): HI = 100(H – M1)/(M2 – M1), где H – значение признака у гибрида, M1 и M2 – его значения у первого и второго родительских видов.
Рисунки, демонстрирующие окраску гибридной особи и типичную окраску одновременно выловленных самок S. caspia и C. saniae (рис. 1), выполнены на свежем материале в 1982 г. К сожалению, планировавшиеся сравнительные исследования аллозимов провести не удалось, поскольку весь собранный материал по щиповкам, хранившийся на кафедре ихтиологии Биологического факультета МГУ, был утрачен вследствие отключения электроэнергии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Долгое время считалось, что в пресных водах бассейна Кызылагачского залива обитает всего один вид рода Cobitis – обыкновенная щиповка, представленная здесь особым подвидом – C. taenia satunini Gladkov, 1935 (Абдурахманов, 1962; Касымов, 1972). На основе анализа коллекций Зоологического музея Московского университета (ЗММУ) нами был описан ещё один новый вид (Васильева, Васильев, 2012), по своим морфологическим особенностям существенно отличающийся от щиповки, широко распространённой в Южном Азербайджане (Астаринский, Ленкоранский, Масаллинский районы) и морфологически сходной с описанным из вод Грузии C. satunini, которую мы в настоящее время относим к виду C. saniae. Новый вид C. amphilekta Vasil’eva et Vasil’ev, 2012 был обнаружен в пробах 1930-х гг. из р. Кумбашинка (Кумбаши) и прилежащих к её устью частях Малого Кызылагачского залива (Васильева, Васильев, 2012). Хотя в сборах 1982 г., когда предположительно был выявлен гибридный экземпляр щиповки, и во всех последующих сборах вид C. amphilekta нами не обнаружен, мы сочли необходимым также включить его в сравнительный анализ, поскольку интрогрессивная гибридизация потенциально могла быть причиной его исчезновения.
Сравнительный анализ особенностей пигментации. В отличие от обоих видов щиповок рода Cobitis, которые известны из бассейна Кызылагачского залива и характеризуются наличием на теле четырёх полос пигментации, так называемых зон Гамбетты (Gambetta, 1934) (рис. 1б, 2), у гибридной особи (рис. 1в) по всему телу хаотично разбросаны мелкие пятнышки тёмно-бурого цвета. Эти пятнышки несколько сгущаются на участках тела, соответствующих передней части 2-й и 4-й зон чистых видов рода Cobitis, но отсутствует чёткая продольная тёмная полоса по линии бока, характерная для каспийской щиповки (рис. 1а). В отличие от каспийской щиповки, у которой вдоль середины спины проходит сплошная тёмная полоса, у гибридной особи здесь хорошо заметны отдельные крупные тёмные пятна: девять пятен до начала спинного плавника и семь – после плавника. У изученных видов рода Cobitis такие пятна имеются (в разном количестве), хотя они не всегда чётко выражены. В верхней части основания хвостового плавника у гибридной особи яркое тёмное пятно овальной формы (рис. 1в). У особей C. saniae у основания хвостового плавника также одно тёмное пятно овальной или полулунной формы; у C. amphilekta это пятно очень узкое, не такое яркое. У каспийской щиповки у основания хвостового плавника пигментные крапинки сгущаются в два нечётких краевых пятна, соединённых более узкой неровной полоской (рис. 1а). В целом особенности окраски соответствуют происхождению анализируемой особи в результате гибридизации каспийской щиповки с видом рода Cobitis при наследовании одних признаков по материнскому, а других – по отцовскому типу.
Сравнительный анализ морфологических признаков и морфометрических характеристик. Важным диагностическим признаком рода Sabanejewia является число ветвистых лучей в хвостовом плавнике, которых у видов этого рода, как правило, 12 (очень редко 13). У видов рода Cobitis, как правило, 14 лучей; 14 ветвистых лучей в хвостовом плавнике и у изученной гибридной особи. Диагностическими признаками каспийской щиповки являются форма нижней губы и относительная длина усиков. Нижняя губа у каспийской щиповки двулопастная, на внутренней стороне каждой лопасти по два усиковидных выроста: нижний представляет собой удлинение окончания внутренней стороны губы, а верхний образован удлинением верхней складки; эти «усики» обычно заметны даже невооружённым глазом. Все три пары настоящих усиков у этого вида длинные: в выборке из Малого Кызылагачского залива у большинства особей (80.6%) мандибулярный усик обычно достигает заднего края глаза и далее, редко (19.4%) чуть не достигает заднего края глаза (Васильева, Васильев, 2019). У обоих сравниваемых видов рода Cobitis и гибридной особи нижняя губа без усиковидных удлинений, а все три пары настоящих усиков короткие: достигают не далее середины глаза, а часто не доходят до его переднего края, как и у гибридной особи. Чешуя у C. saniae имеет характерную форму: чешуи овальной формы, вытянутые горизонтально, с очень маленькой лишённой радиальных борозд центральной частью, сильно смещённой к переднему краю чешуи (Eagderi et al., 2017). У C. amphilekta чешуя овальной формы с относительно большой центральной частью, слабо смещённой к переднему краю чешуи (Васильева, Васильев, 2012); похожей формы чешуя у каспийской щиповки. У гибридной особи среди чешуй под основанием спинного плавника встречались преимущественно чешуи первого типа, хотя попадались единичные чешуйки (соотношение 1 : 10) второго типа с относительно большой слабо смещённой центральной частью. Характерный для самцов рода Cobitis орган Канестрини (костная пластинка у основания 1-го ветвистого луча грудного плавника, форма которой является важным видовым признаком) у гибридной особи отсутствовал. Свойственные самцам рода Sabanejewia вздутия боков тела перед спинным и брюшными плавниками также не наблюдались, хотя следует заметить, что они не всегда выражены и у самцов каспийской щиповки (Васильева, Васильев, 2019). Поэтому мы полагаем, что гибридная особь была незрелой самкой (гистологию гонад не проводили), в пользу чего свидетельствуют также очень короткие грудные плавники и усики (таблица), свойственные обычно самкам щиповок.
Некоторые морфометрические признаки каспийской щиповки Sabanejewia caspia, щиповки Cobitis saniae, их предполагаемого гибрида из Малого Кызылагачского залива и хвалынской щиповки Cobitis amphilekta, а также значения гибридного индекса при разных вариантах родительских видов (по: Васильева, Васильев, 2012)
| Признак | Sabanejewia caspia | Гибрид | Cobitis saniae | Cobitis amphilekta | Гибридный индекс | ||||
|---|---|---|---|---|---|---|---|---|---|
| S. caspia × C. saniae | S. caspia × C. amphilekta | ||||||||
| самки (n = 14) | самцы (n = 4) | самки (n = 2) | самцы (n = 15) | самки (n = 10) | самцы (n = 10) | ||||
| TL, мм | $\frac{{60.0--79.3}}{{66.1 \pm 1.61}}$ | $\frac{{55.0--69.0}}{{64.3}}$ | 63.0 | $\frac{{54.2--61.0}}{{57.6}}$ | $\frac{{50.2--64.8}}{{56.0 \pm 1.02}}$ | $\frac{{51.3--73.2}}{{64.5}}$ | $\frac{{41.8--48.2}}{{44.7}}$ | – | – |
| SL, мм | $\frac{{51.2--65.2}}{{56.6 \pm 1.25}}$ | $\frac{{47.5--60.3}}{{55.3}}$ | 53.8 | $\frac{{46.6--53.0}}{{49.8}}$ | $\frac{{42.2--55.0}}{{47.8 \pm 0.91}}$ | $\frac{{44.0--63.6}}{{55.7}}$ | $\frac{{35.7--41.2}}{{38.3}}$ | – | – |
| В % SL | |||||||||
| aD | $\frac{{48.5--53.4}}{{50.2 \pm 0.40}}$ | $\frac{{48.7--52.9}}{{50.3}}$ | 56.5 | $\frac{{53.7--54.7}}{{54.2}}$ | $\frac{{51.0--54.9}}{{52.8 \pm 0.34}}$ | $\frac{{50.0--53.7}}{{51.8 \pm 0.33}}$ | $\frac{{47.4--54.3}}{{50.9 \pm 0.57}}$ | 157.5 | 393.8 |
| pD | $\frac{{41.2--45.4}}{{43.8 \pm 0.35}}$ | $\frac{{43.6--47.2}}{{45.0}}$ | 35.3 | $\frac{{39.3--39.8}}{{39.6}}$ | $\frac{{36.5--41.7}}{{39.1 \pm 0.43}}$ | $\frac{{38.5--42.5}}{{40.6 \pm 0.43}}$ | $\frac{{37.8--41.6}}{{39.8 \pm 0.37}}$ | 202.4 | 265.6 |
| aV | $\frac{{47.6--52.8}}{{50.4 \pm 0.43}}$ | $\frac{{48.1--51.6}}{{49.8}}$ | 53.9 | $\frac{{55.3--55.8}}{{55.6}}$ | $\frac{{51.9--57.3}}{{54.7 \pm 0.43}}$ | $\frac{{48.6--52.8}}{{51.3 \pm 0.38}}$ | $\frac{{47.9--54.2}}{{52.2 \pm 0.60}}$ | 67.3 | н.о. |
| aA | $\frac{{71.9--80.9}}{{76.6 \pm 0.70}}$ | $\frac{{73.9--77.9}}{{76.6}}$ | 79.4 | $\frac{{78.3--81.1}}{{79.7}}$ | $\frac{{77.4--82.2}}{{79.7 \pm 0.31}}$ | $\frac{{72.5--77.8}}{{75.2 \pm 0.60}}$ | $\frac{{71.8--78.4}}{{75.6 \pm 0.66}}$ | 90.3 | н.о. |
| lpc | $\frac{{13.5--17.8}}{{15.7 \pm 0.31}}$ | $\frac{{15.9--18.0}}{{16.8}}$ | 13.4 | $\frac{{13.4--15.0}}{{14.2}}$ | $\frac{{12.6--16.3}}{{14.3 \pm 0.29}}$ | $\frac{{14.6--17.5}}{{15.7 \pm 0.30}}$ | $\frac{{13.9--18.2}}{{16.3 \pm 0.44}}$ | 153.3 | н.о. |
| P-V | $\frac{{28.1--34.0}}{{31.3 \pm 0.53}}$ | $\frac{{28.8--32.8}}{{31.1}}$ | 34.6 | $\frac{{35.3--36.3}}{{35.8}}$ | $\frac{{30.3--37.0}}{{33.7 \pm 0.51}}$ | $\frac{{32.0--37.0}}{{34.1 \pm 0.56}}$ | $\frac{{30.2--34.0}}{{32.2 \pm 0.65}}$ | 73.3 | 117.9 |
| lP | $\frac{{15.3--19.0}}{{17.2 \pm 0.26}}$ | $\frac{{15.4--18.5}}{{17.0}}$ | 13.9 | $\frac{{14.6--15.1}}{{14.9}}$ | $\frac{{16.0--23.0}}{{19.8 \pm 0.55}}$ | $\frac{{12.7--14.6}}{{13.4 \pm 0.18}}$ | $\frac{{20.2--24.6}}{{22.2 \pm 0.97}}$ | 143.5 | 86.8 |
| lV | $\frac{{12.1--14.2}}{{13.0 \pm 0.17}}$ | $\frac{{11.9--14.1}}{{13.1}}$ | 12.6 | $\frac{{11.9--12.9}}{{12.4}}$ | $\frac{{13.1--16.9}}{{15.5 \pm 0.28}}$ | $\frac{{10.7--12.9}}{{12.2 \pm 0.22}}$ | $\frac{{13.9--18.2}}{{16.1 \pm 0.58}}$ | 66.7 | 50.0 |
| lD | $\frac{{7.3--9.8}}{{8.4 \pm 0.22}}$ | $\frac{{6.5--10.2}}{{8.3}}$ | 10.4 | $\frac{{8.6--10.0}}{{9.3}}$ | $\frac{{8.2--11.3}}{{9.5 \pm 0.26}}$ | $\frac{{8.8--11.5}}{{10.0 \pm 0.31}}$ | $\frac{{9.5--12.5}}{{10.8 \pm 0.35}}$ | 222.2 | 125.0 |
| lA | $\frac{{6.0--9.3}}{{7.3 \pm 0.28}}$ | $\frac{{7.8--9.0}}{{8.5}}$ | 7.4 | $\frac{{6.7--7.9}}{{7.3}}$ | $\frac{{6.8--8.5}}{{7.3 \pm 0.13}}$ | $\frac{{7.8--10.2}}{{8.6 \pm 0.22}}$ | $\frac{{8.1--11.0}}{{9.0 \pm 0.27}}$ | н.о. | 7.6 |
| c | $\frac{{18.3--20.8}}{{19.4 \pm 0.16}}$ | $\frac{{18.2--20.6}}{{19.1}}$ | 20.6 | $\frac{{19.7--21.1}}{{20.4}}$ | $\frac{{19.5--22.9}}{{21.5 \pm 0.25}}$ | $\frac{{17.9--19.8}}{{18.5 \pm 0.19}}$ | $\frac{{20.2--23.0}}{{21.6 \pm 0.48}}$ | 120.0 | –133.3 |
| В % с | |||||||||
| lB1 | $\frac{{16.5--31.4}}{{20.7 \pm 1.07}}$ | $\frac{{20.4--28.6}}{{24.5}}$ | 6.3 | $\frac{{9.8--10.7}}{{10.3}}$ | $\frac{{6.9--17.7{\text{*}}}}{{13.1 \pm 1.06}}$ | $\frac{{8.8--11.2{\text{*}}}}{{10.0 \pm 0.31}}$ | $\frac{{10.8--12.8}}{{11.7 \pm 0.36}}$ | 138.5 | 134.6 |
| lB3 | $\frac{{22.3--40.6}}{{29.8 \pm 1.48}}$ | $\frac{{32.4--39.6}}{{35.4}}$ | 12.6 | $\frac{{15.2--19.6}}{{17.4}}$ | $\frac{{18.7--24.2{\text{*}}}}{{21.4 \pm 0.54}}$ | $\frac{{9.7--22.0}}{{14.2 \pm 1.24}}$ | $\frac{{14.5--25.3}}{{19.1 \pm 1.44}}$ | 138.7 | 110.3 |
| ao | $\frac{{28.8--39.2}}{{35.1 \pm 0.80}}$ | $\frac{{32.7--37.6}}{{35.5}}$ | 45.1 | $\frac{{38.0--42.9}}{{40.5}}$ | $\frac{{33.3--41.7}}{{38.2 \pm 0.67}}$ | $\frac{{38.1--44.1}}{{41.4 \pm 0.60}}$ | $\frac{{35.4--42.2}}{{38.8 \pm 0.70}}$ | 185.2 | 158.7 |
| o | $\frac{{15.8--20.6}}{{18.0 \pm 0.45}}$ | $\frac{{16.8--18.9}}{{18.0}}$ | 16.2 | $\frac{{16.1--19.6}}{{17.9}}$ | $\frac{{15.2--20.9}}{{18.3 \pm 0.52}}$ | $\frac{{17.7--22.8}}{{20.7 \pm 0.48}}$ | $\frac{{21.7--24.4}}{{23.5 \pm 0.39}}$ | н.о. | –66.7 |
| hc | $\frac{{47.8--60.6}}{{55.1 \pm 1.01}}$ | $\frac{{51.0--63.1}}{{54.8}}$ | 56.8 | $\frac{{50.9--52.2}}{{51.6}}$ | $\frac{{45.8--53.9}}{{49.9 \pm 0.80}}$ | $\frac{{46.8--57.0}}{{51.8 \pm 1.13}}$ | $\frac{{45.1--53.5}}{{49.9 \pm 0.92}}$ | –48.6 | –51.5 |
| io | $\frac{{11.7--19.6}}{{16.7 \pm 0.57}}$ | $\frac{{15.3--19.8}}{{17.1}}$ | 11.7 | $\frac{{17.9--19.6}}{{18.8}}$ | $\frac{{11.6--20.8{\text{*}}}}{{16.6 \pm 0.85}}$ | $\frac{{9.2--17.5}}{{14.9 \pm 0.84}}$ | $\frac{{11.9--18.3}}{{13.9 \pm 0.60}}$ | –238.1 | н.о. |
Примечание. TL – общая длина тела, SL – стандартная длина тела; aD, pD, aV, aA – антедорсальное, постдорсальное, антевентральное и антеанальное расстояния; lpc – длина хвостового стебля, P–V – пектовентральное расстояние, lP – длина грудного плавника, lV – длина брюшного плавника, lD – длина основания спинного плавника, lA – длина основания анального плавника, с – длина головы, lB1 – длина усиков 1-й пары, lB3 – длина мандибулярных усиков (3-я пара), ao – длина рыла, о – горизонтальный диаметр глаза, hс – высота головы на уровне середины глаза, b – расстояние между ростральными усиками, io – межглазничное расстояние. Над чертой – пределы изменчивости, под чертой – среднее значение и его ошибка, n – число исследованных особей, экз.; н.о. – гибридный индекс не рассчитывали из-за отсутствия достоверных различий между предполагаемыми родительскими видами.
Морфометрические признаки, по которым достоверные различия выражены между чистыми видами, представлены в таблице. Поскольку не все выборки были репрезентативными, при оценке различий мы руководствовались ошибками средних из репрезентативных выборок. Из 15 морфометрических признаков, по которым выражены различия между самками каспийской щиповки и C. saniae, по четырём (aV, aA, P–V, lV) значения гибридной особи лежат в интервале между средними значениями двух видов, однако сильно сдвинуты в сторону последнего вида; величина гибридного индекса (HI) соответственно варьирует от 66.7 до 90.3. Остальные 11 показателей гибридной особи располагаются вне диапазона между средними каспийской щиповки и C. saniae, при этом в девяти случаях (aD, pD, lpc, lP, lD, c, lB1, lB3, ao) они более близки к значениям C. saniae (соответственно HI варьирует в пределах 120.0–222.2), а в двух (hc, io) – ближе к характеристикам каспийской щиповки (HI принимает отрицательные значения). Из 13 морфометрических признаков, по которым достоверно различаются самки каспийской щиповки и C. amphilekta, всего по трём (lV, lP, lA) значениям гибридной особи лежат в интервале между средними показателями этих видов, при этом они сдвинуты в сторону C. amphilekta по второму признаку, а в направлении каспийской щиповки – по последнему (HI, соответственно, варьирует от 7.6 до 86.8). В семи случаях (aD, pD, P-V, lD, lB1, lB3, ao) показатели гибридной особи более близки к характеристикам C. amphilekta (HI варьирует от 110.3 до 393.8), а в трёх (с, о, hc) – ближе к каспийской щиповке (HI принимает отрицательные значения). От каспийской щиповки гибридная особь наиболее существенно отличается (её показатели за пределами диапазона выборочных значений этого вида) по десяти признакам (aD, pD, aV, lpc, P–V, lP, lD, lB1, lB3, ao), от C. saniae – по семи (aD, pD, lP, lB1, lB3, ao, hc), от C. amphilekta – по восьми (aD, pD, aA, lpc, lA, lB1, ao, о).
Полученные результаты явно подтверждают гибридное происхождение анализируемой нами щиповки, которая существенно отличается от всех трёх видов семейства Cobitidae, известных из бассейна Малого Кызылагачского залива не только по окраске тела, но и по совокупности морфометрических характеристик, что не позволяет считать её аномальной особью какого-либо из этих видов. Одновременно у этой щиповки обнаруживается совмещение особенностей окраски каспийской щиповки (отсутствие зон Гамбетты) и щиповок рода Cobitis (наличие ряда пятен по средней линии спины и одного чёткого пятна у основания хвостового плавника), а также промежуточные значения отдельных морфометрических характеристик. При этом существенные отличия гибрида от предполагаемых родительских видов по ряду морфометрических признаков соответствуют тому известному факту (Николюкин, 1972), что обычно межродовые гибриды более резко обособлены от исходных видов, чем внутриродовые, – переходы между ними отсутствуют.
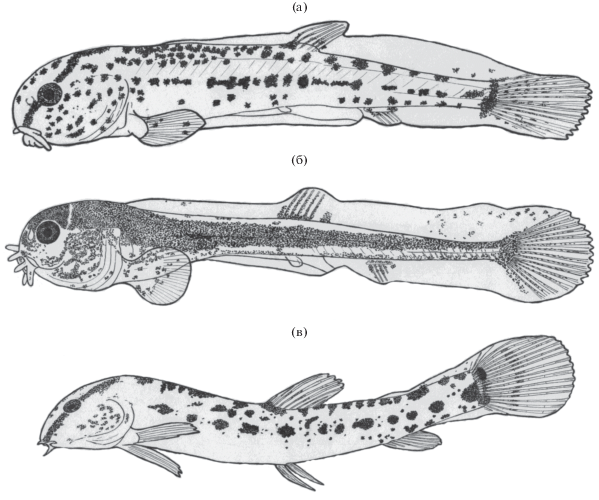
Согласно полученным данным хвалынская щиповка C. amphilekta должна быть исключена из возможных родительских видов, поскольку для этого вида не характерна форма чешуи со смещённым маленьким центром, обнаруженная у гибрида, а пятно у основания хвостового плавника в отличие от гибрида узкое и слабо заметное (рис. 2). Кроме этого по морфометрическим характеристикам C. amphilekta отличается от гибридной особи в большей степени, чем C. saniae.
Рис. 2.
Cobitis amphilekta – паратип, самка TL 68.3 мм, ЗММУ № Р-3751 (Васильева, Васильев, 2012); обозначение см. на рис. 1.

Возможные причины и частота гибридизации. В природе межродовые гибриды рыб встречаются чаще, чем межвидовые; это объясняется тем, что виды разных родов реже изолированы географически, чем виды одного и того же рода (Николюкин, 1972). Оба родительских вида, S. caspia и C. saniae, обнаружены нами не только в прибрежной части Малого Кызылагачского залива, где был найден их гибрид, но и в канале, соединяющем залив с морем, и в реке Арчиванчай Астаринского района Азербайджана. В коллекциях ЗММУ нами обнаружены пробы обоих видов из впадающей в Кызылагачский залив р. Хырмандалы (Хирмандали) и из Джильского озера (Ленкоранская низменность). Сроки нереста обоих видов, по нашим данным, сильно перекрываются. В Малом Кызылагачском заливе и в канале 20–22.04.1982 г. у каспийской щиповки большинство самок были текучими, у большинства самцов сперма почти достигла полного развития (стадия IV), у C. saniae преобладали текучие самки и самцы; 09–10.05.1985 г. большинство самок и самцов каспийской щиповки находились в посленерестовом состоянии (стадия VI), а большинство особей C. saniae были текучими.
Известно, что усилению отдалённых скрещиваний способствует значительная разница в числе особей совместно обитающих видов (Николюкин, 1972). В 1982 г. в пробах 20, 21 и 22 апреля из Малого Кызылагачского залива и канала соотношение особей каспийской щиповки и C. saniae изменялось следующим образом: 23 : 1 → 50 : 12 → 9 : 31. При этом число зрелых самцов у C. saniae с 21 по 22 апреля увеличилось с 7 экз. (при четырёх самках) до 22 экз. (при семи зрелых самках). Очевидно, наблюдался подход самцов к месту нереста. С 9 по 11 мая 1985 г. соотношение каспийской щиповки и C. saniae в уловах изменялось следующим образом: 52 : 7 → 29 : 5 → 32 : 3. В 2018 г. 5 июня в канале было поймано 9 экз. каспийской щиповки и 1 экз. C. saniae, тогда как в р. Арчиванчай 7 и 9 июня 2018 г. поймано в общей сложности 7 экз. каспийской щиповки и 79 экз. C. saniae. Как следует из этих данных, во все годы исследований численность C. saniae в Малом Кызылагачском заливе и в канале была очень низкой, особенно это касается самок, единично встречавшихся во всех пробах, в отличие от самок каспийской щиповки, которые в отдельных пробах даже доминировали по численности над самцами. По-видимому, в 1980-е гг. биотопы Малого Кызылагачского залива уже были малопригодными для обитания C. saniae, а к 2018 г. здесь упала численность обоих видов (в отличие от р. Арчиванчай, где они остаются обычными видами при явном доминировании C. saniae).
Таким образом, все отмеченные выше факторы (симпатрия двух видов, перекрывание сроков их нереста и заметная разница в численности в совместно населяемых биотопах) способствуют возможности гибридизации каспийской щиповки и C. saniae. Обнаружение нами такого гибрида согласуется с общим выводом: если тот или иной вид проявляет склонность к скрещиванию с другими видами, это свидетельствует о каком-то его биологическом неблагополучии и, прежде всего, о нарушении нормального размножения внутри вида (Николюкин, 1972). Действительно, наблюдаемая в Малом Кызылагачском заливе ситуация свидетельствует о нарушении здесь нормального нереста C. saniae. Однако частота наблюдаемой гибридизации очень мала: в 1982 г. на одного гибрида приходилось 149 особей родительских видов, а в 1985 г. среди 255 экз. отловленных щиповок ни одного гибрида не обнаружено.
При проведении искусственной гибридизации исходят из того, что её успешность зависит, как правило, от степени родства скрещиваемых форм: чем более близкородственные виды подвергаются скрещиванию, тем больше шансов получить нормально развивающиеся жизнеспособные и даже плодовитые гибриды (Николюкин, 1972). К настоящему времени известно значительное число примеров искусственных скрещиваний карповых рыб из разных родов, когда были получены жизнеспособные гибриды или, наоборот, гибриды гибли на разных стадиях развития (Николюкин, 1972). Как уже отмечалось выше, жизнеспособные гибриды были искусственно получены для двух видов вьюновых рыб, относящихся к разным родам и существенно различающихся по числу хромосом: Paramisgurnus dabryanus с числом хромосом 2n = 48 и Misgurnus anguillicaudatus с 2n = 100. Гибридные самки от скрещивания самки P. dabryanus с самцом M. anguillicaudatus имели 2n = 74, обнаруживали наибольшее морфологическое сходство с отцовским видом и производили очень мелкую икру, которая после осеменения спермой родительских видов погибла в течение 24 ч; фертильность гибридных самцов не проверялась (You et al., 2009). Среди искусственно полученных жизнеспособных гибридов Misgurnus mizolepis (=P. dabryanus) (2n = 48) и M. anguillicaudatus (2n = 50) из Южной Кореи диплоидные реципрокные гибриды (2n = 49) были фертильными, а триплоидные (2n = 74) – стерильными (Kim et al., 1995).
В 1983 г. мы проводили экспериментальные исследования на щиповках рода Cobitis из диплоидно-полиплоидного комплекса из р. Москва, используя для стимуляции гиногенетического развития икры полиплоидных форм (наряду со спермой самцов из комплекса щиповок) сперму европейского вьюна Misgurnus fossilis (Linnaeus, 1758): в случае гиногенетического развития следовало ожидать нормальное развитие потомства по типу щиповок при отсутствии сходства с отцовским видом. Поскольку внешне полиплоидные щиповки не отличаются от диплоидного бисексуального вида Cobitis taenia, было поставлено 55 опытов с использованием разных самок, геном которых определяли после осеменения икры (Васильев и др., 1993). Из десяти экспериментов с диплоидными самками, одна из которых относилась к виду C. melanoleuca, гибридные личинки были получены только в двух случаях (рис. 3), в остальных скрещиваниях наблюдалась гибель икры на ранних стадиях (в единичных случаях развитие доходило до стадии подвижного эмбриона). Свободные личинки гибрида (рис. 3б) заметно отличались от одновозрастных личинок материнского вида C. taenia (рис. 3а) бóльшими размерами, характером пигментации тела и головы, строением рта и числом усиков. Гибриды явно отставали от личинок C. taenia в развитии и погибли после рассасывания желточного мешка, так и не перейдя на внешнее питание. В отличие от них большинство гиногенетических личинок щиповок успешно перешло на внешнее питание (мы кормили их измельчённым желтком варёного куриного яйца), достигли мальковой стадии (рис. 3в) и были выпущены в естественную среду.
Рис. 3.
Одновозрастные свободные личинки Cobitis taenia TL 12.3 мм (а), гибрида C. taenia × Misgurnus fossilis TL 13.2 мм (б) и малёк C. taenia TL 23 мм (в), масштаб не соблюдён.
Результаты современных филогенетических исследований вьюновых рыб свидетельствуют в пользу большего филетического родства родов Misgurnus и Сobitis при существенной генетической дивергенции от общего ствола представителей рода Sabanejewia (Perdices et al., 2003, 2016). Предполагается, что дивергенция родов Cobitis и Sabanejewia произошла около 10.5 (Perdices et al., 2003) или 12–13 млн лет назад (Ludwig et al., 2001). В этой связи само возникновение жизнеспособного гибрида видов рода Cobitis и Sabanejewia должно представляться маловероятным при учёте результатов искусственной гибридизации щиповки и вьюна.
Крайне низкая частота гибридизации каспийской щиповки и C. saniae, скорее всего, обусловлена существенными различиями в экологии нереста и в нерестовом поведении двух видов. Хотя у обоих видов нерест не изучен, к настоящему времени на основе наблюдений за содержащимися в аквариуме другими видами родов Cobitis и Sabanejewia выявлены существенные межродовые различия в биологии размножения (Bohlen, 2000). Так, все виды изученных щиповок рода Cobitis откладывают икру в густых зарослях водной растительности, при этом самцы демонстрируют разную степень ухаживания, обвивая телом самку и используя орган Канестрини для её удержания во время осеменения икры; икра у большинства видов не клейкая. Поскольку у самцов каспийской щиповки орган Канестрини отсутствует, можно полагать, что в гибридизации участвовал именно самец C. saniae. Кроме этого изученные виды рода Sabanejewia разбрасывают свою более мелкую и клейкую икру на дне аквариума с различным субстратом (песок, гравий, мох, покрывающий крупные камни) и в пустые коробки (Bohlen, 2000). Поэтому происхождение обнаруженного межродового гибрида определённо может быть результатом случайной гибридизации при оплодотворении выметанной икры каспийской щиповки излишней спермой самцов C. saniae, не израсходованной на оплодотворение икры малочисленных конспецифичных самок.
Список литературы
Абдурахманов Ю.А. 1962. Рыбы пресных вод Азербайджана. Баку: Изд-во АН АзССР, 407 с.
Васильев В.П. 1981. Возможный путь возникновения тетраплоидных форм у позвоночных // Природа. № 4 (788). С. 112–113.
Васильев В.П., Васильева Е.Д. 1982. Новый диплоидно-полиплоидный комплекс у рыб // ДАН АН СССР. Т. 266. № 1. С. 250–252.
Васильев В.П., Васильева Е.Д. 2010. Сетчатое видообразование и полиплоидная эволюция у рыб // Актуальные проблемы современной ихтиологии. М.: Т-во науч. изд. КМК. С. 148–177.
Васильев В.П., Васильева Е.Д., Осинов А.Г. 1983. Первое свидетельство в пользу основной гипотезы сетчатого видообразования у позвоночных // ДАН АН СССР. Т. 271. № 4. С. 1009–1012.
Васильев В.П., Васильева Е.Д., Осинов А.Г. 1993. Эволюция диплоидно-триплоидно-тетраплоидного комплекса рода Cobitis (Cobitidae) // Сб. тр. Зоол. муз. МГУ. Т. 30. Гибридизация и проблема вида у позвоночных. С. 6–33.
Васильева Е.Д. 1984. Сравнительный морфологический анализ двух популяций щиповок (род Cobitis, Cobitidae), отличающихся числом пятен у основания хвостового плавника // Вопр. ихтиологии. Т. 24. Вып. 1. С. 43–53.
Васильева Е.Д., Васильев В.П. 2012. Cobitis amphilekta sp. nova – новый вид щиповки (Cobitidae, Cypriniformes) из бассейна Каспийского моря // Там же. Т. 52. № 2. С. 177–183.
Васильева Е.Д., Васильев В.П. 2019. Каспийская щиповка Sabanejewia caspia – давно известный, но практически не изученный вид семейства вьюновых (Cobitidae): особенности морфологии, кариотип, распространение и предполагаемые филогенетические связи // Там же. Т. 59. № 2. С. 137–152.
Васильева Е.Д., Позняк В.Г. 1986. Морфологическая характеристика предкавказской щиповки Sabanejewia caucasica (Berg) (Cobitidae) // Там же. Т. 26. Вып. 3. С. 402–409.
Касымов А.Г. 1972. Пресноводная фауна Кавказа. Баку: ЭЛМ, 286 с.
Николюкин Н.И. 1972. Отдаленная гибридизация осетровых и костистых рыб (теория и практика). М.: Пищ. пром-сть, 335 с.
Avise J.C., Smith J.J., Ayala F.J. 1975. Adaptive differentiation with little genic change between two native California minnows // Evolution. V. 29. № 2. P. 411–426.
Bănărescu P., Nalbant T.T., Chelmu S. 1972. Revision and geographical variation of Sabanejewia aurata in Romania and the origin of S. bulgarica and S. romanica (Pisces, Cobitidae) // Annot. Zool. Botan. Bratislava. V. 75. P. 1–49.
Berrebi P., Dupont F., Cattaneo-Berrebi G., Crivelli A.J. 1989. An isozyme study of the natural cyprinid hybrid Alburnus alburnus × Rutilus rubilio in Greece // J. Fish Biol. V. 34. № 2. P. 307–313.
Bohlen J. 2000. Similarities and differences in the reproductive biology of loaches (Cobitis and Sabanejewia) under laboratory conditions // Folia Zool. V. 49. Suppl. 1. P. 179–186.
Bohlen J., Ráb P., Šlechtová V. et al. 2002. Hybridogeneous biotypes in spined loaches (genus Cobitis) in Germany with implications for conservation // Conservation of freshwater fishes: options for the future / Eds. Collares-Pereira M.J., Coelho M.M., Cowx I.G. Oxford: Fishing News Books, Blackwell Sci. P. 311–321.
Crivelli A.J., Dupont F. 2006. Biometrical and biological features of Alburnus alburnus × Rutilus rubilio natural hybrids from Lake Mikri Prespa, northern Greece // J. Fish Biol. V. 31. № 6. P. 721–733.
Eagderi S., Jouladeh-Roudbar A., Jalili P. et al. 2017. Taxonomic status of the genus Cobitis Linnaeus, 1758 (Teleostei: Cobitidae) in the southern Caspian Sea basin, Iran with description of a new species // FishTaxa. V. 2. № 1. P. 48–61.
Economidis P.S., Sinis A.I. 1988. A natural hybrid of Leuciscus cephalus macedonicus × Chalcalburnus chalcoides macedonicus (Pisces, Cyprinidae) from Lake Volvi (Macedonia, Greece) // J. Fish Biol. V. 32. P. 593–605.
Fujimoto T., Yasui G.S., Yoshikawa H. et al. 2008. Genetic and reproductive potential of spermatozoa of diploid and triploid males obtained from interspecific hybridization of Misgurnus anguillicaudatus female with M. mizolepis male // J. Appl. Ichthyol. V. 24. P. 430–437.
Gambetta L. 1934. Sulla variabilità del cobite fluviatile (Cobitis taenia) e sul rapporto numerico dei sessi // Bull. Mus. Zool. Anat. Comp. Univ. Torino. V. 44. P. 297–324.
Greenfield D.W., Greenfield T. 1972. Introgressive hybridization between Gila orcutti and Hesperoleucus symmetricus (Pisces: Cyprinidae) in the Cuyama River Basin, California: I. Meristics, morphometrics and breeding // Copeia. № 4. P. 849–859.
Hubbs C.L. 1955. Hybridization between fish species in nature // Syst. Zool. V. 4. № 1. P. 1–20.
Itono M., Okabayashi N., Morishima K. et al. 2007. Cytological mechanisms of gynogenesis and sperm incorporation in unreduced diploid eggs of the clonal loach, Misgurnus anguillicaudatus (Teleostei: Cobitidae) // J. Exp. Zool. V. 307A. P. 35–50.
Janko K., Bohlen J., Lamatsch D. et al. 2007. The gynogenetic reproduction of diploid and triploid hybrid spined loaches (Cobitis: Teleostei), and their ability to establish successful clonal lineages – on the evolution of polyploidy in asexual vertebrates // Genetica. V. 131. № 2. P. 185–194.
Janko K., Kotusz J., De Gelas K. et al. 2012. Dynamic formation of asexual diploid and polyploid lineages: multilocus analysis of Cobitis reveals the mechanisms maintaining the diversity of clones // PLoS ONE. V. 7. № 9. P. e45384. https://doi.org/10.1371/journal.pone.0045384
Kim D.S., Nam Y.K., Park I.-S. 1995. Survival and karyological analysis of reciprocal diploid and triploid hybrids between mud loach (Misgurnus mizolepis) and pond loach (Misgurnus anguillicaudatus) // Aquaculture. V. 135. № 4. P. 257–265.
Kwan Y.S., Ko M.H., Won Y.J. 2014. Genomic replacement of native Cobitis lutheri with introduced C. tetralineata through a hybrid swarm following the artificial connection of river systems // Ecol. Evol. V. 4. № 8. P. 1451–1465.
Ludwig A., Bohlen J., Wolter C., Pitra C. 2001. Phylogenetic relationships and historical biogeography of spined loaches (Cobitidae, Cobitis and Sabanejewia) as indicated by variability of mitochondrial DNA // Zool. J. Linn. Soc. V. 131. № 3. P. 381–392.
Morishima K., Nakamura-Shiokawa Y., Bando E. et al. 2008. Cryptic clonal lineages and genetic diversity in the loach Misgurnus anguillicaudatus (Teleostei: Cobitidae) inferred from nuclear and mitochondrial DNA analyses // Genetica. V. 132. P. 159–171.
Perdices A., Doadrio I., Economidis P.S. et al. 2003. Pleistocene effects on the European freshwater fish fauna: double origin of the cobitid genus Sabanejewia in the Danube basin (Osteichthyes: Cobitidae) // Mol. Phylogen. Evol. V. 26. P. 289–299.
Perdices A., Bohlen J., Šlechtová V., Doadrio I. 2016. Molecular evidence for multiple origins of the European spined loaches (Teleostei, Cobitidae) // PLoS ONE. V. 11. № 1. P. 1–18.https://doi.org/10.1371/journal.pone.0144628
Saitoh K., Kim I.-S., Lee E.-H. 2004. Mitochondrial gene introgression between spined loaches via hybridogenesis // Zool. Sci. V. 21. P. 795–798.
Ünver B., Erk’akan F. 2005. A natural hybrid of Leuciscus cephalus (L.) and Chalcalburnus chalcoides (Güldenstädt) (Osteichthyes: Cyprinidae) from Lake Tödürge (Sivas, Turkey) // J. Fish Biol. V. 66. № 4. P. 899–910.
You C., Yu X., Tong J. 2009. Detection of hybridization between two loach species (Paramisgurnus dabryanus and Misgurnus anguillicaudatus) in wild populations // Environ. Biol. Fish. V. 86. P. 65–71.
Zhang G., Sun X., Zhang G. et al. 2018. Molecular characteristics of mitochondrial DNA and phylogenetic analysis of the hybrid loach of Misgurnus anguillicaudatus (female) and Paramisgurnus dabryanus ssp. (male) // Mitochondrial DNA. Part B: Resources. V. 3. № 2. P. 545–546.
Zhao Y., Fujimoto T., Pšenička M. et al. 2016. Non-motile tetraploid spermatozoa of Misgurnus loach hybrids // Fish. Sci. V. 82. P. 127–135.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


